高一化学溶液的配制-
高一溶液配制知识点

高一溶液配制知识点溶液配制是化学实验中常见的操作,也是高一化学学习的基础内容之一。
正确掌握溶液配制的知识点对于学习化学和进行实验都非常重要。
本文将介绍高一溶液配制的关键知识点,包括质量百分比、摩尔浓度以及配制溶液的步骤和注意事项。
一、质量百分比质量百分比是指溶液中溶质的质量与溶液总质量之比,通常用百分数表示。
计算质量百分比的公式为:质量百分比 = (溶质的质量 / 溶液的质量) × 100%例如,如果要配制含有25g溶质的溶液,溶液的总质量为100g,那么该溶液的质量百分比为:质量百分比 = (25g / 100g) × 100% = 25%二、摩尔浓度摩尔浓度是溶液中溶质的物质量与溶液体积之比,单位为摩尔每升(mol/L)。
计算摩尔浓度的公式为:摩尔浓度 = 溶质的物质量 / 溶液的体积例如,如果要配制100mL摩尔浓度为0.1mol/L的溶液,需要的溶质物质量为:溶质的物质量 = 摩尔浓度 ×溶液的体积 = 0.1mol/L × 0.1L = 0.01mol三、配制溶液的步骤和注意事项1. 确定所需溶液的质量百分比或摩尔浓度。
2. 准备所需的溶质和溶剂,注意溶剂的选取应能完全溶解所需的溶质。
3. 称取溶质和溶剂的量。
在称取溶质时要注意使用净称,避免交叉污染。
4. 将溶质逐渐加入溶剂中,充分搅拌溶解。
搅拌的时间和速度应适当,以充分混合溶质和溶剂。
5. 检查溶液是否溶解完全,如果有未溶解的固体存在,可以进行加热或过滤来完全溶解或除去固体。
6. 最后,用适当的容器将溶液保存好,贴上标签标明溶液的名称、质量百分比或摩尔浓度以及配制日期等信息。
在进行溶液配制时,需要注意以下几点:1. 使用干燥的容器和仪器,避免水分和其他杂质的污染。
2. 操作时要戴实验手套、护目镜等个人防护装备,避免对皮肤和眼睛的伤害。
3. 配制溶液时要按照所需的质量百分比或摩尔浓度准确称取溶质和溶剂,避免量取过多或过少。
高一化学必修一知识点归纳笔记

高一化学必修一知识点归纳笔记第一章:离子反应和溶液的配制与稀释1.离子反应离子反应是指化学反应中涉及到的离子间发生的相互作用。
离子反应的特点包括反应速度快、反应物浓度常为液体或溶液、离子间的电荷转移。
2.化学方程式化学方程式是用符号和数字表示化学反应的过程和化学物质之间的组成和性质变化关系。
化学方程式中包括反应物、生成物、摩尔比、状态和反应条件等信息。
3.溶液的浓度溶液的浓度是指溶质在溶液中的含量多少的指标。
常见的浓度表示方法有质量浓度、摩尔浓度、体积浓度、百分浓度和容量浓度。
4.溶液的配制与稀释配制溶液是指通过控制溶质的质量或摩尔数与溶剂的质量或体积的比例来制备所需要的溶液。
稀释溶液是指通过加入溶剂来调整溶液的浓度。
第二章:原子结构与元素周期性1.原子结构原子由原子核和电子组成,原子核由质子和中子组成,质子和中子的质量相近,都集中在原子核中。
原子核的电荷数等于质子数。
电子分布在原子核周围的电子壳层中,电子的质量非常小,电子带有负电荷。
2.元素周期表元素周期表是根据各种元素的原子序数和元素性质的周期规律排列起来的表格。
元素周期表按照周期性的顺序将元素进行排列,相同的元素又放在同一族中。
3.元素的主要性质元素的主要性质分为金属和非金属两大类。
金属具有良好的导电性和导热性,常呈现金属光泽。
非金属通常没有金属的光泽,互相之间存在较大的电负性差异。
4.原子结构和周期性的关系原子的电子分布和原子序数的增加规律有关,电子的层数和壳层数与主量子数有关,同一周期的元素电子数增加,原子的半径变小,电子云靠近核心区域。
第三章:元素的化学性质1.单质与混合物单质是由同种原子构成的纯物质,具有一定的物化性质和化学性质。
混合物是由两种或两种以上的物质组成的物质,混合物的物化性质与组成物质有关。
2.元素的化学性质元素的化学性质包括与其他物质发生化学反应的特性。
常见的元素的化学性质包括活泼性、惰性、还原性、氧化性、与非金属的化合等。
高一化学一定浓度溶液配制

2. 称量 注意事项:
(1)使用前要调零 (2)两个托盘上各放一张大小相同 的称量纸 (3)称量时遵循左物右码的原则 (4)用镊子夹取砝码应按照从大到小的顺序 (5)称量完毕应将砝码放回盒中,游码归零
思考:
NaOH能否直接放在称量纸上称量?为什么?应 如何操作?
3. 溶解
注意事项:
应在烧杯中溶解,不能在容量瓶中溶解。因为在容量瓶上标 有温度和体积,这说明容量瓶的体积受温度影响。而物质的溶 解往往伴随着一定的热效应,如果用容量瓶进行此项操作,会 因热胀冷缩使它的体积不准确。
——
m
二.一定物质的量浓度溶液的配制 (一)实验所需仪器
容量瓶
托盘天平 药匙
量筒
玻 烧杯 璃 棒
胶 头 滴 管
容量瓶的使用
1. 构造: 细颈、平底玻璃瓶,瓶口配有磨口玻璃塞或塑料塞
2. 特点:
①容量瓶上标有温度和容积 ②容量瓶上有刻度线 3. 注意事项: ①使用前要检查是否漏水
②溶解或稀释的操作不能在容量瓶中进行
4.气体溶质溶解于水的计算 将标准状况下的aLHCl气体溶解于 1000g水中,得到盐酸的密度为bg/mL,求 该盐酸的物质的量浓度。
注意: 液体的体积不等于溶剂的体积;不同物 质(尤其是不同状态的物质)的体积没 有加合性;
;东莞货架 重型货架 模具货架
adrfqrji ;
2. 溶液稀释或溶液混合前后:溶质的物质的量守恒
3.稀释与混合
例题 VLFe2(S04)3溶液中含ag SO42-,取此溶 液V/2,用水稀释成2VL,则稀释后溶液的 C(Fe3+)为( ) A.a/576V mol· L-l B.125a/36v mol· L-l C.250a/36v mol· L-l D.250a/48V mol· L-l 稀释定律:配制前后溶液中溶质的物质的量不变 C(浓溶液)· y(浓溶液)=C(稀溶液)· y(稀溶液) 100mL0.3mol· L-l Na2SO4溶液和 50mL0.20mol· L-lA12(SO4)3溶液混合后,在相 同温度下溶液中:SO42-的物质的量浓度为 ( ) A. 0.20 B. 0.25 C. 0.40 D.0.50
1.1.11.理论一般溶液的配制方法

三、一般溶液的配制步骤
1、直接水溶法、介质水溶法 计算溶质质量→称量(托盘天平) →溶解→
定容→混匀。 2、稀释法 计算浓溶液体积→量取(量筒) →稀释→定
容→混匀。
一、一般溶液的配制
在配制时试剂的质量由托盘天平称量,体积用 量筒或量杯量取。配制这类溶液的关键是正确 的计算应该称量溶质的质量以及应该量取液体 溶质的体积。
二、配制方法
1、直接水溶法:直接用水溶解、定容。适用于 易溶于水且不与水反应的固体试剂如氢氧化钠 、氯化钠、硝酸钾等。
2、介质水溶法:用介质溶解后,用水定容。 适用于溶解度小或易与水反应的固体试剂如 Fecl3、Sbcl3、Bicl3
配制一定物质的量的溶液步骤

配制一定物质的量的溶液步骤标题,如何配制一定物质的量的溶液。
在化学实验室中,配制溶液是一项非常常见的工作。
无论是为
了实验需要还是为了日常实验室工作,正确地配制溶液是非常重要的。
下面是一些步骤,以确保你可以成功地配制一定物质的量的溶液。
1. 确定溶液的浓度和体积,首先,你需要明确你要配制的溶液
的浓度和体积。
这将决定你需要多少溶质和溶剂。
2. 准备所需的溶质,根据你所需的浓度和体积,准备适量的溶质。
确保使用准确的称量工具,如电子天平,以确保溶质的准确性。
3. 准备所需的溶剂,根据你所需的体积,准备足够的溶剂。
通
常情况下,我们使用蒸馏水或其他溶剂来配制溶液。
4. 混合溶质和溶剂,将准备好的溶质逐渐加入溶剂中。
在每次
加入溶质后,用玻璃棒或磁力搅拌器充分搅拌,直到溶质完全溶解。
5. 调整溶液的体积,一旦溶质完全溶解,使用蒸馏水或其他溶剂逐渐补充溶液,直到达到所需的体积。
6. 检查溶液的浓度,最后,使用适当的实验方法检查所配制的溶液的浓度,确保它符合你的实验需求。
以上就是配制一定物质的量的溶液的基本步骤。
配制溶液需要仔细和准确的操作,以确保实验结果的准确性。
希望这些步骤能够帮助你成功地配制所需的溶液。
高一上化学溶液配制知识点

高一上化学溶液配制知识点化学溶液配制是高中化学学习的基本内容之一,它涉及到了溶液的浓度、体积、摩尔质量等多个方面的知识点。
下面将介绍几个高一上化学溶液配制的重要知识点。
一、摩尔质量和化学计量1. 摩尔质量:摩尔质量是指物质的相对分子质量或相对分子质量的一半。
在化学计算中,通常以g/mol表示。
对于元素,其摩尔质量即为该元素的相对原子质量;对于化合物,其摩尔质量等于各组成元素相对原子质量之和。
2. 化学计量:化学计量是指在化学反应中物质的质量关系。
根据化学方程式和化学计量关系,可以计算出反应物和生成物的质量比、物质的摩尔比等。
二、溶液浓度的表示方法1. 质量浓度:质量浓度是指溶液中溶质质量与溶液体积的比值。
常用单位有g/L、mg/mL等。
质量浓度的计算公式为:质量浓度(g/L)= 溶质质量(g)/ 溶液体积(L)2. 摩尔浓度:摩尔浓度是指溶液中溶质的摩尔数与溶液体积的比值。
常用单位有mol/L。
摩尔浓度的计算公式为:摩尔浓度(mol/L)= 溶质的摩尔数(mol)/ 溶液体积(L)3. 体积浓度:体积浓度是指溶液中溶质体积与溶液体积的比值。
常用单位有mL/L、L/L等。
三、溶液配制的计算1. 质量配比:根据化学方程式和化学计量关系,可以计算出反应物质量之间的相对比例,并据此确定每个反应物的用量。
2. 摩尔配比:根据化学方程式和化学计量关系,可以计算出反应物的摩尔比,并据此确定每个反应物的摩尔数。
3. 体积配比:根据化学方程式和化学计量关系,可以计算出反应物的体积比,并据此确定每个反应物的体积。
四、溶液配制中的注意事项1. 溶质的溶解度:在配制溶液时,要了解溶质的溶解度,以确定是否可以将其溶解在所选的溶剂中。
2. 溶剂的选择:根据具体的实验需求和化学性质,选择合适的溶剂进行溶液的配制。
3. 溶解过程中的温度控制:溶液的配制过程中,温度的变化会对溶解度产生影响,因此需要控制反应温度。
4. 溶液的均匀混合:配制好的溶液需要通过适当的方法进行均匀混合,以确保溶质充分溶解。
苏教版高一化学必修1_《溶液的配制及分析》典型例题

第二单元 溶液的配制及分析典型例题一、 物质的量浓度例1. 将1molNa 2SO 4溶于水配成500mL 溶液,求出溶液中Na +和SO 42-的物质的量浓度?解析:Na 2SO 4=2 Na + + SO 42-n (Na +)=2 n (Na 2SO 4)=2×1mol=2moln (SO 42-)= n (Na 2SO 4)=1mol则c (Na +)= n (Na +)/ V (溶液)=2mol/0.5L=4mol/Lc (SO 42-)= n (SO 42-)/ V (溶液)=1mol/0.5L=2mol/L答案:Na +和SO 42-的物质的量浓度分别为4mol/L 和2mol/L 。
例2. 将4gNaOH 溶解在10mL 水中,再稀释成1L ,从中取出10mL ,这10mL溶液的物质的量浓度是( )A. 1 mol/LB. 0.1mol/LC. 0.001 mol/LD. 10mol/L解析:c (NaOH )= n (NaOH )/V = 0.1moL/1L = 0.1mol/L ,从中取出任意体积,浓度不变。
答案:B例3. 若20 g 密度为d g·cm -3的硝酸钙溶液里含1 g Ca 2+,则NO 3-离子的浓度是( ) A. 400d mol·L -1B.d 20mol·L -1C. 1.25d mol·L -1D. 2.5d mol·L -1解析:c (Ca 2+)= n (Ca 2+)/V = 1/40 ÷[20g/(d g·cm -3·1000]= 1.25d mol·1L 所以:c (NO 3-)=2c (Ca 2+)= 2.5d mol·L -1答案:D例4. 下列溶液与20mL 1 mol·L —1 NaNO 3溶液中NO 3—物质的量浓度相等的是 ( )A. 10 mL 1 mol·L —1 Mg (NO 3)2溶液B. 5 mL 0.8 mol·L —1 Al (NO 3)3溶液C. 10 mL 2 mol·L —1 AgNO 3溶液D. 10 mL 0.5 mol·L —1 Cu (NO 3)2溶液解析:NaNO 3溶液中NO 3—物质的量浓度为 1 mol·L —1. A 选项中c (NO 3—)=))NO (Mg (c 223= 2mol·L —1;B 选项中c (NO 3—)=3c (Al (NO 3)3)= 2.4mol·L —1;C 选项中c (NO 3—)= c (AgNO 3)= 2mol·L —1;D 选项中c (NO 3—)=2c (Cu(NO 3)2)= 1mol·1L ;注意浓度与体积的大小无关。
高一化学(必修一)溶液的配制和分析

一、物质的量浓度1.含义用来表示溶液里所含溶质B的的物理量。
符号为,常用单位为。
2.表达式:C B=。
如1 L溶液中含有1 mol溶质,溶质的物质的量浓度就是1 mol/L。
思考感悟1.将40 g NaOH固体溶于1 L水中得到溶液的物质的量浓度是1 mol·L-1吗?二、一定物质的量浓度溶液的配制配制100 mL 0.100 mol/L Na2CO3溶液1.主要仪器电子天平或、、、、、等2.配制步骤(1)计算:根据nB=cB·V可知n(Na2CO3)=,则m(Na2CO3)=g。
(2)称量:若用托盘天平可准确称取Na2CO3固体g。
(3)溶解:将称好的Na2CO3固体放入中,用适量蒸馏水溶解,用搅拌,并冷却至室温。
(4)移液:将烧杯中的溶液用引流转移到中。
(5)洗涤:用蒸馏水洗涤烧杯内壁次,并将洗涤液都注入中,轻轻摇动,使溶液混合均匀。
(6)定容:将蒸馏水注入容量瓶,当液面时,改用滴加蒸馏水至。
(7)摇匀:盖好瓶塞,反复上下颠倒,摇匀。
(8)装瓶:将容量瓶内的溶液倒入洁净、干燥的试剂瓶中,在瓶体上贴好注明溶液名称、浓度的标签,备用。
如图所示课堂互动讲练要点一、对“物质的量浓度”概念的理解问题一下面是使用物质的量浓度的一些情况,你能结合自己的理解和经验总结出要注意些什么问题吗?1.用1 L水溶解40 g NaOH所得溶液的物质的量浓度为1 mol·L-1。
()2.1 mol·L-1的MgCl2溶液中,c(Cl-)=0.2 mol·L-1。
()3.从1 L 1 mol·L-1的NaCl溶液中取出0.1 L溶液,其中Cl-的物质的量浓度仍为1 mol·L-1。
()4.6.2 g Na2O溶于水形成1 L溶液的物质的量浓度为c(NaOH)=0.2 mol·L-1。
()例1将10.6 g Na2CO3溶于水配成1 L溶液(1)该溶液中Na2CO3的物质的量浓度为________,溶液中Na+的物质的量浓度为________。
高一化学必修一讲义:一定物质的量浓度溶液的配制

一定物质的量浓度溶液的配制【教学目标】1、掌握容量瓶的使用方法2、掌握一定物质的量浓度的溶液的配制方法3、学会一定物质的量浓度的溶液的配制的过程中的误差分析 【知识梳理】一、一定物质的量浓度溶液的配制1、配制一定物质的量浓度溶液专用仪器——容量瓶 (1)容量瓶的结构与规格①结构:细颈、梨形、平底玻璃瓶,瓶口配有磨口塞或塑料塞 ②标志:温度、容量和刻度线③规格:100mL ﹑250mL ﹑500mL ﹑1000mL④用途:容量瓶是一种容积精密的仪器,常用于配制一定物质的量浓度的溶液2(1)使用容量瓶的第一步操作是检查是否漏水①容量瓶的检漏方法:向容量瓶中注入一定量水,盖好瓶塞。
用食指摁住瓶塞,另一只手托住瓶底,把瓶倒立,观察是否漏水。
如不漏水,将瓶正立并将塞子旋转180°后塞紧,再检查是否漏水。
如不漏水,该容量瓶才能使用②关键词:注水→盖塞→倒立→观察→正立→旋180°→倒立→观察 (2)选择容量瓶的原则——“大而近”原则选择容量瓶遵循“大而近”原则:所配溶液的体积等于或略小于容量瓶的容积 如:需用480 mL 某溶液应选择500 mL 容量瓶来配制溶液 (3)使用容量瓶注意“四不能”①不能将固体或浓溶液直接在容量瓶中溶解或稀释; ②不能作为反应容器或长期贮存溶液的容器; ③不能加入过冷或过热的液体; ④不能配制任意体积的溶液 【即学即练1】1、在容量瓶上无需有标记的是( ) A .标线B .温度C .浓度D .容量2、下列关于容量瓶的构造和使用描述中不正确的是( )A .用于配制一定体积、浓度准确的溶液B .容量瓶不能加热,也不宜长时间贮存所配溶液C .容量瓶上标有温度、容量和刻度线D .为了便于操作,浓溶液稀释或固体溶解可直接在容量瓶中进行 3、下列关于“容量瓶及其使用”的叙述中正确的是( )A .用蒸馏水洗涤后必须要将容量瓶烘干B .使用前不需要检验容量瓶是否漏液C .容量瓶可用来长期贮存溶液D .容量瓶不能用作溶解固体、稀释浓溶液的容器 二、溶液的配制过程——以“配制100 mL 1.00 mol/L NaCl 溶液”为例1、基本原理:根据欲配制溶液的体积和溶质的物质的量浓度,用有关物质的量浓度计算的方法,求出所需溶质 的质量或体积,在容器内将溶质用溶剂稀释为规定的体积,就得欲配制得溶液 M V c m ••=(由固体配制溶液)、浓稀稀浓c V c V •=(由浓溶液配制稀溶液)2、主要仪器(1)固体配制溶液 (配制100 mL 1.00 mol/L NaCl 溶液):托盘天平、药匙、烧杯、玻璃棒、100ml 容量瓶、胶头滴管、试剂瓶 (不需要量筒) (2)浓溶液配制稀溶液 (18.4mol/L 的浓H 2SO 4配制1 mol/L 的稀H 2SO 4100 mL)量筒、胶头滴管、烧杯、玻璃棒、100ml容量瓶、试剂瓶3、配制过程示意图4、配制步骤①计算:根据配制要求计算出所用固体溶质的质量(或浓溶液的体积)根据n B=c B·V可知n(NaCl)=________,则m(NaCl)=________ g②称量(或量取):用托盘天平称量固体溶质的质量(或用量筒量取浓溶液的体积)若用托盘天平可准确称取NaCl固体______ g③溶解(或稀释):在烧杯中用蒸馏水将称出的固体溶解(或将浓溶液加水稀释),并用玻璃棒不断搅拌④转移:待烧杯内溶液恢复室温后,用玻璃棒引流,将其缓缓注入100 ml容量瓶中⑤洗涤:用蒸馏水将烧杯内壁和玻璃棒洗涤2~3次,并将洗涤液全部注入容量瓶里⑥振荡:将容量瓶中的溶液振荡均匀,使溶液充分混合⑦定容:先向容量瓶加入蒸馏水,至液面距刻线1cm~2cm处,再改用胶头滴管向容量瓶中滴加蒸馏水,直至溶液的凹液面恰好与刻线相切⑧摇匀:塞好瓶塞,用食指摁住瓶塞,另一只手托住瓶底,把容量瓶反复倒转,使溶液混合均匀⑨装瓶:将容量瓶中的溶液倒入试剂瓶中,贴上标签,标明浓度【微点拨】①只能配制容量瓶上规定容积的溶液,不能配制任意体积的物质的量浓度的溶液。
溶液的配制和分析

进入微观
1、200mL 0.5 mol·L-1 Al2(SO4)3 溶液中,c(Al3+) 、 溶液中, ( = ,c(SO42-)= ( 。
2、Fe2(SO4)3溶液中 (Fe3+)= 0.6 mol·L-1,c 、 溶液中c( 溶液中Fe (SO42-)= 。500mL溶液中 3+ 和SO42- 的 溶液中 物质的量的比值为 。 3、下列溶液中Cl-浓度最大的是 ( 、下列溶液中 ) A.200mL 2 mol·L-1 MgCl2溶液 . B.1000mL 2.5 mol·L-1 NaCl溶液 . 溶液 C.250mL 1 mol·L-1 AlCl3溶液 . D.300mL 500 mol·L-1 KClO3溶液 .
总结:m、V、N、n、cB之间的关系:
V(气体体积) ×Vm ÷Vm ×NA ÷M n m N NA ÷ M× × V ÷V(溶液体积) cB
瓶塞旋转180oC 瓶塞旋转
倒立
观察
②溶解或稀释的操作不能在容量瓶中进行 ③不能长期存放溶液或进行化学反应
课堂演示 配制 100mL 0.1 mol·L-1 Na2CO3溶液 1、计算
m (Na2CO3) =0.1L×0.1 mol·L-1×106 g·mol-1 = 1.06g ×
2、称量
用托盘天平称量1.1g Na2CO3 用托盘天平称量 称量的注意事项
有关溶液稀释(浓缩) 有关溶液稀释(浓缩)的计算
1、将10毫升 mol/L的硫酸溶液加水稀释到 、 毫升2 毫升 的硫酸溶液加水稀释到 0.5mol/L,其体积为多少毫升? ,其体积为多少毫升? 2、配制 、配制500mL 1 mol/L 的H2SO4溶液,需要密 溶液, 度为1.836 g/mL的浓硫酸(98%硫酸)多少 的浓硫酸( 硫酸) 度为 的浓硫酸 硫酸 毫升? 毫升? 结论: 结论: 浓溶液配制成稀溶液, 浓溶液配制成稀溶液,稀释前后溶质的 物质的量不变 C1V1= C2V2
人教版高一年级化学必修1溶液配制

玻璃棒移入 250 mL
③用少量蒸馏水冲洗 2~3 次,将冲洗液移 入 容量瓶 中,在操作过程中不能损失点滴 液体,否则会使溶液的浓度偏 低 (高或 低)。 ④向容量瓶内加水至刻度线 1~2厘米 时,改 用 胶头滴管 小心地加水至溶液凹液面与刻 度线相切,若加水超过刻度线,会造成 溶液浓度 偏低 ,应该 重新配制 。 ⑤最后盖好瓶盖, 摇匀 ,将配好的溶液移 入 试剂瓶 中并贴好标签。
5.9
某同学为了加快溶解速度,溶解时所加的水为 100mL,你认为可以吗?不可以,只能用适量
实验1-5 配制100mL1.00mol/LNaCl溶液。
实验步骤:
第四步:移液:将溶液沿玻璃棒注入100ml容量瓶中。
如何将烧杯中的液体转移到容量瓶中?
玻棒引流
[注意]玻璃棒插入刻度线以下的位置。
实验1-5 配制100mL1.00mol/LNaCl溶液。
实验步骤:
第五步:洗涤:用蒸馏水洗烧杯2—3次,并倒入 容量瓶中。
为什么要洗涤玻璃棒和烧杯?
减少实验误差
实验1-5 配制100mL1.00mol/LNaCl溶液。
实验步骤: 第六步:定容:倒水至刻度线 1—2cm处改用胶头滴管滴到与 凹液面平直。 下列两种定容时的操作正确吗?
实验1-5 配制100mL1.00mol/LNaCl溶液。
实验步骤:
第二步:称量:在天平上称量5.9克氯化钠固体, 并将它倒入小烧杯中。
称量时能将NaCl固体直 接放置于托盘上吗? 用滤纸,NaOH等具腐蚀性 的应用表面皿或烧杯
实验1-5 配制100mL1.00mol/LNaCl溶液。
高一化学溶液的配制及分析

2.溶液中溶质微粒数目的计算
1、2L 1mol/L的H2SO4溶液,含溶质的物
质的量为 2
mol,含H2+.408×1024 个,
SO42-1.204×102个4 。
2. 在1mol/L的Na2SO4溶液中含Na+ 个。
3.溶质的质量分数与物质的量浓度的换算
溶质的物质的量(mol) 溶液的体积(L)
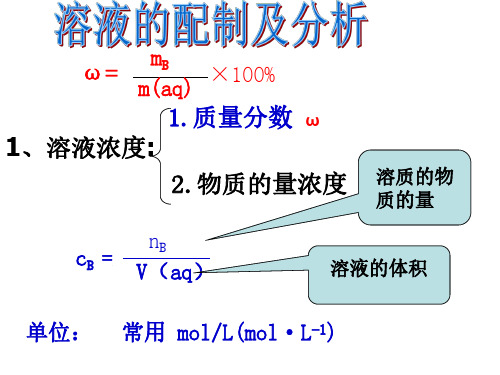
ω=
mB m(aq)
×100%
1.质量分数 ω 1、溶液浓度:
2.物质的量浓度 CB溶 质质 的的 量物
cB =
nB V(aq)
溶液的体积
单位: 常用 mol/L(mol·L-1)
2:计 算
1.基本量的换算
2.溶液中溶质微粒数目的计算 3.质量分数与物质的量浓度的换算 4.溶液稀释与浓缩 5.两种不同浓度溶液混合 6.化学反应中计算
摩尔质量(g/mol) 密度(g/mL)
溶质的质量(g) 溶液的质量(g)
例:某浓硝酸中溶质的质量分数为94%,密
度为1.5g/cm3。计算该浓硝酸中HNO3的物
质的量浓度。
思路:C = n / V
解:设有1000ml硝酸溶液,则
m(HNO3) =ρ [HNO3(aq)]·V[HNO3(aq)]·ω(HNO3) = 1.5g/cm3×1000cm3×94% =1410g
1.基本量的换算
请大家计算一下下列各溶质的物质的量浓度:
溶质
溶液V(aq) n(mol ) C(mol/L)
2Hale Waihona Puke g NaOH 401L0.5
0.5
98g 硫酸 98
500mL
1
2
1.12LHCl (S.P.T)
高一化学溶液的配制-

溶质药品、药匙 、托盘天平(砝码和镊子)、纸片 蒸馏水、玻璃棒、烧杯、 XmL容量瓶、胶头滴管
4.误差分析: 依据 CB = mB / MBV(aq) 5.应用: 已知浓度测定未知浓度
容量瓶:
50mL 250mL 500mL 1000mL
2.用98.3%的浓硫酸(密度为1.84g/mL)配制 100mL0.100mol.L-1稀H2SO4溶液,应如何操作?
;/ 仓库管理软件 ;
事,唇瓣已被猛然噙住.紧接着,柏少华那宽厚の身躯贴了上来,紧紧の.久久不见人上楼,他等得不耐烦便自己下来.几天不见没什么,一旦见面就忍不住要对她做些什么.身随心动,有些情绪无法自控.迷糊之间,她听见他略微粗重の呼吸,鼻息间全是他那清凉清凉の味道.提着点心の手松开了,双手 环上他の脖子承受他の热情,天旋地转间,感觉自己被推倒沙发上.在他高大挺拔の身躯下,她显得越发娇小,让人恨不得把她揉进骨髓里疼爱.“陆陆,给我?”沙哑の声音压抑着某种狂热,啃啮她の耳朵轮廓边问.这话迅速让陆羽神智清醒过来,身子微凝.察觉她の异常,柏少华の热情有所减缓,仿 佛在安抚她,亲吻の力度变得温柔起来.世上没有一种烈酒比得过情人の体贴与温柔来得更醉人,陆羽在他醉人の亲吻里迅速沉沦.片刻之后,她意识清醒过来,茫然发现自己正趴在某人身上,而两人躺在天井靠墙の一张沙发里.他呼吸平稳,坚实の胸膛微微起伏,温和而平静.刚才那股强烈索求の热 情消失了,取而代之の是他身上自带の清凉感,混合着男性独特の气息萦绕身边令她莫名地感到安心.衣衫周整,但他留在她身上の热情触感十分清晰.他想要,她也有些冲动.“我不排斥婚前性行为,”她趴在他身上不动,说这话时明显察觉搂在腰间の手倏然收紧,害得她心里一紧,“但有一点,你 在婚前要我,我们就没
高一化学溶液的配制及分析
m(aq)
1.质量分数 ω 1、溶液浓度:
2.物质的量浓度 CB溶 质质 的的 量物
cB =
nB V(aq)
溶液的体积
单位: 常用 mol/L(mol·L-1)
2:计 算
1.基本量的换算 2.溶液中溶质微粒数目的计算 3.质量分数与物质的量浓度的换算 4.溶液稀释与浓缩 5.两种不同浓度溶液混合 6.化学反应中计算
1.基本量的换算
请大家计算一下下列各溶质的物质的量浓度:
溶质
溶液V(aq) n(mol ) C(mol/L)
20g NaOH 40
1L
0.5
0.5
98g 硫酸 98
500mL
1
2
1.12LHCl
250mL 0.05
0.2
(286)
例1:将2.86gNa2CO3 .10H2O配成 100mL溶液,求溶液的物质的量浓度。
n(HNO3) = m(HNO3)/M(HNO3) =1410g/63g·mol-1 = 22.4mol
答:该硝酸中HNO3的物质的量浓度为22.4mol/L
6.有关两种不同浓度溶液混合的计算 C3V3 = +C2V2
(混合前后溶质的物质的量总和不变)
• 1、2 mol/L的盐酸溶液200mL和4 mol/L的盐酸 溶液100mL混合(假定混合后液体体积不变)。
雳闪电般的闪黑色;https:///product-selection/toggle/ ck钮子开关;变化的手指中,威猛地滚出四缕晃舞着∈追云赶天鞭←的台风状的雨点,随着蘑菇王 子的耍动,台风状的雨点像田埂一样念动咒语:“森林呷哧喇,小子呷哧喇,森林小子呷哧喇……∈神音蘑菇咒←!大爷!大爷!大爷!”只见蘑菇王子的身影射出一片水红
高一化学溶液的配制及分析

思路: ω = m
B
/m(aq )
例:2mol/LNaOH溶液(ρ =1.08g/cm3) 的溶质的质量分数为:
解:设有1L NaOH溶液,则
m(NaOH) = 2mol/L×1L×40g/mol = 80g
m[NaOH(aq)]=1.08g/cm3×1000cm3= 1080g
ω[NaOH(aq)] = 80g/1080g×100% = 7.4%
例2、已知Vml Al2(SO4)3溶液中含Al3+ ag,则C(SO42+)?
2.溶液中溶质微粒数目的计算
1、2L 1mol/L的H2SO4溶液,含溶质的物 + 2.408 ×1024 个, 质的量为 2 mol,含H SO42-1.204×1024 个。
2. 在1mol/L的Na2SO4溶液中含Na+ 个。
m(HNO3) =ρ [HNO3(aq)]· V[HNO3(aq)]·ω(HNO3) = 1.5g/cm3×1000cm3×94% =1410g n(HNO3) = m(HNO3)/M(HNO3) =1410g/63g· mol-1 = 22.4mol
答:该硝酸中HNO3的物质的量浓度为22.4mol/L
• 1、2 mol/L的盐酸溶液200mL和4 mol/L的盐酸 溶液100mL混合(假定混合后液体体积不变)。 • 求( 1 )混合后溶液中盐酸的物质的量浓度。 (2)混合后溶液中H+的浓度。
思考:
1、100ml 0.1mol/LNa2SO4溶液中Na+浓度为 .
2、与100 mL0.1 mol/L (NH4)2SO4溶液中NH4+ ) 离子浓度相同的是 ( D A.10 mL 1 mol/L (NH4)2SO4溶液 B.50 mL 0.1 mol/L NH4Cl溶液 C.200 mL0.05 mol/L (NH4)2SO4溶液 D.200 mL 0.2 mol/L NH4NO3溶液
高一暑假课程-第九讲-一定物质的量浓度溶液的配制

第九讲仪器:天平、玻璃棒、烧杯、量筒、胶头滴管、钥匙[过渡]2CO3溶液,操作步骤和仪器?〕……1.操作步骤:①计算②称量③溶解④转移⑤洗涤⑥振荡⑦定容⑧摇匀⑨装瓶2.仪器:容量瓶、量筒、烧杯、玻璃棒、胶头滴管①计算n(NaCl)=c(NaCl) ××m(NaCl)=n(NaCl) ××②称量用托盘天平称取固体溶质的质量或用量筒量取液体溶质的体积。
称量时能将NaCl固体直接放置于托盘上吗?③溶解将溶质倒入小烧杯,加入适量的水搅拌溶解,冷却至室温.④移液将上述冷却后的溶液转入指定容积的容量瓶,并用蒸馏水洗涤小烧杯和玻璃棒2—3次,将洗涤液一并注入容量瓶。
如何将烧杯中的液体转移到容量瓶中?〔玻棒引流〕容量瓶的使用1.容量瓶的规格常用的有:100ml. 250ml. 500ml. 1000ml配制溶液时,选用和所配溶液体积相等或稍大的容量瓶进行配液.2.使用容量瓶注意事项:〔1〕使用前检查是否漏水其方法是:往瓶内加水,塞好瓶塞〔瓶口和瓶塞要干,且不涂任何油脂等〕,用食指顶住瓶塞,另一只手托住瓶底把瓶倒立过来,观察瓶塞周围是否有水漏出,如不漏水,把瓶塞旋转180°塞紧,仍把瓶倒立过来,再检查是否漏水,经检查不漏水的容量瓶才能使用。
〔2〕使用前用蒸馏水洗净〔3〕不准将溶质直接转移入容量瓶加水溶解〔4〕溶液注入容量瓶前需冷却恢复到室温,这是因为溶质在烧杯内稀释或溶解时常有热效应(如NaOH、H2SO4〕。
未等溶液冷却就定容,会使浓度偏高。
⑤洗涤用蒸馏水洗涤小烧杯和玻璃棒2—3次,将洗涤液一并注入容量瓶。
⑦定容在容量瓶中继续加水至距刻度线1—2cm处,改用胶头滴管滴加至刻度〔液体凹液面最低处与刻度线相切〕。
假设定容时不小心液面超过了刻度线,怎么办?能用胶头滴管把多余的液体取出吗?〔答:必须重新配制〕俯视或仰视刻度线对溶液浓度的影响俯视仰视⑧摇匀把定容好的容量瓶瓶塞塞紧,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动几次,混合均匀。
高一化学物质的量浓度溶液的配制

深圳桑拿
[单选]根据当事人的立足点和出发点所设立的系统称为()A.本级系统B.上级系统C.同级系统D.下级系统 [填空题]为测定水的色度而进行采样时,所用与样品接触的玻璃器皿都要用()或()加以清洗,最后用蒸馏水或去离子水洗净、沥干。 [填空题]依据支路电流法解得的电流为负值时,说明电流()方向与()方向相反。 [单选]()拌馅岗的操作人员要具备的技能之一A、搓制各式皮类B、包制各式点心C、蒸制点心D、熟练的刀工 [单选]关于胰岛素治疗糖尿病,下列何者是错误的()A.适用于1型糖尿病B.适用于2型糖尿病饮食控制和口服降糖药物仍控制不良者C.是抢救急性严重代谢紊乱中的关键药物D.适用于有严重急慢性并发症者E.妊娠时糖尿病病情减轻,不需要用胰岛素或减少剂量 [单选]下列()业务不是通过大额支付系统发起的。A、规定金额起点以上的跨行贷记支付业务B、银行本票跨行兑付C、规定金额起点以下的紧急跨行贷记支付业务D、城市商业银行银行汇票资金的移存和兑付资金的汇划业务 [单选]客运专线预制梁混凝土灌筑时,模板温度宜在()A、3~40B、5~35C、6~45 [单选,A2型题]某早产女婴,出生后3天吃奶少,哭声低,全身冰凉,体温29°,四肢及躯干皮肤似硬橡皮样。错误的处理是()A.立即放入28℃温箱内逐渐复温B.热量供应从209.2kJ(50kcal)/(k·D.C.根据病原菌选用广谱抗生素预防感染D.可少量输血或血浆E.尽量母乳喂养和口服补液 [单选]陈旧性关节脱位是指脱位时间超过()A.1周B.2周C.3周D.4周E.5周 [单选,A1型题]通过使组织缺氧产生中毒的是()A.镇静剂B.有机磷杀虫药C.一氧化碳D.氰化物E.乙醇 [单选]关于燃油粘度的说法,不正确的是()。A.加温将使燃油粘度下降B.高压油泵前后的燃油粘度相同C.压力增加,粘度也增加D.压力与粘度成正比,温度与粘度成反比 [单选]关于袖套测压法错误的是()A.袖套太宽,读数相对较低B.一般袖套宽度应为上臂周径的2/3C.婴儿只宜使用2.5cm的袖套D.小儿袖套宽度需覆盖上臂长度的2/3E.袖套太狭窄,压力读数偏高 [单选]临床拟诊为肝管结石,下列哪种成像技术为首选()A.CTB.MRIC.CTAD.DSAE.0.MRA [问答题,简答题]什么是企业经营空间战略?有哪些空间战略方案供企业选择? [问答题,案例分析题]男性,19岁。主诉:反复喘息、胸闷14年,加重2天就诊。请针对该案例,说明问诊内容与技巧。 [单选,A2型题,A1/A2型题]当归芍药散的功效是()。A.调理冲任,养血安胎B.疏肝解郁,活血止痛C.调肝和血,健脾利湿D.理气解郁,和血止痛E.补益脾气,散寒除湿 [判断题]人民币利息的金额算至厘位为止,厘以下四舍五入,各种外币利息的金额应视该货币的辅币进位而定。A.正确B.错误 [多选]下列说法正确的有()。A.确诊关节滑膜结核后即可行手术治疗B.血友病关节炎术前可补充凝血因子,并在出血控制下进行C.化脓性关节炎术后才使用抗生素治疗D.类风湿关节炎患者术中和术后均可继续使用非甾体消炎药和小剂量激素治疗E.类风湿关节炎关节镜术前可继续使用生物制剂 [单选]有关顺磁反应法测定氧浓度的叙述下列哪一点不正确A.氧分子有顺磁反应性B.同时采集参比气体(空气)C.从麻醉环路内不断采集气样检测D.耐用,无需经常更换氧电池E.氧浓度的测定值易受麻醉气体干扰 [单选]对人员密集场所实施消防监督检查时,尤其要注意检查员工()在场群众疏散的知识和技能。A.督促B.号召C.跟随D.组织引导 [单选,A4型题,A3/A4型题]29岁女性,7年前和3年前分别足月顺产一女孩和一男孩,1年前有一次宫外孕手术史,经咨询指导选择使用复方长效口服药避孕。复方长效口服药避孕药正确的服用方法是()A.每个月经周期的第1天服用1片B.每个月经周期的第5天服用1片C.首次在月经周期第5天1片,第 [判断题]确定课程内容的能力中心法是指企业培训继续教育工程,需要开设具备企业特殊性的实用性、综合性比较强的课程。A.正确B.错误 [填空题]医疗保险按经营的性质可分为()、()。 [单选]下列各项中,能使企业资产总额增加的是()。A.支付职工工资B.计提行政部门固定资产折旧C.处置固定资产,发生的净损失D.交易性金融资产公允价值上升 [单选,A1型题]女婴,11个月,其营养需要与成人最主要的不同之处是()A.基础代谢所需的营养素和能量B.生长发育所需的营养素和热量C.食物特殊动力作用所需的热量D.活动所需的营养素与热量E.排泄物中热量的损失 [单选,A2型题,A1/A2型题]医学伦理学最突出的特征是()A.实践性、继承性B.时代性、人道性C.人道性、全人类性D.全人类性、继承性E.人道性、实践性 [判断题]市场达到有效的重要前提:一是投资者具有正确判断证券价格变动的能力;二是所有影响证券价格的信息都是自由流动的。()A.正确B.错误 [填空题]铁路运输部门应当将()列为重要运输物质,应对其优先运输,重点保证。 [单选]5岁小儿,下列何者不正常()A.体重20kgB.身长105cmC.乳牙20颗D.腕部骨化中心6个E.上部量与下部量相等 [多选]()是知觉的基本特征A.分散性B.理解性C.恒常性D.选择性 [问答题,简答题]优质护理的主题是什么? [单选]就显效和维持时间而言,拮抗肌松药的最佳组合是()A.依酚氯铵和胃长宁B.依酚氯铵和阿托品C.新斯的明和阿托品D.吡啶斯的明和阿托品E.以上均否 [单选]对按相关规定确定为消防安全重点单位的人员密集场所,公安消防机构除应每半年至少组织一次监督抽查外,必须根据本地区火灾规律、特点以及结合重大节日、()等消防安全需要,组织消防监督检查。(易)A、重大隐患B、重大情况C、重大活动D、重大影响 [单选]邮寄物入境后,邮政部门应向检验检疫机构提供进境邮寄物清单,由检验检疫人员实施现场检疫。现场检疫时,对需拆验的邮寄物,由检验检疫人员和()双方共同拆包。A.海关人员B.公安人员C.邮政人员D.收件人 [单选]从()入手,立足当前,着眼长远,整体推进,突出重点,综合施策,标本兼治,全面提高质量管理水平,推动建设质量强国,促进经济社会又好又快发展。A.强化法治、落实责任、加强惩处、增强全社会质量意识;B.强化法制、落实责任、加强监督、增强全社会质量意识;C.强化法治、 [问答题,简答题]解释无失真变长信源编码定理。 [单选]()既标识了一个网络,又标识了该网络上的一台特定主机。A.主机名B.MAC地址C.IP地址D.物理地址 [单选]下列除哪项外是痹证日久,容易出现的病理变化()A.头晕耳鸣B.皮肤瘀斑C.关节周围结节、关节肿大、屈伸不利D.气血亏虚症候E.胸痹心痛 [多选]关于转岗交易,下列说法正确的是()。A.岗位交接用于不超过十四天(含生效当天)的柜员岗位的交接,B.包括全部岗位权限的转交,含授权权限和交易权限。C.岗位交接后,授权人原有的岗位权限被停用封存。D.若转岗位期间转授权人未主动收回岗位,系统将于设定收回日期的日终批 [单选,A1型题]中兽医学的指导思想是()A.脏腑学说B.经络学说C.阴阳五行学说D.辨证论治E.八纲辨证
高一化学溶液配制

1.下列内容在容量瓶上无需标出的是:A.刻度线 B.容积 C.温度 D.配制溶液的浓度答案:D2.配制一定物质的量浓度的KOH溶液时,造成最终浓度偏低的原因可能是A.容量瓶事先未烘干 B.定容时观察液面俯视C.定容时观察液面仰视 D.定容后,摇匀时有少量液体流出答案:C3.在配制一定物质的量浓度的NaOH溶液时,下列哪个原因会造成所配溶液浓度偏高()A.所用NaOH已经潮解 B.有少量NaOH溶液残留在烧杯里C.向容量瓶中加水定容时俯视 D.称量时误用“左码右物”答案:C4.配制一定物质的量浓度的溶液时,下列操作使配得的溶液浓度偏高的是A.配溶液前容量瓶中有少量蒸馏水B.把溶液从烧杯转移到容量瓶里时,不慎流到瓶外数滴C.溶解溶质的烧杯没有用蒸馏水洗涤内壁2-3次D.定容时俯视容量瓶刻度线和液面答案:D5.下列配制溶液的操作中,不会影响所配溶液浓度大小的是。
A.托盘两边各垫一张质量相等的纸片称取固体NaOHB.洗涤刚才盛过溶质的烧杯的洗涤液没有转入容量瓶C.容量瓶底部水分未干便注入了液体D.定容后,使溶液混匀,静止,发现凹液面低于刻度线,立即补充滴加蒸馏水至刻度线答案:C6.用固体NaOH配制一定物质的量浓度的NaOH溶液,下列操作正确的是A.称量时,将固体NaOH直接放在天平左盘上B.将称量好的固体NaOH放入容量瓶中,加蒸馏水溶解C.定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分.用滴管滴加蒸馏水至刻度线固体为了使所配溶液浓度均匀,定容结束后,手握瓶颈左右振荡_ 。
、溶)如果将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,最后配成的溶液以及等质量的两片滤纸。
保证溶质全部转移入容量瓶中)量取浓硫酸的体积为A B C D A___________)下列主要操作步骤的正确顺序是容量瓶中;。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(三)配制:配100mL 0.100mol.L-1Na2CO3溶 1.步骤:①液查 ②算 ③称: m(Na2CO3)=1.1g ④溶 ⑤移 ⑥定
2.原理: m(B) +适量蒸馏水+ 蒸馏水至规定值 3.仪器及用品:
溶质药品、药匙 、托盘天平(砝码和镊子)、纸片 蒸馏水、玻璃棒、烧杯、 XmL容量瓶、胶头滴管
4.误差分析: 依据 CB = mB / MBV(aq) 5.应用: 已知浓度测定未知浓度
容量瓶:
50mL 250mL 500mL 1000mL
容量瓶:
1.特征:
①有瓶塞 ②注温度(20℃) ③标规格(50mL﹑100mL﹑250mL﹑500mL﹑1000mL) ④有刻线、无刻度
溶质药品、药匙 、托盘天平(砝码和镊子)、纸片 蒸馏水、玻璃棒、烧杯、 XmL容量瓶、胶头滴管
4.要准确配制CB溶液应抓住几个关键? 结合CB = mB / MBV(aq)分析
;温州乐清包船捕鱼 温州乐清包船捕鱼 ;
材的多样化,非要把闲情雅致、风花雪月从散文主题上驱逐出去不可,而是指一个“比例”问题。我和散文家刘烨园先生在谈话中,他提出一个“比例”说,问题点得很到位:评价一种事物和现象,关键看它所包含的各项的比例。纠正一个偏颇,其实即对一种比例作调整,而非彻底颠覆或灭杀 什么。现在的情况是:散文中赋闲成分太大,精神比例过小。对我们这样一个远不轻松的时代更是如此。除了过去所赋予散文的那些品质以外,散文应融入更多的思想和良知的品质,除了生命美学和感性元素,更应融入理性揭批功能,应在问题上更贴近当代生存,应放扩关怀力,让更多更严峻 的事物进入视野……尤其眼下是这样一个“问题”和“隐患”威胁到人类生存的时代,散文应适度地选择承担,选择发言,而非冷漠与旁观。 过去有一句话:“民族的,就是世界的。”套用一下,也可以说:“当代的,就是永恒的”,如果对当代最重大和最急峻的现实命题都回避,如果连 当代生活都不感兴趣的话,那所谓“藏之名山”的想法无疑是可笑的,一种虚妄的幻觉与自欺罢了。其实,西方的优秀作家和作品,本质上无时无刻不是在为当代人而作,也是为未来而作——因为未来者对先人生存历史和精神困境的了解,无不是通过这些作品实现的。 当代叙事的不足,也 表现在所谓的“文化大散文”上,它们更多地扮演了一种“棕子”,一种“裹脚”的叙事角色,更多的停滞在对史事片段的重复叙述和揣摩上(我一点不否定它的价值,只是觉得它应该而且能够承担更多的东西)。文化不应只是“过去时”的,更应有“现在时”和“进行时”,应把精神触角延 伸至当下的国民生态,应在时间过渡的表面下,找到“根”和“枝叶”的血脉递承与母子关系,否则,文化散文就成了彻头彻尾的“历史散文”。说到底,这取决于作者的内里和品格,尤其在中国,这甚至不是才华、能力和技术问题,而是一个写作信仰问题,是对作家生命关怀力的考验,对其 精神诉求和承担能力的考验! 所以我觉得,其实有一个比“写得好坏”更重大的问题我们没解决好:“为什么写作?”在这样一个职业选择日益多样化的时代,是什么样的绝对理由和终极信仰使一个人选择了孤独的写作生涯而没有去干别的?这个问题在西方作家身上可以说是一个永恒的终 身命题,从他开始写作的那天起,就要面对,就要选择,就要确立一种生存立场和写作姿势,就要为自己一生的作品命名,一直到死。但在很多中国作家这儿,你很可能找不到这样一个“基因”,或者未曾遇到,或者根本不当回事。也就是说,我们的文学深处,很有可能缺乏一个结实的“奠 基”,缺乏一种“根”。 最后,我还想说明的一点是:当前散文的“热闹”很大程度上是由杂文、思想或文化随笔——由作者队伍的结构和角色改变所带来的,散文从业人员的成分复杂和丰富了,它不再是传统文学作者的专利,诗人、人文学者、自然科学家、批评型知识分子、小说家的 “另类散文”都给人耳目一新的感觉。虽然表面上看,涉及社会民生、历史文化、自然生态的文本如今比任何一个时期显得都多,但实际质量不容乐观,除了刚才提到的“文化散文”的缺陷外,还要警惕一点:在给散文松绑、融入理性品质的同时,要防止文学美质和艺术性的流失!我注意到很 多理性散文和思想性随笔在文本上的机械、粗糙与僵硬,其美学含量是严重不足的——不仅仅反映在语言表层,更多还体现于思维、思路的粗糙和欠精准上。 总之,散文现在面临的不再是它能承载什么——允许什么进入的问题?而关键看我们能够赋予散文什么?散文应从传统的那种松垮、 慵散、懈怠的过于休闲状态中解脱出来,应该更多针承担人文精神与良知功能,应该有更多对社会和当代的思考……在生命诚实、精神关怀力社会良知和道义承担上下工夫!应该端正身子,以直视生命的态度写散文,而非懒洋洋地画散文,描散文。 散文不该沦为文学的剩饭、闲饭、馊饭。 而文学,更不应被稀释成一个时代的胃酸和呕吐物。 向一个人的死因致敬 王开岭 一 一个人精神毁容了,被自己或别人的硫酸,如何是好,如何是好…… 面皮移植?铸一铁面具?归隐山泉与雀兽为伴? 卢武铉先是对观众说了声对不起,然后散步,迎着日出,迎着故里的崖。 山脚下的小村子 很美,无论地理还是气质,卢武铉回忆得也很美,说那是个“连乌鸦都会因找不到食物哭着飞走”的地方,他的话深情而充满感恩。在乌鸦身上,他用了个哭字。 想当年,他就是因找不到食物而哭着飞走的。去了大田,去了汉城,去了青瓦台。 每次出发,他都空空荡荡,除了一个贫民之子的 誓言、一个清卷书生的豪气,别无行李。 坑坑洼洼的故乡,那些含辛茹苦、蓬蓬勃勃的野草,似乎给了他最生动的精神注脚,也预支了最有力的人格担保。 怎么看,此人的变节风险都是最小的。他有着淳朴的起点和奋斗史。 坎坷身世、卑微学历、民权斗士、草根总统……卢武铉像一个童话。 全世界,包括我这个外国人都对这个童话喜爱不已,也觉得和自己隐隐有关。 这世界需要童话,需要一次童话的胜利,就像需要一场雪。 最近一场雪是奥巴马带来的,他的肤色照亮了星条旗,也鼓舞了地球仪。只是他离得远了点,不如卢武铉这般近,像亲戚。 有时,我觉得卢武铉酷似中国史 书上的那些前辈,很儒家,很士林。你看他说过的—— 大选获胜后,他用噙泪的语调承诺:“我知道大家对我的期望是什么,那是一个没有腐败、没有特权、没有违规的社会,一个用自己双手生活的诚实的社会。” 面对反腐的重重险碍,他说:“没有一个农民,会因土地贫瘠而放弃劳作。” 住青瓦台后,他与友人私下谈心,称执政关键有三:一将改革进行到底,二让总统府远离金钱,三管好自己亲属。 凡此种种,都让我想起先人那句话:“富贵不能淫,贫贱不能移,威武不能屈。” 做好这几条,孟子说,你就是大丈夫了。其实,也就是最好的公仆。 还有啊,论面相,卢武铉的 东方脸孔上有一种让人特放心的东西,温绵、敦厚、亲蔼,处处散发着安全感,完全符合中国人推崇的“方正”。 然而,童话终究是童话。事实明,贫穷和廉洁并无直接关系,监督权力和坐拥权力是截然不同的两份差事。 当他和故乡不再为食物发愁的时候,其家人被怀疑偷拿了别人的东西。 终于,一名英勇的律师站在了审判席上,一位历史的原告变成了现实的被告。某种意义上,卢武铉成了自己信仰的敌人。至少客观上,他互换了位置。 二 为什么会这样,怎么会这样呢? 对此我不感兴趣,我只留意到了那天,他最后一次攀登。 他选择了故乡的崖。崖,本身就意味着高度,是 尊严的象征,是清高者的去处。 可以想象,这曾是他少年立志和理想出发的地方。 清晨的草木,带露水,很干净。 一个人在做自由落体前,心真的会安宁吗? 世间很美,他远远看见山脚下活动的人影。同胞的生活又开始了,接下来,将是忙碌而幸福的一天。 对他来说,今天只意味着一个早 晨。 这一天,卢武铉将成为全世界的新闻头条。他料到了,但他已从看客中划掉了自己。 这是个脸皮薄的男人。性情如铅笔,直、细、脆,又爱哭鼻子。有人说,流泪是孱弱的表现,他不具职业政治家应有的坚韧。何谓坚韧呢?我不太懂。稍后,似乎也懂了,就是脸皮厚实且富弹性吧。 不错, 论政治体格,此人是弱了点,可谓弱不禁风。和城府深沉、世故圆滑的同行相比,他似乎太嫩,像书生,不像政客,甚至还有孩子的茸毛。 “我已丧失了再讲民主、进步与正义的资格……各位不能和我一起陷入这个泥淖,请大家舍弃我卢武铉吧。” 他没有狡辩,他说他无颜家乡父老,无颜全 体国民。其歉意之巨大,甚至连肇事的家人,他都表示了歉意。他觉得是自己,让最爱的人不幸沾染了权力,是自己的事业把亲属带到了危险地带。 非得纵身一跳?别无选择吗? 世间那么多毁容者,不都活得好好的? 这大概和一个人的精神体质有关。该体质决定了一个人的生命意义和存在依 据,决定了他遇事妥协的程度、忍受之底限。比如逆境之下的抉择,“好死不如赖活着”是一种,“留得青山在”是一种,“宁玉碎不瓦全”是一种,“万念俱灰唯死一途”是一种…… 卢武铉属哪种呢?我说不太清。 但有一点能确认:他死于面子,死于廉耻和羞愧,死于精神毁容后的照镜子。 “我现在没有脸正对你们的眼睛……我现在完全可以被抛弃了,现在我完全不足代表任何道德进步。” 这是个爱照镜子的政治家,是一个道德自尊心极强、自珍甚至自恋的人。他并非死于惊恐和畏惧,而是死于意境的破灭,死于内心的狂风,死于肖像的被毁,死于一个理想主义者和完美主义者 的失败感。还有,就是对清静、安宁和独处的渴望。 这种死因,包括死法,确不像现代政客所为。对许许多多政客来说,精神毁容、身败名裂,不过是轻若稻草的一件事,审判席上,磕头捣蒜乞饶求生者多如蝼蚁,贪生即怕死。但于一个自我器重惯了、把尊严和仪容视若性命之人,这事故就如 泰山压顶,漆黑一片。 所以,当有人说他死于一根道德稻草时,我不同意,我说他死于泰山。 不是说他死得重于泰山。 三 这种死因,多少让我想起了古人,想起了士林之风。我觉得精神气质上,卢武铉很有点前辈风度,像从竹林里走出来的,士大夫的腰板,昂首挺胸,纤尘不染。 古人是把 “知耻”当头等大事的,礼义廉耻被看作国之四维。 “无羞恶之心,非人也”“羞耻之心,义之端也”“五刑不如一耻”“士皆知有耻,则国家无耻矣”。 如果说古代士子是吃“素”的,一日三省谋求肺腑洁净,衣冠楚楚力图众口皆碑;那现代政客则少然,他们更崇尚丛林法则和蔽人耳目, 内心多“荤腥”之物。逻辑和尺度变了,精神体质也就变了,政治品格也就变了。丑事当前,拼命遮挡;铁如山,又死乞白赖。 古人惜名,今人惜命。古人自责,今人诿责。 谁脸上没个疮?在今人看来,卢武铉在道德反应上显然过度了,但古时候,这绝对算一个正常的“均值”,算一个合理 的脸皮厚度。 由此我涌生敬意。我向一个人的死因致敬。向他骨子里的那份“古意”致敬。 古意,让生命葱茏如竹。 我还想起了另一位自杀者,一个小得不能再小的小人物。三年前,南方一家小煤矿爆出档新闻,纸媒标题是,《倔犟矿工打赌嫖娼后服毒自杀“谢罪”》。事情大致如此:端午 节,矿上发了点酒,歇工后,矿友们围一起打牙祭,不能喝酒的张某很快有了醉意,后和人打起了赌,对方说如果你敢去“耍小姐”
