无机非材基作业第三章
(人教版)选修2课时作业:第3单元-课题1《无机非金属材料》(含答案)

1.(双选)世界著名的科技史学家、英国剑桥大学的李约瑟博士考证说:“中国至少在距今3 000年以前,就已经使用玻璃了”。
下列关于玻璃的叙述中,正确的是( )A.玻璃是人类最早使用的硅酸盐材料B.玻璃在加热熔化时有固定的熔点C.制普通玻璃的原料主要是纯碱、石灰石和石英D.普通玻璃的成分主要是硅酸钠、硅酸钙和二氧化硅【解析】陶瓷是人类最早使用的硅酸盐材料;玻璃是混合物,无固定的熔点。
【答案】CD2.传统硅酸盐材料与新型无机非金属材料的共同特性是( )A.耐高温B.具有电学特性C.具有光学特性D.具有生物功能【解析】由两者的性能可知,传统无机非金属材料和新型无机非金属材料均具有耐高温的性能。
【答案】 A3.陶瓷已广泛应用于生活和生产中,下列不属于陶瓷制品的是( )A.电器中的绝缘瓷管B.实验室中的坩埚C.实验室中的试管D.建筑上烧制的砖瓦【解析】实验室中的试管是由玻璃制成的,不属于陶瓷。
【答案】 C4.下列物质中属于纯净物的是( )A.Na2CO3·10H2O B.水泥C.纯净的盐酸D.普通玻璃【解析】水泥、盐酸、普通玻璃均为混合物。
【答案】 A5.(2018·亳州高二检测)我国及美国、日本等国家都已研制出一种陶瓷柴油机,这种柴油机的发动机部件的受热面用一种耐高温且不易传热的材料来制造,这种材料是( )A.氧化铝陶瓷B.氮化硅陶瓷C.光导纤维D.玻璃钢【解析】Si3N4陶瓷强度大、硬度高、耐磨、不与除氢氟酸外的酸反应。
【答案】 B6.下列说法中,正确的是( )A.传统的无机非金属材料具有抗腐蚀性、耐高温等许多优点,但也有质脆、经不起热冲击的缺点B.新型无机非金属材料继承了传统非金属材料的优点,但不能耐高温C.有些新型无机非金属材料可以作绝缘体,但都不能做半导体D.新型无机非金属材料都能透过可见光【解析】新型无机非金属材料有的可以耐高温;用金刚石可以制作半导体材料;并不是所有的无机非金属材料都可透光。
无机非金属材料科学基础习题

1.1 名词解释:等同点、结点、空间点阵、晶体、对称、对称型、晶系、晶类、布拉菲格子、晶胞、晶胞参数、晶体定向、晶面指数、晶向指数、晶带轴定律1.2 略述从一个晶体结构中抽取点阵的意义和方法?空间点阵与晶体结构有何对应关系?1.3 什么叫对称性?晶体的对称性有何特点,为什么?1.4 晶体中有哪些对称要素,用国际符号表示。
1.5 试找出正四面体、正八面体和立方体中的所有对称元素,并确定其所属点群、晶系。
1.6 根据什么将14种布拉维点阵分成七个晶系?各晶系特点如何?为什么14种布拉维点阵中有正交底心而无四方底心和立方底心点阵型式?以图说明。
说明七个晶系的对称特点及晶体几何常数的关系。
1.7 什么叫单位平行六面体(或单位)?在三维点阵中选取单位平行六面体应遵循哪些原则?为什么?1.8 a≠b≠c, α=β=γ=90℃的晶体属于什么晶系?a≠b≠c, α≠β≠γ≠90°的晶体属什么晶系?能否据此确定这二种晶体的布拉维点阵?1.9 一个四方晶系晶体的晶面,其上的截距分别为3a、4 a,6c,求该晶面的晶面指数。
1.10 四方晶系晶体a=b,c=1/2a。
一晶面在X、Y、Z轴上的截距分别为2a, 3b和6c。
给出该晶面的密勒指数。
1.11 某一晶面在x、y、z三个坐标轴上的截距分别为1a,∞b,3c,求该晶面符号。
1.12 在正交简单点阵、底心点阵、体心点阵、面心点阵中分别标出(110)、(011)、(101)三组晶面,并指出每个晶面上的结点数。
1.13 在立方晶系中画出下列晶面:a)(001);b)(110);c)(111)。
在所画的晶面上分别标明下列晶向:a)[210];b)[111];c)[101]。
1.14 试说明在等轴晶系中,(111)、(111)、(222)、(110)与(111)面之间的几何关系。
1.15 在立方晶系晶胞中画出下列晶面指数和晶向指数:(001)与[210],(111)与[112],(110)与[111],(322)与[236],(257)与[111],(123)与[121],(102),(112),(213),[110],[111],[120],[ 321]。
材基第三章习题及答案

第三章 作业与习题的解答一、作业:2、纯铁的空位形成能为105 kJ/mol 。
将纯铁加热到850℃后激冷至室温(20℃),假设高温下的空位能全部保留,试求过饱和空位浓度与室温平衡空位浓度的比值。
(e 31.8=6.8X1013)6、如图2-56,某晶体的滑移面上有一柏氏矢量为b 的位错环,并受到一均匀切应力τ。
(1)分析该位错环各段位错的结构类型。
(2)求各段位错线所受的力的大小及方向。
(3)在τ的作用下,该位错环将如何运动?(4)在τ的作用下,若使此位错环在晶体中稳定不动,其最小半径应为多大?解:(2)位错线受力方向如图,位于位错线所在平面,且于位错垂直。
(3)右手法则(P95):(注意:大拇指向下,P90图3.8中位错环ABCD 的箭头应是向内,即是位错环压缩)向外扩展(环扩大)。
如果上下分切应力方向转动180度,则位错环压缩。
A B CDττ(4) P103-104: 2sin 2d ϑτdT s b =θRd s =d ; 2/sin 2θϑd d= ∴ τττkGb b kGb b T R ===2 注:k 取0.5时,为P104中式3.19得出的结果。
7、在面心立方晶体中,把两个平行且同号的单位螺型位错从相距100nm 推进到3nm 时需要用多少功(已知晶体点阵常数a=0.3nm,G=7﹡1010Pa )? (3100210032ln 22ππGb dr w r Gb ==⎰; 1.8X10-9J )8、在简单立方晶体的(100)面上有一个b=a[001]的螺位错。
如果它(a)被(001)面上b=a[010]的刃位错交割。
(b)被(001)面上b=a[100]的螺位错交割,试问在这两种情形下每个位错上会形成割阶还是弯折?((a ):见P98图3.21, NN ′在(100)面内,为扭折,刃型位错;(b)图3.22,NN ′垂直(100)面,为割阶,刃型位错)9、一个]101[2-=a b 的螺位错在(111)面上运动。
无机非金属材料科学基础课后习题及答案

第二章答案2-1略。
2-2(1)一晶面在x、y、z轴上的截距分别为2a、3b、6c,求该晶面的晶面指数;(2)一晶面在x、y、z轴上的截距分别为a/3、b/2、c,求出该晶面的晶面指数。
答:(1)h:k:l==3:2:1,∴该晶面的晶面指数为(321);(2)h:k:l=3:2:1,∴该晶面的晶面指数为(321)。
2-3在立方晶系晶胞中画出下列晶面指数和晶向指数:(001)与[],(111)与[],()与[111],()与[236],(257)与[],(123)与[],(102),(),(),[110],[],[]答:2-4定性描述晶体结构的参量有哪些?定量描述晶体结构的参量又有哪些?答:定性:对称轴、对称中心、晶系、点阵。
定量:晶胞参数。
2-5依据结合力的本质不同,晶体中的键合作用分为哪几类?其特点是什么?答:晶体中的键合作用可分为离子键、共价键、金属键、范德华键和氢键。
离子键的特点是没有方向性和饱和性,结合力很大。
共价键的特点是具有方向性和饱和性,结合力也很大。
金属键是没有方向性和饱和性的的共价键,结合力是离子间的静电库仑力。
范德华键是通过分子力而产生的键合,分子力很弱。
氢键是两个电负性较大的原子相结合形成的键,具有饱和性。
2-6等径球最紧密堆积的空隙有哪两种?一个球的周围有多少个四面体空隙、多少个八面体空隙?答:等径球最紧密堆积有六方和面心立方紧密堆积两种,一个球的周围有8个四面体空隙、6个八面体空隙。
2-7n个等径球作最紧密堆积时可形成多少个四面体空隙、多少个八面体空隙?不等径球是如何进行堆积的?答:n个等径球作最紧密堆积时可形成n个八面体空隙、2n个四面体空隙。
不等径球体进行紧密堆积时,可以看成由大球按等径球体紧密堆积后,小球按其大小分别填充到其空隙中,稍大的小球填充八面体空隙,稍小的小球填充四面体空隙,形成不等径球体紧密堆积。
2-8写出面心立方格子的单位平行六面体上所有结点的坐标。
答:面心立方格子的单位平行六面体上所有结点为:(000)、(001)(100)(101)(110)(010)(011)(111)(0)(0)(0)(1)(1)(1)。
无机非金属材料工学课件 第三章

c. 加压装置
采用液压自动或手动控制系统来施加及控制其对物 料的作用力.可以根据物料易磨性的变化而自动地调整压力, 因而使磨机经常保持在最经济条件下运行,这样,既可以减 少无用功的消耗,又能使辊套村板的寿命得到延长.同时,由 于蓄能器的缓冲作用,使液压缸施加压力具有较大的弹性, 又可自动调节,当遇到大而坚硬的杂物时,磨辊可以跳起,从 而避免粉磨部件及传动装置因承受过大荷载而损坏.
3、破碎比—原料和破碎产品的粒度之比,d原料/d产品。
平均破碎比—原料前后物料的平均粒径比,d进/d出。 公称破碎比—破碎机最大进口宽度与最大出料口宽度之比,D进/D出。 总破碎比—物料初始粒度与终产品粒度之比,d初/d终。 破碎级数:一级、二级、多级,各级破碎设备破碎比的连乘积。
I0=
如:100
d越接近a,P越小,筛面倾斜,有效a↓,P↓ (0.7-1.1)a的颗粒为难筛料。
另外,影响因素还有: 物料水分; 筛孔形状; 加料均匀性; 料层厚度 。
d. 限位装置
立式磨独特的限位装置可以使磨机轻载启动,磨辊和磨盘之 间的间隙可调,这样既能保持稳定的料层厚度,提高粉磨效 率,又能保证在断料等不正常情况下磨辊和磨盘不直接触、 避免磨机震动,对 减速机起到保护作用
e. 分离装置
分离器设计为机械传动,转速可调的动态分离器,该分离器 通过锥形高速回转,叶片与粗颗粒撞击,给物料以交较大的 圆周速度,产身的离心力,使其进行分离,细颗粒可通过分 离器叶片之间间隙出磨,由收尘器进行收集.该分离器分级 效率高,调节 余地大.
工作原理:物料在动、定颚板之间受挤压、劈裂、折断的作用
分类:简摆、复摆、综合摆动
规格表示,如: PEF
900
× 1200
复摆式 给料口宽(mm) 给料口长(mm)
无机非金属材料工艺-习题作业-3-1习题答案

一、名词解释阿利特:在硅酸盐水泥熟料中固溶了其它少量氧化物的C3S称为阿利特(Alite),又称为A矿。
贝利特:C2S固溶体称为贝利特(Belite),又称为B矿。
游离氧化钙:当配料不当,生料过粗或燃烧不良时,熟料中就会出现没有被吸收的以游离状态存在的氧化钙,称为游离氧化钙,又称游离石灰石灰饱和系数KH:是熟料中全部氧化硅生成硅酸钙(C3S十C2S)所需的氧化钙量与全部二氧化硅理论上全部生成硅酸三钙所需的氧化钙含量的比值。
(即KH表熟料中二氧化硅被氧化钙饱和形成硅酸三钙的程度。
)硅率SM:是表示熟料中氧化硅含量与氧化铝、氧化铁之和的质量比。
(表示了熟料中硅酸盐矿物与熔剂矿物的比例)铝率 IM:表示熟料中氧化铝与氧化铁含量的质量比,也表示熟料熔剂矿物中铝酸三钙与铁铝酸四钙的比例。
二、问答题1、试述硅酸盐水泥熟料的矿物组成及各矿物的性质。
答:硅酸盐水泥熟料主要含以下四种矿物:硅酸三钙C3S、硅酸二钙C2S、铝酸三钙C3A、和铁铝酸四钙C4AF。
硅酸三钙(C3S)主要由硅酸二钙和氧化钙反应生成。
纯C3S只在2065~1250℃温度范围内稳定,在2065℃以上不一致熔融为CaO与液相,在1250℃以下分解为C2S和CaO。
实际上C3S的分解反应进行得比较缓慢,致使纯C3S在室温下可以呈介稳状态存在。
硅酸硅酸二钙由氧化钙与氧化硅反应生成。
纯硅酸二钙在1450℃温度以下,进行下列多晶转变在室温下硅酸二钙有水硬性的α、α΄L、α΄H、β变型都是不稳定的,有转变为水硬性微弱的γ型的趋势。
当温度低于500℃时,硅酸二钙由β型转变为γ型,体积膨胀10%而导致物料粉化。
硅酸二钙可固溶其它少量氧化物——氧化铝、氧化铁、氧化镁、氧化钾、氧化钛、氧化磷等,使硅酸二钙也形成固溶体。
纯铝酸三钙属等轴晶系。
铝酸三钙中也可固溶部分其他氧化物——SiO2、Fe2O3、MgO、K2O、Na2O 、TiO2等。
铝酸三钙有立方、斜方、四方、假四方以及单斜等五种多晶形态。
无机材料科学基础三章讲解

R=3
R↑, 低聚物浓度 ↑
[SiO4] (%)
2
R=2.3 0
87 65 4 321
负离子含[SiO4]数
[SiO4]四面体在各种聚合物中的分布 与R的关系
6. 聚合物理论总结
1)聚合物的形成阶段: 初期:主要是石英颗粒的分化; 中期:缩聚反应并伴随聚合物的变形; 后期:在一定温度(高温)和一定时间(足够长)下 达到聚合 解聚平衡。
2) 最终熔体组成:
聚合程度不同的各种聚合体的混合物,包括低 聚物、高聚物、 三维碎片、游离碱、吸附物。
3.1.1.2 过冷熔体——玻璃的结构
为了表示玻璃和较低温度下熔体的网络结构 特征,引入四个基本参数:
X= 每个多面体中平均非桥氧 (百分数)
Y= 每个多面体中平均桥氧数(百分数)
Z = 每个多面体中氧离子平均总数(一般硅酸盐和磷 酸盐玻璃中为4,硼酸盐玻璃中为3)
100
Si
η(P)
80
60
Mg
Zn
40
Ni Ca Mn
Cu
Ca Sr
Ba
Cd
Pb
20
0
0.50
1.00
1.50
二价阳离子对硅酸盐熔体粘度的影响
(f) 混合碱效应
熔体中同时引入一种以上的R2O或 RO时,粘度比等量的一 种R2O或RO高,称为“混合碱效应”,这可能和离子的半径、配 位等结晶化学条件不同而相互制约有关。
外,在网络中还对→Si-O-Si←键有反极化作用,减弱了上 述键力。Li+离子半径最小,电场强度最强,反极化作用最大,
故它降低粘度的作用最大。
2)当熔体中R2O含量较高时,熔体中硅氧负离子团接近最简单的 [SiO4]形式,同时熔体中有大量O2-存在,[SiO4]四面体之间主 要依靠R-O键力连接,这时作用力矩最大的Li+就具有较大的粘 度。在这种情况下,R2O对粘度影响的次序是Li+<Na+<K+ 。
材基第三章习题集及标准答案

第三章 作业与习题的解答一、作业:2、纯铁的空位形成能为105 kJ/mol 。
将纯铁加热到850℃后激冷至室温(20℃),假设高温下的空位能全部保留,试求过饱和空位浓度与室温平衡空位浓度的比值。
(e 31.8=6.8X1013)6、如图2-56,某晶体的滑移面上有一柏氏矢量为b 的位错环,并受到一均匀切应力τ。
(1)分析该位错环各段位错的结构类型。
(2)求各段位错线所受的力的大小及方向。
(3)在τ的作用下,该位错环将如何运动?(4)在τ的作用下,若使此位错环在晶体中稳定不动,其最小半径应为多大?解:(2)位错线受力方向如图,位于位错线所在平面,且于位错垂直。
(3)右手法则(P95):(注意:大拇指向下,P90图3.8中位错环ABCD 的箭头应是向内,即是位错环压缩)向外扩展(环扩大)。
如果上下分切应力方向转动180度,则位错环压缩。
A B CDττ(4) P103-104: 2sin 2d ϑτdT s b =θRd s =d ; 2/sin 2θϑd d= ∴ τττkGb b kGb b T R ===2 注:k 取0.5时,为P104中式3.19得出的结果。
7、在面心立方晶体中,把两个平行且同号的单位螺型位错从相距100nm 推进到3nm 时需要用多少功(已知晶体点阵常数a=0.3nm,G=7﹡1010Pa )? (3100210032ln 22ππGb dr w r Gb ==⎰; 1.8X10-9J )8、在简单立方晶体的(100)面上有一个b=a[001]的螺位错。
如果它(a)被(001)面上b=a[010]的刃位错交割。
(b)被(001)面上b=a[100]的螺位错交割,试问在这两种情形下每个位错上会形成割阶还是弯折?((a ):见P98图3.21, NN ′在(100)面内,为扭折,刃型位错;(b)图3.22,NN ′垂直(100)面,为割阶,刃型位错)9、一个]101[2-=a b 的螺位错在(111)面上运动。
无机非材基作业第三章

3.3试解释:(1)MgAl2O4晶体结构中,按r+/r-与CN关系,Mg2+、Al3+都填充八面体空隙,但在该结构中Mg2+进入四面体空隙,Al3+填充八面体空隙;而在MgFe2O4结构中,Mg2+填充八面体空隙,而一半Fe3+填充四面体空隙。
(2)绿宝石和透辉石中Si:O都为1:3,前者为环状结构,后者为链状结构。
答:(1)按照阳、阴离子半径比与配位数之间的关系,Al3+与Mg2+的配位数均应该为6,填入八面体空隙。
但是,根据鲍林规则,高电价离子填充于低配位的四面体空隙时,排斥力要比填充八面体空隙中较大,稳定性较差,所以Al3+填入八面体空隙,而Mg2+填入四面体空隙。
而在MgFe2O4结构中,由于Fe3+的八面体择位能为0,可以进入四面体或八面体空隙,当配位数为4时,Fe3+离子半径0.049nm,Mg2+离子半径0.057nm,Fe3+在四面体空隙中更加稳定,所以Mg2+填充八面体空隙、一半Fe3+填充四面体空隙。
(2)绿宝石和透辉石中Si:O都为1:3。
但是,绿宝石中的其它阳离子Be2+和Al3+的离子半径较小,配位数较小(4或6),相互间斥力较大,所以绿宝石通过[SiO4]顶角相连形成六节环,再通过Be2+和Al3+将六节环连接起来,离子堆积结合状态不太紧密,这样晶体结构较稳定。
透辉石中是Mg2+和Ca2+,离子半径较大,配位数较大(分别为6和8),相互间斥力较小,所以透辉石通过[SiO4]顶角相连形成单链,离子堆积结合状态比较紧密。
3.4CaF2的晶胞参数为0.547nm。
(1)根据CaF2晶胞立体图画出CaF2晶胞在(001)面上的投影图;(2)画出CaF2(110)面上的离子排列简图;(3)正负离子半径之和为多少?答:(1)(2)(3)3.7尖晶石与反尖晶石区别是什么?为什么在反尖晶石结构中许多过渡金属离子填充规律并不完全按离子半径比?答:二价阳离子A填充于四面体间隙,三甲阳离子B填充于八面体间隙的叫正尖晶石。
南昌大学无机材料工程基础第三、五、六章的答案

2 3.14 k 400 50 163 50 ln 50
查表可得对应玻璃面毡的导热系数k 0.058 J / m k,所以Q 59.3mm
2 3.14 0.058 350 163 50 ln 50
r = r1时 t = t1 r = r2时 t = t2
t = t1 +
t2 - t1 ln(r / r1 ) ln(r2 / r1 )
q= - k
¶ t k t1 - t2 = ¶ r r ln(r2 / r1 )
Q = 2p rlq =
2p kl (t1 - t2 ) ln(r2 / r1 )
h D 2 L DL h V A 4 hD 解: 1. 判断是否可用集总参数法,由已知条件得,Bi k k 4k
因h 550 w /(m 2 k ),k 25 w /(m k ),D 1mm, 所以: hD 550 110 3 Bi 0.0055 0.1M 0.05 (无限长圆柱 M 0.5) 4k 4 25 Q 所以,由集总参数的定义式可对金属丝列热平衡方程式: e dV dt t cv
导线温度与稳定值相差 C时其数值为T 107 .38C 1
T 由于: - T 83.38 83.38 exp( 0.55t ) 107.38 - 25 83.38 83.38 exp( 0.55t )
可求得时间t 8.04 S
12
毕渥数-Bi
50 25 9.5
B 0.055
A 2 B 0.11
10
38
直径为 1mm 的金属丝置于温度为25C的恒温槽中,其电阻值为0.01/m。
材基第三章习题和答案解析
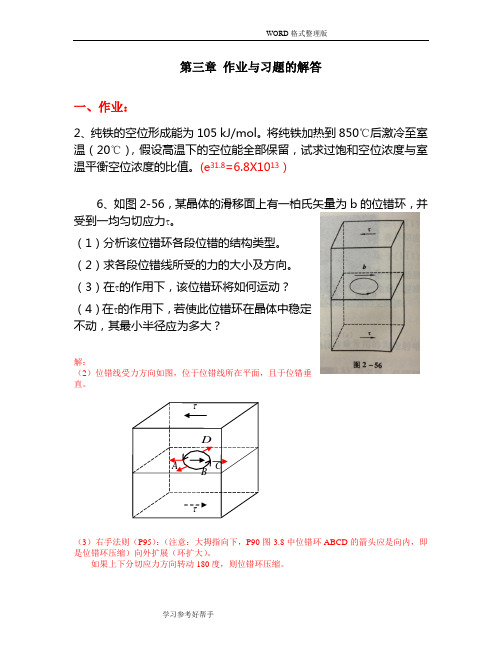
第三章 作业与习题的解答一、作业:2、纯铁的空位形成能为105 kJ/mol 。
将纯铁加热到850℃后激冷至室温(20℃),假设高温下的空位能全部保留,试求过饱和空位浓度与室温平衡空位浓度的比值。
(e 31.8=6.8X1013)6、如图2-56,某晶体的滑移面上有一柏氏矢量为b 的位错环,并受到一均匀切应力τ。
(1)分析该位错环各段位错的结构类型。
(2)求各段位错线所受的力的大小及方向。
(3)在τ的作用下,该位错环将如何运动?(4)在τ的作用下,若使此位错环在晶体中稳定不动,其最小半径应为多大?解:(2)位错线受力方向如图,位于位错线所在平面,且于位错垂直。
(3)右手法则(P95):(注意:大拇指向下,P90图3.8中位错环ABCD 的箭头应是向内,即是位错环压缩)向外扩展(环扩大)。
如果上下分切应力方向转动180度,则位错环压缩。
(4) P103-104: 2sin 2d ϑτdT s b =θRd s =d ; 2/sin 2θϑd d= ∴ τττkGb b kGb b T R ===2 注:k 取0.5时,为P104中式3.19得出的结果。
7、在面心立方晶体中,把两个平行且同号的单位螺型位错从相距100nm 推进到3nm 时需要用多少功(已知晶体点阵常数a=0.3nm,G=7﹡1010Pa )? (3100210032ln 22ππGb dr w r Gb ==⎰; 1.8X10-9J )8、在简单立方晶体的(100)面上有一个b=a[001]的螺位错。
如果它(a)被(001)面上b=a[010]的刃位错交割。
(b)被(001)面上b=a[100]的螺位错交割,试问在这两种情形下每个位错上会形成割阶还是弯折?((a ):见P98图3.21, NN ′在(100)面内,为扭折,刃型位错;(b)图3.22,NN ′垂直(100)面,为割阶,刃型位错)9、一个]101[2-=a b 的螺位错在(111)面上运动。
无机非金属材料工艺-习题作业-3-2习题答案

一、名词解释玻璃形成体:玻璃形成体——能单独形成玻璃,在玻璃中能形成个子特有的网络体系的氧化物,成为玻璃的网络形成体,如SiO2、B2O3和P2O5等。
玻璃调整体: 凡不能单独生成玻璃,一般不进入网络而是处于网络之外的氧化物,称为玻璃的网络外体。
它们往往起调整玻璃一些性质的作用。
常见的有Li2O,Na2O,K2O,MgO,CaO,SrO,BaO等。
玻璃中间体: 一般不能单独形成玻璃,其作用介于网络形成体和网络外体之间的氧化物,称之为中间体,如A12O3,BeO,ZnO,Ga2O3,TiO2、PbO等。
二、问答题1、玻璃原料选择的一般原则?答:1)原料的质量,必须符合要求,而且成分稳定2)易于加工处理3)成本低,能大量供应4)少用过轻相对人体健康有害的原料5)对耐火材料的侵蚀要小2、设计玻璃组成应注意的原则?答:1)根据组成,结构和性质的关系,使设计的玻璃能满足预定的性能要求;2)根据玻璃形成图和相图,使设计的组成能够形成玻璃,析晶倾向小;3)根据生产条件使设计的玻璃能适应熔制、成形、加工等工序的实际要求;4)所设计的玻璃应当价格低廉,原料易于获得.3、试述晶子学说与无规则网络学说的异同点。
答:无规则网络学说:认为按照原子在晶体和玻璃中的作用,形成连续的三维空间网络结构,其结构单元(四面体或三面体)是相同的,但玻璃网络不如晶体网络,晶体网络是有规则、周期性重复排列;玻璃网络是不规则、非周期性的,因而它的内能大于晶体,同时带来了玻璃的各向同性和连续性。
晶子学说:硅酸盐玻璃是有无数“晶子”组成,“晶子”的化学性质取决于玻璃的化学组成,所谓“晶子”不同于一般微晶,而是带有晶格变形的有序区域,在晶子中心质点排列较有规律,愈远离中心则变形程度愈大,“晶子”分散在无定形介质中,从“晶子”部分的过渡是逐步完成的,两者间无明显界限。
相同点:(1)最小的结构单元是[SiO4]四面体;(2)玻璃具有近程有序、远程无序的结构特点;不同点:两种学说强调的内容不同。
无机材料物理化学课后习题及答案

第一章几何结晶学基础1-1. 晶体、晶胞的定义;空间格子构造的特点;晶体的基本性质。
1-2. 参网页上的模型,运用对称要素组合定律,写出四方柱、六方柱、四方四面体、斜方双锥、六八面体、三方柱、复三方三角面体、四六面体的点群符号,并写出其所属的晶系和晶族。
1-3. 参阅网页上的模型,请确定单型中的六八面体、复三方偏三角面体、复六方双锥、和聚型中2、3、4号模型在晶体定向中,各晶体的晶轴分别与哪些对称轴重或晶棱方向平行?1-4. 请写出单型三方柱、四方柱、四方双锥、六方柱、菱面体、斜方双锥各晶面的主要晶面符号。
1-5. 请写出下列聚型模型各晶面的晶面符号:1、2、3、4。
两个对称面相互成1)60°、2)90°、3)45°、4)30°,可组合成什么点群?1-6. 由两根相交的二次轴互成1)90°、2)60°、3)45°、4)30°,可以组合成什么点群?试在面心立方格子中画出菱面体格子1-7. 一晶面在X、Y、Z轴分别截得2、4、6个轴单位,请写出此晶面符号。
1-8. 作图表示立方晶体的(123)、(012)、(421)晶面。
1-9. 在六方晶体中标出晶面(0001)、(2110)、(1010)、(1120)、(1210)的位置。
1. 答:晶体最本质的特点是其内部的原子、离子、或原子集团在三维空间以一定周期性重复排列而成 , 晶体的空间格子构造有如下特点:结点空间格子中的点,在实际晶体中它们可以代表同种质点占有的位置,因此也称为晶体结构中的等同点位置。
行列结点在一维方向上的排列 . 空间格子中任意两个结点连接的方向就是一个行列方向。
面网结点在平面上的分布构成面网。
空间格子中,不在同一行列上的任意三个结点就可联成一个面网。
平行六面体空间格子中的最小单位。
它由六个两两平行且大小相等的面组成。
晶体的基本性质是指一切晶体所共有的性质,这些性质完全来源于晶体的空间格子构造。
无机材料科学基础11章-14章三章习题及答案

第十一章 扩 散11-1 名词解释(试比较其同)1.无序扩散:原子或离子的无规则扩散迁移运动发生在结构无序的非晶态材料中,称为无序扩散。
晶格扩散:原子或离子在晶体结构中不断地改变位置而出现由一处向另一处的无规则迁移运动,称为晶格扩散。
2.本征扩散:不含有任何杂质的物质中由于热起伏引起的扩散。
非本征扩散:由于杂质引入引起的扩散。
3.自扩散:一种原子或离子通过由该种原子或离子所构成的晶体中的扩散。
互扩散:两种或两种以上的原子或离子同时参与的扩散。
4.稳定扩散:是指扩散物质的浓度分布不随时间变化的扩散过程,使用菲克第一定律可解决稳定扩散问题。
不稳定扩散:是指扩散物质浓度分布随时间变化的一类扩散,这类问题的解决应借助于菲克第二定律。
11-2 欲使Mg 2+在MgO 中的扩散直至MgO 的熔点(2825℃)都是非本征扩散,要求三价杂质离子有什么样的浓度?试对你在计算中所作的各种特性值的估计作充分说明。
(已知MgO 肖特基缺陷形成能为6eV )Mg 2+离子在MgO 晶体中以空位机构扩散,MgO 中肖特基空位浓度: []()kT E V Mg2/exp -=''式中E 为空位生成能, E=6ev ;MgO 的熔点T m =3098k 。
故当 MgO 加温至靠近熔点(T M =3098k )时肖特基空位浓度为:[]6231910166.930001038.1210602.16exp ---⨯=⎭⎬⎫⎩⎨⎧⨯⨯⨯⨯⨯-=''Mg V 因空位扩散机构的扩散系数[]Mgm g V MgO D ''∝/ ,所以欲使+2Mg 在MgO 中的扩散直至MgO 的熔点均是非本征扩散,应使+3M离子产生的[]MgV ''远大于热缺陷空位610166.9][-⨯=''Mg V+3M 离子进入MgO 晶格,将发生下面缺陷反应:MgMg MgO V M M ''+−−→−∙22 因此,杂质离子+2M的浓度应远大于两倍的热缺陷空位浓度:[]563108332.110166.92--+⨯=⨯⨯〉〉M11-3 a) :/2CaO Ca+T=1145℃,705.01013=⨯T , =+CaO Dca /21310030.2-⨯ T=1393℃, 600.01013=⨯T, =+CaO Dca /21210920.4-⨯∴ ()()()1666314.8/exp 1092.41418314.8/exp 1003.2exp 0120130⨯-=⨯⨯-=⨯-=--Q D Q D RT Q D D解得: Q=6045kcal/mol D 0=4.21×10-4cm 2/secb) 323/O Al Al + 1393℃(1666k) 1716℃(1989k) 1923k(自取):1013⨯T0.600 0.503 0.520 D / 2.42×10-117.02×10-12解方程组:2.42×10-11=D 0exp(-Q/8.314×1989) 7.02×10-12=D 0exp(-Q/8.314×1923) 得 Q=142.6kcal/mol D 0=1.16×105cm 2/sec11-4 在二根金晶体圆棒的端点涂上示踪原子Au *,并把两棒端点连接,如图11-16(A )所示。
无机非材料课后答案

第六章6-5图6-2是具有多晶转变的某物质的相图,其中DEF线是熔体的蒸发曲线。
KE是晶型I的升华曲线;GF是晶型II的升华曲线;JG是晶型III的升华曲线,回答下列问题:(1)在图中标明各相的相区,并写出图中各无变量点的相平衡关系;(2)系统中哪种晶型为稳定相?哪种晶型为介稳相?(3)各晶型之间的转变是可逆转变还是不可逆转变?解:(1)KEC为晶型Ⅰ的相区,EFBC过冷液体的介稳区,AGFB晶型Ⅱ的介稳区,JGA晶型Ⅲ的介稳区,CED是液相区,KED是气相区;(2)晶型Ⅰ为稳定相,晶型Ⅱ、Ⅲ为介稳相;因为晶型Ⅱ、Ⅲ的蒸汽压高于晶型Ⅰ的,即它们的自由能较高,有自发转变为自由能较低的晶型Ⅰ的趋势;(3)晶型Ⅰ转变为晶型Ⅱ、Ⅲ是单向的,不可逆的,多晶转变点的温度高于两种晶型的熔点;晶型Ⅱ、Ⅲ之间的转变是可逆的,双向的,多晶转变点温度低于Ⅱ、Ⅲ的熔点。
23图6-15为生成2个一致熔融二元化合物的三元系统,据图回答下列问题:(l)可将其划分为几个副三角形?(2)标出图中各边界及相区界线上温度下降方向。
(3)判断各无变量点的性质,并写出相平衡关系式。
解:(1)三个副三角形,△AS1S2、△S1S2B、△S2CB(2)如下图所示(3)无变量点E1、E2、E3都是低共熔点,各向平衡关系式如下:△AS1S2E1△S1S2BE2△S2CBE325根据图6-17回答下列问题:(l)说明化合物S1、S2的性质;(2)在图中划分副三角形及用箭头指示出各界线的温度下降方向及性质;(3)指出各无变量点的性质并写出各点的平衡关系;(4)写出1、3组成的熔体的冷却结晶过程;(5)计算熔体1结晶结束时各相百分含量,若在第三次结晶过程开始前将其急冷却(这时液相凝固成为玻璃相),各相的百分含量又如何?(用线段表示即可);(6)加热组成2的三元混合物将于哪一点温度开始出现液相?在该温度下生成的最大液相量是多少?在什么温度下完全熔融?写出它的加热过程。
高中化学 第3单元课题1 无机非属材料课时作业同步导学2

促敦市安顿阳光实验学校第3单元课题1 (本栏目内容,在学生用书中以活页形式分册装订!)一、选择题1.下列说法中错误的是( )A.生产玻璃和水泥的原料中都含有石灰石B.生产陶瓷和玻璃的原料中都含有石英C.某些合成橡可用做生产黏合剂的主要原料D.生产水玻璃和玻璃的原料中都含有烧碱【解析】黏合剂的基本成分是黏料,常见的黏料有热固性树脂、热塑性树脂、合成橡以及混合型黏料。
水玻璃是能溶于水的硅酸盐,一般用石英和强碱做原料,例如用石英和氢氧化钠制取硅酸钠水玻璃。
生产玻璃的主要原料是石英砂、石灰石和纯碱,生成水泥的主要原料是石灰石和黏土。
【答案】D2.下列说法中,正确的是( )A.制陶的主要原料是石英砂B.制作陶器一般分为制泥、成型、干燥、烧成步骤C.制陶过程中温度越高越好,这样制得的陶器牢固D.在氧化气氛中烧制得灰陶,在还原气氛中得红陶【解析】制陶的原料是黏土,故A错误。
制陶过程中温度不能太高,太高会使陶器变形,故C错误。
在氧化气氛中,铁元素以Fe2O3的形式存在,得红陶,在还原气氛中,铁元素以FeO的形式存在,得灰陶,故D错误。
【答案】B3.根据陶瓷的生产原理,可以得出硅酸盐工业的一般特点是( )①以含硅物质作为原料②主要产物是硅酸盐③反条件是高温④反原理是复杂的物理和化学变化A.①③ B.①②③C.①②③④ D.①③④【解析】陶瓷在生产过程中使用含硅酸盐的原料,在高温条件下发生的是复杂的物理(熔化)、化学变化(硅酸盐参与的反),产品的主要成分是硅酸盐。
【答案】C4.制取下列物质,无需用到二氧化硅的是( )A.玻璃B.水泥C.粗硅D.光导纤维【解析】制造玻璃的原料是纯碱(Na2CO3)、石灰石(CaCO3)和石英砂(SiO2);制造水泥的原料为石灰石和黏土;制造粗硅的原料是SiO2;制造光导纤维的材料是SiO2。
综上所述,不用SiO2为原料的只有水泥。
【答案】B5.在下列粒子中,其形状不是正四面体的是( )A.P4B.[SiO4]4-C.CH4D.CH3Cl【解析】P4、[SiO4]4-和CH4的形状都是正四面体,CH3Cl的形状不是正四面体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.3试解释:(1)MgAl2O4晶体结构中,按r+/r-与CN关系,Mg2+、Al3+都填充八面体空隙,但在该结构中Mg2+进入四面体空隙,Al3+填充八面体空隙;而在MgFe2O4结构中,Mg2+填充八面体空隙,而一半Fe3+填充四面体空隙。
(2)绿宝石和透辉石中Si:O都为1:3,前者为环状结构,后者为链状结构。
答:(1)按照阳、阴离子半径比与配位数之间的关系,Al3+与Mg2+的配位数均应该为6,填入八面体空隙。
但是,根据鲍林规则,高电价离子填充于低配位的四面体空隙时,排斥力要比填充八面体空隙中较大,稳定性较差,所以Al3+填入八面体空隙,而Mg2+填入四面体空隙。
而在MgFe2O4结构中,由于Fe3+的八面体择位能为0,可以进入四面体或八面体空隙,当配位数为4时,Fe3+离子半径0.049nm,Mg2+离子半径0.057nm,Fe3+在四面体空隙中更加稳定,所以Mg2+填充八面体空隙、一半Fe3+填充四面体空隙。
(2)绿宝石和透辉石中Si:O都为1:3。
但是,绿宝石中的其它阳离子Be2+和Al3+的离子半径较小,配位数较小(4或6),相互间斥力较大,所以绿宝石通过[SiO4]顶角相连形成六节环,再通过Be2+和Al3+将六节环连接起来,离子堆积结合状态不太紧密,这样晶体结构较稳定。
透辉石中是Mg2+和Ca2+,离子半径较大,配位数较大(分别为6和8),相互间斥力较小,所以透辉石通过[SiO4]顶角相连形成单链,离子堆积结合状态比较紧密。
3.4CaF2的晶胞参数为0.547nm。
(1)根据CaF2晶胞立体图画出CaF2晶胞在(001)面上的投影图;(2)画出CaF2(110)面上的离子排列简图;(3)正负离子半径之和为多少?
答:(1)(2)
(3)
3.7尖晶石与反尖晶石区别是什么?为什么在反尖晶石结构中许多过渡金属离子填充规律并不完全按离子半径比?
答:二价阳离子A填充于四面体间隙,三甲阳离子B填充于八面体间隙的叫正尖晶石。
如果二价阳离子A分布在八面体间隙中,而三价阳离子一半填充于四面体间隙,另一半在八面体间隙中称为反尖晶石型。
许多过渡金属离子填充空隙的规律并不完全服从阳、阴离子半径与配位数的关系,而场是由晶体的择位能来决定的。
3.10同为碱土金属阳离子Be2+、Mg2+、Ca2+,其卤化物BeF2和SiO2结构同,MgF2与TiO2(金红石型)结构同,CaF2则有萤石型结构,分析其原因。
答:碱土金属离子Be2+、Mg2+、Ca2+,随着原子序数的增大,离子半径逐渐增大,极化性能变化不大。
当阴离子同为F-时,使得其r+/r-增大,配位数增大,由BeF2的4配位到MgF2的6配位,再到CaF2的8配位。
3.13 MgO和CaO同属NaCl型结构,而它们与水作用时则CaO要比MgO活泼,试解释之。
答:
3.16 叙述硅酸盐晶体结构分类原则及各种类型的特点,并举例说明。
答:
答案二:硅酸盐晶体主要是根据[SiO4]在结构中的排列结合方式来分类,具体可以分为五类:岛状、组群状、链状、层状和架状。
结构和组成上的特征见下表:
3.19 堇青石与绿宝石有相同结构,分析其有显著的离子电导,较小的热膨胀系数的原因。
答:堇青石Mg2Al3[AlSi5O18]具有绿宝石结构,以(3Al3++2Mg2+)置换绿宝石中的(3Be2++2Al3+)。
6个[SiO4]通过顶角相连形成六节环,沿c轴方向上下迭置的六节环内形成了一个空腔,成为离子迁移的通道,因而具有显著的离子电导;另外离子受热后,振幅增大,但由于能够向结构空隙中膨胀,所以不发生明显的体积膨胀,因而热膨胀系数较小。
3.20 在透辉石CaMg[Si2O6]晶体结构中,O2-与阳离子Ca2+、Mg2+、Si4+配位型式有哪几种,符合鲍林静电价规则吗?为什么?
答:透辉石CaMg[Si2O6],O2-与阳离子Ca2+、Mg2+、Si4+配位型式有三种,即2个桥氧和2个非桥氧形成[SiO4],6个非桥氧形成[MgO6],4个桥氧和4个非桥氧形成[CaO8]。
在教材的图3-32b中,同时与1个Si4+、2个Mg2+和1个Ca2+配位的非桥氧,其静电价强度总和为4×1/4+2×2×1/6+2×1/8=23/12,而同时与1个Si4+、1个Mg2+和1个Ca2+配位的非桥氧,其静电价强度总和为4×1/4+2×1/6+2×1/8=19/12,小于其负电价;同时与2个Si4+、2个Ca2+配位的桥氧,其静电价强度总和为4×2×1/4+2×2×1/8=5/2,大于其负电价。
所以不完全符合鲍林静电价规则。
但是其总体电价仍然平衡的,晶体结构仍然是稳定的。
原因在于Mg2+和Ca2+两种离子的离子半径不同、配位数不同、配位氧离子不同(桥氧或非桥氧)。
3.22简述(1)什么叫阳离子交换?
(2)从结构上说明高岭石、蒙脱石阳离子交换容量差异的原因。
(3)比较蒙脱石、伊利石同晶取代的不同,说明在平衡负电荷时为什么前者以
水化阳离子形式进入结构单元层,而后者以配位阳离子形式进入结构单元层。
答:(1)在粘土矿物中,如果[AlO6]层中部分Al3+被Mg2+、Fe2+代替时,一些水化阳离子(如Na+、Ca2+等)进入层间,来平衡多余的负电荷,在一定条件下这些阳离子可以被其它阳离子交换,这种现象称为阳离子交换。
(2)高岭石的阳离子交换容量较小,而蒙脱石的阳离子交换容量较大。
因为高岭石是1:1型结构,单网层与单网层之间以氢键相连,氢键强于范氏键,水化阳离子不易进入层间,因此阳离子交换容量较小。
而蒙脱石是为2:1型结构,复网层间以范氏键相连,层间联系较弱,水化阳离子容易进入复网层间以平衡多余的负电荷,因此蒙脱石的阳离子交换容量较大。
(3)蒙脱石和伊利石均为2:1型结构。
但是,蒙脱石的铝氧八面体层中大约有1/3的Al3+被Mg2+所取代,平衡电荷的水化阳离子半径大,而且水化阳离子与负电荷之间距离远,覆网层之间的结合力弱,所以进入层间位置。
伊利石的硅氧四面体层中约1/6的Si4+被Al3+所取代,K+进入复网层间以平衡多余的负电荷,K+位于上下二层硅氧层的六边形网络的中心,构成[KO12],K+与硅氧层中的负电荷距离近,结合力较强,因此以配位离子形式进入结构单元。
3.26
Mg2[SiO4]
答:。
