化学:1.1.1《氢原子光谱和玻尔的原子结构模型》课件(鲁科版选修4)
合集下载
高三物理鲁科版氢原子光谱与能级结构PPT优秀课件

THANKS
FOR WATCHING
演讲人: XXX
PPT文档·教学课件
B.巴尔末公式反映了氢原子发光的连续性
C.巴尔末依据对氢光谱的分析总结出巴尔末公式
D.巴尔末公式准确反映了氢原子所有光谱的波长,其波长
的分立值不是人为规定的
• 答案 C
课堂讲义
• 解析 巴尔末公式只确定了氢原子发光中的 一个线系波长,不能描述氢原子发出的各种 光的波长,也不能描述其他原子发出的光, 故D错误.巴尔末公式是由当时已知的可见光 中的部分谱线总结出来的,但它适用于整个 巴尔末线系,故A、B错误,C正确.
课堂讲义
• 借题发挥 巴尔末公式的应用方法及注意问 题
• (1)巴尔末公式反映氢原子发光的规律特征, 不能描述其他原子.
• (2)公式中n只能取整数,不能连续取值,因此 波长也只是分立的值.
• (3)公式是在对可见光区的四条谱线分析时总 结出的,在紫外区的谱线也适用.
• (4)应用时熟记公式,当n取不同值时求出一一 对应的波长λ.
3.巴尔末公式 (1)巴尔末对氢原子光谱的谱线进行研究得到了下面的公 式: 1λ=R(212-n12) n=3,4,5…该公式称为巴尔末公式. (2)公式中只能取n≥3的整数,不能连续取值,波长是分立 的值.
课堂讲义
4.赖曼线系和帕邢线系:氢原子光谱除了存在巴尔末线系外, 还存在其他一些线系.例如: 赖曼线系(在紫外区):1λ=R112-n12(n=2,3,4,…) 帕邢线系(在红外区):1λ=R312-n12(n=4,5,6,…)
课堂讲义
借题发挥 在计算氢原子发出的某一线系的光的波长时,需首
先明确为哪一线12-n12
,n的取值只
能为整数且大于a.
高二化学《物质结构与性质》精品课件2:1.1.1氢原子光谱和玻尔的原子结构模型

3.玻尔的原子结构模型 玻尔原子结构模型的基本观点: (1)原子中的电子在具有确定半径的_圆__周__轨道上绕_原__子__核__ 运动,并且不辐射能量。 (2)在不同轨道上运动的电子具有_不__同__的能量(E),而且能 量是_量__子__化__的。 (3)只有当电子从一个轨道(Ei)_跃__迁__到另一个轨道(Ej)才会 辐射或吸收能量。
【例】 玻尔理论不能解释
()
A.氢原子光谱为线状光谱
B.在一给定的稳定轨道上,运动的核外电子不辐射能量
C.氢原子的可见光区谱线
D在有外加磁场时氢原子光谱有多条谱线
解析 玻尔理论是针对原子的稳定存在和氢原子光谱为线
状光谱的事实提出的。有外加磁场时氢原子有多条谱线,
玻尔的原子结构模型已无法解释这一现象,必须借助量子
2.光谱和玻尔的原子结构模型 原子光谱:光(辐射)是电子释放能量的重要形式之一,不 同元素的原子发生跃迁时会吸收或释放不同的光,可以用 光谱仪摄取各种元素电子的吸收光谱或发射光谱,总称原 子光谱。 丹麦科学家玻尔在核式原子模型的基础上提出了核外电子 分层排布的原子结构模型。玻尔的原子结构模型的基本观 点是: (1)原子中的电子在具有确定半径的圆周轨道上绕原子核 运动,并且不辐射能量。
(3)卢瑟福原子模型(1911年):在原子的中心有一个带正电 荷的核,它的质量几乎等于原子的全部质量,电子在它的 周围沿着不同的轨道运转,就像行星环绕太阳运转一样。 (4)玻尔原子模型(1913年):电子在原子核外空间的一定轨 道上绕核做高速的圆周运动。 (5)电子云模型(1927年~1935年):现代物质结构学说。 现在,科学家已能利用电子显微镜和扫描隧道显微镜拍摄 表示原子图像的照片。随着现代科学技术的发展,人类对 原子的认识过程还会不断深化。
2019-2020年鲁科版选修3:1.1 原子结构模型课件(58张)

符号 4s
数目 符号 1
4
N
p 4px、4py、4pz 3
↑或↓
d
4d
5
f
4f
7
2.不同电子层中各能级之间能量大小关系 (1)不同电子层中,同一能级,电子层序数越大能量越高。 例如,1s<2s<3s……,2p<3p<4p……。 (2)同一电子层中,各能级之间的能量大小关系是s<p< d<f……例如,第四电子层中4s<4p<4d<4f。 (3)电子层和能级都相同的各原子轨道能量相等。例 如,2px=2py=2pz。
(2)2s________3d
(3)2px________2py
(4)3p________3s
提示:(1)< (2)< (3)= (4)>
2.原子轨道的图形描述
3.电子云 (1)电子运动的特点:电子质量非常小、运动速度极快, 故不能确定某一时刻原子中的电子的精确位置,只能统 计电子在原子核外空间出现的概率大小。
【易错提醒】对能级与电子层关系的认识误区 并不是每个电子层上都有s、p、d、f能级。由于电子 层数等于该电子层上的能级数目,如K层只有s能级,因 此并不是所有的电子层上都有s、p、d、f能级。
【思考·讨论】 1.当量子数为n时,能级、原子轨道数、电子总数和n有 怎样的关系? 提示:能级数=n,原子轨道数=n2,电子总数=2n2。
第1章 原 子 结 构 第1节 原子结构模型
一、氢原子光谱和玻尔的原子结构模型 1.原子结构模型的发展史
2.光谱和氢原子光谱 (1)光谱 ①含义:利用仪器将物质_吸__收__的__光__或_发__射__的__光__的波长 和强度分布记录下来的谱线。 ②形成原因:电子在不同轨道间_跃__迁__时,会辐射或吸收 能量。 (2)氢原子光谱:属于_线__状__光谱。
高二化学《物质结构与性质》精品课件3:1.1.1氢原子光谱和玻尔的原子结构模型

第一节 原子结构模型
第1课时 氢原子光谱和玻尔的原子结构模型
氢原子光谱和玻尔的原子结构模型
1.原子结构的发展历程 在道尔顿原子学说的基础上,不同时期原子结构模型先 后经历了汤姆逊的 葡萄干布丁 模型―→卢瑟福的 核式 模型 ―→玻尔的 核外电子分层排布 的原子结构模型―→ 量子力学 模型。
2.氢原子光谱 光谱分为连续 光谱和 线状 光谱,氢原子光谱是 线状
特点
C.玻尔理论不但成功地解释了氢原子光谱,而且还推
广到其他原子光谱
D.原子中电子在具有确定半径的圆周轨道上像火车一
样高速运转着
[解析] A项,氢光谱是元素的所有光谱中最简单的光 谱;C项,玻尔理论成功地解释了氢原子光谱,但对多 电子原子的光谱解释却遇到了困难;D项,原子中电子 运动没有确定半径的原子轨道,原子轨道是电子运动出 现的“区域”。 [答案] B
典例剖析
氢原子光谱和玻尔原子结构模型
[例 1] 玻尔理论不.能解释 A.氢原子光谱为线状光谱
()
B.在一给定的稳定轨道上,运动的核外电子不辐射
能量
C.氢原子的可见光区谱线
D.在有外加磁场时氢原子光谱增加多条谱线
[解析] 玻尔理论是针对原子的稳定存在和氢原子光 谱为线状光谱的事实提出的,有外加磁场时氢原子光谱增 加多条谱线,玻尔的原子结构模型已无法解释这一现象, 必须借助于量子力学加以解释。
[答案] D
归纳总结 原子结构理论的发展是不断深入的,各个时期 的原子结构模型都是为了解释当时出现的某一现实问题 或实验现象而提出的。随后可能又会碰到不能解释的问 题,这些问题的出现又会推动原理论的改进或新理论的 创建。
[例2] 下列说法正确的是
()
A.氢光谱是元素的所有光谱中最简单的光谱之一
第1课时 氢原子光谱和玻尔的原子结构模型
氢原子光谱和玻尔的原子结构模型
1.原子结构的发展历程 在道尔顿原子学说的基础上,不同时期原子结构模型先 后经历了汤姆逊的 葡萄干布丁 模型―→卢瑟福的 核式 模型 ―→玻尔的 核外电子分层排布 的原子结构模型―→ 量子力学 模型。
2.氢原子光谱 光谱分为连续 光谱和 线状 光谱,氢原子光谱是 线状
特点
C.玻尔理论不但成功地解释了氢原子光谱,而且还推
广到其他原子光谱
D.原子中电子在具有确定半径的圆周轨道上像火车一
样高速运转着
[解析] A项,氢光谱是元素的所有光谱中最简单的光 谱;C项,玻尔理论成功地解释了氢原子光谱,但对多 电子原子的光谱解释却遇到了困难;D项,原子中电子 运动没有确定半径的原子轨道,原子轨道是电子运动出 现的“区域”。 [答案] B
典例剖析
氢原子光谱和玻尔原子结构模型
[例 1] 玻尔理论不.能解释 A.氢原子光谱为线状光谱
()
B.在一给定的稳定轨道上,运动的核外电子不辐射
能量
C.氢原子的可见光区谱线
D.在有外加磁场时氢原子光谱增加多条谱线
[解析] 玻尔理论是针对原子的稳定存在和氢原子光 谱为线状光谱的事实提出的,有外加磁场时氢原子光谱增 加多条谱线,玻尔的原子结构模型已无法解释这一现象, 必须借助于量子力学加以解释。
[答案] D
归纳总结 原子结构理论的发展是不断深入的,各个时期 的原子结构模型都是为了解释当时出现的某一现实问题 或实验现象而提出的。随后可能又会碰到不能解释的问 题,这些问题的出现又会推动原理论的改进或新理论的 创建。
[例2] 下列说法正确的是
()
A.氢光谱是元素的所有光谱中最简单的光谱之一
氢原子光谱和波尔的原子模型ppt课件
Na原子的发射光谱(明线)
H原子的吸收光谱(暗线)
H原子的发射光谱(明线)
吸收光谱和线状谱(发射光谱)的关系:
各种原子的吸收光谱中的每一条暗线都跟该种原子的发射光谱(线状光谱)中的
一条明线相对应。
3.光谱分析
既然每种原子都有自己的特征谱线,我们就可以利用它来鉴别物质和确定物质的组
成成分。这种方法称为光谱分析。
4.由于不同的原子具有不同的结构,能级各不
相同,因此辐射(或吸收)的光子频率也不相
同。这就是不同元素的原子具有不同的特征谱
线的原因。
六、玻尔理论的局限性
1.玻尔理论的不足之处在于保留了
经典粒子的观念,仍然把电子的运
动看作经典力学描述下的轨道运动。
2.玻尔理论成功地解释了氢原子光
谱的实验规律。但对于稍微复杂一
1
E1
激
发
态
h E n E m
基态
原子从低能级向高能级跃迁(电子从低轨道向高轨道跃迁): 吸收光子,原子能量增大
电子从低轨道向高轨道跃迁,电子克服库仑引力做
功,电势能增大,原子的能量增加,要吸收能量。
吸收光子能量:
h E n E m
原子从高能级向低能级跃迁(电子从高轨道向低轨道跃迁): 辐射光子,原子能量减小
优点:灵敏度高
样本中一种元素的含量达到10-13kg时就可
以被检测到。
利用白炽灯的光谱,能否检测出灯丝的成分?
不能,白炽灯的光谱是连续谱,不是原子
的特征谱线,因而无法检测出灯丝的成分
原子的特征光谱
二、氢原子光谱(发射光谱)的实验规律
氢原子是最简单的原子,其光谱也最简单。
n=6
n=5
《氢原子光谱和玻尔的原子结构模型》PPT共24页

45、法律的制定是为了保证每一个人 自由发 挥自己 的才能 ,而不 是为了 束缚他 的才能 。—— 罗伯斯 庇尔
61、奢侈是舒适的,否则就不是奢侈 。——CocoCha nel 62、少而好学,如日出之阳;壮而好学 ,如日 中之光 ;志而 好学, 如炳烛 之光。 ——刘 向 63、三军可夺帅也,匹夫不可夺志也。 ——孔 丘 64、人生就是学校。在那里,与其说好 的教师 是幸福 ,不如 说好的 教师是 不幸。 ——海 贝尔 65、接受挑战,就可以享受胜利的喜悦 。——杰纳勒 尔·乔治·S·巴顿
谢谢!ห้องสมุดไป่ตู้
《氢原子光谱和玻尔的原子 结构模型》
41、实际上,我们想要的不是针对犯 罪的法 律,而 是针对 疯狂的 法律。 ——马 克·吐温 42、法律的力量应当跟随着公民,就 像影子 跟随着 身体一 样。— —贝卡 利亚 43、法律和制度必须跟上人类思想进 步。— —杰弗 逊 44、人类受制于法律,法律受制于情 理。— —托·富 勒
61、奢侈是舒适的,否则就不是奢侈 。——CocoCha nel 62、少而好学,如日出之阳;壮而好学 ,如日 中之光 ;志而 好学, 如炳烛 之光。 ——刘 向 63、三军可夺帅也,匹夫不可夺志也。 ——孔 丘 64、人生就是学校。在那里,与其说好 的教师 是幸福 ,不如 说好的 教师是 不幸。 ——海 贝尔 65、接受挑战,就可以享受胜利的喜悦 。——杰纳勒 尔·乔治·S·巴顿
谢谢!ห้องสมุดไป่ตู้
《氢原子光谱和玻尔的原子 结构模型》
41、实际上,我们想要的不是针对犯 罪的法 律,而 是针对 疯狂的 法律。 ——马 克·吐温 42、法律的力量应当跟随着公民,就 像影子 跟随着 身体一 样。— —贝卡 利亚 43、法律和制度必须跟上人类思想进 步。— —杰弗 逊 44、人类受制于法律,法律受制于情 理。— —托·富 勒
鲁科版高中化学选择性必修2物质结构与性质精品课件 第1章 第1课时 氢原子光谱和玻尔的原子结构模型

解析 普通氢原子没有中子,大多数原子都含有质子、中子和电子三种基本 构成微粒,故A错误;原子中质子数等于电子数,但中子数与质子数或电子数 不一定相等,故B错误;质子带正电,中子不带电,电子带负电,则原子核对电 子的吸引作用的实质是原子核中的质子对核外电子的吸引,故C正确;随着 科学的发展,可认识到质子等微粒还可以再分成更小的微粒,故D错误。
深度思考 为什么氢原子光谱是由具有特定波长、彼此分立的谱线组成的?
提示 根据玻尔原子结构模型,电子所处的轨道的能量是量子化的,轨道间 的能量差也是确定的,而光的频率ν与轨道所具有的能量E之间的关系可用 下式表示。
hν=|Ej-Ei| 式中:h为普朗克常数,其值为6.626×10-34 J·s。 由上式计算得到的光的频率(或波长λ=c/ν,c为光速)只能是不连续的,此时 形成的是具有特征波长的线状光谱。
知识点二
知识点二 氢原子光谱和玻尔的原子结构模型
基础落实•必备知识全过关 1.光谱 (1)概念:利用 原子光谱仪 将物质 吸收的光 或 发射的光 的 频率(或波长)和强度分布记录下来的谱线。 (2)形成原因:核外电子在不同轨道间 跃迁 时,会辐射或吸收能量。 2.氢原子光谱特点 氢原子光谱是 线状 光谱,与根据 卢瑟福 原子结构核式模型得到 的推论不一致。
解析 A选项,汤姆孙通过阴极射线实验发现电子,故A错误;B选项,卢瑟福根 据α粒子散射实验发现原子结构的核式模型,故B正确;C选项,玻尔研究氢 原子光谱,为解释氢原子光谱是线状光谱,引入量子理论,提出定轨理论,即 玻尔理论,故C错误;D选项,汤姆孙发现电子,提出原子结构的“葡萄干布丁” 模型,α粒子散射实验发现的是原子核,故D错误。
[对点训练1] 原子结构模型的演变如图所示,下列符合历史演变顺序的一组排列是( A )
2019版高中化学鲁科版物质结构与性质课件:1.1.1 氢原子光谱和玻尔的原子结构模型 课件(33张)

后,电子跃迁至 能量较高轨道成为激发态原子。
(2)原子基态与激发态相互转化间的能量变化
吸收能量
基态原子
激发态原子
释放能量
2.光是电子释放能量的重要形式之一。在日常生活中,大家看到的许 多可见光(如灯光、霓虹灯光、激光)和节日燃放的焰火等都与原子核外 电子发生跃迁释放能量有关。 (1)不同元素的原子发生跃迁时会吸收或释放不同的光,若用光谱仪摄 取各种元素的电子的 吸收 光谱或 发射 光谱,则可确立某种元素的原 子,这些光谱总称原子光谱。在现代化学中,常利用原子光谱上的特 征谱线来鉴定元素,称为 谱学分析 。 (2)氢原子光谱是 线状 光谱而不是连续光谱,是由于氢原子光谱源自核 外电子在能量不同的轨道之间的跃迁,而电子所处的轨道的能量是_量__ 子化 的。
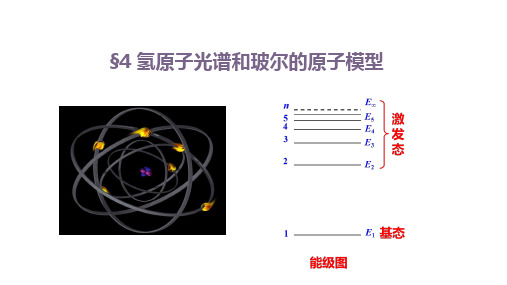
3.为了解释氢原子光谱是 线状 光谱这一实验事实,丹麦科学家玻尔提 出了核外电子分层排布的原子结构模型。其基本观点是:
原子中的电子在具有确定半径的圆周轨道上绕原子核运动, 运动轨迹
并且不辐射能量 在不同轨道上运动的电子具有不同的能量(E),而且能量是 量子化 的。轨道能量与 量子数n 的取值有关。 能量分布 对氢原子而言,电子处于n=1的轨道时能量最低,这种状 态称为 基 态;能量高于 基 态的状态,称为激发 态
第1章 第1节 原子结构模型
第1课时 氢原子光谱和玻尔的原子结构模型
学习目标定位 1.了解原子结构模型的演变历程和玻尔的原子结构模型的内容。 2.知道基态、激发态和原子光谱等概念,认识原子光谱分析的应用。
内容索引
新知导学 —— 新知探究 点点落实 达标检测 —— 当堂检测 巩固反馈
新知导学
一、原子结构模型的演变
√D.揭示氢原子光谱存在多条谱线
高中化学第1章原子结构第1节第1课时氢原子光谱和玻尔的原子结构模型课件鲁科版

解析答案
1
2
3
4
5 6
4.下列说法正确的是( B )
A.氢原子光谱是元素的所有光谱中最简单的光谱之一
B.“量子化”就是不连续的意思,微观粒子运动均有此特点 C.玻尔理论不但成功解释了氢原子光谱,而且还推广到其他原子光谱 D.原子中电子在具有确定半径的圆周轨道上像火车一样高速运动着 解析 氢原子光谱是元素的所有光谱中最简单的光谱;原子光谱源自核外
即就会回到原来的轨道,并向外界以光能的形式释放能量 ______________________________________________________________ 。 解析 焰火在燃烧时产生五颜六色的光,是因为金属原子的核外电子发生
了从低能级向高能级的跃迁,然后电子再从高能级回到低能级,此过程中
是可以稳定共存的 C.卢瑟福核式原子结构模型指出了原子核和核外电子的质量关系、电性 关系及占有体积的关系 D.玻尔电子分层排布原子结构模型引入了量子化的概念,能够成功解释 所有的原子光谱
解析答案
解题反思
20 世纪以前的每种原子结构模型理论都有一定的局限性。
变式训练1 最早成功解释了氢原子光谱为线状光谱的原子结构模型是( B )
4.玻尔原子模型(1913年):电子在原子核外空间的一定轨道上绕核做 高速的圆周运动。 5.原子结构的量子力学模型(20世纪20年代中期):现代物质结构学说。
例1 下列关于原子结构模型的说法中,正确的是(
)
A.道尔顿的原子结构模型将原子看作实心球,故不能解释任何问题
B.汤姆逊“葡萄干布丁”原子结构模型成功地解释了原子中的正负粒子
运动 原子中的电子在具有确定半径的 圆周 轨道上绕 原子核 运动, 轨迹 并且不辐射能量 在不同轨道上运动的电子具有不同 的能量(E),而且能量是 能量 量子化 的。轨道能量随量子数n(1,2,3,„„)的增大而 升高 。 为 基 态;能量高于 基 态的状态,称为 激发 态 电子 跃迁
氢原子光谱及玻尔理论PPT课件

运动方程 :
m 2 Ze2 r 40r 2
原子的能量:
E 1 m 2 Ze2
2
40r
1 Ze2 0
40 2r
电子轨道运动的频率: f e
Z 1
2r 2 40mr 3
r3 2
最大能量为0,而且 r 大,E 大。
第9页/共21页
二.经典理论的困难 1. 经典电动力学原理 有加速度a向外辐射能量,且辐射频率
(3)改变m数值,可给出不同的光谱线系。
以后将会看到,这三条规律对所有原子光谱都适用,所不同的只是各原子的 光谱项的具体形式各有不同而已。
第8页/共21页
§2.3 玻尔模型
(一)电子在库仑场中的运动
原子中的电子绕核运动时,只能在某
些特定的允许轨道上转动,但不辐射
电磁能量,因此原子处于这些状态时
是稳定的,
第2页/共21页
§2.2 氢原子的光谱和原子光谱的一般情况
一 氢原子光谱产生与特点 1 产生 氢气放电 2 特点 可见光,紫外光, 有规律
A 谱线的间隔和强度都向着短波方向递减 B 有4条主要线
第3页/共21页
(二)巴耳末经验公
式
1.
B
n2 n2
4
n 3,4,5
B 364.56nm
氢原子光谱(可见区)的计算值和观测值
T (m)
RH m2
T (n)
RH n2
~ T(m) T(n)
由上式可见,氢原子光谱的任何一条谱线,都可以表示成两 个光谱项之差。
第7页/共21页
综上所述,氢原子光谱有如下规律:
(1)谱线的波数由两个光谱项之差决定:
~ T(m) T(n)
nm
鲁科版高中化学选修三 1.1.1 氢原子光谱和玻尔的原子结构模型

知识归纳 第 12 页
玻尔原子模型(1913年);
电子云模型-薛定谔 (1927~1935年)
氢原子光谱和玻尔的原子结构模型
交流 思考
问题导学 第 13 页
玻尔理论的出现解决了什么问题呢?让我们先一起来看看有关 的知识背景。 “光”背景知识 光是一种电磁波,根据波长分为: γ射线 X射线 紫外光 可见光 红外光 微波 光学光谱 不同波长的光具有不同能量E=hυ,υ=c/λ;大多数物质能吸收或释放 出光;其光的波长可以用光谱仪记录,形成光谱。人的视觉所能感觉 到的是在真空中波长介于400-700nm之间的电磁波。
图片导学 第 16 页
氢原子的 线状光谱
氢原子光谱和玻尔的原子结构模型
知识点1、氢原子光谱
狭义的光:波长400~700nm之间的电磁波;
问题导学 第 17 页
广义的光:即电磁波,包括可见光、红外光、紫外光、X射线等
问题 探究
卢瑟福核式结构模型 经典电磁学
围绕核高速运动的电子 会自动释放出连续能量
光谱应连续而不应线状光谱。H光谱为什么是线性而不是连续光谱呢? 知识点2、玻尔的原子结构模型
氢原子光谱和玻尔的原子结构模型
原子结构模型的发展历史 卢瑟福α粒子散射实验
科学史话 第8 页
1911年,英国物理学家卢瑟福通过α粒子的散射实验,
提出了原子结构有核模型。他认为原子的质量主要集
中在原子核上,电子在核外空间高速运动。 遇到的问题
根据电磁运动规律,电子运动时放出电磁波。因 此,绕着核旋转的电子,因为能量逐渐减小,应沿一条螺旋形的
Rutherford 核式原子模型 Bohr理论 Planck 量子论 Einstein 光子学说
氢原子光谱和玻尔的原子结构模型
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高手笔记:电子云是电子在核 外空间各处出现概率密度大 小的形象化描述。
注意:①电子云是一个形象化
描述 ②一个小黑点不代表一
个电子
③电子云的疏密代表电子在那
电子云这个名词是用 来描述原子或分子中电子 在原子核外围各区域出现 的概率的。为了直观,把 电子的这种概率分布状况 用图像表示时,以不同的 浓淡代表概率的大小,其 结果如同电子在原子核周 围形成了云雾,所以叫电 子云。 也就是说,原子中的、 受束缚的电子不是像行星 绕太阳运转那样在确定的 时刻处于确定的位置的。
2)量子化条件假设
不同轨道上运动的电子具有不同的能量,而且能量 是量子化的,即“一份一份”的,不能任意连续变 化而只能取某些不连续的值 基态 ground state:原子能量最低的定态。
激发态 excited state:除基态外的其他定态。
3)频率条件——频率假设
电子从一个轨道跃迁到另一轨道时,就要吸 收或放出能量,两个定态的能量差为E。如能 量以光辐射的形式表现出来,就形成了光谱。
里出现的概率密度的大小
玻尔理论的出现解决了什么问题呢?让我们先一起来看看有关的知识背景。
一、氢原子光谱和玻尔的原子结构理论
1. 连续光谱(continuous spectrum) 无数波长连续的光形成 2. 线状光谱(原子光谱)(line spectrum) 一些具有特定波长的光形成 3. 氢原子光谱 连续?线状
汤姆生原子模型
原子是一个平均分布着正电荷的粒子,其中镶嵌 着许多电子,中和了正电荷,从而形成了中性原子。
卢瑟福原子模型
原子中心有一个带正电荷的核,它的质量几乎等于原子的全部质 量,电子在它的周围沿着不同的轨道运转,就象行星环绕太阳运 转一样。
卢瑟福的原子结构理论
将原子结构比喻像个小小的太阳系Fra bibliotek中心是带阳电荷的原 子核,外面绕着核转的是带阴电荷的电子。不同的是:在太阳 系中,行星绕太阳转,靠万有引力;在原子中,电子绕着原子 核转,靠异性电荷的吸引力。
卢瑟福的原子结构理论遇到的问题
根据已经知道的电磁运动的规律,电子在运动的时候会放出 电磁波(能量)。因此,绕着原子核旋转的电子,因为能量逐渐 减小,应当沿着一条螺旋形的轨道转动,离中心的原子核越来越 近,最后碰在原子核上。这样一来,原子就被破坏了。 实际上,原子很稳定,有一定大小,并没有发生这种电子同 原子核碰撞的情况。这又怎样解释呢?
绚丽壮观的焰火增加了节日欢乐的气氛,都市夜空色彩夺 目的美景会给你留下不可磨灭的记忆。渐渐长大的你是否想过, 这给你带来惊异和欢乐的美景是如何产生的?是什么产生了这 不同颜色的光?这一节内容的学习,将会帮助我们揭开其中的 秘密。
第 一 节 原 子 结 构 模 型 (1)
道尔顿原子模型
英国科学家道尔顿 (Dalten 1766—1844) 把古代模糊的原子假说 发展为科学的原子理论, 为近代化学的发展奠定 了重要的基础。恩格斯 曾誉称他为“近代化学 之父”。
卢瑟福的核式结构模型
经典电磁学
围绕原子核高速运动的电子 会自动释放出连续的能量
回过头来看玻尔的理论
玻尔原子结构模型 (1)行星模型 点拨:这里的“轨道”实际上就是我们现在所说的电子层。 (2)定态假设 点拨:玻尔原子结构理论认为:同一电子层上的电子能量完 全相同。 (3)量子化条件 点拨:量子化条件的内涵是: 各电子层能量差的不连续性。 (4)跃迁规则 ▲原子光谱产生的原因:电子由激发态跃迁到基态会释放出 能量,这种能量以光的形式释放出来,所以就产生光谱。 ▲氢原子光谱是线状光谱的原因:氢原子上的电子由n=2的激 发态跃迁到n=1的基态,与从n=3的激发态跃迁到n=2的激发 态,释放出的能量不同,因此产生光的波长不同。
4. 玻尔的原子结构模型
Rutherford 核式原子模型 Planck 量子论 Bohr理论 Einstein 光子学说
理论要点
1)定态假设 2)量子化条件假设
3)频率条件—频率假设
1)定态假设
原子中的电子在具有确定半径的圆周轨道(orbit) 上绕核运动时,并不吸收能量,也不辐射能量,电 子处于定态。
波尔原子模型
电子在原子核外空间的一定轨道上绕核做高速的圆周运动。 他应用当时物理学中新发展起来的量子论,指出电子按着固定 的轨道围绕原子核运动的时候是不会放出能量的,所以电子不会掉 到原子核上去。他还指出,电子在原子核外面只能在一定的轨道上 运动。他提出了核外电子排列的规律。这就是有名的玻尔模型。
E = E2- E1= h (=c/)
为什么氢光谱是线状光谱?
氢原子从一个电子 层跃迁到另一个电 子层时,吸收或释 放一定的能量,就 会吸收或释放一定 波长的光, 所以得到线状光谱
n=4
n=3 n=2 n=1
吸收能量
释放能量
原子是组成物质的基本粒子,它们是坚实的、不可再分的实心球。
按照道尔顿的理论,原子是既不能创造,也不能毁灭,又 不能再分割的最最基本的物质粒子。那么,放电管中的“射线” 是什么呢?汤姆逊用实验回答说:是电子,并且在各种元素的 原子中都有电子。这样看来,原子就不是不可再分的了!也就 是说,原子不是最最基本的物质粒子了!
