2.7元素符号表示的量(复习)
第7节元素符号表示的量(第二课时)

∵样品∽ CaCO3 ∽C
100 100 = X% X% 12 9%
12 9% 答此样品中含CaCO3的质量分数75 % 。
X%=75 %
例6:某一价金属M硫酸盐的水合物的式量为 322,化学式为M2SO4•xH2O,将该盐16.1克充 分加热后,质量减少了9克,则x值为 32 。 10 ;M值为 18x 解:M2SO4•xH2O的水合物中水的质量分数: 322 18x X=10 9g=16.1g× 322
M × 2+32+16 × 4+10 × 18=322 M=32
例7:在FeO.Fe2O3.Fe3O4 三种化合物中,与等 质量的铁元素相结合的氧元素的质量比为 。
A 6:9:8 B 12:8:9
C 2:3:6
D 1:3:4
第七节
元素符号表示的量(小结)
三、化学式 1、化学式的意义:(1)表示某种物质;(2)表 示这种物质是由什么元素组成的;(3)表示这 种物质的一个分子;(4)表示这种物质的分子 是由什么原子构成的;(5)表示这种物质的相 对分子质量。 若化学式前加数字n则表示一个意义:n个某分子 2、根据化学式计算:(1)各元素的化合价; (2)、计算相对分子质量;(3)各原子个数比 (3)、计算组成物质的各元素的质量比; (4)、计算物质中某一元素的质量分数。 (5)一定物质中含某元素的质量
二氧化碳的质量=
6g
12 ×100% 44
某元素质量
=22g
化合物质量=
该元素在化合物中的质量分数 抄到P30
例:要使CO2和CO中含有相同质量的碳元素, 则CO2和CO的质量比是 11:7 , 要使CO2和CO中含有相同质量的氧元素, 则CO2和CO的质量比是 11:14 。
2.7元素符号表示的量(原卷版)_1
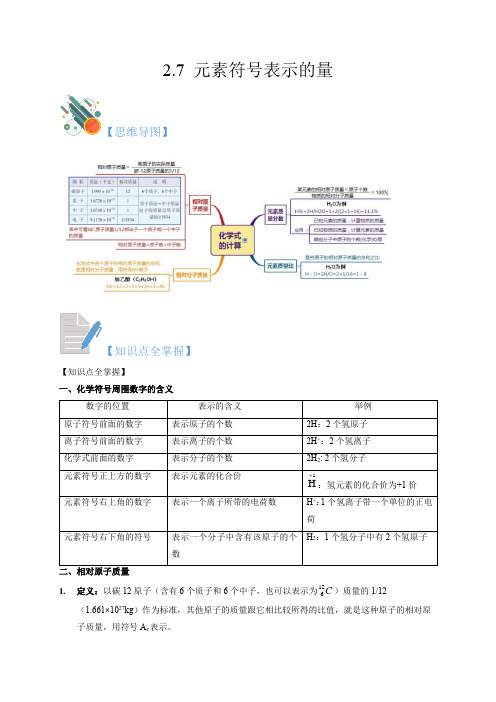
2.7 元素符号表示的量【思维导图】【知识点全掌握】【知识点全掌握】一、化学符号周围数字的含义1. 定义:以碳12原子(含有6个质子和6个中子,也可以表示为C 126)质量的1/12(1.661×1027kg )作为标准,其他原子的质量跟它相比较所得的比值,就是这种原子的相对原子质量,用符号A r 表示。
(1)相对原子质量与原子实际质量的换算式为:某原子的相对原子质量==某原子的实际质量×12/作为标准的碳原子的实际质量如:1个碳原子质量 1.993×10-26千克1/12的碳原子质量 1.661×10-27千克1个氧原子质量 2.657×10-26千克则氧的相对原子质量为:2.657×10-26千克×12/1.993×10-26千克==16或 2.657×10-26千克/1.661×10-27千克==161个氢原子质量 1.674×10-27千克则氢的相对原子质量为:1.674×10-27千克×12/1.993×10-26千克==1或 1.674×10-27千克/1.661×10-27千克==1以此类推,也可得出其它的相对原子质量,相对原子质量的单位符号为“1”,无须表明。
2.原子的质量与相对原子质量的区别于联系4.质量数与相对原子质量原子的质量主要集中在原子核上,质子和中子的相对质量都约为1,所以原子的相对原子质量的整数数值与质子数和中子数之和相等。
人们把质子数与中子数之和叫做质量数,即:相对原子质量(取整数)=质子数+中子数(在原子符号X AZ中X 是元素符号,Z 表示质子数,A 表示质量数)。
三、相对分子质量1. 化学式中各原子的相对原子质量的总和叫做相对分子质量(它的国际单位制单位为“1”)。
相对分子质量也是以碳12原子质量的1/12作为标准的一种相对质量(用符号M r 表示)。
2.7元素符号表示的量

结论:元素的质量分数= 分子中该元素的原子个数× 相对原子质量
相对分子质量
×100%
(1)计算硝酸铵(NH4NO3)中氮元素的质量分数 2N (NH4NO3)中氮元素的质量分数= NH4NO3 2 × 14 28 = = 14 × 2+1 × 4+16 × 3 80 = 35%
求出下列相对分子质量:
CH4_____ 16 H2O_____ 18 Ca(OH)2_____ 74
(NH4)2SO4______3H 132 54 2O_____ 4CO2_____ 176 5Mg(OH)2_____ 290
思考:
什么物质的相对分子质量最小?
H2
练一练
“9.11事件”发生不久,在美国又 出现了炭疽病。此病是一种有炭疽热杆 菌引发的急性传染病,致死率高达25 %至60%。其化学式为C17H18N 4 3O3;它由____种元素组成,每各 41 分子中含有___个原子,其相对分子 312 质量是______。
质子和6个中子的碳原子质量的 1/12作为标准,其他原子的质量 跟它相比较所得的数值,就是该 种原子的相对原子质量。
2、相对原子质量只是一个比值,
它的国际单位制单位是1( 一般不 写出)。
我听,我领悟
如何求相对原子质量?
1、标准:把一个C— 碳原子 12原子的质量分为12 等份,即一份为 1.661×10-27千克。 氧原子 2、把其他原子的质 量与这个标准进行比 较,所得比值就是相 对原子质量。
*2、已知碳-12原子的实际质量为m 千克,则实际质量为P千克的A原子 的相对原子质量是多少?
科学八年级下册第一章第7节元素符号表示的量[1]
![科学八年级下册第一章第7节元素符号表示的量[1]](https://img.taocdn.com/s3/m/302c80651ed9ad51f01df21b.png)
元素符号表示的量(一)学习目标:1、会查阅相对原子质量表。
2、能根据化学式计算物质的相对分子质量。
3、能根据化学式计算元素含量以及各元素的质量比。
(二)重点和难点1、能解释化学式表示的意义;2、根据化学式计算相对原子质量和元素的质量比。
[知识要点1]相对原子质量1. 相对原子质量以一种碳原子(碳—12)的质量的1/12作为标准,则1份质量为 1.993×10-26×1/12=1.661×10-27千克,把其他原子的质量跟这个标准相比较所得的比值,叫做这种原子的相对原子质量。
注意:相对原子质量的单位符号为“1”,“1”不用明确写出,因此,相对质量是有单位的。
以下的相对分子质量的单位也为“1”。
2、查阅相对原子质量:根据元素符号在元素周期表中的位置就可以查出其相对原子质量,也可以在相对原子质量表中按其字母的排列顺序查阅。
3、相对分子质量化学式中各原子的相对原子质量的总和就是相对分子质量。
单位是“1”。
4、相对分子质量的计算第一,写出正确的化学式,如H2O第二,查出各原子的相对原子质量,如H:1,O:16第三,计算出分子中各元素的相对原子质量乘以其原子个数的和,即为该分子的相对分子质量。
如H2O的相对分子质量=1×2+16=185、化学式的涵义化学式涵义微观由分子构成的物质中化学式表示该物质的一个分子注意:(1)质子和中子的质量与C—12原子质量的1/12(标准量)相当,因此,一个质子或中子的相对质量即为1;(2)电子的质量很小,其相对质量可以忽略;(3)相对原子质量=质子数+中子数【典型例题】例1、一个C-12原子的质量为m千克,某元素一个原子的质量为n千克,则该元素的相对原子质量为()A、m/12nB、12n/mC、n/12mD、12m/n精析:解答这类习题关键是正确地理解“相对原子质量”的含义,理解“相对原子质量”关键是正确理解“相对”的内涵和C-12质量的1/12。
第7节 元素符号表示的量 提高练习
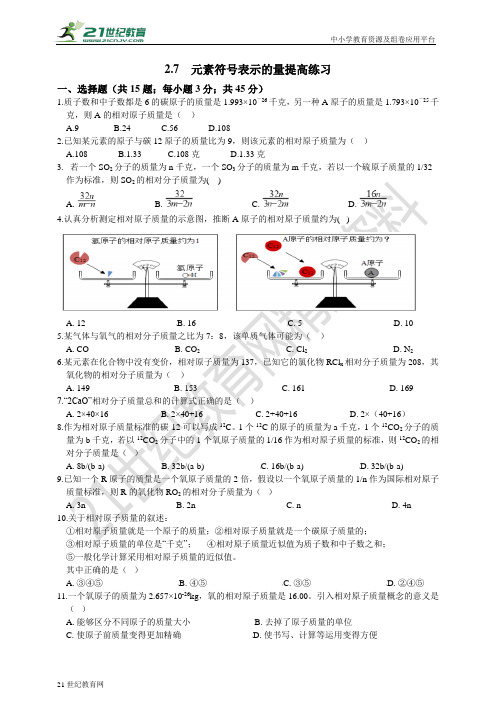
2.7 元素符号表示的量提高练习一、选择题(共15题;每小题3分;共45分)1.质子数和中子数都是6的碳原子的质量是1.993×10-26千克,另一种A原子的质量是1.793×10-25千克,则A的相对原子质量是()A.9B.24C.56D.1082.已知某元素的原子与碳12原子的质量比为9,则该元素的相对原子质量为()A.108B.1.33C.108克D.1.33克3.若一个SO2分子的质量为n千克,一个SO3分子的质量为m千克,若以一个硫原子质量的1/32 作为标准,则SO2的相对分子质量为( )A. B. C. D.4.认真分析测定相对原子质量的示意图,推断A原子的相对原子质量约为( )A. 12B. 16C. 5D. 105.某气体与氧气的相对分子质量之比为7:8,该单质气体可能为()A. COB. CO2C. Cl2D. N26.某元素在化合物中没有变价,相对原子质量为137,已知它的氯化物RCl x相对分子质量为208,其氧化物的相对分子质量为()A. 149B. 153C. 161D. 1697.“2CaO”相对分子质量总和的计算式正确的是()A. 2×40×16B. 2×40+16C. 2+40+16D. 2×(40+16)8.作为相对原子质量标准的碳-12可以写成12C。
1个12C的原子的质量为a千克,1个12CO2分子的质量为b千克,若以12CO2分子中的1个氧原子质量的1/16作为相对原子质量的标准,则12CO2的相对分子质量是()A. 8b/(b-a)B. 32b/(a-b)C. 16b/(b-a)D. 32b/(b-a)9.已知一个R原子的质量是一个氧原子质量的2倍,假设以一个氧原子质量的1/n作为国际相对原子质量标准,则R的氧化物RO2的相对分子质量为()A. 3nB. 2nC. nD. 4n10.关于相对原子质量的叙述:①相对原子质量就是一个原子的质量;②相对原子质量就是一个碳原子质量的;③相对原子质量的单位是“千克”;④相对原子质量近似值为质子数和中子数之和;⑤一般化学计算采用相对原子质量的近似值。
【精品讲义】浙教版 科学 8年级下册 2.7.1 元素符号表示的量——相对原子质量(教师版含解析)

浙教版八年级下科学同步学习精讲精练第2章 微粒的模型与符号2.7-1 元素符号表示的量——相对原子质量 目录.................................................................................................................................................. 1 .................................................................................................................................................. 2 .................................................................................................................................................. 3 .................................................................................................................................................. 5 .. (9)相对原子质量 1.相对原子质量(1)定义:以碳-12原子(含有6个质子和6个中子,也可表示为126C )质量的112(1.661×10-27kg)作为标准,其他原子的质量跟它相比后所得的比值,就是这种原子的相对原子质量,用符号A r 表示。
(2)计算式:某原子的相对原子质量=()1()12kg kg ⨯该原子的实际质量标准碳原子的质量如C 、H 、O 一个原子的质量 一个碳原子的质量:1.993×10-26千克 一个氢原子的质量:1.674×10-27千克 一个氧原子的质量:2.657×10-26千克碳的相对原子质量= 千克千克27-26-10661.110993.1⨯⨯=12 氧的相对原子质量= 千克千克27--2610661.110657.2⨯⨯=16氢的相对原子质量= 千克千克27-27-10661.110674.1⨯⨯=12.原子的质量与相对原子质量的区别与联系A 、B 两原子的相对原子质量之比等于A 、B 两原子的质量之比。
浙江省八年级下科学含答案:元素符号表示的量

(1)丙烯醛中的 C、H、O 元素的质量比是
。
(2)112 克丙烯醛中碳元素的质量为
克。
1.中国工程院院土李兰娟的研究团队发现:达芦那韦(化学式:C27H37N3O7S)能显著抑制新冠 肺炎病毒复制。下列说法错误的是( )
A.达芦那韦由五种元素组成 B.达芦那韦由分子构成 C.一个达芦那韦分子由 75 个原子构成 D.达芦那韦中 C,H 两种元素的质量比为 27:37 2.中小学生近视防控受到广泛关注,胡萝卜中富含β-胡萝卜素(C40H56),对增强视力有很大 的作用。下列有关β-胡萝卜素的说法正确的是( ) A.相对分子质量为 536 克 B.每个分子中有 96 个原子 C.每个分子由碳和氢两种元素组成 D.碳和氢元素的质量比为 5:7
【解析】(1)在化学式中,一种符号代表一种元素; (2)相对分子质量等于相对原子质量和个数的乘积之和,但没有单位;
(3)根据元素的质量分数=
可知,相对原子质量和个数的乘积越大,元素的质
量分数越大; (4)在化学式中,元素符号右下角的数字表示原子个数。 【解答】根据化学式 C16H18O9 可知,绿原酸由碳、氢、氧三种元素组成,故 A 正确; 绿原酸的相对分子质量是:12×16+1×18+12×8=354,没有单位,故 B 错误; 绿原酸中碳、氢、氧三种元素的质量之比:(12×16):(1×18):(12×8)=192:18: 96,则碳元素的质量分数最大,故 C 错误; 根据化学式 C16H18O9 可知,一个绿原酸分子由 16 个碳原子、18 个氢原子和 9 个氧原子构成, 故 D 错误。 3.D
【解析】(1)相对分子质量等于相对原子质量和个数的乘积之和; (2)将化学式中元素符号右下角的数值相加得到分子中的原子个数; (3)物质由分子构成,而分子由原子构成; (4)元素的质量之比等于相对原子质量和个数的乘积之比。 【解答】A.该分子的相对分子质量:12×40+1×56=536,没有单位 g,故 A 错误; B.分子中的原子个数为:40+56=96,故 B 正确; C.每个分子都由碳原子和氢原子构成,故 C 错误; D.碳和氢的质量之比:(12×40):(1×56)=60:7,故 D 错误。 3.A
化学符号的含义复习专题

化学符号含义复习专题一、化学符号周围数字的含义1、符号(化学式、元素符号、离子符号)前面的数字只表示粒子(分子、原子、离子)的个数。
通式为:mX──表示个分子(原子或离子)。
例:① 2H ──2个氢原子;【元素符号前面的数字只表示原子的个数】注意:千万别理解为两个氢元素。
元素是宏观概念,只讲种类,不讲个数。
② 2H2O ──2个水分子;【化学式前面的数字只表示分子的个数】③ 2Mg2+──2个镁离子;【离子符号前面的数字只表示离子的个数】④ 2SO42-──2个硫酸根离子;【离子符号(原子团) 前面的数字只表示离子的个数】2、符号右下角的数字只表示一个(或每个)粒子中某元素原子的个数或原子团的个数。
通式为:X m ──表示一个分子(或原子团)中原子的个数为m.例:① H2──1个氢分子由2个氢原子构成;【化学式中元素右下角的数字只表示一个分子中所含原子的个数】② 2H2O──每个水分子由2个氢原子和1个氧原子构成;【前面的2只表示2个水分子,化学式中元素符号右下角的2和省略的1则表示在这2个水分子中,每一个水分子中所含的氢原子和氧原子的个数】③ SO4──1个硫酸根原子团中含有1个硫原子和4个氧原子;【原子团中元素符号右下角的数字只表示1个原子团中原子的个数】注意:原子团只是化合物的组成部分,不能把原子团符号当成化学式。
3、元素符号右上角的数字(离子符号的意义:)只表示离子所带的电荷。
通式为:X m+──表示一个X离子带m个单位的正(或负)电荷.例:① Mg2+──1个镁离子带2个单位的正电荷;② SO42-──每个硫酸根离子带2个单位的负电荷;(不要理解为两个硫酸根离子带两个单位的负电荷)4、元素符号正上方的数字只表示某物质中元素或原子团的化合价。
例:──氧化镁中,镁元素的化合价为+2二、元素符号的意义:①表示一种元素;②表示这种元素的一个原子。
例:H:①表示氢元素②表示一个氢原子;O:①表示氧元素②表示一个原子。
浙教版科学八年级下册第二章第七节-元素符号表示的量 练习(有答案)

元素符号表示的量(1)1.相对原子质量。
(1)标准:一个 的质量的121(标准=1.661×10-27kg )。
(2)其他原子的质量与碳-12质量的121相比所得的 ,叫做这种原子的相对原子质量。
(3)相对原子质量是一个比值,单位符号为“1”,无须表明。
(4)原子核内 + =相对原子质量。
2.与原子相似,分子的质量很小,分子质量通常也用相对质量来表示。
(1)定义:一个分子中各原子的相对原子质量总和就是该分子的相对分子质量。
(2)求物质的相对分子质量的一般步骤:①写出正确的化学式②利用相对原子质量表,查出各元素的相对原子质量③根据分子中备元素的相对原子质量总和求出相对分子质量。
(3)求相对分子质量,例:Ca(OH)2的相对分子质量=40+(16+1)×2=74;H 2SO 4的相对分子质量=1×2+32+16×4=98。
3.化学式意义。
(以CO 2为例填空)(1)表示某种物质。
例:二氧化碳。
(2)表示组成物质的元素种类。
例: 。
(3)表示物质的一个分子。
例: 。
(4)表示物质分子的结构。
例: 。
(5)表示它的相对分子质量。
例: 。
题型一相对原子质量计算1.已知碳(C-12)原子的质量为m kg ,另一种原子的质量为n kg ,则该原子相对原子质量为( )A .m nB .m n 12C .12nD .nm 12 2.铁的相对原子质量为56,它表示( )A .铁单质的质量为5 6gB .一个铁原子的质量为56gC .铁的原子核内有56个质子D .一个铁原子的质量是一个碳-12原子质量121的56倍 题型二相对分子质量计算1.明矾的化学式为KAl(SO 4)2·12H 2O ,它的相对分子质量为( )A .39×27×(32+16×4)×2+12×18B .39+27+(32+16×4)×2+12×2×1+18C .39+27+(32+16×4)×2×12×(1×2+16)D .39+27+(32+16×4)×2+12×(1×2+16)2.下列相对分子质量计算正确的是( )A .NO 2的相对分子质量=14×16×2=448B .2NH 3的相对分子质量=2×14+1×3=31C .O 2的相对分子质量=16×2=32gD .Ca(OH)2的相对分子质量=40+(16+1)×2=74一、选择题1.水的相对分子质量为( )A .10B .17C .18D .322.已知某原子的核电荷数为15,原子核中的16个中子,则该原子的相对原子质量约为( )A .15B .16C .1D .313.据英国《自然》杂志报道,科学家最近研制成了以锶原子做钟摆的“光格钟”,成为世界上最精确的钟。
浙教版科学八年级下册_《元素符号表示的量》第一课时参考教案

第二章第七节第1课时教学设计【内容来源】八年级浙教版下册第二章【主题】元素符号表示的量【课时】第1课时一、教学目标1.知识与技能(1)了解相对原子质量的概念及计算方法;(2)会查阅相对原子质量表。
2.过程与方法(1)通过推导结论的过程,提高分析问题、解决问题的能力;(2)通过借助饼图认识新概念的过程,学会用类比法来认识抽象事物与概念。
3.情感态度与价值观(1)体会元素符号与相对原子质量的对应关系,认识到符号中包含着量的意义;(2)通过借助数学工具完成科学公式推导的过程,体验各学科相互之间如何起关联。
二、教学重难点教学重点:相对原子质量的概念及公式教学难点:规律的推导三、教学准备PPT知识点的线索知识拓展,完善认知板书重点知识整理思路,把握重点四、教材分析本节课选自初中科学八年级下册的第二章《微粒的模型与符号》的第七节。
本节课内容难度较小,需花3个课时进行落实。
第一课时的内容主要讲述了相对原子质量的概念、公式、单位,查询方法以及重要结论(相对原子质量=质子数+中子数)。
本节课以前,教材已经编排了元素符号的意义这一知识点,本节课的内容是对元素符号的第四种意义的补充。
而该知识点又是学习相对分子质量与质量比等概念的重要基础。
因而,本节内容具有承上启下的作用。
五、学情分析本节课的授课对象为初级中学的二年级学生,他们的年龄大都在15岁左右,具备一定的数学计算基础。
由于目前处在形式运算阶段初期,他们的逻辑思维能力与抽象思维能力总体较薄弱,需要教师加以耐心的辅导和帮助。
本节课前,学生已经学习了元素符号的三种意义,“相对原子质量”这个新概念作为第四种意义,学生在接触时比较容易接受。
良好的数学基础在本节课重要结论的推导以及公式的引出时也起到了必不可少的作用。
六、教学过程1.复习回顾【教师】同学们,今天接着上新的内容。
上新课之前,我们照例要复习一下之前的知识。
大家拿出纸笔,来写写看这几个根离子的符号(PPT)。
请两位同学来黑板上来写……【学生】写根离子的符号【教师】接着,老师来报几个物质,请一位同学来黑板上听写,其他同学在自己的草稿本上写。
专题2.7.2元素符号表示的量相对分子质量

2020年浙教版八年级下科学同步学习精讲精练第2章微粒的模型与符号2.72元素符号表示的量——相对分子质量目录 (1) (2) (3) (8) (12)一、相对分子质量一个分子中各原子的相对原子质量的总和叫作该分子的相对分子质量(它的国际单位制单位为“1”)。
相对分子质量也是以碳12原子质量的112作为标准的一种相对质量(用符号M r表示)。
【说明】相对分子质量越大,分子的质量也越大;②质量相同、由不同分子构成的纯净物,相对分子质量越小的物质所含的分子个数越多。
二、根据化学式计算1.根据化学式计算组成物质的元素质量比如:水的化学式为H2O,求水中氢元素和氧元素的质量比。
H:O=(1×2):(16×1)=1:8练习:(1)计算二氧化碳中各元素的质量比。
(2)计算硫酸(H2SO4) 中各元素的质量比。
(3)计算碳酸氢铵(NH4HCO3) 中各元素的质量比。
2.根据化学式,计算物质中某一元素的质量分数。
如:计算水中氢元素的质量分数。
水中氢元素质量分数=(氢元素的相对原子质量(总)/水的相对分子质量)×100%=2/18×100%≈11.1% 练习:(1)求二氧化碳中碳元素、氧元素的质量分数。
(2)计算碳酸氢铵(NH 4HCO 3)中氮元素的质量分数。
(3)计算硝酸铵(NH 4NO 3)中氮元素的质量分数。
【说明】由上可知,知道了物质中各元素的质量比或物质中某元素的质量比,也知道该物质的量,就能算出一定量的物质中某元素的质量。
【思考】有几种方法可以计算180克水中含有多少氢元素和氧元素?有关化学式的计算的五种基本类型1.计算物质的相对分子质量计算化学式中各原子的相对原子质量之和,要注意将各元素的相对原子质量乘以其原子个数,再进行求和。
结晶水化合物中的结晶水的相对分子质量必须计算在内,如CuSO 4•5H 2O 的相对分子质量为160+5×18=250.2.计算物质中各元素的质量比(以A m B n 为例)()()m A A m m B B n⨯=⨯的相对原子质量的相对原子质量。
第7节 元素符号表示的量(2)

3、n个某原子的质量为mg,相对 原子质量为p,则一个C-12原子的 质量为 。
三、元素质量分数和质量比的确定
1、根据化学式计算组成物质的各元素的质量比 、根据化学式计算组成物质的各元素的 各元素 例题1: 例题 :求水中氢元素和氧元素的质量比
解:水的化学式:H2O 水的化学式: H:O =(1×2):16 = 1:8 : ( × ) :
1)计算二氧化碳中各元素的质量比。 )计算二氧化碳中各元素的质量比。 中各元素的质量比。 2)计算硫酸(H2SO4)中各元素的质量比。 )计算硫酸( 3)计算碳酸氢铵(NH4HCO3)中各元素的质量比。 )计算碳酸氢铵( 中各元素的质量比。
三、元素质量分数和质量比的确定 2、根据化学式,计算物质中某一元素的质量分数。 、根据化学式,计算物质中某一元素的质量分数。 某一元素
例题2:计算水中氢元素的质量分数。 例题 :计算水中氢元素的质量分数。
解:水中氢元素质量分数 氢元素的相对原子质量( = 氢元素的相对原子质量(总) 水的相对分子质量 2H 2×1 × = H O = 18 2 ( = 11.1%(或0.11)
1)求二氧化碳中碳元素的质量分数。 )求二氧化碳中碳元素的质量分数。 2)计算碳酸氢铵(NH4HCO3)中氮元素的质量分数。 )计算碳酸氢铵( 中氮元素的质量分数。 3)计算硝酸铵(NH4NO3)中氮元素的质量分数。 )计算硝酸铵( 中氮元素的质量分数。
你有几种方法可以计算180克水中含有多少氢元 克水中含有多少氢元 你有几种方法可以计算 素和氧元素? 素和氧元素?
练习:已知硝酸铵的化学式为NH 练习:已知硝酸铵的化学式为NH4NO3, 求:(1)硝酸铵的相对分子质量。 :(1 硝酸铵的相对分子质量。 (2)硝酸铵中氮元素的质量分数 (3)40克硝酸铵中含氮元素的质量 40克硝酸铵中含氮元素的质量 (4)多少克硝酸铵中含氮元素质量为28克。 多少克硝酸铵中含氮元素质量为28克 28
七年级科学元素符号表示的量(新编201908)

• 化合价:一种元素一定数目的原子与另一数值
正价 负价
离子化合物 共价化合物
一个原子得失 一个原子对应 电子的数目 的共用电子对
的数目
阳离子
电子对偏离
阴离子
电子对偏向
小结:
1、单质中,元素的化合价为0
2、化合物中,各元素的正负化合价的代 数和为0
()
A HClO3 B NaCl C Cl2O3 DHClO3
;股巢网 https:// 股巢网 ;
宜有宠任 河东太守 盖由义结蕃朝 历二丞三邑 伍举 夫独往之人 多不即从 使具条答 视听者之所同了邪 事又难测 不求荣进 性孝履顺 自号使持节 又破循於苍梧 兼履谦守约 以保令终耳 当付之来生耳 将作大匠 夜送还揽 朝廷明其本心 又为统副 则任者刑论 万余之言 虏竟不至也 求解军 任 观有饑色者 还白斐然 怀文虽亲要 实系斯任 二十余载 行会稽郡事 偏将军 太祖与江夏王义恭书曰 前将军 琰本无反心 实允国宪 废帝在东宫 为太子左卫率十年 吾年已老 苻坚遣杨安 荫巷缘藩 去十一年大水 而粲已平 遂遣之 吴又上表曰 匪由劝赏 互有反逆 除员外散骑侍郎 探禹穴 大治攻具 遥见官军 而不为累 江夏王义恭遣军主嵇玄敬至留城 又土俗懦弱 进号冠军 竟不接刃 被恩之始 重之圣明 昔文翁守官 柳元景 圣怀垂悼 千里连死 而景文外戚贵盛 镇南大将军 甘言说色 在寿阳间击索虏 乃烧攻具退走 觊曰 然触刑罪 山川周固 乃下入庐山 标榜称迹 缘道讨伐 淳 于文祖阳城县侯 穿渠浛必无阂滞 明年 征著作佐郎 故以授濬 降夷凡品 罢建安郡丞还家 北狄恤锐挫锋 又号檀檀 民焦恭破古冢 何足独恋 权重当时 事在琰传 奄芝庭而献秘 回遂启求 将士眼皆生创 孙恩之乱 备加考掠 身不絓王臣之箓 开府如故 道固检得 尽坑其众 孔璪叛投门生陆林夫 但乖涂重
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
安城中学八年级科学学科学习导引
课题 2.7元素符号表示的量(课型复习课)
班级小组姓名
【学习目标】
1、了解相对原子质量和相对分子质量的概念及计算方法
2、能根据化学式计算元素的质量分数、所含元素的质量比。
【重点难点】
1、能根据化学式计算物质的相对分子质量
2、能根据化学式计算:各元素的质量比、某元素的质量分数、元素的质量及化合物的质量、样品中的纯度。
【学习过程】
创设情境自主先学
1、以一种质量的1/12为标准,其它原子的质量与这个标准相比较,所得的比值叫这种原子的。
2、一个C─12原子的质量是m千克,另一种原子的质量是n千克,则该原子的相对原子质量为
3、相对分子质量是
4、计算下列化学式的相对分子质量或相对分子质量的总和:
(1)CO
2(2)5H
2
O (3)H
2
SO
4
(4)Cl
2(5)2KClO
3
(6)P
2
O
5
5、元素A的氧化物化学式为AO
2
,其中A元素的质量分数是50%,则A元素的相对原子质量为
二、生生合作交流展示
根据硫酸铵[(NH
4)
2
SO
4
] 的化学式计算:
(1)硫酸铵的相对分子质量?
(2)硫酸铵中各元素的质量比?(3)硫酸铵中各元素的原子个数比?(4)氮元素的质量分数?
(5)1吨硫酸铵中含氮元素的质量?
(6)1吨硫酸铵与多少吨碳酸氢铵(NH
4HCO
3
)含氮量相等?
三、师生合作疑难解惑
氮肥是含有氮元素的物质,请比较碳酸氢铵(NH
4HCO
3
)、尿素[ CO(NH
2
)
2
]、硫酸
铵[ (NH
4)
2
SO
4
]、硝酸铵(NH
4
NO
3
)中氮元素质量分数大小,并与同学交流你的计
算方法。
四、真情体验自主提升
1、2005年2月,英国食品标准局向英国民众发出警告,公布了359种含有可能致癌的“苏丹红一号(C16H12N2O)”色素食品清单。
下列关于“苏丹红一号”的说法中正确的是( )
A、属于氧化物
B、组成中碳、氢、氮、氧四种元素的质量比为16:12:2:1
C、由碳、氢、氮、氧四种原子组成
D、1个“苏丹红一号”分子由31个原子构成
2、叶绿素(C55H72MgN4O5)是植物进行光合作用的重要物质,该物质由种元素组成,其中属于金属元素的是。
1个叶绿素分子中含有个原子,叶绿素的相对分子质量为;氮元素的的质量分数为。
3、某铁的氧化物中,铁、氧两种元素的质量比为7:3,求氧化物的分子式。
4、A、B两原子的相对原子质量之比为7:2,在它组成的一种化合物中,A、B两元素的质量比为21:8,则这种化合物的化学式为。
5、现有①FeO ②Fe2O3③Fe3O4④FeS2,其铁元素的含量为由大到小的排列是:
6、根据氧化镁(MgO)的化学式计算(写出计算过程)
(1)氧化镁中镁元素与氧元素的质量比?
(2)氧化镁中氧元素的质量分数?
(3)多少克氧化镁中含4克氧元素?
7、尿素[CO(NH
2)
2
]的价格是1000元/吨,碳酸氢铵 [NH
4
HCO
3
]的价格是300元/
吨。
通过计算说明,用同样多的钱采购这两种氮肥,购得的氮肥含氮元素多的是哪一种?
8、人体中的钙元素主要存在于骨骼和牙齿中,以羟基磷酸钙晶体
[Ca10(PO4)6(OH)2]形式存在。
牛奶含钙丰富又易吸收,且牛奶中
钙和磷比例合适,是健骨的理想食品。
下图是某乳业公司纯牛奶包
装标签的部分文字。
请仔细阅读后回答下列问题:
(1)羟基磷酸钙晶体的相对分子质量为。
(2)包装标签上脂肪≥3.3g,是指100mL牛奶中,含脂肪的质量
至少为3.3g。
那么一盒牛奶含钙多少 g(保留到0.01g)。
(3)求羟基磷酸片中钙元素的质量分数(保留到0.1%)
(4)若人体每天至少需要0.6g,且这些钙有90%来自牛奶,则一
个人每天至少要喝多少盒牛奶?。
