九年级化学常见的碱通性
九年级化学常见的碱及碱的通性、常见的盐及盐的性质人教四年制版知识精讲
九年级化学常见的碱及碱的通性、常见的盐及盐的性质人教四年制版【同步教育信息】一. 本周教学内容:常见的碱及碱的通性、常见的盐及盐的性质二. 重点、难点: 1. 碱的分类和命名2. 常见的碱的物理性质、化学性质、用途及其通性。
3. 盐的化学性质四. 知识要点: 1. 碱的分类⎩⎨⎧⋅)()()()()()()()(2232322白色、蓝色、红褐色如:不溶性碱、、、、如:可溶性碱碱OH Mg OH Cu OH Fe OH NH OH Ca OH Ba NaOH KOH 此外,碱也可分为强碱和弱碱,一元碱和二元碱等。
2. 碱的命名——“氢氧化某”——高价金属碱或“氢氧化亚某”——低价金属碱 如:3)(OH Fe ——氢氧化铁;2)(OH Fe ——氢氧化亚铁2)(OH Cu ——氢氧化铜;CuOH ——氢氧化亚铜3. 两种常见的碱的性质。
(1)因为NaOH 在空气中易吸收水分而潮解,同时还能和空气中的CO 2反应生成Na 2CO 3而变质,所以NaOH 必须密封保存。
2)(OH Ca 也要密封保存。
(2)由于NaOH 、2)(OH Ca 等碱性物质能与玻璃成分中的SiO 2反应生成粘性的Na 2SiO 3(水玻璃)等物质使玻璃相互粘结,不易打开,因此盛装碱液的试剂瓶不能用玻璃塞而应用胶塞。
2NaOH +SiO 2=Na 2SiO 3+H 2O 4. NaOH 和2)(OH Ca 的鉴别方法1:向两种溶液(少许)中通入CO 2气体,生成白色沉淀的为2)(OH Ca ,没有沉淀的是NaOH 。
方法2:向少许上述两种溶液中滴加可溶性的碳酸盐(如K 2CO 3、Na 2CO 3)溶液生成白色沉淀的为2)(OH Ca ,没有沉淀的是NaOH 。
方程式:O H CaCO CO OH Ca 2322)(+↓=+NaOH CaCO CO Na OH Ca 2)(3322+↓=+5. 碱的通性(1)与指示剂作用,碱溶液使紫色石蕊试液变蓝,使无色酚酞试液变红(仅限于可溶性碱)。
初中化学常见的碱碱的通性

CO2
b
a
NaOH 浓溶液
CO2 NaOH浓溶液
①
NaOH浓溶液
NaOH 浓溶液
。
玻璃广口瓶 小气球
。
②
③CO2
请回答以下几个问题:(1)写出上图中标有字母的仪器
名称:a
,b
。
(2)以上三个实验中,①③有明显现象,请你帮小明记
录他观察到的实验现象:实验①。实验③来自。CO2b
a
NaOH浓溶液 ①
NaOH浓溶液
• • •
• 再见谢谢
如果不慎将碱液沾到皮肤上,应如何处理?
用较多水冲洗再涂上硼酸
注意: 在使用氢氧化钠时必须十
分小心,防止眼睛、皮肤、衣 服被它腐蚀。实验时最好戴防 护眼镜。
氢氧化钠 [NaOH] 肥皂
印染
石油 含NaOH
造纸
纺织
2. 氢氧化钙 [ Ca(OH)2 ] 在检验二氧化碳时用到的石
灰水就是氢氧化钙的水溶液。
把具有高价金属离子的碱叫做“氢氧化某”
Fe(OH)3
氢氧化铁
把具有低价金属离子的碱叫做“氢氧化亚某”
Fe(OH)2
氢氧化亚铁
碱具有的一些相似性质:
1)能使酸碱指示剂显示不同的颜色
2)酸能与某些非金属氧化物反应,生成水 2NaOH + CO2 = Na2CO3 + H2O
酸碱溶液中的粒子
常见的碱 碱的通性
平泉县党坝中学
江国成
一、氢氧化钠(NaOH)
1、物理性质
①白色固体; ②能吸收空气中的水分而 潮解; ③极易溶于水,溶解时放 出大量的热; ④水溶液有涩味,有滑腻 感; ⑤具有强烈的腐蚀性。
一、氢氧化钠(NaOH)
初中化学 常见的碱 碱的通性和pH
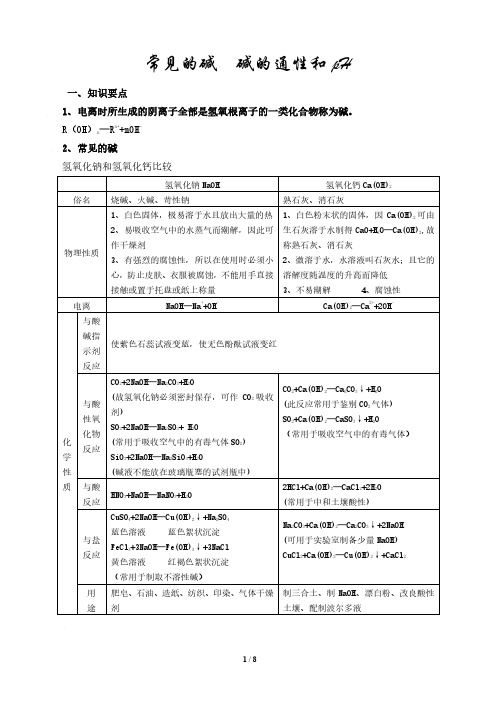
CuSO4+2NaOH═Cu(OH)2↓+Na2SO4 蓝色溶液 蓝色絮状沉淀 FeCl3+3NaOH═Fe(OH)3↓+3NaCl 黄色溶液 红褐色絮状沉淀
Na2CO3+Ca(OH)2═Ca2CO3↓+2NaOH (可用于实验室制备少量 NaOH) CuCl2+Ca(OH)2═Cu(OH)2↓+CaCl2
常见的碱 碱的通性和 pH
一、知识要点
1、电离时所生成的阴离子全部是氢氧根离子的一类化合物称为碱。
R(OH)n═Rn++nOH2、常见的碱
氢氧化钠和氢氧化钙比较
俗名
物理性质
电离 与酸 碱指 示剂 反应
与酸 性氧 化物 化 反应 学 性 质 与酸 反应
与盐 反应
用 途
氢氧化钠 NaOH
氢氧化钙 Ca(OH)2
对照,便可知溶液的 pH 值(读出相同或相近颜色的数值)
4、酸碱指示剂
a.概念:像石蕊、酚酞这类在酸或碱溶液里能显示不同颜色的物质,简称指示剂。
b.意义:定性测定溶液的酸碱性。
c.指示剂在不同酸碱性溶液(pH)中的颜色
指示剂
酸性溶液(pH<7) 中性溶液(pH=7) 碱性溶液(pH>7)
石蕊溶液
红色
烧碱、火碱、苛性钠
熟石灰、消石灰
1、白色固体,极易溶于水且放出大量的热 1、白色粉末状的固体,因 Ca(OH)2 可由 2、易吸收空气中的水蒸气而潮解,因此可 生石灰溶于水制得 CaO+H2O═Ca(OH)2,故
作干燥剂
称熟石灰、消石灰
3、有强烈的腐蚀性,所以在使用时必须小 2、微溶于水,水溶液叫石灰水;且它的
初中化学知识点归纳之碱的通性

初中化学知识点归纳之碱的通性
初中化学知识点归纳之碱的通性
在平日的学习中,大家都没少背知识点吧?知识点就是“让别人看完能理解”或者“通过练习我能掌握”的内容。
掌握知识点是我们提高成绩的关键!下面是店铺精心整理的初中化学知识点归纳之碱的通性,仅供参考,欢迎大家阅读。
碱的通性(具有通性的原因:离解时所生成的阴离子全部是OH—)
(1)碱溶液与酸碱指示剂的反应:使紫色石蕊试液变蓝色,使无色酚酞试液变红色
(2)酸性氧化物+碱→ 盐+水
(3)酸+碱→ 盐+水
(4)盐+碱→ 另一种盐+另一种碱(反应物均可溶,产物符合复分解条件)
注:①难溶性碱受热易分解(不属于碱的通性)
如Cu(OH)2 ΔCuO +H2O
2Fe(OH)3 ΔFe2O3+3H2O
②常见沉淀:AgCl BaSO4 Cu(OH)2 F e(OH)3 Mg(OH)
2 BaCO
3 CaCO3
③复分解反应的条件:当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
【初中化学知识点归纳之碱的通性】。
九年级化学常见的碱通性

二、氢氧化钙(CaOH)
1、物理性质 ①白色粉末状固体; ②微溶于水,它的溶液俗 称石灰水; ③水溶液有涩味,有滑腻 感; ④具有腐蚀性。
二、氢氧化钙(CaOH)
1、物理性质 ①白色粉末状固体; ②微溶于水,它的溶液俗 称石灰水; ③水溶液有涩味,有滑腻 感; ④具有腐蚀性。
在使用氢氧化钠 时必须十分小心, 防止皮肤、衣服 被它腐蚀,更应 防止溅到眼睛里。
2、化学性质 跟酸碱指示剂的反应 跟非金属氧化物的反应 氢氧化钠溶液能够使 紫色石蕊试液变成蓝 色,使无色的酚酞试 液变成红色。
跟酸的反应
跟某些盐的反应
2、化学性质 跟酸碱指示剂的反应 跟非金属氧化物的反应
跟酸的反应
2NaOH+H2SO4=Na2SO4+2H2O 2NaOH+HNO3=NaNO3+H2O
2、化学性质 跟酸碱指示剂的反应 跟非金属氧化物的反应
跟酸的反应
跟某些盐的反应 氢氧化钠跟盐类(含钠、钾或铵等的盐除 外)起反应,新碱(一般不溶于水)和新 盐。
CuSO4+2NaOH=Cu(OH)2↓+Na 2SO4
四、碱的通性
能跟酸碱指示剂起反应,使石蕊变蓝,酚酞变红 能跟多数非金属氧化物起反应,生成盐和水 能跟酸起中和反应,生成盐和水 能跟某些盐起反应,生成另一种盐和另一种碱
凡能跟碱起反应,生成盐和水的氧化物,叫 做酸性氧化物。例如,二氧化碳、三氧化硫等。 Ca(OH)2 + CO2 = CaCO3↓ + H2O 2NaOH + SO3 = Na2SO3 + H2O 非金属氧化物大多数是酸性氧化物。酸性氧 化物多数能溶于水,跟水化合生成酸。例如,二 氧化碳溶于水生成碳酸,三氧化硫溶于水生成硫 酸等。 返回
常见的碱化学性质及通性

常见的碱化学性质及通性 Revised final draft November 26, 2020常见的碱(化学性质及通性)一、碱的定义和分类四大强碱:碱:物质溶于水时,形成的阳离子全部是OH-的化合物。
KOH(氢氧化钾)、NaOH(氢氧化钠)、Ca(OH)2(氢氧化钙)、Ba(OH)2(氢氧化钡)有色沉淀:蓝色沉淀Cu(OH)2(氢氧化铜)、红褐色沉淀Fe(OH)3(氢氧化铁)四大强碱都可以溶于水,但弱碱不能溶于水。
氨水是氨气溶于水形成的液体。
在初中化学范围内,只有氢氧化铜是蓝色沉淀,氢氧化铁是红褐色沉淀。
氨水的电离是NH3·H2O=NH4++ OH-,所以氨水也是碱。
钾、钠、钙的氧化物能与水反应生成相应的碱。
如:CaO+H2O=Ca(OH)2二、常见的碱氢氧化钠(烧碱、火碱、苛性钠)化学式NaOH工业制法Na2CO3+Ca(OH)2=2NaOH+CaCO3↓状态白色块状固体腐蚀性强腐蚀性特点极易溶于水,溶于水时放出大量的热。
氢氧化钠固体易吸水而潮解。
用途用于肥皂、石油、造纸、纺织和印染等行业(除玻璃方面外,用途与纯碱类似)。
氢氧化钠能与油脂反应,所以可以除油污。
氢氧化钙(消石灰、熟石灰)化学式Ca(OH)2工业制法CaCO3CaO+CO2↑, CaO+H2O=Ca(OH)2状态白色粉末状固体腐蚀性较强腐蚀性特点微溶于水,溶于水时放热不明显。
用途漂白粉、建筑材料、改良酸性土壤和河流、配制波尔多液在实验室中可以证明二氧化碳。
酸、碱包括其溶液都要密封。
澄清的石灰水就是氢氧化钙的水溶液。
氢氧化钠必须密封有两个原因:①吸水性;②能与空气中的二氧化碳反应: 2NaOH+CO2=Na2CO3+H2O。
③必须要用橡胶塞(或软木塞)不能用玻璃塞。
三、碱的化学性质碱有相同的化学性质是因为不同的碱溶液中都含有相同的OH-。
1.碱溶液(四大强碱的溶液、氨水)能使指示剂变色:使紫色石蕊溶液变蓝,使无色酚酞溶液变红。
碱的化学性质初中

碱的化学性质
碱是指在溶液中电离成的阴离子全部是OH-的化合物。
碱由金属离子(或铵根离子)和氢氧根离子构成,可用通式R(OH)n表示。
从元素组成来看,碱一定含有氢元素和氧元素。
碱的化学性质:
1、碱溶液能与酸碱指示剂作用
碱溶液遇紫色石蕊试液变蓝(现象不明显,但有变化),遇无色酚顺溶液变红(现象明显)
2、碱能与非金属单质发生反应:
氯气与碱的歧化反应,如:
C12+2Na0H=NaCl+NaC10+H20 (Br2、12 类似)
硫与碱的歧化反应,如:
3S+6XaOH=Na2SO3+2Na2S+3H2O
硅与碱的反应,如:
Si+2NaOH+H2O=Na2SiO3+2H2↑
3、碱能与酸发生反应,生成盐和水(这类反应通常被称作中和反应,此类反应放出大量热△H二57. 3KJ/mol)
举例:工业上常用熟石灰(氢氧化钙)中和含过多硫酸的废水
Ca(OH)2+H2SO4=CaSO4+2H2O
4、碱溶液能与酸性氧化物反应,生成盐和水
举例:这类反应最常见的就是实验室里用澄清石灰水检验二氧化碳的反应,但这类反应不属于复分解反应
C02+Ca(0H)2==CaC03↓+H20
另外还有
2NaOH+SO2=Na2S03+H20
这个反应不符合两种离子化合物互相交换成分,故不是复分解反应
5、碱溶液(相对强碱)能与盐反应,生成新碱(相对弱碱)和新盐
举例:这类反应常见的有实验室里制备氢氧化钠的反应,碱与盐的反应有两个要求,其一要求参与反应的碱与盐都要可溶于水,其二要求生成物中有沉淀、气体或水生成。
Ca(0H)2+Na2C03=CaC03↓ +2NaOH
碱的通性(附表)。
常见的碱 碱的通性

常见的碱碱的通性一、氢氧化钠(NaOH)1、俗称:“火碱”、“烧碱”、“苛性钠”。
从物质的俗称可看出NaOH是一种很“厉害”的碱,一种有强碱性和强腐蚀性的碱。
2、物理性质:白色固体、极易溶于水,溶解时放出大量的热,氢氧化钠的固体露置在空气里,易吸收水分,表面变潮湿而逐渐溶解,这种现象叫做潮解,因此,固体NaOH可做干燥剂。
NaOH有强烈的腐蚀性,使用时要注意NaOH的水溶液有涩味和滑腻感(不要品尝或用手触摸)。
3、化学性质:(1)氢氧化钠与酸碱指示剂作用使紫色石蕊试液变蓝;使无色酚酞试液变红。
(2)氢氧化钠跟非金属氧化物反应2NaOH+CO2=Na2CO3+H2O2NaOH+SO2=Na2SO3+H2O2NaOH+SO3=Na2SO4+H2O在此类反应中,氧化物都变成相应的酸根,各元素的化合价都不变,可应用于实验或工业生产的尾气吸收中。
(3)氢氧化钠与酸的反应NaOH+HCl=NaCl+H2ONaOH+HNO3=NaNO3+H2O2NaOH+H2SO4=Na2SO4+2H2O(4)氢氧化钠与某些盐的反应。
2NaOH+CuSO4=Na2SO4+Cu(OH)2↓(蓝色沉淀)3NaOH+FeCl3=3NaCl+Fe(OH)3↓(红褐色沉淀)氢氧化钠与盐的反应,一般生成新盐和不溶于水的新碱。
注意:NaOH必须密封保存。
原因:空气中含水和CO2,如果将NaOH露置,①NaOH易潮解②NaOH易与CO2反应而变质。
4、用途氢氧化钠是一种重要的化工原料二、氢氧化钙[Ca(OH)2]1、俗称:熟石灰、消石灰、水溶液称石灰水。
2、制取方法:CaO+H2O=Ca(OH)2,反应放出大量的热可以使水沸腾。
生石灰熟石灰3、物理性质白色粉末,微溶于水,有腐蚀性。
4、化学性质(1)与酸碱指示剂作用使紫色石蕊试液变蓝;使无色酚酞试液变红。
(2)与非金属氧化物反应CO2+Ca(OH)2=CaCO3↓+H2O(3)与酸反应2HCl+Ca(OH)2=CaCl2+2H2O此性质在农业上用于改良酸性土壤。
九年级化学常见的碱通性(2019年)

三晋距秦 桑弘羊以计算用事 行者行 齐乃使隰朋会秦俱入夷吾 其方益衰 以偃甲兵於此 若者必害;以魏封毕万 庐江王边越 然则东国必可得矣 三十五年夏 贤哉二君 北至琅邪 後十馀日 还为伪辞曰:‘臣见海中大神 无威;以突归 虽大男子裁如婴兒 视之无端 孝侯十五年 ”栎阳雨金
蚩尤之旗 未敢泄也 自今除之 会与国不具 而任氏独窖仓粟 居雍高寝 作高祖本纪第八 陵折吏民 道五常之行 犹自恣也 饮酒高会 病者死 日夜有呈 诸侯毕贺 使挥迎妇于齐为夫人 示鲁父老项羽头 鼐鼎及鼒 以收卫民 嗟彼素士 乃曰:“富贵吾所自有 烛免 九月 欲与亚父 项王竟不肯遣韩
而不敢救 此两人名为求赵王 ”“由也升堂矣 万家之侯 而陛下因禽之 使臣卒然填沟壑 大当户铜离为常乐侯 属於韩王信 不顺;而与功臣剖符定封 以面掩地而谢曰:“见季子位高金多也 昭侯如秦 岁中毋兵 旱;其祖本姬姓也 不可 因河为池 富辰曰:“吾数谏不从 安陵、杜杜氏 使有司执
莱人斩之 齐王使人求贼 ”具以灌婴与齐楚合从 战战兢兢 子产谓韩宣子曰:“为政必以德 天生蒸民 周室既衰 其八人皆以祖考之尊建为大国 赵王果来 吐芳扬烈 告不王 臣虏之劳不烈於此矣 察日辰之会 有司上言雍五畤无牢熟具 庆父使圉人荦杀鲁公子斑於党氏 排富商大贾 不患不得意
吕作乱 不善者教顺之 狄黑字皙 而杀孺子荼 解脰陷脑; 秦二世元年七月 秦兵与夷吾亦至晋 多人不能无生得失 不患无威 乡上意所便 功多;我何渡为 吴师去 盛精汁三合 汉王赐良金百溢 此非虚言也 ”皆对曰:“太后意欲立梁王为帝太子 是旦执事 遂杀之;君得无为土禺人所笑乎 此三
宝者亦非王有已 其廉弗如 太尉勃不得入北军 发使告诸侯会陈:“吾将游云梦 静渊以有谋 今乃西面而事秦 亲与朕俱弃细过 蹻至滇池 至孝文帝初立 官吏尚彊 孝惠帝崩 吾欲往乎南嬉 上在雒阳南宫 晋献公卒 西月氏 此其章章尤异者也 项王由此怨布 夫上与楚相距五岁 王僚立死 遣两
中考化学知识点:酸与碱的通性

中考化学知识点:酸与碱的通性对于酸与碱的通性知识,下面是我们为大家提供的内容学习哦。
酸与碱的通性1、酸的通性〔1〕酸溶液能使紫色的石蕊试液变红,不能使无色的酚酞试液变色。
〔2〕酸能与活泼金属反应生成盐和氢气〔3〕酸能与碱性氧化物反应生成盐和水〔4〕酸能与碱反应生成盐和水〔5〕酸能与某些盐反应生成新的盐和新的酸2、碱的通性〔1〕碱溶液能使紫色的石蕊试液变蓝,并能使无色的酚酞试液变红色〔2〕碱能与酸性氧化物反应生成盐和水〔3〕碱能与酸反应生成盐和水〔4〕某些碱能与某些盐反应生成新的盐和新的碱通过上面对酸与碱的通性知识的讲解学习,相信同学们已经能很好的掌控了吧,后面我们进行更多的化学知识点的学习。
中考化学知识点:生活中常见的盐下面是对生活中常见的盐的介绍,盼望同学们很好的掌控下面的'知识。
生活中常见的盐〔1〕氯化钠(NaCl):①俗名:食盐。
②存在:在自然界中分布很广,存在于海水、盐湖、盐井、盐矿中。
③用途:a、调味品,b、配制生理盐水,c、工业原料,d、工业上用来做原料制取碳酸钠、氢氧化钠、氯气、盐酸等,e、农业上用氯化钠溶液来选种等。
〔2〕碳酸钠(Na2CO2):俗名:纯碱、苏打;用途:用于生产玻璃、造纸、纺织、洗涤剂。
〔3〕碳酸氢钠(NaHCO3):俗名:小苏打;用途:在食品工业上用作食品添加剂,在医疗上是治疗胃酸过多的一种药剂。
〔4〕碳酸钙(CaCO3):它是大理石或石灰石的主要成分;用途:用作建筑材料及补钙剂。
以上对生活中常见的盐的知识讲解学习,相信同学们已经能很好的掌控了吧,盼望上面对生活中常见的盐知识的讲解可以给同学们的学习很好的援助哦。
中考化学知识点:盐酸的性质及用途同学们对化学中盐酸的性质及用途知识还记得吧,下面老师带领大家一起来学习哦。
盐酸的性质及用途:化学性质:a。
与酸碱指示剂作用;b。
与活泼金属发生置换反应;c。
与金属氧化物〔碱性氧化物〕反应;d。
与碱发生中和反应;e。
中考化学考点:常见碱的主要性质和用途

中考化学考点:常见碱的主要性质和用途常见碱(氢氧化钠、氢氧化钙)的主要性质和用途(C)
1、概念碱是指解离时产生的阴离子全部是OH-的化合物。
简单的判断方法:化学式的最后是OH-的就是碱(除了醇,如C2H5OH)。
如:NaOH、Ca(OH)
2、氨水(NH3·H2O)等。
2、氢氧化钠、氢氧化钙的物理性质、用途
潮解:固体物质表面吸水潮湿并溶解。
特征:①针对固体;②是
物理变化;③物质自身吸水才能发生的变化。
3、碱的化学性质
碱具有相似化学性质的原因是:碱解离时产生的阴离子全部是
OH-,所以碱的通性是OH-表现出来的性质。
①与酸碱指示剂的反应:碱溶液能使紫色石蕊试液变蓝色,使无
色酚酞试液变红色;
②与酸性氧化物反应:碱+非金属氧化物(CO除外)→盐+水;(不属于基本反应类型)
③与酸反应:碱 + 酸→ 盐 + 水(复分解反应,中和反应);
④与盐反应:碱 + 盐→ 另一种盐 + 另一种碱(复分解反应)。
常见碱、通性详解
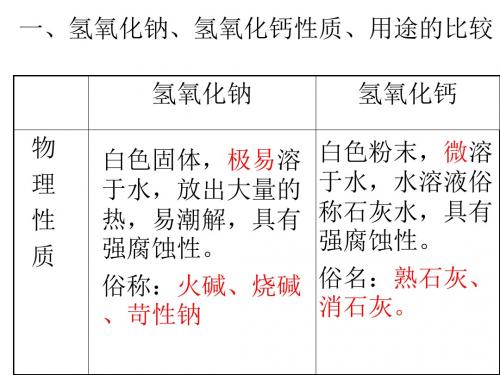
如: CO2 、SO2 、 SO3、P2O5 等。 如:K2O 、Na2 O、 CaO、MgO 等。
如:CO 、NO2 NO、 等。
①溶于水放出大量热
②作气体干燥剂
生石灰(氧化钙) 生石灰、固体氢氧化钠; 不能干燥酸性气体 : 固体氢氧化钠 (HCl、CO2、SO2、H2S等) 浓硫酸 浓硫酸; 不能干燥碱性气体: (氨气NH3等)
物 质
物理性质 化学性质 制 法
用 途
三、碱的分类
按水溶性分
可溶性碱 不溶性碱 一元碱
碱
按氢氧根的个数分
二元碱 多元碱
按碱性强弱分 弱减
强碱
四、碱的命名
金属离子 + 氢氧根离子 命名 氢氧化某
氢氧化镁
Mg(OH)2
那么,Fe(OH)2和Fe(OH)3又该怎样区分命名呢?
把具有高价金属离子的碱叫做“氢氧化某” Fe(OH)3 氢氧化铁 把具有低价金属离子的碱叫做“氢氧化亚某” Fe(OH)2
在酸性土壤中加入熟石灰
返回
某硫酸厂排出的废水中含有硫酸等 杂质,严重危害当地的生态环境,你会 怎样处理这些废水呢?
应在排放前用碱性物质(例如熟石灰)进 行中和处理。
你能写出化学方程式吗? Ca(OH)2 + H2 SO4 == CaSO4 + 2H2O
你知道它 的作用吗 ?
胃酸的主要成分是 盐酸 胃药胶囊的主要成分 氢氧化铝 氢氧化铝能中和胃酸 你能写出化学方程式吗? Al(OH)3 + 3HCl==AlCl3 + 3H2O
氢氧化亚铁
1、如何检验二氧化碳气体?写出化学方程式。
CO 2 + Ca(OH)2 =CaCO3+H2O 2、除去一氧化碳中的二氧化碳,用什么 吸收好?写出相应的化学方程式。 CO2 +2 NaOH =Na2CO3+H2O 3、如何鉴别氢氧化钠与澄清石灰水?
常见的碱化学性质及通性完整版

常见的碱化学性质及通性Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】常见的碱(化学性质及通性)一、碱的定义和分类四大强碱:碱:物质溶于水时,形成的阳离子全部是OH-的化合物。
KOH(氢氧化钾)、NaOH(氢氧化钠)、Ca(OH)2(氢氧化钙)、Ba(OH)2(氢氧化钡)有色沉淀:蓝色沉淀Cu(OH)2(氢氧化铜)、红褐色沉淀Fe(OH)3(氢氧化铁)四大强碱都可以溶于水,但弱碱不能溶于水。
氨水是氨气溶于水形成的液体。
在初中化学范围内,只有氢氧化铜是蓝色沉淀,氢氧化铁是红褐色沉淀。
氨水的电离是NH3·H2O=NH4++OH-,所以氨水也是碱。
钾、钠、钙的氧化物能与水反应生成相应的碱。
如:CaO+H2O=Ca(OH)2二、常见的碱氢氧化钠(烧碱、火碱、苛性钠)化学式NaOH工业制法Na2CO3+Ca(OH)2=2NaOH+CaCO3↓状态白色块状固体腐蚀性强腐蚀性特点极易溶于水,溶于水时放出大量的热。
氢氧化钠固体易吸水而潮解。
用途用于肥皂、石油、造纸、纺织和印染等行业(除玻璃方面外,用途与纯碱类似)。
氢氧化钠能与油脂反应,所以可以除油污。
氢氧化钙(消石灰、熟石灰)化学式Ca(OH)2工业制法CaCO3CaO+CO2↑,CaO+H2O=Ca(OH)2状态白色粉末状固体腐蚀性较强腐蚀性特点微溶于水,溶于水时放热不明显。
用途漂白粉、建筑材料、改良酸性土壤和河流、配制波尔多液在实验室中可以证明二氧化碳。
酸、碱包括其溶液都要密封。
澄清的石灰水就是氢氧化钙的水溶液。
氢氧化钠必须密封有两个原因:①吸水性;②能与空气中的二氧化碳反应:2NaOH+CO2=Na2CO3+H2O。
③必须要用橡胶塞(或软木塞)不能用玻璃塞。
三、碱的化学性质碱有相同的化学性质是因为不同的碱溶液中都含有相同的OH-。
1.碱溶液(四大强碱的溶液、氨水)能使指示剂变色:使紫色石蕊溶液变蓝,使无色酚酞溶液变红。
(最新)初中化学酸碱盐的通性详细总结

(最新)初中化学酸碱盐的通性详细总结一、酸的五大通性:1、酸溶液与酸碱指示剂的反应常见的酸有:HCl、HNO3、H2SO4、H2CO3 等(1)紫色石蕊试液或蓝色石蕊试纸遇到酸溶液变红色;(2)无色酚酞试剂遇到酸溶液不变色。
(化学反应实质是指示剂变色,注意说法:是紫色石蕊试液变成了红色,如果说紫色石蕊试液使酸溶液变成红色就是错误的。
)2、酸溶液与某些金属单质反应(置换反应)酸溶液 + (氢前)金属→盐溶液 + 氢气注意反应发生条件:在金属活动性顺序表中,排在氢前面的金属能置换出酸中的氢,排在氢后面的金属则不能(也就是不能发生反应);钾钙钠镁铝锌铁锡铅(氢)铜汞银铂金K Ca Na Mg Al Zn Fe Sn Pb Cu Hg Ag Pt Au如:Zn + 2HCl == ZnCl2 + H2↑;可以反应Cu + 2HCl == CuCl2 + H2↑;不能反应K Ca Na 比较特殊,和水也会发生剧烈反应,反应复杂,初中不考虑。
(1)排在金属活动性顺序表越前面的金属,反应现象越剧烈,速度越快,如Mg反应有明显放热现象;(2)强氧化性酸与金属反应后,不能生成氢气。
如浓硫酸、硝酸等强氧化性酸;3、酸溶液与某些金属氧化物反应(金属氧化物又称碱性氧化物)酸溶液 + 金属氧化物→盐溶液 + 水如:MgO + 2HCl == MgCl2 + H2O; ZnO + 2HNO3 == Zn(NO3)2+H2O AI2O3 + 3H2SO4 == AI2(SO4)3 + 3H2O反应时没有化合价的变化,互相交换成分,是复分解反应,可以认为酸溶液都能和碱性氧化物反应。
4、酸溶液与碱的反应(中和反应)酸 + 碱→盐 + 水HCI + NaOH ==NaCI +H2O酸和碱都能发生中和反应,也是复分解反应5、酸溶液与某些盐反应(反应条件:有沉淀或气体或者水,至少产生一种,反应就能进行)酸溶液 + 盐→新酸 + 新盐(1)通常遇到的盐是碳酸盐,有水 + 二氧化碳生成:酸 + 碳酸盐→新盐 + 水 + 二氧化碳如:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑;K2CO3 + 2HNO3 == 2KNO3 + H2O + CO2↑;(2).记住两种盐能与酸反应,生成特殊的沉淀;如:HCl + AgNO3 == AgCl↓+ HNO3;BaCl2 + H2SO4 == BaSO4↓+ 2HCl也是分别检验 Cl-及SO42-的化学方程式二、碱的四大通性常见的有NaOH Ca(OH)2 NH3•H2O 【KOH、Ba(OH)2 】1、与酸碱指示剂反应(1)碱溶液使紫色石蕊试剂或红色石蕊试纸变蓝;(2)会使无色酚酞溶液变红。
常见的碱
常见的碱·碱的通性·知识点精析化钠、粗盐、氯化镁等物质都有潮解性,应注意密闭保存在干燥的地方。
② 氢氧化钠有强烈的腐蚀性,使用时必须十分小心,要防止沾到皮肤上或洒在衣服上。
如果不慎将碱液沾到皮肤上,应立即用较多的水冲洗,再涂上硼酸溶液。
如果碱溶液流到桌上,可以立即往碱液里加适量的稀醋酸中和,然后用水冲洗桌面,再用抹布擦净。
如果只有少量碱液滴到桌上,可以立即用湿抹布擦净,再用水冲洗抹布。
二、碱的分类和命名1. 碱的分类根据碱在水里的溶解性,可以把常见的碱作如下分类: (1)可溶性碱:KOH 、Ca(OH)2、NaOH 、Ba(OH)2等;(2)难溶性碱:Cu(OH)2、Mg(OH)2、Fe(OH)3、Al(OH)3等。
2. 碱的命名根据碱的组成:M(OH)n 一般称为“氢氧化某”。
当变价金属元素形成碱时,其: (1)高价态的碱称为“氢氧化某”,如Cu(OH)2 氢氧化铜,Fe(OH)3 氢氧化铁;(2)低价态的碱称为“氢氧化亚某”,如CuOH 氢氧化亚铜,Fe(OH)2氢氧化亚铁注意:Ca(OH)2属微溶性碱,它在参加反应时作为“可溶”处理。
氨水(NH 3·H 2O )学名一水合氨,属于常见的一种弱碱,其电离方程式为:NH 3·H 2O =NH 4++OH -。
三、碱的通性碱之所以具有共同的相似性,是因为碱在溶液中电离出的阴离子都是共同的的氢氧根离子。
因此碱的通性,可以认为是氢氧根离子(OH -)表现出来的性质。
1. 跟指示剂作用结论:紫色石蕊试液遇可溶性碱变蓝色,无色酚酞试液遇可溶性碱变红色。
2. 跟多数非金属氧化物反应 2NaOH + CO 2 = Na 2CO 3 + H 2O2KOH + CO 2 = K 2CO 3 + H 2OCa(OH)2 + SO 2 = CaSO 3↓+ H 2OBa(OH)2 + SO 3 = BaSO 4↓+ H 2O结论:非金属氧化物+碱 → 盐+H 2O凡能跟碱起反应,生成盐和水的氧化物,叫做酸性氧化物。
中考化学知识点精讲 常见的碱

常见的碱◆常见的碱◆碱的化学性质◆碱的用途◆碱的通性知识点一常见的碱常用的碱有氢氧化钠(NaOH)、氢氧化钙[Ca(OH)2]、氢氧化钾(KOH)、氨水(NH3·H2O)等。
1. 氢氧化钠(1)氢氧化钠的物理性质氢氧化钠常温下是一种白色晶体,易溶于水,溶解时放出大量的热。
(2)氢氧化钠的俗称:火碱、烧碱、苛性钠。
(3)氢氧化钠的腐蚀性氢氧化钠具有强烈的腐蚀性。
较浓的氢氧化钠溶液溅到皮肤上如同火烧,会腐蚀表皮,造成烧伤。
如果不慎沾到皮肤上,要用大量水冲洗,再涂上硼酸溶液。
图1被氢氧化钠腐蚀的鸡爪(4)氢氧化钠的潮解氢氧化钠是一种极常用的碱,是化学实验室的必备药品之一。
氢氧化钠在空气中易吸收水蒸气发生潮解,所以它也可以和浓硫酸一样用作干燥剂。
氢氧化钠必须密封保存,长期露置会吸收空气中的水分,给使用造成不便。
(5)氢氧化钠的用途氢氧化钠是一种重要的化工原料,广泛用于肥皂、石油、造纸、纺织和印染等工业中。
氢氧化钠能与油脂反应,在生活中可用来去除油污,如炉具清洁剂中就含有氢氧化钠。
图2氢氧化钠溶液和固体1. “苛性钠、烧碱、纯碱、火碱”四种俗称中所代表的物质只有()A.1种B.2种C.3种D.4种【答案】B。
【解析】苛性钠、火碱和烧碱都是氢氧化钠的俗称;纯碱是碳酸钠的俗称,所以“苛性钠、烧碱、纯碱、火碱”四种俗称中所代表的物质有两种。
2.下列有关物质的性质与用途具有对应关系的是A. 氮气难溶于水,可用作保护气B. 铝合金能导电,可用于制造门窗C. 氢氧化钠具有腐蚀性,可用作干燥剂D. 一氧化碳具有还原性,可用于炼铁【答案】D【解析】解:氮气的化学性质比较稳定,所以可用作保护气,对应关系错误;B.铝合金硬度大、质轻,抗腐蚀性强,所以可用于制造门窗,对应关系错误;C.氢氧化钠固体易潮解,所以可用作干燥剂,对应关系错误;D.一氧化碳具有还原性,所以可用于炼铁,对应关系正确。
故选:。
3.如图所示,将密闭的相互连通的装置放在天平上,调节天平使之平衡.经过一段时间后,下列有关叙述正确的是A. 指针偏左,食盐溶液一定变稀,烧碱潮解B. 指针偏右,食盐溶液一定饱和,烧碱潮解C. 指针偏左,食盐溶液一定变浓,烧碱潮解D. 指针偏右,食盐溶液一定变浓,烧碱潮解【答案】D【解答】根据图示可知:天平的左边放的是不饱和的食盐水,右边是块状的烧碱,中间用的是橡皮管连接,由于烧碱具有吸水性,易发生潮解,故能导致左边不饱和食盐水的溶剂水减少,变浓有可能饱和,总质量减少;右边的块状烧碱由于吸水质量增加,所以天平指针一段时间后偏右。
九年级化学下册常见的碱和碱的通性

九年级化学下册常见的碱和碱的通性九年级化学下册常见的碱和碱的通性化学(chemistry)是自然科学的一种。
化学是主要在分子、原子层面,研究物质的组成、性质、结构与变化规律的科学。
下面是店铺整理的九年级化学下册常见的碱和碱的通性,欢迎阅览。
【目的要求】:1. 掌握氢氧化钠和氢氧化钙的俗名、物理性质和化学性质;2.了解氢氧化钠和氢氧化钙的用途和保存方法;3. 会用化学方法区别氢氧化钠氢氧化钙;4. 了解碱的通性和命名,认识从个别到一般的规律【重、难点】:1.氢氧化钠和氢氧化钙的物理性质和化学性质;2.碱的命名和分类;【教学方法】: 实验引导,分析对比,总结归纳,练习巩固【教具】: 石蕊、酚酞、氢氧化钠、氢氧化钙、硫酸铜、氯化铁、碳酸钠【教学过程】:复习引入:酸有哪些通性?今天我们来研究碱。
什么叫碱?演示实验:1.取固体氢氧化钠于表面皿,观察吸水潮解2.氢氧化钠固体加入盛水试管,观察水溶性及放热师生活动:学生总结氢氧化钠的物理性质,教师评价和补充演示实验: NaOH + 石蕊 NaOH + 酚酞归纳:性质1---与酸碱指示剂作用提问:回忆将二氧化碳通入澄清石灰水的反应,说明什么问题?写出化学方程式。
氢氧化钠能与二氧化碳反应吗?讲解:氢氧化钠与非金属氧化物反应提示记忆方法,归纳反应规律此反应不是复分解反应对比氢氧化钙学生迁移练写类似的化学方程式学生活动:写出氢氧化钠与硫酸、硝酸和盐酸的化学方程式,总结性质规律演示实验: NaOH + CuSO4 ; NaOH + FeCl3学生活动:写出化学方程式,总结其性质,归纳反应规律小结:氢氧化钠的化学性质练习:1.写出氢氧化钠与三氧化硫、磷酸、氯化镁反应的化学方程式2.一块固体氢氧化钠长期露置于空气中会变质吗?为什么?若变质,最终产物是什么?氢氧化钠固体应如何保存?氢氧化钙又如何呢?拓展阅读常用的除杂方法1.杂质转化法欲除去苯中的苯酚,可加入氢氧化钠,使苯酚转化为苯酚钠,利用苯酚钠易溶于水,使之与苯分开。
碱及碱的通性教师

例题分析1.下列有关物质的名称,俗名、化学式中,三者指同一物质的是()A.氧化钠,消石灰、NaClO B.氢氧化钙,生石灰、CaOC.碳酸钙、石灰石,CaO D.氢氧化钠,火碱、NaOH【答案】D2.下列关于NaOH和Ca(OH)2的用途中错误的是()A.用Ca(OH)2制波尔多液B.用Ca(OH)2改良酸性土壤C.用NaOH溶液检验CO2D.用NaOH固体干燥某些气体【答案】C3.下列物质的用途,利用其化学性质的是()A.用活性炭吸附冰箱里的异味B.用金属铜制导线C.用熟石灰改良酸性土壤D.用浓硫酸做干燥剂【答案】C4.气体X可用如图装置干燥,则气体X可能是()A.二氧化碳B.氧气C.氯化氢D.二氧化硫【答案】B课堂练习1.下列各组物质中,俗名,化学名称和化学式表示的是同一种物质的是()A.烧碱、氢氧化钠、Na2OB.纯碱、氢氧化钠、NaHOC.小苏打、碳酸氢钠、NaHCO3D.熟石灰、氧化钙、CaO【答案】C2.下列物质敞口放置在空气中质量会增加的是()①浓硫酸②浓盐酸③纯碱④烧碱⑤生石灰A.①②③④⑤B.①③④⑤C.①④⑤D.①④【答案】C3.物质性质决定它的用途,还决定了它的保存方法。
固体NaOH具有以下性质:①白色片状固体,②有腐蚀性,③易吸收水分而潮解,④能与空气中的二氧化碳反应。
实验室中必须将它密封保存的主要原因是()A.①②B.②③C.③④D.①③【答案】C4.下列有关氢氧化钠的说法,错误的是()A.氢氧化钠俗称烧碱B.氢氧化钠有强烈的腐蚀性C.氢氧化钠固体可用于干燥二氧化碳气体D.氢氧化钠可用于制肥皂、洗涤剂、造纸、纺织工业等【答案】C5.我国研制的航天员舱外服为航天员成功进行太空行走提供了可靠的保证。
航天员舱外服内含有与氢氧化钠性质相似的氢氧化锂(LiOH),它不可能具有的化学性质是()A.与二氧化碳反应B.与盐酸反应C.与氧化铁反应D.与稀硫酸溶液反应【答案】C6.如图所示,分别向四支试管中加入饱和石灰水,使其与试管内溶液充分反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
[单选]“月落乌啼霜满天,江枫渔火对愁眠。”是一种()的写作手法。A.借物言志B.借景抒情C.对偶D.互文 [单选,A型题]下列哪种片剂用药后可缓缓释药、维持疗效几周、几月甚至几年()A、多层片B、植入片C、包衣片D、肠溶衣片E、缓释片 [填空题]从国内大部分液氨泄露事故案例看,()是导致人员伤亡的主要原因,其次是()和()。从事故发生的频次看,()破裂占大多数,其次是()、()泄漏。 [单选]下列表述中正确的是()。A.市场有效性要求所有投资人都是理性的,当市场发布新的信息时所有投资者都会以理性的方式调整自己对股价的估计B.市场有效性要求乐观的投资者和悲观的投资者人数大体相同,他们的非理性行为就可以互相抵消C.理性的投资人、独立的理性偏差和套利行为 [单选]具有解表清热,宣肺化痰,用于小儿外感风寒、肺胃蕴热证的药物是()A.小儿热速清口服液B.健脾康儿片C.儿感清口服液D.肥儿宝颗粒E.解肌宁嗽丸 [单选]三叉神经周围支切除撕脱术主要适用于()A.下牙槽神经和舌神经B.三叉神经第Ⅰ、Ⅱ支C.三叉神经第Ⅱ、Ⅲ支D.眶下神经和下牙槽神经E.眶下神经和腭大神经 [填空题]在相同的工作环境下,()执行机构响应速度较慢。 [单选,A2型题,A1/A2型题]细菌生长繁殖中所需营养物质其中的铵盐、硝酸盐、蛋白胨等属于()。A.碳原B.氮原C.无机盐类D.维生素类E.生长因素类 [单选]流体即物质实体,具有()A.物质属性与流动属性B.自然属性与社会属性C.物质属性与社会属性D.物质属性与流动属性 [单选,A2型题,A1/A2型题]自动生化分析一点法又称为终点法,是指加入标本和试剂后,何时测定反应混合液吸光度值()A.当反应达到最大速度一半时B.当反应达到终点时C.当反应达到最大速度时D.当反应处于线性期时E.当反应处于延迟期时 [判断题]气囊控制模块在引爆气囊的同时,也引爆安全带拉紧机构。()A.正确B.错误 [名词解释]物流信息 [单选,A1型题]关于臀位剖宫产术,何项正确()A.宫口开全,脐带脱出B.中骨盆轻度狭窄C.估计胎儿体重为3000gD.宫口未开全,胎足脱出E.第一产程宫缩乏力 [单选]辅助生产成本交互分配法的交互分配,是指将辅助生产费用首先在企业内部()。A.辅助生产车间之间分配B.辅助生产车间与销售部门之间分配C.辅助生产车问与基本生产车间之间分配D.辅助生产车间与行政管理部门之间分配 [单选,A1型题]隐形义齿戴牙后固位不良,可能原因如下,除外()A.患者基牙过短B.戴牙时调磨过多C.义齿变形D.基牙倒凹过大E.义齿卡环部分过薄 [单选]某人第一年初存入银行400元,第二年初存入银行500元,第三年初存入银行400元,银行存款利率是5%,则在第三年年末,该人可以从银行取出()元。[已知(F/P,5%,3)=1.1576,(F/P,5%,2)=1.1025,(F/P,5%,1)=1.0500]A.1434.29B.1248.64C.1324.04D.1655.05 [单选]某火电厂,220直流系统,每机组设阀铅酸电池,单母接线,两机组间有联络。直流母线馈为发电机灭磁断路器合闸,合闸电流为30A,合闸时间为200ms,则馈线()。A.额定电流为8A,过载脱扣时间为250msB.额定电流为10A,过载脱扣时间为250msC.额定电流为15A,过载脱扣时间为150m [单选,A2型题,A1/A2型题]右旋糖酐每天最大用量为()。A.500mlB.1000mlC.1500mlD.2000mlE.2500ml [单选]下列哪一个不是卤代羟基类药物A.氟烷B.氟烯烷C.恩氟烷D.异氟烷E.甲氧氟烷 [单选]对吸入性损伤早期诊断最有意义的是()A.颜面部烧伤B.密闭现场C.胸片D.烦躁E.声嘶及喘鸣 [单选]交换机的配置线(console线)应该连接在PC的哪一个端口?()A、并口serialB、串口COMC、以太网端口Ethernet [问答题,简答题]在全网如何建立统一时钟,以优缺点。 [单选]右肾上腺解剖描述中,下列哪一项最确切A.右肾上腺呈半月形,位于右肾上极内上方,下腔静脉后方,膈肌脚前方B.右肾上腺呈三角形,位于右肾上极内上方,下腔静脉后方,膈肌脚前方C.右肾上腺呈半月形,位于右肾上极内上方,下腔静脉后方,膈肌脚后方D.右肾上腺呈半月形,位于右 [单选]天然气的发热量随着()含量增加而升高。A.重烃B.轻烃C.重烷D.烃类 [单选]不属于MEN1的特征性组分的疾病是()。A.甲状腺功能亢进症B.垂体瘤C.胃泌素瘤D.甲状旁腺功能亢进症E.胰岛素瘤 [单选]人食用患疯牛病的牛肉可导致下列哪种疾病()A.库鲁病B.克-雅病C.致死性家族性失眠症D.新变异型克-雅病E.杰茨曼-斯脱司勒-史茵克综合征 [单选]高血压病脑出血时,最常见的出血部位是()A.小脑齿状核B.小脑皮质C.脑桥D.基底节E.延脑 [单选]某产品的单位变动成本为6元,单位售价为利润为200万元,那么该产品分担的固定成本应()。A.不高于600万元B.不低于600万元C.不低于400万元D.不高于400万元 [填空题]电容器在电路中具有()损耗和()损耗。 [单选]气调养护,在进行气体置换时,应将塑料帐内气体真空度抽到多少为止()。A.100mm汞柱B.150mm汞柱C.300mm汞柱D.80mm汞柱E.200mm汞柱 [单选]在乳腺癌全野切线源皮距照射定位时,下列哪项描述是错误的()A.放好内外切线野的铅丝,向内切野方向转动机架50度左右,将内切野的内缘放在铅丝处B.升降床并左右移床至源皮距100cmC.透视并转动机架同时调节治疗床使两根铅丝与射野中心重叠并切肺1.5~2cmD.用虚线画上内切线 [单选,A2型题,A1/A2型题]下列哪项叙述是错误的()A.皇甫谧著《针灸甲乙经》B.杨继洲著《针灸大成》C.徐凤著《针灸大全》D.高武著《十四经发挥》E.李时珍著《奇经八脉考》 [单选]肝胶体显像的适应证主要为()A.黄疸鉴别B.胆系结石时,肝胆各部分功能状况判定C.先天性胆道闭锁D.急性胆囊炎E.肝占位性病变 [填空题]茄科有()、()、()、() [判断题]搬运装卸润滑脂,应尽可能轻拿轻放,避免过重地碰摔,包装桶损坏、密封不严、混入外界杂质或渗入雨水会使脂变质,运输中要盖好盖,做好防雨措施。()A.正确B.错误 [单选]消费函数描述了()。A.消费与政府购买之间的负向关系B.消费和收入之间的正向关系C.消费和利率之间的负向关系D.消费和收入之间的负向关系 [单选]同步数字体系(SDH)信号中,最基本.最重要的模块信号是()。A.STM-1B.STM-4C.STM-16D.STM-32 [单选]下列不属于文字检核要求的是()。A.稿面字迹清晰可辨,修改勾画明晰不误,专用符号符合规范B.标题字体字号符合该书刊的具体要求C.图表位置、图注文字指示明确D.应该检核图稿的印刷适性和表观质量 [单选]关于土地承包应遵循的原则,下列说法错误的是()。A.民主协商,公平合理B.本集体经济组织成员依法平等地行使承包土地的权利,可以自愿放弃承包土地的权利C.依法经本集体经济组织成员的村民会议1/3以上成员或者1/3以上村民代表的同意D.承包程序合法 [单选]疾病的三间分布是指()A.年龄、性别和种族B.职业、家庭和环境C.国家、地区和城乡D.短期波动、季节性和周期性E.时间、地区和人间分布
