人教版高中化学实验清单大全实验室必备
最新人教版高中化学实验目录(修订版)
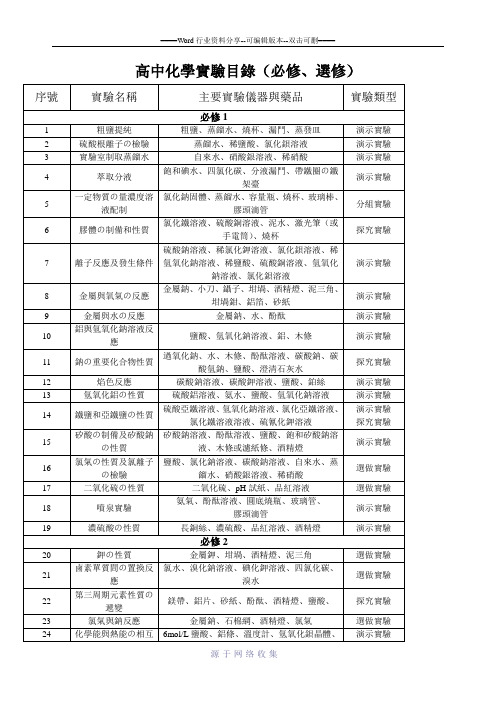
14
鐵鹽和亞鐵鹽の性質
硫酸亞鐵溶液、氫氧化鈉溶液、氯化亞鐵溶液、氯化鐵溶液溶液、硫氰化鉀溶液
演示實驗
探究實驗
15
矽酸の制備及矽酸鈉の性質
矽酸鈉溶液、酚酞溶液、鹽酸、飽和矽酸鈉溶液、木條或濾紙條、酒精燈
演示實驗
16
氯氣の性質及氯離子の檢驗
鹽酸、氯化鈉溶液、碳酸鈉溶液、自來水、蒸餾水、硝酸銀溶液、稀硝酸
演示實驗
9
金屬與水の反應
金屬鈉、水、酚酞
演示實驗
10
鋁與氫氧化鈉溶液反應
鹽酸、氫氧化鈉溶液、鋁、木條
演示實驗
11
鈉の重要化合物性質
過氧化鈉、水、木條、酚酞溶液、碳酸鈉、碳酸氫鈉、鹽酸、澄清石灰水
探究實驗
12
焰色反應
碳酸鈉溶液、碳酸鉀溶液、鹽酸、鉑絲
演示實驗
13
氫氧化鋁の性質
硫酸鋁溶液、氨水、鹽酸、氫氧化鈉溶液
演示實驗
31
糖類、蛋白質の性質
葡萄糖固體、蒸餾水、氫氧化鈉溶液、硫酸銅溶液、碘酒、土豆或面包、雞皮、濃硝酸、蒸發皿、20%蔗糖溶液、稀硫酸
探究實驗
32
鋁熱反應
幹燥氧化鐵粉末5g、鋁粉2g、氯酸鉀固體、鎂條、蒸發皿
選做實驗
33
海帶制碘
海帶、酒精、蒸餾水、3mol/L稀硫酸、3%雙氧水、澱粉溶液
選做實驗
選做實驗
22
第三周期元素性質の遞變
鎂帶、鋁片、砂紙、酚酞、酒精燈、鹽酸、
探究實驗
23
氯氣與鈉反應
金屬鈉、石棉網、酒精燈、氯氣
選做實驗
24
化學能與熱能の相互轉化
6mol/L鹽酸、鋁條、溫度計、氫氧化鋇晶體、氯化銨晶體、2mol/L鹽酸、2mol/L氫氧化鈉溶液、砂紙
人教版高中化学必修1教材实验

人教版高中化学必修1教材实验
【实验1-1】过滤和蒸发
——
粗盐的提纯(必修1,P5)
过滤:漏斗、玻璃棒、烧饼、滤纸、铁架台 【实验1-3】蒸馏(必修1,P8)
【实验1-4】萃取(必修1,P9)
利用物质在互不相溶的溶剂里溶解度的不同,用一种溶剂把物质从它与另一种溶剂所组成的溶
【实验1-5】一定物质的量浓度的溶液的配制(必修1,P16)
托盘天平(带镊子)、烧杯、玻璃棒、100mL 容量瓶、胶头滴管
2Na+2H O=2NaOH+H↑
【科学探究】铁与水蒸气的反应(必修1,P50)
【科学探究】碳酸钠和碳酸氢钠的性质(必修1,P56)
【实验4-8】氨的性质(必修1,P97)
浓硫酸的脱水性实验(必修1,P101)
向蔗糖中加入浓硫酸时,蔗糖变黑,体积膨胀,变成疏松多孔的海绵状的炭,并放出有刺激性【实验4-9】浓硫酸与铜反应(必修1,P101)。
高中化学实验

高中化学实验高中化学实验是学生学习和探索化学知识的重要环节,通过实验,学生能够亲自操作、观察现象、分析结果,培养实验操作能力和科学思维。
以下是一些常见的高中化学实验及其相关参考内容。
1. 酸碱中和实验:参考内容:实验目的:观察酸碱中和反应,了解酸碱指示剂的作用。
实验器材:酸、碱、酸滴定管、酸碱指示剂、稀释瓶、容量瓶等。
实验步骤:取一定量的稀硫酸放入容量瓶中,用酸滴定管加入适量的氢氧化钠溶液,同时添加几滴酸碱指示剂,轻轻摇晃容量瓶,当溶液的颜色发生改变时,停止加入氢氧化钠溶液的滴加,记录滴加的体积。
重复以上步骤,使用不同的酸、碱和酸碱指示剂,观察现象。
2. 燃烧实验:参考内容:实验目的:观察燃烧反应的性质、产物及释放的能量。
实验器材:燃烧器、点火器、氧气气源等。
实验步骤:在燃烧器中放入一小块镁条,点燃镁条后,用燃烧器上方的夹臂固定一根带有化学盐的木条或金属丝,观察盐或金属在燃烧时的颜色变化和火焰的形状,用观察结果推测产物。
然后,将实验器材更换成氢气气源,进行相同的实验过程,重点观察反应的活跃性。
3. 气体生成实验:参考内容:实验目的:通过化学反应生成气体,并观察气体特性。
实验器材:氢氧化钠、醋酸、酯、瓶塞、导管等。
实验步骤:将一定量的氢氧化钠溶液放入烧杯或烧瓶中,加入醋酸或酯,然后迅速用瓶塞塞住瓶口,并通过导管连接到气体收集装置中。
随着反应的进行,观察收集装置中气体的变化,并进行气体性质的测试。
4. 晶体生长实验:参考内容:实验目的:观察晶体的形成过程及晶体的外观。
实验器材:溶液、宽瓶、滤纸、蓋子等。
实验步骤:制备饱和溶液,将溶液倒入宽瓶中,并用滤纸覆盖瓶口。
通过调节溶液浓度、温度和搅拌速度等因素,观察晶体在一段时间内的生长情况,并记录下来。
最后,观察晶体的外观特征,如颜色、形状和尺寸等。
5. 化学分析实验:参考内容:实验目的:通过化学反应进行定性分析。
实验器材:待测样品、试剂、试管架等。
实验步骤:根据待测样品的特性,选择合适的试剂进行混合和反应,观察反应过程中的现象和变化,以确定样品中的存在物质。
高中化学实验目录

高中化学实验目录实验一:溶液的配制与稀释实验目的通过溶液的配制与稀释实验,掌握化学计量的基本原理,熟悉常用化学实验仪器的使用。
### 实验仪器和药品 - 称量瓶 - 称量纸 - 三角瓶 - 蒸馏水 - 盐酸 - 碳酸钠实验步骤1.使用称量瓶准确称取一定质量的盐酸溶液。
2.在三角瓶中加入一定体积的蒸馏水。
3.将称取好的盐酸溶液缓慢加入三角瓶中的蒸馏水中,并用玻璃杯轻轻搅拌均匀。
4.可根据需要对溶液进行进一步的稀释。
实验结果通过实验观察,溶液正确配制后呈现透明且均匀的溶液。
通过本实验,我们成功地配制了一定浓度的盐酸溶液,并了解了化学计量的基本原理与实验操作技巧。
实验二:酸碱中和反应的测定实验目的通过酸碱中和反应的测定实验,了解酸碱滴定的原理、方法以及计算的基本步骤。
实验仪器和药品•锥形瓶•滴定管•石蕊试剂•菊花蓝指示剂•硫酸•碳酸钠溶液1.在锥形瓶中加入一定体积的磷酸溶液。
2.用滴定管滴加磷酸溶液中的一滴石蕊试剂,并加入菊花蓝指示剂几滴。
3.用碳酸钠溶液慢慢滴定磷酸溶液,每滴加入碳酸钠溶液时轻轻摇晃瓶子。
4.当溶液由红色转为橙黄色,再滴定几滴,呈现橙黄色不变,则为滴定终点。
实验结果通过实验观察,滴定终点为橙黄色。
实验结论通过本实验,我们掌握了酸碱中和反应的测定方法,并了解了酸碱滴定的原理和计算步骤。
实验三:气体的收集与性质测量实验目的通过气体的收集与性质测量实验,掌握常见气体的制备方法,了解气体的一些基本性质。
实验仪器和药品•气体收集瓶•氢氧化钠溶液•粉末锌实验步骤1.在气体收集瓶的底部加入一定体积的氢氧化钠溶液。
2.准备一小块锌,在实验台上迅速加热至红热状态。
3.将红热锌迅速投入氢氧化钠溶液中。
4.观察气体的生成与收集。
实验结果通过实验观察,锌与氢氧化钠溶液反应后产生了氢气。
实验结论通过本实验,我们成功地制备了氢气,并了解了气体的一些基本性质。
(完整版)高中化学实验汇总

高中化学课本实验汇总一、《必修一》1、粗盐提纯P5除去粗盐中的泥沙、CaCl2、MgCl2和一些硫酸盐按顺序写出所选试剂添加顺序:所涉及的实验操作:2、溶液中SO42—检验方法P6溶液中Ag+检验方法P73、蒸馏P7-8所涉及的实验仪器:注意:沸石、冷却水流向、弃去开始的馏出液……4、萃取分液P9操作方法:注意:查漏(方法:)溶液颜色:溴水溴的CCl4溶液液溴溴蒸气碘水碘的CCl4溶液碘碘蒸气玻璃塞上的小孔作用5、电解水P13气体摩尔体积、正氧负氢、氧一氢二实验中正负极气体体积比略小于1:2的原因:(2个)6、一定物质的量浓度溶液的配制P16操作:误差分析:7、胶体的性质和制备P26(1)氢氧化铁胶体制备的方法:(2)丁达尔效应:(操作和现象)(3)浊液和胶体过滤之后:补充:浊液、溶液、胶体利用半透膜实验:(4)电泳(P28科学视野)补充:带正电的胶粒;带负电的胶粒8、离子反应P31-33(现象)(1)Na2SO4+KCl(2)NaSO4+BaCl2(3)NaOH+HCl(4)CuSO4+NaOH(5)NaOH(酚酞)+HC1(6)Na2CO3+HCl 9、钠单质的性质P47、P49(1)如何取一小块钠(2)钠的切割、加热(3)钠与水的反应反应方程式:10、铝单质的性质P48铝熔化实验中的现象:11、铁单质与水反应P50反应方程式:注意:棉花、肥皂液、氢气的检验12、过氧化钠与水反应P55注意:放热反应,滴加酚酞(现象)13、碳酸钠和碳酸氢钠的性质P56(1)外观差别(2)溶于水温度变化(3)滴加酚酞溶液的现象(4)热分解实验(大管套小管)(5)与酸反应的现象14、焰色反应P57操作方法:常见焰色:15、氢氧化铝的性质P58(1)”6。
4)3溶液中滴加氨水(2)Al(OH)3加稀盐酸和NaOH溶液16、铁的氢氧化物P60(1)F eCl3溶液和FeSO4溶液中滴加NaOH溶液(2)F e(OH)2的制备沉淀在空气中放置的现象如何设计实验长时间观察到白色沉淀:17、Fe3+的检验P61操作及现象:化学方程式:补充:Fe2+的检验方法:(1)(2)18、Fe2+和Fe B+的相互转化P61FeCl3溶液中加Fe粉:FeCl2溶液中滴加氯水:补充:FeCl2酸性溶液中滴加H2O2溶液:19、铝盐和铁盐的净水作用P62现象,方程式20、硅酸的制备P76Na2SiO3(1:2或1:3稀释)+酚酞+稀盐酸,至红色变浅接近消失。
高中化学实验目录 (3)

高中化学实验目录实验一:酸碱中和反应的观察实验目的观察酸碱溶液之间的中和反应,了解中和反应的特征和性质。
实验器材和试剂•烧杯•试管•酸性溶液(如盐酸)•碱性溶液(如氢氧化钠)•酚酞指示剂实验操作步骤1.取一小量酸性溶液倒入烧杯中。
2.取一小量碱性溶液倒入试管中。
3.向碱性溶液中滴加酚酞指示剂,记录颜色变化。
4.缓慢滴加酸性溶液到碱性溶液中,观察溶液随着酸的加入颜色的变化。
5.记录中和点的位置。
实验结果和结论在酸性溶液滴入碱性溶液时,溶液的酸碱指示剂逐渐转变颜色,最终转变成中性溶液的颜色。
中和点即为酸碱溶液完全中和的位置。
实验二:金属与酸反应实验目的观察金属与酸发生反应产生气体的现象,研究金属与酸的反应规律。
实验器材和试剂•试管•石蕊试纸•盐酸、硫酸等酸性溶液•锌、铁、铜等金属片实验操作步骤1.取一小片金属片放入试管中。
2.加入适量的酸性溶液,观察反应现象。
3.使用石蕊试纸检测溶液的酸性或碱性变化。
金属与酸发生反应时,会生成气体,并伴随着溶液的酸性或碱性变化。
不同金属与酸的反应速度和效果也会有所不同。
实验三:溶解度实验实验目的研究不同物质在水中的溶解度,探讨影响溶解度的因素。
实验器材和试剂•试管•秤•盐酸、硫酸等溶液•不同固体物质(如盐、糖等)实验操作步骤1.用秤称取一定质量的固体物质。
2.将固体物质放入试管中。
3.逐渐加入溶剂(如水),并颠倒试管使溶质与溶剂充分接触。
4.观察固体物质是否完全溶解,或者溶解度的变化。
不同物质在水中的溶解度各不相同。
溶解度受到温度、压强和固体与溶剂之间的相互作用等因素的影响。
实验四:气体的制备与收集实验目的学习气体的制备和收集方法,了解常见气体的性质。
实验器材和试剂•反应瓶•气体收集瓶或气球•酸性溶液(如盐酸)或碱性溶液(如氢氧化钠)•反应物(如金属、碳酸氢钠等)实验操作步骤1.准备一个反应瓶,将反应物放入其中。
2.将反应瓶与气体收集瓶或气球连接。
3.加入适量的酸或碱性溶液,观察气体的生成。
人教版新课标高中化学实验目录2

Ⅳ—1
4—1 教 师
演示 Ⅳ—1 4—2 教 师 演示
Ⅳ—2 Ⅳ—2 Ⅳ—2 4—3 教 师
演示
4—4 教 师
演示
4—5 教 师
演示
Ⅳ—2 4—6 教 师
演示 Ⅳ—3 4—7 教 师 演示 Ⅳ—3 — 科 学 探究
Ⅳ—3 Ⅳ—4 —
实践 活动
演示
4—8 教 师
Ⅳ—4
4—9 教 师
演示
第 2 页,共 10 页
化学实验目录
20 21 氢氧化铝 的制取 氢氧化铝 的两性 氢氧化铁 、氢氧化 亚铁的生 成 铁离子的 检验 碳酸钠、 碳酸氢钠 性质实验
铝盐和铁 盐的净水 作用
试管、胶头滴管、硫酸铝溶液、氨水。 试管、胶头滴管、氢氧化铝、稀盐酸、氢氧化钠溶液 。 试管、胶头滴管、氢氧化钠溶液、氯化铁溶液、硫酸 亚铁溶液。 试管、胶头滴管、氯化铁溶液、氯化亚铁溶液、硫氰 化钾溶液。 试管、胶头滴管、铁架台、带导管的单孔胶塞、酒精 灯、火柴、碳酸钠、碳酸氢钠、酚酞溶液、蒸馏水、 澄清石灰水、
6
7
量筒、温度计、小烧杯、稀盐酸(2mol/L)、氢氧化 钠(2mol/L)。 烧杯、电流计、铜片、锌片、导线、稀硫酸。
Ⅱ—1 2—3
教师 演示 教师 演示 科学 探究 教师 演示 教师 演示
8 9
Ⅱ—2 2—4 —
烧杯(500mL)、果汁(橙汁、柠檬汁、苹果汁)、发 Ⅱ—2 光二极管、鳄鱼夹、铜片、铁片、美条、导线。 试管、胶头滴管、双氧水(5%)、氯化铁(1mol/L)冷 水、热水、火柴、木条。 试管、胶头滴管、双氧水(5%)、氯化铁(1mol/L)、 二氧化锰、火柴、木条。 分子模型。
离子反应 离子反应 试管、胶头滴管、硫酸钠溶液、氯化钾溶液、氯化钡溶液
高中化学18个必做实验

高中化学18个必做实验作为高中化学课程的一部分,实验是必不可少的一环。
通过实验,学生可以亲手操作,观察化学现象,加深对现象和理论的理解。
以下是高中化学课程中的18个必做实验。
1. 化学计量实验化学计量实验是基础中的基础,也是高中化学实验的第一个实验。
它可以帮助学生了解元素和化合物的化学计量关系。
在实验中,学生需要称取一定质量的物质,然后进行化学反应,最后用滴定仪测量反应过程中的物质量。
2. 钠与水的反应钠与水的反应是一种典型的单质与化合物反应。
在实验中,学生需要将一小块钠放进水中,观察反应过程中的化学现象,包括钠的起火、火焰变色等。
3. 果汁中的酸碱度实验果汁中的酸碱度实验可以让学生了解酸度和碱度的基本性质和区别。
在实验中,学生需要用电极测量果汁的pH值,并观察各种物质对果汁pH值的影响。
4. 四元醇与醛的反应四元醇与醛的反应是一种典型的加成反应。
在实验中,学生会用四元醇去还原一定量的醛,然后观察醛的变化,包括颜色的变化、气味变化等。
5. 硫酸铜的制备硫酸铜的制备是一种比较基础的实验,它可以让学生对化学反应的经验有更深刻的认识。
在实验中,学生需要将一定比例的铜和硫酸进行反应,制备出硫酸铜晶体。
6. 催化剂的作用实验催化剂的作用实验可以让学生更好地理解催化剂的基本原理和作用。
在实验中,学生需要对某种反应进行观察,分别添加有无催化剂,然后比较其反应速度和产物的种类。
7. 酵母发酵实验酵母发酵实验可以让学生理解微生物在生物和工业中的重要性。
在实验中,学生需要用酵母发酵葡萄糖,并观察发生的化学反应和产物。
8. 碱性金属与水的反应碱性金属与水的反应实验可以让学生了解金属的化学性质和反应规律。
在实验中,学生需要将一些碱性金属放进水里,观察金属在水中的反应过程。
9. 稀释溶液浓度实验稀释溶液浓度实验可以让学生进一步理解溶液浓度和摩尔概念。
在实验中,学生需要根据已知溶液的摩尔浓度和质量,来制备出一定摩尔浓度的溶液。
高中化学课本实验汇总

高中化学课本实验汇总高中化学课本实验汇总一、《必修一》1、粗盐提纯这个实验的目的是除去粗盐中的泥沙、CaCl2、MgCl2和一些硫酸盐。
试剂添加的顺序应该按照实验步骤进行。
实验操作包括加水、加试剂、过滤、再结晶等步骤。
2、溶液中SO4^2-检验方法这个实验是为了检验溶液中SO4^2-的存在。
实验操作包括加BaCl2试剂,观察是否出现沉淀,从而判断溶液中是否含有SO4^2-。
3、溶液中Ag+检验方法这个实验是为了检验溶液中Ag+的存在。
实验操作包括加NH3试剂,观察是否出现沉淀,从而判断溶液中是否含有Ag+。
4、蒸馏这个实验需要用到蒸馏器等实验仪器,操作时需要注意沸石、冷却水流向、弃去开始的馏出液等细节问题。
5、萃取分液这个实验的操作方法包括加入萃取剂、摇匀、分离、查漏等步骤。
在实验过程中还需要注意溶液的颜色,如溴水、溴的CCl4溶液、液溴、溴蒸气、碘水、碘的CCl4溶液、碘、碘蒸气等。
6、电解水这个实验需要注意正负极气体体积比略小于1:2的原因,可能是因为电极表面的气体不完全排出或水中杂质的影响。
在实验中还需要测量气体的摩尔体积,了解氧一氢二和正氧负氢的比例关系。
7、一定物质的量浓度溶液的配制这个实验需要按照一定的计算公式来进行浓度溶液的配制。
在实验中需要注意溶液的浓度和容积的准确计算。
7、胶体的性质和制备(P26)1)制备氢氧化铁胶体的方法:将FeCl3溶液滴加到NaOH溶液中,搅拌并加热,形成红棕色胶体。
2)XXX效应:将NaCl加入AgNO3溶液中,观察到白色沉淀,说明NaCl是Cl-离子的存在证明。
3)浊液和胶体过滤后:浊液可通过滤纸过滤,而胶体则需使用半透膜进行过滤。
补充:浊液、溶液、胶体可通过半透膜实验进行区分,浊液和溶液可通过半透膜扩散,而胶体则不行。
4)电泳(P28科学视野):带正电的胶粒向阴极移动,带负电的胶粒向阳极移动。
8、离子反应(P31-33)1)Na2SO4+KCl→2NaCl+K2SO42)Na2SO4+BaCl2→2NaCl+BaSO43)NaOH+HCl→NaCl+H2O4)CuSO4+NaOH→Cu(OH)2↓+Na2SO45)NaOH(酚酞)+XXX→NaCl+H2O+酚酞变色6)XXX→2NaCl+H2O+CO2↑9、钠单质的性质(P47、P49)1)取一小块钠时,应使用铜夹夹住,避免手接触。
高中化学实验目录(很全)

化学实验01溶液的配制(1)02溶液的配制(2)03中和滴定04测定食醋的总酸度05浓氨水含量的测定06双指示剂法07沉淀滴定08氧化还原滴定09托盘天平10量筒11容量瓶12移液管13滴定管14锥形瓶15温度计16液氧及其性质17用高锰酸钾制取氧气18用氯酸钾制取氧气19用过氧化氢制取氧气20用过氧化钠制取氧气21过氧化钠与水反应生成物的探究22氧气与木炭反应23氧气与铁丝反应24氧气与红磷反应25氧气与白磷反应26氧气与硫反应27测量气体体积的方法28锌与浓硫酸反应29锌与浓硝酸反应30锌与稀硫酸反应31钠与稀盐酸反应32锌与稀盐酸反应33锡与稀盐酸反应34铝与氧氧化钠溶液反应35硅与氧氧化钠溶液反应36启普发生器37制取氢气的装置(1)38氢气的收集(排气法)39氢气的收集(排水法)40氢气的除杂41氢气的除杂与干燥42氢气的验纯43制取氢气的装置(2)44氢气还原氧化铜45氢气还原四氧化三铁46氢气的趣味实验(1)47氢气的趣味实验(2)48实验室制取二氧化碳49二氧化碳的检验50碳酸钠与稀硫酸反应51碳酸氢钠与稀硫酸反应52灭火器原理53家庭实验碱面与醋酸反应54呼吸过程中二氧化碳含量比较55二氧化硫实验室制法56二氧化硫的其它制法57二氧化硫化学性质58二氧化硫和硫化氢反应59亚硫酸钠与硫化钠反应60硫的歧化与反歧化61干冰的气化62二氧化碳不支持燃烧63镁在干冰中燃烧64三氧化硫的制备65浓硫酸的性质(1)吸水性66浓硫酸的性质(2)脱水性67浓硫酸的性质(3)强氧化性68浓硫酸与氯化钠反应69浓硫酸与溴化钠反应70浓硫酸与碘化钾反应71浓硫酸与稀硫酸的鉴别72浓硫酸与纤维素反应73浓硫酸与蔗糖反应74.氯气的制备和收集75.氯气的除杂与干燥76.氯气的检验77.氯气的其它制法(1)78.氯气的其它制法(2)79.生活实验84消毒液洁侧灵混合80.新制氨水成分的确定81.红色酚酞褪色原因研究82.氢气在氯气中燃烧83.氯气与氢气混合爆炸84.红磷在氯气中燃烧85.白磷在氯气中燃烧86.钠在氯气中燃烧87.铁与氯气反应88.铜与氯气反应89.氯气与色素反应(1)90.氯气与色素反应(2)91.氢气在溴蒸汽中的燃烧92.溴离子、碘离子的氧化顺序93.氯气的液化94.氯化氢的喷泉实验95.氯化氢的实验实制法96.氯化氢气体的验满97.防止倒吸的装置98.氯化氢的其它制法99.工业合成氯化氢的原理100.干湿氯化氢气体性质的比较101.氨气的实验室制法102.实验室制取氨气的其它方法(1)103.实验室制取氨气的其它方法(2)104.实验室制取氨气的其它方法(3)105.喷泉实验(1)106.喷泉实验(2)107.喷泉实验(3)108.氨气与氯气反应109.氨气还原氧化铜110.氨气催化氧化111.氨气在氧气中燃烧112.如何制备纯净的一氧化氮113.一氧化氮实验实制法114.电弧法制一氧化氮115.一氧化氮和氧气混合气体被水吸收116.硝酸盐的分解117.二氧化氮实验实制法118.二氧化氮和溴蒸气的检验(1)淀粉碘化钾试纸检验119.二氧化氮和溴蒸气的检验(2)水洗法120.二氧化氮和溴蒸气的检验(3)用硝酸银溶液检验121.二氧化氮和溴蒸气的检验(4)用四氯化碳检验122.浓、稀硝酸与指示剂的反应123.浓、稀硝酸与金属铜反应124.浓、稀硝酸与金属铝反应125.浓硝酸与木炭反应126.浓硝酸与硫粉反应127.钠与其主要化合物的转化关系图128.钠与水反应130.钠与硫酸铜溶液反应131.钠与氯化铁溶液反应132.钠与无水乙醇反应133.钠与苯酚反应134.钠与冰醋酸反应135.钠与氧气反应136.过氧化钠与二氧化碳反应137.过氧化钠与水反应历程探究138.碳酸氢钠转化为碳酸钠139.碳酸钠转化为碳酸氢钠140.铁与其主要的化合物的转化关系图141.铁与稀硫酸反应142.铁与硫酸铜溶液反应143.硫化氢的检验144.铁与高价铁离子氧化还原反应145.铁与浓硫酸反应146.三氯化铁水解平衡移动研究147.高价铁离子与亚铁离子互变148.亚铁离子转化为高价铁离子149.氢氧化亚铁的制备150.二价铁离子与三价铁离子的鉴别(1)苯酚法151.二价铁离子与三价铁离子的鉴别(2)碱液法152.二价铁离子与三价铁离子的鉴别(3)淀粉碘化钾试纸法153.二价铁离子与三价铁离子的鉴别(4)高锰酸钾法154.铝及其化合物的关系图155.铝与氧气反应156.毛刷实验158.铝与PH=2的盐酸、醋酸反应159.铝与氢氧化钠溶液反应160.铝热反应161.三氧化二铝的两性162.氢氧化铝的两性163.氯化铝溶液与碳酸氢钠溶液反应164.氯化铝溶液与氢氧化钠溶液反应165.氯化铝溶液与氨水反应166.偏氯酸钠的性质实验167.甲烷的实验室制法168.甲烷的可燃性169.甲烷的爆炸实验170.甲烷在氯气中燃烧171.乙烯的制备172.乙烯的加成反应173.乙烯的氧化反应174.乙烯与溴的反应探究175.甲烷的取代反应176.乙炔的实验室制法177.电石气成分的研究178.乙炔的性质179.乙炔的燃烧180.乙炔的爆炸181.氧炔焰产生高温182.苯的溶、沸点183.回流装置的选择184.苯的燃烧185.苯的溴代反应186.苯的硝化反应187.苯与氯气的加成188.苯与甲苯的鉴别189.苯酚的溶解性190.苯酚的弱酸性191.苯酚的取代反应192.苯酚的显色反应193.酚醛树脂的制备194.乙醇与钠的反应195.乙醇的酯化反应196.乙醇的催化氧化反应197.酯化反应的简易装置198.乙醇的氧化反应199.乙醇的取代反应200.葡萄糖燃烧实验201.葡萄糖与镁粉反应202.葡萄糖的性质203.葡萄糖的碳化204.葡萄糖酸的制备205.葡萄糖酸锌、葡萄糖酸钙的制取206.葡萄糖二酸的制备207.葡萄糖二酸亚铁的制备208.葡萄糖与镁粉反应209.葡萄糖的银镜反应210.葡萄糖与新制氢氧化铜的反应211.浓度对化学反应速率的影响212.温度对化学反应速率的影响213.浓度对化学平衡移动的影响214.压强对化学平衡移动的影响215.温度对化学平衡移动的影响216.原电池原理217.电解氢氧化钾溶液218.电解氯化铜溶液219.电解氯化钠溶液220.电镀221.中和热的测定222.溶解度的测定223.硫酸铜晶体里结晶水含量的测定。
高中化学实验目录及常用药品列表

氯化亚铁(aq)
氯水(新制)
HCl、HClO、Cl2等 KClO3
氯酸钾(s)
镁带(s)
Mg
钠(s) 泥水(或用粉笔末+水) 硼酸(饱和) 品红(aq) 葡萄糖(s) 葡萄糖(10%) 氢氧化钡(s) 氢氧化钠(0.01M) 氢氧化钠(0.1M) 氢氧化钠(0.55M) 氢氧化钠(10%)
Na
H3BO3 C6H12O6 C6H12O6 Ba(OH)2 NaOH(又称火碱、烧碱) NaOH(又称火碱、烧碱) NaOH(又称火碱、烧碱) NaOH(又称火碱、烧碱)
Na2CO3(又称苏打、纯碱) Na2CO3(又称苏打、纯碱) NaHCO3(又称小苏打) NaHCO3(又称小苏打) Fe Fe Fe K3[Fe(CN)6] Cu Cu 淀粉
淀粉酶
HNO3 HNO3 NH4NO3 KNO3 Sr(NO3)2 AgNO3 AgNO3 Zn Zn
锌粒(s) 锌片
新制石灰水 溴的四氯化碳溶液 溴化钾(s) 溴化钠(aq) 溴化铜(s) 溴水 亚硫酸钠(s) 盐酸(0.1M) 盐酸(0.5M) 盐酸(1M)
【B1-2-K】胶体的制备及性质(丁达尔效应)【B23-5/6】糖类和蛋白质的特征反应、糖类水解 【B1-2-1/2/3】离子反应及其发生的条件【X3-21/2/3】配合物、铜氨络合物的生成和性质、硫氰 化铁配离子的颜色 【B2-2-4】铜锌原电池(选用)【X4-4-1】铜锌原电 池 【X4-4-1】铜锌原电池 【B1-3-9/10】铁的氢氧化物制取、三价铁离子的 检验和氧化性 【B1-3-K/4】铝箔氧化,铝与盐酸、NaOH的反应 【B1-3-K/4】铝箔氧化,铝与盐酸、NaOH的反应【 B2-1-K】同周期金属元素性质的递变【B2-2-1/2/3 】金属与酸、氢氧化钡与氯化铵、酸碱中和反应中 的能量变化 【B2-4-1】铝热反应 【X4-3-K】探究盐溶液的酸碱性 【B2-2-1/2/3】金属与酸、氢氧化钡与氯化铵、酸 碱中和反应中的能量变化 【X4-3-3/4/5】沉淀的溶解与转化 【B1-1-1/2】粗盐的提纯、硫酸根离子的检验【 B1-2-1/2/3】离子反应及其发生的条件 【B1-3-5/6/K】过氧化钠、碳酸钠和碳酸氢钠的性 质,焰色反应 【X4-3-K】探究盐溶液的酸碱性 【X4-3-3/4/5】沉淀的溶解与转化 【B1-4-6】氯离子的检验【X4-3-3/4/5】沉淀的溶 解与转化 【X4-4-K】验证牺牲阳极的阴极保护法 【B1-2-1/2/3】离子反应及其发生的条件【X4-3-K 】探究盐溶液的酸碱性 【X4-4-3】铁的吸氧腐蚀【实验室制取氯气】 【B1-1-5】一定物质的量浓度溶液的配制【X3-21/2/3】配合物、铜氨络合物的生成和性质、硫氰 化铁配离子的颜色 【X4-4-2】电解氯化铜溶液 【B1-3-5/6/K】过氧化钠、碳酸钠和碳酸氢钠的性 质,焰色反应【X3-2-1/2/3】配合物、铜氨络合物 的生成和性质、硫氰化铁配离子的颜色 【B1-3-9/10】铁的氢氧化物制取、三价铁离子的 检验和氧化性 【B1-3-9/10】铁的氢氧化物制取、三价铁离子的 检验和氧化性【B1-4-3/4/5】氢气在氯气中燃烧, 氯水、氯气的漂白作用【B2-1-1】卤素单质间的置 换反应 【B2-4-1】铝热反应
高中化学实验目录大全

高中化学实验目录大全化学实验是高中化学课程不可或缺的重要组成部分,通过实验可以帮助学生理解化学知识、锻炼实验操作技能,提高科学思维和实验能力。
下面是一份高中化学实验目录大全,供广大同学参考。
一、物质的性质与变化1. 实验目的:了解物质的物理性质和化学性质,通过实验判断物质是否发生化学反应。
2. 实验内容:(1)观察和测量不同物质的物理性质,如颜色、透明度、硬度、密度、溶解度等。
(2)观察化学反应过程中产生的气体、热量、颜色、光线等现象,判断反应是否发生。
(3)进行物质的化学分离和纯化实验,如过滤、结晶、蒸馏等。
3. 实验器材:试管、试剂、加热器、玻璃棒等。
4. 实验注意事项:(1)实验前应对实验器材做好消毒、清洁和干燥处理,并佩戴实验手套、护目镜等防护用品。
(2)实验过程中应注意实验室卫生和安全,保持实验环境整洁有序。
二、电解质的电离与导电性1. 实验目的:了解电解质的电离性质,掌握电流强度、电阻和电位差的关系,研究溶液的导电性。
2. 实验内容:(1)测试电解质和非电解质的导电性,比较它们之间的差异。
(2)通过改变电池电压和电流强度,测量电解质的电离度,探究其影响因素。
(3)研究不同浓度的电解质和饱和溶液之间的电导率变化规律。
3. 实验器材:导电仪器、电极、电池、溶液等。
4. 实验注意事项:(1)实验前应检查导电仪器和电池的正常运行状态,并正确安装电极。
(2)实验过程中应保持电解质溶液密闭、温度稳定,避免玻璃器皿破裂等安全事故。
三、气体的制取和性质1. 实验目的:研究气体的制取、性质和应用。
2. 实验内容:(1)制取氢气、氧气、氮气等常见气体,掌握其制备方法和实验操作技巧。
(2)测定气体的密度、颜色、气味和燃烧性质,区分不同气体。
(3)研究气体的溶解度和扩散速率等性质。
3. 实验器材:气体收集装置、气压计、加热器、反应瓶等。
4. 实验注意事项:(1)实验前应检查实验器材的完整性和使用方式,并做好防护措施。
高中化学实验目录

高中化学实验目录1. 实验名称:溶液的稀释实验目的本实验旨在通过稀释溶液来探究浓度的变化对溶液性质的影响。
实验原理稀释是指通过加入溶剂来使溶液的浓度减少的过程。
溶液稀释的数学关系可以用以下公式表示: C1V1 = C2V2 (其中C 表示浓度,V表示体积)材料和设备•目标溶液 20mL•稀释溶剂•称量瓶•称量器具•烧杯实验步骤1.准备20mL的目标溶液。
2.使用称量器具将一定体积的目标溶液放入称量瓶中。
3.加入适量的稀释溶剂,使溶液的浓度减少。
4.使用烧杯等容器接收溶液。
5.记录所加入的溶剂体积。
6.计算最终溶液的浓度。
实验结果与分析通过实验可以得出,稀释溶液的浓度与所加入溶剂的体积是成反比的关系。
浓溶液的稀释可以使溶液的颜色淡化,同时也可以降低溶质的反应活性。
实验注意事项•实验过程中要注意安全,避免溶液的飞溅。
•操作时要准确称量,避免测量误差对实验结果的影响。
•不可将实验物品带离实验室。
2. 实验名称:酸碱滴定实验目的本实验旨在探究酸碱滴定过程中反应的特点,以及滴定溶液的浓度计算。
实验原理酸碱滴定是一种定量分析方法,通过滴定剂逐滴加入被测溶液中,直到溶液发生颜色变化或指示剂变色为止。
滴定过程中,当反应达到等当点时,被测溶液中的反应物的浓度可以根据滴定剂的浓度计算得出。
材料和设备•碱滴定剂•酸溶液(被测溶液)•指示剂•滴定管•烧杯•手套实验步骤1.将酸溶液放入烧杯中。
2.加入适量的指示剂,使溶液的颜色变化。
3.将烧杯放在白色背景下以便更好地观察颜色变化。
4.使用滴定管逐滴加入碱滴定剂,同时搅拌溶液。
5.当溶液的颜色发生明显变化时,立即停止滴定,并记录滴定剂的用量。
实验结果与分析通过酸碱滴定实验可以确定被测溶液中的酸碱度,最终根据滴定剂的用量可以计算出被测溶液中反应物的浓度。
滴定过程中,滴定剂与被测溶液发生定量反应,滴定终点的颜色变化为指示剂的颜色变化。
实验注意事项•滴定时要缓慢滴加滴定液,避免过量使用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
饱和食盐水
科学探究:用实验验证牺牲阳极的阴极保护法
烧杯、电流表、导线、锌(Zn)片、铜(Cu)片、
硫氰化钾溶液、3%NaCl溶液
实验2-1温度、浓度对化学平衡的影响
烧杯、两烧瓶NO2和N2O4的混合气体,热水、冰水(或冷水
试管;0.01mol /L氯化铁溶液和1mol/L氯化铁溶液;0.03mol /L硫氰化钾溶液和1mol/L硫氰化钾溶液,
科学探究:催化剂对反应速率的影响
试管、烧杯、过氧化氢溶液(5%)、0.1mol/l氯化铁溶液、CuSO4溶液;高锰酸钾酸性溶液(0.01mol/l)
草酸溶液(0.1mol/l)、MnSO4固体;淀粉、碘水、2mol/lH2SO4
实验3-1强弱电解质的比较
试管、滴管、PH试纸
醋酸溶液(1mol/L)、盐酸(1mol/L)、镁条
CuCl2溶液饱和NaCl溶液
实验1-3、电镀
铜的精炼
U形管、石墨棒、铜(粗)棒、铜棒、锌(Zn)片
CuSO4溶液ZnSO4溶液
实验1-4、锌铜原电池原理
烧杯、电流表、导线、盐桥
锌(Zn)片、铜(Cu)片、ZnSO4溶液、CuSO4溶液
科学探究:制作原电池
砂纸、滤纸、导线、灵敏电流表、食盐水
实验1-5、铁的吸氧腐蚀实验
实验3-3沉淀溶解平衡
试管、胶头滴管、烧杯、玻璃棒
氢氧化镁固体、盐酸、氯化铵溶液
实验3-4沉淀的转化
试管、胶头滴管、0.1mol/l硝酸银溶液、0.1mol/l碘化钾溶液、0.1mol/l硫化钠溶液、0.1mol/l氯化钠溶液
实验3-5沉淀的转化
试管、胶头滴管、0.1mol/l MgCl2溶液
2mol/NaOH溶液、0.1mol/l FeCl3溶液
溴乙烷、氢氧化钠、试管、烧杯、碳棒高锰酸钾酸性溶液、导气管
第三章烃的含氧衍生物
第一节醇酚
P51乙醇的消去反应
蒸馏烧瓶、锥形瓶、温度计、酒精灯、铁架台、石棉网、锥形瓶、牛角管、铁圈、乙醇、氢氧化钠、浓硫酸、溴的四氯化碳、高锰酸钾酸性溶液、试管
P52重铬酸钾酸性溶液与乙醇的反应
重铬酸钾酸性溶液、乙醇、试管
第四章生命中的基础有机物
第一节油脂
P80实验4-1葡萄糖的银镜反应
银氨溶液、葡萄糖溶液、氢氧化钠10%、硫酸铜5%、试管、烧杯、酒精灯、滴管、试管夹
第二节糖类
P82探究蔗糖、麦芽糖的水解
蔗糖、硫酸、麦芽糖,水浴装置,
P83:科学探究:设计实验探究淀粉水解
试管、胶头滴管
第三节蛋白质和核酸
P89;蛋白质的性质:实验4-2:盐析实验
实验2-5温度对反应速率的影响
试管、烧杯、0.1mol/lNa2S2O3溶液、
0.1mol/lH2SO4热水、冰水
科学探究:温度对反应速率的影响
试管、烧杯、1mol/lKI溶液、0.1mol/lH2SO4淀粉溶液
实验2-6催化剂对反应速率的影响
锥形瓶、双孔胶塞、短导管、漏斗、木条、过氧化氢溶液(10%)、氯化铁溶液、洗涤剂、二氧化锰固体、
普通高中实验教科书《化学》选修5实验
章
节
实验名称
所需主要仪器、试剂及器材
第一章认识有机化合物
第四节研究有机物的步骤和方法
P17实验1-1.蒸馏实验
蒸馏烧瓶、冷凝管、接引管(尾接管)、锥形瓶、温度计、酒精灯、铁架台、石棉网、锥形瓶、的重结晶
圆底烧瓶、冷凝管、漏斗、烧杯、酒精灯、三角架、玻璃棒、粗苯甲酸
P53苯酚的性质
苯酚、盐酸、氢氧化钠、试管、试管架
P54苯酚与溴水反应
苯酚、溴水、试管、试管架
第二节醛
P57实验3-1;乙醛与银氨溶液的反应
2%AgNO3溶液、2%稀氨水、乙醛稀溶液试管、烧杯、酒精灯、滴管
P57实验3-2;乙醛与氢氧化铜溶液的反应
氢氧化钠10%、硫酸铜2%、乙醛、试管、烧杯、酒精灯、滴管、试管夹
第二章烃和卤代烃
第一节脂肪烃
P32实验2-2乙炔的制取和性质
圆底烧瓶、试管、试管架、滴管、分液漏斗、铁架台、石棉网、铁圈、试管夹、饱和食盐水、硫酸铜溶液、电石、高锰酸钾、溴的四氯化碳
第二节芳香烃
P38:实验2-2;苯、甲苯与高锰酸钾溶液反应
高锰酸钾酸性溶液、苯、甲苯、小烧杯、试管
第三节卤代烃
P42:实验2-3;溴乙烷与氢氧化钠反应
实验3-2强弱电解质的比较
试管、滴管、铁架台(附铁夹)
CH3COOH溶液(0.1mol/L)、NaCO3溶液、NH3·H2O
科学探究:
盐溶液的酸碱性
pH试纸、试管、玻璃棒、酚酞溶液、石蕊溶液、氯化钠溶液、碳酸钠溶液、氯化铵溶液、醋酸钠溶液、碳酸氢钠溶液、硫酸钠溶液、硫酸铵溶液
科学探究:影响盐类水解的因素、氯化铁的水解实验
pH计、烧杯、试管、酒精灯、氯化铁溶液(0.1mol/l)、水、硫酸铁溶液(0.1mol/l)、硫酸溶液(6mol/l)
实践活动:
酸碱中和滴定
酸式滴定管、碱式滴定管、PH计、锥形瓶、烧杯、锥形瓶、铁架台、滴定管夹、盐酸溶液(0.1000mol/l)、氢氧化钠溶液(0.1000mol/l)、酚酞溶液、蒸馏水
酝酿铅、鸡蛋清、试管、烧杯、、滴管、试管夹
P90实验4-4;颜色实验蛋白质的颜色反应
浓硝酸、鸡蛋清、试管、烧杯、、滴管、试管夹
第五章进入合成有机高分子化合物时代
第二节应用广泛的高分子材料
P108酚醛树脂的制备
苯酚、40%甲醛、浓盐酸、水浴装置、玻璃棒、试管、烧杯、、滴管、试管夹、乙醇
高中化学选修4实验
实验名称
实验仪器、试剂
实践活动;中和反应反应热的测定
大烧杯(500 ml)、小烧杯(100 ml)、量筒(50 ml)、温度计、环形玻璃搅拌棒、硬纸板、泡沫、泡沫塑料板、纸条、0.5 mol/L盐酸、0.55mol/LNaOH溶液
实验1-2、电解饱和NaCl的溶液
U形管、石墨棒、铜棒、电流表、KI淀粉试纸酚酞溶液
实验2-2压强对化学平衡的影响
针管; NO2和N2O4的混合气体
实验2-3化学反应速率
锥形瓶、分液漏斗、注射器、铁架台(附铁夹)、导管、Zn粒、1mol/LH2SO4、4mol/LH2SO4
实验2-4浓度对反应速率的影响
试管、烧杯、高锰酸钾溶液(0.01mol/l)、
草酸溶液(0.1mol/l)草酸溶液(0.2mol/l)
