2 腐蚀电池
第2章腐蚀电化学原理简介PPT课件

腐蚀反应中释放的化学能又是从何而来的?
形成腐蚀电池确实对腐蚀有加速作用。在腐蚀控制工作中仍 然要注意防止形成腐蚀电池,或减小腐蚀电池的推动力。
Zn+2H+→Zn2++H2↑
电流的流动
金属中:电子从阳极流向阴极。
形 溶液中:离子迁移。阳离子从阳极区向阴极区迁移,阴离子从
成
阴极区向阳极区迁移。
回 路
阳极:发生氧化反应
阴极:发生还原反应
中国民航大学 理学院 2010/8/14
5
A
k
e
-
+
化学 Zn
Cu
势能2H+
Zn2+
SO42-
电池工作的推动力是电池反应的化学势能,即反应物和反应 产物之间的化学势差。
化学势能与构成电池的两个电极的电位差成正比。
ΔrGm=-nFE
中国民航大学 理学院 2010/8/14
6
2.1 腐蚀电池
-+
Zn Cu e
Zn2+
2H+ SO42-
◦ 把Zn-Cu原电池短路,电池仍可以持续工作。
电池工作的结果仅造成Zn被溶解(腐蚀),不能输出有用的 电功
形成了腐蚀原电池(可简称腐蚀电池)。电化学腐蚀是以腐 蚀电池工作的方式完成的
中国民航大学 理学院 2010/8/14
10
2.1 腐蚀电池
2.1.2 腐蚀电池的类型
◦ 按组成腐蚀电池的阴极、阳极的大小:
宏观腐蚀电池:阳极区和阴极区尺寸较大,区分明显,多数 情况下肉眼可辨。
腐蚀电池形成的原因

腐蚀电池形成的原因腐蚀电池是指电池在使用过程中,由于各种原因导致电池内部产生腐蚀现象。
腐蚀电池的原因可以分为以下几个方面。
电池的使用时间过长是导致电池腐蚀的主要原因之一。
电池内部的化学反应会随着时间的推移而逐渐加速,导致电池的寿命减少。
当电池使用时间过长时,电池内部的化学物质会发生变化,产生腐蚀现象。
电池的存放环境也会影响电池是否发生腐蚀。
如果将电池放置在潮湿的环境中,电池的外壳容易受到腐蚀。
潮湿的环境会导致电池外壳上的金属部分与空气中的氧气发生反应,产生金属氧化物,从而引起腐蚀。
电池的使用条件也会对电池是否发生腐蚀起到一定的影响。
例如,当电池在高温环境中使用时,电池内部的化学反应速度会加快,从而加速了电池的腐蚀过程。
同样地,当电池在低温环境中使用时,电池的化学反应速度会减慢,延缓了电池的腐蚀过程。
电池的质量也会影响电池是否腐蚀。
低质量的电池往往在制造过程中掺杂了一些杂质,这些杂质会导致电池内部产生腐蚀现象。
因此,选购优质的电池对于避免电池腐蚀是非常重要的。
不正确的使用方法也可能导致电池腐蚀。
例如,当电池的正负极放置不正确时,电池内部的化学反应会受到干扰,从而导致电池腐蚀。
此外,如果电池被错误地连接到电器设备上,也会导致电池腐蚀。
为了避免电池腐蚀,我们可以采取一些预防措施。
首先,我们应该注意电池的使用时间,及时更换老化的电池。
其次,我们应该将电池存放在干燥的环境中,避免电池受潮。
此外,我们还应该避免将电池暴露在高温或低温环境中,避免电池受到过度的温度影响。
另外,我们应该选择优质的电池,避免使用低质量的电池,以减少电池腐蚀的风险。
最后,我们在使用电池时要遵循正确的使用方法,确保电池的正负极正确连接,并正确地安装到电器设备中。
电池腐蚀的原因主要包括电池使用时间过长、存放环境潮湿、使用条件过热或过冷、电池质量低劣以及不正确的使用方法等。
为了避免电池腐蚀,我们应该注意电池的使用时间和存放环境,选择优质的电池,并遵循正确的使用方法。
腐蚀电池的工作原理

腐蚀电池的工作原理
腐蚀电池的工作原理是阳极过程和阴极过程的结合。
在阳极过程中,金属以离子形式溶解进入溶液,同时等量的电子留在金属表面。
这些电子通过电子导体向阴极区迁移,即发生氧化反应。
在阴极过程中,电解质溶液中的物质捕获电子形成新的物质,即发生还原反应。
这个过程可以是氧气、氢气或铁离子等的还原。
腐蚀电池的形成是由于金属表面吸附的水膜溶解了空气中的CO₂、NO₂、SO₂等气体,形成了电解质溶液,而金属表面不纯,如铁中含有的石墨、渗碳体或其它杂质,它们大多数没有铁活泼。
这样形成的腐蚀电池的阳极为铁,而阴极为杂质。
当金属表面某些区域主要发生阳极反应,而其它区域主要发生阴极反应时,就形成了腐蚀电池。
阳极反应是导致金属材料破坏的主要原因,因此常采用外接电源或用导线将另一块电极电位较低的金属与被保护金属相连接,以使腐蚀发生在电位较低的金属上。
第二章 金属腐蚀电化学理论基础

(Pt (镀铂黑)H2(1atm), H+(aH+=1)) 标准氢电极的电极反应为 (Pt) H2 = 2H+ + 2e 规定标准氢电极的电位为零。以 标准氢电极为参考电极测出的电位值 称为氢标电位,记为E(vs SHE) 。 SHE是最基准的参考电极,但使用 不方便,实验室中常用的参考电极有:
1.宏观腐蚀电池
铜铆钉
1. 异种金属相接触 如 电偶腐蚀。 2. 浓差电池 (1)金属离子浓度不同, 浓度低电位低,容易腐蚀。 (2)氧浓度不同 氧浓度低电位低,更容易腐蚀。 3. 温差电池 如金属所处环境温度不同, 高温电位低,更容易腐蚀。
铝板
粘 土
沙 土
2. 微观腐蚀电池 (1)材料本身的不均匀性
也可以简单地说,绝对电极电位是电子导体和离子导体接 触时的界面电位差。
双电层:
由于金属和溶液的内电位不同,在电极系统的金属相和
溶液相之间存在电位差,因此,两相之间有一个相界区,叫做
双电层。 电极系统中发生电极反应,两相之间有电荷转移,是形成 双电层的一个重要原因。 例如:Zn/Zn2+,Cu/Cu2+ 。
腐蚀原电池产生的电流是由于它的两个电极在电解质中的 电位不同产生的电位差引起的,该电位差是电池反应的推动力。 构成腐蚀原电池的基本要素(*) • • • • 阳极 阴极 电解质溶液(*) 电池反应的推动力-电池两个电极的电位差
电流流动:在金属中靠电子从阳极流向阴极;在溶液中靠离 子迁移;在阳、阴极区界面上分别发生氧化还原反应,实现电子 的传递。 从金属腐蚀历程也可看出化学腐蚀与电化学腐蚀的区别。
盐水滴实验
3%NaCl+铁氰化钾+酚酞
腐蚀电池简介

(阳极)Zn I H2SO4 I Cu(阴极)
腐蚀电池与原电池的比较:
相同点:都有阴(正)极,阳(负)极,都有电子通道 和离子通道;
不同点:原电池不短路,电化学能做有用功, 腐蚀电池短路,不可做有用功,转换为热能。
腐蚀电池的三个必要条件:
(1)存在电位差,要有阴极、阳极存在,阴极 电位总比阳极电位正; (2)要有电解质溶液存在,溶液中有氧化剂 (根本原因); (3) 在腐蚀电池的阴、阳极之间要有连续传递 电子的回路。
b 氧浓差电池 由于金属与含氧量不同的溶液相接触而引起的电位差 所构成的腐蚀电池。 造成缝隙腐蚀的主要因素,危害性大。 O2+2H2O+4e → 4OH- (阴极反应)
氧的分压越高,电极电位越高。
介质中溶解氧浓度越大,氧电极电 位越高;而氧浓度较小处则电极电位 较低称为腐蚀电池的阳极。
(2)微观腐蚀电池类型-电化学不均匀性
(1)金属化学成分不均匀
(2)金属组织结构不均匀
(3)金属表面的物理状态不均匀
(4)金属表面膜的不完整
3 腐蚀电池类型
根据构成腐蚀电池的电极尺寸大小,可以把腐蚀 电池分为两类:
(1)宏观腐蚀电池——电极尺寸相对较 大(肉眼可以分辨阴极和阳极) (2)微观腐蚀电池——电极尺寸微小 (电化学的不均匀性是基本原因)
(1)宏观腐蚀电池类型
①电偶电池 两种具有不同电极电位的金属在同一电介质中相接触, 铜铆钉 即构成电偶电池(Galvanic Cell)。 铝板 ②浓差电池 同一种金属浸入不同浓度的电介质中,或者虽在同 一电介质中但局部浓度不同,都可形成浓差电池。 a 金属离子浓差电池
原电池的来源:
1800 年, Volta发现用一对锌盘和银盘固定在含有盐水的硬纸板上, 当用双手接触锌盘和银盘时,感觉有微电流通过。 1836年,英国化学家Daniel 发明以其名字命名的丹尼尔电池
腐蚀电池

化学成分不均匀性
浓差电池
腐蚀形态 是局部腐 蚀,腐蚀 破坏主要 集中在阳 极区。
金属组织不均匀性
微电池的阴、阳极位置 不断变化,腐蚀形态是 全面腐蚀;阴、阳极位 置固定不变,腐蚀形 态是局部腐蚀。
温度腐蚀电池
物理性质或状态的 不均匀性
电解池阳极腐蚀电池
金属表面膜不完 整
(一)宏观电池
1.两种不同金属构成的电偶电池
实质是浸在电解质溶液中的金属表面上,形成了以金属阳极溶解,
腐蚀剂发生阴极还原的腐蚀电池。绝大多数情况下,这种电池是短了路
的原电池。
化学腐蚀与电化学腐蚀的比较
化学腐蚀和电化学腐蚀一样,都会引起金属失效。在化 学腐蚀中,电子传递是在金属与氧化剂之间直接进行,没
有电流产生。而在电化学腐蚀中,电子传递是在金属和溶
倘若铜作为杂质分散地分布在锌中,就会形成许许多多微小的腐蚀 电池,称为腐蚀微电池。
产生的电流是由于它的两个电极即锌板与铜板在硫酸溶液中的电位不同 产生的电位差引起的,该电位差是电池反应的推动力。
在生产实践中,要想使整个金属的物理和化学性质、金属各部位所接 触的介质的物理和化学性质完全相同,使金属表面各点的电极电位完全相 同是不可能的。由于种种因素使得金属表面的物理和化学性能存在着差异, 使金属表面上各部位的电位不相等,我们把这些情况统称为电化学不均匀 性,它是形成腐蚀电池的基本原因。
4.金属表面膜不完整形成的微观电池
金属的表面一般都存在一层初生膜。如果这种膜不完整、有缝隙或破 损,则孔隙或破损处的金属相对于表面膜来说,电极电位较负,成为微 电池的阳极,故腐蚀将从这里开始。这是导致小孔腐蚀和应力腐蚀的主 要原因。
酸溶液接触的一端因其电极电位较负,作为电池的阳极将遭受腐蚀。而在
腐蚀电池形成的原因

腐蚀电池形成的原因腐蚀电池是指电池内部的活性物质与电池外部的介质发生化学反应,导致电池性能下降甚至无法正常工作的现象。
腐蚀电池主要由以下几个原因引起:1. 导电介质的侵入:电池通常由正极、负极和电解质组成。
当电池的外壳或密封件出现破损时,导电介质(如水、酸、碱等)可能会进入电池内部。
这些导电介质会与电池内部的活性物质发生反应,导致腐蚀现象的发生。
2. 极化反应:在电池工作过程中,正极和负极会发生氧化还原反应,产生电流。
但是,由于某些因素(如过高的电流、温度等),电池内部的活性物质无法完全参与反应,形成了未参与反应的过剩物质。
这些过剩物质会与电池内部的其他物质发生反应,引发腐蚀现象。
3. 电极材料的选择:电池内部的电极材料对电池的性能和寿命有很大影响。
如果电极材料选择不当,容易被外界介质腐蚀,导致电池性能下降。
例如,铁电池在潮湿环境下容易发生腐蚀。
4. 电池的使用环境:电池在不同的环境中工作时,可能会受到温度、湿度、气体等因素的影响。
当电池暴露在高温、高湿度或有害气体的环境中时,这些因素会加速电池内部的腐蚀过程。
5. 电池的老化:随着电池使用时间的增长,电池内部的活性物质会逐渐消耗和分解,导致电池性能下降。
同时,电池的外壳和密封件也会随着时间的推移而老化,导致电池更容易受到外界介质的腐蚀。
为了减少电池的腐蚀现象,可以采取以下措施:1. 选择合适的电池类型:不同类型的电池有不同的腐蚀特性。
在选择电池时,应根据使用环境和需求选择合适的电池类型,以减少腐蚀的可能性。
2. 保持电池干燥:电池对湿度非常敏感,因此在存储和使用电池时,应尽量减少与水和湿度接触的机会。
可以使用密封的电池盒或包装来保护电池免受湿度的影响。
3. 避免过高的温度:高温环境会加速电池内部的化学反应,导致腐蚀现象的发生。
因此,在使用电池时,应尽量避免将电池暴露在高温环境中。
4. 定期更换电池:电池随着时间的推移会逐渐老化,因此应定期更换电池,以确保电池的正常工作和减少腐蚀的可能性。
腐蚀电池

纯锌与含铜锌在HCl溶液中的腐蚀比较
下一页
返回
腐蚀电池的特点:
1. 阳极反应都是金属的氧化反应,造 成金属材料的破坏。 2. 反应最大限度的不可逆。 3. 阴、阳.阳极反应
通式:Me→Men++ne 产物有二种: 可溶性离子,如Fe-2e=Fe2+ 不溶性固体,如2Fe+3H2O=Fe2O3+6H++6e
2.阴极反应
通式:D+me=[D.me]
常见的去极化剂(氧化剂)是 H+和O2 2H++2e=H2
析氢腐蚀或氢去极化腐蚀
O2+4H++4e=2H2O
(酸性溶液中)
O2+2H2O+4e=4OH-(中性或碱性溶液中)
3.电流回路
金属部分:电子由阳极流向阴极 溶液部分:正离子由阳极向阴极迁移
返回
腐蚀电池的种类
大电池(宏观腐蚀电池):
指阴极区和阳极区的尺寸较大,区分明显。 类型: 1. 电偶腐蚀电池 2. 氧浓差电池 3. 活态-钝态腐蚀电池 ★大电池的腐蚀形态是局部腐蚀,腐蚀破坏主 要集中在阳极区。
微电池(微观腐蚀电池):
指阳极区和阴极区尺寸小,很难区分。 ★★形态:
①微电池的阴、阳极位置不断变化时, 腐蚀形态是全面腐蚀; ②阴、阳极位置固定不变,腐蚀形态是 局部腐蚀。 返回
环境方面
金属离子浓度差异 氧浓度的差异 温度差异
“亚微观”不均匀
腐蚀电池形成原因举例
钢 铝 渗碳体 新管道 新管道
铁
(a)不同金属组合
(b)金属中含杂项
(c)表面状态不同
应力集中 砂土
腐蚀电池ppt课件

可编辑课件PPT
6
形成腐蚀电池的原因
金属方面
□成分不均匀 □表面状态不均匀 □组织结构不均匀 □应力和形变不均匀 □“亚微观”不均匀
环境方面
◇金属离子浓度差异 ◇氧浓度的差异 ◇温度差异
可编辑课件PPT
7
腐蚀电池形成原因举例
钢 铝
渗碳体
新管道
新管道
(a)不同金属组合
应力集中
铁
(b)金属中含杂质
粘土
20
若阴、阳极直接交界,那么难溶性沉积物即可在直接靠近金属表面处形成较 紧密的、具有一定保护性的氢氧化物保护膜粘附在金属上。对于阴极呈细微 夹杂物的形式而散布在阳极基体上的金属(例如锌中含有杂质Cu),当它腐 蚀时可形成能覆盖相当部分金属表面的腐蚀次生产物的沉积膜。这种膜在一 定程度上可阻滞腐蚀过程的进行。因此,倘若能变更腐蚀的次生过程产物组 成,就能变更膜的性质,尤其是保护性质。腐蚀过程的许多特点是与膜的性 质变化有关。
可编辑课件PPT
32
4.金属表面膜不完整形成的微观电池
金属的表面一般都存在一层初生膜。如果这种膜不完整、有缝隙或破损 ,则孔隙或破损处的金属相对于表面膜来说,电极电位较负,成为微电 池的阳极,故腐蚀将从这里开始。这是导致小孔腐蚀和应力腐蚀的主要 原因。
可编辑课件PPT
23
腐蚀电池的种类
区指
分阴
明极 大显区 电。和 池阳 (极 宏区 观的 腐尺 蚀寸 电较 池大 ),
异金属接触电池
浓差电池
腐蚀形态 是局部腐 蚀,腐蚀 破坏主要 集中在阳 极区。
温度腐蚀电池
电解池阳极腐蚀电池
可编辑课件PPT
指
阳
微极 电区 池和 (阴 微极 观区 腐尺 蚀寸 电小 池, )很
腐蚀 第2章 腐蚀热力学
Fe Fe2++2e
i corr
lg i
平衡电位 – 热力学, E0 H2/H+ , E0 Fe/Fe2+ …. 非平衡电位 – 动力学/测量, 腐蚀电位,混合电位或偶合电位
2.2 金属在介质中的腐蚀倾向
2.2.1 腐蚀倾向热力学判断
从热力学可知,判断化学变化的方向和限度,对于不同 的条件,有不同的热力学判据。 对于孤立体系可用熵变判据; 对于等温等容下的体系,可用亥姆霍兹自由能判据; 在等温等压条件下,可用吉布斯自由能判据: 自发过程
+
i — i 组分内电位 i — i 组分外电位 I — i 组分表面电位
i= i + i 电功 i
相
当两相电化学位相等,电化学平衡建立:
Me Men+ + ne 对应电位差为平衡电极电位
Fe Fe 2+ + 2e Fe 2+ + 2e Fe
电荷平衡: ia = ic 物质平衡: M = Mn+
化学热力学- 化学位不同 相间粒子转移,粒子自发地从高化学位相转入低化学 位相,直到两相化学位相等。 iI = 0 在电场作用下,两相电化学位不同 相间粒子转移,带电粒子自发的从高电化 学位相转入低电化学位相,直到两相的电化学位相等。 iI = 0 电化学位与化学位关系: i= I + nFI = 化学功 + 电功
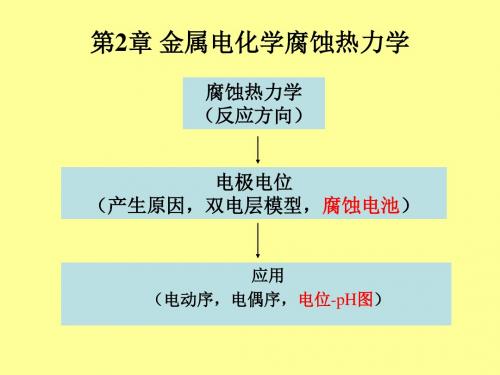
腐蚀热力学 (反应方向) 电极电位 (产生原因,双电层模型,腐蚀电池)
应用 (电动序,电偶序,电位-pH图)
2.1 电极体系和电极电位
2.1.1 双电层
腐蚀总是发生在相间界面,重要概念-电极电位,即电极各 相间电位差之和。双电层普遍存在-相间电位差本质原因
电化学腐蚀原理与防护方法

一电化学腐蚀原理1.腐蚀电池(原电池或微电池)金属的电化学腐蚀是金属与介质接触时发生的自溶解过程。
在这个过程中金属被氧化,所释放的电子完全为氧化剂消耗,构成一个自发的短路电池,这类电池被称之为腐蚀电池。
腐蚀电池分为三(或二)类:(1)不同金属与同一种电解质溶液接触就会形成腐蚀电池。
例如:在铜板上有一铁铆钉,其形成的腐蚀电池。
铁作阳极(负极)发生金属的氧化反应:Fe→Fe2++2e-;(Fe→Fe2++2e)=-0.447V.阴极(正极)铜上可能有如下两种还原反应:(a)在空气中氧分压=21kPa时:O2+4H++4e-→2H2O;(O2+4H++4e-→2H2O)=1.229V,(b)没有氧气时,发生2H++2e-→H2;(2H++2e-→H2)=0V,有氧气存在的电池电动势E1=1.229-(-0.447)=1.676V;没有氧气存在时,电池的电动势E2=0-(-0.447)=0.447V。
可见吸氧腐蚀更容易发生,当有氧气存在时铁的锈蚀特别严重。
铜板与铁钉两种金属(电极)连结一起,相当于电池的外电路短接,于是两极上不断发生上述氧化—还原反应。
Fe氧化成Fe2+进入溶液,多余的电子转向铜极上,在铜极上O2与H+发生还原反应,消耗电子,并且消耗了H+,使溶液的pH值增大。
在水膜中生成的Fe2+离子与其中的OH—离子作用生成Fe(OH)2,接着又被空气中氧继续氧化,即:Fe2++2OH-→Fe(OH)24Fe(OH)2+2H2O+O2→4Fe(OH)3 Fe(OH)3乃是铁锈的主要成分。
这样不断地进行下去,机械部件就受到腐蚀。
(2)电解质溶液接触的一种金属也会因表面不均匀或含杂质微电池。
例如工业用钢材其中含杂质(如碳等),当其表面覆盖一层电解质薄膜时,铁、碳及电解质溶液就构成微型腐蚀电池。
该微型电池中铁是阳极:Fe→Fe2++2e-碳作为阴极:如果电解质溶液是酸性,则阴极上有氢气放出(2H++2e-→H2);如果电解质溶液是碱性,则阴极上发生反应O2+2H2O+4e-→4OH-。
【金属腐蚀与防护】2腐蚀电池

(1)阴极极化控制:Pc >> Pa , R可以忽略 (2)阳极极化控制:Pa>> Pc , R可以忽略 (3)欧姆电阻控制:R >>Pa , Pc
用Evan极化图表示各种因素对腐蚀电流的影响
E E Eoc
E
Pc
Eoa
Icor
I
Icor
Icor
I
(a)阳极初始电位负移 E E
(b)阴极初始电位正移 E
Eoc Ec 是阴极极化曲线的斜率 的绝对值, Icor 叫阴极极化率,记为 Pc,表示阴极反应的阻力 。
Ea Eoa 是阴极极化曲线的斜率 的绝对值, Icor 叫阳极极化率,记为 Pa,表示阳极反应的阻力 。
Ec Ea 是回路的欧姆电阻R,它包括金属和溶液部分的电阻。 Icor
Eoc Eoa Icor Pa Pc R
铜 铜
粘土
(d)应力及形变差异
(e)氧浓度差异
(f)金属离子浓度差异
腐蚀电池的种类
大电池(宏观腐蚀电池):指阳极区和阳极 区的尺寸较大,区分明显,肉眼可辩。 微电池(微观腐蚀电池):指阳极区和阴极 区尺寸小,肉眼不可分辨。 ★大电池的腐蚀形态是局部腐蚀,腐蚀破坏主 要集中在阳极区。 ★★如果微电池的阴、阳极位置不断变化, 腐蚀形态是全面腐蚀;如果阴、阳极位置固 定不变,腐蚀形态是局部腐蚀。
3.腐蚀电池的阴、阳极短路(即短路的原电 池),电池产生的电流全部消耗在内部,转 变为热,不对外做功。
腐蚀电池的构成
(b)Zn块和Cu块直 接接触(短路)
(a)Zn块和Cu块通过 导线联接
(c)Cu作为杂质分布 在Zn表面
A
K
Zn
Cu
腐蚀电池的必备条件

腐蚀电池的必备条件嘿,你知道腐蚀电池是啥不?这玩意儿可神奇啦!腐蚀电池可不是随随便便就能形成的,那得有必备条件呢。
先说说啥是腐蚀电池。
就好比一个小怪兽,专门搞破坏,让金属啥的慢慢被腐蚀掉。
那它咋出现的呢?得有几个关键条件。
一个条件就是得有不同的电极。
这就像两个人,性格不一样,一个胆大一个胆小。
在腐蚀电池里,不同的电极就有不同的电位,这电位差就是腐蚀电池的动力源。
没有这不同的电极,腐蚀电池可就玩不转啦。
你说是不是很神奇?要是都一样,那哪来的动力去搞腐蚀呢?还有啊,得有电解质。
电解质就像是腐蚀电池的游乐场,让那些小电荷们能在里面欢快地跑来跑去。
没有电解质,电荷们就没地方玩啦,腐蚀电池也就没戏唱了。
你想想,要是没有游乐场,小朋友们得多无聊啊。
腐蚀电池也一样,没了电解质,就没了活力。
再有呢,得有电子导体。
这电子导体就像是高速公路,让电子能快速地跑来跑去。
要是没有电子导体,电子就像在小路上走路,慢吞吞的,腐蚀电池也发挥不出威力。
这就好比你要去一个地方,走高速和走小路,那速度能一样吗?另外,腐蚀得在一个合适的环境里。
要是环境不合适,腐蚀电池也不好使。
比如说温度太高或者太低,湿度太大或者太小,都可能影响腐蚀电池的形成。
这就像人一样,得在合适的环境里才能舒服地生活。
腐蚀电池也有它的“小脾气”呢。
你可能会问,那这些条件少一个行不行?那肯定不行啊!就像一辆汽车,少了一个轮子还能跑吗?腐蚀电池也一样,缺了哪个条件都不行。
而且啊,这些条件还得配合好。
不同的电极得产生足够的电位差,电解质得够“活泼”,电子导体得畅通无阻,环境也得恰到好处。
只有这样,腐蚀电池才能发挥出它的威力。
那腐蚀电池有啥危害呢?它能让金属生锈、损坏设备,给我们的生活带来很多麻烦。
不过,我们也可以想办法防止腐蚀电池的形成。
比如给金属涂上保护层,让电解质没那么容易接触到金属;或者控制环境,让腐蚀电池没那么容易形成。
腐蚀电池的形成需要不同的电极、电解质、电子导体和合适的环境。
腐蚀原电池

(e)初始电位差和阴~阳极 极化率共同影响
Eoc Ec Icor
是阴极极化曲线的斜率
的绝对值, 。
叫阴极极化率,记为
为记,率化极极阳叫 aoE aE rocI
Pc ,表示阴极反应的阻力
。力阻的应反极阳示表 , aP ,
率斜的线曲化极极阳是
Ec Ea Icor
是回路的欧姆电阻
R ,它包括金属和溶液部
分的电阻。
Icor
Eoc Eoa Pa Pc R
Eoc Ec Icor
是阴极极化曲线的斜率
的绝对值, 。
叫阴极极化率,记为
为记,率化极极阳叫 aoE aE rocI
Pc ,表示阴极反应的阻力
。力阻的应反极阳示表 , aP ,
率斜的线曲化极极阳是
Evans极化图的数学表达式
Eoc Eoa ( Eoc Ec Icor Ec Ea Icor Ea Eoa Icor ) Icor
•腐蚀电流
阳极电流:Ia 腐蚀电流:Icor Ia=Icor 在什么条件下相等? 法拉第定律:氧化或还原1摩尔的任何物质 所需要的电量为nF。
V
A nF
i cor
2 形成腐蚀电池的原因
金属方面 • 成分不均匀 • 组织结构不均匀 • 表面状态不均匀 • 应力和形变不均匀 • 热处理差异 环境方面 金属离子浓度差异 氧含量的差异 温度差异
r
A
K
高阻电压表
V
测Zn电极电 位的电路没 画出来
Zn
Cu
参比电极
K 开路时,i=0, Cu和Zn的电位分别为静止电位Eoc(Cu),Eoa(Zn)
K 闭路,电流通,r 减小, 电路欧姆电阻 R减小,电流 i 增大,Zn电位正移,Cu电位负移,
腐蚀电池形成的原因

腐蚀电池形成的原因腐蚀电池是指由于电池内部或外部环境中的化学反应导致电池内部金属元素被氧化或还原而失去活性,从而影响电池的性能和寿命。
腐蚀电池的形成原因主要包括以下几个方面。
首先,电池内部化学反应不平衡。
在正常使用过程中,电极和电解质之间会发生复杂的化学反应,这些反应可以产生一定量的气体、液体和固体产物。
如果这些产物不能及时排出,就会导致反应不平衡,进而促进腐蚀的形成。
例如,在铅酸蓄电池中,正极板上的硫酸铅晶体会逐渐形成,并随着时间推移扩散到整个正极表面。
如果这些晶体不能及时清除,则会阻碍正极上的化学反应,并最终导致正极板被氧化。
其次,外部环境因素影响。
许多因素都可能对电池产生负面影响,包括温度、湿度、空气中的氧化剂、光照等等。
当这些因素超出了电池的设计范围时,它们可能会促进电池内部化学反应的发生,导致腐蚀的形成。
例如,在铁镍电池中,如果电池暴露在潮湿的环境中,则会促进电极上的氧化反应,从而导致电极被腐蚀。
第三,使用不当。
使用不当也是导致电池腐蚀的主要原因之一。
例如,在锂离子电池中,如果充电过度或放电过度,则会导致正极和负极上的材料被氧化或还原,并最终导致腐蚀的形成。
此外,在存储和运输过程中,如果没有采取适当的措施保护电池,则它们可能会受到机械损伤、振动、压力、温度变化等影响,从而导致腐蚀。
最后,在某些情况下,特定类型的材料也可能对电池产生负面影响。
例如,在锌碳干电池中,如果阳极和阴极之间使用了不适当的隔离材料,则隔离材料可能会吸收水分并与阳极或阴极发生反应,从而导致腐蚀。
综上所述,电池的腐蚀形成是由于多种因素的复杂作用。
为了避免电池的腐蚀,我们应该采取适当的措施保护电池,并在使用和存储过程中遵守相关的安全规定和操作指南。
腐蚀电池的类型

[1]p31-34: 腐蚀电池的类型根据组成腐蚀电池的电极尺寸大小及阴、阳极区分布随时间的稳定性,并考虑到促使形成腐蚀电池的影响因素和腐蚀破坏的特征,一般可将腐蚀电池分为三大类:宏观腐蚀电池、微观腐蚀电池和亚微观腐蚀电池。
一,宏观腐蚀电池,这类腐蚀电池通常是指由肉眼可见的电极所构成,如图2—9所示。
这类腐蚀电池的阴极区和阳极区往往保持长时间的稳定,因而导致明显的局部腐蚀。
1.异金属接触电池。
不同的金属浸于不同的电解质溶液中,当电解液连通且两金属短路时,即构成宏观腐蚀电池,如图2—9(a)所示的短路丹聂尔电池,其中锌为阳极,被溶解,铜为阴极,溶液中的Cu2+离子在阴极上接受电子而被还原,析出铜。
不同的金属在同一电解液中相接触,即构成电偶电池(Galvanic Cell)。
实际上,金属结构中常出现不同金属相接触的情况,在电解液存在的情况下可形成宏观腐蚀电池。
这时,可观察到电位较负的金属(阳极)腐蚀加快,而电位较正的金属(阴极)腐蚀减慢,甚至得到完全保护。
构成这种腐蚀电池的两种金属电极电位相差愈大,可能引起的腐蚀愈严重。
这种腐蚀破坏称为电偶腐蚀(Galvanic Corrosion)或双金属腐蚀(Bimetallic Corrosion)。
例如,舰船的推进器是青铜制成的,如图2—9(b)。
舰船在海洋中,由于青铜的电位比钢制船壳的正得多,从而构成腐蚀电池。
钢制船壳成为阳极而遭到腐蚀。
再如,铝制容器用铜铆钉铆接时,当铆接处位于电解液中,由于铝的电位比铜负,便形成了腐蚀电池。
结果,铆钉周围的铝为阳极,遭到腐蚀,而铜铆钉为阴极,受到保扩。
2.浓差电池,同一种金属浸入不同浓度的电解液中,或者虽在同一电解液中但局部浓度不同,都可形成浓差腐蚀电池。
浓差腐蚀电池可分为金属离子浓差电池·(Metal Ion Concentration Cell)和差异充气电池(Differential Aeration Cell)或氧浓差电池(Oxygen Conce ntration Cell)。
详述腐蚀电池的性质及构成

6、船几种:
1.船体在初次涂装时由于其表面处理的不干净,存在残碱、残盐、残存氧化皮或锈斑 等而引起的破坏作用。
2.生物腐蚀。生物腐蚀是由海洋生物的船底附着引起的,这种腐蚀包括化学腐蚀和电 化学腐蚀两种。由于海洋生物在船底的附着,破坏了漆膜,造成钢板局部电化学腐蚀;由 于微生物的新陈代谢作用,分泌出具有侵蚀性的产物如CO2、NH4OH、H2S等以及其他有 机酸和无机酸引起钢板的腐蚀作用等。
5、说明什么叫钝化?
钝化是使金属表面转化为不易被氧化的状态,而延缓金属的腐蚀速 度的方法。另外,一种活性金属或合金,其中化学活性大大降低,而成 为贵金属状态的现象,也叫钝化。
钝化,金属由于介质的作用生成的腐蚀产物如果具有致密的结构,形 成了一层薄膜(往往是看不见的),紧密覆盖在金属的表面,则改变了 金属的表面状态,使金属的电极电位大大向正方向跃变,而成为耐蚀的 钝态。
相同点
1.均有氧化还原反应发生 2.均为自发反应
不同点
1.原电池的氧化还原反应是分开进行的,即阳 极氧化,阴极还原;而腐蚀电池则是在发生腐 蚀的位置同时同地进行反应 2.原电池是特殊的异相催化反应,受电极界面 双电层影响较大 3.原电池中物质进行转变过程中有电子通过外 电路
4、腐蚀电池的工作机理。
3.由于光照、温度、化学介质、磨损或机械损伤等某一原因引起的破坏。 4.介质渗透后使涂层下金属表面发生电化学腐蚀所引起的破坏。
船舶腐蚀防护措施
船舶的防护直接关系到船舶的使用寿命和航行安全。船舶的防护包括合理选材、合 理设计结构、表面保护(涂层保护、金属喷涂层、金属包覆层、衬里)、阴极保护等。 船体防护系统是保护船体免受腐蚀侵害的系统,主要有两大系统组成:防腐蚀涂漆系统 和外加电流或牺牲阳极的阴极保护系统。
2 腐蚀电池解析

W Q It
W ——阴极上析出物质的质量,单位:g; ——电化学当量,单位:克/库仑; Q ——电量,库仑; I ——电流,安培; t ——时间,秒。
电化学当量
在一个电极反应中,相当于1摩尔电子的参与反 应物的质量
M nF
F ——法拉第;M——原子量; n——化合价;
阳极极化:电位偏离初始电位正移。 阴极极化:电位偏离初始电位负移。
极化值
极化程度的大小用极化值表示,记为
E E E0
过电位
E Ee
a Ea Eea 0 c Ec Eec 0
极化曲线
极化曲线的绘制
Sa Sa
极化曲线的形状与电极面积无关, Sc 只取决于阳极反应和阴极反应的特征。 极化曲线的形状与电极面积有关, Sc 面积改变,极化曲线的形状也改变。
初生产物和次生产物都有可溶和不可溶性产物。
只有不可溶性产物,才能对金属产生保护作用。
2.2 腐蚀电池的形成原因
腐蚀电池的形成原因 腐蚀电池的种类 腐蚀电池的观察
腐蚀电池的形成原因
当金属设备和电解质溶液接触时,为什么 金属设备表面会形成腐蚀电池?
这是因为金属方面和溶液方面存在着电 化学不均一性,从而导致金属和溶液界面 不同部位出现电位差异。
腐蚀电池的观察 盐水滴实验
实验现象 阳极阴极的什么部位? 阳极阴极反应是什么? 用腐蚀电池理论解释实验现象。
高阻电压表
2.3 腐蚀电池的极化
极化现象 电流接通后,电池电动势降低的现象叫做极 化现象。
原电池的极化 对于化学电源,极化现象是有害的,需要 采取防护措施。
阳极极化和阴极极化
腐蚀电池的分类

●腐蚀电池的分类(1)宏观腐蚀电池1) 异种金属浸于不同的电解质溶液:(a)2) 电偶电池——异种金属在同一腐蚀介质中相接触(b)(c)3) 浓差电池:金属材料的电位与介质中金属离子的浓度C有关4) 温差电池:金属材料的电位与介质温度有关,浸入腐蚀介质中金属各部分,由于所处环境温度不同,可形成温差腐蚀电池(2)微观腐蚀电池1) 金属表面化学成分不均匀性而引起的微观电池2) 金属组织不均匀性构成的微观电池;多晶体:不锈钢产生晶间腐蚀;多相合金:金相照片的制定3) 金属表面物理状态的不均匀性构成的微观电池各部分应力分布不均匀或形变不均匀——导致腐蚀微电池。
变形大或应力集中的部位可能成为阳极而腐蚀。
钢板弯曲处、铆钉头部区域容易优先腐蚀4) 金属表面膜不完整构成的微观电池:无论是金属表面形成的钝化膜,还是镀覆的阴极性金属镀层,由于存在孔隙或发生破损,使得该处裸露的金属基体的电位较负,构成腐蚀微电池,孔隙或破损处作为阳极而受到腐蚀●平衡电极电位:是所有粒子在电极界面各相中的化学势相等,电极表面同时达到电荷和物质平衡时的电位。
●标准电极电位:在标准状态下(即参加电极反应物质的活度=1时),电极的平衡电位为标准电极电位。
纯金属浸于自身离子活度为1mol/L的溶液中的平衡电极电位即为标准电极电位。
●非平衡电极电位:当金属和电解质溶液建立的双电层的电极过程为不可逆时,其电极电位成为非平衡电极电位。
●1:根据热力学原理,可用吉布斯(Gibbs)自由能判据来判断腐蚀反应发生的方向和限度。
2:标准电极电位与腐蚀倾向:金属发生腐蚀的热力学条件:金属氧化反应的平衡电极电位低于氧化剂反应的平衡电极电位。
●平衡电极电位E和溶液pH的关系1.只与电极电位有关,而与溶液的pH无关这类反应的特点: 只有电子交换,不产生氢离子(或氢氧根离子)2. 只与pH有关,与电极电位无关;这类反应的特点: 化学反应,不涉及电子的得失,与电位无关3.既同电极电位有关,又与溶液pH有关;这类反应的特点: 电极反应,有H+(或OH-)参加电极反应●电位—pH图的应用(1)指出各种条件下稳态物质形式,判别金属腐蚀的倾向性;(2)指示控制腐蚀的途径。
腐蚀与防护答案

一、填空题2构成金属表面电化学不均一的主要原因①金属化学成分不均一、②组织结构不均一、③物理状态不均一、④表面膜不完整。
3.应力腐蚀发生条件a敏感材料合金易发生b特定的腐蚀介质c拉伸应力。
4.减缓磨损腐蚀的办法是合理设计结构及正确选材与表面处理及电化学保护。
5. 氧化膜要具有保护性必须满足的条件为①PBR值大于1;②膜具有良好的化学稳定性自愈能力强;③膜具有完整性致密、缺陷少;④具有一定的强度和塑性,与基体结合牢固。
6.提高钢的抗氧化性,采用合金化处理或在钢表面形成高熔点氧化物的途径。
8金属耐蚀合金化的途径有提高金属的热力学稳定性、减弱合金的阳极活性、减弱阴极过程和使合金表面生成电阻大的腐蚀产物膜。
9.用衬里作为防腐蚀,被粘物表面必须满足:有好的润湿性、表面有一定的粗糙度和表面清洁。
橡胶衬里整个过程的关键工序消除衬层鼓泡、硫化、衬贴。
11.阳极保护的主要控制参数有临界电流密度ib(致钝电流密度)、钝化区电位范围Ep~Eop和维钝电流密度ip。
12. 钛在王水、氯水中耐蚀是由于其具有很强的自钝性。
13. 高分子材料在溶剂中的溶解性能基本上遵循极性相近原则、溶度参数相近原则、溶剂化原则但聚四氟乙烯虽然也是非极性的,而对于任何极性或非极性的溶14.杂散电流引起的腐蚀破坏特点形成两个宏观腐蚀电池。
15.合金元素钼的耐蚀特点使合金耐还原性介质腐蚀和抗氯离子引起的点蚀。
16. 生产上为了降低维钝电流密度,常常采用涂料-阳极保护的联合保护。
15.均匀腐蚀速度表征法重量法、深度法、电流密度表征法,局部腐蚀速度表征法局部最大腐蚀深度或强度损失法。
20.涂料由成膜物质、颜料、稀释剂、助剂、分散介质组成。
21.金属产生剥蚀的条件:金属具有一定的层状晶粒结构,晶粒尺寸的长度、宽22. 阳极性镀层对基体的保护是机械保护和电化学保护作用共同作用的结果阴极性镀层的保护作用取决于镀层的完整性和厚度。
23.镁合金在海水中发生腐蚀时阴极去极化反应为氧去极化腐蚀。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(3)电流回路
金属部分:电子由阳极流到阴极 溶液部分:阳离子由阳极向阴极迁移,阴离子由阴
极向阳极迁移。
以上三个环节既相互独立,又彼此制约,其中任 何一个受到抑制,都会使腐蚀电池工作强度减少。
腐蚀电流—腐蚀速度的指标
法拉第第一定律:
在电解过程中,阴极上还原物质析出的量与所通过 的电流强度和通电时间成正比。
腐蚀电池的观察
盐水滴实验
实验现象 阳极阴极的什么部位? 阳极阴极反应是什么? 用腐蚀电池理论解释实验现象。
高阻电压表
2.3 腐蚀电池的极化
极化现象 电流接通后,电池电动势降低的现象叫做极 化现象。
原电池的极化 对于化学电源,极化现象是有害的,需要 采取防护措施。
阳极极化和阴极极化
(2)阳极极化值 Ea与阴极极化值Ec的绝对 值之和 Ea + Ec 等于多少? (3)如果阳极和阴极都不极化,电流表指示 应为多少?
(4)如果使用零电阻电流表,且溶液电阻可 以忽略不计,那么电流达到稳态后,阳极 与阴极的电位差Ec – Ea、阳极极化值与阴 极极化值的绝对值之和 Ea + Ec 等于 多少?电流表的指示又为多少?
Ecor
用上图装置测得的极化曲线(阴阳极面积不相等)
E0c
Ec
Ecor
Ea-Ec=IR
Ea
E0a I Imax I’max I
Evans极化图及其应用
阴极极化曲线 欧姆电阻产生的电 压降IcorR
Ec
Ea
阳极极化曲线
Icor (Icor)max
Evans极化图的数学表达式
第二章作业
2. 某腐蚀体系的参数为:
E 0a = -0.4V,E0c = 0.8V,Ecor = -0.2V。 当R = 0时,Icor = 10mA,该腐蚀电池属于 什么控制类型?如果欧姆电阻R = 90,那 么Icor =? 腐蚀电池又属于什么控制类型?
W Q It
W ——阴极上析出物质的质量,单位:g;
——电化学当量,单位:克/库仑;
Q ——电量,库仑; I ——电流,安培; t ——时间,秒。
电化学当量
在一个电极反应中,相当于1摩尔电子的参与反 应物的质量
M
nF
F ——法拉第;M——原子量; n——化合价;
在铜离子的电沉积过程中:Cu 2+ +2e→Cu,Cu 2+的当量即其 1/2摩尔质量,63.5/2克。
对于溶液中的离子,其当量即该离子的摩尔质量与其电荷数 的比值,如1当量的Ag+=118克;1当量的Al 3+ =27/3克。
法拉第第二定律
电解过程中,通过的电量相同,所析出或溶解 出的不同物质的物质的量相同。也可以表述为:电 解lmol的物质,所需用的电量都是l个“法拉第” (F),等于 96500 C 或者 26.8 A·h,即
(2)阴极反应 D me [D me]
D称为去极化剂。水溶液中常见的去极化剂(氧化 剂)是H+和O2
析 吸氢氧腐腐蚀 蚀: :或O或O22HH22OO2244HH2222eeHH22OO44HHee2244ee22HH
224OOO((H酸酸性性(中溶溶性液液或))碱性溶液) 4OH (中性或碱性溶液)
只有不可溶性产物,才能对金属产生保护作用。
2.2 腐蚀电池的形成原因
腐蚀电池的形成原因 腐蚀电池的种类 腐蚀电池的观察
腐蚀电池的形成原因
当金属设备和电解质溶液接触时,为什么 金属设备表面会形成腐蚀电池?
这是因为金属方面和溶液方面存在着电 化学不均一性,从而导致金属和溶液界面 不同部位出现电位差异。
1F 96500C 26.8(A h)
前提:如果阳极反应仅仅是金属的氧化反应,造 成金属的腐蚀破坏,那么阳极反应产生的电流Ia 就是金属的腐蚀电流Icor。即
Icor Ia
腐蚀电流密度icor为
icor
I cor S
S——试样暴露表面积,单位:m2
腐蚀电流密度与失重腐蚀速度V-的
什么是腐蚀电池 腐蚀电池的工作环节 腐蚀电流—腐蚀速度的指标 腐蚀过程的产物
腐蚀电池
金属材料在电解质溶液中发生的腐蚀属于电化学 腐蚀,这种腐蚀是通过在金属暴露表面上形成的 原电池来进行的,这种电池叫做腐蚀电池。
腐蚀电池的阳极上发生金属的氧化反应,从而导 致金属的破坏;阴极上发生某些物质的还原反应。
V W St
It I M
St S nF M
icor nF
当阳极反应还有其他物质的氧化反应,阳极的电流 密度大于腐蚀电流密度。在用ia计算失重腐蚀速度 必须注意这个问题。
腐蚀过程的产物
初生产物:阳极产物和阴极反应的生成物。 次生产物:初生产物迁移相遇发生反应形成的产物。
初生产物和次生产物都有可溶和不可溶性产物。
大电池(宏观腐蚀电池)
阳极区和阴极区尺寸较大,区分明显,重要 的有以下几类: 电偶腐蚀电池 氧浓差电池 活态-纯态腐蚀电池
微电池(微观腐蚀电池)
阳极区和阴极区的尺寸很小,很难区分 (称为微阳极和微阴极)。如金属材料中 的杂质,组织结构差异所形成的腐蚀电池 就属于微电池。显然,亚微观不均匀性形 成的腐蚀电池也是微电池。
阳极极化:电位偏离初始电位正移。 阴极极化:电位偏离初始电位负移。
极化值
极化程度的大小用极化值表示,记为
E E E0
过电位
E Ee
ac
Ea Ec
Eea Eec
0 0
极化曲线
极化曲线的绘制
Sa
Sc
极化曲线的形状与电极面积无关, 只取决于阳极反应和阴极反应的特征。
Sa
Sc
极化曲线的形状与电极面积有关, 面积改变,极化曲线的形状也改变。
教材P15 习题1,2 1. 将铜片和锌片插在3%NaCl 溶液中,测得铜
片和锌片未接通时的电位分别为 +0.05V和 –0.83V。当用导线通过电流表把铜片和锌 片接通,原电池开始工作,电流表指示的 稳定电流为0.15mA。已知电路的欧姆电阻 为200。 (1)原电池工作后阳极和阴极的电位差Ec – Ea = ?
金属方面的不均一性
金属材料的成分不均匀 金属表面状态不均匀 金属组织结构不均匀 应力和形变的不均匀 “亚微观”不均匀性
环境方面的不均匀性
金属离子浓度差异 溶解氧浓度差异 温度差异
腐蚀电池的种类
根据阳极区和阴极区的分布及相对大小,可 以将腐蚀电池分为两大类: 大电池(宏观腐蚀电池) 微电池(微观腐蚀电池)
腐蚀电池特点
✓ 阳极反应是金属的氧化反应,造成金属材 料的破坏
✓ 阴阳极是短路的,产生的电流转变为热, 不能对外做功。
✓ 反应是以最大限度的不可逆方式进行的。
腐蚀电池的工作环节
(1)阳极反应
Me Men ne
产物有两种,可溶性离子和不可溶性固体。 Fe 2H2O HFeO2 3H 2e 2Fe 3H2O Fe2O3 6H 6e Fe 2OH Fe(OH )2 2e
