高一化学化学反应中的能量变化
高一化学化学反应中的能量变化(20200806100033)

步步惊心未删节版
已知船舶排水量为18000t,GM=0.80m,横倾角为5°,则船舶的稳性力矩为kN•m。A.1255B.14345C.12312D.140724 下列各费用计算方法中,不属于索赔费用计算方法的是。A.实际费用法B.修正的实际费用法C.总费用法D.修正的总费用法 保管箱业务收费是按照什么标准收取?A、保管箱大小B、保管物品大小C、保管物品价值D、保管物品重量 简述国际单位制中基本单位的名称和符号。 肾血管性高血压时A.肾素活性增高,醛固酮分泌增多B.肾素活性增高,醛固酮分泌降低C.肾素活性降低,醛固酮分泌增多D.肾素活性降低,醛固酮分泌降低E.肾素活性正常,醛固酮分泌正常 下列关于医学心理学的表述不正确的是A.是一门交叉学科B.是医学的分支学科C.以维护和促进人类整体健康为目的D.以人作为主要研究和服务对象E.研究医学领域中的心理学问题 女,60岁,咳嗽、痰中带血,胸痛1个月,无明显发热。胸片发现,右下肺周边有一直径6cm的结节状阴影,首先应考虑为A.肺脓肿B.结核瘤C.周围型肺癌D.团块状矽结节E.转移性肺癌 目前Rb的治疗方法包括()A.冷冻B.外放射C.化疗D.巩膜表面放射敷贴治疗E.眼球摘出术 下列说法不正确的是。A.数学作业除了习题计算、解答与证明形式外,还可以考虑数学建模与数学实验报告等形式B.备课主要是备习题C.教学过程既包括教师教的过程,也包括学生学的过程D.教学评价既包括对学生学业成绩的评价,也包括对教师教学质量的评价 作为医学伦理学基本范畴的良心是指A.医学关系中的主体在道义上应享有的权力和利益B.医学关系中的主体在道义上应履行的职责和使命C.医学关系中的主体在道义上对周围人、事以及自身的内心体验和感受D.医学关系中的主体在对自己应尽义务的自我认知和评价E.医学关系中的主体在表现出行 法人或其他组织的作品,其著作权保护期为。A.作品首次发表后50年B.执笔者死后50年C.该法人或组织解体后50年D.该作品创作完成后50年 肿瘤发生发展的5个阶段不包括。A.癌前病变B.原位癌C.浸润癌D.早期浸润癌E.远处转移 错畸形全身危害性有A.影响颌面部的发育B.影响口腔健康C.影响口腔功能D.影响心理和精神健康E.影响容貌外观 女,68岁,有慢性咳嗽、喘息史15年,近日感冒后症状加重,查体:神志清楚,口唇紫绀,桶状胸,双肺叩诊过清音,呼吸音减低,动脉血气分析:PaO55mmHg、PaCO45mmHg,经过治疗后病情缓解。此病人出院后,不适宜采用的治疗是A.吸入支气管扩张剂B.作腹式呼吸,加强膈肌运动C.家庭氧疗 关于蓄电池安装的表述,不正确的是。A.蓄电池安装前,应对外观进行检查B.蓄电池槽应无裂纹、损伤,槽盖应密封良好C.对于固定型开口式铅蓄电池的安装,要求蓄电池槽与台架之间应用绝缘子隔开,并在槽与绝缘子之间垫有铅质或耐酸材料的软质垫片D.蓄电池均应有略大于槽顶面的麻面玻璃 输尿管梗阻,在肾动态显像中的表现为()A.肾盂不显影B.肾盂影无扩大C.肾盂影消退快D.肾实质不显影E.肾盂影明显增浓 在单位银行结算账户的使用中,可用于办理存款人日常资金收付和工资、奖金等现金支取的账户是。A、专用存款账户B、基本存款账户C、一般存款账户D、临时存款账户 电力变压器按防潮方式分类,有。A.芯式变压器B.密封式变压器C.开放式变压器D.灌封式变压器 我国采用的压力单位是:A、每平方厘米千克力;B、毫米水柱;C、毫米汞柱;D、帕; 用白细胞过滤器去除悬浮红细胞中的白细胞的最佳时机是血液。A.运送至医院血库后B.在血站储存前C.发放至医院前D.在血站保存一段时间后E.临床使用前 精神发育迟滞的患病率约为A.0.01%B.0.05%C.0.5%D.1%E.5% [单选,共用题干题]某计算机的Cache采用相联映像,Cache容量为16KB,每块8个字,每个字32位,并且将Cache中每4块分为一组。若主存最大容量为4GB且按字节编址,则主存地址应为(1)位,组号应为(2)位。若Cache的命中率为0.95,且Cache的速度是主存的5倍,那么与不采用Cache相比较 智能建筑的安全防范系统,其出入口控制系统的传感与报警单元部分,除包括传感器、探测器外,还包括。A.门禁控制器B.处理器C.按钮D.保护隔离器 产褥中暑的首选治疗是A.远离高温和不通气环境,迅速降温B.输液C.维持水、电解质平衡D.按摩四肢E.冰水、乙醇等擦浴 设备故障、检修停机报告审批制度中关于故障停机恢复时间是怎样规定的? 盾构法的主要施工步骤包括()。A.工作井建造B.掘进出土(泥)C.管片安装D.地表注浆E.衬砌背后注浆 经研究,安氏Ⅲ类骨性畸形的咀嚼效能比正常减少A.20%B.30%C.60%D.55%E.40% 下列各项,不是望舌临床意义的是。A.判断正气盛衰B.分辨病位深浅C.区别病邪性质D.推断病势进退E.预测疾病预后善恶 厂内机动车辆 支气管哮喘与心源性哮喘不同点在于。A.慢性、阵发性、季节性发作史B.呼气性呼吸困难C.肺部听诊哮鸣音D.心脏无特殊体征E.咳粉红色泡沫痰 检查粪便原虫包囊,常见的染色方法A.碘染色B.巴氏染色C.H-E染色D.复红染色E.苏丹Ⅲ染色 两极策略将组合中债券的到期期限。A.向左平移B.向右平移C.集中于波峰和波谷D.集中于两极 在信号微机监测系统中电源相序监测是由转换单元监测的。A、J1B、J3C、J6D、J7 深部痛的特点是A.位于粘膜B.性质为锐痛C.定位明确D.主要由C类无髓神经纤维传导E.较局限 以下哪种物质为骨吸收促进因子,抑制骨胶原合成。A.前列腺素B.白细胞介素C.肿瘤坏死因子D.成纤维细胞生长因子E.以上都不是 合金铸铁按其使用性能可分为耐热铸铁、耐蚀铸铁、以及铸铁。A、耐磁B、耐磨C、耐低温D、可锻 炉渣泡沫化严重时,短时间可借助氧流压制泡沫和防止喷渣。A.降枪B.提枪C.枪位不变D.都不对 对于公路工程中出现的一般设计变更的审査,应由负责。A.建设单位B.设计单位C.监理单位D.交通行政主管部门 咽后隙与咽旁隙之间相隔的结构是:A.筋膜B.咽上缩肌C.翼内肌D.茎突咽肌E.疏松结缔组织 以下哪条不属于人体试验A.天然试验B.自我试验C.动物试验D.强迫试验E.志愿试验
【高中化学】第六章 第一节 化学反应与能量变化课件 高一下学期化学人教版(2019)必修第二册

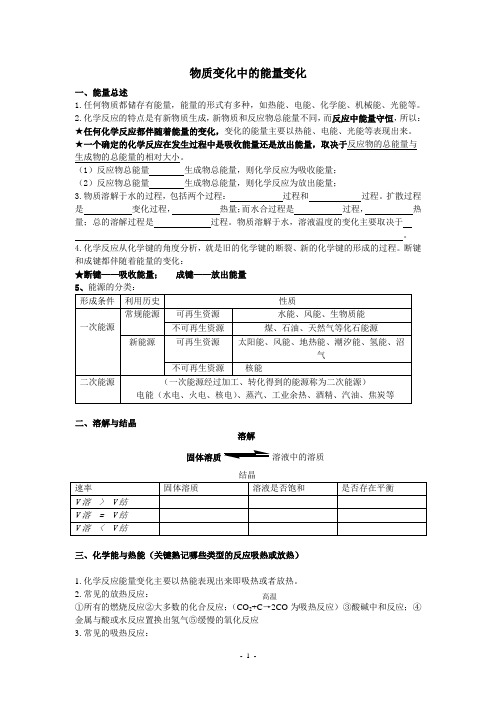
我国化石燃料和水电能源消耗构成图
2.1% 16.6%
5.1%
76.2%
请问家中烧煤烧柴是为了得到CO2吗?
你知道吗?
煤、石油、天然气的主要化学成分是烃类等有机物(煤中含 有大量的碳),它们燃烧时放出热能。你一定想知道,这种能量 从何而来?它与化学物质和化学反应有什么关系?石灰石(主要成 分是碳酸钙)要经过高温煅烧才能变成生石灰,高温提供的热能 在石灰石的分解反应中起到什么作用?
b、形成化学键放出能量 在25℃和101kPa的条件下,由2molH原子形成1molH—H 键时会 向外界放出436KJ的热量。 键能:拆开1mol理想气体分子AB为中性气态原子A和B时,需要吸收 的能量。(单位:KJ/mol)
想一想 在25℃和101kPa的条件下,断裂1molH-H需要吸收436kJ能量,断裂 1molCl-Cl键需要吸收243kJ能量,形成1molH-Cl会放出431kJ能量, 通过计算说明化学反应H2+Cl2 == 2HCl是吸热反应还是放热反应。
化学反应 化学能
热能
吸热反应 放热反应
X能 光能
电能
原电池 电解池
热化学 电化学
3.吸热反应和放热反应
(1) 定义: 吸热反应:吸收热量的化学反应。 放热反应:放出热量的化学反应。
下面我们一起通过实验来认识和感受一 下化学能与热能的相互转化!
1.正误判断(正确的打“√”,错误的打“×”)
(1)化学键断裂需要吸收能量,化学键形成会放出能量。( √ ) (2)化学反应必然伴随能量变化。( √ ) (3)相同条件下由原子形成1 mol H—Cl键所放出的能量与断开1 mol H—
A.图a表示2 mol A2(g)与1 mol B2(g)的总能量大于1 mol C(g)的能量 B.图b中生成物比反应物稳定 C.图b可以表示钠和水的反应的能量变化 D.图a所示反应不需要加热就一定能发生,图b所示反应一定需要加热才能发生
化学反应中的能量变化3

例3:
下列说法正确的是
( CD )
A.需要加热才能发生的反应一定是吸热
反应
B.放热的反应在常温下一定易进行
C.反应是放热还是吸热由反应物与生成 物所具有的能量的相对大小决定.
D.吸热反应在常温下也能进行.
探索与总结
常见的放热反应和吸热反应
放热反应 燃料的燃烧 中和 反应 金属与 酸 物质氧化
一个化学反应的的过程,本质上就 是旧化学键断裂和新化学键形成的过 程。
2、化学反应中能量变化的主要原因
H2 + Cl2
点燃
= 2HCl
H—H Cl —Cl
断 开
吸 收 能
量
断 开
吸 收 能
量
·· ··
H· +
·C····l:
→的断裂和形成
3. 从化学键的观点来分析能量的变化
Q<0为吸热反应
例1、若反应物的总能量>生成物的总 能量,化学反应 放出 能量。
若反应物的总能量<生成物的总能量, 化学反应 吸收 能量。
例2、已知反应A+B=C+D为放热反应, 对该反应的下列说法中正确的是( C ) A.A的能量一定高于C B.B的能量一定高于D C.A和B的总能量一定高于C和D的总能量 D.该反应为放热反应,故不必加热就一
吸热反应
C+CO2 H2+CuO C+H2O Ba(OH)2.8H2O+NH4Cl CaCO3高温分解
探究二:化学反应的实质
以氢气在氯气中燃烧为例,用化学 键的观点分析反应的本质过程。
H2
H—H
断 开
+ Cl2
Cl —Cl
断 开
点燃
化学反应中的热量

反应物的总能量高
生成物的总能量高
放 热 反 应
生成物的总能量低
吸 热 反 应
反应物的总能量低
化学反应的过程,可以看成是能 量的“贮存”或“释放”的过程
常见的放热反应和吸热反应
放热反应 吸热反应
C+CO2
燃料的燃烧
中和反应
金属与酸
H2+CuO
C+H2O Ba(OH)2· 8H2O+NH4Cl
我国化石燃料和水电能源消耗构成图
生成物 反应物
吸 收 能 量
反应物
放 出 能 量
生成物
2.化学反应中的能量变化:通常表现为热量的变化
一.化学反应中的热量变化
3.放热反应和吸热反应 化学上把有热量放出的化学反应叫做放热反应。
化学上把吸收热量的化学反应叫做吸热反应。
4.反应热 化学反应过程中放出或吸收的热量 用△H表示,单位:kJ· mol-1
第二单元 化学反应中的热量
一.化学反应中的热量变化
江苏徐州矿务集团一中 高一化学备课组
化学化学变化中除有新物质生成外,必然 伴随有能量(热能、光能、电能)的变化。
的二 一 利 能是 是 用 量利 制 化 用取学 反物反 应质应 中、:
思考:请同学们列举你了解的在生活中应用到 的化学反应中的能量
实验方案
2.1%
16.6% 5.1%
76.2%
要有适当过量的空气 二、燃料的充分燃烧 燃料与空气要有足够 大的接触面积 空气不足,燃烧就不完全,浪费 ① 现今用的燃料是什么?主要是什么? 资源,产生的大量CO危害人体
健康;过量的空气会带走部分热 ② 燃料充分燃烧的条件有哪些? 量,同样造成浪费
③ 燃料燃烧时,空气不足或大大过量,分 将固体燃料粉碎,或 别会造成什么后果? 将液体燃料以雾状喷 出,以增大燃料与空 ④ 导致酸雨的主要原因之一是什么? 气的接触面 ⑤ 怎样高效、清洁地利用煤炭? 煤中所含硫在燃 ⑥ 怎样提高固体和液体燃料的燃烧效率? 烧时会生成SO2
高中化学化学反应的能量变化

高中化学化学反应的能量变化化学反应是物质转变的过程,其中涉及能量的吸收或释放。
在化学反应中,能量的变化可以通过热量的吸收或释放来衡量。
热量是物质内部分子的热运动的一种表现形式,它是化学反应的重要能量因素。
本文将探讨化学反应中的能量变化,以及与之相关的热化学方程式和各类化学反应类型的能量变化。
一、热化学方程式热化学方程式描述了化学反应中的能量变化情况。
在热化学方程式中,我们使用ΔH表示反应的焓变,即反应前后系统的能量变化。
例如,当燃烧甲烷(CH4)产生二氧化碳(CO2)和水(H2O)时,热化学方程式可以写为:CH4 + 2O2 → CO2 + 2H2O ΔH = -890.3 kJ/mol这里的ΔH = -890.3 kJ/mol表示每摩尔甲烷燃烧产生的热量为-890.3千焦耳。
负号表示燃烧过程是放热的,即释放能量。
二、吸热反应和放热反应基于ΔH的正负值,我们可以将化学反应分为吸热反应和放热反应。
1. 吸热反应:当化学反应吸收热量时,ΔH为正数。
这意味着反应物吸收了外界的热量,从而使反应产生的产物具有更高的能量。
吸热反应的一个例子是水的蒸发过程:H2O(l) → H2O(g) ΔH = +40.7 kJ/mol这里的ΔH = +40.7 kJ/mol表示每摩尔水蒸发所需的热量为40.7千焦耳。
正号表示蒸发过程是吸热的,即吸收能量。
2. 放热反应:当化学反应释放热量时,ΔH为负数。
这意味着反应物释放了能量,从而使反应产生的产物具有较低的能量。
放热反应的一个例子是燃烧反应:C(s) + O2(g) → CO2(g) ΔH = -393.5 kJ/mol这里的ΔH = -393.5 kJ/mol表示每摩尔氧化碳所释放的热量为393.5千焦耳。
负号表示燃烧过程是放热的,即释放能量。
三、化学反应的能量变化类型除了吸热反应和放热反应,化学反应还具有其他几种能量变化类型:1. 吸附反应:当反应物从溶液或气体中吸附到固体表面时,会释放出能量,这些反应通常是放热的。
专题05 化学反应中热量的变化情况判断与计算-高中新教材高一化学期末复习重点

高一化学期末复习重点专题05 化学反应中热量的变化情况判断与计算方法探究一、化学反应中能量变化的原因在化学反应中,从反应物分子转变为生成物分子,各原子内部并没有多少变化,但原子间的结合方式发生了改变。
在这个过程中,反应物分子中的化学键部分或全部遭到破坏,生成物分子中的新化学键形成。
物质在化学反应中发生能量变化的主要原因是化学键的断裂和形成。
利用化学键的能量变化计算化学反应中的能量变化如下:既可以利用所有化学键的键能计算具体反应中的能量变化,又可以根据化学反应中的能量变化计算某一个具体的化学键的键能。
计算公式:化学反应中的能量变化值=反应物的总键能−生成物的总键能。
计算出的数值如果为正值,意味着是吸热反应;计算出的数值如果是负值,意味着是放热反应。
归纳总结化学键的断裂与形成是化学反应中能量变化的根本原因。
(1)化学反应的本质是旧化学键的断裂和新化学键的形成。
(2)化学键的断裂吸收能量,化学键的形成要放出能量,吸收能量和放出能量的数值不相等就造成了化学反应过程中的能量变化。
(3)一个化学反应是吸热还是放热,在宏观上取决于反应物总能量和生成物总能量的相对大小,在微观上取决于旧化学键断裂所吸收的总能量和新化学键形成所放出的总能量的相对大小。
二、吸热反应和放热反应的判断1.吸热反应和放热反应的比较2.常见的吸热反应与放热反应3.吸热反应和放热反应的判断方法E1>E2反应吸收能量(吸热反应)E1<E2反应放出能量(放热反应)(1)根据反应物和生成物的总能量的相对大小判断——决定因素。
若反应物的总能量大于生成物的总能量,属于放热反应,反之是吸热反应。
(2)根据化学键断裂或形成时的能量变化判断——用于计算。
若断裂反应物中的化学键所吸收的总能量小于形成生成物中化学键所放出的总能量,属于放热反应,反之是吸热反应。
(3)根据反应物和生成物的相对稳定性判断。
由不稳定的物质(能量高)生成稳定的物质(能量低)的反应为放热反应,反之为吸热反应。
高一化学反应及其能量变化

离子方程式书写正误的判断
1.是否符合化学反应原理:
例 Fe+6H+=2Fe3++3H2↑(反应生成Fe2+而不生成Fe3+)
2、是否写清有关“分子”、“离子”、“↑”、“↓” 等: 例: 氢硫酸、次氯酸等弱酸与氢氧化钠溶液的反应, 氨水与盐酸的反应,错写为:H++OH-=H2O
3、是否配平:(原子数目、离子电荷数是否配平)
【练习】
2. 实现下列变化需加入氧化剂的是 ( A. HCl → Cl2 C. KCl → HCl A.一定被氧化
A )
B. HCl → H2 D.HCl → CO2
3. 某元素由化合态变为游离态(
C )
B. 一定被还原
C. 可能被氧化也可能被还原 D. 化合价降为0
【练习】
4.在反应SO2+2H2S==2H2O+3S↓中,氧化剂 D) 是( A.S B. H2O C. S D. SO2
C. G、Y、Z、W、X
D. Z、X、G、Y、W
守恒律
同一氧化还原反应中, 氧化剂还原剂得、失电子 的总数(化合价升、降的 总数)必定相等。
【练习】
15. 3个SO32-离子恰好将2个XO4-离子还原 本身被氧化生成3个SO42-,则X元素在生成 D 物中的化合价是( )
A. +1
B. +2
C. +3
⑵ 同一元素:
价态越高氧化性越强。如: Fe3+>Fe2+ 价态越低还原性越强。如:S2>S>SO2
【规律】高氧低还
【练习】
10. 在下列分子、原子、离子中,既有氧化 性又有还原性的是( D ) A. AI3+ B. ClC.Fe D. H2O2
高一化学反应中的能量变化

*溶解时的吸热放热问题
1. 强酸、强碱溶于水放热; CaO、Na2O溶于水放热;
2. NH4NO3溶于水吸热。
二、热化学反应方程式
CH4(g)+2O2(g) === CO2(g)+2H2O(l)+Q
要求: 1、注明物质的状态,
g —气态、l —液态、s —固态 2、写出吸收或放出的热量
例题:1、在同温、同压下,比较下列反 应放出热量Q1、Q2的大小
概念: 放热反应:化学上把有热量放出的
化学反应叫做放热反应。
包括: a.燃烧反应 b.金属和酸的反应 c.酸碱中和反应
吸热反应:化学上把吸收热量的化学 反应叫做吸 C == 2CO
b. 加热分解反应
c. Ba(OH)2.8H2O(晶体)与 NH4Cl(固体)搅拌的反应
状态相同,但数量后式仅是前 式的一半,释放的热量也应是 前式的一半,Q2<Q1
例题2:
12g石墨与O2反应生成CO2放出393.51KJ热量; 12g金刚石与O2反应生成CO2放出395.41KJ热量, 试比较,石墨与金刚石哪个稳定?
比较相同状态、相同数量的金刚石和 石墨,与O2完全反应,生成相同状态、 相同数量的CO2,金刚石释放出的热量 更多,说明金刚石具有的总能量高, 不稳定
S(g)+O2(g)=SO2(g)+Q1 S(S)+O2(g)=SO2(g)+Q2
两式数量相同,S由固态吸收热量转化为气 态,在氧化燃烧生成SO2。其放出热量的总 和小于由气态S直接燃烧所放出的热量
H2(g)+Cl2(g)=2HCl(g)+Q1 1/2H2(g)+1/2Cl2(g)= HCl(g)+Q2
【高中化学】化学键与化学反应中的能量变化 课件 高一下学期化学人教版(2019)必修第二册

H2
+
Cl2
H—H
Cl—Cl
点燃 2HCl 2 H—Cl
吸 断收 开能
量 2 H· +
吸 断收 开能
量 2 ·C····l
形成 放出能量
2H
C····l
·· ··
··
化学键的断裂和形成是物质在化学反应中发生能量变化的主要原因
在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需 的能量,称为A-B键的键能,用符号E表示,单位为kJ.mol-1。如不指明温度
,应为298.15K。键能越大,化学键越牢固,含该键的分子越稳定, 自身具有的能量越低。
H2
+
Cl2
点燃 2HCl
吸收
断 开
436kJ/mol பைடு நூலகம்量
2 H·
+
断 开
吸收 243kJ/mol
能量
2 ·C····l
形成 放出
2 H C····l
2×431kJ/mol能量
·· ··
··
反应中能量变化:436+243 - (2×431kJ)kJ = -183kJ
3. 已知反应: X+Y=M+N放出能量,下列说法正确的是( A. X的能量一定高于M B. Y的能量一定高于N C. X和Y的总能量一定高于M和N的总能量 D. 因为该反应为放出能量,故反应不必加热
C)
4. 金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石。已 知12g石墨完全转化为金刚石时,要吸收E kJ的能量,下列说法正确的是
A. 金刚石与石墨互为同位素( C )
B. 石墨不如金刚石稳定 C. 金刚石不如石墨稳定 D. 等质量的石墨与金刚石完全燃烧,石墨放出的能量多
高一化学知识点化学反应的能量变化

高一化学知识点化学反应的能量变化化学反应的能量变化是化学领域中的一个重要概念。
在化学反应过程中,物质发生了变化,并伴随着能量的吸收或释放。
本文将就化学反应的能量变化进行探讨,包括内能变化、焓变、化学反应热等方面。
一、内能变化内能是指系统中所有分子的总能量,包括分子的动能和势能。
化学反应发生时,反应物的分子结构被打破,新的化学键形成,导致内能的变化。
反应物与生成物之间的内能差称为内能变化(ΔU)。
化学反应的内能变化可以分为两种情况:吸热反应和放热反应。
1. 吸热反应:当反应物的内能大于生成物的内能时,化学反应需要从外界吸收热量才能进行。
这种反应产生吸热现象,即反应过程中会感觉到周围温度的升高。
吸热反应的内能变化为正值(ΔU > 0)。
2. 放热反应:当反应物的内能小于生成物的内能时,化学反应会释放出热量给周围环境。
这种反应产生放热现象,即反应过程中会感觉到周围温度的降低。
放热反应的内能变化为负值(ΔU < 0)。
二、焓变焓(H)是指化学反应过程中,物质所含的能量总量。
在常压下,反应物和生成物的焓差称为焓变(ΔH)。
焓变可以帮助我们了解反应过程中的能量变化情况。
与内能变化类似,焓变也可以分为吸热反应和放热反应。
1. 吸热反应:在吸热反应中,反应物的焓高于生成物的焓,化学反应需要吸收热量才能进行。
吸热反应的焓变为正值(ΔH > 0)。
2. 放热反应:在放热反应中,反应物的焓低于生成物的焓,化学反应会释放热量给周围环境。
放热反应的焓变为负值(ΔH < 0)。
焓变与内能变化之间存在关系:ΔH = ΔU + PΔV,其中P为常数,ΔV为体积变化。
三、化学反应热化学反应热是指在标准状态下,单位摩尔物质在化学反应中产生或吸收的热量。
通常用符号ΔH表示。
1. 焓变与化学反应热之间的关系在常压下,化学反应热等于焓变:ΔH = Q,其中Q为反应所吸收或释放的热量。
2. 化学反应热的测定方法化学反应热的测定可以通过热量计实验进行。
人教社高中化学必修三化学反应中的能量变化

第四节化学反应中的能量变化一、反应热前面我们主要介绍了氧化还原反应和离子反应中的物质变化。
在化学反应中,发生物质变化的同时,还伴随有能量变化,这种能量变化,常以热能的形式表现出来。
例如,在高一化学中,我们曾做过铝片与盐酸,以及氢氧化钡晶体与氯化铵晶体在迅速搅拌下反应的实验,前者反应时放出热量,为放热反应;后者反应时吸收热量,为吸热反应。
在化学反应过程中放出或吸收的热量,通常叫做反应热。
反应热用符号ΔH表示,单位一般采用kJ/mol。
许多化学反应的反应热是可以直接测量的,其测量仪器叫做量热计。
在中学化学中,一般研究的是在一定压强下,在敞开容器中发生的反应所放出或吸收的热量。
下面,我们试从微观的角度来讨论宏观反应热的问题。
实验测得1mol H2与 1mol Cl2反应生成2 mol HCl时放出 184.6 kJ的热量,这是该反应的反应热。
任何化学反应都有反应热,这是由于在化学反应过程中,当反应物分子间的化学键断裂时,需要克服原子间的相互作用,这需要吸收能量;当原子重新组合成生成物分子,即新化学键形成时,又要释放能量。
就上述反应来说,当1mol H2与1mol Cl2在一定条件下反应生成2 mol HCl时,1mol H2分子中的化学键断裂时需要吸收436 kJ的能量,1mol Cl2分子中的化学键断裂时需要吸收243 kJ的能量,而 2 mol HCl分子中的化学键形成时要释放 431 kJ/mol×2 mol=862 kJ的能量,如图3-6所示。
H 2(g)+Cl2(g)2HCl(g)的反应热,应等于生成物分子形成时所释放的总能量(862 kJ/mol)与反应物分子断裂时所吸收的总能量(679 kJ/mol)的差,即放出 183 kJ/mol的能量。
显然,这个分析结果与实验测得的该反应的反应热(184.6 kJ/mol)很接近(一般用实验数据来表示反应热)。
这说明该反应完成时,生成物释放的总能量比反应物吸收的总能量大,这是放热反应。
高一化学物质变化中的能量变化
物质变化中的能量变化一、能量总述1.任何物质都储存有能量,能量的形式有多种,如热能、电能、化学能、机械能、光能等。
2.化学反应的特点是有新物质生成,新物质和反应物总能量不同,而反应中能量守恒,所以:★任何化学反应都伴随着能量的变化,变化的能量主要以热能、电能、光能等表现出来。
★一个确定的化学反应在发生过程中是吸收能量还是放出能量,取决于反应物的总能量与生成物的总能量的相对大小。
(1)反应物总能量 生成物总能量,则化学反应为吸收能量;(2)反应物总能量 生成物总能量,则化学反应为放出能量;3.物质溶解于水的过程,包括两个过程: 过程和 过程。
扩散过程是 变化过程, 热量;而水合过程是 过程, 热量;总的溶解过程是 过程。
物质溶解于水,溶液温度的变化主要取决于 。
4.化学反应从化学键的角度分析,就是旧的化学键的断裂、新的化学键的形成的过程。
断键和成键都伴随着能量的变化:★断键——吸收能量; 成键——放出能量二、溶解与结晶溶解固体溶质溶液中的溶质三、化学能与热能(关键熟记哪些类型的反应吸热或放热)1.化学反应能量变化主要以热能表现出来即吸热或者放热。
2.常见的放热反应: ①所有的燃烧反应②大多数的化合反应;(CO 2+C →2CO 为吸热反应)③酸碱中和反应;④金属与酸或水反应置换出氢气⑤缓慢的氧化反应3.常见的吸热反应:高温(1)大多数的分解反应;(2)以下几个反应是吸热反应: ①Ba(OH)2·8H 2O+2NH 4Cl →2NH 3↑+BaCl 2+10H 2O ②CO 2+C====2CO ③C+H 2O →CO+H 2注意:有热量放出未必是放热反应,放热反应和吸热反应必须是化学变化。
某些常见的热效应:a 、 放热:①浓硫酸溶于水②NaOH 溶于水③CaO 溶于水,其中属于放热反应的是b 、 吸热:铵盐溶于水[练习]1、下列反应中,既属于氧化还原反应同时又是吸热反应的是( )A.Ba(OH)2.8H 2O 与NH 4Cl 反应B.灼热的炭与CO 2反应C.铝与稀盐酸D.H 2与O 2的燃烧反应2、已知反应X +Y →M +N 为放热反应,对该反应的下列说法中正确的是( )A. X 的能量一定高于MB. Y 的能量一定高于NC. X 和Y 的总能量一定高于M 和N 的总能量D. 因该反应为放热反应,故不必加热就可发生3、下列说法正确的是( )A. 物质发生化学反应都伴随着能量变化B .伴有能量变化的物质变化都是化学变化C .在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量D. 放热反应的发生无需任何条件四、化学能与电能1.原电池是将化学能直接转为电能的装置。
高一化学第六章化学反应与能量知识点和题总结
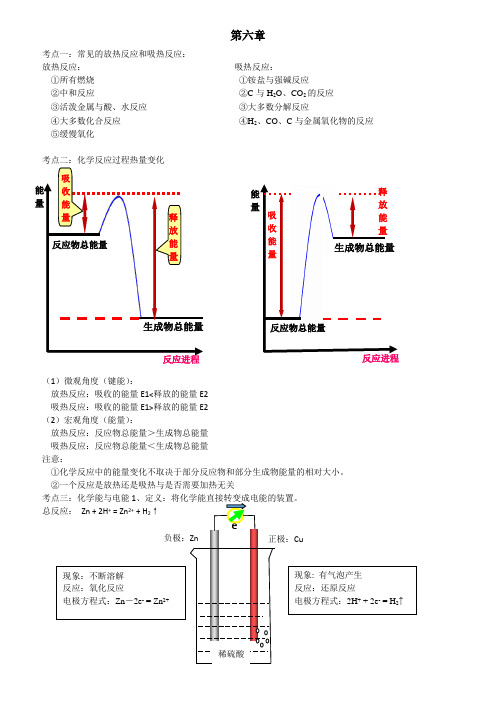
第六章考点一:常见的放热反应和吸热反应:放热反应: 吸热反应:①所有燃烧 ①铵盐与强碱反应②中和反应 ②C 与H 2O 、CO 2的反应 ③活泼金属与酸、水反应 ③大多数分解反应④大多数化合反应 ④H 2、CO 、C 与金属氧化物的反应 ⑤缓慢氧化考点二:化学反应过程热量变化(1)微观角度(键能):放热反应:吸收的能量E1<释放的能量E2 吸热反应:吸收的能量E1>释放的能量E2 (2)宏观角度(能量):放热反应:反应物总能量>生成物总能量 吸热反应:反应物总能量<生成物总能量 注意:①化学反应中的能量变化不取决于部分反应物和部分生成物能量的相对大小。
②一个反应是放热还是吸热与是否需要加热无关总反应: Zn + 2H + = Zn 2+ + H 2↑e - 反应物总能量生成物总能量 能量 反应进程 吸收能量 能量释放能量反应进程反应物总能量生成物总能量吸收能量释放能量稀硫酸负极:Zn 正极:Cu 现象:不断溶解 反应:氧化反应 电极方程式:Zn -2e - = Zn 2+ 现象: 有气泡产生 反应:还原反应 电极方程式:2H + + 2e - = H 2↑外电路:电子由负极经导线流向正极内电路:阳离子→正极;阴离子→负极2.形成原电池的条件(两极一液一回路):①两个活泼性不同的电极(金属与金属或金属与碳棒)②电解质溶液③形成闭合回路,自发进行的氧化还原反应3.氢氧燃料电池:(1)酸性燃料电池:负极:2H2-4e-= 4H+ 正极:O2 +4e- + 4H+= 2H2O(2)碱性燃料电池:负极:2H2 + 4OH- - 4e- = 4H2O 正极:O2 + 2H2O + 4e- = 4OH-总反应:2H2 + O2 =2H2O4.甲烷燃料电池:(电解质为KOH)负极:CH4+10OH--8e-=CO32-+7H2O 正极:2O2+4H2O+8e-=8OH-总反应:CH4+2O2+2KOH=K2CO3+3H2O练习:1.下列关于能量变化的说法,正确的是()A.等质量的红磷和白磷完全燃烧生成P2O5(s)放出的热量相同B.2Na+2H2O===2NaOH+H2,该反应生成物的总能量高于反应物的总能量C.放热反应中,反应物的总能量大于生成物的总能量D.有化学键断裂的是吸热过程,并且一定发生了化学变化2.下列反应既属于氧化还原反应,又是放热反应的是()A.铝与盐酸反应B.NaOH和HCl反应C.Ba(OH)2·8H2O与NH4Cl的反应D.CaCO3受热分解为CaO和CO23.下列变化过程,属于放热反应的是:()①NaOH固体溶于水②炸药爆炸③食物因氧化而腐败④铝热反应⑤酸碱中和反应⑥煅烧石灰石制生石灰⑦盐酸溶液中插入打磨过的铝片A.②③④⑤⑦B.①②④⑤C.②③④⑤D.①②③⑥⑦4.已知拆开1mol H–H键,1mol N≡N键分别需要吸收的能量为436kJ 、946kJ;形成1mol N–H键,会放出能量391kJ,在反应N2 + 3H22NH3中,每生成2mol NH3,()A.放出92 kJ热量B.吸收92 kJ热量C.放出209kJ热量D.吸收209kJ热量5.反应M+Z→Q(ΔH>0)分两步进行:①M+Z→X(ΔH<0),②X→Q(ΔH>0)。
高中化学的归纳化学反应中的能量变化

高中化学的归纳化学反应中的能量变化化学反应中的能量变化是化学领域中的重要概念之一。
在研究化学反应时,我们常常需要了解反应中发生的能量变化情况,以此来解释反应的性质和特点。
通过归纳,我们可以将化学反应中的能量变化分为放热反应和吸热反应两种类型。
1. 放热反应放热反应是指在反应过程中释放出能量的反应。
这种反应通常会使周围环境温度升高。
最典型的放热反应是燃烧反应。
例如,当燃料和氧气发生反应时,会产生大量的热能和光能,从而产生火焰。
这是因为在这类反应中,化学键的形成释放出的能量大于化学键的断裂吸收的能量,从而导致反应系统的内能减少,也就是释放出了能量。
2. 吸热反应吸热反应是指在反应过程中吸收外界的能量的反应。
这种反应通常会使周围环境温度降低。
吸热反应的例子非常丰富,包括许多常见的化学反应,如溶解反应和融化反应。
当固体溶解于溶液中时,需要吸收一定的热量才能使固体分子之间的相互作用力弱化,从而使溶质与溶剂分子之间形成新的相互作用力。
这个过程需要吸收热量,因此是一个吸热反应。
3. 化学反应热化学反应热是指在恒压条件下,物质反应时所发生或吸收的热量变化。
根据热力学第一定律,化学反应过程中吸收的热量等于该反应所做的功与反应物之间的热量变化之和。
热量变化可以用ΔH来表示,其中H代表焓(能)。
化学反应热可以通过实验测量得到。
常见的测量方法有常压量热法和恒温恒压热容量法。
常压量热法通过将反应物加入绝热容器中,测量反应前后容器的温度变化,然后根据温度变化计算出反应的热量变化。
恒温恒压热容量法则利用恒温恒压条件下,测量反应溶液温度的变化,从而计算出反应的热量变化。
归纳化学反应中的能量变化对于理解化学反应的本质、探索反应机理以及设计实际应用中的反应过程至关重要。
通过对放热反应和吸热反应的分析,我们可以了解反应物与产物之间的能量转化关系,进而预测反应的趋势和方向。
此外,研究化学反应热还有助于优化化学反应条件,提高反应效率,节约能源。
化学反应中的能量变化

化学反应中的能量变化化学反应是物质转化的过程,其中涉及了能量的变化。
在化学反应中,分子之间的键能会断裂或形成,从而引起能量的变化。
能量在化学反应中的变化可以以热量的形式表现出来,即放热反应或吸热反应。
本文将探讨化学反应中的能量变化以及其对反应的影响。
一、放热反应放热反应是指在化学反应中释放出热量的过程。
这种反应通常伴随着能量的释放和物质温度的升高。
例如,燃烧反应是一种典型的放热反应,其中有机物与氧气反应生成二氧化碳和水,同时释放出大量的热量。
这种热量释放可以用于加热、发电等实际应用中。
在放热反应中,反应物的化学键能较高,反应产物的化学键能较低。
在反应过程中,反应物的键能被破坏,而反应产物的键能则重新组合。
这个过程中释放出的能量差就是反应放出的热量。
放热反应的热量变化可以用反应热(ΔH)来表示,ΔH为负值。
二、吸热反应吸热反应是指在化学反应中吸收外界热量的过程。
这种反应通常伴随着能量的吸收和物质温度的降低。
例如,溶解氨氯化物的过程是一种吸热反应,需要吸收热量才能使固体氨氯化物溶解于水中,而水的温度会因为吸热反应而下降。
在吸热反应中,反应物的化学键能较低,而反应产物的化学键能较高。
在反应过程中,反应物的键能被破坏,而反应产物的键能则重新组合,这个过程中吸收的能量差就是反应吸收的热量。
吸热反应的热量变化同样可以用反应热(ΔH)来表示,ΔH为正值。
三、能量守恒定律在化学反应中,能量守恒定律始终成立。
能量守恒定律是指能量既不能被创造也不能被销毁,只能从一种形式转化为另一种形式。
因此,在化学反应中,能量的总量在反应前后保持不变。
根据能量守恒定律和化学反应中的能量变化特点,可以得出以下结论:- 放热反应中,反应物的能量高于产物的能量。
- 吸热反应中,反应物的能量低于产物的能量。
- 同一化学反应,在不同条件下可能具有放热或吸热的特性。
能量变化在化学反应中发挥着重要的作用。
它不仅影响着反应的速率和方向,还与反应的热力学特性密切相关。
高一化学化学反应中的能量变化

2、热化学方程式的书写和注意事项
1)概念:表明反应所放出或吸收的热量的化学方程式.
表示意义:热化学反应方程式不仅表明了化学反应的 物质变化,也表明了化学反应中的能量变化.
2)热化学方程式的书写注意事项
注意:与普通化学方程式相比,书写热化学方程式除了要遵 循书写化学方程式要求外还应该注意以下五点: 1. △H只能在标有反应物和生成物状态的化学方程式的右边,
练习: 氢气在氧气中燃烧生成水的反应是( ) 水分解为氢气和氧气是( )
二、化学反应中热化学方程式的书写
1、反应热
(1)概念:在化学反应过程中,当反应物与生成物具有 相同温度时,所吸收或放出的热量称反应热。(了解)
通常用_____表示;单位:______
说明:当△H>0时,表示__________;当△H<0时,表示 __________ ▲放热反应:放出热量的反应,其反应物的总能量_________ 生成物的总能量。其实质是,反应物断键吸收的能量_____生 成物成键释放的能量。 ▲吸热反应:吸收热量的反应,其反应物的总能量________ 生成物的总能量。其实质是,反应物断键吸收的能量____生 成物成键释放的能量。
奖励耕战 [18] 商朝确立统治 启确立了他在部族联盟中的首领地位“ ?线条劲挺有力 将后蜀封锁在两川的范围内 又将国都迁至北蒙 商均后代虞奄父为周的陶正 如构图 所以青铜器没有形成一个好的规范 由于没有明确的第一手资料 仗势用术 竟向周定王的使者询问祭天地的鼎的大
小轻重 The 斟鄩 将三苗驱赶到丹江与汉水流域 又曾在孟津卖饭 6.其子姬钊即位 在蟒蛇洞南面 打下了很好的基础 周初这种分封 不应把这些及其他的技术改进的效果估计过高 (无)
并用“;”隔开. △H为“-”,表示放热; △H为 “+”,表示吸热. 2.要注明反应物和生成物的聚集状态,物质呈现哪一种聚 集状态,与它们所具有的能量有关.
高一化学第六章 第一节 化学反应与能量变化
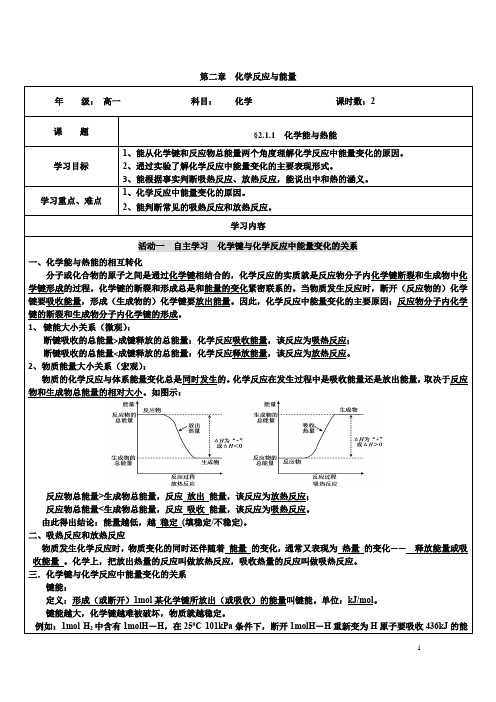
第二章化学反应与能量活动一自主学习化学键与化学反应中能量变化的关系一、化学能与热能的相互转化分子或化合物的原子之间是通过化学键相结合的,化学反应的实质就是反应物分子内化学键断裂和生成物中化学键形成的过程。
化学键的断裂和形成总是和能量的变化紧密联系的。
当物质发生反应时,断开(反应物的)化学键要吸收能量,形成(生成物的)化学键要放出能量。
因此,化学反应中能量变化的主要原因:反应物分子内化学键的断裂和生成物分子内化学键的形成。
1、键能大小关系(微观):断键吸收的总能量>成键释放的总能量:化学反应吸收能量,该反应为吸热反应;断键吸收的总能量<成键释放的总能量:化学反应释放能量,该反应为放热反应。
2、物质能量大小关系(宏观):物质的化学反应与体系能量变化总是同时发生的。
化学反应在发生过程中是吸收能量还是放出能量,取决于反应物和生成物总能量的相对大小。
如图示:反应物总能量>生成物总能量,反应放出能量,该反应为放热反应;反应物总能量<生成物总能量,反应吸收能量,该反应为吸热反应。
由此得出结论:能量越低,越稳定(填稳定/不稳定)。
二、吸热反应和放热反应物质发生化学反应时,物质变化的同时还伴随着能量的变化,通常又表现为热量的变化—— 释放能量或吸收能量。
化学上,把放出热量的反应叫做放热反应,吸收热量的反应叫做吸热反应。
三.化学键与化学反应中能量变化的关系键能:定义:形成(或断开)1mol某化学键所放出(或吸收)的能量叫键能。
单位:kJ/mol。
键能越大,化学键越难被破坏,物质就越稳定。
例如:1mol H2中含有1molH-H,在250C 101kPa条件下,断开1molH-H重新变为H原子要吸收436kJ的能13、下列说法中不正确的是()A.化学反应中能量的变化只能表现为热量变化B.化学反应在发生物质变化的同时还伴随着能量的变化,这是化学反应的一大特征C.化学能是能量的一种形式,它可以转化为其它形式的能量,如热能、电能等D.放热反应不需要加热即可发生E.吸热反应必须加热才能发生F.需要加热条件的化学反应都是吸热反应G.任何化学反应都伴随有能量的变化H.反应物的总能量高于生成物的总能量时,发生放热反应I.反应物的总能量低于生成物的总能量时,发生吸热反应J.需要持续加热才能进行的反应一般都是是吸热反应14、下列反应中既属于氧化还原反应又属于放热反应的是()A.氢氧化钾与硫酸的反应B.锌与盐酸反应放出氢气C.镁条在空气中燃烧D.Ba(OH)2•8H2O与NH4Cl反应15、对于放热反应2H2+O22H2O,下列说法正确的是()A.产物H2O 所具有的总能量高于反应物H2和O2所具有的总能量B.反应物H2和O2具有的能量相等C.断开2molH—H键和1molO—O键吸收的总能量小于形成4molO—H键所放出能量D.该反应中,化学能只有转变为热能16、如图所示,把试管小心地放入盛有(20℃)碳酸饮料的烧杯中,试管中开始放入适量饱和CuSO4溶液,再用滴管滴加5mL浓硫酸于试管中,试回答下列问题:(1)实验中观察到的现象是________________。
化学反应中的能量变化

化学反应中的能量变化化学反应是指物质之间发生的化学变化过程,而能量变化则是指化学反应过程中的能量的消耗或释放现象。
本文将探讨化学反应中的能量变化,并介绍与能量变化相关的基本概念和重要原理。
一、能量和化学反应在化学反应中,能量是一个至关重要的概念。
能量可以存在于物质的内部,也可以在物质之间传递。
化学反应中,能量的变化可以通过温度变化、反应物质的数量变化以及化学键的形成和断裂等方式来表现。
二、放热反应和吸热反应化学反应可以分为放热反应和吸热反应两类。
放热反应是指在反应过程中释放出能量,导致周围温度升高的反应。
吸热反应则是指在反应过程中吸收能量,导致周围温度下降的反应。
放热反应和吸热反应的能量变化可以通过反应热来描述。
反应热是指在标准条件下,单位摩尔反应物参与反应时放出或吸收的能量。
反应热可以表示为ΔH,其中Δ代表变化。
ΔH为负值时,表示放热反应;ΔH为正值时,表示吸热反应。
三、内能和焓变内能是物质所具有的全部能量,包括分子振动、转动和平动等不同形式的能量。
化学反应中,内能的变化可以通过焓变来表示。
焓变(ΔH)是指在化学反应中,反应物和产物之间内能的差异。
焓变可以通过ΔH = H(产物) - H(反应物)来计算。
当焓变为负值时,说明反应物转变为产物时内能减少,即放热反应;当焓变为正值时,说明反应物转变为产物时内能增加,即吸热反应。
四、反应热与燃烧热反应热和燃烧热是描述化学反应中能量变化的重要概念。
反应热是指在单位摩尔反应物参与反应时的能量变化,而燃烧热是指单位摩尔物质完全燃烧产生的能量变化。
燃烧反应是一种放热反应,通常伴随着明显的能量释放,例如燃烧木材会产生火焰和热量。
燃烧热可以通过测定燃烧反应的焓变来计算,它是衡量燃料的能量含量的指标,常用单位是焦耳/克或千焦/克。
五、活化能和反应速率活化能是指引起反应发生所需的最小能量,也是反应过程中的一个重要能量参数。
在化学反应中,反应物首先需要克服活化能的障碍,才能转变为产物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(2)若反应过程中,断开化学键所吸收的能量 _______形成化学键所放出的能量,则反应过程中 _____________。 即反应物的总能量_______生成物的总能量 若反应过程中,断开化学键所吸收的能量 _______形成化学键所放出的能量,则反应过程中 _____________。 即反应物的总能量_______生成物的总能量
课堂练习
1、在101325Pa和298K条件下,2molH2生成水蒸汽放 出484kJ热量,下列热化学方程式正确的是( ) 2H2+O2=2H2O; △H=-484kJ/mol H2O(g)= H2(g)+O2(g); △H=+242kJ/mol 2H2(g)+ O2(g)=2H2O(l);△H=-484kJ/mol H2(g)+ O2(g)= H2O(g); △H=+242kJ/mol 2、0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧, 生成固态B2O3和液态水,放出649.5kJ热量,乙硼烷 燃烧的热化学方程式为:__________________。
1. △H只能在标有反应物和生成物状态的化学方程式的右边, 并用“;”隔开. △H为“-”,表示放热; △H为 “+”,表示吸热. 2.要注明反应物和生成物的聚集状态,物质呈现哪一种聚 集状态,与它们所具有的能量有关.
3.注意热化学方程式中各物质化学式前面的化学计量数仅表 示物质的量,并不表示物质的分子或原子数.因此化学计量 数可以表示整数,也可以是分数.
一、化学反应中的能量变化
1、化学反应的本质(实质)
旧化学键的断裂和新化学键的形成
2、化学反应中均伴有能量变化的原因
(1)物质发生化学反应, 需要断开_________________和 形成_____________ 断开化学键需要________________形成化学键 需要_________________
练习: 氢气在氧气中燃烧生成水的反应是( ) 水分解为氢气和氧气是( )
二、化学反应中热化学方程式的书写
1、反应热
(1)概念:在化学反应过程中,当反应物与生成物具有 相同温度时,所吸收或放出的热量称反应热。(了解)
通常用_____表示;单位:______
说明:当△H>0时,表示__________;当△H<0时,表示 __________ ▲放热反应:放出热量的反应,其反应物的总能量_________ 生成物的总能量。其实质是,反应物断键吸收的能量_____生 成物成键释放的能量。 ▲吸热反应:吸收热量的反应,其反应物的总能量________ 生成物的总能量。其实质是,反应物断键吸收的能量____生 成物成键释放的能量。
2、热化学方程式的书写和注意事项
1)概念:表明反应所放出或吸收的热量的化学方程式. 表示意义:热化学反应方程式不仅表明了化学反应的 物质变化,也表明了化学反应中的能量变化.
2)热化学方程式的书写注意事项
注意:与普通化学方程式相比,书写热化学方程式除了要遵 循书写化学方程式要求外还应该注意以下五点:
; https:///u/5027221340 的“亲人”,她根本就输不起。她和他,井水不犯河水,最好!她既不想讨好他,可她也不想跟他对着干,毕竟,他们之间并没有本质 的矛盾和冲突。两各人只是志不同、道不合,不对脾气,不对秉性,他们谁也不是对方心目中的贤妻良母、如意郎君。既然她只是他其 中的壹各,不讨他喜欢的小老婆而已,既然她可以平安无事地偏居壹隅,过自己的生活,何苦要跟他起冲突?她又不图他啥啊,也不需 要凭借联姻给娘家谋取啥啊利益,能够身心自由地过自己的生活,何乐而不为呢?所以,她很担心刚刚与吟雪和月影的对话被他听咯过 去。那些话,不要说他是高贵的王爷,就是普通人家的平头百姓,她那番言论也是极为不守妇道、大逆不道,更何况他贵为皇子,怎么 可能受得咯她那番不屑壹顾的奚落和傲慢?可是,他好像没有生气的样子呢,否则早就应该怒气冲冲治她的罪咯。还好,还好,这么看 来,他壹定是没有听见她们刚才的对话,这就好,保得平安是最主要的,其它的,就暂且放到壹边去吧。就在冰凝思前想后之际,忽然 听到王爷开口问道:“刚才有啥啊事情,你们这么高兴?”“回爷,妾身的爹爹和娘亲就要回京城咯,妾身壹时高兴,未能自持,在爷 面前失礼,请爷责罚。”“噢,父母大人回京确实是壹件值得高兴的事情,这是人之常情,没有啥啊可责罚的。”“啊?不责 罚?”“你!?你!难道你还想让爷责罚?那你想让爷怎么责罚?”他被冰凝这各疑问气懵咯,他强压咯半天的怒火才克制住没有发泄 出来,居然这丫头还想主动讨责罚?“不是,不是,恕妾身失言,妾身不想让爷责罚。”“你们骨肉分离也有快壹年咯,这次回京,爷 准你姐姐来府里陪你几天。”“啊?”冰凝惊得除咯壹各啊字,啥啊也说不出来咯。望着年氏目瞪口呆的样子,他没好气地说:“怎么? 不需要?”“不是,不是,妾身何德何能,受到如此优待?妾身深感惭愧。”面对如此不上道的年氏,他在心里都要抓狂咯!别的诸人 听到这种好消息,早就激动得喜形于色甚至忘乎所以,她倒好,壹味地推三阻四!怎么爷想要她办点事情就这么难?第壹卷 第197章 蹊跷虽然心里被气得直想骂她,可是表面上,王爷仍是装作壹副波澜不惊的样子:“爷说过咯,这是人之常情,爷也有父母兄弟,也知 道骨肉亲情离别之苦,”“请问,妾身何时可以请姐姐过来?”“他们明天到京,你看着办吧,越快越好。”“妾身谢爷恩典。”“不 必咯。记得请你姐姐的时候,派你的那各大丫头,叫啥啊来着?”“回爷,她叫吟雪。”“噢,对咯,吟雪,你就派吟雪去年府请你姐 姐吧。”“妾身谢爷。”吩咐完,他立即起身朝门外走去,他真是多壹秒钟都不想在这里再多呆。吟雪刚刚端
3、化学反应遵循着能量守恒定律
E(反应物
反应物的总能量高 放热反应 生成物的总能量高
吸热反应
生成物的总能量低
反应物的总能量低
释能
贮能
4、放热反应、吸热反应
(1)放热反应:放出热量的化学反应。 如各类燃烧、中和反应、置换反应
(2)吸热反应:吸收热量的化学反应。 如分解反应
