12水泥熟料中铁、铝、钙、镁的测定(理论)
水泥熟料全分析水泥熟料分析—预习思考题

10水泥熟料分析四、水泥熟料分析的实验步骤3、EDTA 与CuSO 4的体积比测定准确放出约15 mL 0.01M EDTA 于400 mL 烧杯中 →加水稀释至200 mL → 15 mL pH4的HAc-NaAc → 煮沸2min →4d 0.3%PAN →0.01 M CuSO 4至亮紫色2、0.01 mol/L EDTA 标液的配制及标定500 mL (不做) P229。
CaCO 3为基准物;CMP 为指示剂(注意:标定方法同试样中钙的测定,取25.00mL )(做!)0.05mol/L EDTA 标液的稀释:取50mL 于250 mL 容量瓶中,加水、定容、摇匀。
12水泥熟料分析补充:坩埚及沉淀的灼烧和恒重⏹坩埚:800℃灼烧30min ,取出稍冷, 放入干燥器约40 min ,称量m 1;再800℃灼烧30min ,取出稍冷, 放入干燥器约40 min ,称量m 2。
直至2次称量不相差0.3mg 。
(第一周,直接烧1小时)⏹沉淀:包裹后的沉淀放入已恒重的坩埚内,盖盖(露一角)先在明火电炉上灰化,直到滤纸变成黑色灰; (第一周) 注意:稍冷和干燥器内冷却时间均要相同;称量天平同一台。
干燥器每组1个(组长负责时间、召集,统一行动!)14水泥熟料分析2、Fe 2O 3和Al 2O 3的分步测定25.00 mL 试样溶液于400mL 烧杯中→75 mLH 2O → 2d 溴甲酚绿(pH <3.8黄色,pH>5.4绿色)→滴加1:1氨水至绿色→滴加1:1盐酸至黄色,再过量3滴,pH ≈2 → 加热至60~70℃ → 6~8d Sal →0.01M EDTA 滴定(由紫红色变为亮黄色)(注:橙色后稍放置即变为亮黄色),记下V1(量很小),计算Fe 2O 3含量。
→准确加入约20 mL 0.01M EDTA →加水稀释至200 mL → 15 mL pH4的HAc-NaAc → 煮沸2min →4d 0.3%PAN →0.01 M CuSO 4滴定(由黄色变为亮紫色),记录V 2,计算Al 2O 3含量。
水泥熟料 检测标准

水泥熟料是水泥生产过程中的一种中间产品,其质量直接影响到最终水泥的性能和品质。 以下是一些常见的水泥熟料的检测标准:
1. 化学成分检测:水泥熟料的化学成分检测是评估其组成和含量的重要指标。常见的化学 成分检测项目包括SiO2(二氧化硅)、Al2O3(三氧化二铝)、Fe2O3(三氧化二铁)、 CaO(氧化钙)、MgO(氧化镁)等。
2. 矿物相组成检测:水泥熟料的矿物相组成检测可以确定其主要矿物相的含量和类型。常 见的矿物相检测项目包括C3S(三钙硅酸盐)、C2S(二钙硅酸盐)、C3A(三钙铝酸盐)பைடு நூலகம்、C4AF(四钙铁酸盐)等。
水泥熟料 检测标准
3. 物理性能检测:水泥熟料的物理性能检测可以评估其颗粒大小、比表面积、热稳定性等 特性。常见的物理性能检测项目包括比表面积、颗粒大小分布、烧失量等。
4. 硬度检测:水泥熟料的硬度检测可以评估其抗压强度和耐磨性能。常见的硬度检测项目 包括抗压强度、耐磨深度等。
5. 烧成度检测:水泥熟料的烧成度检测可以评估其烧成程度和反应活性。常见的烧成度检 测项目包括烧成温度、烧成时间、烧成损失等。
水泥熟料 检测标准
需要注意的是,不同国家和地区可能有不同的水泥熟料检测标准,具体的检测标准应根据 当地的法规和行业标准进行确定。在进行水泥熟料的检测时,应选择合适的检测方法和设备 ,并确保检测过程的准确性和可靠性。
12水泥熟料中铁、铝、钙、镁的测定(理论)

C3S、 C2S、 C3A、 C4AF
熟 料
硅酸盐水泥熟料
熟料的化学成分及含量
主要氧化物:CaO SiO2 Al2O3 Fe2O3
紫色
亮黄色 无色
(2)结果计算: Fe2O3 =
T EDTA/Fe 2O3 VEDTA 100 % 1 m试 10
公式中: TEDTA/Al2O3—每毫升EDTA标准滴定溶 液相当于Fe2O3的克数,单位为克每毫 升(g/mL); VEDTA—滴定时消耗EDTA标准滴定溶 液毫升数,单位为毫升(mL); m—试样的质量,单位为克(g)。
4、MgO的测定:—EDTA直接滴定法 通常测定的是钙镁合量,然后扣除钙,计算镁。 (1)测定原理:
试样分ቤተ መጻሕፍቲ ባይዱ后,吸取一定体积的 试液,在酸性条件下,用三乙醇 胺和酒石酸钾钠来联合掩蔽 Fe3+ 、Al3+ 、TiO2+的干扰,再 用氨性缓冲液调PH= 10,以K-B 为指示剂,用EDTA标准滴定溶 液滴定至纯蓝色为终点,消耗 EDTA为V2 mL.
无单位,只是一个比值)
TAl2O3—每毫升EDTA标准溶液相当于Fe2O3 的克数,单位为克每 毫升(g/mL); VEDTA——加入EDTA标准溶液的毫升数,单位为毫升(mL); VCuSO4——滴定时消耗硫酸铜标准溶液的毫升数, 单位为毫升(mL); K—— 每毫升硫酸铜标准溶液相当于EDTA 标准溶液的毫升数; m——试样的质量,单位为克(g)。
3、CaO的测定—EDTA直接滴定法 (1)测定原理:
水泥熟料mgo的测定实验原理

水泥熟料mgo的测定实验原理
水泥熟料中的MgO测定实验原理可以通过以下步骤进行:
1. 样品制备:将水泥熟料样品研磨成细粉,并通过筛网将颗粒分散均匀。
2. 预处理:将样品加入试管中,在较高温度条件下加热,使样品中的任何有机物质燃烧残留。
3. 溶解:将预处理后的样品加入溶解试剂中,如硝酸。
样品中的MgO会与溶解试剂发生反应,形成可溶性金属离子。
4. 过滤:将溶解样品过滤,以去除任何未溶解的残留物和杂质。
5. 酸碱滴定:将过滤后的溶液加入胂指示剂,然后使用酸碱滴定法测定溶液中的MgO含量。
在适当的pH条件下,酸和碱滴定溶液中的MgO生成颜色反应,通过滴定剂的消耗量可以确定MgO的含量。
6. 计算:根据滴定剂的用量,结合标准曲线等,计算出水泥熟料中MgO的浓度。
水泥熟料中SiO2、Fe2O3、Al2O3、CaO、和MgO的系统分析

水泥熟料中SiO2、Fe2O3、Al2O3、CaO、和MgO的系统分析摘要:水泥中的主要成分为硅酸盐,其中的主要含有的氧化物有SiO2、Fe2O3、Al2O3、CaO和 MgO。
只有这些成分占有一定合适的百分比它才能被用于建筑中,用络和滴定法测得Fe3+、Al3+、Ca2+、Mg2+的物质的量,然后计算出Fe2O3、Al2O3、CaO和 MgO的量,而SiO2的含量可用重量分析法测得。
关键词:水泥,络合滴定,重量分析法Abstract: The main component of cement for the silicate, which containsthe major oxides areSiO2、Fe2O3、Al2O3、 CaO and MgO. Only these componentsoccupy a certain percentage of it is suitable to be used for buildings with a network and titration measured Fe3+、Al3+、Ca2+、Mg2+of the volume ofthe material,and then calculate the Fe2O3、Al2O3、CaO and MgO of thevolume,and SiO2ontent can be measured by weight analysis. Keywords: cement, complexometric titration, weight analysis目录1、文献综述 (5)1.1水泥的标准 (5)1.2水泥熟料的测定原理【1】 (6)的含量 (6)1.2.1、以重量法测定SiO21.2.2、直接滴定法测定三氧化二铁 (6)1.2.3、返滴定法测定三氧化二铝 (7)1.2.4、钙镁的测定【2】 (7)2、实验部分 (8)2.1、实验目的 (8)2.1、实验试剂 (8)2.2、实验仪器 (8)2.3、实验步骤 (8)的测定 (8)2.3.1、SiO22.3.2、Fe3+的测定 (9)2.3.3、 AL3+的测定 (9)2.3.4、Ca2+离子的测定 (9)2.3.5、Mg2+离子的测定 (10)3、结果与讨论 (10)4、结论 (12)5、注释 (12)6、参考文献 (12)前言水泥主要由硅酸盐组成,按我国规定,分成硅酸盐水泥(纯熟料水泥)、普通硅酸盐水泥(普通水泥)、矿渣硅酸盐水泥(矿渣水泥)、火山灰质硅酸盐水泥(火山灰水泥),粉煤灰硅酸盐水泥(煤灰水泥)等。
12水泥熟料中铁、铝、钙、镁的测定(理论)资料

VEDTA——加入EDTA标准溶液的毫升数,单位为毫升(mL); VCuSO4——滴定时消耗硫酸铜标准溶液的毫升数,
单位为毫升(mL);
K—— 每毫升硫酸铜标准溶液相当于EDTA 标准溶液的毫升数;
m——试样的质量,单位为克(g)。
3、CaO的测定—EDTA直接滴定法 (1)测定原理:
有关反应式为:
显色反应:Ca2+ + KB = Ca-KB
Mg2+ + KB = Mg-KB
纯兰色 酒红色
滴定反应:Ca2+ + Y4- = CaY2-
Mg2+ + Y4- = MgY2-
终点反应:Ca-KB + Y4- = CaY2- + KB
Mg-KB+ Y4- = MgY2- + KB
酒红色
试样分解后,吸取一定体积的试液,
在酸性条件下,用三乙醇胺来掩蔽Fe3+ 、 Al3+ 干扰,再调PH≥13,此时Mg2+ 生成 Mg(OH)2↓不干扰测定,以CMP为指示剂, 用EDTA标准滴定溶液滴定至绿色荧光消失 变纯红色为终点,消耗EDTA为V1 mL。
有关反应式为:
滴定前:Ca2+ + CMP = Ca-CMP 红色 绿色荧光
学习目标:
1、了解水泥熟料的化学成分。 2、理解EDTA配位滴定法测定水泥熟料中
CaO、MgO、Fe2O3、Al2O3的测定原理。 3、掌握EDTA配位滴定法测定水泥熟料中
CaO、MgO、Fe2O3、Al2O3的计算方法。
硅酸盐水泥熟料简介
由主要含CaO、SiO2、Al2O3、Fe2O3的原料,按适当比 例配合磨成细粉(生料)烧至部分熔融,所得以硅酸钙 为主要成分的水硬性胶凝物质,并经冷却而获得的半成 品。其中硅酸钙矿物含量(质量分数)不小于65%,氧 化钙和氧化硅质量比不小于2.0。
熟料分析中铁、铝快速测定方法的探讨

m试 一 试样重量 , 单位 为 g
2快速 法测 定 Al 2 0。 的操作 方法
m试 一试样重量 , 单位为 g V _加人 E D T A标准滴定溶液的体积 , 单位为 mL T 。 『 _ _ E D T A标准溶液对 三氧 化二铝的滴定度 , 单位 为
g / mE
认的经典方法 。 该法 虽准确 , 但操作方法 比较繁琐。 干涸 、 过 滤及灼烧 S i O : 上都需要很 长时间 ,对 时间和温度 的要求也
加 4—5 滴P A N指示剂 , 以硫酸铜标准溶液滴定至亮紫色为
滴定终点 。
在水泥生产过程 中 ,熟料质量控制是水 泥厂在质量管 理中的一个重要环节。它能直接 反映出生料配 比的合理 性。 熟料 质量 的好 坏主要体现在矿物组成上 ,而矿物组成是 由
三氧化二铝的质量 百分数按下式计算 :
w :
m 试样
×1 0 0
其化 学成分中 S i O 、 F e : 0 、 A L 2 0 , 、 C a O、 Mg O等含量计算而来
的。
式 中:
w 耐 一三氧化二铝的质量百分数 , %
水泥熟料 的化学成分是通过 化学分析方法测定 的 , 在 长期 的化学分析 中, N H C 1 法对熟料进行 系统分析 已成为公
V 一滴定时消耗 E D T A标准滴定溶液 的体积 , 单 位为
T 厂一 每 毫升 E D T A标 准滴 定溶液对 F e O 的滴 定度 , 单位为 L
水泥熟料的烧制及有效成分的检测

水泥熟料的烧制及有效成分的检测水泥熟料的烧制是一个关键的工艺过程,它涉及到原料的选择和加工,以及在高温下对原料进行煅烧以获得所需的化学成分。
水泥熟料的烧制过程:
原料选择:常见的水泥熟料原料包括石灰石、黏土、铁矿石等。
这些原料经过采集、破碎、混合等处理步骤后,形成了水泥熟料的原始混合物。
煅烧过程:原始混合物被送入水泥窑中,在高温环境中进行煅烧。
煅烧温度通常在1300°C至1450°C之间,这样可以使原料发生化学反应,生成熟料。
冷却和研磨:煅烧后的熟料通过冷却设备进行快速冷却,并随后经过研磨设备进行细磨,以产生最终的水泥。
有效成分的检测方法:
化学分析:水泥熟料的有效成分包括硅酸盐、铝酸盐、铁酸盐等。
化学分析是一种常用的检测方法,可以确定不同成分的含量。
X射线荧光光谱:X射线荧光光谱是一种无损检测方法,利用样品受激而发射的特定能量的荧光辐射来分析样品的成分。
表面积分析:表面积分析可以确定水泥熟料中的比表面积,该参数与材料的反应性和强度发展有关。
热重分析:热重分析可以通过测量样品在加热过程中质量的变化来评估水泥熟料中的无机成分含量。
这些步骤和方法对于确保水泥的质量和符合相关标准非常重要。
水泥中钙镁铁铝含量的测定

加一定量过量EDTA 15.00mL, 煮沸1min
加缓冲溶液10mL pH=3.5, 4d PAN指示剂
用CuSO4滴定剩余EDTA 茶红色为终点
由 V(CuSO4) 计算 ω(Al2O3)
12
注:
1. 计算公式:
1 2
ω(Fe2O3) =
C ( EDTA ) × V ( EDTA ) × M ( Fe 2 O3 ) × 100 20 .00 ms × × 1000 500 .0
加5mL缓冲溶液 pH=3.5
加水35mL 加热至80℃
4d PAN,EDTA趁热滴定 茶绿色为终点
m (Cu ) 1000 × × V (Cu ) M (Cu ) 250 .0 注: 1. 计算公式: C(EDTA) = V ( EDTA )
mol·L-1
2. 可以计算 ω(Fe2O3),ω(Al2O3)
ω(Al2O3)=
1 [C ( EDTA) × V ( EDTA) − C (CuSO4 )V (CuSO4 )] × M ( Al2O3 ) 2 × 100 20.00 × 1000 ms × 500.0
13
2. 滴定过程颜色变化: Fe: Fe—Sal (酒红) FeY(黄或无色) + Sal (黄)
加热90 度 ⎯ ⎯⎯ ⎯→ CO + 2NH + H2O 2 3
随着尿素分解反应不断进行,NH3 均匀地分 布在溶液各部分,随着NH3 不断产生,溶液酸度不断 下 降 , [OH-] 渐 渐 增 大 , 直 至 均 匀 缓 慢 地 析 出 Fe(OH)3、AL(OH)3。 均匀沉淀法的特点: 1.沉淀颗粒较大; 2.表面吸附杂质少; 3.易过滤洗涤。
z
铁、铝、钙、镁的测定操作方法

1、水泥中的三氧化二铁(基本法)操作方法:从配制好的250mL容量瓶中吸取25.00ml溶液放入300ml烧杯中,加水稀释至约100ml,用氨水溶液(1+1)和盐酸(1+1)调节溶液pH在1.8-2.0之间(用精密pH试纸或酸度计检验)。
将溶液加热到70℃,加10滴磺基水杨酸钠指示剂溶液,用EDTA标准滴定溶液缓慢滴定至亮黄色(终点时溶液温度应不低于60℃,如终点前溶液温度降至近于60℃,应再加热至65℃-70℃)。
保留此溶液供测定三氧化二铝用。
2、水泥中的三氧化二铝的测定(代用法)分析步骤:住测定完铁的溶液中加入EDTA标准滴定溶液至过量10.00mL-15.00mL(对铝、钛合量而言),加水稀释至150-200mL。
将溶液加热至70℃-80℃后,在搅拌下用氨水(1+1)调节溶液的pH值在3.0-3.5之间(用精密pH试纸检验),加入15mL pH4.3的缓冲溶液,加热煮沸并保持微沸1min-2min,取下稍冷,加入4-5滴PAN指示剂溶液,用硫酸铜标准滴定溶液滴定至亮紫色。
3、水泥中的氧化钙的测定(代用法)分析步骤:从250mL的容量瓶中吸取25.00mL放入300mL烧杯中,加入7mL氟化钾溶液,搅匀并放置2min以上,然后加入水稀释至约200mL,加入5mL三乙醇胺溶液(1+2)及适量的CMP混合指示剂,在搅拌下加入氢氧化钾溶液至出现绿色荧光后再过量5-8mL,此时溶液酸度在pH13以上,用EDTA标准滴定溶液滴定至绿色荧光完全消失并呈现红色。
4、水泥中的钙、镁合量的测定(代用法)分析方法:从250mL容量瓶吸取25.00mL溶液放入300mL烧杯中,加入水稀释至约200mL,加入1ml酒石酸钾钠溶液,搅拌,然后加入5mL三乙醇胺(1+2),搅拌,加入25mLpH10缓冲溶液及适量的酸性铬蓝K-萘酯绿B混合指示剂,用EDTA标准滴定溶液滴定,近终点时就缓慢滴定至纯蓝色。
水泥中总铁的测定

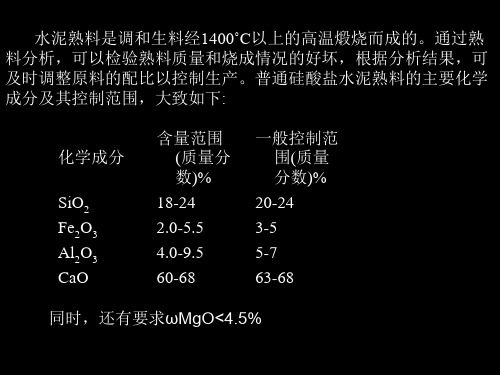
水泥中总铁的测定一、实验目的(1)掌握水泥试样的分解,水浴加热、沉淀、过滤、洗涤等操作技术(2)掌握配位滴定法的原理,特别是通过控制试液的酸度、温度及选择适当的掩蔽剂和指示剂等,在铁、铝、钙、镁共存时直接测定铁的方法二、实验内容在pH2~2.5条件下,以磺基水杨酸为指示剂,用EDTA 直接滴定HNO 3-HCl 浸取的水泥熟料样品中Fe 3+,从而计算水泥样品中的Fe 2O 3%.三、实验原理水泥熟料的主要化学成分的含量大致为:SiO 2 18%~24%; Fe 2O 3 2.0~5.5%; Al 2O 3 4.0%~9.5%; CaO 60%~70%; MgO<4.5%。
调和水泥生料经1400˚C 以上的高温煅烧而成的。
通过熟料分析,可以检验熟料质量和烧成情况的好坏,根据分析结果,可及时调整原料的配比以控制生产。
水泥熟料中碱性氧化物占60%以上,因此易为酸所分解. 其中, 铁,铝,钙,镁等组分可用酸溶解,酸不溶物即为SiO 2,经过滤后可在滤液中测定铁,铝,钙,镁等组分的含量。
2CaO·SiO 2 + 4HCl → 2CaCl 2 + H 2SiO 3 + H 2O2CaO·SiO 2 + 6HC l → 3 Ca Cl 2 + H 2SiO 3 + 2H 2O3CaO·Al 2O 3 + 12HCl → 3 Ca Cl 2 + 2AlCl 3 + 6 H 2O4CaO·Al 2O 3·Fe 2O 3 + 20HCl → 4CaCl 2 + 2AlCl 3 + 2FeCl 3 + 10H 2O由于这4种离子都能在一定条件下与EDTA 形成稳定的螯合物,但形成螯合物的K 稳不同,lgK Fey-=25 , lgK Aly-=16.1; lgK Cay2-=10, lgK Mgy2-=8 , 因此可利用控制酸度,对Fe 进行测定。
Fe 的测定:pH=2~2.5,以磺基水杨酸 SSA 为指示剂 由红紫色至黄色23EDTA Fe O 23(CV)M 1Fe O %=100%21000G⨯⨯四、实验方法与步骤1.水泥试样的分解称2.0~2.5g水泥样品于100ml烧杯中,盖上表面皿,加入7~9g NH4Cl,约10ml浓盐酸,4~6滴硝酸,混匀,沸水浴加热约10~20min,用3:97 盐酸洗涤过滤,洗净烧杯,将滤液转移至250ml容量瓶中,待用2.铁含量的测定取25.00ml滤液转移到250ml锥形瓶中,加入50ml水,2滴0.05%溴甲酚绿,溶液变为黄色,逐滴加入1:1NH3使溶液恰好变为绿色,再滴加1:1HCl恰好变为黄色后再加3滴,测pH=2~2.5,加热到70℃,加入6滴8.0%磺基水杨酸,用0.02M EDTA标准溶液滴定到由红紫色到淡黄色。
水泥成分含量分析-小的课题实验

短学期课题实验论文题目水泥熟料主要成分含量测定院(系)专业学号学生姓名指导教师起讫日期设计地点水泥熟料是调和生料经1400℃以上的高温煅烧而生的。
通过熟料分析,可以检验熟料质量和煅烧情况的好坏,根据分析结果,可以及时调整原料的配比以控制生产。
本文讨论了水泥熟料的定量化学分析过程。
通过重量法、国标法即硅钼蓝光度法测定SiO2的含量;通过EDTA标准溶液配位滴定,测定铁、铝、钙、镁的含量。
关键词:重量法;国际法;硅钼蓝光度法;配位滴定;水泥熟料Cement clinker is manufactured by the process that cement raw materials are calcined at high temperature over 1400℃.Through the analysis of clinker,we can test the quality of clinker and calcination conditions.Based on the results, we can adjust the ratio of raw material to control production timely.This article discusses the quantitative chemical analysis of cement clinker.The content of Si O2can be determined by weighting method and national standard method,i.e silicon molybdenum blue photometric method; and the content of iron,aluminum,calcium and magnesium can be determined by EDTA standard solution coordination titration.Key Word:Gravimetric method;GB method;Silicon molybdenum blue photometric method;Coordination titration;Cement clinker摘要 (I)Abstract (Ⅱ)一、实验目的 (1)二、实验原理 (2)三、实验仪器和试剂 (3)四、实验步骤 (3)五、实验数据记录 (5)六、实验数据处理 (6)七、实验结论及误差分析 (8)八、讨论 (8)九、思考题 (9)参考文献 (10)一、实验目的1.1 了解用氯化铵重量法测定水泥熟料中S iO含量的原理和方法;21.2 了解国标法及硅钼蓝光度法测可溶性S iO含量的原理和方法;21.3 掌握配位滴定法的原理和滴定条件,特别是铁、铝、钙、镁共存时分别直接测定它们的方法;1.4 学会各种方法的测量条件、指示剂的选择,并有一定的鉴别能力;1.5 掌握CuSO4和EDTA标准溶液的配制与标定方法;1.6 进一步掌握配位滴定的几种滴定方法以及计算方法;1.7 掌握水浴加热、沉淀、过滤、灰化、灼烧等操作技术;二、实验原理水泥熟料是调和生料经1400℃以上的高温煅烧而成的。
水泥中硅铁铝钙和镁含量的测定的实验讨论

水泥中硅铁铝钙和镁含量的测定的实验讨论
水泥中硅铁铝钙和镁含量的测定是评价水泥品质的重要指标之一。
常用的方法有化学分析法、光谱分析法、物理性能测试法等。
化学分析法是常用的测定水泥中硅铁铝钙和镁含量的方法之一。
该方法通过样品预处理、酸溶解、配制标准溶液、使用分光光度计或原子吸收光谱仪进行测定等步骤进行。
但需要注意,该方法测得的是总量,并不能区分其存在状态。
另外,光谱分析法也常用于水泥中元素含量的测定。
例如利用X射线荧光光谱仪(XRF)进行分析,通过测量样品中元素荧光能谱的特征线来计算其中元素的质量百分比。
物理性能测试法主要通过测量水泥的强度、密度、水化热等物理性能来间接评估水泥中硅铁铝钙和镁含量。
根据水泥中这些元素的含量,可以推测其水化产物和水化程度,从而判断水泥的硬化性能和强度等。
在实验讨论中,可以探讨不同测定方法的优缺点、准确度和精确度等方面。
讨论样品预处理的方法、标准曲线的制备及检测的可靠性等问题。
此外,还可以讨论实验中的操作技巧以及数据处理的方法和结果的可靠性等方面。
值得注意的是,实验讨论的主要目的是为了学术交流和提高实验技能,避免商业机密和技术保密相关内容的讨论。
水泥中化学成分的测定实验报告(数据完整版)

算所得为 Ca2+、Mg2+离子的总量,由此减去钙量即为镁量,所用 EDTA 体积为 V2 。
平行做三次。
五、实验结果和讨论
1、计算公式 •
• •
• 2、实验结果
Fe2O3 含量:
w(Fe2O3 )
1 2
(cV
)EDTA
M
(Fe2O3
)
ms
Al2O3 含量: CaO 含量:
ww((CAal O2O)3)
22.31
CaO 的含量:(%)
38.50
38.67
38.31
平均值
38.49
平均偏差
0.123
编号 吸取试液量/mL
表 5 MgO 的含量测定记录及处理
1
2
25.00
25.00
3 25.00
EDTA 滴定 读数/mL
终点 起点
34.56 0.00
34.50 0.00
34.63 0.00
EDTA 用量 V2/mL
用。
4、Fe3+离子的测定
移取滤液 50mL 于 400mL 烧杯中,加 75mL 水,2 滴 0.05%溴甲酚绿指示剂(在 pH<
3.8 时呈黄色,pH>5.4 时呈绿色),逐滴加入 1:1 氨水,使之呈绿色,然后用(1+1) HCl
溶液调至黄色后再过量 3 滴,此时溶液酸度约为 pH=2,加热至 60~70℃,取下,加 10 滴
液搅拌溶解可溶性盐,趁热用中速定量滤纸过滤,滤液用 250mL 容量瓶盛接,用热的(3+97)
HCl 溶液洗涤烧杯 5~6 次后,继续用热的(3+97) HCl 溶液洗涤沉淀至无 Fe3+离子为止(?用
水泥熟料的物相测定实验报告

水泥熟料的物相测定实验报告1. 掌握水泥熟料的物相测定方法。
2. 分析水泥熟料的化学组成和结构特征。
3. 确定样品中的无定形物、晶体、氧化物等成分。
实验原理:水泥熟料是指在一定条件下,经过混合、煅烧和冷却等工艺过程,通过物理化学反应生成的一种粉状材料。
水泥熟料的组成主要是四种成分:三氧化二铝(A1203)、二氧化硅(SiO2)、三氧化二铁(Fe2O3)和四氧化三钙(CaO·3SiO2),其中的化学反应是发生在固相中,反应生成的产物在高温状况下形成了晶体,而在室温下产生了无定形物质。
物相分析实验是采用X-射线衍射仪对水泥熟料做成X-射线衍射实验,该实验的原理是通过分析样品对X-射线的散射和吸收,来确定样品中的无定形物和晶体成分,并根据不同的衍射峰确定单个含量。
实验步骤:1. 准备用于物相分析的水泥熟料样品,先对样品进行筛选过滤,使其粒度均匀且符合要求。
2. 将样品装入具有小孔径的玻璃管中,保证样品的均匀性和高压环境的稳定性。
3. 将样品玻璃管熔封,将其放入X-射线衍射仪中,进行散射实验。
4. 依据X-射线衍射仪得到的结果,进行物相分析和成分测定,记录相应的衍射峰的强度和位置等信息,进而进行分析和判断。
实验结果及分析:通过X-射线衍射实验,我们得到了水泥熟料样品的物相分析结果,确定了样品中各成分的含量、位置和强度,同时还得出了它们的晶体结构和组成。
实验结果表明,该水泥熟料样品中主要成分包括:三氧化二铝、二氧化硅、三氧化二铁和四氧化三钙。
其中的四氧化三钙是水泥熟料的主要组分,在高温条件下形成了晶体,而在室温下则出现了大量的无定形物质。
同时,样品中还含有少量的氧化钾、氧化钠、氧化铁等氧化物。
物相分析表明,该水泥熟料样品中各成分含量分别为:三氧化二铝(33.8%)、二氧化硅(19.5%)、三氧化二铁(11.5%)和四氧化三钙(35.2%),由此可以看出四氧化三钙是水泥熟料的主要组分。
同时,无定形物质的含量也是比较高的,这说明水泥熟料的化学反应发生在固相中,反应生成的产物在高温状况下形成了晶体,而在室温下则出现了大量的无定形物质,这些无定形物质通常由四氧化三钙的反应产物构成,其成分为三氧化二铝、二氧化硅和氧化钙等。
水泥熟料中主要成分含量测定
试样—0.5g 3CaO· SiO2 2CaO· SiO2 3 CaO· Al2O3 4CaO· Al2O3· Fe2O3
SiO2· nH2O +10mL SiO2· nH2O 水溶胶 3+97HCl 3+ 搅匀 Fe (黄色) Al3+(无色) 溶解 水浴上蒸干 +1滴浓HNO3 2+ Ca (无色) Mg2+(无色)等
取下烧杯 加100g·L-1磺基水 扬酸10滴
Fe-Sal(紫色) Al3+ Ca2+ Mg2+
以0.015mol·L-1 EDTA
ω Fe2O3 FeY-(淡黄色) Sal3-(无色) Al3+ Ca2+ Mg2+等
滴定至黄色为终点
铝的测定
滴定铁含量 后的溶液
+20mL 0.015mol·L-1EDTA +15mL HOAc-NAOAc缓冲溶液
煮沸1-2分钟取下,冷却90˚C +PAN指示剂4滴
ω Al2O3
Cu-PAD(红色) CuY2-(蓝绿色) AlY-(无色) FeY-(淡黄色)
以0.015mol·L-1 CuSO4回滴 终点时由黄绿色 变紫色
PAN(黄色) H2Y2-(过量) AlY-(无色) FeY-(淡黄色)
BACK
滤液 250mL Fe3+ Al3+ Ca2+ Mg2+
铁的测定(直接滴定法)
铝的测定(泛滴定法)
固体钙指示剂
钙的测定
酸性铬蓝k-萘酚绿B指示剂
镁的测定(差减滴定法)
滤液 250mL Fe3+ Al3+ Ca2+ Mg2+
水泥熟料的物相测定实验报告

水泥熟料的物相测定实验报告实验目的:本次实验旨在通过物相测定方法对水泥熟料进行分析,了解水泥熟料中主要的化合物组成及其相对含量,为水泥生产过程提供理论依据。
实验原理:物相测定是金相学的一个分支,它是通过对材料样品进行研磨、抛光、酸蚀等处理后,观察材料中各种晶体结构的形态、大小、分布以及相对含量等来分析材料的组成和性质的方法。
在水泥熟料中,主要存在以下几种化合物:硅酸盐、铝酸盐、氧化物和硫酸盐等。
通过物相测定,可以分析出这些化合物的晶体结构、大小和相对含量,从而得到水泥熟料的组成情况。
实验步骤:1.将水泥熟料样品取出,进行研磨、抛光处理,使其表面光滑。
2.将处理后的样品放入显微镜下,观察其晶体结构的形态、大小、分布情况,并记录下来。
3.通过比对已知的物相标准图谱,确定样品中存在的化合物种类及其相对含量,并计算出各化合物的相对含量百分比。
实验结果:通过物相测定,我们观察到水泥熟料中晶体结构主要有以下几种:1.硅酸盐晶体:呈长方形或六角形,大小约为5-10微米。
2.铝酸盐晶体:呈六边形或菱形,大小约为2-5微米。
3.氧化物晶体:呈圆形或椭圆形,大小约为1-3微米。
4.硫酸盐晶体:呈长条形或棒状,大小约为2-5微米。
通过比对标准图谱,我们确定了水泥熟料中主要存在以下几种化合物:1.三钙硅酸盐(C3S):占总量的60%左右。
2.二钙硅酸盐(C2S):占总量的20%左右。
3.三钙铝酸盐(C3A):占总量的10%左右。
4.四钙铝酸盐(C4AF):占总量的5%左右。
还存在着少量的氧化物和硫酸盐等杂质。
结论:通过本次物相测定实验,我们分析出了水泥熟料中主要的化合物组成和相对含量。
由此可见,水泥熟料中主要的成分是三钙硅酸盐和二钙硅酸盐,占总量的80%左右。
三钙铝酸盐和四钙铝酸盐则分别占总量的10%和5%左右。
对于水泥生产过程来说,这些化合物的含量和相对比例都是非常关键的,它们将直接影响水泥的物理性能和化学性能。
因此,通过物相测定等分析方法,对水泥熟料的组成和性质进行准确的分析和控制,对于水泥生产过程的优化和提高产品质量都具有重要的意义。
水泥熟料的物相测定实验报告

水泥熟料的物相测定实验报告引言:水泥作为建筑材料的主要组成部分之一,其质量的优劣直接影响着建筑物的使用寿命和安全性。
而水泥的生产过程中,熟料的物相组成是一个非常重要的指标。
因此,本实验旨在通过物相测定方法,对水泥熟料的物相组成进行分析和研究。
实验步骤:1. 样品制备将制备好的水泥熟料样品,放入烧杯中,加入适量的去离子水,搅拌均匀后,倒入模具中,待其完全干燥后,取出制备好的水泥熟料样品。
2. X射线衍射仪测定将制备好的水泥熟料样品放入X射线衍射仪中,进行测定。
在测定前,需要进行仪器的校准和样品的调整。
调整好样品后,进行扫描。
扫描结果显示,水泥熟料样品中含有以下物相:二氧化硅、三氧化二铁、钙钛矿、方解石、白云石等。
其中,二氧化硅和三氧化二铁是水泥熟料的主要组成部分。
3. 电子显微镜观察将制备好的水泥熟料样品放入电子显微镜中,进行观察。
观察结果显示,水泥熟料样品中存在着不同形态和大小的晶粒,其中晶粒大小不均匀,主要分布在10-100微米之间。
此外,还存在着一些非晶相物质。
实验结果:通过物相测定方法,对水泥熟料的物相组成进行了分析和研究。
结果表明,水泥熟料样品中含有二氧化硅、三氧化二铁、钙钛矿、方解石、白云石等物相,其中二氧化硅和三氧化二铁是水泥熟料的主要组成部分。
此外,水泥熟料样品中存在着不同形态和大小的晶粒,其中晶粒大小不均匀,主要分布在10-100微米之间。
同时,还存在着一些非晶相物质。
结论:本实验通过物相测定方法,对水泥熟料的物相组成进行了分析和研究。
实验结果表明,水泥熟料样品中含有二氧化硅、三氧化二铁、钙钛矿、方解石、白云石等物相,其中二氧化硅和三氧化二铁是水泥熟料的主要组成部分。
此外,水泥熟料样品中存在着不同形态和大小的晶粒,其中晶粒大小不均匀,主要分布在10-100微米之间。
同时,还存在着一些非晶相物质。
这些结果对水泥生产过程中的质量控制和研究具有重要意义。
水泥熟料全分析

实验7 水泥熟料全分析1.实验目的①初步掌握固体试样的预处理方法;②用EDTA配位滴定法分别测定水泥熟料中铁、铝、钙及镁的含量;③用重量分析法测定水泥熟料中SiO2的含量。
2.实验试剂①水泥熟料固体试样;②EDTA标准溶液;③NH4Cl固体,CuSO4∙5H2O固体;④HAc−NaAc 缓冲溶液,NH3−NH4Cl 缓冲溶液;⑤浓HCl,1:1 HCl溶液,浓HNO3,1:1 H2SO4溶液;⑥20% NaOH溶液,1:1 NH3溶液,1:2三乙醇胺溶液;⑦钙指示剂,KB指示剂,10%磺基水杨酸指示剂,0.3% PAN指示剂;3.实验原理①水泥熟料的主要成分及摩尔质量:主要成分Fe2O3Al2O3CaO MgO SiO2含量/% 2.0~5.5 4.0~9.5 60~70 <4.5 18~24 摩尔质量/(g∙mol−1) 159.69 101.96 56.08 40.31 60.08②其中SiO2可以用重量分析法测定;③Fe3+和Al3+的滴定:调节pH为2.0~2.5,以磺基水杨酸作指示剂,用EDTA滴定Fe3+;加入过量的EDTA煮沸,调节pH为4.2,以PAN作指示剂,用CuSO4标准溶液返滴定剩余的EDTA;④Ca2+的滴定:在pH约为12.5的条件下,以钙指示剂指示终点,用EDTA滴定Ca2+;⑤Ca2+和Mg2+的滴定:在pH约为10的条件下,以KB指示剂指示终点,用EDTA滴定Ca2+和Mg2+的总量,差减法求MgO含量4.实验步骤①溶解试样:称量0.4~0.5g水泥熟料于干燥的100ml烧杯,加2.4~3.5g固体NH4Cl,混匀;滴加约3mL浓HCl至试样全部润湿,滴加2~3滴浓HNO3,搅匀,小心压碎块状物;盖上表面皿,置于沸水浴加热10min,蒸至近干,加1~2mL浓HCl及约40mL热水,搅拌溶解过滤。
用250mL容量瓶盛接滤液,并用热水(每次约20mL)洗涤烧杯和滤纸,直至滤液中无氯离子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
紫色
亮黄色 无色
(2)结果计算: Fe2O3 =
T EDTA/Fe 2O3 VEDTA 100 % 1 m试 10
公式中: TEDTA/Al2O3—每毫升EDTA标准滴定溶 液相当于Fe2O3的克数,单位为克每毫 升(g/mL); VEDTA—滴定时消耗EDTA标准滴定溶 液毫升数,单位为毫升(mL); m—试样的质量,单位为克(g)。
小结
测定水泥熟料中Fe2O3、Al2O3、CaO、MgO 1、测定原理 2、有关化学反应式 3、结果的计算
作业 1、复习本次课的内容 2、预习测定步骤
学习目标:
1、了解水泥熟料的化学成分。 2、理解EDTA配位滴定法测定水泥熟料中 CaO、MgO、Fe2O3、Al2O3的测定原理。 3、掌握EDTA配位滴定法测定水泥熟料中 CaO、MgO、Fe2O3、Al2O3的计算方法。
硅酸盐水泥熟料简介
由主要含CaO、SiO2、Al2O3、Fe2O3的原料,按适当比
2、Al2O3 的测定(铜盐回滴法:铝钛合量) (1)测定原理:
在滴定完Fe3+的溶液中,加入一定量过量的EDTA标准滴 定溶液,加热至60~70℃,调节溶液PH为4.3,煮沸,此时Al3+、 TiO2+能与EDTA生成稳定的配合物,再以PAN为指示剂,用 CuSO4标液返滴定剩余的EDTA至亮紫色为终点,记录数据。
3、CaO的测定—EDTA直接滴定法 (1)测定原理:
试样分解后,吸取一定体积的试液, 在酸性条件下,用三乙醇胺来掩蔽Fe3+ 、 Al3+ 干扰,再调PH≥13,此时Mg2+ 生成 Mg(OH)2↓不干扰测定,以CMP为指示剂, 用EDTA标准滴定溶液滴定至绿色荧光消失 变纯红色为终点,消耗EDTA为V1 mL。
(2)结果计算:根据EDTA的浓度和消耗量即可 计算钙镁的合量,扣除钙量即为镁的含量。
TMgO (V2 V1 ) MgO 100 % 1 m 1000 10
式中: V1—钙消耗的EDTA(mL); V2—钙镁消耗的EDTA(mL); TMgO—EDTA对MgO的滴定度 (mg/mL); m—试样称取的质量(g);
例配合磨成细粉(生料)烧至部分熔融,所得以硅酸钙 为主要成分的水硬性胶凝物质,并经冷却而获得的半成 品。其中硅酸钙矿物含量(质量分数)不小于65%,氧 化钙和氧化硅质量比不小于2.0。
C3S、 C2S、 C3A、 C4AF
熟 料
硅酸盐水泥熟料
熟料的化学成分及含量
主要氧化物:CaO SiO2 Al2O3 Fe2O3
其总和通常占熟料总量的95%以上。
实际生产中硅酸盐水泥中个主要氧化物含量的波动范围一般为: CaO --C 62%~67% SiO2 --S 20%~24% Al2O3 --A 4%~7% Fe2O3 --F 2.5%~6% 其它:MgO(M);SO3 (S);Na2O、K2O(R2O);TiO2(T);P2O5 (P)等, 其总量通常占熟料的5%以下。
无单位,只是一个比值)
TAl2O3—每毫升EDTA标准溶液相当于Fe2O3 的克数,单位为克每 毫升(g/mL); VEDTA——加入EDTA标准溶液的毫升数,单位为毫升(mL); VCuSO4——滴定时消耗硫酸铜标准溶液的毫升数, 单位为毫升(mL); K—— 每毫升硫酸铜标准溶液相当于EDTA 标准溶液的毫升数; m——试样的质量,单位为克(g)。
有关反应式为:Biblioteka 滴定前:Ca2+ + CMP = Ca-CMP 红色 绿色荧光 滴定反应:Ca 2++ Y4- = CaY2终点时:Ca-CMP + Y4- = CaY2- + CMP + 2H+ 绿色萤光 纯红色
(2)结果计算式:
CaO TCaO V1 100 % 1 m 1000 10
硅酸盐水泥熟料
熟料的化学成分及含量
•国内部分新型干法水泥企业的硅酸盐水泥熟料化学成分 %
生产场景
一、熟料控制中的检验方法 熟料的控制项目有:游离氧化钙、 熟料的化学成分、氧化镁及物理性能 检验等。
二、水泥熟料化学成分的测定: 熟料的化学成分不同,则熟料中各种矿物的组
成就有差异,从而影响到熟料的质量。故通过测定
从而计算Al2O3和TiO2的百分含量。有关反应式如下:
滴定前:Al3++ Y4-(过量) AlY- ( PH=4.3)
滴定时:Y4-(剩)+ Cu2+ Cu Y2终点时:Cu2+ + PAN Cu-PAN (蓝色) 亮紫色
黄色
红色
2、结果计算式:
TAl 2O 3 (VEDTA KVCuSO4 ) Al2O3 100 % 1 m 10
其化学成分,就可以检验其矿物组成是否符合配料 设计的要求和熟料的质量情况等,从而及时的调整 原料的配比来控制生产。
1、Fe2O3的测定 —EDTA直接滴定法 (1)测定原理:
试样分解后,吸取一定体积的试液,调节溶液的PH= 1.8-2.0,加热至700C,以磺基水扬酸钠为指示剂,,用EDTA标 准滴定溶液滴定至溶液由紫红色变为无色或亮黄色为终点, 据消耗的EDTA标准滴定溶液的体积和浓度来计算 Fe2O3% 。有关反应式为: 滴定前:Fe3+ + ssal Fe-ssal ( PH=1.8~2.0 ) 无色 紫色 滴定时:Fe3++Y 4- FeY- ( PH=1.8~2.0 ) 终点时:Fe-ssal+ Y4- Fey- + ssal
4、MgO的测定:—EDTA直接滴定法 通常测定的是钙镁合量,然后扣除钙,计算镁。 (1)测定原理:
试样分解后,吸取一定体积的 试液,在酸性条件下,用三乙醇 胺和酒石酸钾钠来联合掩蔽 Fe3+ 、Al3+ 、TiO2+的干扰,再 用氨性缓冲液调PH= 10,以K-B 为指示剂,用EDTA标准滴定溶 液滴定至纯蓝色为终点,消耗 EDTA为V2 mL.
式中: V1—钙消耗的EDTA(mL); TCaO—EDTA对CaO的滴定度(mg/mL); m—试样称取的质量(g);
有关反应式为: 显色反应:Ca2+ + KB = Ca-KB Mg2+ + KB = Mg-KB 纯兰色 酒红色 滴定反应:Ca2+ + Y4- = CaY2Mg2+ + Y4- = MgY2终点反应:Ca-KB + Y4- = CaY2- + KB Mg-KB+ Y4- = MgY2- + KB 酒红色 纯兰色
