金的理化性质与用途
科学版九年级化学上册1.4 物质性质的探究(课件)【新版】

6 下列物质的用途与其依据的性质关系不相符的是( A.酒精用作燃料——酒精具有可燃性 B.氧气用于急救病人——氧气能供给呼吸 C.石墨常用作电极——石墨具有导电性 D.氢气可用于填充探空气球——氢气具有可燃性
知2-练
)
知识点 3 科学探究
【投影展示】见教材P21·金属铜化学性质的探究
(实验1-10)将一小段光亮的铜片在酒精灯火焰上加热片刻,铜 片的颜色有什么变化?为什么?
4 (中考·北京)下列物质的用途中,利用其化学性质的是( A.干冰用于人工降雨(固态二氧化碳升华) B.天然气用作燃料 C.液氮用作冷冻剂 D.铜用于制作导线
知2-练
)
5 填写下列物质对应的性质或用途。 (1)铜具有优良的导电性,可以制________; (2)酒精具有________,可以作内燃机的燃料; (3)氧气具有________,可以用作火箭的助燃剂; (4)铁具有导热性,可以用来制________。
就表现出来的性质 能表现出来的性质
颜色、状态、气味、
熔点、沸点、硬度、 密度、溶解性、挥发 性、导电性、导热性
可燃性、稳定性、氧 化性、还原性等
等
可直接观察或用仪器 必须通过化学变化来
测定
观察和确定
不能认为物理性质一定是物质在发生物理变
化中表现出来的性质。因为有些物理性质如
密度、颜色、气味等都不需要发生物理变化
这节课我们学习了哪些知识?你能说一说吗?
一、物质的性质
1.物理性质和化学性质
(1)物理性质:不需要发生化学变化就表现出来的性质。
(2)化学性质:在化学变化中表现出来的性质
2.物质的性质与用途的关系
三、科学探究
体现
用途
性质
初中化学金属的性质与用途知识点总结

初中化学金属的性质与用途知识点总结
一、金属的性质
1. 密度:金属的密度较大,通常比非金属大。
2. 导电性:金属具有良好的导电性能,能够传导电流。
3. 导热性:金属能够快速传导热量。
4. 延展性:金属具有良好的延展性,能够制成薄片或丝线。
5. 韧性:金属具有一定的韧性,能够在受力下发生形变而不断裂。
6. 熔点:金属的熔点一般较高。
7. 反应性:金属具有不同程度的化学反应性,可以与非金属发生反应。
二、金属的用途
1. 金属材料:金属广泛应用于制造工业中,例如建筑、汽车、机械等领域。
2. 电器与电子设备:金属用作导线与电子元件的材料,能够帮助电流传导与电子信号传输。
3. 装饰材料:一些金属具有良好的光泽,可以用于装饰建筑或制作珠宝首饰。
4. 食品包装:某些金属具有较好的耐腐蚀性能和防潮性能,适合用于食品包装材料。
5. 药品与化妆品:金属可以作为医药和化妆品中的某些成分,具有特定的疗效或美容功效。
这些是初中化学中金属的性质与用途的一些知识点总结,希望对你有所帮助。
药物化学复习大纲

药物化学教学大纲Medicinal Chemistry(供自考生使用)前言药物化学是一门以化学为基础来研究药物的专门学科。
其内容包括:发现与发明新药;合成化学药物;研究和改进药物合成工艺;阐明药物化学性质;研究药物分子与机体细胞(生物大分子)之间相互作用规律等。
它是药学领域中重要的带头学科。
药物化学的教学目的应该使学生能有效利用现有化学药物,在常用药物的结构、名称、性质、鉴别、制备、构效关系及新药研究的方法等各个方面获得系统的理论知识和必要的操作技能,从而能合理地调制配方,制备优质药剂,做好药品检验和保管工作,同时对药物研究和新药发展有一定的了解。
本课程需要有机化学、分析化学相关知识作基础;药物化学的知识为学生进一步学习天然药物化学、药理学、药物分析及药学专业课程打下基础。
本大纲与人民卫生出版社出版,郑虎主编的普通高等教育“十一五”国家级规划教材第五版《药物化学》配套使用,适用于自考生的教学。
大纲所列教学内容可通过课堂讲授、计算机多媒体、自学、讨论、实验、实习等方式进行教学。
划横线部分为要求学生重点掌握的内容,其他为一般熟悉和一般了解内容。
总学时为80学时。
绪论目的要求了解药物的通用名、化学名、商品名的含义和要求。
教学内容1、药物化学的定义。
2、药物化学的研究内容及任务。
3、药物化学发展史。
4、化学药物的命名。
中枢神经系统药物目的要求掌握异戊巴比妥的结构、性质、构效关系、合成和用途;盐酸吗啡的结构、性质和构效关系。
熟悉地西泮的结构、代谢和构效关系;苯妥英钠的结构、性质和用途。
了解镇静催眠药的结构类型;盐酸氯丙嗪的性质和构效关系;咖啡因的结构和性质。
教学内容1、镇静催眠药。
异戊巴比妥的结构、化学名、理化性质、合成、体内代谢及临床应用;巴比妥类药物构效关系;地西泮的结构、化学名、理化性质、体内代谢及应用;吩噻嗪药物的构效关系;酒石酸唑吡坦的结构及应用。
2、抗癫痫药。
苯妥英钠的结构、化学名、理化性质、体内代谢及应用;卡马西平、卤加比的结构及应用。
常用物料理化性质及禁忌

常用物料理化性质及禁忌目的:常用物料的理化性质旨在于培训新员工及对常用物料的基本认识和了解,也作为一线生产人员的学习资料。
内容概述:主要介绍了常用物料的熔点、沸点、溶解性、毒性等基本理化性质。
目录1、氢气第3页2、氩气第3页3、液氮第3页4、吡啶第4页5、丙酮第5页6、环己烷第6页7、二氯甲烷第6页8、二氯乙烷第7页9、甲醇第7页10、三乙胺第7页11、四氢呋喃第8页12、乙醇第8页13、乙酸乙酯第9页14、正庚烷第9页15、甲苯第10 页16、钯炭第10 页17、金属钠第11 页18、镁粉第11 页19、正丁基锂第11 页20、叔丁醇钾第12 页21、氢化铝锂第12 页22、硼氢化钠第12 页23、硼氢化钾第13 页24、硫酸第13 页25、盐酸第13 页26、氢氧化钠第14 页一、氢气理化性质:分子式:H2沸点:-252.77℃20.38K熔点:-259.2℃密度:0.09kg/m3相对分子质量:2.01易燃性级别:4毒性级别:0易爆性级别:1氢气是无色并且密度比空气小的气体(在各种气体中,氢气的密度最小。
标准状况下,1 升氢气的质量是0.0899 克,比空气轻得多)。
因为氢气难溶于水,所以可以用排水集气法收集氢气。
另外,在101 千帕压强下,温度-252.87℃时,氢气可转变成无色的液体;-259.1℃时,变成雪状固体。
常温下,氢气的性质很稳定,不容易跟其它物质发生化学反应。
但当条件改变时(如点燃、加热、使用催化剂等),情况就不同了。
如氢气被钯或铂等金属吸附后具有较强的活性(特别是被钯吸附)。
金属钯对氢气的吸附作用最强。
重氢在常温常压下为无色无嗅无毒可燃性气体,是普通氢的一种稳定同位素。
它在通常水的氢中含0.0139~0.0157。
其化学性质与普通氢完全相同。
但质量大些,反应速度小一些。
可燃性:纯氢的引燃温度为400℃。
氢气在空气里的燃烧,实际上是与空气里的氧气发生反应,生成水。
还原性:氢气与氧化铜反应,实质是氢气还原氧化铜中的铜元素,使氧化铜变为红色的金属铜。
十种沸点超过200℃的溶剂理化性质总结

十种沸点超过200℃的溶剂理化性质总结-标准化文件发布号:(9556-EUATWK-MWUB-WUNN-INNUL-DDQTY-KII列举十种高沸点液体(>200℃),简单列出其理化性质,以及对金属盐的溶解能力:1、苯甲醇沸点:205 ℃密度:1.045 g/ml(25℃)水溶性:4.29 g/100mL(20℃)性质与用途、以及金属盐溶解性::①有极性,低毒,蒸汽压低,因此用作醇类溶剂。
可燃,可与乙醇、乙醚、苯、氯仿等有机溶剂混溶。
②苯甲醇不宜久贮,它在空气中能缓慢氧化为苯甲醛和苯甲醚。
③用作色谱分析试剂,也用于有机合成。
与卤化磷和氢卤酸反应生成卤化苄。
卤化苄和苯甲醇都是苄基(苯甲基)化试剂。
④可通过氯化苄与碳酸钾或碳酸钠长时间加热水解而得;或苯甲醛的甲醇溶液与氢氧化钠液在65~75℃下反应而得。
⑤能溶解Na,与其发生酸碱反应。
2、二甲酸酯(DBE)沸点:196~225 ℃密度:1.19 g/ml(25℃)水溶性:/性质与用途、以及金属盐溶解性::①DBE是由三种二价酸酯组成的混合物,是丁二酸二甲酯,戊二酸二甲酯和已二酸二甲三种良好环境溶剂的组合。
②低毒、低味、含水量低、使用安全;良好的稳定性,自然存放不会产生氧化和分解;沸点高,馏程长,可帮助调节整个溶剂系统的挥发速率③极好的溶解力,与聚氯酯树脂、丙烯酸树脂、聚酯树脂、醇酸树脂、环氧树脂等相溶性良好。
④生产时,先由甲醇同混和的二元酸反应,然后精馏分离成不同的产品。
3、苯甲酸乙酯沸点:212 ℃密度:1.045 g/ml(25℃)水溶性:insoluble性质与用途、以及金属盐溶解性::①无色液体,溶于乙醇、乙醚、石油醚、丙二醇、矿物油和大多数非挥发性油,不溶于水和甘油。
②用作溶剂及香料辅助剂,也用于有机合成:用作纤维素酯、纤维素醚、树脂类的溶剂、适用于香蕉、樱桃、梅子、葡萄等香精以及烟用和酒用香精中。
③由苯甲酸和乙醇在无水硫酸铝和微量硫酸存在下酯化而制备。
十种沸点超过200℃的溶剂理化性质总结

列举十种高沸点液体(>200℃),简单列出其理化性质,以及对金属盐的溶解能力:1、苯甲醇沸点:205 ℃密度:1.045 g/ml(25℃)水溶性:4.29 g/100mL(20℃)性质与用途、以及金属盐溶解性::①有极性,低毒,蒸汽压低,因此用作醇类溶剂。
可燃,可与乙醇、乙醚、苯、氯仿等有机溶剂混溶。
②苯甲醇不宜久贮,它在空气中能缓慢氧化为苯甲醛和苯甲醚。
③用作色谱分析试剂,也用于有机合成。
与卤化磷和氢卤酸反应生成卤化苄。
卤化苄和苯甲醇都是苄基(苯甲基)化试剂。
④可通过氯化苄与碳酸钾或碳酸钠长时间加热水解而得;或苯甲醛的甲醇溶液与氢氧化钠液在65~75℃下反应而得。
⑤能溶解Na,与其发生酸碱反应。
2、二甲酸酯(DBE)沸点:196~225 ℃密度:1.19 g/ml(25℃)水溶性:/性质与用途、以及金属盐溶解性::① DBE是由三种二价酸酯组成的混合物,是丁二酸二甲酯,戊二酸二甲酯和已二酸二甲三种良好环境溶剂的组合。
②低毒、低味、含水量低、使用安全;良好的稳定性,自然存放不会产生氧化和分解;沸点高,馏程长,可帮助调节整个溶剂系统的挥发速率③极好的溶解力,与聚氯酯树脂、丙烯酸树脂、聚酯树脂、醇酸树脂、环氧树脂等相溶性良好。
④生产时,先由甲醇同混和的二元酸反应,然后精馏分离成不同的产品。
3、苯甲酸乙酯沸点:212 ℃密度:1.045 g/ml(25℃)水溶性:insoluble性质与用途、以及金属盐溶解性::①无色液体,溶于乙醇、乙醚、石油醚、丙二醇、矿物油和大多数非挥发性油,不溶于水和甘油。
②用作溶剂及香料辅助剂,也用于有机合成:用作纤维素酯、纤维素醚、树脂类的溶剂、适用于香蕉、樱桃、梅子、葡萄等香精以及烟用和酒用香精中。
③由苯甲酸和乙醇在无水硫酸铝和微量硫酸存在下酯化而制备。
④苯甲酸乙酯的金属盐溶解性较好,能与多种金属盐和氯化锡、三氯化铝、氯化钛、碘化镁、五氯化锑等形成结晶性复合物,但不太稳定,在空气中易分解。
实验九 金霉素沉淀法提取工艺

实验九金霉素沉淀法提取工艺一、实验目的了解金霉素的沉淀法提取工艺过程,熟悉操作原理。
并通过重量差法测定金霉素含量,计算总收率。
二、实验原理金霉素是金色链霉菌在发酵过程中的代谢产物,生产上采用沉淀、通气、二级发酵培养制得金霉素发酵液。
发酵液用草酸酸化,加蛋白凝结剂硫酸锌出去蛋白。
再利用金霉素钙镁盐易溶于有机溶媒乙醇、醋酸丁酯、丁醇的特性加以提纯,利用其盐酸盐难溶于溶媒的特性,在醋酸丁酯-丁醇提取液与乙醇提取液中加入过量盐酸使其结晶析出,最后经洗涤、干燥、过筛,即得成品。
1.金霉素沉淀法提取步骤(1)制备金霉素盐酸盐(CTC):取 CTC 发酵液若干(称取固体兽药20g,溶于100ml蒸馏水中),加入 1%量的草酸,然后用液体草酸调pH 1.1~1.3,搅拌0.5h,加入 0.2%黄血盐与硫酸锌,再加入适量的硅藻土作助滤剂,过滤,滤渣用同样量的 pH1.1~1.3 的酸水顶洗,合并滤液。
然后在滤液中加入与 CTC 等摩尔量 MgCl2(溶液中氯化镁的浓度达到1mol/L),用氨水调 pH 8.0,过滤,滤饼即复盐。
(2)制备结晶液:取适量乙醇(约100ml),加入 8%的尿素,用盐酸调pH 2.0,加入 CTC 复盐,搅拌使其溶解。
(3)结晶的制备:往结晶液里缓慢滴入浓盐酸,调 pH(0.5±0.02),在结晶液中加入 10%的饱和氯化钠溶液,搅拌结晶(10℃12h),过滤,结晶用乙醇洗涤,热风吹干。
2.具体流程图如下:三、思考题(一)、预习1.根据实验操作步骤,列出本实验所用的药品和仪器(包括规格和数量,用途);2.查阅文献资料,按如下要求归纳金霉素的理化性质:( 1)结构式和分子量( 2)标明其活性功能团及各自的 pK 值,说明各基团的酸碱性,计算等电点 pI 值;( 3)说明不同 pH 条件下,金霉素在水中的溶解度变化情况;(4)分别写出金霉素游离碱和盐酸盐在水,丙酮和丁醇中的溶解度数值;( 5)写出金霉素水溶液稳定性的影响因素。
黄金知识科普

金银金贵的奥秘实际上,黄金白银在人类历史上之所以成为财富象征、货币之王,主要是由两个因素决定的,而且和我们人类的爱美天性有最大的关联。
第一个因素是历史原因或者说是文化传统,第二个因素是金银的特殊理化性质。
我们知道,黄金是古埃及王室的最爱,比如埃及帝王谷发现的第18王朝图坦哈蒙法老的木乃伊上就覆着纯金的面具。
古埃及的国王或法老们派出商团或军队闯入南方努比亚的黑人地盘,或者派遣船队渡越地中海、红海从事远洋贸易,很重要的一个目标就是搜寻黄金。
古埃及文书中,经常提到“科普托斯沙漠的黄金”、“瓦瓦特的黄金”、“库施的黄金”。
科普托斯沙漠是指今埃及的东部沙漠,黄金集中出产于基纳一带;而三大金矿区中的后两个都在古埃及本土以南的大努比亚地区,相对集中于阿斯旺到哈拉发干河之间。
努比亚是个古代地域名词,指的是今埃及阿斯旺以南到苏丹科斯提以北的尼罗河地区,即北纬12~24度之间的尼罗河盆地。
瓦瓦特和库施都位于靠近古埃及本土的努比亚北部,当年古埃及人和古努比亚人的分界线是尼罗河第一瀑布,努比亚人是地道的尼格罗种的黑人。
希腊人和罗马人习惯称呼努比亚人为“埃塞俄比亚人”,意思是“深褐色皮肤的人”,与现代的埃塞俄比亚国不是一回事情。
希罗多德在著作中就说:埃塞俄比亚有大量的黄金。
古埃及军队从第4王朝(约BC2613~BC2498年)创始就挥师向南闯入了努比亚,大概在这时就发现了此间盛产黄金,由此更是屡屡南下远征劫掠努比亚。
古埃及的疆界不断南扩,在吸血努比亚黑人财富的同时也变得益发强大。
第11王朝(约BC2133~BC1991年)的孟图赫特普二世和孟图赫特普三世相继派遣埃及大军入侵努比亚。
第12王朝(约BC1991~BC1786年)的创始人阿美涅姆赫特一世则亲自领军南征,其铭文纪功云:“我捕捉了瓦瓦特的人,我俘虏了马佐伊的人!”其子塞努塞尔特一世远征努比亚到尼罗河第二瀑布附近,征服土著城邑十余座,战后多处开采当地的金、铜、紫晶等矿和埃及缺乏的石材。
贵金属基础知识

贵金属篇第一章 概述一、 材料与材料的划分 1、 材料又称原料,资料是指可以直接造成成品的东西。
材料又称原料,资料是指可以直接造成成品的东西。
贵金属:80%被用来制作成首饰。
又被称为“工业革命的维生素”被用来制作成首饰。
又被称为“工业革命的维生素” 贵金属的特点:贵贵金属的特点:贵 二、 材料的划分 材料材料非金属非金属有机材料:珍珠有机材料:珍珠 象牙象牙 琥珀琥珀 玳瑁玳瑁 木头木头 皮革等皮革等 无机材料:钻石无机材料:钻石 红蓝宝等红蓝宝等金属金属黑色金属材料:鉄黑色金属材料:鉄 鉄碳合金等鉄碳合金等 有色金属材料:铝有色金属材料:铝 锌 铜等铜等贵金属材料:金贵金属材料:金 银 铂等铂等三、 贵金属材料贵金属:是指地壳中产量(储量)少,密度大,价格高的有色金属。
包括:黄金、白银、铂族元素(钯金、铑金、铱金、锇金、钌金、铂金)族元素(钯金、铑金、铱金、锇金、钌金、铂金)金属:有良好的延展性、导电导热性、具有较高的金属光泽。
除汞外,在常温下都是固体。
非金属:没有或有较差的延展性,导电导热性也差,不具有金属光泽。
非金属:没有或有较差的延展性,导电导热性也差,不具有金属光泽。
四、 金属材料的物理、化学性质 1、 金属的化学性质金属在室温或高温条件下,抵抗各种化学作用的能力,主要是指抵抗活泼介质侵入的能力。
力。
例如:抵抗酸碱,氧气、氢气、抗氧化性等。
例如:抵抗酸碱,氧气、氢气、抗氧化性等。
2、 金属的物理性质包括:密度、颜色、光泽、导电性、导热性、塑性(延展性)、硬度、熔点、强度、沸点等。
等。
1) 密度:单位体积内金属(物质)的质量。
单位:g/cm3. 2) 熔点:金属由固态转变为液态时的温度(绝大部分的非晶质没有固定的熔点)。
3) 硬度:金属抵抗更硬物质压入的能力,抵抗局部塑性变形的能力。
一般采用莫氏硬度。
度。
4) 金属的强度:金属材料在载荷的作用下,抵抗塑性变形和断裂的能力。
金属的强度:金属材料在载荷的作用下,抵抗塑性变形和断裂的能力。
铂金

铂金金属单质,是稀有的贵金属元素,元素符号为Pt。 铂金的名字来源于西班牙。铂族元素包含:铂、钯、 铑、钌、铱和锇这6种金属元素。 理化性质 铂族金属色泽美丽;延展性强;耐熔、耐摩擦、耐腐 蚀;在高温下化学性稳定。因此,它们有着广泛的用 途在铂族金属中,人们最熟悉用得最多的是铂金。它 比贵金属中的黄金、白银等更加稀少和贵重。 纯净的铂金呈银白色;具金属光泽。铂金的颜色和光 泽是自然天成的,历久不变。硬度为4.5。 跟黄金一样不溶于单一的硝酸、硫酸跟盐酸。硝酸+ 盐酸(即王水)二者混合能将其溶解。生成氯化金。 清洗时提醒顾客小心盗金。
铂金的常见链形
瓜子链、十字瓦片链(结实)、元宝车花链、长城链、蛇骨链(不能折)、满天星链 (挂头发)、板链、水波链、三珠一筒米字车花链等
水波纹链
瓜 子 链
(十字)瓦片链
元宝链
长城链
蛇骨链
三珠一筒米字车花链
水波纹链
生产工艺
熔金→倒模→抛光→执模 →打布轮→车花→电金。 熔金利用乙炔火焰烧石英坩埚(耐高温埚)内的铂金,使之熔炼成
国际铂金协会(PGI)
国际铂金协会由世 界上著名的铂金矿 业公司于1975年赞 助成立。协会一直 致力于全球铂金事 业的发展。跟全球 很多珠宝商家有着 战略合作关系。
铂金协会代言人
纯净、稀有和永恒,章子 怡勇敢、坚强、自信,凭 借多年来的勤奋和努力在 事业上变得愈发出色。这 正如纯净而坚韧的铂金, 闪耀迷人光芒.” 2007年3 月后,章子怡为铂金协会 代言人。
理化性质
延展性强,可拉成很细的铂丝,轧成极薄的铂箔;强度和韧性,也都 比其它贵金属高得多。1克铂金即使是拉成1.6公里长的细丝,也不会 断裂。 熔点高达1773.5℃。导热导电性能好。化学性质极其稳定,不溶于强 酸强碱,在空气中不氧化。铂金不吸水银,并具有独特的催化作用。
金的理化性质与用途

纯金为正黄色。金能与任何比例的银和铜形成合金。当金中含有杂质时,颜色会随之改变,含银量增加颜色变淡,含铜是增加颜色变深.金粉碎成粉末或碾成超薄金箔时,‘颜色可呈青紫色、红色、紫色乃至深揭色到黑色。 金的延展性在任何温度下都比其他金属的好。它的延伸率为39% ,坑拉强度为23kg/mm 2,可将金碾成千分之一mm的金箔,拉成比头发丝还细的金丝。但当其中含有铅、铭、啼、钥、锑、砷、锡等杂质时会变脆。如金箔中含铭达0.05%时甚至可以用手挂碎。 金的比重为19.29-19.37。金锭中由干含有一些气体,其比重较小,但经压延后比重会增大。 金在冶金炉中(温度1100-1300℃之间)熔炼时,它的挥发损失很小,约为0.01- 0.025%。但当炉料中含有挥发性杂质,如含锑或汞5%的合金等时,金的损失可达0.2%。金在熔炼时的“挥发”损失,主要是由于金有很强的吸气性引起的。金在熔融状态时,可吸收相当于自身体积37-46倍的氛,或33-48倍的氧。当改变冶金炉气氛,如把还原气氛改为氧化气氛成把氧化气氛改还原气氛或者进行浇铸时,熔融金属所吸收的大且气体,如氧、氢或一氧化碳等就会随着气氛的改变或金属的冷凝而放出,出现类似沸腾的现象。随着气体的喷出,就会有许多大大小小的金属珠喷起,其中较小的金属珠(特别是0.001mm以下的)被强烈的气流带走而造成飞溅损失。 金是最稳定的元素,在自然界中仅与啼形成天然化合物啼化金。金可溶于王水,也可与氮或碱金属氛化物(氛化钾、佩化钠等)作用生成氮或氛的化合物。此外,同时含有硝酸和硫酸的溶液也可溶解金,碱金属硫化物也会与金作用生成可溶性硫化金。碱对金无显著的侵蚀作用,单独的硫酸、盐酸或硝酸对金都不起作用。 金在化合物中常以一价和三价的状态存在。与提取金有关的主要化合物为金的氮化物和氛化物。 金与银可以以任何比例形成合金,但合金中的含银最只有在接近或大于70%时.硫酸或硝酸才可以溶解其中的全部银,残留的是M海 M,状的金。当用主水溶解金银合金时,由千所生成的氮化银覆盖子合金的表面,而使金的溶解停止。 金与铜可以任何比例形成合金。此合金的弹性强,但延展性较差。往金铜合金中加入银还可炼制成金银铜合金。 金与汞在任何比例下都能形成合金。其中因金、茉比例不同,合金可呈固体或液体状态。这是混汞法提金的墓础。本文来自:银浆回收 (/ )
金属钛粉(钛粉)的理化性质及危险特性表

本品易燃,具刺激性。
急救
措施
皮肤接触:
脱去污染的衣着,用肥皂水和清水彻底冲洗皮肤。
眼睛接触:
提起眼睑,用流动清水或生理盐水冲洗。就医。
吸入:
迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,给输氧。如呼吸停止,立即进行人工呼吸。就医。
食入:
饮足量温水,催吐。就医。
燃烧爆炸危险性
危险特性:
金属钛粉尘具有爆炸性,遇热、明火或发生化学反应会燃烧爆炸。其粉体化学活性很高,在空气中能自燃。金属钛不仅能在空气中燃烧,也能在二氧化碳或氮气中燃烧。高温时易与卤素、氧、硫、氮化合。
建规火险分级:
乙
有害燃烧产物:
氧化钛。
灭火方法:
采用干粉、干砂灭火。严禁用水、泡沫、二氧化碳扑救。高热或剧烈燃烧时,用水扑救可能会引起爆炸。
②储存注意事项:为安全起见,储存时常以不少于25%的水润湿、钝化。储存于阴凉、通风的库房。远离火种、热源。库温不超过30℃,相对湿度不超过80%。保持容器密封,严禁与空气接触。应与氧化剂、酸类、卤素等分开存放,切忌混储。配备相应品种和数量的消防器材。储区应备有合适的材料收容泄漏物。
③运输注意事项:运输时运输车辆应配备相应品种和数量的消防器材及泄漏应急处理设备。装运本品的车辆排气管须有阻火装置。运输过程中要确保容器不泄漏、不倒塌、不坠落、不损坏。严禁与氧化剂、酸类、卤素、食用化学品等混装混运。运输途中应防曝晒、雨淋,防高温。中途停留时应远离火种、热源。车辆运输完毕应进行彻底清扫。铁路运输时要禁止溜放。
金属钛(险货物编号:
41504
英文名:
titanium
UN编号:
1352
CAS号:
7440-32-6
钙的化学性质,物理性质,用途

钙的化学性质,物理性质,用途
钙的物理性质:银白色、质稍软的金属,有金属光泽。
属元素周期表中IIA族碱土金属,熔点842℃,沸点1484℃,密度1.55克/立方厘米,电离能6.11电子伏特。
钙的化学性质:活泼,在空气中表面上会形成一层氧化物或氮化物薄膜,以防止继续受到腐蚀。
钙可与氧反应生成氧化钙,与氮反应生成氮化钙Ca3N2,与氟、氯、溴、碘等反应生成相应卤化物,与氢气在400℃催化剂作用下生成氢化钙。
常温下跟水反应生成氢氧化钙并放出氢气,跟盐酸稀硫酸等反应生成盐和氢气,跟碳在高温下反应生成碳化钙CaC2;加热时几乎能还原所有金属氧化物,在熔融时也能还原许多金属氯化物。
钙在工业领域具体应用如下:脱氧剂:冶炼锡青铜、镍、钢时,钙用作脱氧剂。
脱水剂:钙是有机溶剂的脱水剂。
化学元素 金

化学元素金
金是一种化学元素,符号为 Au,原子序数为 79。
金是一种柔软、金黄色、有光泽的金属,具有良好的延展性和导电性。
金在自然界中以单质形式存在,通常与其他金属形成合金。
它是人类最早发现和使用的金属之一,被广泛用于珠宝制作、货币、电子设备、牙科材料等领域。
金的化学性质相对稳定,不易被氧化或腐蚀。
它在常温下不与大多数物质发生反应,但在特定条件下可以与氯气、氟气等物质发生反应。
金也可以与某些盐类形成配合物。
金在人类历史和文化中具有重要地位,被视为珍贵和有价值的物质。
它在不同文化中被用于制作珠宝、工艺品和宗教仪式。
此外,金也是国际金融体系中的重要储备货币之一。
总的来说,金作为一种化学元素,具有独特的物理和化学性质,在各个领域都有广泛的应用和重要的价值。
理化性质

三、在体内的过程
金属汞
进入途径
呼吸道:主要, 呼吸道:主要,占70%;蒸气形式 ; 消化道: 消化道:吸收极少 皮肤:仅见于含汞的油膏 皮肤:仅见于含汞的油膏
汞盐
有机汞
呼吸道: 呼吸道:气溶胶形式 完整皮肤 消化道 指同时悬浮于空气 中的粉尘、 中的粉尘、烟、雾 呼吸道 皮肤 消化道:吸收率达90% 消化道:吸收率达
特征性: 特征性: 易兴奋征 汞震颤 生产环境的劳动调查: 生产环境的劳动调查: 口腔炎 血 临床症状、体征和实验室检查: 临床症状、体征和实验室检查: 、尿、发汞 职业史: 职业史:诊断前提 驱汞诊断: 驱汞诊断: 对象:有密切铅接触史,有临床表现, 对象:有密切铅接触史,有临床表现,但 尿汞不高的人。 尿汞不高的人。
书写震颤 喝汤震颤 N衰弱症候群 衰弱症候群 N系统症状: 植物 功能紊乱 肉跳 系统症状: 系统症状 植物N功能紊乱 汞震颤(肌肉震颤) 汞震颤(肌肉震颤) 精神症状: 精神症状: 突出症状—易兴奋征 突出症状 易兴奋征 性格改变 口腔症状:主要表现—口腔炎 口腔症状:主要表现 口腔炎、齿龈炎 口腔炎、 其他: 胃肠道功能紊乱症状(部分) 其他: 胃肠道功能紊乱症状(部分) 肾功能损害(少数) 肾功能损害(少数) 月经失调(可有) 月经失调(可有) 意向性、 意向性、 动作性震颤
诊断为职业性慢性中度汞中毒
小结: 小结:
一、理化性质 二、接触机会 三、在体内的过程 四、病机制和临床表现 五、诊断及处理原则 六、治疗原则
要求: 要求:
了解理化性质、接触机会、 了解理化性质、接触机会、 在体内的过程 理解发病机制和临床表现 掌握诊断、处理、 掌握诊断、处理、治疗原则 重 点
四、发病机制与临床表现
初中-化学-人教版-人教版九年级化学1.1物质的变化与性质测试卷3

人教版九年级化学1.1物质的变化与性质测试卷3一、选择题下列历史典故中发生了化学变化的是()A. 火烧赤壁B. 司马光砸缸C. 刻舟求剑D. 铁杵磨成针下列变化中属于化学变化的是()A. 汽油挥发B. 海水晒盐C. 石蜡熔化D. 高粱酿酒下列变化中,属于化学变化的是()A. 干冰升华B. 食物腐败C. 铁丝弯曲D. 汽车爆胎下列变化中,属于化学变化的是()A. B.C. D.下列生产工艺中,不涉及化学变化的是()A. 烧制生石灰B. 海水晒盐C. 冶炼生铁D. 海水制镁诗词是中华民族灿烂文化的瑰宝。
下列古诗中不涉及化学变化的是()A. 爆竹声中一岁除,春风送暖入屠苏B. 忽如一夜春风来,千树万树梨花开C. 落红不是无情物,化作春泥更护花D. 千锤万凿出深山,烈火焚烧若等闲下列物质的用途,利用化学性质的是()A. 银用作导线B. 干冰用作制冷剂C. 蒸馏水用作配制溶液D. 小苏打用于治疗胃酸过多症下列物质的用途利用其物理性质的是()A. 氢气用作燃料B. 红磷可制作烟幕弹C. 氮气可充入食品包装袋防腐D. 稀有气体可用于制成电光源银是一种银白色金属,密度较大,具有良好的导电性,长期放置会被氧化而发黑。
其中属于银的化学性质的是()A. 银白色B. 密度较大C. 导电性良好D. 能被氧化下列物质的用途主要由物理性质决定的是()A. 氮气用于食品保鲜B. 干冰用于人工降雨C. 小苏打用于治疗胃酸过多症D. 氢氧化钠用作炉具清洁剂下列对甲烷性质的描述,属于化学性质的是()A. 极难溶于水B. 具有可燃性C. 标准状况下,密度比空气小D. 通常为无色、无味的气体物质的性质决定物质的用途,下列物质的用途由其物理性质决定的是()A. 酒精作燃料B. 铁锅作炊具C. 二氧化碳灭火D. 氮气作保护气下列有关物质用途的叙述中,不正确的是()A. 铜丝用作导线B. 碳酸钙用作补钙剂C. 浓硫酸用作食品干燥剂D. 小苏打用于焙制糕点根据物质的性质与用途。
常见化学品理化性质表
手防护:戴一般作业防护手套。
其他防护:工作现场严禁吸烟。避免高浓度吸入。进入罐、限制性空间或其他高浓度区作业,须有人监护。
液氮的理化性质及危险特性
标识
中文名:液氮
分子式:N2
分子量:28.01
英文名:Liquid nitrogen
UN编号:1977
CASNo:7727-39-9
人进入高浓度二氧化碳环境在几秒钟内迅速昏迷倒下反射消失瞳孔扩大或缩小大小便失禁呕吐等更严重者出现呼吸停止及休克甚至死亡
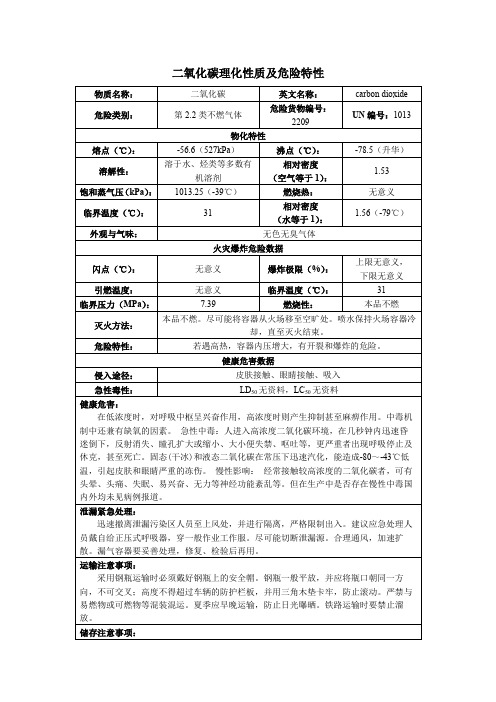
二氧化碳理化性质及危险特性
物质名称:
二氧化碳
英文名称:
carbon dioxide
危险类别:
第2.2类不燃气体
危险货物编号:2209
UN编号:1013
物化特性
熔点(℃):
-56.6(527kPa)
溶解性:微溶于水、乙醇
毒性及健康危害
接触限值(中国MAC):未制定标准
毒理学资料:LD50无资料,LC50无资料
侵入途径:无资料
健康危害:皮肤接触液氮可致冻伤。如在常压下气化产生的氮气过量,可使空气中氧分压下降,引起缺氧窒息。
急救措施:
吸入:迅速脱离现场至空气新鲜处。保持呼吸通畅。如呼吸困难,给吸输氧。如呼吸停止,立即进行人工呼吸。就医。
储存注意事项:
储存于阴凉、通风的库房。远离火种、热源。库温不宜超过30℃。应与易(可)燃物分开存放,切忌混储。储区应备有泄漏应急处理设备。
操作注意事项:
密闭操作。密闭操作,提供良好的自然通风条件。操作人员必须经过专门培训,严格遵守操作规程。防止气体泄漏到工作场所空气中。远离易燃、可燃物。搬运时轻装轻卸,防止钢瓶及附件破损。配备泄漏应急处理设备。
氰化金钾的理化性质及危险特性
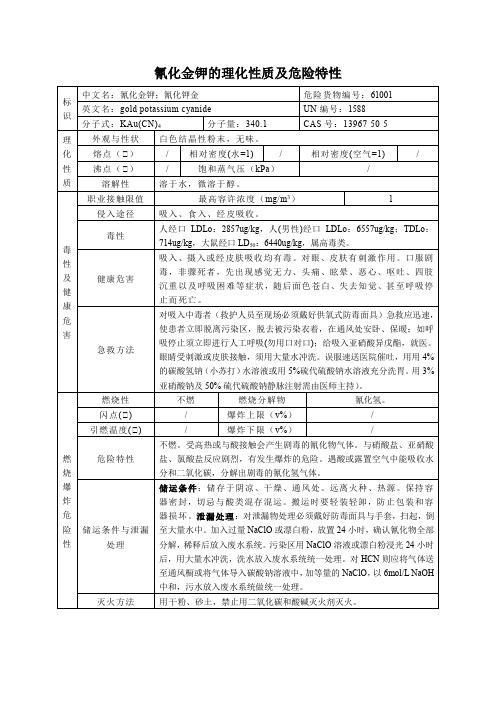
吸入、摄入或经皮肤吸收均有毒。对眼、皮肤有刺激作用。口服剧毒,非骤死者,先出现感觉无力、头痛、眩晕、恶心、呕吐、四肢沉重以及呼吸困难等症状,随后面色苍白、失去知觉、甚至呼吸停止而死亡。
急救方法
对吸入中毒者(救护人员至现场必须戴好供氧式防毒面具)急救应迅速,使患者立即脱离污染区,脱去被污染衣着,在通风处安卧、保暖;如呼吸停止须立即进行人工呼吸(勿用口对口);给吸入亚硝酸异戊酯,就医。眼睛受刺激或皮肤接触,须用大量水冲洗。误服速送医院催吐,用用4%的碳酸氢钠(小苏打)水溶液或用5%硫代硫酸钠水溶液充分洗胃。用3%亚硝酸钠及50%硫代硫酸钠静脉注射需由医师主持)。
/
沸点(℃)
/
饱和蒸气压(kPa)
/
溶解性
溶于水,微溶于醇。
毒性及健康危害
职业接触限值
最高容许浓度(mg/m3)
1
侵入途径
吸入、食入、经皮吸收。
毒性
人经口LDLo:2857ug/kg,人(男性)经口LDLo:6557ug/kg;TDLo:714ug/kg,大鼠经口LD50:6440ug/kg,属高毒类。
氰化金钾的理化性质及1001
英文名:gold potassium cyanide
UN编号:1588
分子式:KAu(CN)4
分子量:340.1
CAS号:13967-50-5
理化性质
外观与性状
白色结晶性粉末,无味。
熔点(℃)
/
相对密度(水=1)
/
相对密度(空气=1)
燃烧爆炸危险性
燃烧性
不燃
燃烧分解物
氰化氢。
闪点(℃)
/
爆炸上限(v%)
/
引燃温度(℃)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
金的理化性质与用途
纯金为正黄色。
金能与任何比例的银和铜形成合金。
当金中含有杂质时,颜色会随之改变,含银量增加颜色变淡,含铜是增加颜色变深.金粉碎成粉末或碾成超薄金箔时,‘颜色可呈青紫色、红色、紫色乃至深揭色到黑色。
金的延展性在任何温度下都比其他金属的好。
它的延伸率为39%,坑拉强度为23kg/mm2,可将金碾成千分之一mm的金箔,拉成比头发丝还细的金丝。
但当其中含有铅、铭、啼、钥、锑、砷、锡等杂质时会变脆。
如金箔中含铭达0.05%时甚至可以用手挂碎。
金的比重为19.29-19.37。
金锭中由干含有一些气体,其比重较小,但经压延后比重会增大。
金在冶金炉中(温度1100-1300℃之间)熔炼时,它的挥发损失很小,约为0.01-0.025%。
但当炉料中含有挥发性杂质,如含锑或汞5%的合金等时,金的损失可达0.2%。
金在熔炼时的“挥发”损失,主要是由于金有很强的吸气性引起的。
金在熔融状态时,可吸收相当于自身体积37-46倍的氛,或33-48倍的氧。
当改变冶金炉气氛,如把还原气氛改为氧化气氛成把氧化气氛改还原气氛或者进行浇铸时,熔融金属所吸收的大且气体,如氧、氢或一氧化碳等就会随着气氛的改变或金属的冷凝而放出,出现类似沸腾的现象。
随着气体的喷出,就会有许多大大小小的金属珠喷起,其中较小的金属珠(特别是0.001mm以下的)被强烈的气流带走而造成飞溅损失。
金是最稳定的元素,在自然界中仅与啼形成天然化合物啼化金。
金可溶于王水,也可与氮或碱金属氛化物(氛化钾、佩化钠等)作用生成氮或氛的化合物。
此外,同时含有硝酸和硫酸的溶液也可溶解金,碱金属硫化物也会与金作用生成可溶性硫化金。
碱对金无显著的侵蚀作用,单独的硫酸、盐酸或硝酸对金都不起作用。
金在化合物中常以一价和三价的状态存在。
与提取金有关的主要化合物为金的氮化物和氛化物。
金与银可以以任何比例形成合金,但合金中的含银最只有在接近或大于70%时.硫酸或硝酸才可以溶解其中的全部银,残留的是M海M,状的金。
当用主水溶解金银合金时,由千所生成的氮化银覆盖子合金的表面,而使金的溶解停止。
