第六章配位化合物结构和性质
配位化合物的结构和性质

2
3
sp
sp2
直线形
平面三角形
[Ag(NH3)2]+
[CuCl3]2-
4
sp3
d3s dsp2
四面体
四面体 平面正方形 三角双锥形 四方锥形
[Ni(NH3)4]2+
MnO4[Ni(CN)4]2Fe(CO)5 [TiF5]2-
5
dsp3 d4s
6
d2sp3
八面体
[Fe(CN)6]3-
6.2 价键理论
(3) 平行正方形场
在平行正方形配合物中,四个配体沿x,y轴正负方向与
中心离子接近。 在平行正方形配合物中,dx2-y2轨道的电子云极大值方向 指向配体,因此能级最高,高于Es能级;dxy 轨其也在xy平面上,所以
也要受到较大的排斥故能级也高于Es能级;dz2 轨道的能级 较低,低于Es能级;dyz和dxz轨道受到的排斥作用相同,是 简并的,能级最低。这样,在平面正方形场中,能级分裂为 四组。
由于△值通常从光谱确定,故称这个顺序为光谱化学序列。
分裂能和成对能
b) 当配体固定时,分裂能随中心离子的不同而不同,其
大小次序为:
Pt 4 Ir 3 Pd 4 Rh3 Mo3 Ru3 Co3 Cr 3 Fe 3 V 2 Co2 Ni 2 Mn2
中正负离子的静电作用;
中心离子在配体的静电作用下,使原来简并的d轨道分 裂成能级不同的几组轨道;
d电子在分裂的d轨道上重新排布,优先占据能量较低
的轨道,往往使体系的总能量有所降低,形成强场低自 旋、弱场高自旋的配合物。
二、d轨道在晶体场中的分裂
d原子轨道的角度分布图
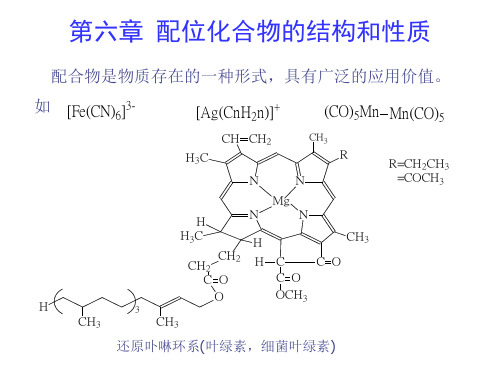
配位化合物的结构与性质

配位化合物的结构与性质配位化合物是由中心金属离子和周围的配体离子或分子通过配位键结合形成的化合物。
由于配体的性质和配位方式的不同,配位化合物具有丰富的结构和性质。
本文将从配位化合物的结构和性质两个方面进行探讨。
一、配位化合物的结构配位化合物的结构主要包括中心金属离子和配体的组成以及它们之间的配位方式。
1. 中心金属离子中心金属离子是配位化合物的核心,它通常是一个带正电荷的离子。
常见的中心金属离子有过渡金属、稀土金属和镧系金属等。
不同的中心金属离子具有不同的电子排布和电子轨道结构,因此导致了不同的化学性质和配位特性。
2. 配体配体是与中心金属离子形成配位键的离子或分子。
常见的配体包括氨、水、氯化物、亚硝酸根、硫氰酸根等。
它们具有孤对电子或反应活性基团,能够提供一对或多对电子给中心金属离子形成配位键。
不同的配体具有不同的硬软酸碱特性,从而影响了配位键的强度和稳定性。
3. 配位方式配位方式是指配体与中心金属离子形成的空间排布方式。
常见的配位方式有线性、平面、四面体、八面体等。
不同配位方式对应于不同的配体数目和配位键的排布方式,从而影响了配位化合物的结构和性质。
二、配位化合物的性质配位化合物的性质主要由中心金属离子和配体的性质以及它们之间的配位方式决定。
1. 化学性质配位化合物具有多种多样的化学性质。
一方面,中心金属离子的价态和电子排布可以影响配位键的稳定性和反应活性;另一方面,配体的硬或软酸碱特性影响了配位键的强度和反应性。
通过改变中心金属离子和配体的性质,可以调控配位化合物的催化活性、化学吸附性能等。
2. 物理性质配位化合物的物理性质包括颜色、磁性、光学性质等。
其中,颜色是由于配位化合物中的电子跃迁所引起的,不同电子能级之间的跃迁导致了不同的吸收光谱和颜色。
磁性是由于中心金属离子孤对电子或配体的磁性所引起的,不同的磁性表现出不同的磁化行为。
光学性质则与配位化合物的吸收、散射、透射等相关。
3. 结构性质配位化合物的结构性质包括配位键长度、配位键角度等。
配位化合物的结构与性质

具有空的价轨道
2010-11-19
2
一. 配合物概述
配合物是由中心金属原子(M)与配位体 (L) 按一定的组成和空 间构型组成的化合物 (MLn),是金属离子最普通的一种存在形 式。其中: n = 2~12,主要是 4和6
特点: 中心原子具有空的价轨道 配位体具有孤对电子或多个非定域电子 通过配键形成――配位离子和配位化合物分子 类型: 以中心原子数的多少分为单核或多核配位化合物 多核可以形成M一M之间有键结合的金属原子簇化合物
2010-11-19
3
应用领域: 分析化学,分离化学,催化化学,生物化学,分子生物学,
酶学,检验,分离,沉淀,络合,增溶,染料,生物,叶绿素 ( Mg ) , 血红素(Fe) ,细胞色素( Cu , V )等。
主要理论: 价键理论,配位场理论
配位体: 具有孤对电子或π键电子并能与金属离子进行配位的原子
H2 C
NH2
C
C
O
OO
O
EDTA4-乙二胺四乙酸根
乙二胺en
2010-11-19
6
二. 配位化合物结构理论
价键理论――晶体场理论――分子轨道理论――配位场理论
杂化轨道 静电作用模型 MOT处理配键 配位化合物的
VBT理论 共价配键
MOT+CFT
电价配键
1. VBT ① 共价配键和d-s-p杂化轨道(低自旋化合物)
第六章 配位化合物的结构与性质
2010-11-19
1
配位化合物过去叫络合物,是一类比较复杂的分 子,一般是指由中心原子(过渡金属原子或离子) 与若干配体以配位键结合而成的化合物。
(有孤对电子或π键的分子或阴离子) 配体
《结构化学第六章》
产生磁性的原因: 物质具有不同的磁性,首先是源于物质内部的电子组
态,即电子在原子轨道和分子轨道上的排布情况;其次是 源于化学成分、晶体结构、晶粒组织和内应力等因素,这 些因素引起磁矩排列的情况不同。
.
物质的磁结构分类:
.
6.6.2 顺磁共振
顺磁共振是研究具有未成对电子的物质,如配合物、 自由基和含有奇数电子的分子等顺次性物质结构的一种重 要方法,它又称为电子顺磁共振(EPR)或电子自旋共振 (ESR)。 原理:
.
三种成键方式(自由基反应):
6.5.3 簇合物的催化性能(自学)
.
6.6 物质的磁性和磁共振
磁性是普遍存在的一种物质属性,任何一种物质材料 都有磁性,只不过表现形式和程度有所不同。物质的磁性 常用磁化率х或磁矩μ表示。磁化率是在外磁场H中物质 磁化强度M和磁场强度H的比值:
M/H
Χ是一个无量纲的量。
因子是为了使δ得到一个便于表达的数值。
对于扫频仪器,δ可以如下表达成
Δ是i 无量v纲 v参的,1由0于6 乘10v6因i v子参v,参所以1单0位6为ppm。
.
影响化学位移的因素: (1)核外电子分布 (2)抗磁各向异性效应 (3)溶剂效应和氢键的影响
.
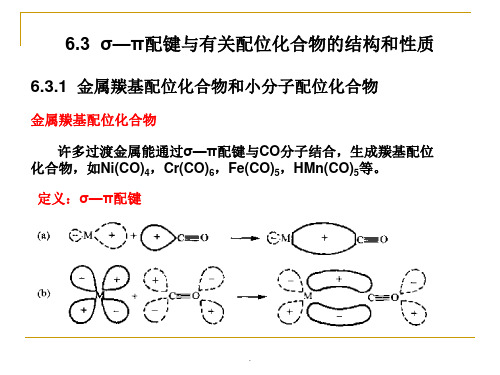
3.磷、砷、锑、铋的三价化合物,如PF3、PCl3、AsCl3、 SbCl3、PR3等也可作为配位体形成σ—π配键。P、As等原子除 有一孤对电子可以作为电子对的供给者,与M形成σ键外,它还 有空的d轨道可和M形成反馈π键,使配位化合物稳定存在,例如 Pd(PF3)4、HCo(PF3)4、Ni(PF3)4、(R3P)4Mo(CO)2等。
.
6.3.2 不饱和烃配位化合物
以不饱和烃为配位体,通过σ—π配键与过渡金属形成的 配位化合物,在石油化工中占有重要地位。
配位化合物的结构与性质

配位化合物的结构与性质配位化合物是由中心金属离子和一定数量(通常2-10个)的可供配位的分子或离子(配体)通过配位键结合而形成的化合物。
它是化学中非常重要的一类分子,具有多种结构和性质。
结构特点配位化合物最明显的结构特点是中心金属离子和配体之间的配位键,通常是通过金属离子上的空位轨道与配体上的待键电子形成的。
这种配位键形成的结果是形成了一个略呈正八面体或正四面体形态的金属配合物分子。
这种结构基本的几何参数是配合物中金属离子和配体之间的键长,金属离子上配位轨道形态的种类,以及金属离子和配体之间的角度。
除此之外,配位化合物还表现出明显的立体性。
比如说,在多数属于八面体结构的金属配合物中,配体的排布方式并不对称,导致配合物整体呈现出某种程度的非对称性。
性质特点配位化合物的性质特点十分丰富。
这类化合物同时拥有金属离子和配体的特性,因此它们的物理化学性质具有较强的多样性。
化学反应:配合物可以催化反应或受体原位离子介导的化学反应,具有种种反应规律,并可以通过多种方法来改变它的反应方式和反应速率等性质。
比如说,常见的螯合反应和配体置换反应等。
光学性质:许多金属配合物由于其具备特殊的结构和电子状态,有着比较特殊的发射和吸收光谱。
在吸收光谱方面,金属配合物可以吸收具有相应能量的光线。
而在发射光谱方面,则是通过激发过程所带来的电子的反跃而发出特定的光线。
这种光学性质已被广泛采用于生物分子探针和材料科学领域。
磁性:由于金属中心离子的未配对电子结构,在许多情况下会带来显著的磁性效应。
基于这种效应,配位化合物在磁性和电子学领域中有着广泛应用。
酸碱性:金属离子通常处于一种特殊的氧化态,因此对酸碱性的响应性也具有特殊的特点。
这种性质使得一些金属配合物具备了很好的可控酸碱催化性质,也有助于在一些化学反应循环中使反应处于最佳的酸碱平衡状态。
总体而言,配位化合物是现代化学中一类重要的分子。
它的复杂性和多样性在众多领域中的应用前景十分广泛,其中包括生物医学和材料科学等重要领域。
配位化合物的结构和性质特征

配位化合物的结构和性质特征配位化合物是由中心金属离子与周围的配体结合形成的化合物。
它们具有独特的结构和性质特征,这些特征决定了它们在许多领域的广泛应用。
结构特征配位化合物的结构由中心金属离子以及配体之间的化学键决定。
其中,中心金属离子通过配位键与配体结合。
这些化学键可以是金属与配体的共价键或离子键,具体取决于配合物的性质和配体的性质。
配位化合物的结构也受到配体的环境影响。
配体的化学性质和空间取向可以影响配位化合物的几何构型,如线型、平面和立体构型。
此外,配位化合物常常存在不同的立体异构体,其中配体或配位数的变化会产生不同的空间结构。
这些结构特征对于配位化合物的性质和反应活性具有重要意义。
性质特征配位化合物的性质和特征可以分为以下几个方面:1. 稳定性:配位化合物通常比相应的金属离子更稳定,这是由于配体的共价键或离子键使得整个配位体更加稳定。
配位化合物的稳定性取决于中心金属离子和配体之间的相互作用。
2. 反应活性:配位化合物可以通过与其他化合物发生反应来改变其结构和性质。
例如,配位化合物可以与其他配体交换,形成新的配位体结构。
这种反应活性使得配位化合物在催化、药物和材料等领域具有广泛的应用。
3. 光谱特征:配位化合物在光谱学中表现出独特的吸收和发射特征。
它们可以通过紫外-可见光谱、红外光谱、核磁共振光谱等技术进行表征。
这些光谱特征可以用于确定配位化合物的结构和配位键的性质。
4. 磁性:一些配位化合物具有磁性。
这是由于金属离子和配体之间的相互作用导致了磁性的产生。
磁性配位化合物在材料科学和医药领域具有重要的应用价值。
总结起来,配位化合物的结构和性质特征对于理解其化学性质和应用具有重要意义。
通过研究和分析配位化合物的结构和性质,我们可以更好地应用它们在催化、药物和材料等领域,并进一步探索其潜在的应用价值。
第六章 配位化合物的结构和性质

0
1 2
0
0.4 0.8
0
0.4 0.8
3
4 5
1.2
0.6 0
1.2
1.6 2.0
6
7 8 9 10
0.4
0.8 1.2 0.6 0
2.4
1.8 1.2 0.6 0
辽宁石油化工大学
三、 配合物的构型畸变与Jahn-Teller效应
下表列出了八面体场中产生畸变的电子结构:
八面体畸变 小畸变 大畸变
20300cm -1 24900cm
-1
后者的比前者增大了 23%
辽宁石油化工大学
分裂能的大小可由光谱数据推得 例如: Ti3+ 具有d1组态 ,在 [Ti(H2O)6]3+ 中发生d→d跃迁:
(t 2 g ) (e g ) (t 2 g ) 0 (e g )1
辽宁石油化工大学
d x2 y 2
d
d xy
d z2 d xz , d yz
球对称场
正方形场
在正方形场中轨道能级的分裂图
辽宁石油化工大学
eg
t2
d
d x2 y 2
d xy
d z2
e
四面体场 球对称场
t2 g
八面体场
d xz , d yz
正方形场
图6.3 各种配位场中金属d轨道能级的分裂情况
[FeF6]3-, [Ni(NH3)6]2+
Fe3+ 3d5 Ni2+ 3d8
n=5 n=2
中心离子采用sp3d2杂化,呈八面体构型
自旋平行的电子达到可允许的最大值,称为高自旋配合物
2. 共价配键
共价配合物:中心离子的d电子重排,空出轨道,进行dsp内 轨杂化,接受配位体孤对电子,形成低自旋共价配合物。 在共价配键的形成中,可设想成几个部分: (1) 重排:中央离子为了尽可能多成键,往往发生电子重排 ,使之自旋配对,腾出空轨道,以参加杂化。 (2)杂化:空出的d轨道与s、p轨道一起杂化。 (3)成键:每个配体提供一对电子与一条杂化轨道形成一个配 建,因此 分子构型与杂化构型一致。 例如
结构化学课件-配位化合物的结构和性质

二茂铁分子中两个C5H5环平行,之间距离为332pm;所有CC键的键长都相等的,为140pm;Fe原子位于两个C5H5环之 间,与十个碳原子等距离,Fe-C之间的距离为204pm。
上一内容 下一内容 主目录
College of Chemistry, LNU
配位化合物的结构
上一内容 下一内容 主目录
上一内容 下一内容 主目录
College of Chemistry, LNU
配位化合物的结构
-配键
CO的5与金属的空d轨道作用形成键,由CO提供电子。 金属的d轨道与CO的*轨道作用形成键,由金属提供电子
,称为反馈键。
上一内容 下一内容 主目录
College of Chemistry, LNU
6.1.2 -配键及金属羰基配位化合物的结构
CO作为配体的特点
二电子给体,不因配位形式或金属骨干的价态改变而改 变。
协同成键效应,可以获得显著的稳定能,直接有利于过 渡金属配位化合物的形成。
配位原子是C而不是O,与一般含氧配体不同
CO的电子组态是 12223242145220 最高占据轨道5主要是由C的原子轨道提供,电荷密度偏 向C。
配位化合物的结构
金属羰基配位化合物的磁性
一般是反磁性,只有个别例外,如V(CO)6
单核和多核金属羰基配位化合物
CO提供两个电子,金属M的价电子数N为偶数 单核羰基配位化合物,CO的数目9-N/2
N为奇数 多核羰基配位化合物
上一内容 下一内容 主目录
College of Chemistry, LNU
上一内容 下一内容 主目录
College of Chemistry, LNU
配位化合物的结构
一些含金属-金属四重键的化合物
结构化学第六章配位化合物的结构和性质
3. 分子轨道理论-MO
分子轨道理论是用分子轨道理论的观点和方法 处理金属离子和配位体的成键作用。
cM M cL L
满足对称性匹配、轨道最大重叠、能级高低相 近等条件,对称性匹配在其中起突出作用。
4. 配位场理论-MOT
配位场理论是晶体场理论的发展,其实质是配 位化合物的分子轨道理论。在处理中心金属原 子在其周围配位体所产生的电场作用下,金属 原子轨道能级发生变化时,以分子轨道理论方 法为主,根据配位体场的对称性进行简化,并 吸收晶体场理论的成果,阐明配位化合物的结 构和性质。
配位场稳定化能(LFSE)
定义:d电子从未分裂的d轨道(能级为ES)进入 分裂后d轨道所产生的总能量下降值。
计算 d6:八面体场 弱场高自旋:(t2g)4(eg)2
LFSE 4 4 D g 2 6 D g 4 D g
强场低自旋:(t2g)6(eg)0
LFSE 6 4 D g 24 D g
6.2 配位场理论
(1)配合物中化学键的本质是纯粹的静电作用; (2)过渡金属的中心离子有5个d轨道,当它们受到周围非球形 对称的配位负电场的作用时,d轨道要发生分裂,此现象 称为配位场效应; (3)同一构型的配合物,中心离子电荷越多,周期越大,分裂 能越大,对同一中心离子的分裂能随配位体场强弱不同而 异; (4)当电子成对能“P”大于分裂能“”时,电子尽量不成对 ,形成高自旋;如P小于时,电子尽量成对,形成低自旋 ; (5)大,配离子稳定,所以强场配体配合物稳定性大。
d6:四面体场,必是高自旋 : (e)3(t2)3
2 4 3 4 LFSE 3 10 D g 3 10 D g 2.7 D g 5 9 5 9
配位化合物的结构与性质

配位化合物的结构与性质配位化合物是指由中心金属离子和周围配位体(也称为配位络合物)通过配位键相互结合而形成的化合物。
它们广泛存在于生命系统、催化剂和材料科学等领域,具有丰富的结构和性质。
本文将重点讨论配位化合物的结构与性质,并进一步探讨其中的影响因素。
一、结构特征1. 配位数与配位键类型:配位化合物的结构特征受到中心金属离子的配位数和配位键类型的影响。
根据配位基团与金属之间的配位键数,我们可以区分出单齿、双齿、三齿等不同的配位体。
例如,一种醋酸盐配合物中,乙酸根离子通过氧原子与金属离子形成双齿配位,而三齿配体可通过三个原子与金属离子形成配位键。
2. 配位几何构型:配位基团与金属之间的配位键具有一定的空间取向,导致配位化合物呈现不同的配位几何构型。
常见的配位几何构型包括线性、四方形、八面体等。
例如,一种八面体配合物中,六个配位基团通过配位键与中心金属离子连接,使得配合物的结构形成了八面体状。
二、理化性质1. 稳定性和热稳定性:配位化合物通常具有较高的稳定性,这归功于金属与配位体之间的强的配位键。
这些配位键不易被热量或其他外界条件破坏,从而赋予了配位化合物良好的热稳定性。
2. 磁性和颜色:配位化合物中的中心金属离子在配位体的影响下,可以表现出不同的磁性和颜色。
例如,一些配位化合物由于自旋和有序排列引起的相互作用,表现出磁性行为。
同时,由于配位体的电子结构调节作用,配位化合物还会呈现出不同的颜色。
这些性质的变化可以用于研究配位化合物的性质和应用。
三、影响因素1. 配位体的选择:配位体的选择对配位化合物的结构和性质有着重要影响。
不同类型的配位体具有不同的电子性质和空间取向,从而影响了配位化合物的配位数和配位几何构型。
2. 金属离子的性质:金属离子的尺寸、电子组态和电荷状态等也会影响配位化合物的结构和性质。
例如,金属离子的电荷状态越高,它与配位体之间的相互作用越强,从而使配位化合物的稳定性增加。
3. 外界条件:一些外界条件,如温度、压力和溶剂等,也会影响配位化合物的结构和性质。
配位化合物的结构与性质

配位化合物的结构与性质
配位化合物是由中心金属离子与周围的配体离子共同构成的。
它们的结构和性质对于理解和应用这些化合物具有重要意义。
结构
配位化合物的结构由中心金属离子和配体离子之间的配位键连接模式所决定。
常见的配位键连接模式包括线性、平面和立体等。
- 线性配位键连接模式:配体离子在平衡位置排列,形成一条直线连接中心金属离子。
- 平面配位键连接模式:配体离子在平衡位置排列,形成一个平面与中心金属离子相连接。
- 立体配位键连接模式:配体离子在平衡位置排列,形成一个立体结构与中心金属离子相连接。
性质
配位化合物具有一系列独特的性质,包括磁性、光学性质和化
学活性。
- 磁性:配位化合物中的中心金属离子通过与配体离子之间的
电子转移产生磁性。
它们可以表现出顺磁性或反磁性,这取决于中
心金属离子和配体离子之间的电子排列方式。
- 光学性质:一些配位化合物具有特殊的光学吸收和发射性质,可以用于制备染料、荧光标记物等。
- 化学活性:由于中心金属离子和配体离子之间的配位键的特
殊性质,配位化合物在化学反应中表现出不同的活性。
它们可以参
与配位交换反应、氧化还原反应等。
结构和性质的研究对于配位化合物的设计和合成具有重要意义。
通过了解配位化合物的结构和性质,我们可以合理设计新型配位化
合物以满足不同的应用需求。
第六章--配合物的结构和性质

• VBT的基本要点: 的基本要点: 的基本要点
和配体L之间 (A)配合物的中心离子 和配体 之间,是由中心离子提供 )配合物的中心离子M和配体 之间, 与配位数相图的空轨道来接受配体提供的孤对电子, 与配位数相图的空轨道来接受配体提供的孤对电子,形成配 位键。 位键。 有空轨道,: 3有孤对电 ,:NH 如:在[Cu(NH3)4]2+中,Cu2+有空轨道,: ( 故可以形成配位键: 子,故可以形成配位键:见P69。 。 (B)为了形成稳定的配合物,中心离子采取杂化轨道与配位 )为了形成稳定的配合物, 原子形成σ配键, 原子形成σ配键,杂化轨道的类型与配位个体的配位键型和 空间构型相对应。 P71表 空间构型相对应。见P71表。
●单核配位化合物:一个配位化合物分子(或离子)中只含有一 单核配位化合物:一个配位化合物分子(或离子) 单核配位化合物 个中心原子。 个中心原子。 ●多核配位化合物:含两个或两个以上中心原子。 多核配位化合物:含两个或两个以上中心原子。 ●金属原子簇化合物:在多核配位化合物中,若M—M之间有键 金属原子簇化合物:在多核配位化合物中, 之间有键 合称为金属原子簇化合物 金属原子簇化合物。 合称为金属原子簇化合物。 ●配位化合物是金属离子最普遍的一种存在形式。 配位化合物是金属离子最普遍的一种存在形式。 ●金属离子和不同的配位体结合后,性质不相同,可以进行溶解、 金属离子和不同的配位体结合后,性质不相同,可以进行溶解、 沉淀、萃取,以达到合成制备、分离提纯、分析化验等目的。 沉淀、萃取,以达到合成制备、分离提纯、分析化验等目的。
内轨型配合物: 内轨型配合物: 为外轨型配合物, 如[FeCN6]3- 为外轨型配合物,见P69。 。 特点: 轨道参与杂化; 特点:(n-1)d轨道参与杂化;配体的孤对电子部分 轨道参与杂化 进入中心离子的( ) 轨道中 轨道中; 进入中心离子的(n-1)d轨道中;配体一般为电负 性小的原子, 性小的原子,如C,P,因电负性小,易给出电子, ,因电负性小,易给出电子, 对中心离子的价层电子结构有强烈的影响。 对中心离子的价层电子结构有强烈的影响。因此内 轨型配位键形成时打乱了中心离子的外层电子排布。 轨型配位键形成时打乱了中心离子的外层电子排布。
配位化合物的结构和性质

配位化合物的结构和性质配位化合物是由中心金属离子与周围配体形成的化合物。
它们具有多种不同的结构和性质,对于化学领域的研究和应用有着重要的意义。
一、结构配位化合物的结构可以分为线性、平面四方形、八面体和正方形平面等多种形式。
其中,线性结构是指配体以直线形式与中心金属离子相连,形成一条直线。
而平面四方形结构则是指配体以四个顶点的方式与中心金属离子相连,形成一个四边形平面。
八面体结构则是指配体以六个顶点的方式与中心金属离子相连,形成一个八面体。
正方形平面结构则是指配体以四个顶点的方式与中心金属离子相连,形成一个正方形平面。
这些不同的结构形式决定了配位化合物的物理和化学性质。
二、性质1. 形成常数:形成常数是衡量配位化合物形成程度的指标。
它是指配体与中心金属离子结合形成配位化合物的平衡常数。
形成常数的大小与配体与中心金属离子的亲和力有关,一般来说,形成常数越大,配位化合物的形成越稳定。
2. 配位键的强度:配位键的强度是指配体与中心金属离子之间的键的强度。
它取决于配体的性质以及配位化合物的结构。
一般来说,配位键的强度越大,配位化合物的稳定性越高。
3. 配位化合物的颜色:配位化合物常常具有丰富的颜色。
这是由于配体与中心金属离子之间的电子转移引起的。
当配体中的电子跃迁到中心金属离子的d轨道时,会吸收一定波长的光,产生特定的颜色。
4. 磁性:配位化合物的磁性是由中心金属离子的电子结构决定的。
当中心金属离子的d轨道未被配体完全填满时,配位化合物会表现出磁性。
具体来说,如果中心金属离子的d轨道未被配体填满一半,则为顺磁性;如果中心金属离子的d轨道被配体填满一半,则为抗磁性。
5. 光学活性:某些配位化合物具有光学活性,即能够旋转平面偏振光的偏振面。
这是由于配位化合物中的手性中心引起的。
手性中心是指一个分子中存在对映异构体的碳原子或金属离子。
三、应用配位化合物的结构和性质对于化学领域的研究和应用有着重要的意义。
首先,通过研究不同结构的配位化合物,可以深入了解化学反应的机理和动力学过程。
第6章 配位化合物的结构和性质

例
HgI3
四方锥 三角双锥
SbCl
2 5
Fe(CO)5
6.1.2 配位化合物结构理论的发展
配合物中的化学键一直是化学家们十分感兴 趣的一个领域,为了解释配位化合物中中心 离子与配位体间的成键本质,化学家们进行 了长期的探索,先后提出过好几种理论,其 中最有影响的有以下四种。
1. 价键理论(VBT)
[Co(NH3)6]3+、[HgI4]2-、Ni(CO)4 等复杂离子或分 子,其中都含配位键,所以它们都是配位单元。由它们 组成的相应化合物则为配合物。如:
[Co(NH3)6]Cl3、k2[HgI4]、Ni(CO)4
配位化合物的组成
內界
外界
Cu(NH3)4 SO4
配位数
中心离子
配位体
单啮配位体 多啮配位体
配合物的磁性
磁 性:物质在磁场中表现出来的性质。 顺磁性:被磁场吸引的性质 µ> 0 , n > 0 。例如:O2,NO, NO2等物质具有顺磁性。 反磁性:被磁场排斥的性质 µ= 0 , n =0 。大多数物质具有反 磁性。 铁磁性:被磁场强烈吸引的性质。例如:Fe,Co,Ni属于铁 磁性物质。
氧化值为+1的离子常形成配位数为2的配合物,如 [Ag(NH3)2]+,[AgCl2]-和[AgI2]-等。
Ag+与NH3形成配合物时,Ag+与5s,5p轨道杂化接受2个NH3的 孤对电子成键:
② 配位数为 4 的配合物
空间构型两种:四面体与平面正方形,这取决于形成体的 价层电子结构和配体的性质。
H2[HgI4] K2[SiF6] K2[Co(SO4)2] [Ag(NH3)2]Cl [CrCl2(NH3)4]·Cl·2H2O K[PtCl3NH3] [Co(NH3)5H20]Cl3
结构化学基础-6配位化合物的结构和性质

4 t 0 9 ☻ 立方体场( Oh, 8 配位):
☻ 平面正方形场(D4h):
4 8 = 2 t 2 0 0 9 9
x y2
Ed 2
Ed xy Eb1 g Eb2 g 10 Dq
所以,d 8 结构形成平面正方形结构者甚多。但当 Dq 较小时 (弱场),也可能形成正四面体配位化合物。
• N2的HOMO(3g)能量比CO低,而LUMO轨道又比 CO的高 • 即 N2 较 CO 来说,既不易给出电子,又不易 接受电子。 • 所以 N2 分子配合物不易合成。
磷配体
金属不饱和烃配合物
• 1825年, Zeise(蔡斯)盐:PtCl3(C2H4)]–K+
金属不饱和烃配合物
• 这样既可防止由于形成配键使电荷过分集 中到金属原子上,又促进成键作用。
核磁共振
研究对象:原子核的磁矩在磁场中对电磁波的吸收和发射
• 第1次,美国科学家Rabi发明了研究气态原子核磁性的共振方法,获 l944年诺贝尔物理学奖。 • 第2次,美国科学家Bloch(用感应法)和Purcell(用吸收法)各自独 立地发现宏观核磁共振现象,因此而获1952年诺贝尔物理学奖。 • 第3次,瑞士科学家Ernst因对NMR波谱方法、傅里叶变换、二维谱技 术的杰出贡献,而获1991年诺贝尔化学奖。 • 第4次,瑞士核磁共振波谱学家Kurt Wüthrich,由于用多维NMR技术在 测定溶液中蛋白质结构的三维构象方面的开创性研究,而获2002年诺 贝尔化学奖。同获此奖的还有一名美国科学家和一名日本科学家。 • 第5次,美国科学家Paul Lauterbur于1973年发明在静磁场中使用梯度 场,能够获得磁共振信号的位置,从而可以得到物体的二维图像;英 国科学家Peter Mansfield进一步发展了使用梯度场的方法,指出磁共 振信号可以用数学方法精确描述,从而使磁共振成像技术成为可能, 他发展的快速成像方法为医学磁共振成像临床诊断打下了基础。他俩 因在磁共振成像技术方面的突破性成就,获2003年诺贝尔医学奖。
配位化合物的结构与性质

配位化合物的结构与性质配位化合物是由中心金属离子与周围的配体离子或分子通过配位键结合而成的化合物。
它们具有独特的结构与性质,对于我们理解化学反应、催化、材料科学等方面都具有重要意义。
本文将介绍配位化合物的结构特点以及其性质,并探讨它们在现代科学中的应用。
1. 配位化合物的结构特点配位化合物的结构特点主要体现在以下几个方面:1.1 配位键的形成配位化合物中的配位键是通过金属离子与配体之间的配位作用形成的。
这种配位作用是一种共价键的特殊形式,可以通过配体的配位对数来描述。
常见的配位键包括金属-配体配位键、金属-金属配位键等。
1.2 配合物的配位几何结构配位几何结构指的是配位化合物中金属离子与配体之间的空间排列方式。
根据配位原理,常见的配位几何结构包括线性、方形平面、三角双锥、正四面体等。
1.3 配位化合物的立体异构性由于配位离子的配位数和配位键的种类不同,配位化合物可能存在多种立体异构体。
这种立体异构性对于配位化合物的物理性质和化学性质都有重要影响。
2. 配位化合物的性质配位化合物具有多种独特的性质,包括磁性、光谱性质、催化性质等,下面将分别进行介绍。
2.1 磁性配位化合物中的金属离子可以表现出不同的磁性行为,例如顺磁性和反磁性。
这种磁性行为与金属离子周围配体的性质密切相关。
2.2 光谱性质配位化合物在紫外可见光谱和红外光谱等方面具有独特的性质。
通过光谱分析,可以了解配位化合物的电子结构、配位键性质等信息。
2.3 催化性质配位化合物广泛应用于催化领域。
例如,贵金属配位化合物在有机合成中具有良好的催化活性,可以加速化学反应的进行。
3. 配位化合物的应用配位化合物在科学研究和工业应用中有广泛的应用。
3.1 化学分析与测定配位化合物在化学分析与测定中起着重要作用。
例如,通过络合滴定可以定量测定金属离子的浓度。
3.2 金属催化剂配位化合物在金属催化剂中起着关键作用,广泛应用于化学合成、能源转换等领域。
金属配位催化剂可以提高反应速率和选择性,有效地促进化学反应的进行。
配位化合物的结构和性质

配位化合物的结构和性质配位键是指中心金属离子与配位体离子或分子之间的化学键。
一般来说,配位键是由配位体中的配位位点与中心金属离子的空位之间形成的。
常见的配位位点有氧、氮、卤素、硫等原子,配位键可以用坐标键表示。
配位键的形成使得中心金属离子与配位体之间形成了一个稳定的化学结构。
配位化合物的结构多种多样,可以分为晶体结构和分子结构两种。
晶体结构是由大量的配位化合物分子组成的,通过相互作用形成结晶体。
晶体结构的特点是具有有序、规则的排列方式,其中中心金属离子与配位体之间的配位键呈现出复杂的几何构型。
常见的晶体结构有寻常离子晶体、共价配位晶体和离子-分子晶体等。
而分子结构则是由单个配位化合物分子组成的,分子结构较为简单。
分子结构中,中心金属离子以及周围的配位体离子或分子通过配位键结合在一起。
配位化合物的结构决定了它们的性质。
首先,由于配位键的形成使得中心金属离子的空位被占据,导致配位化合物的结构稳定。
其次,配位化合物常常具有较高的熔点和沸点,这是由于配位中心金属离子和配位体之间较强的键能引起的。
此外,由于配位体与中心金属离子之间的电荷转移作用,配位化合物通常具有较好的导电性和磁性,可用于电池、电磁材料等领域。
此外,配位化合物还常常表现出较好的催化性能,可用于有机合成等反应中。
另外,一些具有特定的配位结构的配位化合物,如螯合物、簇合物等,还具有特殊的性质和应用,可用于药物、催化剂等领域。
配位化合物具有丰富的应用价值。
首先,在多个领域中广泛应用的催化剂就是配位化合物,催化剂可促使化学反应的进行,并提高反应速率。
催化剂对反应物质具有选择性,可以选择性地催化其中一种反应,从而提高合成产率。
除此之外,配位化合物还可用于药物领域,如铂抗癌药物顺铂(cisplatin)、鉴定DNA结构的法林(phenanthroline)等。
而金属配合物作为光敏感材料,有着广泛的应用前景,在光催化、光克隆以及信息存储等领域具有重要价值。
配位化合物的结构

cM M cL L
3. 螯合配位体:一个配位体的几个配位点能直接和同一个金属离子配位。
不带电的单核螯合分子,水中难溶,易溶于有机溶液中,常作萃取络合剂, (如:乙酰丙酮铝Al(acac)3 ,) 带电的单核螯合离子一般很难从水中沉淀出来,这种配位体可作掩蔽剂,如 酒石酸盐、EDTA等都是这类掩蔽剂。
★右图示出[Co(EDTA)]-配位 离子中,一个EDTA螯合配位 体和Co3+螯合的情况。
第六章
配位化合物的结构和性质
6.1 概述
●配位化合物:又称络合物,是一类含有中心金属原子(M)和若干配位体 (L)的化合物(MLn )。 ★中心原子M通常是过渡金属元素的原子(或离子),具有空的价轨道。 ★配位体L则有一对或一对以上孤对电子。 ★ M和L之间通过配位键结合,成为带电的配位离子,配位离子与荷异性电荷 的离子结合,形成配位化合物。
配位离子的电子组态和几何构型
配位离子 Fe(CN)64-
3d
Co(NH3)63+
Co(CN)64-
Ni(CN)42FeF63Ni(NH3)62+
4s 4p 5s
杂化轨道 几何形状
d2sp3 d2sp3
八面体 八面体
d2sp3
八面体
dsp2
平面四方
—
八面体
—
八面体
2. 晶体场理论 ●晶体场理论的内容:
●金属离子和不同的配位体结合后,性质不相同,可以进行溶解、沉淀、萃取, 以达到合成制备、分离提纯、分析化验等目的。
●配位化学是湿法冶金的重要基础。
1. 配位体
●每个配位体至少有一个原子具有一对(或多对)孤对电子,或分子中有π 电 子。如,N、O、C、P、S、Cl、F等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3. 分子轨道理论 ●分子轨道理论的内容:
用分子轨道理论的观点和方法处理金属离子和配位体的成键作用。
描述配位化合物分子的状态主要是M的价层电子波函数 M 与配体L的
分子轨道 L 组成离域分子轨道
●金属离子和不同的配位体结合后,性质不相同,可以进行溶解、沉淀、萃取, 以达到合成制备、分离提纯、分析化验等目的。
●化学工业上,一些重要的催化剂是配位化合物。
1. 配位体
●每个配位体至少有一个原子具有一对(或多对)孤对电子,或分子中有π 电 子。如,N、O、C、P、S、Cl、F等。
●根据配位体所提供的络合点数目和结构特征,可将配体分成以下几类:
★有时中心原子和配位体直接结合成不带电的中性配位化合物分子。
●单核配位化合物:一个配位化合物分子(或离子)中只含有一个中心原子。
●多核配位化合物:含两个或两个以上中心原子。 ●金属原子簇化合物:在多核配位化合物中,若M—M之间有键合称为金属原 子簇化合物。
●配位化合物是金属离子最普遍的一种存在形式。
如:八面体配位离子中,6个配位体沿± x,± y,± z 坐标接近M,L的负电
荷坐对 标之dx间2y2, dxdy, z2dx轨z,d道yz受的到电推子斥排较斥小作,用能大级,上使升这较两轨少道,能这级样上d轨升道较分多裂,成而两夹组在:两
能级低的3个d轨道
dxy,dxz,dyz通常用t2g表示;高能级的2个d轨道dx2
2. 配位化合物结构理论的发展
阐明配位化合物结构的重要理论:
●价键理论 ●晶体场理论 ●分子轨道理论 ●配位场理论
1. 价键理论
●价键理论的内容:
根据配位化合物的性质,按杂化轨道理论用共价配键和电价配键解释配 位化合物中金属离子和配体间的结合力。 例如: ★ Fe(CN)64-、Co(NH3)63+、Co(CN)64-、Ni(CN)42-等呈现反磁性和弱磁性是由 于中心离子有未充满的d轨道和 s,p 空轨道,这些空轨道通过杂化组成杂 化轨道,由配位体提供孤对电子,形成L→ M的σ 配键; ★ FeF63-、CoF63-等的磁性表明,中心离子的未成对电子数目和自由离子一 样,认为金属离子和配位体以静电吸引力结合。
3. 螯合配位体:一个配位体的几个配位点能直接和同一个金属离子配位。
不带电的单核螯合分子,水中难溶,易溶于有机溶液中,常作萃取络合剂, (如:乙酰丙酮铝Al(acac)3 ,) 带电的单核螯合离子一般很难从水中沉淀出来,这种配位体可作掩蔽剂,如 酒石酸盐、EDTA等都是这类掩蔽剂。
★右图示出[Co(EDTA)]-配位 离子中,一个EDTA螯合配位 体和Co3+螯合的情况。
,d y2
z2
通常用
eg表示。
这两组能级间的差值,称为晶体场分裂能,用Δo (或Δ )表示。 d电子根据分裂能(Δ )和成对能(P)的相对大小填在这两组轨道上,形成 强场低自旋或弱场高自旋结构,以此解释配位化合物的结构、光谱、稳定性及 磁性等一系列性质。
●晶体场理论的作用和缺陷:
★可以成功地解释配位化合物的许多结构和性质; ★只按静电作用进行处理,相当于只考虑离子键的作用,出发点过于简单。 ★难于解释分裂能大小变化次序。
把中心离子(M)和配体(L)的相互作用看作类似离子晶体中正负离子的静电 作用。
当L接近M时,M中的d轨道受到L负电荷的静电微扰作用,使原来能级简并 的d轨道发生分裂。按微扰理论可计算分裂能的大小,因计算较繁,定性地将 配体看作按一定对称性排布的点电荷与M的d轨道电子云产生排斥作用。
●在晶体场中d 轨道能级分裂,引起电子排布及其他一系列性质 的变化,据此可解释配位化合物的各种性质。
配位离子的电子组态和几何构型
配位离子 Fe(CN)64-
3d
Co(NH3)63+
CoБайду номын сангаасCN)64-
Ni(CN)42FeF63Ni(NH3)62+
4s 4p 5s
杂化轨道 几何形状
d2sp3 d2sp3
八面体 八面体
d2sp3
八面体
dsp2
平面四方
—
八面体
—
八面体
2. 晶体场理论 ●晶体场理论的内容:
[Co(EDTA)]-配位螯合离子的结构
(4)键配位体:含有π 电子的烯烃、炔烃、芳香烃等也可作配体。 如:C2H4、丁二烯、CO、C6H6、C5H5等都是。
★在配位化合物的结构中,一个配位体同时和n 个不同的金属原子M配位 时,常在配位体前加μn-记号,例如 Fe3(CO)10·(μ2-CO)2 ,表示有2个 CO 分别同时和2个Fe原子结合。若一个配位体有n个配位点与同一金属原 子结合,则在配位体前标上ηn-记号,例如(η5- C5H5 ) 2 Fe,表示每个 C5H5都有5 个配位点和同一个Fe原子结合。
●价键理论的作用:
★能简明解释配位化合物几何构型和磁性等性质; ★可以解释Co(CN)64-存在高能态电子,非常容易被氧化,是很强的还原剂, 能把水中的H+还原为H2。
●价键理论的缺点:价键理论是定性理论,没有提到反键轨道,不涉及
激发态,不能满意地解释配位化合物的光谱数据,不能满意说明有些化合 物的磁性、几何构型和稳定性。
1.单啮配位体:只有一个配位点的配体。
如:NH3 ,形成的单核配位离子比单个金属离子大(半径增大),使正、负 离子间静电引力下降,溶解度增大,不易沉淀,AgCl能溶于氨水,生成银氨 络离子。
2. 非螯合多啮配位体:配体有多个配位点,但受几何形状限制不能与同一金属 离子配位。
如:PO43-、CO32- 等,一个配体与多个金属离子配位,每个金属离子与若干个 这样的配位体配位,形成的多核配位化合物,往往是不溶性沉淀,常作沉淀 剂。
第六章
配位化合物的结构和性质
6.1 概述
●配位化合物:又称络合物,是一类含有中心金属原子(M)和若干配位体 (L)的化合物(MLn )。 ★中心原子M通常是过渡金属元素的原子(或离子),具有空的价轨道。 ★配位体L则有一对或一对以上孤对电子。 ★ M和L之间通过配位键结合,成为带电的配位离子,配位离子与荷异性电荷 的离子结合,形成配位化合物。
