Zr离子
常见金属离子配位数及颜色总结自动保存的

[Cu(NH3)4]2+绛蓝[Fe(SCN)6]3-血红[Pt(NH3)4}2+顺式绿色反式黄色Fe3+与苯酚的配合物紫色Fe3+与CO的配合物血红二茂铁橙黄色铝与铝试剂的配合物玫瑰色1.红色Fe(SCN)]2+(血红色);Cu2O(砖红色);Fe2O3(红棕色);红磷(红棕色);液溴(深红棕色);Fe(OH)3(红褐色);I2的CCl4溶液(紫红色);MnO4-(紫红色);Cu(紫红色);在空气中久置的苯酚(粉红色).2.橙色:溴水;K2Cr2O7溶液.3.黄色:AgI(黄色);AgBr(浅黄色);K2CrO4(黄色);Na2O2(淡黄色);S(黄色);FeS2(黄色);久置浓HNO3(溶有NO2);工业浓盐酸(含Fe3+);Fe3+水溶液(黄色);久置的KI溶液(被氧化I2)4.绿色:Cu2(OH)CO3;Fe2+的水溶液;FeSO4.7H2O;Cl2(黄绿色);F2(淡黄绿色);Cr2O35.蓝色:Cu(OH)2;CuSO4.5H2O;Cu2+的水溶液;I2与淀粉的混合物.6.紫色:KMnO4(紫黑色);I2(紫黑色);石蕊(pH=8--10);Fe3+与苯酚的混合物.7.黑色:FeO,Fe3O4,FeS,CuS,Cu2S,Ag2S,PbS,CuO,MnO2,C粉.8.白色:Fe(OH)2,AgOH,无水CuSO4,Na2O,Na2CO3,NaHCO3,AgCl,BaSO4,CaCO3,CaSO3,Mg(OH)2,Al(OH)3,三溴苯酚,MgO,MgCO3,绝大部分金属等.一、单质绝大多数单质:银白色。
Cu紫红O2无Au黄S黄B黄或黑F2淡黄绿C(石墨黑Cl2黄绿C(金刚石)无Br2红棕Si 灰黑I2紫黑H2无稀有气体无P白、黄、红棕。
二、氢化物LiH等金属氢化物:白NH3等非金属氢化物:无三、氧化物大多数非金属氧化物:无主要例外:NO2棕红N2O5和P2O5白N2O3暗蓝ClO2黄大多数主族金属的氧化物:白主要例外:Na2O2浅黄PbO黄K2O黄Pb3O4红K2O2橙Rb2O亮黄Rb2O2棕Cs2O橙红Cs2O2黄大多数过渡元素氧化物有颜色MnO绿CuO黑MnO2黑Ag2O棕黑FeO黑ZnO白Fe3O4黑Hg2O黑Fe2O3红棕HgO红或黄Cu2O红V2O5橙四、氧化物的水化物大多数:白色或无色其中酸:无色为主碱:白色为主主要例外:CsOH 亮黄Fe(OH)3红褐HNO2溶液亮蓝Cu(OH)2蓝Hg(OH)2桔红五、盐大多数白色或无色主要例外:K2S棕黄CuFeS2黄KHS黄ZnS白Al2S3黄Ag2S黑MnS 浅红CdS黄FeS黑棕SnS棕FeS2黄Sb2S3黑或橙红CoS黑HgS红NiS黑PbS黑CuS、Cu2S 黑Bi2S3黑FeCl3·6H2O棕黄Na3P红FeSO4·9H2O蓝绿NaBiO3黄Fe2(SO4)3·9H2O棕黄MnCl2粉红Fe3C灰MnSO4淡红FeCO3灰Ag2CO3黄Fe(SCN)3暗红Ag3PO4黄CuCl2棕黄AgF黄CuCl2·7H2O蓝绿AgCl白CuSO4白AgBr浅黄CuSO4·5H2O蓝AgI黄Cu2(OH)2CO3暗绿盐溶液中离子特色:NO2-浅黄Cu2+或[Cu(H2O)4]2+蓝MnO4-紫红[CuCl4]2-黄MnO42-绿[Cu(NH3)4]2+深蓝Cr2O72-橙红Fe2+浅绿CrO42-黄Fe3+棕黄非金属互化物PCl3无XeF2、XeF4、XeF6无PCl5浅黄氯水黄绿CCl4无溴水黄—橙CS2无碘水黄褐SiC无或黑溴的有机溶液橙红—红棕SiF4无I2的有机溶液紫红六.其它甲基橙橙CXHY(烃)、CXHYOZ无(有些固体白色)石蕊试液紫大多数卤代烃无(有些固体白色)石蕊试纸蓝或红果糖无石蕊遇酸变红葡萄糖白石蕊遇碱变蓝蔗糖无酚酞无麦芽糖白酚酞遇碱红淀粉白蛋白质遇浓HNO3变黄纤维素白I2遇淀粉变蓝TNT淡黄Fe3+遇酚酞溶液紫焰色反应Li紫红Ca砖红Na黄Sr洋红K浅紫(通过蓝色钴玻璃)Ba黄绿Rb紫Cu绿稀有气体放电颜色He粉红Ne鲜红Ar紫V ,Ti 及其化合物:黄色的CrO 42-,紫色的MnO 4-.二氧化钛(金红石),TiCl 3紫色粉末状固体,V 2O 5砖红色或橙黄色粉末,淡黄色的钒二氧基VO 2+,VO 2+蓝色,黄色的二过氧钒酸根阴离子[VO 2(O 2)2]3-,红棕色的过氧钒阳离子[V(O 2)]3+,Cr,Mo,W:Cr 2O 3绿色固体,Cr(OH)3灰蓝色胶状沉淀,Cr 3+紫色,CrO 2?绿色,CrO 42?黄色 硫酸铬因含结晶水数量不同而有不同颜色:Cr 2(SO 4)3·18H 2O 紫色,Cr 2(SO 4)3·6H 2O 绿色,Cr 2(SO 4)3棕红。
Zr_浓度梯度掺杂改性NCM811_高镍三元正极材料的研究

Zr 浓度梯度掺杂改性 NCM811 高镍三元
正极材料的研究
张圆雪ꎬ牟 粤ꎬ文越华ꎬ李 萌ꎬ王 跃ꎬ朱振威ꎬ孟闻捷
( 军事科学院防化研究院 总体研究所ꎬ北京 100191)
摘 要: 高镍三元电极材料是高比能量锂离子电池最具应用前景的正极材料ꎬ但随着镍含量增
大ꎬ其结构稳定性变差ꎮ 为此ꎬ本文制备了 Zr 浓度梯度掺杂改性的 NCM811( Zr ̄PCG) 高镍三
的作用ꎬ以期进一步提升 NCM811 高镍三元正极
备受瞩目ꎮ 为了满足上述需求ꎬ三元材料逐渐向
材料的循环稳定性、热稳定性和倍率性能ꎮ
高镍材料或耐高压三元材料的方向发展ꎬ但随着
高镍三元( NCM) 正极材料中镍含量的增加ꎬ也会
+
引发一系列问题ꎬ如 Li / Ni
2+
混排、导电性变差、
界面副反应重、不可逆相变、晶格氧逸出等 [4 - 7] ꎮ
Zr 浓度梯 度 掺 杂 的 LiNi0 8 Co0 1 Mn0 1 O2 黑 色 粉
氛保护的共沉淀反应釜( 釜 R) 内ꎬ之后实验步骤
度前驱体粉 末 Ni0 8 Co0 1 Mn0 1 ( OH) 2 ꎬ 产 品 按 照
ergy of Zr—O bonds can effectively suppress the escape of free oxygen. The 1 0 Zr PCG cathode
with a doping amount of 1% has a crystal structure with the best stabilityꎬand the Zr doping also
Key words: high energy densityꎻ lithium ̄ion batteriesꎻ high ̄nickel ternary anodeꎻ Zr dopingꎻ gra ̄
常见金属元素掺杂对磷酸铁锂性能有何影响?

常见金属元素掺杂对磷酸铁锂性能有何影响?由于具有较低的原料成本、较高工作电压平台和热稳定性、优良电化学循环性能等优点,磷酸铁锂(LiFePO4)电池在动力电池占有较大的市场份额,在基站储能、新能源等领域的需求量呈爆发式增长趋势。
然而,较低的锂离子扩散系数和电子电导率,导致LiFePO4材料的倍率性能差,极大限制了其在高倍率锂电池领域的商业化应用延伸。
因此,LiFePC‰正极材料的改性研究已成为近年来的研究热点。
同时,由于市面上服役的LiFePO4电池已有大批量进入退役潮,对退役电池的LiFePO4材料进行高价值回收在近年来备受关注。
由于废旧LiFePO4正极材料分离预处理的局限性,少量Al箔或Cu箔不可避免地混入LiFePO4正极粉;此外,LiFeP04正极材料掺Ti改性趋于材料产业化,这些都使得LiFePo4正极废料含有一定量的Al、CU和Ti杂质。
鉴于回收过程Al、Cu. Ti的深度脱除仍是难点,并且金属掺杂改善LiFePo4材料性能已然成为共识,因此,研究以Al、Cu, Ti等为主的金属元素掺杂在改善材料性能的同时,也对降低生产成本有着积极意义。
离子掺杂原理迄今为止,LiFePOz l的改性方法主要有形貌控制、纳米化、表面包覆、离子掺杂等。
其中,离子掺杂主要是指在包覆碳层的LiFePo4晶格中掺杂某些导电性好的金属离子,以降低Li+沿一维路径扩散的阻力,达到改善LiFePo4材料的循环性能和倍率性能的目的。
一方面,掺杂离子不等价地替换LiFePC)4材料中的Li、Fe或。
原子,可促成材料的晶格产生有利的缺陷;另一方面,电子结构各异的掺杂元素与LiFePO4的晶格相匹配,可扩宽Li+的扩散通道,提高Li+在晶格中的扩散动力学,从而提升材料的高倍率性能。
LiFeP04晶体结构示意图根据掺杂离子占据的位置,LiFePθ4掺杂改性可分为Li位掺杂、Fe位捧杂、0位掺杂及Li、Fe位共掺杂。
①Li位掺杂可使一维通道的锂的层间距膨胀,进而改善Li+的扩散动力学;②Fe位掺杂可提高热稳定性和结构稳定性,降低电阻,提高材料的导电率;③0位掺杂可以改变材料的电子结构,提高晶体的电化学稳定性。
元素离子检测

元素离子检测
经过几年的技术积累,科标检测在元素离子检测领域经过多年的技术实践, 不断进行技术创新,现在已经形成一套完备的检测体系。
元素离子检测是指根据样品不同特点选定不同分析测试方法进行分析测试, 以得到样品中元素或离子的种类和含量,实现样品中元素或离子种类和含量的测 定,满足客户对元素离子检测的要求。
相关检测仪器:
成分分析
分析手段 色谱分析 光谱分析 热分析
质谱分析
其他分析
相关仪器
高效液相色谱仪、气相色谱仪、凝胶色谱仪、离子 色谱仪
傅里叶变换红外光谱仪(FTIR)、紫外可见光分光度 计(UV-VIS)、X 射线荧光光谱仪(XRF)、电感耦合等 离子体发射光谱仪(ICP-AES)、拉曼光谱仪(Raman) 热重分析仪(TGA)、差式扫描量热仪(DSC)、DSC/TGA 联用仪、动态热机械分析仪(DMA)、热机械分析仪 (TMA) 电感耦合等离子体质谱(ICP-MS)、气相色谱质谱联 用仪(GC-MS)、液相色谱质谱联用仪(LC-MS)、裂解 气质联用仪(PyGC-MS)、顶空气相色谱质谱联用仪 (HS-GC-MS) 扫面电子显微镜(SEM)、透射电子显微镜(TEM)、核 磁共振仪(NMR)、元素分析仪(EA)、x-射线衍射仪 (XRD)、x-射线光电子能谱分析仪(XPS)、马尔文激 光粒度仪
高场强元素与大离子亲石元素

高场强元素大离子亲石元素
高场强元素与大离子亲石元素相对,二者共属于不相容元素根据不相容元素离子电位的大小可以分为:高场强元素与大离子亲石元素。
高场强元素high field-strength element(HFSE)
离子电价较高、半径较小、具有较高离子场强(为离子电价与半径之比)的元素,其离子电位π>3,难溶于水,典型代表为Nb、Ta、Zr、Hf、U 、Th、HREE、Ce、Pb4+、Ti等。
这些元素地球化学性质一般较稳定,不易受变质、蚀变和风化作用等的影响,因此常用来恢复遭后期变化岩石的原岩性质。
大离子亲石元素(large ion lithophile element)(LILE)
离子半径大、离子电荷低、离子电位π<3,易溶于水,化学性质活泼,地球化学活动性强;典型代表有K、Rb、Cs、Sr、Ba等。
N_2流量对多弧离子镀ZrTiN涂层性能的影响

具切 削性能 提 出更 高 的要求 。 自 j 纪 7 二 世 0年 代 以来 ,
( iZ ) T , rN涂层 , 究 了基 体偏 压 对 涂 层 硬 度 、 合 力 研 结
a di o e h o i /mi d t n wh n t e N2f w s 1 i l 20 mL n,t e f se td p st n r t st 4. h a t s e o ii a e i o 2 6 nm/ i o m n. K e wo ds:Z Ti Co t s;M u t-ac I n l t g;Ni o e lw t y r r N a i ng l i r o -p ai n t g n F o Ra e;H adn s r r e s;Ad e i n h so
物理气 相沉 积技术 逐渐 成 熟 , 被 广泛 应 用 于切 削 刀 并
具 、 磨 耐 腐 蚀 零 件 以 及 各 种 医 用 器 具 的 表 面 改 耐
性 。TN涂层 刀具 由于 具有 高 硬 度 和小 摩 擦 系 数 i
等优 良性 能 , 早应 用 于 各 类 加 工场 合 当 中 ,ZN涂 最 r 层刀 具在切 削淬硬 钢等难 加工 材料时 表现 出更好 的低 温、 低磨 损 率 等 切 削性 能 , ri ZTN涂 层 刀具 的 出现 , 表现 出 比单一 TN、r i ZN涂 层刀具 更优 越 的物 理性 能 。 高玉周 等人 一 采用 电弧离 子镀 方 法 , 通过 分 别 控 制 独立 的 靶 和 z 靶 电流 , 高速 钢基 体 上 制 备 了 r 在
Aba t a t:Zr N o tn s ae p e a e n c r i e to u sr t s b ut-a e in-p ai g Th nl n e o sr c Ti c a i g r r p r d o a b d o ls b tae y m L i r o Ltn . e if ue c fN2
锆盐体系化学氧化方程式

锆盐体系化学氧化方程式【主题】锆盐体系化学氧化方程式【引言】锆盐体系是化学中一个重要的研究领域,它涉及到锆离子在溶液中的化学行为以及氧化反应的机理。
本文将从深度和广度的角度探讨锆盐体系的化学氧化方程式,帮助读者更全面地理解这一主题。
【锆盐体系的基本概念】锆盐体系是指由锆离子(Zr)构成的溶液体系。
在化学中,锆离子可分为锆酸盐和锆氧盐两个主要类别。
锆酸盐是以锆酸(ZrO2)为主要离子的化合物,而锆氧盐则是指锆离子与氧离子结合形成的盐类。
锆盐体系在溶液中的化学行为主要涉及锆离子的溶解、络合反应和氧化反应等。
【化学氧化方程式的概述】化学氧化方程式描述了物质在氧化反应中的转化过程。
在锆盐体系中,化学氧化方程式起到了解释氧化反应基本原理的作用。
下面将以锆酸盐和锆氧盐为例,分析锆盐体系中的化学氧化方程式。
【锆酸盐体系的化学氧化方程式】1. 锆盐的溶解反应:锆酸盐在水溶液中可以发生溶解反应,其化学方程式为:ZrO2(s) + 2H2O(l) ↔ Zr(OH)4(aq)此方程式表明锆酸盐离子化合物(如ZrO2)与水反应生成锆酸盐(Zr(OH)4)。
2. 锆盐的络合反应:在溶液中,锆酸盐可以与其他离子或分子形成络合物。
当锆酸盐与氟离子结合时,可以形成锆氟络合物,其化学方程式为:Zr(OH)4(aq) + 4F-(aq) ↔ ZrF4(aq) + 4OH-(aq)这个方程式说明了锆酸盐与氟离子反应生成锆氟络合物。
【锆氧盐体系的化学氧化方程式】1. 锆离子的溶解反应:锆氧盐中的锆离子在溶液中也可以发生溶解反应,其化学方程式为:ZrO2(s) + H2O2(aq) ↔ ZrO4+(aq) + 4OH-(aq)这个方程式描述了锆氧盐在过氧化氢溶液中的溶解反应。
2. 锆离子的氧化反应:锆氧盐中的锆离子可以通过氧化反应形成更高价态的氧化物。
锆氧盐经过氧化反应可以形成锆酸盐,其化学方程式为:ZrO4+(aq) + H2O2(aq) → ZrO2(aq) + O2(g) + 2H2O(l)通过这个方程式,我们可以看到锆氧盐中的锆离子经过氧化反应生成锆酸盐、氧气和水。
离子交换反应动力学

(3)淋洗剂
要求: a. 能将阴离子从树脂上互换下来 b. 能生成电导性很低物质
Na2B4O7 < NaOH < NaHCO3 < Na2CO3 最理想旳叫原则条件:
0.003MNaHCO3 0.0024MNa2CO3
能够满意旳作为一 系列淋洗体系.
对于阳离子情况相同,只是把分离柱换成低容量旳阳离子互换树脂, 克制柱为大容量旳阴离子互换树脂即可,淋洗液要求同上述。但阳 离子有其复杂性
总之互换反应速度决定于三种过程,一般说互换化学反应过程速 度快于膜扩散和粒扩散过程,而两者究竟那个过程是决定速度阶段则 与诸多原因有关。
影响互换速率旳主要原因:
1.树脂颗粒旳大小 H+和Na+在磺酸苯乙烯阳离子互换树脂上旳动力学数据
树脂颗粒
树脂中扩散 半交换时间
NO.
交联度
温度/℃
半径/cm
速度
s
1
例如:Li-K, Mg-Ba 以0.001M — 0.01M HNO3 淋洗 R-N + M = R-M + H+ 以HNO3淋洗 克制柱R-OH,能够以便测出M
但是经常: ① M与OH-会生成沉淀 金属不能分离; ②二价金属不易洗脱。 应用不如阴离子广泛。
2.单柱法色谱
双柱法有它旳缺陷,要再生,增长仪器旳复杂性。
N
2
CmaxVmax m
2
Cmax
m Vmax
N 2
J. Inczedy, J. Chromatog 50.114 (1、DB
可用下式计算塔板数 能够近似计算塔板数
N
2
DB
a
DA a
2
1
DB
锆离子的化合价

锆离子的化合价
锆离子的化学符号为Zr,它在化学中有着非常广泛的应用。
作为一种
重要的过渡金属元素,锆的电子结构中的价电子有着非常特殊的化学
行为,使得它在化学反应中表现出非常强大的性质。
那么,锆离子的
化合价是多少呢?
首先,我们需要明确一下化合价的概念。
化合价是指每个原子在化合
物中所承担的氧化数。
在正常条件下,锆原子的最外层电子结构为
5s25p0,其中最外面的电子壳居于5s轨道上。
由于5s轨道上具有两个电子,因此锆的化合价为+2。
锆离子可以通过失去或者获得电子来改变它的化合价。
在其饱和状态下,锆会失去两个电子,变成锆离子。
这时,锆的价电子就变成了满
壳电子,也就是居于4d轨道上的电子,因此锆离子的化合价为+4。
在实际的实验室实践中,锆离子的+4价状态较为常见,在各种化学反应中都有着极其重要的地位。
除了+2和+4价之外,锆还可以表现出+3价以及+5价的状态。
由于
锆原子的5s和4d轨道上的电子非常容易发生杂化,使得锆原子在+3、+4和+5这三个不同的化合价状态下都能够稳定存在。
需要指出的是,锆离子在化学反应中的化合价取决于其所处的化学环境以及与之反应的其他元素的性质。
因此,在实际的应用中,需要通过实验来确定其化合价,以便更好地指导化学反应的实践操作。
总之,锆离子的化合价在不同的条件下表现出多种化学状态,其中+2和+4价状态是最为常见的。
当然,在实验中还可能表现出+3和+5价的状态。
在实际应用中,需要灵活运用各种化学知识来探索锆离子的化学行为,以期能够更好地指导化学实践的操作。
等离子体质谱法测定Nb、Ta、Zr、Hf等9种元素量
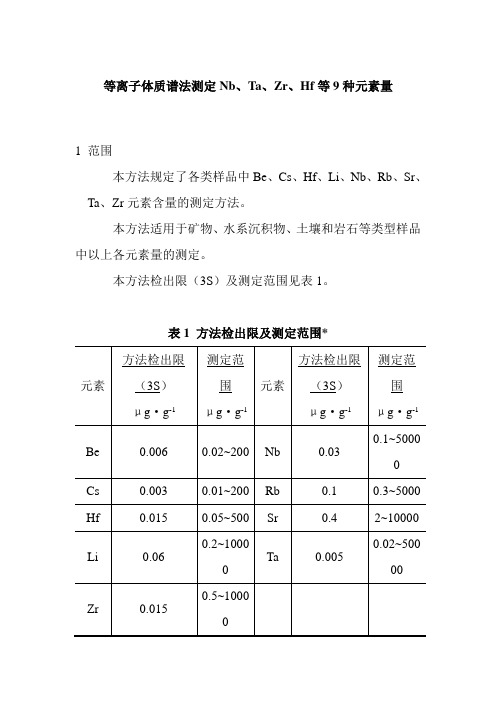
等离子体质谱法测定Nb、Ta、Zr、Hf等9种元素量1 范围本方法规定了各类样品中Be、Cs、Hf、Li、Nb、Rb、Sr、Ta、Zr元素含量的测定方法。
本方法适用于矿物、水系沉积物、土壤和岩石等类型样品中以上各元素量的测定。
本方法检出限(3S)及测定范围见表1。
表1 方法检出限及测定范围*元素方法检出限(3S)μg·g-1测定范围μg·g-1元素方法检出限(3S)μg·g-1测定范围μg·g-1Be 0.006 0.02~200 Nb 0.03 0.1~5000Cs 0.003 0.01~200 Rb 0.1 0.3~5000 Hf 0.015 0.05~500 Sr 0.4 2~10000Li 0.06 0.2~1000Ta 0.0050.02~50000Zr 0.015 0.5~1000*可根据含量确定称样量及稀释倍数扩大测定范围上限。
2 规范性引用文件下列文件中的条款通过本方法的本部分的引用而成为本部分的条款:下列不注日期的引用文件,其最新版本适用于本方法。
GB/T20001.4 标准编写规则第4部分:化学分析方法。
GB/T14505 岩石和矿石化学分析方法总则及一般规定。
GB6379 测试方法的精密度通过实验室间试验确定标准测试方法的重复性和再现性。
GB/T14496-93 地球化学勘查术语。
3 方法提要试料用氢氟酸、硝酸、高氯酸分解并赶尽高氯酸,用王水溶解后,移至聚乙烯试管中,定容,摇匀。
分取部分澄清溶液,用硝酸(3+97)稀释至1000倍(指试料总稀释系数为1000)后,在等离子体质谱仪上测定。
4 试剂除非另有说明,在分析中仅使用确认为优级纯的试剂和去离子水。
在空白试验(6.2)中,若已检测到所用优级纯试剂中含有大于以上元素方法检出限的含量,并确认已经影响试料中以上元素低量的测定,应净化试剂。
4.1 盐酸(1.19g/mL)4.2 硝酸(1.40g/mL)4.3 氢氟酸(1.13g/mL)4.4 高氯酸(1.67g/mL)4.5 硝酸(3+97)4.6 王水750mL盐酸(4.1)与250mL硝酸(4.2)混合,摇匀。
正极材料zr的作用机理

正极材料ZR的作用机理
正极材料在锂电池中起着至关重要的作用,其机理主要体现在以下几个方面:
1.提供锂离子:正极材料为锂电池提供锂离子,充电时,锂离子从正极材料品格中脱出,经电解质后插入负极材料的晶格中,使得负极富锂,正极贫锂,放电时进行相反过程,使正极富锂,负极贫锂。
2.影响电池能量密度和寿命:正极材料的性质直接影响电池的能量密度和寿命。
正极材料参数如晶格结构、锂离子嵌入脱出能力等,直接影响电池的能量密度和充放电性能。
3.安全性:正极材料是电池克容量与安全性的短板,材料的各项参数直接影响锂电池的能量密度、使用寿命和安全性。
以上内容仅供参考,如需获取更多信息,建议查阅相关文献或咨询专业人士。
zr基mof路易斯酸碱位点

zr基mof路易斯酸碱位点全文共四篇示例,供读者参考第一篇示例:Lewis酸碱理论是由美国化学家吉尔伯特·劳伦斯创立的一种酸碱理论。
根据这一理论,Lewis酸是能够接受电子对的物质,而Lewis碱是能够捐赠电子对的物质。
在这一理论中,路易斯酸碱位点是指化合物中能够接受或捐赠电子对的原子或分子的位置。
一般来说,Lewis酸碱位点都是指通常的孤对电子。
zr基mof(金属有机骨架)是一种由金属阳离子和有机配体组成的开放金属-有机骨架化合物。
在zr基mof中,金属离子充当Lewis酸位点,而有机配体则充当Lewis碱位点。
这种配位结构使得zr基mof具有良好的稳定性和可控性,广泛应用于各种领域,如气体吸附分离、催化剂、药物传递等。
在zr基mof中,金属阳离子通常充当Lewis酸位点。
金属离子的d轨道通常是空的,具有较强的亲电子性,可以吸引配体中的电子对。
这种电子对的共价键形成使金属阳离子得到稳定,从而实现了zr基mof的结构稳定性。
金属阳离子在zr基mof中还具有调控性能,可以通过改变金属离子的种类、配位数、配位几何等来调控zr基mof的性质和功能。
除了金属离子和有机配体外,zr基mof中还存在其他Lewis酸碱位点,如孔道内部的功能基团、表面氧化物等。
这些位点的存在使得zr基mof具有更多的反应活性和功能性,可以用于催化剂、吸附分离、传感器等领域。
通过精心设计和调控这些位点,可以实现zr基mof在不同领域的广泛应用。
zr基mof中的Lewis酸碱位点是实现其结构稳定性和功能性的关键因素。
通过合理设计和调控金属离子、有机配体和其他Lewis酸碱位点,可以实现zr基mof的定向合成、性能优化,为其在催化、气体吸附分离、药物传递等领域的应用提供了重要的理论基础和实践指导。
随着对zr基mof的深入研究和应用,相信它将在未来的科学研究和工程技术中发挥越来越重要的作用。
第二篇示例:MOF是一种金属有机框架,是一种多孔材料,由金属离子作为节点,有机配体作为连接部分构成。
五水合硝酸锆的相对原子质量

五水合硝酸锆的相对原子质量1. 简介说到五水合硝酸锆,这个名字听起来是不是很高大上,像是某个神秘的化学魔法?其实它就是我们生活中常见的一种化合物,尽管它的名字很拗口,但它的性质却很有趣。
五水合硝酸锆,顾名思义,里面有五个水分子,而锆的身影更是让它显得格外出众。
今天咱们就来聊聊这个小家伙的相对原子质量,带你走进化学的奇妙世界,咱们轻松点,别把自己搞得太紧张哦!2. 相对原子质量的概念2.1 什么是相对原子质量?先来解释一下相对原子质量。
简单来说,它就是一个元素的“重量”,但和我们平常说的重量不太一样。
相对原子质量是指一个原子的质量与碳12的质量比。
听起来有点复杂,不过别担心,想象一下你在超市里买苹果,每个苹果的重量和标准苹果比就行了。
2.2 为啥相对原子质量那么重要?相对原子质量可重要了,它就像化学世界里的“身份证”。
通过这个数字,我们可以知道元素的属性,还能推算出其他化合物的组成成分。
简单说,就是让我们在化学实验里不至于迷了路,有个清晰的方向。
而对于五水合硝酸锆来说,了解它的相对原子质量,可以帮助我们搞清楚它的各种应用,真是个不可或缺的小帮手。
3. 五水合硝酸锆的相对原子质量3.1 五水合硝酸锆的组成那么,五水合硝酸锆的相对原子质量到底是多少呢?首先,我们得知道它的组成。
它的化学式是Zr(NO₃)₂·5H₂O,这里有锆(Zr),还有两个硝酸根离子(NO₃⁻),再加上五个水分子(H₂O)。
别小看这几个元素,每个元素都有自己独特的质量,我们需要把它们都算上,才能得出最终的结果。
3.2 计算相对原子质量为了计算五水合硝酸锆的相对原子质量,我们得先找出每个元素的相对原子质量。
锆(Zr)大约是 91.22,硝酸根离子中的氮(N)大约是 14.01,氧(O)是 16.00,水分子里的氢(H)则是 1.01。
然后我们就可以开始大显身手了。
根据化学式,五水合硝酸锆的相对原子质量计算公式就出来了:。
锆:1 × 91.22硝酸根离子:2 × (14.01 + 3 × 16.00) = 2 × 62.01 。
磷酸锆熔点

磷酸锆熔点磷酸锆是一种常见的无机化合物,其分子式为Zr(HPO4)2,具有较高的熔点。
本文将从以下几个方面对磷酸锆的熔点进行详细介绍。
一、什么是磷酸锆?磷酸锆是一种无机化合物,属于磷酸盐类。
其化学式为Zr(HPO4)2,是由锆离子和磷酸根离子组成的。
它通常呈白色粉末或晶体,易溶于强酸和碱性溶液中。
二、磷酸锆的性质1.物理性质磷酸锆为白色粉末或晶体,具有较高的密度和硬度。
其密度为3.9g/cm³,硬度为5.5-6.5(莫氏硬度)。
此外,它还是一种无定形固体,在加热时会逐渐分解。
2.化学性质由于其含有两个不同的离子(Zr4+和HPO42-),因此磷酸锆具有多种化学反应。
例如,在强碱性条件下可以发生水解反应生成氢氧化锆:Zr(HPO4)2 + 4NaOH → Zr(OH)4 + 2Na2HPO4在强酸性条件下,磷酸锆可以与酸反应生成相应的盐:Zr(HPO4)2 + 2HCl → ZrCl2 + 2H3PO4此外,磷酸锆还可以与一些金属离子形成配合物,例如与铵离子形成的配合物(Zr(HPO4)2·2NH3)。
三、磷酸锆的熔点磷酸锆具有较高的熔点,通常在1000℃以上。
具体来说,其熔点在不同文献中有所差异,大致在1200-1400℃之间。
下面介绍一些相关文献中关于磷酸锆熔点的数据:1.《无机化学丛书》第五卷中给出的数据为1300℃。
2.《无机化学手册》第四版中给出的数据为1375℃。
3.《化学品安全技术规范》中给出的数据为1200℃以上。
需要注意的是,不同实验条件下测得的结果可能会有所不同。
例如,在氧气氛围下测量得到的熔点可能会比在空气中测量得到的熔点高一些。
四、影响磷酸锆熔点的因素1.纯度纯度是影响磷酸锆熔点的一个重要因素。
高纯度的磷酸锆通常具有较高的熔点,而杂质的存在会降低其熔点。
因此,在实验中需要尽可能提高样品的纯度,以减小误差。
2.晶体结构晶体结构也会影响磷酸锆的熔点。
例如,一些文献中报道了不同晶型(如单斜晶系和正交晶系)下的磷酸锆熔点不同,其中单斜晶系下的磷酸锆具有较低的熔点。
正极材料体相掺杂的优化

正极材料体相掺杂的优化目前,研究者大都认为掺杂是稳定材料结构、改善材料性能最有效的途径。
掺杂一方面可以提高电极材料的结构稳定性,同时也可以改变电极材料的表面催化活性,从而削弱其与电解液的反应,实现正极材料与电解液的相容性。
但由于掺杂量一般都较小,改善材料表面催化性能的效果相对较小,相比之下,提高材料的结构稳定性的效果更加明显。
正极材料掺杂的研究主要集中在三个方面,即阳离子掺杂、阴离子掺杂和阴、阳离子复合掺杂。
阳离子掺杂阳离子掺杂研究目前已经比较深入。
不同阳离子,如Zr、Li、Co、Mn、Ti、A1、Mg、Ca、Sr、V、Cr、Sn、Fe、Zn等,在不同正极材料(如LiMn20q、LiC002和LiNiOz)中掺杂均可以不同程度地提高材料的结构稳定性。
如在LiNiOz中掺人Co,随着材料中Co 含量的增加,迁入到山层的Ni的数量明显减少,可以得到稳定有序的2D层状结构,降低了活性氧含量,有效改善电极材料的电化学性能和热稳定性。
尖晶石LiMn20d中部分Mn离子被Co、Ni、Cr、A1、Ga、Sr等元素取代后,可以稳定尖晶石结构,同时降低材料表面对电解液的氧化性,提高电极的电化学性能[1053。
掺杂少量Li制得富锂相的尖晶石LiMnz O‘,使结构中锰的平均化合价增大,抑制了Jahn-Teller效应的发生,并且富锂可使晶胞收缩,在充放电过程中体积变化较小,提高了材料的结构稳定性和循环性能。
掺杂Cr可以大大减小电池的自放电现象,主要是由于Cr—O键能比Mn—O键的键能高,从而使尖晶石LiMn20q的结构更稳定。
掺杂Co同样有利于减少Mn3+的含量,提高锰的平均价态,有效抑制Mn的溶解和Jahn-Teller效应的发生,稳定晶体结构,提高材料的循环性能和高温稳定性。
一些金属离子(如Mg、A1、Ti、Nb、W)掺杂LiFeP04可以显著提高LiFeP04的电子导电性,改善LiFeP04电化学性能。
NbS+的离子半径小、价态高,掺杂LiFeP04还可以提高其可逆容量,使其可逆容量达150mA.h,并具有良好的循环性能和倍率充放电性能。
Zr离子

阳离子
静电作用 形成
化合物
阴离子
阳离子: 阴离子
K+
-
Na
+
Mg
-
2+
Al3+
2-
NH4
+
(铵根离子)
Cl OH SO4
(硫酸根离子)
常见原子团离子: SO42- 硫酸根离子 CO32- 碳酸根离子 NO3- 硝酸根离子 OH氢氧根离子 NH4+ 铵根离子
3、离子的表示——离子符号
离子所带电荷数(得失电子 数;当n=1时略去不写 ) 离子带正或负电
四、物质与构成粒子之间的关系:离子
粒子种类
+17
原子
阳离子
+12 +17
阴离子
区
结构
质子数=电子总数
质子数>电子总数
带正电 稳定结构
质子数<电子总数
带负电 稳定结构 Cl— S2— O2—
别
电性
稳定性
不显电性
稀有气体原子是稳定 结构,其它原子不稳 定。
符号 联 系
H
Mg Hg
H+ Mg2+ Hg2+
质子 (+)
原 子
原子核
(不带电) 中子
核外电子 (-) 原子是电中性的!
质子数 = 核外电子数= 核电荷数= 原子序数
电子不像行星绕太阳旋转有固定的轨道,但有经常 出现的区域,科学家把这样的区域称为电子层
核外电子是在不同的电子层内运动的,此现象叫做核外电子的 分层排布。
一、核外电子的排布
1、核外电子的排步特点:
3钠原子失去1个电子后,发生变化的是(D ) A.相对原子的质量 B.质子数 C.中子数 D.电子层数
三价zr离子溶解

三价zr离子溶解全文共四篇示例,供读者参考第一篇示例:三价Zr离子通常是指氧化锆中的锆离子,它是一种带有3+电荷的离子。
在溶液中,三价Zr离子具有一些独特的化学性质,对于一些领域的应用起着重要作用。
本文将探讨三价Zr离子在溶解过程中的各种特性和应用。
让我们来了解一下三价Zr离子的一般溶解性质。
在溶液中,三价Zr离子常常与溶剂中的水分子发生化学反应,形成水合离子。
由于Zr3+离子的电荷较大,水合离子形成后溶解度相对较低。
在一定的条件下,三价Zr离子可以形成Zr(OH)3沉淀,使得水溶液中的Zr浓度降低。
在实际应用中,需要控制溶解条件以确保Zr3+离子的稳定存在。
三价Zr离子在溶解过程中具有一些特殊的化学性质。
三价Zr离子在溶液中容易发生水合反应,形成含有Zr-OH基团的络合物。
这些络合物在一些催化和合成反应中具有重要的作用。
三价Zr离子在溶解过程中还容易与一些配体形成配合物,形成具有特殊性质的化合物。
这些配合物在生物医药和材料科学等领域有着广泛的应用。
三价Zr离子的溶解性质对于一些领域的应用具有重要的意义。
在材料科学领域,三价Zr离子可以用来制备ZrO2等金属氧化物材料,这些材料具有良好的热稳定性和化学稳定性,在高温和腐蚀环境中有着广泛的应用。
在生物医药领域,三价Zr离子则可以用来制备Zr-89等放射性同位素标记物质,用于医学影像和治疗。
三价Zr离子还可以用作催化剂、螯合剂等,对一些有机合成反应和废水处理具有重要的作用。
三价Zr离子在溶解过程中具有独特的化学性质和应用价值。
通过研究三价Zr离子的溶解特性,可以更好地理解其在各个领域的应用,并进一步推动相关领域的发展和应用。
希望本文对读者对三价Zr离子的溶解性质有所启发和帮助。
第二篇示例:三价Zr离子指的是锆元素失去了三个电子,呈现3+价的阳离子形式。
在溶解过程中,三价Zr离子的行为受到许多因素的影响,如溶剂、溶解温度、pH值等。
本文将从三价Zr离子的性质、溶解机制、影响因素以及应用领域等方面进行探讨。
zr化学式

Zr化学式介绍Zr是化学元素锆的化学符号,原子序数为40。
它是一种过渡金属,属于第4周期,位于钛和铪之间。
锆是一种银灰色的金属,具有良好的耐腐蚀性和高熔点。
它在工业上广泛应用于各种领域,包括航空航天、核能、化工和制造业等。
锆的性质物理性质•锆是一种具有金属光泽的金属,外观呈银灰色。
•它的密度相对较高,约为6.5 g/cm³。
•锆的熔点较高,约为1852°C。
•它是一种良好的导电体和导热体。
化学性质•锆具有良好的耐腐蚀性,能够抵抗大多数酸和碱的侵蚀。
•它与氧气反应形成氧化锆(ZrO₂),这是一种白色固体,常用于陶瓷和涂料制造。
•锆还能与氯气反应生成氯化锆(ZrCl₄),这是一种重要的中间体化合物,广泛用于有机合成和催化反应。
锆的应用航空航天•锆合金具有良好的高温强度和耐腐蚀性,广泛应用于航空航天领域。
•锆合金可以用于制造发动机部件、燃烧室和导弹外壳等。
核能•锆合金被广泛用于核电站中的燃料棒制造。
•它具有低的中子吸收截面,能够有效地阻止核燃料的裂变产物逃逸。
化工•氯化锆是一种重要的化工原料,广泛用于制造催化剂、聚合物和涂料等。
•锆还可以用于制造防腐蚀材料和电子元件等。
制造业•锆合金具有良好的加工性能,可以用于制造船舶、汽车和机械等工业设备。
•锆合金还可以用于制造高性能的手表和首饰等奢侈品。
锆的化学式•锆的原子序数为40,它的化学式为Zr。
•锆的离子通常以Zr⁴⁺的形式存在,它的化学式为Zr⁴⁺。
结论Zr化学式代表着化学元素锆的符号。
锆是一种重要的过渡金属,具有良好的耐腐蚀性和高熔点。
它在航空航天、核能、化工和制造业等领域得到广泛应用。
锆的化学式为Zr,表示其原子序数为40。
锆离子的化合价

锆离子的化合价介绍锆离子是锆元素失去或获得电子后形成的带电粒子。
化合价是锆离子在化合物中的电荷状态,即指示锆离子与其他离子或原子结合形成化合物时所获得或失去的电荷数。
锆离子的电子结构为了理解锆离子的化合价,首先需要了解锆离子的电子结构。
锆(Zr)的原子序数为40,原子结构为1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d2。
在化合物中,大多数情况下,锆离子会失去其5s和4d电子,形成锆离子的带电状态。
锆离子的常见化合价锆离子的常见化合价为+4。
在锆离子的4d壳层中存在两个电子,这两个电子很容易失去,从而使锆离子带有+4的电荷。
锆离子以+4价形式出现在许多常见的化合物中,如ZrO2(氧化锆)和ZrCl4(四氯化锆)。
锆离子的其它化合价除了+4价的锆离子外,还存在一些其它化合价的锆离子。
例如,+2价的锆离子在某些化合物中也是可能的。
这种情况下,锆原子失去两个5s电子,并形成Zr2+离子。
锆离子的不同化合价可能受到溶剂、反应条件和反应物的影响。
影响锆离子化合价的因素锆离子的化合价受到以下因素的影响:溶剂选择溶剂的选择可以影响锆离子的化合价。
在水溶液中,锆离子主要以Zr4+的形式存在,而在非极性溶剂中,锆离子可以以+2价存在。
配位环境锆离子的配位环境也可以影响其化合价。
不同配位数和配位型数的配合物中,锆离子的化合价可能不同。
例如,在八配位的配合物中,锆离子常以+4价出现,而在六配位的配合物中,锆离子可以呈现不同的化合价。
氧化态锆离子的化合价与其氧化状态也有关系。
氧化态+4的锆离子常见于氧化锆等化合物中。
然而,当锆离子处于较低的氧化态时,如+2,锆离子可能与不同的配体形成不同的化合物。
反应条件在一些特殊反应条件下,锆离子的化合价可能会发生改变。
例如,在还原条件下,+4价的锆离子可以被还原为+2或+0。
形成不同化合价的锆离子形成不同化合价的锆离子需要满足以下条件:1.损失或获得适当数量的电子–形成+4价锆离子时,锆离子会失去两个5s电子和两个4d电子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
-
-
-
钠离子
氯离子
+17
-
+11
-
-
-
<电子数= 18
质子数= 11 > 电子数= 10
带一个单位正电荷
质子数= 17
带一个单位负电荷
Na+
Cl-
静电作用形成化合物
-
-
+11
-
+17
-
-
-
-
-
-
-
NaCl
氯离子和钠离子 氯化钠由__________ ______构成.
三、离子 1、离子的形成 失去电子 形成 原子 得到电子 形成
+11
氯原子
-
- -
+17
- - -
-
-
-
-
-
质子数=电子数=11
不带电
Na
质子数=电子数=17
不带电
Cl
钠原子
+11
氯原子
+17
-
-
-
-
-
-
-
-
-
-
- -
钠原子
+11
氯原子
-
-
- +17
- - -
-
-
-
-
-
-
钠原子
-
氯原子
+17
-
-
-
- -
+11
-
-
-
-
钠原子
+11
氯原子
-
-
-
+17
-
-
-
n±
X
在元素符号的右上方注明所带正电荷 数或负电荷数。数字在前,正负在后
Cl
一个氯离子
-
一个氯离子带 一个单位负电 荷
4、离子符号表示的意义: 1)表示一个某离子 2)表示每个离子带几个单位的正或负电荷 3)离子符号前面的化学计量数(系数) 表示离子的个数;
Mg2+:表示一个镁离子, 表示每个镁离子带两个单位的正电荷。
A.质子数为6 B.核外有两个电子层,第 一层有4个电子 C.核外电子数为6 D.核电荷数等于核外电子数
5、某粒子结构示意图
+X
2 8 Y
, X表
示( 质子数 ),该粒子有( 3 )个 电子层,Y与粒子的( 化学性质 )有 关系;当X-Y=10时,该粒子为 ( 原子 )(填类别);当Y=8时, 该粒子带2个单位负电荷,该粒子符号 为( S2- )
C、氯化钠是由
氯离子和钠离子
构成的;
规律
①分子构成的物质: 一般非+非 水H2O、氧气O2等 ②原子构成的物质: 稀有气体 金属等
氦气He、汞Hg、金刚石C等 ③离子构成的物质: 一般金+非 氯化钠NaCl、氯化钾KCl、氢氧化钠NaOH等
练习
1.原子结构中与元素化学性质的关系最密 切的是(C)。 A.电子层数 B.质子数 C.最外层电子 数 D.中子数 2.某元素的原子结构示意图为 C 则该元素原子质子数为( )。 A.6 B.8 C.16 D.2
A. B. C, D.
2Mg2+ : 表示两个镁离子
一个硫离子 一个硫离子带2个单 位负电荷。
表示3个硫离子
+12
Mg
2 82
+16
2 8 6
S
原子中,质子数=电子数
1、在原子中,质子数和电子数有何关系 ?
Mg2+
+12 2 8
S2- +16 2 8
8
2、在离子中,质子数和电子数又有何关系?
阳离子中,质子数>电子数 阴离子中,质子数<电子数
四、物质与构成粒子之间的关系:离子
粒子种类
+17
原子
阳离子
+12 +17
阴离子
区
结构
质子数=电子总数
质子数>电子总数
带正电 稳定结构
质子数<电子总数
带负电 稳定结构 Cl— S2— O2—
别
电性
稳定性
不显电性
稀有气体原子是稳定 结构,其它原子不稳 定。
符号 联 系
H
Mg Hg
H+ Mg2+ Hg2+
相对稳定结构:最外层电子数达到8个电子(或当第一层为 最外层时达到2个电子)的结构。
1-18号元素的电子排布:
元素的分类 稀有气体元素 金属元素 非金属元素
最外电子层的电子 数 8个(He为2个) 一般<4个 一般≥4个
得失电子倾向 相对稳定, 不易得失 易失去 最外层电子 易得电子
化学性质
稳定 不稳定 不稳定
2个氮原子 1个铵根离子 NH4+ 2个氢氧根离子
2OH -
8.下列粒子中: B • 哪些是金属元素, • 哪些是非金属元素, C D E • 哪些是稀有气体元素? A • 哪些属于同种元素? D E
A
B
C
D
E
中考链接
• 1.(2006年中考题)某元素原子结构示意图为 • ,则x的值为____。根据元素原子结构示意图, 不能直接获得的信息是——(填编号) ①核电荷数②相对原子质量③电子层数④最外层 电子数 2.(2007年中考题)下列结构示意图中表示阳离子 的是()
得电子 得电子 原子 阴离子 阳离子 失电子 失电子
四、物质与构成粒子之间的关系:
直接构成物质
金属、稀 有气体
同种元素组成
具有相同质子数的 构成
构成
氧气 水 氮气 CO2
同一类原子的总称 得失电子
不同种元素组成
构成
NaCl MgSO4
例;构成物质的微粒有三种,分别是原子,分子和离子,请完成下题 A、水是由 B、汞是由 水分子 汞原子 构成的; 构成的;
每层的电子数最多为2n2。
(4)最外层上不能超过8个电子。
*Fe的原子结构是2 8 14 2
二、原子结构示意图
原子核
+ 15
原子核带正电
2
8 5
第1层
质子数
第2层 第3层
(也叫最外层)
1、元素的种类决定于核内质子数
判断下列原子的结构示意图是哪种原子的结构示意图:
Li
C
Al
元素的种类决定于原子核内 的质子数 而元素的化学性质则与什么 有关呢?
各种元素的原子在化学反应中的目的:
都想使自己的最外层达到8个电子的稳定结构.
2、可推导出的结论有: *在同一周期中:电子层数相同; 最外层电子数依次增加,由1增加到8;
*在同一族中:最外层电子数相同。
*最外层电子数决定了元素的化学性质。
提问:
如:金属钠与氯气反应,又是 怎样生成氯化钠的呢?
钠原子
质子 (+)
原 子
原子核
(不带电) 中子
核外电子 (-) 原子是电中性的!
质子数 = 核外电子数= 核电荷数= 原子序数
电子不像行星绕太阳旋转有固定的轨道,但有经常 出现的区域,科学家把这样的区域称为电子层
核外电子是在不同的电子层内运动的,此现象叫做核外电子的 分层排布。
一、核外电子的排布
1、核外电子的排步特点:
思考:6.科学研究证实,物质是由微粒构成的,例 如铁是由铁原子构成的。请你填写构成下列物质 的具体微粒的名称。 ⑴体温计中的汞是由 汞原子 构成的; ⑵人工降雨用的干冰是由二氧化碳分子构成的; ⑶食盐中的氯化钠是由 钠离子、氯离子 构成的。
物质构成练习 物质构成练习
7、用化学符号表示:
2N2 2N 2个氮分子 2Fe 3+2个亚铁离子 2Fe 2+ 2个铁离子 n H2O 2个铁原子 2Fe n个水分子
3钠原子失去1个电子后,发生变化的是(D ) A.相对原子的质量 B.质子数 C.中子数 D.电子层数
4.据中央电视台对云南澄江抚仙湖湖底古城考 古的现场报道,科学家曾通过测定古生物遗骸 中的碳14原子含量来推断古城年代。碳14原子 结构示意图如图,其相对原子的质量为14。下 列关于碳14的说法中不正确的是(B)。
1.核外电子分层排布 2.离核越远,电子的能量越高
电子层数:1 离核距离:近 能量高低:低 2 3 4 5 6 7 Q 远 高
K L
M N
பைடு நூலகம்O P
2、核 外 电 子 的 排 布 规 律 :
⑴依据能量最低原则先 排 内 层, 后排 外 层。
⑵ 第 一 层 上 最 多 排2 个 电 子。
⑶ 第 二 层 上 最 多 排8 个 电 子。
阳离子
静电作用 形成
化合物
阴离子
阳离子: 阴离子
K+
-
Na
+
Mg
-
2+
Al3+
2-
NH4
+
(铵根离子)
Cl OH SO4
(硫酸根离子)
常见原子团离子: SO42- 硫酸根离子 CO32- 碳酸根离子 NO3- 硝酸根离子 OH氢氧根离子 NH4+ 铵根离子
3、离子的表示——离子符号
离子所带电荷数(得失电子 数;当n=1时略去不写 ) 离子带正或负电
