生物素标记方法
生物素标记抗体步骤

生物素标记抗体步骤
生物素标记抗体是一种常用的实验技术,能够在细胞、组织和蛋白质水平上检测目标分子的表达和定位。
以下是生物素标记抗体的步骤:
1. 预处理样本:将样本适当处理(如细胞培养、组织切片等),使其适合于抗体检测。
2. 抗原修复:对于一些抗原易于损伤或失活的样本(如石蜡包埋组织),需要进行抗原修复。
通常采用高压加热或酶消化等方法。
3. 抗体处理:加入适当浓度的生物素标记抗体,将其与目标分子结合。
4. 洗涤:用PBS等缓冲液对样本进行洗涤,去除非特异性结合的抗体。
5. 酶标记物处理:加入标记有辣根过氧化物酶(HRP)等酶标记物的检测抗体,使其与生物素标记抗体结合。
6. 洗涤:同样进行洗涤。
7. 显色:加入酶底物,如TMB(3,3',5,5'-四甲基苯丁二酸二乙酯)或DAB(3,3'-二氨基联苯)等,使样本呈现可见的颜色反应。
8. 停止反应:加入酸性溶液,停止反应。
9. 显微镜观察:在显微镜下观察样本,记录结果。
生物素标记抗体技术可以应用于免疫组化、免疫印迹等多种实验中,是一种方便、快速、准确的检测方法。
- 1 -。
hrp酶 标记 生物素 方法

HRP酶标记生物素方法:生物技术的关键应用
在生物技术领域,酶标记技术是一种广泛应用的检测方法。
其中,HRP(辣根过氧化物酶)酶标记生物素方法因其高灵敏度、高特异性和非放射性等优点,成为了生物医学研究中的重要工具。
本文将介绍HRP酶标记生物素方法的原理、应用及优化方法。
一、HRP酶标记生物素方法的原理
HRP酶标记生物素方法的基本原理是利用酶与底物的反应产生可检测的光学信号。
具体来说,将目标分子(如抗体、抗原、核酸等)与生物素结合,形成生物素标记的目标分子。
随后,将生物素标记的目标分子与HRP酶结合,形成酶标
记的复合物。
当底物加入酶标记复合物时,酶催化底物反应产生可检测的光学信号,通过信号的强弱判断目标分子的含量。
二、HRP酶标记生物素方法的应用
HRP酶标记生物素方法在生物医学领域有着广泛的应用,如免疫分析、核酸检测、蛋白质组学等。
其中,在免疫分析中,HRP酶标记生物素方法可用于检测抗原或抗体的含量,具有高灵敏度、高特异性和低背景干扰等优点。
此外,在核酸检测中,HRP酶标记生物素方法可用于检测DNA或RNA的存在及表达水平。
在蛋白质组学中,HRP酶标记生物素方法可用于蛋白质的相互作用研究和蛋白质组学分析。
三、HRP酶标记生物素方法的优化
为了提高HRP酶标记生物素方法的灵敏度和特异性,研究者们不断尝试优化该方法。
其中,以下几点是优化HRP酶标记生物素方法的关键:
1.选择合适的酶浓度和底物浓度:在保证酶催化反应速率的同时,降低背景
干扰和信号的非特异性。
2.优化反应条件:如pH值、温度、离子强度等,以获得最佳的酶催化反应
效果。
抗体的标记——生物素(Biotin)

抗体的标记——生物素(Biotin)一般每个抗体可以标记3~5个生物素,标记时,生物素与抗体的比率受抗体浓度影响,对于10 mg/ml 的抗体溶液来说,生物素应超过蛋白12倍(摩尔数),对于2 mg/ml 的抗体溶液应超过20倍,生物素也可以直接以粉末的形式加入蛋白溶液中。
蛋白样品不得含有叠氮钠、BSA、甘氨酸、Tris或其他任何有自由氨基的添加物。
1. 抗体/蛋白的前处理:1.1 选择适当截留的超滤柱中加入400μl 标记反应溶液(0.1M PBS pH 7.2),加入1mg抗体,混匀。
1.2 4℃,6,000rpm,离心2min,弃滤液;于超滤柱中再加入200μl 标记反应溶液,混匀。
4℃,6,000rpm,离心2min,1.3 重复步骤1.2 6~7次。
1.4 混匀超滤柱中的残留的液体,室温静置1min;将超滤柱反转倒置于一新的超滤管中,4℃,6,000rpm,2min,收集液体。
1.5 取50μl PBS于超滤柱中混匀,静置1min。
倒置超滤柱,4℃,6,000rpm,2min,收集液体。
1.6 步骤1.4 与步骤1.5 的收集的滤液合并,用标记反应溶液调节抗体浓度到2mg/ml,4℃放置备用。
2. 生物素的标记:2.1 将生物素溶解在合适的溶剂中(请参照所选购生物素的说明书,不同的生物素其溶剂不同),浓度为20mg/ml,按照生物素与抗体分子摩尔比1:20的比例加入抗体溶液,室温反应1h。
2.2 葡聚糖凝胶分离纯化/透析袋或者超滤管去除游离生物素及其他试剂。
2.3 将抗体保存于合适的抗体保存液。
进行抗体标记的时候,需要对抗体性质、交联剂和标记物的性质非常了解,否则很难标记出高品质的抗体;标记量低,导致信号值低;标记量太高,不但容易造成背景,并且还容易由于标记物的聚集造成信号拮抗,反而降低或者淬灭信号值。
标记物的种类繁多,不同类型的标记物其性质完全不一样,标记物很难选择和把握,建议初学者使用专业化的试剂盒进行标记,或者直接委托专业化公司标记。
生物素-亲和素标记技术完整讲解剖析

4.2 在分子生物学中的应用
不对称PCR
低浓度引物 高浓度引物
4.2 在分子生物学中的应用 Southern 印迹杂交
4.2 在分子生物学中的应用
分子分子杂交的基本类型
固相杂交 液相杂交 原位杂交 基因芯片
4.2 在分子生物学中的应用
分子杂交的基本类型
液相杂交 将参加液相杂交的两条核酸链都游离在 溶液中,在一定条件下(溶液的离子强度 、温度、时间等)进行杂交,然后再将未 杂交的探针除去,即得到杂交后的核酸分 子。
三 实验方法及步骤
生物素-亲和素标记技术的主要方法 :
(1)桥-亲和素-生物素标记法(BAB法) (2)亲和素-生物素-过氧化物酶法(ABC法) (3)标记生物素-抗生物素法 ( LAB法)
(1)桥-亲和素-生物素标记法(BAB法)
桥-亲和素-生物素标记法(bridged avidin-biotin technique,BAB)分为直
生物素-亲和素标记技术
第一组
一 背景 二 原理 三 实验方法及步骤 四 应用 五 反应特点 六 应用前景
一 背景
生物素:
又称维生素H 、辅酶R,是水溶性维生素,也属于维生素B族。
1936年,两位德国科学家Kogl和Tonnis从煮熟的鸭蛋黄中 分离提取出一种结晶物质,是酵母生长所必需的,称之为 “生物素”。生物素厂泛存在于自然界的各种生物中,是人类 和动物维持健康不可缺少的要素,并因而得名。因其在食物 中的分布很广,几乎每种食物中都含有少量的生物素,加之 人体每日的所需量又很少,所以,人们一般都不缺乏这种维生 素。
直接法步骤
(2)亲和素-生物素-过氧化物酶法 (ABC法)
即亲和素-生物素-过氧化物酶法(avidin-biotin complex technology,ABC),其原理是预先按一定比例将亲和素(或链霉亲和 素)与酶标生物素结合,形成可溶性的亲和素(或链霉亲和素)-生物素 -过氧化物酶复合物,当其与检测反应体系中的生物素化一抗(直接 法)或生物素化二抗(间接法)相遇时,复合物中未饱和的亲和素 (或链霉亲和素)结合部位即可与抗体上的生物素结合。在亲和素-生 物素-过氧化物酶复合物形成时,一个标记了生物素的酶分子可通过 其生物素连接多个亲和素(或链霉亲和素)分子,一个亲和素(或链霉 亲和素)分子又可桥联多个酶标生物素分子,这样就形成具多级放大 作用的晶格样网状结构,其中网络了大量酶分子。ABC法背景染色淡, 方法简单,节约时间,可用于双重或多重免疫染色,尤其在组织切片 和细胞悬液中抗原的检测和亚细胞水平定位分析中应用较广。
生物素标记步骤

生物素标记步骤生物素标记啊,就像是给小分子或者生物大分子戴上一个独特的小标签。
这事儿听起来有点复杂,可一旦搞明白,就像学会了一个超级有趣的魔法。
先来说说生物素标记的材料准备。
你得有生物素化试剂,这就像是魔法药水,是整个标记过程的关键家伙。
不同的生物素化试剂就像不同口味的糖果,各有各的用处。
然后呢,要标记的目标分子也得准备好,不管是蛋白质还是核酸,它们就像等待打扮的小娃娃。
还需要合适的缓冲液,缓冲液就像一个温柔的保护罩,让整个反应在合适的环境里进行,不至于太“暴躁”或者太“消沉”。
比如说,对于某些蛋白质的生物素标记,磷酸盐缓冲液就常常被用到,就像某些菜一定要放特定的调料一样。
接着就是正式的标记过程啦。
如果是标记蛋白质,要先确保蛋白质处于一个良好的状态。
就像人要精神饱满才能去参加活动一样。
一般要把蛋白质溶解在合适的缓冲液里,浓度也要合适,不能太浓像浆糊,也不能太稀像清汤寡水。
然后慢慢地加入生物素化试剂,这个加入的速度很有讲究,太快了就像一阵狂风把好好的布置都吹乱了,可能会导致标记不均匀或者产生一些不好的副反应。
就像画画的时候一笔画得太急,线条就歪歪扭扭的。
要慢慢地、稳稳地加进去,一边加还要一边轻轻搅拌,就像搅拌咖啡一样,让生物素化试剂和蛋白质能够充分地“拥抱”“打招呼”。
标记核酸也有它自己的小窍门。
核酸分子本身就像一串精致的小珠子项链。
首先要让核酸处于合适的离子环境中,这就像给项链找一个合适的展示台。
然后加入生物素化试剂的时候,要注意温度的控制。
有些核酸标记在常温下就可以顺利进行,就像有些花在春天的常温下就开得很好。
但有些可能需要稍微高一点或者低一点的温度,就像有些花需要在温室或者凉爽的环境里才肯盛开。
而且标记的时间也很关键,时间太短可能标记不完全,就像给蛋糕上的奶油只涂了一半。
时间太长呢,又可能会出现一些意外情况,就像蛋糕在烤箱里烤过头了。
在标记的过程中,有时候会遇到一些小麻烦。
比如说标记效率不高,这就像种庄稼收成不好一样让人头疼。
生物素-亲和素标记技术完整讲解

直接法:
+ B-E + A
ABC
+ABC
Ab-Ag-Ab-B + ABC
Ab-Ag-Ab-B-ABC
直接法 间接法
(3)标记生物素-抗生物素法
标记亲和素-生物素法(labeled avidin-biotin, LAB)直接法是以标记亲和素(或链霉亲和素)直接 与免疫复合物中的生物素化一抗连接进行酶呈色 反应,间接法是采用生物素化的二抗和抗原结合, 由于加入了二抗,较直接法检测灵敏度要高,对 免疫细胞中免疫球蛋白的定位具有特异性。LAB 法需以生物素标记一抗,应用不如ABC法普遍, 与ABC法相比,LAB法操作较简单,但灵敏度较 低
亲和素:
亲和素是一种糖蛋白,可由蛋清中提取。分子量60kD, 每个分子由4个亚基组成,可以和4个生物素分子亲密结合。 亲和素与生物素的结合,虽不属免疫反应,但特异性强,亲和力大, 两者一经结合就极为稳定。由于1个亲和素分子有4个生物素分子的 结合位置,可以连接更多的生物素化的分子,形成一种类似晶格的复合体。 因此把亲和素和生物素与ELISA偶联起来,就可大大提高ELISA的敏感度。
直接法步骤
(2)亲和素-生物素-过氧化物酶法 (ABC法)
即亲和素-生物素-过氧化物酶法(avidin-biotin complex technology,ABC),其原理是预先按一定比例将亲和素(或链霉亲和 素)与酶标生物素结合,形成可溶性的亲和素(或链霉亲和素)-生物素 -过氧化物酶复合物,当其与检测反应体系中的生物素化一抗(直接 法)或生物素化二抗(间接法)相遇时,复合物中未饱和的亲和素 (或链霉亲和素)结合部位即可与抗体上的生物素结合。在亲和素-生 物素-过氧化物酶复合物形成时,一个标记了生物素的酶分子可通过 其生物素连接多个亲和素(或链霉亲和素)分子,一个亲和素(或链霉 亲和素)分子又可桥联多个酶标生物素分子,这样就形成具多级放大 作用的晶格样网状结构,其中网络了大量酶分子。ABC法背景染色淡, 方法简单,节约时间,可用于双重或多重免疫染色,尤其在组织切片 和细胞悬液中抗原的检测和亚细胞水平定位分析中应用较广。
蛋白质的定量分析方法

蛋白质的定量分析方法
检测蛋白质含量的方法有多种,常见的包括凯氏定氮法、生物素标记法、吸光光度法等。
1.凯氏定氮法(Kjeldahlmethod):这是一种经典的蛋白质定量方法,主要通过测定样品中氮元素的含量来计算蛋白质含量。
凯氏定氮法包括消解、蒸馏和滴定三个步骤,其原理是将样品中的氮元素转化为氨氮,然后通过滴定测定氨氮的含量,进而计算蛋白质含量。
2.生物素标记法(Biotin-labelingmethod):这是一种利用生物素(Biotin)与蛋白质特异性结合的方法来检测蛋白质含量。
首先将生物素标记到目标蛋白质上,然后利用亲和层析法(如生物素-亲和素系统)进行定量分析。
3.吸光光度法(Absorbancemethod):这是一种基于蛋白质在紫外光区域的吸收特性进行定量分析的方法。
蛋白质中的芳香族氨基酸(如酪氨酸、苯丙氨酸和色氨酸)具有在紫外光区域(如
280nm)的吸收特性,通过测量样品在这一波长处的吸光值,可以计算蛋白质含量。
各种方法适用于不同的实验条件和要求,选择合适的方法需要根据实际情况来判断。
在实际操作过程中,还需注意遵循实验规程,确保实验结果的准确性。
生物素标记

1 煮透析袋,纯水,1L烧杯,加0.1-1.0%EDTA,待水沸腾,将透析袋扔进去,20分钟。
2 配制NAHCO3~NA2CO
3 缓冲液
NAHCO3:2.93g
NA2CO3:1.59g 溶于1000ml双蒸水,PH大约9.6 浓度0.01 mol/L 3 待标记的Ab移入透析袋中,用0.01 mol/L ,PH大于8.7的碳酸盐缓冲液透析过夜,移入2ml EP管中。
4 称1mg Biotin 溶于1ml DMSO中。
5 取50ul Biotin 溶液加至1 mg /L。
Ab中(浓度至少为1 mg /mL,否则难以标记)Biotin在标记液中约1/15M。
6 将EP管放入震荡器,室温,避光震荡4h.
7 纯化:
透析:用0.01mol PH 7.2 的PB溶液透析72 h,弃除游离Biotin,每天换液2次,约8到12 h换一次。
PB母液配制:0.2 mol/L,PH大约7.3
NA2HPO4.12 H2O:35.8g加入500 ml双蒸水
NAH2PO4.2H2O:15.6g 加入500 ml双蒸水
配制时,取1 81ml NA2HPO4,0.2 mol/L溶液,2 19ml NAH2PO4 0.2 mol/L溶液。
一共100ml,
8 已标记的Biotin-Ab用7.2PH PBS 保存,经浓度0.15单位的NACL 缓冲液稀释至2倍工作浓度,分装于4度保存。
注意:1 标记前注意抗体效价
2 标记后检测。
生物素标记多肽方法

生物素标记多肽方法
1. 嘿,你知道生物素标记多肽方法里的直接标记法不?就好像给多肽这个小家伙直接贴上一个显眼的标签一样!比如把特定的生物素直接连接到多肽上,哇塞,这多直接有效啊!简单粗暴但超有用呀,你说是不是?
2. 哇哦,还有化学偶联法呢!这就像是给多肽和生物素牵红线呀,让它们紧密地结合在一起。
比如在合适的条件下,利用化学反应让它们完美联姻,这不超酷的嘛?
3. 嘿呀,竞争取代法你听过没?可以想象成一场有趣的“位置争夺战”呢!用生物素去和其他物质竞争多肽上的结合位点,厉害吧!就像在游戏里争夺宝物一样刺激呢,难道不是吗?
4. 别忘了还有酶促标记法哟!好比让酶这个小助手来帮忙给多肽加上生物素这个标记,多神奇呀!像是有了个魔法小帮手一样,是不是很有意思呀?
5. 还有光化学标记法呢,这就如同用特殊的光给多肽打上生物素的印记。
就好像阳光在大地上留下痕迹一样自然又独特呢,你不觉得超级神奇吗?
6. 哈哈,最后还有亲和素-生物素法呢!这就像是让亲和素当媒人,把
生物素和多肽牵在一起。
就好像好朋友帮忙介绍对象一样,效果杠杠的呀,你不认同吗?
我觉得这些生物素标记多肽的方法真的好有趣,也好实用啊!每种方法都有它独特的魅力和用处呢!。
化合物生物素标记下拉

化合物生物素标记下拉
在生物学研究中,化合物生物素标记下拉是一种常用的实验方法,可以用于检测特定蛋白质的表达、寻找蛋白质的相互作用等。
下面我
们将详细介绍这种实验方法的步骤。
第一步:蛋白抽提
在进行化合物生物素标记下拉实验之前,首先需要从细胞组织或
细胞中提取出目标蛋白质。
通常需要将细胞或组织分别裂解,并添加
破坏蛋白质的酶如胰蛋白酶等,待蛋白质裂解后,用离心等方法分离
出蛋白质。
第二步:生物素标记
将蛋白质与生物素偶联,需要使用化合物生物素标记试剂盒。
将
生物素分子与化合物分子结合,使化合物成为一种加强信号的标记物,它能够与特定的亲生物素结合。
第三步:亲生物素树脂
细胞抽提液中含有大量非特异性蛋白,若直接以生物素标记的蛋
白液进行下拉实验,则结果会受到大量干扰。
因此需要用亲生物素树
脂进行纯化。
将生物素标记的蛋白质溶液加入亲生物素树脂,有特异
性地结合标记蛋白质。
通过洗涤步骤,可以将其他杂质洗掉,最终获
得纯化后的蛋白质样品。
第四步:下拉实验
将纯化后的蛋白质样品加入含有特定蛋白质的细胞中,让其与目
标蛋白相互作用。
使用亲生物素树脂,将所有含有标记蛋白质的细胞
集中下拉,其余未包含需要检测的蛋白质的蛋白质便留在上清液中。
通过对上清液与下拉液的分析,可以确定目标蛋白的相互作用分子。
总之,化合物生物素标记下拉实验可以广泛应用于蛋白质的相互
作用和功能研究领域,其实验步骤简单,准确度高,成为蛋白质相互
作用研究的重要实验手段。
生物素标记蛋白操作方法
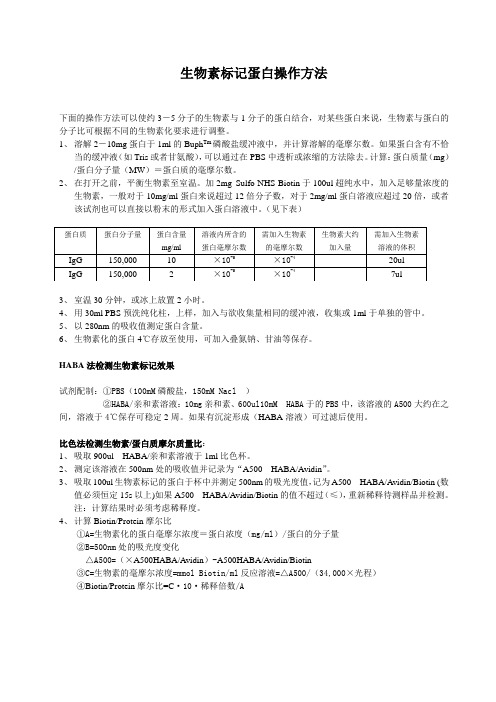
生物素标记蛋白操作方法下面的操作方法可以使约3-5分子的生物素与1分子的蛋白结合,对某些蛋白来说,生物素与蛋白的分子比可根据不同的生物素化要求进行调整。
1、溶解2-10mg蛋白于1ml的Buph Tm磷酸盐缓冲液中,并计算溶解的毫摩尔数。
如果蛋白含有不恰当的缓冲液(如Tris或者甘氨酸),可以通过在PBS中透析或浓缩的方法除去。
计算:蛋白质量(mg)/蛋白分子量(MW)=蛋白质的毫摩尔数。
2、在打开之前,平衡生物素至室温。
加2mg Sulfo-NHS-Biotin于100ul超纯水中,加入足够量浓度的生物素,一般对于10mg/ml蛋白来说超过12倍分子数,对于2mg/ml蛋白溶液应超过20倍,或者该试剂也可以直接以粉末的形式加入蛋白溶液中。
(见下表)3、室温30分钟,或冰上放置2小时。
4、用30ml PBS预洗纯化柱,上样,加入与欲收集量相同的缓冲液,收集或1ml于单独的管中。
5、以280nm的吸收值测定蛋白含量。
6、生物素化的蛋白4℃存放至使用,可加入叠氮钠、甘油等保存。
HABA法检测生物素标记效果试剂配制:①PBS(100mM磷酸盐,150mM Nacl )②HABA/亲和素溶液:10mg亲和素、600ul10mM HABA于的PBS中,该溶液的A500大约在之间,溶液于4℃保存可稳定2周。
如果有沉淀形成(HABA溶液)可过滤后使用。
比色法检测生物素/蛋白质摩尔质量比:1、吸取900ul HABA/亲和素溶液于1ml比色杯。
2、测定该溶液在500nm处的吸收值并记录为“A500HABA/Avidin”。
3、吸取100ul生物素标记的蛋白于杯中并测定500nm的吸光度值,记为A500HABA/Avidin/Biotin (数值必须恒定15s以上)如果A500HABA/Avidin/Biotin的值不超过(≤),重新稀释待测样品并检测。
注:计算结果时必须考虑稀释度。
4、计算Biotin/Protein摩尔比①A=生物素化的蛋白毫摩尔浓度=蛋白浓度(mg/ml)/蛋白的分子量②B=500nm处的吸光度变化△A500=(×A500HABA/Avidin)-A500HABA/Avidin/Biotin③C=生物素的毫摩尔浓度=mmol Biotin/ml反应溶液=△A500/(34,000×光程)④Biotin/Protein摩尔比=C·10·稀释倍数/A。
生物素标记核酸方法

生物素标记核酸方法引言:生物素标记核酸方法是一种常用的实验技术,通过将生物素与核酸分子结合,可以追踪和检测特定的核酸序列。
本文将介绍生物素标记核酸的原理、方法以及应用领域。
一、原理生物素是一种小分子有机物,具有很强的亲和力。
生物素标记核酸方法利用生物素与亲和剂亲和结合的特性,将生物素连接到核酸分子上。
通常采用二亚甲基双亲和剂(EDC)或过氧化物酶(H2O2)等化学试剂进行反应,将生物素共价地连接到核酸分子上。
二、方法1. 生物素标记DNA方法(1)制备DNA探针:将需要标记的DNA序列与生物素探针连接,通常采用连接试剂进行反应,生成生物素标记的DNA探针。
(2)标记DNA探针:将连接了生物素的DNA探针与目标DNA 序列进行杂交反应,使生物素与目标DNA结合。
(3)检测信号:通过酶标法、荧光染料或放射性同位素等方法,将生物素标记的DNA探针检测出来。
2. 生物素标记RNA方法(1)制备RNA探针:将需要标记的RNA序列与生物素探针连接,通常采用连接试剂进行反应,生成生物素标记的RNA探针。
(2)标记RNA探针:将连接了生物素的RNA探针与目标RNA序列进行杂交反应,使生物素与目标RNA结合。
(3)检测信号:通过酶标法、荧光染料或放射性同位素等方法,将生物素标记的RNA探针检测出来。
三、应用领域1. 基因表达分析:生物素标记核酸方法可以用于研究基因的表达水平,通过标记mRNA或miRNA等核酸分子,可以检测它们在细胞或组织中的表达情况。
2. 分子诊断:生物素标记核酸方法可以用于检测病原体的核酸序列,如病毒、细菌等,用于疾病的诊断和监测。
3. 分子遗传学研究:生物素标记核酸方法可以用于研究基因的遗传变异、突变等,从而揭示基因与表型之间的关系。
4. 蛋白质相互作用研究:生物素标记核酸方法可以用于研究蛋白质与核酸的相互作用,通过标记DNA或RNA分子,可以检测它们与特定蛋白质的结合情况。
结论:生物素标记核酸方法是一种重要的实验技术,可以用于追踪和检测特定的核酸序列。
生物素标记核酸方法

生物素标记核酸方法引言:生物素标记核酸方法是一种常用的实验技术,用于检测、定位和研究核酸的功能和分布情况。
生物素(Biotin)是一种小分子化合物,具有较强的亲和力和特异性,可以与酶和抗体等蛋白质结合,从而实现对核酸的标记和检测。
本文将介绍生物素标记核酸的原理、方法和应用。
一、生物素标记核酸的原理生物素标记核酸的原理基于生物素与亲和剂的结合。
生物素能够与亲和剂如酶、抗体等特异性结合,形成稳定的复合物。
通过将亲和剂标记在生物素上,就可以实现对核酸的标记。
常用的生物素标记方法包括生物素标记末端法、生物素标记引物法和生物素标记缺口法等。
二、生物素标记核酸的方法1. 生物素标记末端法生物素标记末端法是一种将生物素标记在核酸的末端的方法。
首先,将核酸末端修复,以便连接生物素分子。
然后,在核酸末端上引入生物素分子,通过特定的酶或化学试剂进行连接。
最后,通过适当的检测方法,如酶标测定法或荧光探针法,可以检测到生物素标记的核酸。
2. 生物素标记引物法生物素标记引物法是一种将生物素标记在核酸引物上的方法。
在引物的适当位置引入生物素分子,并通过特定的酶或化学试剂进行连接。
接下来,使用生物素标记的引物与待检测的核酸进行反应,形成生物素标记的核酸引物-目标核酸复合物。
最后,通过适当的检测方法,如PCR、电泳或原位杂交等,可以检测到生物素标记的核酸。
3. 生物素标记缺口法生物素标记缺口法是一种通过特定酶切割核酸,形成生物素标记的缺口的方法。
首先,在核酸的适当位置引入生物素分子,并通过特定的酶或化学试剂进行连接。
然后,使用特定酶切割核酸,使核酸链断裂形成缺口,并在断裂的位置上引入生物素标记。
最后,通过适当的检测方法,如原位杂交或荧光显微镜观察等,可以检测到生物素标记的核酸。
三、生物素标记核酸的应用1. 分子生物学研究生物素标记核酸方法在分子生物学研究中广泛应用。
例如,通过生物素标记的引物进行PCR扩增,可以检测和定量目标核酸的存在和表达水平。
生物素标记的应用实验原理

生物素标记的应用实验原理1. 引言生物素标记是生命科学研究中常用的一种实验技术,在生物学领域中有着广泛的应用。
本文将介绍生物素标记的原理、实验步骤以及常见应用领域。
2. 生物素标记的原理生物素标记是利用生物素与亲生物素的高亲和力进行标记的一种技术。
生物素是一种小分子,能够与亲生物素结合蛋白质相互作用。
亲生物素是一种对生物素具有高亲和力的结合剂,通过与生物素结合形成稳定的复合物。
3. 生物素标记的实验步骤生物素标记实验通常包括以下步骤:3.1 标记反应首先,需要准备好待标记的分子,可以是蛋白质、核酸或其他小分子。
然后,将生物素和亲生物素标记剂一起与待标记的分子进行反应。
标记反应可以通过化学交联、生物合成或标记基团的化学反应等方式进行。
3.2 纯化和检测完成标记反应后,需要对反应产物进行纯化和检测。
纯化可以使用凝胶过滤、柱层析等方法进行。
检测可以利用电泳、质谱等技术进行,以确保标记的分子具有高纯度和理想的标记效果。
3.3 应用实验标记完成的分子可以用于各种生物学实验中。
常见的应用实验包括免疫组化、荧光染色、原位杂交等,这些实验可以在细胞水平或组织水平上观察到标记分子的位置和定位。
4. 生物素标记的应用领域生物素标记在生命科学研究中有着广泛的应用。
下面将介绍几个常见的应用领域:4.1 蛋白质研究生物素标记可以用于蛋白质的表达和纯化过程中,通过标记蛋白质使其易于检测和纯化。
此外,生物素标记还可以用于蛋白质间相互作用的研究,通过标记不同蛋白质使其易于检测和定位。
4.2 基因组学研究生物素标记可以用于DNA或RNA的标记,用于基因组学研究中的测序、杂交等实验。
标记后的DNA或RNA可以用于检测特定序列、寻找基因突变等。
4.3 细胞信号转导研究生物素标记可以用于研究细胞信号转导通路中的蛋白质相互作用和定位。
通过标记信号蛋白,可以研究其在信号传递过程中的活性、相互作用和定位。
4.4 药物研发生物素标记可以用于药物研发中的药物靶点筛选和药物活性评价。
蛋白质测量方法

蛋白质测量方法蛋白质是生物体内一种重要的有机化合物,它在维持生命活动和调节机体功能中起着至关重要的作用。
因此,准确地测量蛋白质含量对于研究和应用领域都具有重要意义。
本文将介绍常用的蛋白质测量方法。
一、低里德伯法低里德伯法是一种常用的测定蛋白质浓度的方法。
该方法利用蛋白质与试剂结合产生的差异吸光度来测量蛋白质的含量。
常用的试剂有布拉德福试剂、比色法试剂等。
首先,将待测样品与试剂混合,使其发生反应;然后,通过比色计或分光光度计测量混合液的吸光度,并将吸光度值与已知浓度的标准曲线进行对比,从而确定样品中蛋白质的含量。
二、生物素标记法生物素标记法是一种基于生物素与蛋白质结合的原理进行测量的方法。
该方法通过将生物素与蛋白质结合,在测定过程中利用生物素与酶标记物的结合来测定蛋白质的含量。
首先,将待测样品与生物素结合,形成生物素-蛋白质复合物;然后,加入酶标记物与复合物结合,并通过化学反应使酶标记物产生发光或发色反应;最后,通过检测发光或发色反应的强度来测定蛋白质的含量。
三、Western blotting法Western blotting法是一种常用的蛋白质分离和检测方法。
该方法通过将蛋白质样品进行电泳分离,并利用蛋白质间的电荷差异进行分离,然后将分离后的蛋白质转移到膜上,并利用特异性抗体与目标蛋白质结合,最后通过酶标记物或荧光染料等进行检测。
通过Western blotting法可以精确地测定蛋白质的分子量和相对含量。
四、质谱法质谱法是一种高灵敏度和高分辨率的蛋白质测量方法。
该方法通过将蛋白质样品进行分离,并利用质谱仪进行分析,得到蛋白质的质谱图谱。
根据蛋白质的质量-电荷比和丰度信息,可以推断出蛋白质的分子量和含量。
质谱法具有高通量、高灵敏度和高特异性的优点,适用于复杂样品的蛋白质测量。
总结起来,蛋白质测量方法有低里德伯法、生物素标记法、Western blotting法和质谱法等。
每种方法都有其特点和适用范围,选择合适的方法可以准确地测量蛋白质的含量。
标记亲和素生物素法

标记亲和素生物素法标记亲和素生物素法是一种常用的生物化学实验技术,用于研究蛋白质的相互作用。
本文将介绍亲和素生物素法的原理、应用和实验步骤。
一、原理亲和素生物素法基于生物素(biotin)与亲和素(avidin或streptavidin)之间的高度特异性结合。
生物素是一种水溶性维生素,与亲和素结合后形成稳定的复合物。
利用这种结合关系,可以将含有生物素的分子与亲和素结合,从而实现对目标分子的标记和纯化。
二、应用亲和素生物素法在生物科学研究中有广泛的应用。
其中一些主要应用包括:1. 蛋白质纯化:通过将含有生物素的标签蛋白与亲和素结合,可以实现对目标蛋白的高效纯化。
2. 免疫组化:生物素标记的抗体可以与细胞或组织中的特定抗原结合,从而实现对抗原的检测和定位。
3. 蛋白质相互作用研究:通过将目标蛋白与生物素标记的配体蛋白结合,可以研究蛋白质的相互作用和信号传导机制。
三、实验步骤亲和素生物素法的实验步骤主要包括以下几个方面:1. 标记生物素:将生物素与所需标记的分子(如蛋白质或核酸)进行化学反应,将生物素引入目标分子中。
2. 制备亲和素柱:将亲和素(如avidin或streptavidin)固定在柱子上,形成亲和素柱。
亲和素柱可以商购买或自行制备。
3. 样品处理:将标记了生物素的分子与亲和素柱接触,使其与亲和素结合。
4. 洗脱:通过改变溶液条件,如改变pH值或添加竞争性配体,使亲和素与目标分子解离,从而洗脱目标分子。
5. 分析和应用:将洗脱得到的目标分子用于后续实验或分析,如Western blot、质谱分析等。
四、实验注意事项在进行亲和素生物素法实验时,需要注意以下几点:1. 使用高纯度的生物素和亲和素,以确保实验结果的准确性。
2. 选择适当的洗脱条件,以实现目标分子的高效洗脱。
3. 控制实验中的非特异性结合,以减少背景信号。
4. 根据实验需要选择合适的生物素标记方法,如目标分子的标记位置和标记方式(N-末端、C-末端或内部标记)。
生物素标记rna

生物素标记rna
生物素标记RNA是一种常用的实验技术,它可以用于研究RNA的生物学功能和分子机制。
生物素标记RNA的原理是将生物素分子与RNA分子结合,从而使RNA分子具有生物素的特性,可以用生物素亲和素或其他生物素结合蛋白进行检测和纯化。
生物素标记RNA的制备方法有多种,其中最常用的是化学合成法和转录法。
化学合成法是将生物素分子与RNA分子通过化学反应结合在一起,而转录法则是利用RNA聚合酶将生物素标记的核苷酸加入到RNA分子中。
无论是哪种方法,都需要对生物素标记RNA进行纯化和检测,以确保其质量和纯度。
生物素标记RNA的应用范围非常广泛,包括基因表达分析、RNA 互作研究、RNA结构和功能研究等。
其中,基因表达分析是最常见的应用之一。
通过将生物素标记RNA与细胞或组织中的RNA混合,可以利用生物素亲和素或其他生物素结合蛋白将其分离出来,从而分析RNA的表达水平和差异表达基因。
此外,生物素标记RNA还可以用于RNA互作研究,通过将生物素标记RNA与RNA结合蛋白或RNA结合小分子混合,可以分析RNA的结构和功能。
生物素标记RNA是一种非常有用的实验技术,可以用于研究RNA 的生物学功能和分子机制。
它的制备方法简单,应用范围广泛,是RNA研究领域中不可或缺的工具之一。
蛋白活细胞追踪技术的方法

蛋白活细胞追踪技术的方法细胞追踪是生物学研究中的重要手段之一,能够帮助科学家们观察和分析细胞的运动、分化和相互作用等。
蛋白活细胞追踪技术是一种常用的方法,通过标记特定蛋白在细胞内的表达来追踪细胞的活动。
本文将介绍几种常见的蛋白活细胞追踪技术,并分析它们的优缺点。
一、荧光蛋白标记法荧光蛋白标记法是最常见的蛋白活细胞追踪技术之一。
通过将绿色荧光蛋白(GFP)等荧光蛋白与目标蛋白融合,使得目标蛋白表达的细胞在荧光显微镜下呈现出明亮的荧光信号,从而实现对细胞的追踪。
这种方法简单、直观,但需要目标蛋白能够与荧光蛋白融合,并且需要使用荧光显微镜进行观察。
二、免疫染色法免疫染色法是一种通过特异性抗体检测目标蛋白在细胞中的表达情况的方法。
通过将特异性抗体与荧光标记物结合,使得目标蛋白表达的细胞在荧光显微镜下呈现出荧光信号。
这种方法适用于无法融合荧光蛋白的蛋白分子,但需要具备目标蛋白的特异性抗体,并且需要进行免疫染色的操作。
三、生物素标记法生物素标记法是一种利用生物素与亲和素结合的特异性来追踪细胞的方法。
通过将生物素与目标蛋白结合,然后使用荧光标记的亲和素结合在生物素上,从而实现对目标蛋白表达的细胞的追踪。
这种方法可以应用于一些无法使用荧光蛋白或抗体进行标记的蛋白,但需要进行多步骤的操作。
四、化学荧光探针法化学荧光探针法是一种利用化学合成的荧光探针标记目标蛋白的方法。
通过合成特定结构的化学荧光探针,使其能够与目标蛋白发生特异性的结合,并在荧光显微镜下显示出荧光信号。
这种方法可以用于标记各种类型的蛋白,但需要合成特定的化学荧光探针。
蛋白活细胞追踪技术包括荧光蛋白标记法、免疫染色法、生物素标记法和化学荧光探针法等多种方法。
每种方法都有其适用的场景和优缺点,科学家们可以根据实验需求和目标蛋白的特性选择合适的技术。
随着技术的不断发展,相信蛋白活细胞追踪技术将在细胞生物学研究中发挥越来越重要的作用。
生物素标记氨基

生物素标记氨基
生物素是一种水溶性维生素,也被称为维生素H或辅酶R。
它在生物体内起着重要的作用,包括能量代谢、DNA复制和细胞分裂等。
生物素还可以被用作标记分子的工具,其中最常用的是生物素标记氨基。
生物素标记氨基是一种将生物素与氨基酸结合的方法。
这种方法可以用于标记蛋白质、肽和其他生物分子。
生物素标记氨基的方法有多种,其中最常用的是生物素标记L-赖氨酸。
生物素标记L-赖氨酸的方法是将生物素与L-赖氨酸结合,然后将其插入到蛋白质或肽的氨基酸序列中。
这种方法可以通过化学合成或基因工程技术来实现。
在化学合成中,生物素和L-赖氨酸通过化学反应结合在一起,然后将其插入到蛋白质或肽的氨基酸序列中。
在基因工程技术中,生物素和L-赖氨酸的结合是通过基因重组技术实现的。
生物素标记氨基的优点是可以用于检测蛋白质、肽和其他生物分子的存在和定位。
生物素标记氨基可以用于免疫印迹、免疫荧光、免疫组化和原位杂交等技术。
生物素标记氨基还可以用于分离和纯化蛋白质、肽和其他生物分子。
生物素标记氨基可以通过亲和层析、亲和电泳和亲和柱等技术实现。
生物素标记氨基是一种重要的生物分子标记方法。
它可以用于检测、
定位、分离和纯化蛋白质、肽和其他生物分子。
生物素标记氨基的方法有多种,其中最常用的是生物素标记L-赖氨酸。
生物素标记氨基的优点是灵敏度高、特异性强、操作简便、成本低廉。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
生物素标记方法
生物素标记方法是研究分子生物学、生物医学以及基因工程领域中常用的一种技术手段。
生物素是一种小分子,能够稳定结合在蛋白质、DNA、RNA等生物分子上,然后通过化学反应将其标记,从而实现对这些生物分子的检测、分离、纯化等目的。
下面,我将介绍几种常用的生物素标记方法。
1. 化学合成法
该方法是指直接将生物素与目标分子进行化学反应合成标记物。
一般情况下,将生物素与分子中含有取代基或官能团的氨基酸、碳水化合物、核苷酸等分子反应,形成生物素标记分子。
这种方法操作简单,标记分子的稳定性相对较高,但也存在反应产物多样性和纯化难度较大的问题。
2. 酶标法
生物素酶标方法是通过先将目标分子与无生物素酶的生物素结合蛋白偶联,然后加入酶标记化学底物,使之被生物素结合蛋白吸附,生成酶标记。
该方法不需要化学反应,有色或荧光信号明显,而且有较高的检测灵敏度和特异性,可以用于定量检测和高通量筛选。
3. 亲和柱纯化法
该方法是利用生物素亲和柱的特异性吸附作用,对生物素标记蛋白、DNA等生物大分子进行纯化,从而获得高质量的样品。
最常用的是streptavidin疏水亲和纯化柱和avidin疏水亲和纯化柱。
这种方法操作简单,纯化效果好,但标记分子的稳定性较低,可能存在对目标蛋白活性影响等问题。
以上是生物素标记方法的三种常用技术手段,可以根据不同的研究需求选择合适的方法使用。
生物素标记技术的广泛应用不仅有助于分子生物学和生物医学的研究发展,也为新药发现和治疗提供了重要的帮助。
