第六章 苯环
06芳香烃

FeX3 + HCl
NO2 硝化: HNO3+ H2SO4 50~55 C
0
+ H2O
SO3H 磺化: 浓 H2SO4 ~80 C
0
+ H2O
R
烷基化:
+ RX
无水AlCl3
+ HX
酰基化: O + R C X 无水AlX3
O C R
19
※
亲电取代反应的机理
(1)首先亲电试剂E+进攻苯环,并很快和苯环的电子形成络 合物。
苯乙烯
苯乙炔
3-苯基丙烯
2-甲基-2苯基丁烷
15
(3)芳基(Aryl)
芳烃分子去掉一个或氢原子后剩余的基团,Ar-:
3. 苯的衍生物的命名: 苯环上有多个不同官能团取代基时,选处于优先次序的官 能团为母体,其它官能团作为取代基。官能团优先次序:
16
NO2 CH3 3-硝基甲苯
CH3 O2N Cl
~200oC
CH2R
Or Zn-Hg / HCl
*2 制备直链烷烃
42
6.6 烷基苯芳香侧链的反应 一、烷基苯的氧化
一般氧化剂不氧化苯环,特殊氧化剂如:
+ 9 O2
。 400 ~ 500 C V2O5
O 顺丁烯二酸酐
具有α- H 的烷基苯侧链可被氧化 :
C H2C H3
KMnO 4 / H3O+
=
O O
=
CO O H
43
苯环较稳定,不易氧化。无论烷基侧链的长短,其氧化产物通常
都是苯甲酸。
没有α- H 的烷基苯很难被氧化。
CH3CH2 C(CH3)3 KMnO4 HOOC C(CH3)3
有机化学单环、多环及非苯芳香烃

BrBiblioteka BrBrBr②苯为高度不饱和的分子,却不容易发生加成反应而容
易发生取代反应。
③苯环的特殊稳定性: 不与氧化剂反应; 在化学反应中苯环常保持不变;氢化热和燃烧热低。
氢化热是化合物催化加氢时所放出的热量,氢化热小 说明化合物内能低,比较稳定。
环己烯、环己二烯和苯催化加氢时都生成环己烷,氢 化热数据为:
120°
·
·
0.110nm ·
·
Π6 6
0.1397nm
·
·
苯的大π键 Π 66。
(2) 分子轨道理论
没有参加杂化的六个2p轨道重新组合成六个π分子轨 道,其中三个是成键轨道,三个是反键轨道。
在基态时,苯分子中的六个π电子都在成键轨道上,它 们的能量要比在孤立的π轨道低得多,因此苯环是一个 稳定的体系。
③ 苯环上有强吸电子基团如硝基、磺酸基、羧基、酰基 时,不发生Friedel-Crafts反应;
(5) Friedel-Crafts酰基化反应 酰基化试剂常用酰氯或酸酐,最常用的催化剂
是AlCl3,产物为芳酮。
乙酰基
O
+ CH3 C Cl AlCl3
O C CH3
CH3 +
CH3
O C
O C
O
AlCl3
CH3
CH3
Cl
+
Cl
氟代太激烈,氟苯要用间接方法制备;碘代时生成的 HI有强的还原性,必须除去HI反应才能顺利进行。
+ I2 + AgClO4
I + AgI + HClO4
(3) 磺化反应
浓 H2SO4 , 80℃ or H2SO4(SO3) , 室温
有机化学第六章芳香烃

Y
可见,凯库勒式并不能确切地反映苯的真实情况
现代物理方法(射线法、光谱法、偶极距的测定)表明,苯分子是 一个平面正六边形构型,键角都是120°,碳碳键长都是0.1397nm。图 示如下:
杂化轨道理论解释
苯分子中的碳原子都是以sp2杂化轨道互相沿对称轴方向重叠形成6个C-Cσ键组成一个 正六边形,每个C各以一个sp2杂化轨道分别与H的1s轨道沿对称的方向重叠,形成六 个C-Hσ键,由于是sp2杂化,所以键角都是120。所有原子均在同一平面上。 每个C还有一个未参与杂化的垂直于与碳环平面σ键的P轨道,彼此侧面重叠,形成一 个封闭的共轭体系,每个P轨道上有一个P电子,组成了π66大π键。由于共轭效应使π 电子高度离域,电子云完全平均化,故无单双键之分。 因此,苯的电子云是一个整体,分布在环的上、下方,并且是完全平均的,所以苯分 子中每个C-C键都有π键的性质,并且是完全相同的,故邻位二元取代物也应当只有一 种。 应当注意且要牢记,苯环中并没有一般的C-C单键和C=C双键。
( 2 )体系能量降低,氢化热(208.5 kJ·mol-1)比环己烯氢 化热的三倍低得多( 3×119.3-208.5 = 149.4 kj·mol-1 ),这 149.4 kj·mol-1即为苯的共轭能。
苯现在的表达方式
价键式
分子轨道离域式
共振式
自旋偶合价键理论 (1986年Copper等提出)
+ Cl2 + Br2
Fe 或 FeCl3 55~60℃
Fe 或 FeBr3 55~60℃
+ 2Cl2 Fe 或 FeCl3
反应历程:
Cl
+ HCl
Br
+ HBr
Cl
+
大学有机化学第六章

第六章单环芳烃•要求深刻理解和熟练掌握的内容:苯的结构;单环芳烃的化学性质,苯环上的亲电取代反应机理及定位规律的理论解释。
•要求一般理解和掌握的内容:单环芳烃的来源和制法•难点:•苯环上亲电取代反应定位规律的理论解释第六章单环芳烃•大多数芳烃含有苯的六碳环结构,少数非苯芳烃的结构和性质与苯环相似,也称芳烃.•芳烃的性质特点:(1)不易发生加成反应,(2)不易氧化,(3)而容易起取代反应.(1)单环芳烃•芳烃可分为以下三类:(2)多环芳烃(3)非苯芳烃苯的分子式: (C6H6)一苯环的结构1. 凯库勒结构式性质特点:苯不易发生加成,不易氧化,但容易发生取代反应。
苯的凯库勒式结构+H 2∆H=-120kJ/mol+3H 2∆H=-208kJ/mol (2)苯的氢化(3)1,3-环己二烯脱氢-H 2∆H=-23kJ/mol苯的稳定性证明(1) 环己烯催化加氢:四、单环芳烃的物理性质芳香烃不溶于水,但溶于有机溶剂。
一般芳香烃均比水轻。
沸点随相对分子质量升高而升高。
熔点除与相对分子质量有关外,还与结构有关,通常对位异构体由于分子对称,熔点较高。
苯亲电取代反应的能量示意图反应进程势能+E +EE H+六、苯环上亲电取代反应的定位效应1. 定位规律A.烷基苯的取代反应CH3CH3NO2NO2CH3混酸℃3057%40%甲苯的硝化比苯容易,新引入的取代基主要进入原取代基的邻对位。
实验现象:B.硝基苯的取代反应发烟HNO3+H2SO4NO2NO2NO295℃93.2%硝基苯的硝化比苯困难,新引入的取代基主要进入原取代基的间位。
高中化学课件苯完整课件

洗涤剂 塑料 溶剂 增塑剂 锦纶,纺织材料 消毒剂 合成洗涤剂 染料
一、苯的用途
基础有机化工原料: 合成纤维、合成橡胶、塑料、农药、医药、染料、香料等。苯也常用于有机溶剂
服装 制鞋
纤维
现象:溴水和酸性KMnO4溶液都不褪色。 1)平面正六边形结构。 勤奋钻研的品质和执著追求的科学态度。 不被 酸性KMnO4溶液 氧化 但总的来说易取代,难加成,能氧化. 硝基:-NO2(注意与NO2、NO2- 区别) 硝基:-NO2(注意与NO2、NO2- 区别) 纯净的硝基苯是无色而有苦杏仁气味的油状液体,不溶于水,密度比水大。 C.苯 D.乙烯 阅读课本P71 多么奇怪的梦啊,总共只有一瞬间的梦,但是在他眼前的原子和分子却没有消失,他记住了在梦中看见的分子中原子的排列顺序,也许这就是答案吧?他匆匆地在纸上写下了他所能够回想的一切,后来凯库勒提出了两点假设。 “化学建筑师”凯库勒的主要贡献: 〔1〕苯分子是平面六边形的稳定构造; 很强的审美能力和丰富的审美经验。 B、能发生加成反应,但困难 (1) 6个碳原子构成平面六边形环; 教学难点:苯的分子构造 溴化氢易溶于水,防止倒吸。 〔2〕苯分子中的碳碳键是一种介于单键和双键之间的化学键 掌握苯的典型化学性质。
凯库勒的发现与他本人具备以下素质有关: 1.广博而精深的化学知识。 2.建筑学造诣和对空间结构的丰富想象力。 3.很强的审美能力和丰富的审美经验。 4.勤奋钻研的品质和执著追求的科学态度。
科学史话—苯的构造?
阅读课本P71
分子式为C6H6--苯分子的碳的含量如此之高,究竟具有什么结构呢?
讨论: 1、从苯的元素组成看,苯属于哪类有机物? 2、据分子式,推出苯所代表的一类物质的通式。 3、按常理苯应为饱和烃还是不饱和烃?
有机化学 第六章 芳香烃

(一) 芳烃的构造异构和命名 (二) 苯的结构 (三) 单环芳烃的来源 (四) 单环芳烃的物理性质 (五) 单环芳烃的化学性质 (六) 苯环上取代反应的定位规则 (七) 稠环芳烃 (八) 芳香性 (九) 富勒烯
第六章 芳烃 芳香性
• 芳烃——芳香族碳氢化合物。含有苯环的一 大类C、H化合物。 “芳香”二字的含义:
1,2,4,5-四甲苯
(2) 命名
命名时,一般以芳环为取代基,也可以芳环为母体。具
体情况,具体对待:
CH=CH2
CH=CH2
苯乙烯
对二乙烯基苯 CH=CH2
CH2Cl
CH2OH
苯氯甲烷 氯苄
苯甲醇 苄醇
• C6H5- 苯基(Ph-) ;
C6H5CH2- 苄基 ;
Ar- 芳基(芳环上去掉一个氢后,所剩下的原子团);
O
慢
H
SO3-
快 HSO4-
+
σ-络合物
SO3- 快
H3O+
SO3H + H2O
(丁) 烷基化反应机理
苯环烷基化反应中,AlCl3的作用是与卤烷起反应, 加速R+的生成:
RCl + AlCl3
R+ + AlCl4-
亲电试剂
+ R+
R
+H
σ-络合物
AlCl4-
R + HCl + AlCl3
苯环烷基化反应时,产生异构化的原因:
Br
p-二溴苯
注意:第二个卤素原子进入第一个卤素原子的邻、对位。
(乙) 硝化
+ HNO3
浓H2SO。4
50-60 C
第六章芳香烃(2)

亲核性
+
+E
亲电试剂
-
Y
靠近
+ -
E
Y
H
吸取质子
π络合物
E
慢
σ络合物
非芳香正碳离子中间体
+ Y-
E
+ HY
H+离去形成取代产物,这时中心碳由 sp3 又转为 sp2恢复芳香结构。
21
22
23
24
第六章 芳香烃 第一节 苯及其同系物(三、性质)
1.卤代反应
苯在三卤化铁或铁粉等催化剂作用下, 与氯和 溴作用, 分别生成氯苯和溴苯以及卤化氢。
上页 下页 首页 18
三、苯及其同系物的性质
苯及其同系物均不溶于水,易溶于乙醚、四氯 化碳或石油醚等有机溶 剂。 相对密度几乎都小于1。 苯及其同系物一般都有毒性,长期吸入它们的 蒸气,会损害造血器官及神经系统,因此在操作 时需注意采取防护措施。
上页 下页 首页 19
四.单环芳烃的化学性质
上页 下页 首页 16
若苯环上连接不同的烷基时,烷基名称的排列顺序 按“优先基团”后列出的原则,其位置的编号应将 简单的烷基所连的碳原子定为 1号位,并以位号总 和最小为原则来命名。
5
CH3CH2CH2
CH2CH3
1
2 CH(CH3)2
3
1-乙基-5-丙基-2-异丙基苯
(1-ethyl-2-isopropyl-5-propylbenzene)
CH3
+
HE CH3
+
H
E
CH3
能形成最稳定 的正碳离子
+
HE CH3
+ 上页
第六章苯与芳香烃6-1.用次氯酸叔丁脂(t-BuOCl)对甲苯进行一元氯化
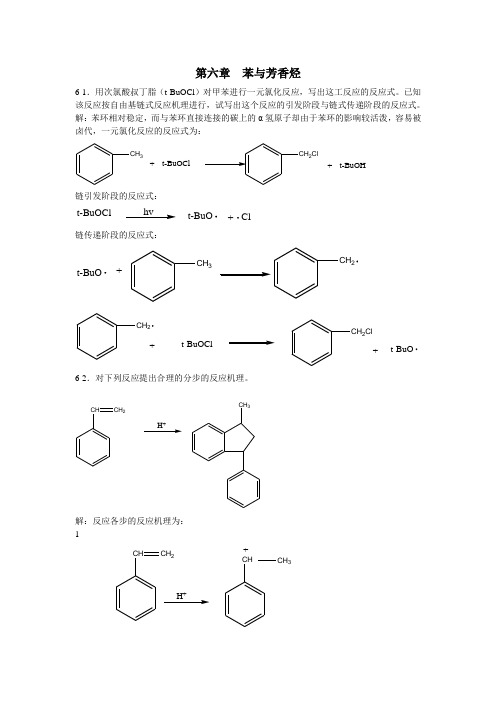
第六章 苯与芳香烃6-1.用次氯酸叔丁脂(t-BuOCl )对甲苯进行一元氯化反应,写出这工反应的反应式。
已知该反应按自由基链式反应机理进行,试写出这个反应的引发阶段与链式传递阶段的反应式。
解:苯环相对稳定,而与苯环直接连接的碳上的α氢原子却由于苯环的影响较活泼,容易被卤代,一元氯化反应的反应式为:CH 3+t-BuOCl2Cl+t-BuOH链引发阶段的反应式:t-BuOClhv+Cl t-BuO链传递阶段的反应式:+CH 3CH 2t-BuOt-BuOCl+CH 2ClCH 2+t-BuO6-2.对下列反应提出合理的分步的反应机理。
H +CH 3CHCH 2解:反应各步的反应机理为: 1CHCH 2H +CHCH 3+2CH3 4CHCH2 CH3CH HCH3 -H+6-3.写出下列反应的机理。
OR ROH R RH3O解:此反应机理如下:OR R H+OH+RROHRR+碳正离子重排OHRR6-4.写出下列反应的机理。
C CH3CH2H3CCH3H3C解,此反应机理如下:1.C CH3CH2H+CCH3CH3+2.32CCH33.H 3CCH 3HCH34.H 3CCH 3H 3C-H +6-5.写出下列反应的机理。
COOHCOOHNO 2HNO 3H 2SO 4,∆解,反应机理如下: 1.HONO 2∆+OH 2NO 2H 2O +22.NO 2+2COOHCOOH3.COOHNO 2COOHNO 2-H +6-6.写出下列反应机理。
CH 3AlCl 3HClCH 3CH 32+解:反应机理为: 1.CH 3H +CH 3H+CH 32.CH 3CH 3CH 3H +CH 3H+CH 3CH 36-7.亚硝基苯在发生亲电取代反应时,亚硝基是第一类定位基或是第二类定位基,他在致活或致钝苯环,简要解释之。
解:亚硝基苯在发生亲电取代反应时,亚硝基是第一类定位基,能使苯环活化,亲电基团主要进攻邻对位。
第六章 芳香烃

4. 定位效应及其应用 邻对位定位基;间位定位基
(只能做取代基)
三、苯及其同系物的性质
物理性质
不溶于水,易溶于乙醚、 四氯化碳或石油醚;相对 密度几乎都小于1
化学性质
芳香性——易取代、难 加成、难氧化、环有特 殊稳定性。
注意
苯及其同系物一般都有毒性,注意防护!
(一) 苯的亲电取代反应(electrophilic substitution)
恢复sp2 质子离去 提供 环具有 电子对 特殊稳定性 吸引 亲电试剂 过渡态
H
+
H
H H H
H
H
H H H H
H
H
2-
H H H
H
环丙烯 正离子
H
H
环戊二烯 负离子
H
H H H
环辛四烯 二负离子
环庚三烯 正离子
H
H
C C H
C
H C C H
H
H
C
C
H
H
H
本 章 要 点
1. 苯的结构 2. 命名 sp2 杂化碳 , 平面型分子, 环闭大π键
以苯作母体;以侧链作母体
3. 性质 ——芳香性:环稳定,易取代,难加成,难氧化 亲电取代:卤代、硝化、磺化 游离基取代:侧链αH的卤代 氧化:具有 α-H 的侧链可氧化为-COOH
CH3
+ +
NO 2
+
-
邻对位定位基的特点
• ①与苯直接相连的原子不含有双键和叁键、
除烃基外都带有未共用电子对。
• ②邻、对位取代基除苯环外都能使苯环活化
(卤素除外)使取代反应易进行。 常见的邻、对位定位基 :
第六章芳烃

第六章芳烃第一节苯的结构一、凯库勒构造式1865年凯库勒(Kekule)首先提出了苯的环状结构,即六个碳原子在同一平面上彼此连结成环,每个碳原子上都结合着一个氢原子。
为了满足碳的四价,凯库勒提出如下的构造式:二、闭合共轭体系近代物理方法测定,苯分子中的六个碳原子都是sp2杂化的,每个碳原子各以两个sp2杂化轨道分别与另外两个碳原子形成C-Cσ键,这样六个碳原子构成了一个平面正六边形。
使苯分子中的所有原子都在一个平面上,键角都是120°。
见图3-1(a)。
每个碳原子还有一个未参与杂化的p轨道,它的对称轴垂直于此平面,与相邻的两个碳原子上的p轨道分别从侧面平行重叠,形成一个闭合的共轭体系。
见图6-1(b)。
图6-1(a) 苯的骨架图6-1(b) 苯的环状共轭体系图6-1(c) 苯的π电子云至今还没有更好的结构式表示苯的这种结构特点,出于习惯和解释问题的方便,仍用凯库勒式表示。
目前,为了描述苯分子中完全平均化的大π键,也用下式表示苯的结构。
第二节单环芳烃的构造异构和命名根据分子中所含苯环的数目和连接方式,芳香烃可分为如下几类:单环芳烃例如:(苯)芳香烃多环芳烃例如:(联苯)稠环芳烃例如:(萘)一、单环芳烃的构造异构1.苯环上的支链不同,产生的构造异构当苯环上连有不同的支链时,产生异构现象。
如:当苯环支链有三个以上碳原子时,可能出现碳链排列方式不同,产生异构现象。
如:正丙苯异丙苯2.支链在环上的位置不同,产生的位置异构当苯环上连有两个或两个以上支链时,可能出现支链在环上位置不同,产生异构现象。
如:邻二甲苯间二甲苯对二甲苯二、单环芳烃的命名1.苯的一元取代物只有一种时,以苯环为母体命名,烷基作取代基,称为“某烷基苯”,其中“基”字常省略。
若侧链为不饱和烃基(如烯基或炔基等),则以不饱和烃为母体命名,苯环作为取代基。
如:乙苯异丙苯苯乙烯苯乙炔2.当苯环上有两个或两个以上烷基时,可用阿拉伯数字标明烷基的位置。
有机化学第六章芳烃

第六章芳烃芳烃是芳香族碳氢化合物的简称。
一般情况下,把苯及其衍生物称为芳香族化合物。
其中分子中只含一个苯环的芳烃叫做单环芳烃。
芳香二字的来由最初是指从天然树脂(香精油)中提取而得、具有芳香气的物质。
现代芳烃的概念是指具有芳香性的一类环状化合物,它们不一定具有香味,也不一定含有苯环结构。
芳香烃具有其特征性质——芳香性(易取代,难加成,难氧化)。
第一节单环芳烃的结构、异构和命名一、单环芳烃的结构苯是单环芳烃中最简单最重要的化合物,也是所有芳香族化合物的母体。
1. 凯库勒构造式根据元素分析得知苯的分子式为C6H6。
仅从苯的分子式判断,苯应具有很高的不饱和度,显示不饱和烃的典型反应—加成、氧化、聚合,然而苯却是一个十分稳定的化合物。
通常情况下,苯很难发生加成反应,也难被氧化,在一定条件下,能发生取代反应,称为“芳香性”。
1865年凯库勒从苯的分子式出发,根据苯的一元取代物只有一种,说明六个氢原子是等同的事实,提出了苯的环状结构。
这个式子虽然可以说明苯分子的组成以及原子间连接的次序,但这个式子仍存在着缺点,它不能说明苯既然含有三个双键,为什么苯不起类似烯烃的加成反应?环己烯的氢化热为119.6kJ/mol,如果苯的构造式用凯库勒式表示的话,苯的氢化热为环己烯氢化热的三倍。
119.6×3=358.8KJ/mol 。
实际上苯的氢化热是208.4KJ/mol,比预计的数值低150.4KJ/mol。
2.闭合共轭体系根据现代物理方法(如X射线法,光谱法等)证明了苯分子是一个平面正六边形构型,键角都是120℃ ,碳碳键的键长都是0.1397nm。
按照轨道杂化理论,苯分子中六个碳原子都以sp2杂化轨道互相沿对称轴的方向重叠形成六个C-C σ键,组成一个正六边形。
每个碳原子各以一个sp2杂化轨道分别与氢原子1s轨道沿对称轴方向重叠形成六个C-H σ键。
由于是sp2杂化,所以键角都是120℃,所有碳原子和氢原子都在同一平面上。
第六章 单环芳烃

芳香族化合物最初是指从树脂或香精油等天然物质中提取得到的具有芳香气味的化合物,故称芳香族化合物。
后来发现此类化合物都含有苯环,自此以后,芳香族化合物即指含有苯环的化合物。
但实际上,含有苯环的化合物并不都具有芳香气味,具有芳香气味的化合物也不一定都含有苯环,所以“芳香族化合物”系指含有苯环的化合物并不太确切。
但由于历史原因,这一名称至今仍然沿用,不过它的含义已经不同了。
如今芳香族化合物的新含义,系指含有苯环结构及性质类似于苯(芳香性)的一类化合物。
芳香烃根据分子中所含苯环的数目和结合方式分为单环芳烃、稠环芳烃和多环芳烃。
单环芳烃:指分子中仅含一个苯环的芳烃,包括苯、苯的同系物和苯基取代的不饱和烃。
例如:苯 甲苯 乙苯 苯乙烯稠环芳烃:指分子中含两个或两个以上苯环,且苯环之间共用两个相邻的碳原子结合的芳烃。
例如:萘 蒽 菲多环芳烃:指分子中两个或两个以上苯环通过单键或碳链连接的芳烃。
例如:二联苯 1,4-联三苯 二苯甲烷本章重点讨论单环芳烃和稠环芳烃。
6.1 苯的结构苯的分子式为C 6H 6,碳氢数目比为1:1,应具有高度不饱和性。
事实则不然,在一般条件下,苯不能被高锰酸钾等氧化剂氧化,也不能与卤素、卤化氢等进行加成反应,但它却容易发生取代发应。
并且苯环具有较高的热稳定性,加热到900℃也不分解。
象苯环表现出的对热较稳定,在化学反应中不易发生加成、氧化反应,而易进行取代反应的特性,被称之为芳香性。
苯具有的特殊性质——芳香性,必然是由于它存在一个特殊的结构所决定的。
1865年,凯库勒(Kekule’)提出了苯的环状对称结构式:CH 3CH 2CH 3CH=CH 2CH 214简写式此式称为苯的凯库勒式,碳环是由三个C=C 和三个C —C 交替排列而成。
它可以说明苯分子的组成及原子相互连接次序,并表明碳原子是四价的,六个氢原子的位置等同,因而可以解释苯的一元取代产物只有一种的实验事实。
但是凯库勒式不能解释苯环在一般条件下不能发生类似烯烃的加成、氧化反应;也不能解释苯的邻位二元取代产物只有一种的实验事实。
ch6 芳香烃

现在一般用
表示苯,表示苯中6个碳-碳键并无区别,
但是在研究取代反应历程时, 不如经典式 方便,故两种表示方法都在使用。
芳烃
11
凯库勒结构的优越性
利用凯库勒结构,可以解释: ① 苯为什么经催化加氢后得到环己烷?
H2/Pt
② 苯的一元取代产物为什么只有一种?
X
原因是苯的一元取代的两种可能
X
的产物结构,其实是完全相同的
结构。
芳烃
12
凯库勒结构的不足
① 凯库勒结构式实际上是环己三烯
则其中的“C-C”单键和“C=C”双键键长应不同,实测结 果在苯中所有的“C-C”键长均为0.140nm、“C-H”键长也 均为0.110nm,并很难进行加成或氧化反应,这与环己 三烯的性质的差别较大。
芳烃
16
1、价键理论
每个碳原子上剩有一个未参 与杂化的p轨道,其对称轴垂
H
120°
H
直碳环所在平面,并彼此平
行,于两侧相互交盖重叠, H
形成一个闭合的π键,这样处
H
于该π键中的π电子能够高度
离域,π电子云完全平均化,
分子能量降低,分子更稳定。
H 0.110 nm
0.140 nm
H
芳烃
17
价键理论
②六个π电子均进入成键轨道,且能量低于3个孤立的π键 。
2β
反键轨道
1β
1β
原子轨道
1β
乙烯 2个π 电子,共下降2 β 平均每个 π 电子下降1β
有机化学第06章 芳烃(2)
特点:
①这些取代基与苯环直接相连的原子一般都是饱和的或带
有孤电子对或带负电荷(苯环、乙烯基除外);
②大都是给电子取代基,除卤素外,这类定位基均能使苯
环上电子云密度升高,使苯环活化。因此这些定位基又称
活化基;
③这些取代苯(除卤苯外)的亲电取代反应活性比苯高,
反应速度比苯快。
(2)间位定位基 (第二类定位基) X
2
I + 2Cu
+ 2CuI
二、性质
与苯性质相似,将其中的一个苯基看作是另一个苯基的取 代基。
CH3
混酸 Δ
NO2
混酸 Δ
NO2
CH3
NO2+
NO2
+
CH3
NO2 NO2
CH3
若其中一个苯环上含间位定位基时,则发生异环取代; 若是邻对位定位基,则发生同环取代。
6.9稠环芳烃
一、 萘及其衍生物
1、化学性质
Δ ,~90%
O
O 9,10-蒽醌 OO
K2Cr2O7+H2SO4 或CrO3 + HAC
9,10-菲 醌
二、定位规律的理论解释 1、电子效应 1)邻、对位定位基对苯环的影响
δ- H
δ-
2)从共振论观点
进攻邻位 :
CH3H +
E
CH
δ- H
CH 3 H +E
CH3
进攻对位 : +
HE
CH3 +
HE
X
+Y
Y
间位定位能力由强到弱的次序大致如下:
+
NR3
NO2 , CCl3 , CN , SO3H,
高等有机第六章

X + E X E
π络合物
X H E X + E H
σ络合物
X H E
π络合物
芳香亲电取代的一般机理
二、亲电体的活性(略) 三、定位效应和反应活性 1、邻对位定位基和间位定位基 邻对位定位基 -I及+C效应基团:-OR,-OH,-NR2 -F, Cl, -Br, I +I及+C效应基团:-O-I及-C效应基团:CH3 > CH3CH2 > (CH3)2CH2 > (CH3)3C 间位定位基 -I 效应基团:N+R3,P+R3,As+R3,N+H3 -I及-C效应基团:NO2,CN,SO3H,CHO,COR, COOH,CONH
(n10)
定义:分子式符合(CH)n的环多次甲基化合物称为轮烯。
命名:
轮烯是根据碳氢的数目来命名的。
(CH)10
H
H
十碳五烯, 10-轮烯 或 [10]轮烯
判别轮烯芳香性的原则
(1)轮烯是非扩张环,有环内氢与环外氢。环内氢无斥力 (2)环碳必须处在同一平面内。 (3)符合4n+2规则。
H H
HH HH
(2) 环辛四烯双负离子
能发生典型的烯烃 反应。离域能为零。 具有单、双键结构。 澡盆型。
4HCCH
Ni(CN)2 15-20 atm, 50oC (70%)
无芳香性
- 2Na 乙醚
=
有芳香性
C-C键键长平均 化,均为1.40A。 八个碳原子共平 面。
*Na给出二个电子。
3. 大环芳香结构(轮烯)
H H HH
HHH HH H
10-轮烯因环内 氢的相互作用, 使C不能同处 在同一平面内, 无芳香性。
苯环的定位规则.ppt

33%
5%
NO2
+ HNO3(发烟)
浓H2SO4 90℃
NO2
NO2 +
6%
NO2
+
NO2
1%
NO2 NO2
93%
第二个取代基进入的位置是受苯环上原有基团的影响,这种 现象称为定位效应。苯环上原有基团称为定位基。
一、定位效应
1、邻对位定位基
-NHCH3 >–NH2 >– OH >– OCH3 >–R >–X
2、间位定位基
–N+(CH3)3 >–NO2 >–SO3H >–CHO >–COOH
二、定位效应的解释
H
1、邻对位基的定位效应
--CH3使苯环电子云密度升高,而 活化苯环, 为邻、对位定位基。
HCH
δ
δ-
δ-
A
A 的定位能力次序大致为(从强到弱)
-O , -NR2, -NHR, -NH2, -OH, -OR, -NHCOR -OCOR, -R, -CH3 , -X
-CHO, -COR,-COOH, -CONH2。
三、定位效应的应用
1、预测反应产物
(1)两个定位基对于引入第三取代基的定位效应 一致:
三、定位效应的应用
1、预测反应产物
(2)两个定位基对于引入第三取代基的定位效应不一致
a.同类型—定位效应 强的取代基所决定
三、定位效应的应用
1、预测反应产物
(2)两个定位基对于引入第三取代基的定位效应不一致
给电子基团
二、定位效应的解释
2、间位定位基的定位效应
O
O
N
存在着:
吸电子诱导效应(-I) 吸电子共轭效应(-C)
第六章 苯环

芳香烃
第二章
(Aromatic Hydrocarbons)
芳香族化合物:一些具有特殊稳定性和化学性质的环 状化合物。
单环芳香烃
CH3
联苯与联多苯型
CH3
芳香族 多环芳香烃 化 合 物
多苯脂代烃
C
绸环芳烃
H
非 苯 芳 香 族 化 合 物
HO
O
N
N
(1) 单环芳烃——分子中只含有一个苯环
CH3
•正碳离
子证据
C H 3C H 2C H 2X C H 2C H 2C H 3 + A lC l 3 CH
CH3
CH3
A lC l 3 C H 3C H 2C H 2X C H 3C H C H 2 H
~ H C H 3C H C H 3
Note: Rearrangement may occur in alkylation
C H=C H2
苯
甲苯
苯乙烯
(2) 多环芳烃——分子中有两个或以上的苯环
联苯
萘(nai)
蒽(en)
非苯芳香性化合物-----不含苯环的芳香性化合物
HO O
H N N
杂环芳香性化合物
非苯芳香性化合物
离子型芳烃
满足Hü ckel规则 Hü ckel规则: 平面型环状分子
环状共轭体系
有4n+2个电子
E. Hü ckel, 1931
CH3 O 2N NO2
CH3
CH3 NO2
(TNT)
• 转变为苯胺衍生物
H N O 3 (浓 ) Ar H H 2 S O 4 (浓 ) Ar NO2 (还原) Fe or Sn / HCl
2, 4, 6-三硝基甲苯
第六章 芳香烃 芳核上的亲电取代反应
AlCl3
烷基化试剂:卤代烷、烯烃或醇
Lewis酸
Lewis酸AlCl3、ZnCl2、BCl3 和无机酸 HF、H3PO4 、H2SO4
亲电试剂的形成:
R-Cl + AlCl3 → R+ + AlCl4AlCl3
70~80℃
CH(CH3)2
CH2CH2CH3
+ CH3CH2CH2Cl
机理:
(2)苯环侧链的氧化
CH3 K M nO 4 C H ( C H 3) 2
条件:α-H
COOH
COOH
氧化的特点:无论侧链多长,均被氧化成羧 氧化的特点: 基,直接连在苯环上。
CH(CH3 )2
+
COOH [O] COOH
C 2 H5
C(CH3)3
[O]
C(CH3)3
4.加成反应 加氢
+
C2H5
COOH
H
C H
C
C H
C
H
轨道杂化理论认为: 苯中碳原子sp2杂化,处在同一平面内,苯环 上所有原子都在一个平面内;键角都是120°;每 个碳原子有一个未杂化的p轨道, 6个p轨道侧面重 叠形成闭合的共轭体系。
苯形成了一个电子云密度完全 平均化了的没有单、双键之分的 大π键。苯的结构式常表示为:
H C C H C H C
CH2 CH CH2 CH3CH2 CH CH CH2 CH3 CH3
3-苯基丙烯 3–甲基-4-苯基己烷
CH=CH2
C
CH
苯基:Ph-(Phenyl的缩写) 芳基:Ar-(Aryl的缩写)
苯乙烯
3 C2H5
苯乙炔
CH3 2 1 CH3
药物分析总结

各论总结第六章芳酸类非甾体抗炎药物1.结构特征:苯环、游离羧基2.代表药物:水杨酸游离羧基、阿司匹林酯键、游离羧基、双水杨酯酯键、游离羧基、二氟尼柳游离羧基、甲芬那酸游离羧基、双氯芬酸钠酯键、布洛芬游离羧基、酮洛芬二苯甲酮、游离羧基、萘普生酯键、吲哚美辛游离羧基、吡罗昔康S、酰胺键、美洛昔康S、酰胺键、尼美舒利、对乙酰氨基酚酰胺键3.鉴别实验:(1)三氯化铁反应:①.水杨酸反应:水杨酸加三氯化铁试液,生成紫堇色配位化合物阿司匹林水解、双水杨酯水解、二氟尼柳②.酚羟基反应:对乙酰氨基酚的水溶液加三氯化铁试液,显蓝紫色吡罗昔康、美洛昔康:烯醇式羟基(2)缩合反应酮洛芬酮洛芬二苯甲酮:乙醇溶解,酸性条件下硫酸,与二硝基苯肼缩合加热至沸生成橙色的偶氮化合物(3)重氮化偶合反应对乙酰氨基酚:潜在的芳伯氨基对乙酰氨基酚:稀盐酸加热条件下,与亚硝酸钠试液,再加入碱性β萘酚生成红色偶氮化合物(4)水解反应阿司匹林阿司匹林与碳酸钠加热水解,加入过量稀硫酸酸化,生成白色沉淀,并产生醋酸臭气5荧光反应甲芬那酸溶于硫酸后,与重铬酸钾反应显深蓝色,随即变为棕绿色4.阿司匹林及双水杨酯中游离水杨酸与有关物质的检查1阿司匹林中的有关物质:合成起始原料苯酚及合成中间体与副产物,如游离水杨酸、醋酸苯酯、水杨酸本酯、水杨酰水杨酸、水杨酸酐、乙酰水杨酸本酯、乙酰水杨酸酐游离水杨酸:阿司匹林为乙酰水杨酸,在生产过程中因乙酰化不完全,或在精制过程中及贮藏期间的水解而产生水杨酸;游离水杨酸对人体有毒性,因其分子中所含的酚羟基在空气中易被逐渐氧化生成一系列有色如淡黄、红棕甚至深棕色醌型化合物而使阿司匹林成品变色,因而需加以控制①阿司匹林中游离水杨酸的检查HPLC检测方法:稀硫酸铁铵溶液显色反应注:药典采用1%冰醋酸溶液制备供试品溶液,以防阿司匹林水解,同时采用HPLC检查,C18作填充柱②双水杨酯中游离水杨酸的检查紫外检测方法:铁盐比色法水杨酸可与三价铁生成有色配位化合物注:为避免双水杨酯的水解,以三氯甲烷为溶剂,采用水相萃取比色法(2)对乙酰氨基酚中对氨基酚和对氯苯乙酰胺的检查①对氨基酚及有关物质对氨基酚同时含有酚羟基和氨基,具有酸碱两性,在反相色谱条件下易出现峰拖尾和峰分裂的现象,可使用离子对色谱法消除这一现象检测方法:以四丁基氢氧化铵为离子对试剂,采用离子对反相HPLC法检查5.含量测定1原料药的测定:阿司匹林:酚酞作指示剂①直接滴定法:药物溶于中性乙醇,以酚酞为指示剂,用NaOH滴定液直接滴定专属性较差,易受阿司匹林的水解及其产物、有机酸类稳定剂的干扰,不适于阿司匹林制剂;原料药测定时,也需要注意规范操作,避免水解引起的偏差②剩余量滴定法:用定量过量的NaOH滴定液溶解后,用盐酸滴定液回滴定剩余的NaOH滴定液③水解后剩余量滴定法:加入定量过量的NaOH,加热使酯键水解后,再用硫酸回滴剩余的NaOH滴定液可显着提高准确度和精密度阿司匹林原料药优点:准确、避免了酯键水解的干扰缺点:但无法消除药物里本身酸性物质的干扰④两步滴定法:第一步中和酸性水解产物及稳定剂,以消除干扰;第二步为水解后剩余量滴定阿司匹林制剂(3)制剂当附加成分显着影响主成分测定时,可采用:两步滴定法、柱分配色谱-紫外分光光度法、高效液相色谱法高效液相色谱法:用离子抑制-反相高效液相色谱法测定,用外标法计算含量注:供试品溶液制备里冰醋酸的作用:①抑制阿司匹林的解离,进而消除因色谱柱对阿司匹林的吸附而造成的色谱峰拖尾与分裂的现象②抑制阿司匹林的水解,增加溶液的稳定性第七章苯乙胺类拟肾上腺素药物1.结构特征:苯乙胺、邻二酚羟基1酚羟基①两个酚羟基:肾上腺素、盐酸异丙肾上腺素、重酒石酸去甲肾上腺素、硫酸特布他林、盐酸多巴胺②一个酚羟基:盐酸去氧肾上腺素、硫酸沙丁胺醇、重酒石酸间羟胺③没有酚羟基:盐酸甲氧明、盐酸氯丙那林、盐酸克伦特罗、盐酸麻黄碱、盐酸伪麻黄碱、盐酸氨溴索(2)脂肪伯胺可发生Rimini反应重酒石酸去甲肾上腺素、盐酸多巴胺、重酒石酸间羟胺、盐酸甲氧明、2.理化性质:酚羟基特性、弱碱性、旋光性、紫外吸收特性3.鉴别实验(1)与三氯化铁的反应盐酸去氧肾上腺素、肾上腺素、盐酸多巴胺:酚羟基与三氯化铁显绿色、碱性条件下为紫红色(2)与甲醛硫酸的反应:肾上腺素显红色、盐酸异丙肾上腺素显棕色至暗紫色、重酒石酸去甲肾上腺素显淡红色(3)氨基醇的双缩脲反应盐酸麻黄碱、盐酸伪麻黄碱、盐酸去氧肾上腺素芳环侧脸具有氨基醇结构盐酸麻黄碱无酚羟基,极性小:加水溶解后,加硫酸铜与20%NaOH溶液即显蓝紫色;加乙醚,振摇后放置,乙醚层显紫红色络合物,水层变成蓝色Cu2+盐酸去氧肾上腺素有酚羟基,极性大:加水溶解后,加硫酸铜与29%NaOH溶液即显蓝紫色;加乙醚,振摇后放置,乙醚层不显色络合产物在水层,不在乙醚层;可与盐酸麻黄碱区别(4)脂肪伯胺的Rimini反应重酒石酸间羟胺:取本品5mg,溶解,加亚硝基铁氰化钠试液2滴、丙酮2滴与碳酸氢钠,在60℃水浴中加热1min,即显红紫色;4.特殊杂质与检查(1)酮体:紫外分光光度法(2)光学纯度的检查:色谱法、电泳法(3)有关物质除盐酸克伦特罗外:去氧肾上腺素TLC、其他高效液相色谱法5.含量测定(1)非水溶液滴定法由于本类药物为弱碱性,在水溶液中用酸滴定液直接滴定没有明显的突跃,终点难以观测,常不能获得满意的测定结果;而在非水酸性溶剂中,只要其在水溶液中的pKb值小于10,都能被冰醋酸均化到溶剂醋酸根水平,相对碱强度显着增强,因而使弱碱性药物的滴定能够顺利进行①对象:有机碱及其氢卤酸盐、磷酸盐、硫酸盐及金属盐类药物②非水溶剂种类:酸性溶剂:冰醋酸碱性溶剂:二甲基甲酰胺两性溶剂:甲醇惰性溶剂:甲苯、三氯甲烷③pKb为8~10:冰醋酸pKb为10~12:冰醋酸与醋酐pKb>12:醋酐④基本原理:强酸置换出与弱碱结合的弱酸BH+A-+HClO4→BH+ClO4-+HA;⑤酸根的影响:HA在醋酸介质中的酸性:高氯酸>氢溴酸>硫酸>盐酸>硝酸>磷酸如测定有机碱性药物氢卤酸盐时,由于被置换出的氢卤酸盐的酸性相当强,影响滴定终点,不能直接滴定,需进行处理;一般处理方法是加入定量的醋酸汞冰醋酸溶液,使其生成在醋酸中难解离的卤化汞,以消除氢卤酸对滴定的干扰与不良影响⑥终点指示:常用电位法和指示剂法;指示剂为结晶紫,酸式色为黄色,碱式色为紫色(2)溴量法一个酚羟基:盐酸去氧肾上腺素:淀粉作指示剂、重酒石酸间羟胺在酸性溶液中酚羟基的邻对位活泼氢能与过量的溴定量地发生溴代反应,再以碘量法硫代硫酸钠滴定测定剩余的溴(3)亚硝酸钠法重酒石酸去甲肾上腺素、盐酸多巴胺、重酒石酸间羟胺、盐酸甲氧明盐酸克伦特罗分子结构中含有芳伯氨基,在酸性溶液中可与亚硝酸钠定量发生重氮化反应,生成重氮盐,可用永停滴定法指示终点4.紫外分光光度法及比色法盐酸克伦特罗栓芳伯氨基和盐酸异丙肾上腺素气雾剂酚羟基盐酸克伦特罗:处理后加亚硝酸钠,摇匀、加氨基磺酸钠、摇匀、加盐酸奈乙胺、摇匀注:奈乙胺遇亚硝酸钠也能显色,干扰比色测定,所以在重氮化后,应加氨基磺酸铵将剩余的亚硝酸分解除去第八章对氨基苯甲酸酯和酰苯胺类局麻药物1.结构:亲脂性芳香环、中间连接功能基酯键——对氨基苯甲酸酯类、酰胺键——酰苯胺类、亲水性胺基2.鉴别反应(1)重氮化偶合反应芳伯氨基:苯佐卡因、盐酸普鲁卡因、盐酸氯普卡因、盐酸普鲁卡因胺芳伯氨基在酸性溶液中与亚硝酸钠反应,加入碱性β-萘酚溶液显猩红色沉淀芳仲胺在酸性溶液中与亚硝酸钠反应,生成乳白色沉淀(2)与金属离子的反应①鉴别盐酸利多卡因:在碳酸钠试液中与硫酸铜反应生成蓝紫色配位化合物,再转入三氯甲烷中显黄色②鉴别盐酸普鲁卡因胺:被浓过氧化氢氧化成羟肟酸,再与三氯化铁反应显紫红色,随即变为棕黑色;羟肟酸铁的反应③.盐酸利多卡因在酸性条件下可与氯化钴试液反应生成亮绿色(3)水解产物反应①鉴别盐酸普鲁卡因:加NaOH变为白色沉淀,加热变为油状物,继续加热,生成的气体使湿润的红色石蕊试纸变蓝,加热至油状物消失,加盐酸即析出白色沉淀②鉴别苯佐卡因:加NaOH加热煮沸,再加入碘加热,生成黄色沉淀,并产生碘仿的臭气水解后,与碘生成黄色沉淀3.特殊杂质与检查(1)对氨基苯甲酸类杂质的检查水解生成对氨基苯甲酸类,对氨基苯甲酸随储藏时间的延长或受热,可进一步脱羧转化成苯胺,而苯胺又可被氧化为有色物,使注射液变黄、疗效下降、毒性增加2酰苯胺类局麻药中2,6二甲基苯胺及其他杂质的检查3盐酸罗哌卡因的光学纯度检查毛细管电泳法4. 含量测定1亚硝酸钠滴定法:苯佐卡因、盐酸普鲁卡因中性红做指示剂:内指示剂法、注射用盐酸普鲁卡因、盐酸普鲁卡因胺及其制剂、醋氨苯砜①原理:芳伯氨基或水解后生成芳伯氨基的药物在酸性溶液中与亚硝酸钠定量发生重氮化反应,可用永停滴定法指示终点②测定的主要条件A.加入适量溴化钾加快反应速度:在不同无机酸中,重氮化反应速度不同,即氢溴酸>盐酸>硝酸、硫酸,由于氢溴酸昂贵,多用盐酸;但为了加快反应速度,往往加入适量的溴化钾,使体系中的溴化钾和盐酸起到氢溴酸的加速作用B.加过量盐酸加速反应:过量盐酸有利于:1重氮化反应速度加快;2重氮盐在酸性溶液中稳定;3防止生产偶氮氨基化合物而影响测定结果芳胺类药物与酸的摩尔比为:1:~6C.反应温度:重氮化反应的速度与温度成正比,但是生成的重氮盐又随温度升高而加速分解,可在室温10~30℃,其中15℃以下结果较准确D.滴定速度滴定时宜将滴定管尖端插入液面以下2/3处,一次将大部分亚硝酸钠滴定液在搅拌条件下迅速加入,然后将滴定管尖端提出液面,用少量水淋洗尖端,再缓缓滴定E.指示终点的方法:电位法、永停滴定法、外指示剂法准确度差、内指示剂法终点提前,测定结果偏低(2)非水溶液滴定法盐酸布比卡因弱碱性氮原子将供试品溶于冰醋酸-醋酐溶液中,用高氯酸滴定至终点;以电位法指示滴定终点注:加入醋酐的目的是:增强布比卡因的碱性,使滴定突跃明显第九章二氢吡啶类钙通道阻滞药物1.结构与性质(1)结构:苯基、1,4-二氢吡啶母核(2)典型药物:硝苯地平、尼莫地平、非洛地平、尼索地平(3)理化性质①.二氢吡啶的还原性:铈量法②.硝基的氧化性亚铁盐反应、重氮化-偶合反应③.二氢吡啶环氨基质子解离性:丙酮溶液与氢氧化钠反应显橙红色④.弱碱性:与氯化汞生成白色沉淀⑤.光不稳定性:避光操作⑥.旋光性:外消旋体⑦. UV2.化学鉴别(1)亚铁盐反应:苯环硝基具有氧化性,可与氢氧化亚铁发生反应,生成红棕色沉淀(2)重氮化-偶合反应:硝基具有氧化性,在酸性条件下被锌粉还原为芳伯氨基,可用重氮化-偶合反应鉴别硝苯地平3.有关物质与检查:避光操作、名字①硝苯地平中有关物质的检查杂质I:2,6-二甲基-42-硝基苯基-3,5-吡啶二甲酸二甲酯杂质II:2,6-二甲基-42-亚硝基苯基-3,5-吡啶二甲酸二甲酯②苯磺酸氨氯地平杂质I:2-2-氨基乙氧基甲基-42-氯苯基6-甲基-吡啶-3-羧酸乙酯-5-羧酸甲酯4.含量测定:硝苯地平:邻二氮菲做指示剂铈量法硝苯地平铈量法也称为硫酸铈法,是以CeSO42为标准溶液的氧化还原反应滴定法;由于酸度较低时Ce4+易水解,故本滴定在强酸条件下进行;Ce4+位黄色,Ce3+无色,自身可做指示剂,但不够灵敏,常用邻二氮菲做指示剂;铈量法优点:①. CeSO42标准溶液稳定②. Ce4+还原为Ce3+是单电子转移,不产生中间价态的产物,反应简单,副反应少③.大部分有机物不与CeSO42作用,不干扰测定;因此本法特别适合于糖浆剂第十章巴比妥及苯二氮卓类镇静催眠药物一、巴比妥类1.结构与性质(1)结构:环状丙二酰脲(2)代表药物:巴比妥barbital、苯巴比妥phenobarbital、苯基、司可巴比妥secobarbital、双键、戊巴比妥pentobbarbital、异戊巴比妥amobarbital、硫喷妥钠thiopental sodium,C2上S取代(3)理化性质:①.弱酸性:酮式烯醇式互变:二元酸②.水解反应:与碱液共沸水解,释放出氨气③.与金属离子的反应:A.与银盐的反应:在碳酸钠溶液中生成钠盐而溶解,再与硝酸银反应,先生成一银盐,硝酸银过量时再生成二银盐一银盐溶解二银盐不溶B.铜盐:在吡啶溶液中生成烯醇式异构体,再与铜-吡啶试液反应,生成紫色配位化合物鉴别含S巴比妥类药物,呈绿色C.钴盐:碱性溶液中与钴盐反应,生成紫堇色配合物D.汞盐:与硝酸汞或氯化汞反应,生成白色沉淀,沉淀在氨试液中溶解④.与香草醛反应:在浓硫酸存在下,与香草醛发生缩合反应,生成棕红色产物⑤. UV:原性药物在酸性溶液中无UV吸收5,5-二取代,1,5,5-三取代碱性溶液中电离:A.5,5-二取代巴比妥类药物pH10:一级电离:240nmpH13:二级电离:255nmB.1,5,5-三取代巴比妥类药物:只发生一级电离:240nm⑥显微结晶:巴比妥为长方形结晶;苯巴比妥开始结晶是球形,后成花瓣状(4)鉴别实验1丙二酰脲反应①.银盐反应:与碳酸钠、硝酸银反应,生成白色沉淀,沉淀振摇即溶解,硝酸银过量时不溶解②.铜盐反应:在吡啶溶液中溶解后,与铜吡啶试液反应,显紫色2)特征基团反应①.硫元素:在NaOH溶液中与铅离子反应,生成白色沉淀②.不饱和取代基:分子结构中含有丙烯基,可与I2、Br2、KMnO4发生加成反应,使其褪色可作为司可巴比妥的专属性鉴别(5)特殊杂质的检查项目:酸度甲基橙指示剂、乙醇溶液的澄清度、中性或碱性物质提取重量法、有关物质6含量测定①.银量法:在滴定过程中,巴比妥类药物首先形成可溶性的一银盐,当被测供试品完全形成一银盐后,继续用硝酸银滴定液滴定,稍过量的银离子就与巴比妥类药物形成难溶性的二银盐沉淀,使溶液变浑浊,以此指示终点ChP采用甲醇和无水碳酸钠溶剂系统,以银-玻璃电极电位法指示终点③.溴量法:司可巴比妥中的不饱和建可与溴定量发生加成反应二、苯二氮卓类:硫酸荧光反应1.结构:苯环、七元含氮杂环1位N上无取代基的有:奥沙西泮、劳拉西泮、氯硝西泮,可发生醇式-烯醇式互变,具有酸碱两性2.性质:弱碱性N、水解性在强酸溶液中生成二苯甲酮衍生物、UV3.鉴别实验(1)化学鉴别法①沉淀反应:遇碘化铋钾生成橙红色沉淀②硫酸荧光反应(2)芳伯胺反应:1位N上无取代者,与盐酸共热水解后,生成芳伯胺,可发生重氮化-偶合反应如奥沙西泮的盐酸溶液,缓慢加热煮沸,放冷,依次加入亚硝酸钠和碱性β-萘酚试液,生成橙红色沉淀;4.有关物质与检查氯氮卓:二苯甲酮5.含量测定(1)非水溶液滴定法原料药的测定①非水碱量法:本类药物多为碱性,高氯酸滴定液②非水酸量法:奥沙西泮及劳拉西泮,氢氧化四丁基铵滴定液,二甲基甲酰胺为溶剂第十一章吩噻嗪类抗精神病药1.结构:硫氮杂蒽母核,2、10位有取代基2.理化性质:①弱碱性N②易氧化性光照时易氧化变色,避光保存③与金属离子配合呈色硫与钯离子配合呈色,其氧化物亚砜和砜则无此反应④UV:205、254最强、300nm,双波长分光光度法3.鉴别实验(1)与生物碱沉淀剂反应:与三硝基苯酚反应生成沉淀(2)氧化显色反应硫氮杂蒽母核具有还原性(3)与钯离子配合呈色:硫氮杂蒽母核与钯离子配合呈色的反应可用于吩噻嗪类药物及其制剂鉴别;盐酸异丙嗪由于配合反应发生在硫氮杂蒽母核的硫元素与钯离子之间,该反应不受硫氮杂蒽母核氧化物亚砜和砜的干扰,专属性强如葵氟奋乃静与氯化钯反应生成红色沉淀题:有氧化产物存在时,吩噻嗪类药物的鉴别或含量测定方法为钯离子比色法吩噻嗪类药物与钯离子反应,需在pH2±酸性条件下进行(4)含卤素取代基的反应①.焰色反应:奋乃静氯:绿色②.显色反应:吩噻嗪类的2位有含氟取代基时,可经有机破坏使共价结合的氟元素分解成氟化物,在酸性条件下与茜素锆试液反应,溶液颜色改变;4.有关物质与检查名字:有个吩噻嗪5.含量测定(1)非水溶液滴定法:弱碱性,高氯酸为滴定液2提取后双波长分光光度法:消除辅料及氧化物的干扰3钯离子比色法盐酸异丙嗪:同上性质4HPLC:由于本类药物具有弱碱性及紫外吸收特性,主要采用反相色谱和离子对色谱进行分离、紫外检测器进行检测①反相高效液相色谱法:扫尾剂:含氮碱性竞争试剂:醋酸铵、三乙胺、二乙铵、乙腈②离子对高效液相色谱法极性较强的吩噻嗪类药物在反相色谱固定相中的保留较弱,有时调整流动相的pH抑制其解离也不能使这些药物的色谱行为得到改善;离子对高效液相色谱法RP-HPLC通常在反相色谱流动相的水中加入与待测组分离子电荷相反的离子对试剂,使之在洗脱中与待测组分离子形成离子对,以增强待测组分在非极性固定相中的保留离子对的非极性部分越大,离子对在非极性固定相中的保留越强,从而改善待测组分的色谱保留行为与分离行为弱碱性吩噻嗪类药物常用烷基磺酸盐阴离子对试剂,如戊烷磺酸钠、庚烷磺酸钠、十二烷磺酸钠等;为促进碱性药物质子化,一般使流动相呈酸性;盐酸氯丙嗪的含量测定方法:非水滴定法、紫外法、铈量法第十二章喹啉与青蒿素类抗疟药一、喹啉类药物荧光1.结构:喹啉环、奎宁环N碱性强,与硫酸成盐,2个N与一个硫酸成盐2.理化性质:(1)碱性(2)旋光性(3)荧光特性:蓝色荧光喹啉、甲芬那酸、苯并二氮卓类(4):UV3.鉴别实验(1)荧光:硫酸奎宁和二盐酸奎宁在稀硫酸溶液中显蓝色荧光(2)绿奎宁反应:水溶液中滴加溴试液与氨试液,即显翠绿色4.有关物质与检查(1)硫酸奎宁:酸度、三氯甲烷-乙醇中的不溶物、其他金鸡纳碱(2)磷酸咯萘啶:酸度、氯化物、水中不溶物、甲醛、四氢吡咯5.含量测定注意:原料药和片剂消耗高氯酸的摩尔比是不同的二、青蒿素类无特征UV吸收1. 结构:倍半萜内酯、过氧桥2. 理化性质:1氧化性:过氧桥2旋光性:右旋体3水解反应:内酯在碱性条件下水解4无特征UV吸收青蒿素、巴比妥原型药物2.鉴别实验(1)过氧桥的氧化反应碘化钾-淀粉实验:酸性条件下与碘化钾试液反应,淀粉指示液显蓝紫色(2)羟肟酸铁反应:在碱性条件下与羟胺生成羟肟酸,在稀酸中与高铁离子反应显紫红色盐酸普鲁卡因胺、青蒿素(3)香草醛-硫酸实验(4)IR无特征UV吸收3.第十三章莨菪烷类抗胆碱药1.结构:莨菪醇、苯乙酸2.性质:(1)水解性:酯键,阿托品可水解成莨菪醇和莨菪酸(2)碱性:N较强(3)旋光性:东莨菪碱有旋光性,阿托品为外消旋体无旋光性,可用于区分3.鉴别实验(1)托烷生物碱类的Vitali鉴别酯键水解后,经发烟硝酸加热,再与KOH醇溶液和固体KOH作用,显深紫色4.有关物质与检查(1)氢溴酸东莨菪碱:酸度、易氧化物阿扑东莨菪碱/脱水东莨菪碱,含有不饱和双键,紫外吸收、其他生物碱阿扑阿托品/脱水阿托品、颠茄碱,浑浊(2)硫酸阿托品:莨菪碱左旋体,利用旋光度检查5.含量测定酸性染料比色法:硫酸阿托品(1)原理:在适当pH水溶液中,碱性药物与H+结合成阳离子,而一些酸性染料可解离成阴离子;两种离子定量结合,生成具有吸收光谱明显红移的有色离子对,该离子对可以定量地被有机溶剂萃取,测定有机相中有色离子对特征波长处的吸光度,即可进行碱性药物的含量测定;(2)酸性染料:溴甲酚绿、溴麝香草酚蓝、溴甲酚紫、溴酚蓝(3)影响因素:①.水相最佳pH:选择一个最佳pH,使有机碱性药物和酸性染料分别全部以BH+和In-的状态存在,是酸性染料比色法至关重要的条件酸件染料比色法中,水相的pH值过小,则酸性染料以分子状态存在②.酸性染料及其浓度:A.选用的酸性染料与有机碱性药物定量地结合B.生成的离子对要在有机相中有较大的溶解度C.生成的离子对在最大吸收波长处有较高的吸光度D.染料在有机相中要不溶或很少溶E.浓度太高,会产生严重的乳化层③.有机溶剂的选择应选择对有机碱性染料与酸性染料形成的离子对萃取效率高、能与离子对形成氢键,不与或极少与水混溶的有机溶剂作为萃取溶剂,一般用三氯甲烷④.水分的影响:水相中有过量的酸性染料,水分的混入又可能会使有机相浑浊,从而影响比色测定的准确性,所以在萃取过程中应严防水分混入有机相;可加入脱水剂或干燥滤纸过滤⑤.酸性染料中的有色杂质:可在加入供试品之前将缓冲液与酸性染料的混合液先用所选用的有机溶剂萃取弃去,以便除去酸性染料中的有色杂质第十四章维生素类药物脂溶性维生素:ADEK;水溶性维生素:B、C、盐酸、叶酸一维生素A1. 结构:环己烯、共轭多烯醇侧链2. 来源:鱼肝油3. 维生素A1又称为视黄醇,鱼肝油中维生素A主要为醋酸酯和棕榈酸酯4. 鉴别三氯化锑反应:维生素A在无水三氯化锑的无醇三氯甲烷溶液中显蓝色,渐变为紫红色;注:反应必须在无水、无醇条件下进行6.含量测定:三点校正法(二)维生素B1氨基嘧啶环与噻唑环荧光反应维生素B1也称为盐酸硫胺thiamine hydrochloride1.鉴别实验:(1)硫色素荧光反应:维生素B1在碱性溶液中可被铁氰化钾氧化成硫色素,硫色素溶于正丁醇中显蓝色荧光维生素B1的专属性鉴别方法:加NaOH试液溶解后,加铁氰化钾试液与正丁醇,强力振摇,放置使分层,上面的醇层显强烈的蓝色荧光;加酸使成酸性,荧光即消失,再加碱使成碱性,荧光又显出2.含量测定:非水溶液滴定法原料药、紫外分光光度法维生素B1片剂和注射液的含量测定、硫色素荧光法VB1的专属性反应(三)维生素C水溶性抗氧化剂1.结构:烯二醇、内酯环2.理化性质:(1)溶解性:水溶性(2)酸性:一元酸(3)旋光性:2个手性碳,4个对映异构体(4)还原性:烯二醇基具有极强的还原性(5)水解性:Vc因双键使内酯环变得较稳定,和碳酸钠作用可生成单钠盐,不发生水解;但在强碱中,内酯环水解生成酮酸盐(6)糖类性质(7)UV3.鉴别(1)与硝酸银反应:烯二醇具有强还原性,可被硝酸银氧化,产生黑色金属银沉淀(2)与二氯靛酚钠反应:2,6-二氯靛酚钠在酸性介质中为玫瑰红色,碱性介质中为蓝色;与维生素C作用后生成还原型的无色的酚亚胺方法:取本品,加水溶解;加二氯靛酚钠,试液的颜色即消失。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
例: H 3 C
H 3C
2-氯甲苯
• 直接氯代
C l2, F e H 3C H 3C
Cl + H 3C Cl
• 用磺化法保护
H 2 S O 4 (浓 ) H 3C
(得混合物)
C l2 , F e H 3C S O 3H
D
Cl
保护对位
Cl H 2O , H + H 3C S O 3H H 3C
D
(得纯产物)
•烷基化反应中可发生重排
10
10
苯环烷基化其它方法
问题:正碳离子的产生途径还有那些?
•由烯烃
R C R C
R
H
+
R C
R C H R
与苯环 反应
R H+
R
•由醇
例
R
OH
R
OH2
R
+
H 2O
H 2C
CHCH3 / HF
CH3 CH CH3
C H 3C H 2O H / H 2S O 4 C H 2C H 3
• 所以, 凯库勒式并不能代表苯分子的真实结构.
苯分子结构的近代概念 (1) 分子轨道理论 •六个离域的电子总能量较 低.苯中所有碳碳键都相等. 键长也完全相等(0.139nm) 闭 合 共 轭 体 系
•六个碳均为 sp2杂化
H H
H H
H
苯的p轨 道交盖
H
大键
苯的离域 分子轨道
苯的结构
1. 苯环的性质分析
•与亲电试剂反应(主要性质) •不饱和,可加成 失去芳香性, 较难发生 •被氧化剂氧化
有电子,象烯烃
与亲电试剂反应分析
Nu E H E
-H
+
Nu H H E
加成
不利 (失去芳香性)
E
取代
有利 (恢复芳香性)
苯环上的亲电取代机理通式
E H
H E
H E
慢
E
势 能
H E
H E
硝化反应在合成上的重要性
• 制备硝基苯类化合物(炸药)
CH3 H N O 3 (浓 ) / H 2 S O 4 (浓 ) 5 5 oC NO2 NO2 + H N O 3 (发 烟 ) / H 2 S O 4 (浓 ) 11 0oC NO2 NO2 O 2N CH3 NO2 + CH3 H N O 3 (发 烟 ) / H 2 S O 4 (浓 ) 8 0oC
回移动,所以下列两种结构式迅速互变,不能分离.
H C H H C C C H C H H
H C H H C C C H C C H H
C
迅速互变
另外, 虽然含有三个双键,但苯不起类似烯烃的加成反应
•凯库勒式的缺陷
(1) 按凯库勒式:苯分子中有交替的碳碳单键和双键, 而 单键和双键的键长是不等的.苯应该是一个不规则的 六边形结构. (2) 实际上:苯分子中碳碳键的键长完全相等 ,均为 0.139nm.即比一般的碳碳单键短,比一般的碳碳双键 长一些.
(ii)
+
(C H 3 ) 2 C = C H 2
H2SO4,110 ℃ 加压
1, 2-二溴苯 邻二溴苯 o-二溴苯 (ortho) o-Br2C6H4
3-硝基苯甲酸 间硝基苯甲酸 m-硝基苯甲酸 (meta) m-NO2C6H4COOH
简写 p-ClC6H4CHO
• 多个基团时用数字表示相对位置
2 3 1
OH COOH
H 2N
2-羟基-4-氨基苯甲酸
4
连三甲苯
偏三甲苯
均三甲苯
H
C
H
X
H C C H H H H C C C H C X H
•一元取代物: 只有一种
H H C C
C
C C H
C
•苯的邻位二元取代物
Br C H H C C C H
• 上面两式是等同的
Br C
C Br H
H H
C C C H
C C
Br H
C
• 实际上是一种
• 凯库勒假定:苯的双键是不固定的,而是不停地来
第三节
苯及同系物的反应
芳香性:芳香族化合 物具有的特殊稳定性 及特殊的化学性质
一. 苯环的稳定性
苯的氢化热低(稳定)
DH(氢化热)
苯 (环己三烯)
150 kJ/mol (difference)
额外稳 定性: 共振能
-356 kJ/mol (expected) -230kJ/mol -118kJ/mol -206 kJ/mol (actual)
3. 苯环上的硝化反应
H 2 S O 4 (浓 ) + H N O 3 (浓 ) 55~60 C
o
无 H2SO4时反应很慢
NO2
机理
H H O NO2 O S O 3H H H O NO2 + HSO4
浓H2SO4作用: •产生NO2 •除去生成的水
H 2O + NO2
NO2
H NO2
- H+ NO2
• 下列化合物中哪些不能发生傅-克烷基化反应?
(1) C6H5CN (2) C6H5CH3 (3) C6H5CCl3
(4) C6H5CHO
(5) C6(1)、(3)、(4)、(6)均不能发生傅-克烷基化反应. (5)很容易发生傅克反应,但最好不用AlCl3做催化 剂(络合)。
第一节 苯环的结构 一. 凯库勒结构式 • 苯加氢生成环己烷,苯的 一元取代物只有一种 ,说 明苯环上的六个碳原子和六个氢原子的地位是等同 的. • 1865年凯库勒提出苯的结构是一个对称的六碳环,每 个碳原子上都连有一个氢原子.
H
H
C
C H H C C C
H
C
H
H
C C C
C
H H
满足碳四价
C H
例1 2 例2 3
+ C H Cl 3
+ Cl -C H 2 -C H 2 -C H 2 - Cl
AlCl3
C H 2 -C H 2 -C H 2
AlCl3
CH
例3
苯 + CCl4
AlCl3
?(考虑空间位阻)
• 完成下列反应式:
(i)
+
OH
HF,0℃
OH (C H 3 ) 3 C C(C H 3 ) 3
H 2 S O 4 (浓 ) H 3C H 3C S O 3H
(有机强酸,固体)
TsOH,对甲基苯磺酸
• 由磺酸转化为其它衍生物
Ar S O 3H P O C l3 Ar S O 2C l
ROH Ar S O 2O R
磺酸酯
RNH2 Ar S O 2N H R
磺酰胺
磺化反应可逆性在合成上的应用
Cl
s-络合物
- H+
快
+ E
E
E
反应进程
常见的几类苯环上的亲电取代反应
X2
X
Fe or FeX3 H N O 3 , 浓 H 2S O 4
卤代反应
(混酸)
浓 H 2S O 4 o r
NO2
硝化反应 磺化反应
+
发 烟 H 2S O 4 R X , A lC l 3
S O 3H
R
烷基化反应
Friedel-Crafts 反应 (傅-克反应)
CH3 O 2N NO2
CH3
CH3 NO2
(TNT)
• 转变为苯胺衍生物
H N O 3 (浓 ) Ar H H 2 S O 4 (浓 ) Ar NO2 (还原) Fe or Sn / HCl
2, 4, 6-三硝基甲苯
Ar
NH2
苯胺类化合物的 主要制备方法
4. 苯环上的磺化反应
1 o H 2 S O 4 (浓 ), 1 0 C 或 H 2 S O 4 (发 烟 ),4 0 C (含 1 0 % S O 3 )
H C H C C H
108pm
• 苯的结构表达方式
140pm
H
o C 120
120o
C
C H
H
或
• 平面型分子 • C-C完全相等
Br
H H
Br
Br
H H
Br
表达的是同一分子 (苯的1, 2-二溴代 产物只有一个)
H
H
第二节
芳香族化合物命名和物理性质
一. 一取代
(1). 以苯为母体
R CH3
Ph NO2
简写
Ph R Ph X
烷基苯
X
甲苯
Br
异丙苯
Cl NO2
卤代苯
溴苯
氯苯
硝基苯
(2)苯环为取代基
CH CH2 Ph CH CH2 C CH
Ph:苯基(phenyl)
苯乙烯
Ph
苯乙炔
CH2 NHCH3
Bz:苄基(benzyl) PhCH2—
2- 苯 基 庚 烷
甲基苄基胺
当取代基为-NH2,-OH, -SO3H,-COOH时,看作一类化合物
O R C X , A lC l 3
O C R
酰基化反应
2. 苯环上的卤代反应
Fe or FeX3
+
X2
X
( X = C l, B r)
机理
亲电中心
X2 + Fe FeX3
X2
+
FeX3
X
X
FeX3
X
X
FeX3
H X
- H+ X
