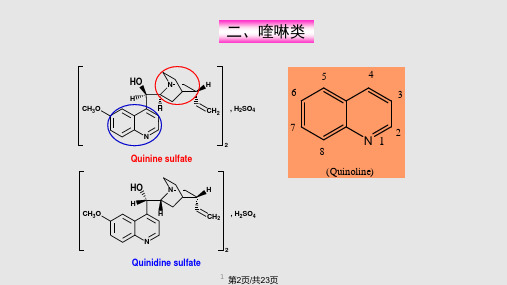
奎宁和辛可宁衍生物的合成及其在不对称双羟化反应中的催化作用
奎宁的合成与发展

1820年,法国化学家佩雷蒂尔和卡文顿从金鸡纳树皮中提取到了奎宁和 辛可宁生物碱,从此科学家们围绕着奎宁进行研究
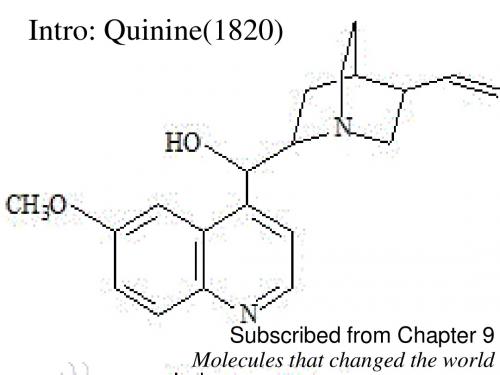
1907年,在经过大量的实验的基础上,德国化学家拉贝(Rabe)报 道了奎宁的结构,如图5 但是,奎宁的立体化学结构直到 20 世纪 40 年代才被真正确定图 2
图2
二,合成发展
1945年,美国化学家伍德沃德(Woodward)和多林(Doering)以7羟基异喹啉为原料经过还原,重氮化,缩合等十六个步骤合成奎宁, 该奎宁全合成路线成为现代有机合成化学的里程碑,该合成主要路线 如图
1991年,Wilson(威尔逊)也合成了产物,是经过十步用(Q)作原料来完成的
2001 年 , 美国哥伦比亚大学( Columbia University)Stork(斯托克) 教授领导的团队宣布完成了奎Байду номын сангаас的全合成 2004美国哈佛大学(Harvard University)的 Igarashi教授宣布利用不 对称催化反应完成了具有立体选择性即不对称合成奎宁的方法
在1970-1978年,Uskokovic(乌斯科科维奇)经过三步由(M)成目标产物,之 后又以 β-Collidine作反应物经过九步得到预期产物
Funk(芬克)于1984年由(O)开始同样经过八步反应完成了目标物的合成
在 1987年Brown(布朗)从 (N)出发经过八步达到目的
1990年时 Hannesian(亨利逊)与 Brown一样手性化合物为起始原料,经过 14步由(P)合成产物
[1]郭瑞霞,李力更,付炎,霍长虹,王磊,史清文. 天然药物化学史话:奎宁的发现、 化学结构以及全合成[J]. 中草药,2014,19:2737-2741. [2]杨素华. 奎宁简介及合成史[J]. 赤峰学院学报(自然科学版),2008,01:5051.
不对称双羟基化反应

催化导论——不对称双羟基化反应学号:10110310班级:1011031姓名:戴明明摘要不对称双羟基化反应又名为夏普莱斯不对称双羟基化反应,是巴里·夏普莱斯在Upjohn双羟基化反应的基础上,于 1987 年发现的以金鸡纳碱衍生物催化的烯烃不对称双羟基化反应。
与sharpiess环氧化反应一样,该反应也是现代有机合成中最重要的反应之一。
原理不对称二羟基化反应(asymmetric dihydroxylation,AD)是一类重要的催化不对称反应[1],它不仅是许多手性药物,如紫杉醇C13侧链、美托洛尔、普萘洛尔、氨苄青霉素、昆虫激素和维生素D活性代谢物合成中的关键步骤[2],而且还为不对称催化反应中新型配体的合成提供了必需的手性砌块[3].研究该反应的核心问题之一是手性配体的设计与合成.迄今为止,文献已经报道了许多行之有效的配体,但是有些配体制备复杂、分离难度大、价格昂贵,因此设计合成简单,价廉和高效的手性配体仍然是目前的研究重点[4].本研究以天然金鸡纳生物碱奎宁和辛可宁为原料,将其结构中的活性基团羟基转换为碱性更强的氨基,与对氯苯甲酰氯反应得到新的手性配体1和2,考察这两种配体在AD反应中的催化活性及不对称诱导作用.典型的反应条件是四氧化锇(OsO4)和二氢奎宁(DHQ)或二氢奎尼丁(DHQD)的手性配体衍生物作为催化剂,以计量的铁氰化钾、N-甲基吗啉N-氧化物(NMO)或叔丁基过氧化氢作为再氧化剂,并加入其他添加剂如碳酸钾和甲磺酰胺等。
现实条件中常用非挥发性的锇酸盐K2OsO2(OH)4 代替OsO4。
[8][9] 市售的二羟化混合物试剂称为AD-mix,有 AD-mix α(含(DHQ)2-PHAL)和AD-mix β(含 (DHQD)2-PHAL)两种。
大多数烯烃在上述条件下,能都以高产率、高ee值生成光学活性的邻二醇,而且反应条件温和,无需低温、无水、无氧等条件。
DHQ 和DHQD 衍生物可分别用于一对对映异构邻二醇的合成,反应产物的立体构型可根据烯烃的结构,利用下图来进行预测。
喹宁xin学习教程
光谱鉴别
2. Fluorescence法—quinine and quinidine USP 29
A 1 in 2000 solution in dilute sulfuric acid exhibits a vivid blue fluorescence. On the addition of a few drops of hydrochloric acid, the fluorescence disappears.
酸度 氯仿-乙醇中不溶物 其他金鸡纳碱
7
第8页/共23页
酸度 本项检查主要控制药物中的酸性杂质。奎宁和
奎尼丁的碱性不同,奎尼的碱性略大于奎尼丁,其饱和 水溶液的PH为8.8。
检查方法:取本品约20mg,加水20m1溶解后,用酸度计进行测定, pH值应为5.7一6.6。
氯仿一乙醇中不溶物 本项检查主要控制药物在
8
第9页/共23页
其他金鸡纳碱
本项检查主要控制硫酸奎宁中其他生物碱,
因其化学结构不十分明确,没有合适的对照品,
因此采用薄层色谱中的高低浓度对比法进行检查。
检查方法:取本品,加稀乙醇制成
l0mg/ 1ml溶液 50ug/ 1ml溶液
供试品溶液;
对照溶液。
TLC法
检查方法:同一硅胶G薄层板上,以氯仿-丙酮-二乙胺(5: 4:1.25)为展开剂,展开后,微热使展开剂挥散,喷以碘铂酸钾 试液使显色。供试品溶液如显杂质斑点,与对照溶液的主斑点 比较,不得更深。
9
第10页/共23页
Assay
非水溶液滴定法 紫外分光光度法 高效液相色谱法
10
第11页/共23页
含Non量-aq测ueo定us titration
奎宁的合成与发展PPT课件

一、发现 二、合成发展
-
1
一、发现
在西方,17世纪前南美洲印第安人靠喝金鸡纳树皮水治疗疟疾;
19世纪中期英国学者将金鸡纳树种子带到印度尼西亚的爪哇岛开始大面积 种植;欧洲人将金鸡纳树皮提炼成金鸡纳霜供患者服用,但金鸡纳树适合 生长于热带海拔800-3000米的山地,生长环境有限造成金鸡纳霜价格昂 贵
欧洲人将金鸡纳树皮提炼成金鸡纳霜供患者服用但金鸡纳树适合生长于热带海拔8003000米的山地生长环境有限造成金鸡纳霜价格昂1820年法国化学家佩雷蒂尔和卡文顿从金鸡纳树皮中提取到了奎宁和辛可宁生物碱从此科学家们围绕着奎宁进行研究1907年在经过大量的实验的基础上德国化学家拉贝rabe报道了奎宁的结构如图5但是奎宁的立体化学结构直到20世纪40年代才被真正确定图21945年美国化学家伍德沃德woodward和多林doering以7羟基异喹啉为原料经过还原重氮化缩合等十六个步骤合成奎宁该奎宁全合成路线成为现代有机合成化学的里程碑该合成主要路线如图在19701978年uskokovic乌斯科科维奇经过三步由m成目标产物之后又以collidine作反应物经过九步得到预期产物funk芬克于1984年由o开始同样经过八步反应完成了目标物的合成在1987年brown布朗从n出发经过八步达到目的1990年时hannesian亨利逊与brown一样手性化合物为起始原料经过14步由p合成产物1991年wilson威尔逊也合成了产物是经过十步用q作原料来完成的2001年美国哥伦比亚大学columbiauniversitystork斯托克教授领导的团队宣布完成了奎宁的全合成2004美国哈佛大学harvarduniversity的igarashi教授宣布利用不对称催化反应完成了具有立体选择性即不对称合成奎宁的方法天然药物化学史话
Analysis and Intro Molecules that Change the world
Progress of Synthesis Box 2
• 1850年代, 有机合成已开始崭露头角,化学家也掌 握了加热、结晶、萃取、蒸馏等技术手段。 1856年, 根据奎宁的分子式组成,Perkin尝试从两 分子N-烯丙基甲苯胺出发,加上3个氧原子再脱去 一分子水来合成奎宁。但是反应实际情况如下:
青蒿素
(artemisinin)
咯奈啶
(malaridine)
抗疟类药物
• 自20世纪40年代起几类抗疟药叶酸合成抑制剂 (以二氢叶酸还原酶抑制剂和磺胺类药物为代 表),金鸡钠碱或喹啉类药物(以氯喹,氨酚喹 和甲氟喹应用最广),四环素和青蒿素衍生物的 相继问世,使疟疾一度得到有效控制。60年代以 来,恶性疟原虫对主要抗疟药氯喹产生抗药性, 抗药性已经遍及亚洲,美洲,大洋州和广大非洲 地区,并从单药抗药性向多药抗药性发展。目前 除了对青蒿素类衍生物,疟原虫可能对每一种抗 疟药都产生了耐药性,同类药物的交叉耐药使这 个问题更为严重。
疟疾在世界上分布广泛,无论过去还是现在都是危害人类最严重的虫媒传染病。目 前全世界仍约有24亿人生活在疟疾流行区,每年3-5亿人发病,其中 150-270万人死 亡;大约100万例5岁以下儿童死亡是由疟疾和相伴其它疾病所致。热带非洲国家 疟疾发病人数超过全球疟疾发病总人数的90%。 控制复发药 伯氨喹 病因预防药 乙胺嘧啶
Pharmacology
• 药动学:口服在肠道迅速吸收,广泛分布于全 身组织,以肝中浓度最高,在肝脏中被氧 化分解,迅速失效。其代谢产物和少量原 药经肾排泄,24小时几乎全部排出 • Clinical Use 抗疟作用(后面介绍)、有一定的退热作 用。对妊娠子宫有轻微兴奋作用。 • Adverse Reaction(金鸡纳反应) 耳鸣、头痛、恶心、呕吐、腹痛、腹泻、 视力和听力减退等,故现在不作为抗疟一 线药物(后面介绍)
辛可宁季铵盐合成及催化手性烷基化反应.

辛可宁季铵盐合成及催化手性烷基化反应不对称相转移催化烷基化反应是不对称形成C-C键的重要方法之一,本文研究了辛可宁衍生相转移催化剂的制备及催化二苯亚甲基甘氨酸叔丁酯不对称烷基化过程,主要研究内容如下:通过苯甲醛还原-溴化、卤素置换、苄胺水解-溴化、NBS溴化4种方法合成了14个取代苄基溴化物,产率38%~97%,并确定了取代苯甲醛还原-溴化法为取代苄基溴的最佳制备方法。
实验发现金鸡纳碱与取代苄溴在四氢呋喃中回流为最佳的金鸡纳碱季铵盐制备方法,用该方法合成了11个金鸡纳碱季铵盐,和5个羟基保护的金鸡纳碱季铵盐,收率在57%~88%之间,产物经1H-NMR、13C-NMR、HRMS、比旋光、熔点表征,其中6个未见文献报道。
选用16个金鸡纳碱季铵盐为不对称相转移催化剂催化二苯亚甲基甘氨酸叔丁酯的不对称烷基化过程,发现催化剂分子结构中的苄基具有4-Br取代基,或金鸡纳碱的羟基被醚化后其产物的对映选择性提高。
以Cn-15为催化剂,对二苯亚甲基甘氨酸叔丁酯进行不同烷基化,可达95%产率,96%e.e.。
同主题文章[1].姚守拙,沈国励,戴桂林. 辛可宁选择性电极的研究' [J]. 科学通报. 1983.(21)[2].张政朴,李贺先,张华,王瑛,何炳林. 使用聚合物负载的辛可宁类生物碱为相转移催化剂不对称诱导合成[o—乙基,o—取代芳基硫代磷酰氯]' [J].离子交换与吸附. 1993.(05)[3].张海丽,叶永康,徐斌. 辛可宁修饰碳糊电极的应用研究——铋的阳极溶出伏安法测定' [J]. 分析测试学报. 2000.(02)[4].周朝晖,蒋亚琪,王毓,章慧,颜文斌. 微型柱色谱制备辛可宁酒石酸复合物' [J]. 广西师范大学学报(自然科学版). 2000.(S1)[5].沈雨生,隋明,李瑞. 奎尼丁和辛可宁的层析机理' [J]. 吉林大学学报(理学版). 1980.(03)[6].晏哲,刘万忠,周性尧. 辛可宁的FIA-ISE分析研究' [J]. 化学传感器. 1990.(02)[7].刘志航,宦双燕,沈国励,俞汝勤. 以分子印迹电聚合膜为仿生受体检测辛可宁' [J]. 高等学校化学学报. 2005.(06)[8].朱章祺. 以催化波极谱法测定钢铁中微量钨' [J]. 上海钢研. 1987.(04)[9].任文康. 催化极谱测定痕量钨时辛可宁的干扰及消除' [J]. 分析试验室. 1983.(04)[10].方天如,刘德珍,吴涤,张从云,成荣敏,郑贻基,王佛松. 含金鸡钠碱的光活性聚合物2.含辛可宁的两亲单体及其两亲聚合物' [J]. 功能高分子学报. 1997.(01)【关键词相关文档搜索】:药物化学; 辛可宁; 季铵盐; 相转移催化; 不对称烷基化; 二苯亚甲基甘氨酸叔丁酯【作者相关信息搜索】:大连理工大学;药物化学;孟庆伟;李智;。
一种奎宁酮还原酶及其在不对称合成(R)-3-奎宁醇中的应用[发明专利]
![一种奎宁酮还原酶及其在不对称合成(R)-3-奎宁醇中的应用[发明专利]](https://img.taocdn.com/s3/m/59b6f858ae1ffc4ffe4733687e21af45b307fe93.png)
(10)申请公布号 (43)申请公布日 2014.02.05C N 103555608A (21)申请号 201310422722.1(22)申请日 2013.09.16CGMCC No7986 2013.08.09C12N 1/20(2006.01)C12N 9/02(2006.01)C12N 15/53(2006.01)C12N 15/63(2006.01)C12N 1/21(2006.01)C12P 17/18(2006.01)C12R 1/01(2006.01)(71)申请人华东理工大学地址200237 上海市徐汇区梅陇路130号(72)发明人许建和 郁惠蕾 张文霞 潘江(74)专利代理机构上海专利商标事务所有限公司 31100代理人沈端(54)发明名称一种奎宁酮还原酶及其在不对称合成(R)-3-奎宁醇中的应用(57)摘要本发明公开了一种放射形土壤杆菌,其表达的奎宁酮还原酶及其基因,含有该基因的重组表达质粒和重组表达转化体,其重组酶及其制备方法,以及该重组酶作为催化剂在不对称还原3-奎宁酮制备(R)-3-奎宁醇中的应用。
与制备(R)-3-奎宁醇的其他方法相比,使用本发明的奎宁酮还原酶所制备的(R)-3-奎宁醇不仅产物浓度高,而且光学纯度好,反应条件温和,操作简便,易于放大,因此在抗胆碱药物中间体的生产中具有很好的工业应用前景。
(83)生物保藏信息(51)Int.Cl.权利要求书1页 说明书8页序列表6页 附图3页(19)中华人民共和国国家知识产权局(12)发明专利申请权利要求书1页 说明书8页序列表6页 附图3页(10)申请公布号CN 103555608 A1/1页1.一种放射形土壤杆菌(Agrobacterium radiobacter)CGMCC7986,其特征在于,所述放射形土壤杆菌表达奎宁酮还原酶。
2.一种奎宁酮还原酶,其特征在于,所述奎宁酮还原酶是:(a)具有SEQ ID No.2所示氨基酸序列的蛋白质;或(b)由SEQ ID No.2所示氨基酸序列经过取代、缺失或添加一个或多个氨基酸而得到的具有奎宁酮还原酶活性的衍生蛋白质。
手性小分子催化剂的合成及其在不对称反应中的应用_文献综述_

Scheme 10
9
手性季铵盐类相转移催化剂在不对称反应中的应用进展
第一部分 性相转移催化剂催化顺式α,β-不饱和酮的环氧化反应,一直效果不佳。
最近 Waldemar.Adam 等人的报道了以过氧化叔丁醇类化合物为氧化剂,以 Cat 16
催化 Isoflavone 的环氧化反应,取得了很好的对映选择性(Scheme 10)。以羟基被
手性季铵盐类相转移催化剂在不对称反应中的应用进展
第一部分 综述
第一部分 手性季铵盐类相转移催化剂在不对称反应
中的应用进展
文献综述
相转移催化剂( Phase-Transfer Catalysts, PTC )是一类在有机合成中普遍使 用且非常有效的催化剂,它通过将分子或离子从一个反应相转移到另一个反应相, 从而加速非均相反应的进行。近年来,手性相转移催化剂,作为一种手性因素在 催化不对称反应方面得到了很大的发展。手性相转移催化剂中最常用的是手性季 铵盐类催化剂[1]。金鸡纳碱衍生的手性季铵盐类催化剂,由于制备简单,原料廉价 易得,引起了化学家们的关注。本文主要总结了 2000 年以来金鸡纳碱衍生的手性 季铵盐类相转移催化剂在不对称反应中的应用进展。
Ph2C N CO2But 1
1) 4-Cl-C6H4CH2Br
Cat 1 (10mol%) rt, 15h 50% NaOH, CH2Cl2 95%yield, 64%ee 2) Crystallize Racemate 3) Deprotect
Scheme 1
H2N CO2H 2
ovell : 50% ( >99%ee )
8
手性季铵盐类相转移催化剂在不对称反应中的应用进展
得了不错的效果[13](Scheme 9)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
奎宁和辛可宁衍生物的合成及其在不对称双羟化反应中的催化作用作者:何炜,刘鹏,金瑛,辛春艳,张生勇【关键词】奎宁;辛可宁;不对称双羟化反应【Abstract】 AIM: To synthesize 2 novel chiral ligands derived from cinchona alkaloids and study their catalytic performance in asymmetric dihydroxylation (AD) of 5 olefins. METHODS: Inexpensive quinine and cinchonine were transformed to 9NH2quinine and9NH2cinchonine, which reacted with 4chlorobenzoyl chloride to afford 2 novel chiral ligands. The AD reactions of olefins were performed inH2OtBuOH (1∶1) using the 2 ligandsK2OSO2(OH)4 as catalysts. RESULTS: The applications of the 2 ligands in AD of 5 olefins produced 5 corresponding chiral diols, respectively in 87%-95% yields and 76%-93% enantiomeric excess. CONCLUSION: 2 novel stable chiral ligands were synthesized by simple and inexpensive methods. When they were used in catalytic AD, high yields and enantiomeric excess of the products were observed.【Keywords】 quinine; cinchonine; asymmetric dihydroxylation【摘要】目的:合成两种新的金鸡纳生物碱类衍生物配体并将其用于催化五种烯烃的不对称二羟化反应,考察催化效果. 方法:以价廉易得的奎宁和辛可宁为原料,经过结构转换得到9氨基奎宁和9氨基辛克宁,进而与对氯苯甲酰氯反应制得两种新型手性配体,并将其用于锇催化的烯烃的不对称双羟化反应. 结果:在五种烯烃的不对称双羟化反应中,化学产率为87%~95%,对映体过量值为76%~93%. 结论:两种对氯苯甲酰胺类新型手性配体合成方法简便、成本低廉、性质稳定,对烯烃的不对称二羟化反应有较强的催化活性和光学选择性.【关键词】奎宁;辛可宁;不对称双羟化反应0引言不对称二羟基化反应(asymmetric dihydroxylation,AD)是一类重要的催化不对称反应[1],它不仅是许多手性药物,如紫杉醇C13侧链、美托洛尔、普萘洛尔、氨苄青霉素、昆虫激素和维生素D活性代谢物合成中的关键步骤[2],而且还为不对称催化反应中新型配体的合成提供了必需的手性砌块[3].研究该反应的核心问题之一是手性配体的设计与合成.迄今为止,文献已经报道了许多行之有效的配体,但是有些配体制备复杂、分离难度大、价格昂贵,因此设计合成简单,价廉和高效的手性配体仍然是目前的研究重点[4].本研究以天然金鸡纳生物碱奎宁和辛可宁为原料,将其结构中的活性基团羟基转换为碱性更强的氨基,与对氯苯甲酰氯反应得到新的手性配体1和2(图1),考察这两种配体在AD 反应中的催化活性及不对称诱导作用.1材料和方法材料奎宁,辛可宁(上海化学试剂二厂,德国进口试剂分装);叠氮化钠(西安试剂厂,化学纯);甲磺酰氯,对氯苯甲酰氯(Acros试剂);甲磺酰胺,(E)二苯乙烯,苯乙烯,α甲基苯乙烯,(E)β甲基苯乙烯,β萘乙烯,锇酸钾(Aldrich试剂);其余试剂为国产AR.或PC.级试剂,用前均经纯化处理. XRC1显微熔点仪(四川大学科学仪器厂),温度计未经校正;PERKINELMER 343型自动旋光仪(美国PE公司);INOVA400型核磁共振波谱仪(美国VARIAN),未作特殊说明者均以CDCl3为溶剂,TMS为基准物质; Apex II和ZABHS型质谱仪(美国Bruker);III型元素分析仪(德国Viro EL);600E型高效液相色谱仪(美国Waters)(Turbochrom数据处理;检测波长220 nm);Chiralcel OJ, OD, OBH, AD,ODH手性色谱柱(日本Daicel).方法奎宁甲磺酸酯的制备按文献[5]的方法,在250 mL的三口瓶中,加入g(12 mmoL)奎宁,70 mL四氢呋喃(经钠和二苯甲酮回流处理过)和7 mL三乙胺.上述反应混合液冷至0℃,慢慢滴加 mL (12 mmoL)甲磺酰氯的10 mL四氢呋喃溶液.滴加完毕后,0℃反应 h,再室温反应4 h直到反应完全(薄层层析监测).抽滤,减压蒸除滤液中的四氢呋喃,余物用1 mol/L HCl酸化至pH=5,水相用乙酸乙酯萃取3次,无水硫酸镁干燥.蒸除乙酸乙酯溶剂后得油状粗产物,粗产物再经快速柱层析(Et2O/MeOH=9∶1)得白色晶体2a g,产率为90%(图2).氨基脱氧奎宁的制备将奎宁甲磺酸酯溶于27 mL DMF中,加入NaN3 (420 mg, mmol),85~90℃搅拌21 h.向反应液中加入20 mL水,用30 mL乙酸乙酯萃取3次.有机层再用水洗,无水硫酸镁干燥.减压蒸除溶剂得红色胶状物.将上述粗产物溶解在绝对甲醇中( mmol/mL),加入催化量的10% Pd/C,室温下用高纯H2常压催化氢化直到反应完全(TLC检测).反应液经短的中性Al2O3填充柱过滤,滤去不溶物,并旋转蒸除溶剂.余物经快速柱层析(EtOAc/MeOH=10∶1)分离得淡黄色油状物9氨基脱氧奎宁,产率为82%(图2).手性配体1的合成将9氨基脱氧奎宁(485 mg, mmol)溶于25 mL二氯甲烷和10 mL三乙胺中,0℃下慢慢滴加对氯苯甲酰氯溶液(25 mg, mmol溶于5mL THF中).滴加完毕,继续室温搅拌,用薄层层析跟踪反应(展开剂为乙酸乙酯∶甲醇=9∶1)直到反应完全(约需要46 h).反应完毕后,向反应液中加入25 mL 二氯甲烷稀释,有机相用10%的碳酸钠水溶液洗3次(20 mL×3),无水碳酸钠干燥.蒸除溶剂后,油状粗产物经快速柱层析(EtOAc/MeOH=10∶1)得白色固体,即为手性配体1,450 mg,产率81%(图2).手性配体2的合成以辛可宁为原料,按照上述方法合成手性配体2.手性配体1和2催化的烯烃不对称双羟化反应于50 mL三颈瓶中加入 g (3 mmol)K3[Fe(CN)6], g(3 mmol)K2CO3, mmol配体, mg ( μmol)K2OsO2(OH)4,95 mg CH3SO2NH2(1 mmol)(端烯不加),1 mmol烯烃,6 mL水和6 mL叔丁醇,0℃搅拌反应,薄层层析检测反应进程. 反应完全后,加入 g Na2SO3,搅拌1 h,加入10 mL乙酸乙酯,搅拌分层.水层用乙酸乙酯萃取(15 mL×3) ,合并有机层,用2 mol/L KOH 10mL洗涤(端烯不用KOH),再用水洗至中性,无水MgSO4干燥,减压浓缩,硅胶柱层析分离(正己烷/乙酸乙酯=7∶3)(图3).催化反应结果的评价方法催化反应的结果是由反应产物的对映体过量值来衡量的. 本研究所选烯烃经不对称双羟化反应所得手性二醇的对映体过量值是按照文献[9]由高效液相色谱测定.2结果手性配体1的波谱数据该物质熔点为110~112℃,总率为60%,[α]20D 为+ (c=,CHCl3). IR(KBr)ν(cm-1):3420,2938,2870,1650,1586,1475. 1H NMR:δ~(m,1 H),~(m,4 H),~(m,1 H),~(m, 4 H),(s,3 H), (m,2 H),(ddd,J=,, Hz,1 H),(m,2 H),~ (m, 9 H), (d,J=,1 H). MS (EI): m/z= 461,322,306,160,82.手性配体2的波谱数据该物质熔点为133~135℃,总产率43%. [α]20D为+ (c=,CHCl3). IR(KBr)ν(cm-1):3320,2935,1640,1515. 1H NMR:δ~ (m,1 H),~ (m,4 H),~ (m,1 H),~(m,5 H), (m,2 H), (br s,1 H),(m,1 H),~ (m,9 H),(d,J=,1 H), (d,J=,1 H). MS(EI): m/z = 7,276,262,157,136,105.不对称催化反应的结果手性配体1和2在锇酸钾的存在下,对5种烯烃进行了不对称二羟化反应.结果显示,这两种新型手性配体都可以有效地催化不对称双羟化反应,对5种烯烃均表现出高的催化活性(化学产率为87%~95%)和不对称诱导作用(对映体过量值为76%~93%)(表1).表1手性配体1和2催化的烯烃不对称双羟化反应3讨论烯烃的不对称双羟化反应经过近十年的发展已取得重大发展,具有良好催化效果的配体主要是金鸡纳生物碱衍生物类手性配体.在讨论配体的构效关系时, Kolb等[6]曾指出C9位的氧原子对于配体与四氧化锇的结合是必需的,当其被碳原子取代时,配合物稳定性会显著下降. 本研究将金鸡纳生物碱9位氧原子用氮原子取代,并在9N位引入芳香取代基,所得配合物性质稳定,在不对称双羟化反应中亦表现出良好的催化活性和对映选择性.另外,通过对配体1和2的催化反应进行比较,我们也发现喹啉环上的甲氧基有利于提高反应速度和立体选择性,这一结论与Kolb等[7]所揭示的规律相符.总之,本研究以价廉易得的天然金鸡纳生物碱奎宁和辛可宁为原料,以温和的反应条件简便地合成了两种适合不对称双羟化反应的手性配体,为烯烃AD反应的配体家族增加了两个新成员,与Jacobsen等[8]报道的类似配体对氯苯甲酸奎宁酯相比,所得手性配体1和2催化的双羟化反应化学产率高,立体选择性也提高了近10个百分点.【参考文献】[1]李月明,范青华,陈新滋.不对称有机反应[M]. 北京:化学工业出版社,20XX: 93-108.[2]郑虎.药物化学[M]. 5版,北京:人民卫生出版社,20XX: 105-110.[3] Cheng SK, Zhang SY, Wang PA, et al. Homogeneous catalytic asymmetric dihydroxylation of olefins induced by an efficient and recoverable polymerbound ligand QNAQNOPEGOMe[J]. Appl Organometal Chem, 20XX, 19: 975-979.[4]张生勇,郭建全.不对称催化反应[M]. 北京:科学出版社,20XX: 93-95.[5] Rper S,Franz MH,Hoffmann MR. Preparetion of enantiopure 1azabicyclo[]nonanes functionalized at carbon C3, from cinchonine and cinchonidine[J]. J Org Chem, 20XX, 68: 4944-4946.[6] Kolb HC,Andersson PG,Sharpless KB. Toward an understanding enantioselectivity in the osmium catalyzed asymmetric dihydroxylation Kinetics[J]. J Am Chem Soc, 1994, 116(4):1278-1291.[7] Kolb HC, van Nieuwenhze MS, Sharpless asymmetric dihydroxylation[J]. Chem Rev, 1994, 94: 2483-2547.[8] Jacobsen EN, Marko I, Mungall WS, et al. Asymmetric dihydroxylation via ligandaccelerated catalysis [J]. J Am Chem Soc,1988, 110(6): 1968-1970。
