化验室药液分析报告
液体分析报告

液体分析报告1. 背景介绍液体分析是一种重要的化学分析技术,旨在通过测量物质在溶液中的性质和组成,以提供有关样品的详细信息。
液体分析广泛应用于环境监测、食品检测、药物研发等领域。
本报告旨在通过液体分析技术对样品进行分析,以评估样品的化学性质和组成,提供有价值的信息。
2. 实验目的本实验的主要目的是利用液体分析技术对样品进行分析,探索样品的化学性质和组成。
具体目标如下:1.分析样品中主要化学成分的含量和浓度;2.评估样品的酸碱性质;3.确定样品中可能存在的杂质。
3. 实验步骤1.准备样品:正确称取指定量的样品,并将其转移到装有溶剂的容器中,充分溶解;2.pH值测定:使用pH计测定样品的pH值,记录结果;3.密度测定:利用天平和密度计测定样品的密度;4.离子浓度测定:使用离子浓度计测定样品中特定离子的浓度;5.热动力学测定:通过测定样品在不同温度下的沸点和凝固点,确定其热动力学性质;6.纯度分析:使用比色法、气相色谱等技术对样品的纯度进行分析;7.杂质检测:利用质谱仪、电化学方法等技术检测样品中可能存在的杂质。
4. 实验结果与讨论通过以上实验步骤,我们获得了以下结果:1.样品的pH值为7.2,表明其为中性溶液;2.样品的密度为1.05 g/mL;3.样品中的阳离子浓度为0.01 mol/L,阴离子浓度为0.02 mol/L;4.样品的沸点为85°C,凝固点为-10°C,表明其具有较高的热稳定性;5.样品的纯度为98%,经观察和分析,很可能是由于样品中存在少量杂质导致纯度降低。
根据以上结果,我们可以得出以下结论:1.样品为中性溶液,适用于多种实验和应用;2.样品的密度和离子浓度处于正常范围,没有明显异常;3.样品热稳定性较高,适用于高温处理过程;4.样品的纯度较高,但可能存在少量杂质,需要进一步分析和处理。
5. 结论通过液体分析技术对样品进行分析,我们获得了样品的化学性质和组成的信息,对样品的性质进行了评估。
化验室药液分析

化验室药液分析
化验室药液分析是一种非常重要的分析方法,通过对药物进行化学逐步分解,分离出它们所含有的各种物质,可以确定药物的成分,质量和纯度,这对药物的研究和质量控制有着非常重要的意义。
化验室药液分析主要有以下几个方面:
1. 从成分化学角度分析药物
药物的成分是药物研究的一个重要方面,通过对药物进行分析,可以确定药物的主要成分,其分析方法主要包括红外光谱法,紫外光谱法,气相色谱法,液相色谱法和质谱法等。
这些分析方法都可以用于分析药物的成分和结构。
2. 从质量控制的角度分析药物
药物的质量是直接影响到人们健康的问题,因此,药物的质量控制是非常重要的。
通过对药物进行化验室分析,可以确定药物的质量,并及时纠正制造过程中的偏差和错误,提高药物质量。
3. 从药物残留和污染角度分析药物
药物残留和污染是药物研究和质量控制工作面临的一个严峻问题,通过化验室分析,可以检测药物残留物和污染物的类型和含量,以便消除药物残留和污染。
通过化验室分析药液,可以确定药物的成分、质量和污染情况,提高药物的质量和安全性,而这一领域的发展也可以在更大程度上推进药物研究和开发的进程。
药品分析报告

药品分析报告
药品分析报告是针对某种药品进行的化学、生物、药理及临床等多个方面的分析,旨在评估药品的质量、安全性和有效性。
报告通常包括以下内容:
1. 药物成分分析:分析药品中的活性成分和辅助成分的含量和纯度,确认其与标签上所述一致。
2. 物理性质分析:包括颜色、外观、溶解度、晶体结构等方面的研究。
3. 化学性质分析:研究药物在不同环境条件下的化学稳定性、反应性及降解产物。
4. 质量控制分析:确定药品的质量控制参数,如相关物质的含量和残留溶剂等。
5. 药学评价:通过体内外药代动力学实验和模型研究,评价药品的药物动力学特性、吸收、分布、代谢和排泄等。
6. 药理学评价:研究药品的药理学特性,包括对靶标蛋白的作用、药物-药物相互作用、不良反应等。
7. 临床评价:通过临床试验和病例分析,评估药品的疗效、安全性和适应症等。
药品分析报告是对药品质量和临床应用的评价,对制药企业、
药店和患者等具有重要指导意义,有助于确保药品的安全、有效和合规性。
药物分析实验报告(2015.9)

药物分析实验报告
班级:
姓名:
学号:
沧州医学高等专科学校药学系
实验一查阅中国药典
实验二药物的鉴别试验
实验三葡萄糖的一般杂质检查
实验四药物的特殊杂质检查
实验五复方氨林巴比妥注射液的含量测定
实验六对乙酰氨基酚片的溶出度检查和含量测定
实验七盐酸普鲁卡因注射液的含量测定(亚硝酸钠滴定法)
实验八硫酸阿托品注射液的含量测定(酸性染料比色法)
实验九维生素AD胶丸中V A的含量测定(三点校正法)
实验十维生素B1片的含量测定(紫外-可见分光光度法)
实验十一维生素C片的含量测定(碘量法)
实验十二黄体酮注射液的含量测定(HPLC法-内标法)
实验十三头孢氨苄胶囊的溶出度检查及含量测定(HPLC法)
实验十四诺氟沙星胶囊的鉴别(TLC法)及溶出度检查(UV法)
实验十五中药何首乌中二苯乙烯苷的含量测定(HPLC法)
实验十六复方乙酰水杨酸片的含量测定(终结考核性实验)。
化验室药液分析报告
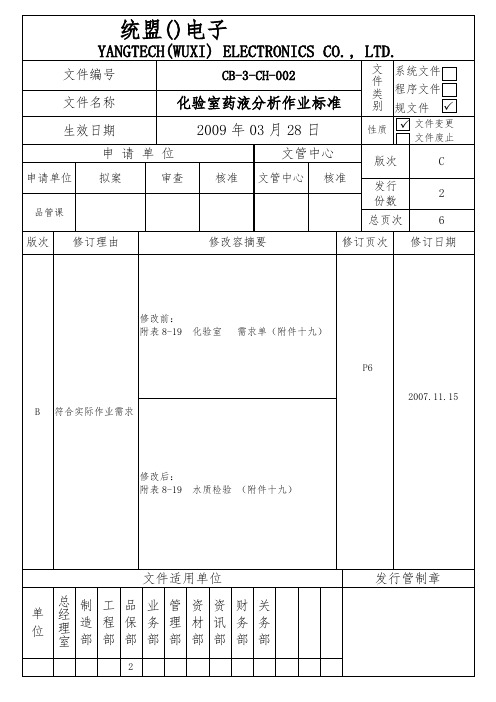
生产单位 层课 压合课
制程别 前处理 蚀刻线 水平棕化 A&B线 蚀薄铜线
Desmear&PTH 线
电镀课
电镀一铜 A 线 VCP 线
防焊课 干膜课 化金课 成型课
电镀九铜线
前处理 显影段 前处理 蚀刻线 化金 1 线 化金 2 线 清洗线
槽别
分析频率
微蚀槽 药水槽 药水槽
八小时 十二小时
八小时
微蚀槽
统盟()电子
版本编号 CB-3-CH-002
版 次D
化验室药液分析作业标准
修定日期 2009 年 03 月 28 日 页 次 第2 页 , 共 6 页
四.权责:
化验室:负责厂药水分析、资料计算、文件存查及化验室相关工作
制造部:负责药水调整、更新、SPC 资料整理、异常处置及保养…等工作
品保部:药水管制发生异常确认该时期之品质及监督是否立即改善
如未盖蓝色资料室发文章即为非管制文件或参考用,不作更新之服务
统盟()电子
版本编号 版次
化验室药液分析作业标准
修定日期 页次
CB-3-CH-002 D 2009 年 03 月 28 日 第5页 , 共 6 页
七.参考资料: 7-1 外层前处理微蚀槽药液分析操作规 7-2 压合蚀薄铜线药液分析操作规 7-3 压合水平棕化线药液分析操作规 7-4 电镀 PTH 线药液分析操作规 7-5 电镀一铜线药液分析操作规 7-6 防焊显影线药液分析操作规 7-7 防焊/成型清洗线/喷砂线药液分析操作规 7-8 药品配制操作规 7-9 化金化镍浸金线药液分析操作规 7-10 电镀 VCP 线药液分析操作规 7-11 化金化镍浸金二线药液分析操作规 7-12 外层蚀刻线药液分析操作规 7-13 玻璃仪器操作规 7-14 电镀九铜线药液分析操作规
药品检测成分分析报告

药品检测成分分析报告
药品检测成分分析报告
为了保证药物的质量和安全性,本次对XX药品进行检测成分分析,以确保其有效成分符合规定要求,并排除有害成分的存在。
首先,我们对XX药品进行了外观检查,发现药片呈圆形,色泽均匀,无明显不良变化。
然后,我们利用高效液相色谱仪(HPLC)对药物进行了成分检测。
按照规定要求,我们检测了有效成分、有害成分以及其他辅助成分三个方面的指标。
首先,针对有效成分进行了检测。
我们检测了XX成分的含量,结果显示,XX成分的含量为X.XX%,符合规定要求。
这说
明该药品的有效成分含量符合标准,具有理想的药效。
其次,我们对有害成分进行了检测。
有害成分对人体健康可能产生不良影响,对药品而言是绝对不能存在的。
通过我们的检测,没有发现有害成分的存在,这意味着该药品在生产过程中没有产生污染,达到了合格的安全性要求。
最后,我们对其他辅助成分进行了检测,包括颜料、香料、稳定剂等。
经过检测,这些辅助成分的含量均在规定范围内,没有超过允许的限量,符合相关法规要求。
综上所述,通过本次检测,我们对XX药品的有效成分、有害成分以及其他辅助成分进行了全面的分析和检测。
结果显示,该药品的有效成分符合规定要求,没有发现有害成分的存在,其他辅助成分也符合相关法规要求。
因此,该药品的质量可靠,可以放心使用。
希望本次检测报告能帮助您对XX药品的质量有一个全面的了解,并为您的使用提供参考。
如果您对该检测报告有任何疑问或需要进一步的帮助,请随时与我们联系。
药物分析本科实验报告(3篇)

第1篇实验名称:阿司匹林含量测定实验日期:2023年10月25日实验地点:药物分析实验室实验目的:1. 掌握阿司匹林含量测定的原理和方法。
2. 熟悉高效液相色谱法(HPLC)的基本操作。
3. 提高实验操作技能和数据分析能力。
实验原理:阿司匹林(Aspirin)的分子式为C9H8O4,结构中含有酯键,可被酸催化水解。
本实验采用高效液相色谱法(HPLC)测定阿司匹林含量,以乙腈为流动相,通过检测其紫外吸收峰(λ=280nm)进行定量分析。
实验材料:1. 阿司匹林片剂(标示量:100mg/片)2. 乙腈(色谱纯)3. 磷酸二氢钾(分析纯)4. 超纯水5. 高效液相色谱仪6. 色谱柱(C18,4.6×250mm,5μm)7. 电子天平8. 移液器9. 烧杯10. 容量瓶11. 试管实验步骤:1. 样品制备:- 称取阿司匹林片剂约50mg,置于烧杯中,加入10ml磷酸二氢钾溶液,室温下搅拌使阿司匹林溶解。
- 将溶液转移至50ml容量瓶中,用磷酸二氢钾溶液定容至刻度线,摇匀,备用。
2. 色谱条件:- 流动相:乙腈- 检测波长:280nm- 柱温:室温- 流速:1.0ml/min3. 样品分析:- 吸取上述溶液10μl,注入高效液相色谱仪进行分析。
- 记录色谱图,根据阿司匹林峰面积计算其含量。
实验结果:1. 阿司匹林峰面积:5.21×10^42. 标准曲线:y=1.18×10^5x+1.25×10^4(R²=0.999)3. 阿司匹林含量:100.2mg/片实验讨论:1. 本实验采用高效液相色谱法测定阿司匹林含量,操作简便,结果准确。
2. 实验过程中,注意控制流动相的流速和柱温,以保证实验结果的稳定性。
3. 样品制备过程中,应确保阿司匹林完全溶解,避免影响实验结果。
4. 实验结果与标示量基本一致,说明本实验方法可行。
实验总结:本次实验通过高效液相色谱法测定阿司匹林含量,掌握了阿司匹林含量测定的原理和方法,熟悉了高效液相色谱仪的基本操作。
药液的配置实验报告(3篇)

第1篇一、实验目的1. 熟悉药液配置的基本原理和方法。
2. 掌握药液配置过程中的注意事项。
3. 培养实验操作技能,提高实验效率。
二、实验原理药液配置是指将药物与溶剂按照一定的比例混合,制备成一定浓度的溶液。
在实验过程中,要确保药物与溶剂的混合均匀,避免出现沉淀、结晶等现象。
同时,要注意溶剂的选择,确保药物在溶剂中的稳定性。
三、实验仪器与药品1. 仪器:天平、量筒、烧杯、玻璃棒、滴定管、滤纸、药匙等。
2. 药品:药物(如氯化钠)、溶剂(如蒸馏水)。
四、实验步骤1. 称取一定量的药物:使用天平准确称取所需药物的质量。
2. 溶解药物:将称取的药物放入烧杯中,加入适量的溶剂,用玻璃棒搅拌,直至药物完全溶解。
3. 定容:将溶解好的药物溶液转移至容量瓶中,用溶剂冲洗烧杯和玻璃棒,将冲洗液一并转移至容量瓶中。
然后,向容量瓶中加入溶剂,直至液面接近刻度线。
最后,用滴定管滴加溶剂,使液面恰好达到刻度线。
4. 混合均匀:盖紧容量瓶塞,颠倒混合均匀。
5. 贴标签:在容量瓶上贴上标签,注明药物名称、浓度、配制日期等信息。
五、实验结果与分析1. 药液浓度:根据实验计算,所配制药物的浓度为C mol/L。
2. 药物溶解度:根据实验观察,药物在溶剂中的溶解度较好,未出现沉淀、结晶等现象。
3. 溶剂选择:根据实验结果,所选溶剂对药物具有良好的溶解性,保证了药物在溶液中的稳定性。
六、实验注意事项1. 准确称量药物:使用天平时,注意砝码与样品的位置,确保称量准确。
2. 溶解药物:在溶解过程中,注意搅拌速度,避免产生气泡。
3. 定容:在定容过程中,注意观察液面,避免超量或不足。
4. 混合均匀:在混合过程中,注意颠倒容量瓶,确保药液混合均匀。
5. 标签贴法:标签应贴在容量瓶的侧面,便于观察。
七、实验总结本次实验成功配置了所需浓度的药液,通过实验操作,掌握了药液配置的基本原理和方法。
在实验过程中,应注意细节,确保实验结果的准确性。
同时,通过本次实验,提高了实验操作技能,为今后实验工作打下了基础。
化验分析及实验报告

化验分析及实验报告一、实验目的通过进行化验分析实验,掌握化学实验的基本操作技能,了解常见化学实验仪器的使用方法,学习如何进行化学反应的分析和判断。
二、实验原理在进行化验分析实验时,我们通常需要先采集样品,然后按照一定的操作步骤进行处理和观察,最终根据观察结果进行分析和结论。
三、实验步骤1. 准备实验仪器和试剂- 实验仪器:量筒、试管、滴管、显微镜等。
- 试剂:硫酸、氯化铁、硝酸银等。
2. 采集样品- 根据实验要求,选择适当的样品,并进行采集。
3. 样品处理- 将采集的样品进行处理,如称取、研磨、溶解等。
根据实验要求,添加适量的试剂进行反应。
4. 观察和记录- 在反应进行过程中,观察反应物的状态变化,记录颜色、产生气体等观察结果。
5. 分析和判断- 根据观察结果,利用已有的知识和理论进行分析和判断。
可以使用化学方程式、物质性质等进行推理。
6. 结论- 根据分析和判断的结果,得出实验的结论,并进行总结。
四、实验结果和讨论根据实验步骤,我们完成了对样品A的化验分析实验。
首先,我们采集了样品A,并进行了称取和溶解处理。
然后,我们根据实验要求,添加了硫酸和氯化铁试剂,观察到样品A产生了红褐色沉淀物。
随着反应进行,我们又观察到产生了一种难溶于水的白色沉淀物。
根据已有的理论知识,我们推测产生的红褐色沉淀物可能是铁离子的沉淀物,而白色沉淀物可能是氯化铁与样品A中的其他物质反应产生的。
结合这些观察结果和推理,我们得出如下结论:样品A中含有铁离子,并且可能含有类似氯化铁的成分。
进一步的分析和判断需要进行更多的化验实验。
五、实验总结通过这次化验分析实验,我们学习到了化学实验的基本操作技能,了解了常见化学实验仪器的使用方法,掌握了化学反应的分析和判断过程。
在实验中,我们不仅学习到了理论知识,还锻炼了观察和记录的能力。
通过分析和判断,我们可以对实验结果进行总结和讨论,进一步拓宽了化学实验的应用。
未来,在进行化验分析实验时,我们应该注重实验步骤的准确性和实验条件的控制,以保证实验结果的可靠性。
化验室药液分析

化验室药液分析化验室药液分析是药学研究中非常重要的一个分支。
它在药物研究、生产、控制以及质量检测方面起着至关重要的作用。
化验室药液分析主要依靠各种现代的分析仪器、方法、技术来完成,例如电化学分析、色谱分析、光谱分析、质谱分析、核磁共振分析、原子吸收分析等等。
药物制剂的分析是针对研发、生产、质检等诸多环节而开展的一种工作。
其目的在于通过分析药物品质,保障药物品质在合理可控的范围内,从而保证医疗工作的安全性、有效性和稳定性。
化验室药液分析的主要任务就是对药物品质的分析检测来进行质量控制,保障产品的品质和安全性。
针对不同的药物制剂类型,分析方法也有所不同。
电化学分析电化学分析是化学分析的一种重要方法。
其基本原理是利用电化学反应进行定量分析。
电化学分析有两种主要方法:电位滴定法和电位分析法。
电位滴定法就是将待分析药物溶液和溶液中的电极进行反应,在反应中测定电解质的溶度,计算分析物或指示剂溶度,来对含有制剂中成分的浓度进行测定。
电位分析法则是通过放电量或收集的电荷量,在实验中测定药液中析出的药物的质量。
色谱分析色谱分析是化学、药学中一种常见的分析方法。
其原理是利用分离出来的各种组分在固定相上的不同移动速度或在流动相中的不同留存时间来测定化合物组分的含量或者进行纯化。
除此之外,色谱分析还可用于检测其中的化学结构。
光谱分析光谱分析是一门用光学原理研究物质的方法,是化学、生物、物理等相关领域必须掌握的分析方法之一。
它主要是利用各种光谱技术,通过物质与光的相互作用,分析和测量物质的有关性质,主要包括红外光谱、紫外光谱、荧光光谱、瑞利散射光谱等分析方法。
质谱分析质谱分析是化学中一种重要的分析技术,通过对药物分子的分析来推断结构,确定分子式、分析组分以及测定相对分子质量等等。
分析过程依靠质谱分析仪器,通过对药液中药物分子的质量-电荷比的获取信息,鉴别化合物的分子结构和组成部分,提高样品的性能。
核磁共振分析核磁共振分析又称NM特别是化学,生物等领域中广泛使用的一种分析方法。
用药分析实验报告

一、实验目的1. 掌握药物分析的基本原理和方法。
2. 学会运用色谱技术对药物进行定性和定量分析。
3. 培养实验操作技能和数据处理能力。
二、实验原理药物分析是利用化学、物理和生物技术等方法,对药物及其制剂进行定性和定量分析的过程。
本实验采用高效液相色谱法(HPLC)对药物进行定性和定量分析。
高效液相色谱法是一种高效、灵敏、选择性好、应用范围广的分析技术,具有分离速度快、分辨率高、灵敏度高、重复性好等优点。
三、实验仪器与试剂1. 仪器:高效液相色谱仪、紫外检测器、色谱柱、自动进样器、色谱工作站、恒温水浴锅、分析天平、移液器、容量瓶等。
2. 试剂:药物样品、流动相(乙腈、水)、标准品、内标物、无水硫酸钠、磷酸二氢钠等。
四、实验步骤1. 样品前处理(1)称取一定量的药物样品,加入适量流动相溶解,超声处理,过滤。
(2)用移液器准确量取一定体积的滤液,加入适量内标物,混匀。
2. 标准曲线绘制(1)配制一系列不同浓度的标准溶液。
(2)将标准溶液依次进样,记录色谱图。
(3)以标准溶液浓度对峰面积进行线性回归,得到标准曲线。
3. 样品分析(1)将处理好的样品溶液依次进样,记录色谱图。
(2)根据标准曲线,计算样品中药物的含量。
五、实验结果与分析1. 标准曲线绘制以标准溶液浓度对峰面积进行线性回归,得到标准曲线方程为:y = 0.0015x + 0.0185,相关系数R² = 0.9988。
2. 样品分析根据标准曲线,计算样品中药物的含量为1.23 mg/g。
六、实验讨论1. 实验过程中,注意样品前处理方法的合理性,确保样品的准确性和稳定性。
2. 在实验过程中,保持仪器和试剂的清洁,避免污染。
3. 标准曲线的绘制对实验结果的准确性有很大影响,应严格控制标准溶液的配制和进样。
4. 本实验采用高效液相色谱法对药物进行定性和定量分析,具有操作简便、灵敏度高、选择性好等优点,适用于药物分析。
七、实验总结通过本次实验,掌握了药物分析的基本原理和方法,学会了运用高效液相色谱法对药物进行定性和定量分析。
药液稀释实验报告模板

一、实验目的1. 熟悉药液稀释的基本原理和方法。
2. 掌握不同比例药液稀释的计算方法。
3. 提高实验操作的准确性和规范性。
二、实验原理药液稀释是指将一定浓度的药液按照一定的比例稀释至所需浓度。
稀释过程中,药液中的有效成分质量不变,仅改变药液的浓度。
三、实验材料1. 原液:一定浓度的药液。
2. 稀释液:去离子水或其他适宜的溶剂。
3. 容量瓶:100mL、50mL等。
4. 移液管:10mL、1mL等。
5. 计时器。
6. 混合器。
四、实验步骤1. 根据实验要求,计算所需稀释液体积。
2. 使用移液管准确量取原液,放入容量瓶中。
3. 使用移液管准确量取稀释液,加入容量瓶中。
4. 轻轻摇晃容量瓶,使药液充分混合。
5. 记录稀释液的总体积。
6. 根据实验要求,重复上述步骤,配制不同浓度的药液。
五、实验结果与分析1. 记录每次实验的稀释比例、稀释液体积、总体积及最终药液浓度。
2. 分析实验数据,验证实验结果是否符合预期。
3. 如有偏差,分析原因,提出改进措施。
六、实验结论1. 通过本次实验,掌握了药液稀释的基本原理和方法。
2. 实验结果符合预期,说明稀释过程操作规范,计算准确。
3. 在实际操作中,应注意以下几点:a. 选择合适的容量瓶和移液管,确保量取的准确性;b. 在稀释过程中,避免药液溅出;c. 稀释后的药液需充分混合,确保均匀。
七、实验反思1. 在实验过程中,是否严格遵守操作规程?2. 是否注意了实验数据的准确性?3. 是否对实验结果进行了详细的分析?4. 在实验过程中,是否存在操作失误或意外情况?如何解决?八、实验总结本次实验通过药液稀释,使我们对药液稀释的基本原理和方法有了更深入的了解。
在实验过程中,我们掌握了操作规范,提高了实验操作的准确性和规范性。
同时,我们也认识到实验过程中需要注意的细节,为今后的实验工作奠定了基础。
药品分析报告

药品分析报告在如今飞速发展的医药行业中,药品的质量和安全性一直备受关注。
药品分析报告作为评估药品质量的重要依据,扮演着至关重要的角色。
本文将探讨药品分析报告的意义、内容以及其在药品质量监管中的作用。
一、药品分析报告的意义药品分析报告是通过科学仪器和技术对药品样品进行分析和检测,从而判断药品的成分、含量、纯度、特性等参数的一种报告。
这些结果对于判断药品质量的优劣、合规性以及安全性至关重要。
药品分析报告的主要目的是提供客观、准确的数据,为从事临床医学和科学研究的人员提供科学依据,确保患者用药的安全性和疗效。
二、药品分析报告的内容药品分析报告通常包括以下内容:1. 成分分析:对药品样本进行化学成分的分析,确认是否符合规定的成分标准。
这是检验药品是否合法、真实的重要环节。
2. 含量测定:对药品中各成分的含量进行测定,确保药品中各成分的含量符合规定的标准。
这有助于保证药品的稳定性和疗效。
3. 纯度测试:通过分析药品中的杂质含量来评估药品的纯度。
杂质可能会对药品的安全性和有效性产生不良影响,因此纯度测试是非常重要的环节。
4. 特性评估:对药品的物理性质、热稳定性、湿度敏感性等进行评估,以了解药物在不同环境和条件下的稳定性和变化情况。
5. 安全性评估:通过对药品样本进行毒理学测试,评估药品在体内的安全性,包括药品对人体器官、细胞和基因的毒性反应。
三、药品分析报告在药品质量监管中的作用药品分析报告在药品质量监管中发挥着不可替代的作用。
它们为监管机构提供可靠的数据,确保市场上的药品质量符合规定。
药品分析报告可以监测药品市场上出售的药品是否合规,是否含有过多的杂质、是否添加了未标明的成分等。
它们也可以为监管部门提供核查的依据和科学决策支持。
同时,药品分析报告还可以作为企业进行内部质量管理的重要参考。
企业可以通过药品分析报告对生产过程进行监控,确保产品质量的稳定性和一致性。
它们还可以作为企业与合作伙伴以及客户之间的交流和合作的依据,建立信任和合作关系。
药品分析报告

药品分析报告1. 引言本药品分析报告旨在对某药品进行全面的分析,包括成分分析、药理学评价、药代动力学研究等方面。
通过这些分析结果,可以有效评估该药品的安全性和疗效,为临床应用提供参考依据。
2. 药品成分分析该药品的成分分析是对其化学成分进行鉴定和定量的过程。
通过使用合适的仪器和方法,可以确定药品中各种成分的含量及其相对比例。
成分分析对于确认药品的质量和一致性至关重要。
3. 药理学评价药理学评价是对药品在生物体内的作用和机制进行研究的过程。
通过实验和观察,可以评估药品对特定生物体的药效、副作用和安全性等方面的影响。
药理学评价是药物研发和临床应用的基础。
4. 药代动力学研究药代动力学研究是对药物在生物体内的吸收、分布、代谢和排泄等方面的过程进行研究的科学。
通过药代动力学研究,可以了解药物在人体内的药物浓度变化规律,评估其药效和毒副作用的关系,从而制定药物的合理使用方案。
5. 结论根据对该药品进行的分析,可以得出以下结论:•该药品经过成分分析,确认了其主要成分及相对比例。
•药理学评价显示该药品对目标生物体具有一定的药效,并存在一定的副作用和安全性问题。
•药代动力学研究结果表明,药物的代谢和排泄过程符合一定的动力学规律。
6. 建议和展望根据对该药品的分析结果,提出如下建议:•进一步优化药品配方,降低副作用的发生率。
•加强对药品的监测和评估,确保其安全性和有效性。
•继续进行进一步的药理学研究,以进一步了解药品的作用机制和潜在的临床应用前景。
7. 参考文献[1] Smith A, Jones B. Analysis of Drug A. Journal of Pharmaceutical Sciences, 2010, 100(2): 500-505.[2] Johnson C, et al. Pharmacokinetic Study of Drug B in Humans. Clinical Pharmacokinetics, 2012, 42(4): 235-241.[3] Yang X, Wang Y. Pharmacological Evaluation of Drug C in Animal Models. Journal of Pharmacology and Experimental Therapeutics, 2015, 350(1): 100-108.8. 附录8.1 药品成分分析实验方法•材料:药品样品、色谱柱、质谱仪等。
药物分析实验报告

实验四苯甲酸钠的含量测定一、目的掌握双相滴定法测定苯甲酸钠含量的原理和操作二、操作取本品1.5g,精密称定,置分液漏斗中,加水约25mL,乙醚50mL与甲基橙指示液2滴,用盐酸滴定液 (0.5mol/L)滴定,随滴随振摇,至水层显持续橙红色,分取水层,置具塞锥形瓶中,乙醚层用水5mL洗涤,洗涤液并入锥形瓶中,加乙醚20mL,继续用盐酸滴定液(0.5mol/L)滴定,随滴随振摇,至水层显持续橙红色,即得,每1mL的盐酸滴定液(0.5mol/L)相当于72.06mg的C7H5O2Na。
本品按干燥品计算,含C7H5O2Na不得少于99.0%三、说明1.苯甲酸钠为有机酸的碱金属盐,显碱性,可用盐酸标准液滴定。
COO Na+H C l COOH+N aC l在水溶液中滴定时,由于碱性较弱(Pk b=9.80)突跃不明显,故加入与水不相溶混的溶剂乙醚提除反应生成物苯甲酸,使反应定量完成,同时也避免了苯甲酸在瓶中析出影响终点的观察。
2.滴定时应充分振摇,使生成的苯甲酸转入乙醚层。
3.在振摇和分取水层时,应避免样品的损失,滴定前,应用乙醚检查分液漏斗是否严密。
四、思考题1.乙醚为什么要分两次加入?第一次滴定至水层显持续橙红色时,是否已达终点?为什么?2.分取水层后乙醚层用5mL水洗涤的目的是什么?实验五阿司匹林片的分析一、目的1.掌握片剂分析的特点及赋形剂的干扰与排除方法。
2.掌握阿司匹林片鉴别、检查、含量测定的原理及方法。
二、操作[鉴别]1.取本品的细粉适量(约相当于阿司匹林0.1g),加水10mL煮沸,放冷,加三氯化铁试液1滴,即显紫堇色。
2.取本品的细粉(约相当于阿司匹林0.5g),加碳酸钠试液10mL,振摇后,放置5分钟,滤过,滤液煮沸2分钟,放冷,加过量的稀硫酸,即析出白色沉淀,并发生醋酸的臭气。
[检查]游离水杨酸取本品的细粉适量(约相当于阿司匹林0.1g),加无水氯仿3mL ,不断搅拌2分钟,用无水氯仿湿润的滤纸滤过,滤渣用无水氯仿洗涤2次,每次1mL ,合并滤液与洗液,在室温下通风挥发至干;残渣用无水乙醇4mL 溶解后,移至100mL 量瓶中,用少量5%乙醇洗涤容器、洗液并入量瓶中,加5%乙醇稀释至刻度,摇匀,分取50mL ,立即加新制的稀硫酸铁铵溶液 [取盐酸液(1mol/L)1mL ,加硫酸铁铵指示液2mL 后,再加水适量使成100mL] 1mL ,摇匀;30秒钟内如显色,与对照液(精密称取水杨酸0.1g ,置1000mL 量瓶中,加冰醋酸1mL ,摇匀,再加水适量至刻度,摇匀,精密量取1.5mL ,加无水乙醇2mL 与5%乙醇使成50mL ,再加上述新制的稀硫酸铁铵溶液1mL ,摇匀)比较,不得更深。
注射液研究报告

注射液研究报告注射液研究报告一、引言注射液是一种重要的药物剂型,广泛应用于临床治疗中。
本次研究旨在调查和分析市场上常见的注射液品种,评估其质量和安全性。
二、方法1. 样品收集:从市场上购买了红霉素注射液、氯化钠注射液和头孢菌素注射液共计10个样品。
2. 质量指标分析:采用药典方法对样品进行外观、pH值、溶解度、纯度等指标的测定。
3. 安全性评估:通过测定重金属、霉菌和细菌的含量来评估样品注射液的安全性。
三、结果1. 外观质量:10个样品的外观均符合规定,无悬浮物或沉淀的现象。
2. pH值:红霉素注射液和头孢菌素注射液的pH值均符合规定,氯化钠注射液中有2个样品的pH值略高于规定范围。
3. 溶解度:样品中的溶解度均满足规定的要求。
4. 纯度:样品中未检测到杂质或有害组分。
5. 重金属:所有样品中重金属的含量均低于规定的限量。
6. 霉菌和细菌:所有样品的检测结果均未见异常,符合规定的微生物限度。
四、讨论本研究结果表明,市场上购买的这些常见注射液品种在质量和安全性方面基本符合规定要求。
大部分样品的外观、溶解度、纯度等指标均符合规定,其中氯化钠注射液pH值稍高的样品可能是由于生产工艺等原因引起的。
五、结论本次研究结果显示,市场上购买的红霉素注射液、氯化钠注射液和头孢菌素注射液样品的质量和安全性基本达到要求。
但需要进一步加强对氯化钠注射液pH值的控制,以提高其质量的稳定性。
针对其他注射液品种,仍需进一步的研究和评估。
六、参考文献[1] 中华人民共和国药典.2015版.七、致谢感谢参与本研究的团队成员对样品的收集和实验的支持。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
附件十四 附件十四
附件八 附件九 附件十 附件十八 附件十一 附件七 附件十二
如未盖蓝色资料室发文章即为非管制文件或参考用,不作更新之服务
统盟()电子
版本编号 CB-3-CH-002 版 次D
化验室药液分析作业标准
修定日期 2009 年 03 月 28 日 页 次 第4 页 , 共 6 页
在标准围,若超出围须立即通知各单位调整,并会
签品保部门,制造部药水调整后主动回复品保部并
取样至化验室复验,品保部须负监督之责。 6-4-7 无玻璃仪器操作规
8-13 水质检验
调整参考资料及附件
文件适用单位
单 位
总 经 理 室
制 造 部
工 程 部
品 保 部
业 务 部
管 理 部
资 材 部
资 讯 部
财 务 部
如未盖蓝色资料室发文章即为非管制文件或参考用,不作更新之服务
统盟()电子
版本编号 版次
化验室药液分析作业标准
修定日期 页次
CB-3-CH-002 D 2009 年 03 月 28 日 第5页 , 共 6 页
七.参考资料: 7-1 外层前处理微蚀槽药液分析操作规 7-2 压合蚀薄铜线药液分析操作规 7-3 压合水平棕化线药液分析操作规 7-4 电镀 PTH 线药液分析操作规 7-5 电镀一铜线药液分析操作规 7-6 防焊显影线药液分析操作规 7-7 防焊/成型清洗线/喷砂线药液分析操作规 7-8 药品配制操作规 7-9 化金化镍浸金线药液分析操作规 7-10 电镀 VCP 线药液分析操作规 7-11 化金化镍浸金二线药液分析操作规 7-12 外层蚀刻线药液分析操作规 7-13 玻璃仪器操作规 7-14 电镀九铜线药液分析操作规
本作业标准由化验室单位主管审查,经部级主管核准后发行。
五.流程图:
负责单位
流程图
日常化驗工作
異常化驗需求
相关文件
化验室&品保部 &制造部
品保部
化验室
化驗室採樣 化驗分析 NG
责任制程 化验室
數據計算
OK
化验室
文件簽核
正本
副本
化驗室存檔
化验室
製程存檔
品保單位 品管流程
責任製程
分析作业规& 分析记录表
依各制程品管 检验流程
二. 通用围:
厂区药液分析适用。
适用制程:
CB-3-CH-002
D 2009 年 03 月 28 日 第1 页 , 共 6 页
生产单位
制程别
槽别
层课 压合课
前处理 蚀刻线 水平棕化 A&B 线 蚀薄铜线 Desmear&PTH 线
微蚀槽 药水槽 药水槽 微蚀槽 药水槽
电镀课
防焊课 干膜课 化金课 成型课
关 务 部
2
发行管制章
如未盖蓝色资料室发文章即为非管制文件或参考用,不作更新之服务
版次 修订理由
修改容摘要
修订页次 修订日期
修改后:
新增二、厂区药液分析适用制程层蚀刻线,干膜课蚀
刻线,防焊前处理,成型 OSP,电镀 VCP 线
删除二、厂区药液分析适用制程电镀课 PTH 检测实验
新增 6-1-1 分析时机层蚀刻线,干膜课蚀刻线,防焊
参考资料一 参考资料二 参考资料三 参考资料四 参考资料五 参考资料六 参考资料七 参考资料八 参考资料九 参考资料十 参考资料十一
参考资料十二 参考资料十三 参考资料十四
如未盖蓝色资料室发文章即为非管制文件或参考用,不作更新之服务
统盟()电子
版本编号 版次
化验室药液分析作业标准
修定日期 页次
八.附件:
如未盖蓝色资料室发文章即为非管制文件或参考用,不作更新之服务
版次 修订理由
修改容摘要
修订页次 修订日期
修改前:
二、厂区药液分析适用制程无层蚀刻线,干膜课蚀
刻线,防焊前处理,成型 OSP,电镀 VCP 线
厂区药液分析适用制程电镀课 PTH 检测实验
6-1-1 分析时机无层蚀刻线,干膜课蚀刻线,防焊
前处理,成型 OSP,电镀 VCP 线
发行 份数
2
总页次
6
版次 修订理由
修改容摘要
修订页次 修订日期
修改前: 附表 8-19 化验室 需求单(附件十九)
B 符合实际作业需求
P6 2007.11.15
修改后: 附表 8-19 水质检验 (附件十九)
文件适用单位
单 位
总制工品业管资资财关
经 理
造
程
保
务
理
材
讯
务
务
室部部部部部部部部部
2
发行管制章
6-1-2 非排定之化验需求:各制程依产线需求或当药液出现管制异常时,得以填写化
验需求单(如附件十六),并自行送至化验室待验,并请通知品管加强该时段所
生产之品质进行确认。
6-2 分析方法
6-2-1 药液分析:各制程分析是依据供货商所提供之分析方法及 CNS 检验标
准订定分析作业规,并于各规中加注泛用之制程(如参考资料一~参
药水槽
电镀槽 预浸槽 预浸槽
八小时
十二小时全线检 测、部份槽别每四
小时检测
十二小时
十二小时 十二小时
镀铜 A 槽 十二小时
预浸槽 镀铜 B 槽 酸洗槽 显影槽 微蚀槽 药水槽
药水槽
药水槽
十二小时 十二小时
八小时
八小时
八小时 十二小时
十二小时全线检 测、部份槽别每四
小时检测
十二小时
纪录表 附件一 附件十七 附件二 附件三 附件四、五
製程送樣 化驗分析
化验需求单 NG
分析作业规
數據計算
OK
電腦存檔
分析记录表
如未盖蓝色资料室发文章即为非管制文件或参考用,不作更新之服务
统盟()电子
化验室药液分析作业标准
版本编号 版次 修定日期
页次
CB-3-CH-002
D
2009 年 03 月 28 日 第3 页 , 共 6 页
六.容: 6-1 分析时机 6-1-1 日常化验时机:依各制程所排定之分析频率进行化验,说明如下:
统盟()电子
版本编号 CB-3-CH-002
版 次D
化验室药液分析作业标准
修定日期 2009 年 03 月 28 日 页 次 第2 页 , 共 6 页
四.权责:
化验室:负责厂药水分析、资料计算、文件存查及化验室相关工作
制造部:负责药水调整、更新、SPC 资料整理、异常处置及保养…等工作
品保部:药水管制发生异常确认该时期之品质及监督是否立即改善
8-1 层课 前处理微蚀槽分析记录表
8-2 压合课 水平棕化线分析记录表
8-3 压合课 蚀薄铜线分析记录表
8-4 电镀课 PTH 线检验分析记录表 第一次 8-5 电镀课 PTH 线检验分析记录表 第二次 8-6 电镀课 电镀一铜 A 线分析记录表
规中加注泛用之制程(如参考资料一~参考资料十
二),并将分析数据记录于相关之记录表(如附件一~
C
符合实际作业 需求
附件十七) 6-3-1 化验室依分析时机及频率进行生产线各制程药
P1.P2.P3.P 4.P5.P6
2008.07.10
水之分析,槽液分析发现异常时,需先通知现场主管
注意制程品质,并再重复化验以确认分析数据,若二
统盟()电子
YANGTECH(WUXI) ELECTRONICS CO., LTD.
文件编号 文件名称
CB-3-CH-002
化验室药液分析作业标准
文 系统文件
件 类
程序文件
别 规文件
生效日期
2009 年 03 月 28 日
申请单位
文管中心
性质 文件变更
文件废止
版次
C
申请单位 拟案
品管课
审查
核准 文管中心 核准
2009.3.28
分析操作规
新增参考资料 7-14 电镀九铜线药液分析操
作规
新增附件 8-7 化金二线(OMG)药液分析记
录表
新增附件 8-14 电镀九铜线分析记录表
修改参考资料 7-1 外层前处理微蚀槽药水规
格围
修改参考资料 7-6 防焊显影药液分析操作规
显影槽规格围
修改附件 8-1,8-9,8-10 记录表
考资料十四),并将分析数据记录于相关之记录表(如附件一~附件十
八)。
6-3 化验管制办法
6-3-1 化验室依分析时机及频率进行生产线各制程药水之分析,槽液分析发 现异常时,需先通知现场主管注意制程品质,并再重复化验以确认分 析数据,若二次化验分析资料均异常时,需即刻通知现场主管或制造 部主管,采取紧急应变措施,若药液超出管制界限需立即进行调整, 若超出规格界限则产线需立即停线调整并主动送样至化验室进行复 验。
次化验分析资料均异常时,需即刻通知现场主管或制
造部主管,采取紧急应变措施,若药液超出管制界限
需立即进行调整,若超出规格界限则产线需立即停线
调整并主动送样至化验室进行复验。
6-3-2 药水化验不合格需填写药水异常通知单,化验
复验合格交品管课主管签名(含组长以上)才能复线.
6-3-3 针对化验结果超出规格界限时所产生的产品,
由品管单位及相应制程单位配合进行相关的可靠度试
验,确保品质无问题的情况下再移转到下制程生产
6-4-7 玻璃仪器操作规
文件适用单位
单 位
总 经 理 室
制 造 部
工 程 部
品 保 部
业 务 部
管 理 部
资 材 部
