常见化学反应式与物质特徵
常见的化学反应

常见的化学反应——燃烧1. 燃烧的定义回忆木炭、红磷、铁丝在氧气中燃烧的现象燃烧的特征可以归纳为:发光、放热、生成新物质。
燃烧的定义:燃烧是一种发光、放热的剧烈的化学反应。
注意:(1)燃烧不一定要有氧气参加;(2)物质在燃烧过程中一定有发光、发热现象产生,但有发光、发热现象的不一定是燃烧,比如电灯通电发光、发热;(3)并不是所有的物质燃烧都有火焰产生,那些不易挥发的、不易分解的固体,如红磷、铁丝等燃烧时就没有火焰。
2. 燃烧和人类生产生活的关系人们利用可燃物燃烧时发出的光和热来照明、取暖、烧煮食物、冶炼钢铁等,燃烧能够造福于人类,但是一旦失控,也会给人类带来灾难。
据2000年到2006年统计,每年大约有5万人次死于火灾,随着人数的增长,科学的进步,现在已经降低到2-4万人次,每年经济损失超过200亿元。
3. 燃烧的条件先来看一个实验物质燃烧需要同时满足三个条件:(1)物质具有可燃性;(2)可燃物与氧气接触;(3)可燃物的温度达到燃烧所需的最低温度(着火点)。
说明:(1)三个条件同时满足,缺一不可,否则燃烧不能发生;(2)着火点是物质本身的固有属性,一般不随外界条件的变化而变化;(3)燃烧本身是一个化学反应,燃烧的条件实质就是化学反应的条件——反应物和反应条件。
4. 完全燃烧与不完全燃烧(1)完全燃烧与不完全燃烧(不充足)(2)物质完全燃烧的条件1)增大氧气的浓度;2)增大可燃物与氧气的接触面积。
(3)燃料完全燃烧的意义1)增加能源的使用效率,使有限的能源发挥最大的作用;2)降低环境污染的程度。
燃料燃烧时会产生一氧化碳等有毒气体,不仅污染环境,还危害人体健康。
当固体燃料不充分燃烧时还会增加烟尘的排放而加重环境污染。
注意:虽然燃烧需要足量的空气或氧气,但这些气体的通入量也要适当,否则,过量的气体会带走部分热量,同样会造成浪费。
5. 一氧化碳一氧化碳的性质:一氧化碳的来源:燃料的不完全燃烧、汽车尾气的排放、管道煤气泄漏等都会增加空气中一氧化碳的含量。
常见无机化学反应归纳

高中化学常见无机化学反应归纳1.与碱反应产生气体 (1) (2)铵盐:O H NH NH 234+↑−→−+碱2.与酸反应产生气体(1) (2) ()()()2332222332H H H CO HCO CO S HS H S SO HSO SO +++------⎧−−→↑⎪⎪−−→↑⎨⎪−−→↑⎪⎩化合物 3.Na 2S 2O 3与酸反应既产生沉淀又产生气体: S 2O 32-+2H +=S ↓+SO 2↑+H 2O 4.与水反应产生气体(1)单质(2)化合物 5.强烈双水解6.既能酸反应,又能与碱反应(1)单质:Al (2)化合物:Al 2O 3、Al(OH)3、弱酸弱碱盐、弱酸的酸式盐、氨基酸。
7.与Na 2O 2反应8.2FeCl 3+H 2S=2FeCl 2+S ↓+2HCl⎪⎪⎩⎪⎪⎨⎧↑+=++↑+=++↑−−→−-232222222232222H SiO Na O H NaOH Si H NaAlO O H NaOH Al H Si Al OH 、单质⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎪⎨⎧⎪⎪⎩⎪⎪⎨⎧⎪⎩⎪⎨⎧↑↑−−→−↑−−−→−⎪⎩⎪⎨⎧↑↑−−→−↑↑−−−→−⎪⎩⎪⎨⎧↑↑−−→−↑−−−→−↑−−→−2222222222342342342NO SO SO S CO NO CO SO C NO NO SO H HNO SO H HNO SO H HNO SO H HCl 、、、非金属、金属单质浓浓浓浓浓⎪⎩⎪⎨⎧↑+=+↑+=+22222422222O HF O H F H NaOH O H Na ()()()⎪⎪⎩⎪⎪⎨⎧↑+=+↑+↓=+↑+↓=+↑+=+22222232323222322222326233422H C OH Ca O H CaC S H OH Al O H S Al NH OH Mg O H N Mg O NaOH O H O Na ()()()()()⎪⎩⎪⎨⎧↓−−→−↓+↑−−→−↓+↑−−→−-----+32322323233222OH Al AlO OH Al S H HS S OH Al CO HCO CO Al O H O H O H 与⎪⎩⎪⎨⎧+↑−−→−+↑−−→−NaOH O CO Na O O H CO 2322229.电解10.铝热反应:Al+金属氧化物−−→−高温金属+Al 2O 3 11. Al 3+ Al(OH)3 AlO 2-12.归中反应:2H 2S+SO 2=3S+2H 2O4NH 3+6NO −−→−催化剂4N 2+6H 2O13.置换反应:(1)金属→金属 (2)金属→非金属 (3)非金属→非金属 (4)非金属→金属14、一些特殊的反应类型:⑴ 化合物+单质 化合物+化合物 如:Cl 2+H 2O 、H 2S+O 2、、NH 3+O 2、CH 4+O 2、Cl 2+FeBr 2⑵ 化合物+化合物 化合物+单质NH 3+NO 、H 2S+SO 2 、Na 2O 2+H 2O 、NaH+H 2O 、 Na 2O 2+CO 2、CO+H 2O⑶ 化合物+单质 化合物PCl 3+Cl 2 、Na 2SO 3+O 2 、FeCl 3+Fe 、FeCl 2+Cl 2、CO+O 2、Na 2O+O 214.三角转化:15.受热分解产生2种或3种气体的反应:(1)铵盐 (2)硝酸盐 16.特征网络:(1))(222酸或碱D C B A O H O O −−→−−→−−→−①323222HNO NO NO NH OH O O −−→−−→−−→−(气体) ()⎪⎪⎩⎪⎪⎨⎧↑+↑+−−→−↑+−−→−↑+↑−−→−22232222H Cl NaOH NaCl O Al O Al O H O H 电解电解电解溶液熔融⎩⎨⎧+→+铝热反应盐金属盐金属.2.1⎪⎩⎪⎨⎧+−−→−+↑−−−→−+C MgO CO Mg H Fe Mg Na O H H 22222点燃或)、、活泼金属(⎪⎪⎩⎪⎪⎨⎧+=++−−→−++−−→−+↑+=+)、(、高温高温HI HBr HCl S S H I Br Cl H CO O H C CO Si SiO C O HF O H F 2)(224222222222222⎪⎩⎪⎨⎧+−−→−++−−→−+222CO C O H H 金属金属氧化物金属金属氧化物高温高温⎪⎩⎪⎨⎧↑+↑−→−+↑+↑−→−+↑+↑−→−∆∆∆S H NH S NH HS NH OH SO NH SO NH HSO NH O H CO NH CO NH HCO NH 232442233243422332434])[(])[(])[(⎪⎩⎪⎨⎧↑+↑+−→−↑+↑+−→−∆∆223222322242)(2O NO Ag AgNO O NO CuO NO Cu②42322222SO H SO SO S H O H O O −−→−−→−−→−(气体)③322222CO H CO CO C OH O O −−→−−→−−→−(固体) ④NaOH O Na O Na Na OH O O −−→−−→−−→−222222(固体) (2)A —A 为弱酸的铵盐:(NH 4)2CO 3或NH 4HCO 3; (NH 4)2S 或NH 4HS ;(NH 4)2SO 3或NH 4HSO 3(3)无机框图中常用到催化剂的反应:322223322222223236454222232222NH H N OH NO O NH SO O SO O O H O H O KCl KClO MnO MnO −−−→−++−−−→−+−−−→−+↑+−−→−↑+−−−→−∆∆∆∆催化剂,催化剂,催化剂,,17.关于反应形式的联想:1.热分解反应:典型的特征是一种物质加热含有电解熔融的Al 2O 3来制备金属铝、电解熔融的NaCl 来制备金属钠。
常见化学反应式与物质特徵

常見化學反應式與物質特徵 常見化學方程式:
(一)化合反應:A+B→C
(二)分解反應:C→A+B+....
(五)電解及電池反應
常見物質的特徵:
(一)顏色、氣味:
1.紅色:紅磷、Cu、Fe2O3
2.黃色:S、含有Fe3+鹽的溶液
3.藍色:CuSO4·5H2O、含有Cu2+鹽的溶液
4.黑色:木炭C、Fe粉、氧化銅CuO、二氧化錳MnO2、氧化鐵Fe3O4
5.白色:BaSO4、AgCl、MgO、P2O5、CaO、NaOH、Ca(OH)2、CaCO3、KCl、NaCl、BaCO3、CuSO4、Na2CO3、NaHCO3……等
6.無色氣體:空氣、O2、H2、CO2、CO、CH4、N2、SO2
7.刺激性氣味氣體:SO2、NH3、HCl、HNO3。
8.無色:乾冰以及大部分酸、鹼、鹽的溶液和酒精、乙酸的溶液。
(二)焰色:
1.非金屬:氫氣(淡藍色火焰)、硫(藍紫色火焰)、磷(黃色火焰)
2.金屬:鈉(黃色火焰)、鎂(耀眼白光)、鋅(黃綠色火焰)、
銅(綠色火焰,本身不燃燒)
(三)物質的學名、俗名及對應的化學式:
Hg汞(水銀)、CO2二氧化碳(乾冰)、CO一氧化碳(煤氣)、CH4甲烷(沼氣天然氣)、CaO氧化鈣(生石灰)、Ca(OH)2氫氧化鈣(熟石灰、消石灰)、CaCO3碳酸
鈣(石灰石、大理石、灰石、石灰岩)、NaCl氯化鈉(食鹽)、C2H5OH乙醇(酒精)、CH3COOH乙酸(醋酸)、NaOH氫氧化鈉(燒鹼、苛性鈉)、Na2CO3碳酸鈉(純鹼、
蘇打)、NaHCO3碳酸氫鈉(小蘇打)、HCl氫氯酸(鹽酸)、K2CO3碳酸鉀(草木灰主
要成分)、HCOOH甲酸、CaSO4硫酸鈣(石膏)。
化学方程式的反应类型特点及解释

化学方程式的反应类型特点及解释化学方程式是描述化学反应过程的简单表示方法。
它由反应物、生成物和反应条件等组成。
化学方程式中含有的反应类型是根据化学反应发生的方式和转化物质的特点进行分类的。
首先,我们来了解一下化学反应的基本概念。
化学反应是指物质之间发生的变化,新的物质被产生出来。
化学反应的特点包括反应物的消失和生成物的出现,化学键的重新组合等。
根据化学反应的过程和反应物的性质,化学方程式可以分为下面几种反应类型。
1. 合成反应(Combination reaction):指两个或两个以上的物质结合在一起形成一个新的物质,例如:A +B -> AB2. 分解反应(Decomposition reaction):指一个物质分解成两个或两个以上的物质,例如:AB -> A + B3. 双替换反应(Double displacement reaction):指两个物质交换部分或全部成分,生成两个新的物质,例如:AB + CD -> AD + CB4. 离子反应(Ion exchange reaction):指在反应物中存在电离的离子,反应过程中离子发生交换,生成新的离子物质,例如:AgNO3 + NaCl -> AgCl + NaNO35. 氧化还原反应(Redox reaction):指化学反应中原子重新组合形成新物质,同时发生电荷的转移,例如:Cu + 2HCl -> CuCl2 + H26. 酸碱中和反应(Acid-base neutralization reaction):指酸和碱反应产生盐和水,例如:HCl + NaOH -> NaCl + H2O这些反应类型代表了化学反应的常见方式,每一种反应类型都有其独特的特点和解释。
例如,合成反应是指两个或两个以上的物质结合在一起形成一个新的物质,这是因为反应物之间能够发生吸引力。
分解反应则是一个物质分解成两个或两个以上的物质,这可能是因为该物质不稳定,需要分解成更稳定的物质。
科学初步认识简单的化学反应

科学初步认识简单的化学反应化学反应是物质之间发生的转化过程,其中涉及到原子、分子之间的重新组合、键的断裂和形成。
通过对化学反应的研究,人类能够更深入地了解物质的性质和变化规律。
本文将介绍几种常见的简单化学反应,以及它们的基本原理和实际应用。
一、酸碱中和反应酸碱中和反应是指在酸和碱之间发生的化学反应,产物为盐和水。
其反应式可以表示为:酸(H+)+碱(OH-)→盐+水。
这种反应常用于酸碱中和反应实验和各类中和药剂的制备过程。
例如,氢氧化钠(NaOH)和盐酸(HCl)反应生成氯化钠(NaCl)和水(H2O)。
二、氧化还原反应氧化还原反应是指物质在电子转移过程中发生氧化或还原的反应。
氧化是指物质失去电子,而还原是指物质获得电子。
常见的氧化还原反应有金属与非金属的反应、金属与酸的反应等。
例如,铁(Fe)与氧气(O2)反应生成氧化铁(Fe2O3),这是一种典型的氧化反应。
三、置换反应置换反应是指一种元素或原子团取代另一种元素或原子团的反应。
置换反应常见的有单一置换反应和双重置换反应。
单一置换反应是指一种元素取代了化合物中的另一种元素,其反应式可以表示为:A + BC → AC + B。
双重置换反应是指两种化合物中的正离子和负离子重新组合形成两个新的化合物,其反应式可以表示为:AB + CD → AD + CB。
置换反应广泛应用于工业生产和实验室合成中。
四、水解反应水解反应是指化合物在水中发生离解并与水反应,产生新的化合物的反应。
常见的水解反应有酸水解和盐水解两种反应。
酸水解是指酸与水反应产生酸根离子的过程,例如硫酸与水反应生成硫酸根离子(HSO4-)。
盐水解是指盐与水反应产生酸碱的过程,例如氯化钠与水反应生成氢氧化钠(NaOH)和盐酸(HCl)。
五、聚合反应聚合反应是指单体(小分子)通过共价键的形成而合成高分子化合物的过程。
这种反应也被称为缩合反应。
聚合反应是合成高分子材料的重要方法,例如合成塑料和合成纤维。
高中化学各反应公式

高中化学各反应公式1.氧化还原反应:氧化还原反应是指物质中的电子转移过程。
反应中氧化剂得到电子,另一物质则失去电子,称为还原剂。
常见的氧化还原反应包括:-燃烧反应:燃料与氧气反应生成二氧化碳和水。
例如:C3H8+5O2→3CO2+4H2O-金属与非金属氧化物反应:金属与非金属氧化物反应生成金属氧化物。
例如:2Mg+O2→2MgO-金属与酸反应:金属与酸反应生成盐和氢气。
例如:Zn+2HCl→ZnCl2+H22.酸碱反应:酸碱反应是指酸与碱反应生成盐和水的化学反应。
常见的酸碱反应包括:-酸与碱反应:酸和碱的中和反应。
例如:HCl+NaOH→NaCl+H2O-酸与金属碱反应:酸与金属碱反应生成盐和水。
例如:2HCl+Mg(OH)2→MgCl2+2H2O-酸与碳酸盐反应:酸与碳酸盐反应生成盐、水和二氧化碳。
例如:H2SO4+CaCO3→CaSO4+H2O+CO23.氧化反应:氧化反应是指物质中的氧原子数增加的反应。
常见的氧化反应包括:-金属与氧气反应:金属与氧气反应生成金属氧化物。
例如:2Mg+O2→2MgO-非金属与氧气反应:非金属与氧气反应生成氧化物。
例如:C+O2→CO2-有机物的燃烧反应:有机物与氧气反应生成二氧化碳和水。
例如:C3H8+5O2→3CO2+4H2O4.还原反应:还原反应是指物质中的氧原子数减少的反应。
常见的还原反应包括:-金属与非金属氧化物反应:金属与非金属氧化物反应生成金属。
例如:2Fe2O3+3C→4Fe+3CO2-金属与酸反应:金属与酸反应生成氢气。
例如:Zn+2HCl→ZnCl2+H2-还原剂还原反应:还原剂失去电子,被氧化剂得到电子。
例如:2Na+Cl2→2NaCl5.沉淀反应:沉淀反应是指反应物中溶解度较低的产物在溶液中析出而生成的反应。
常见的沉淀反应包括:-阴离子交换反应:两种溶液中有交换离子的反应。
例如:AgNO3+NaCl→AgCl↓+NaNO3-阳离子交换反应:两种溶液中有交换离子的反应。
化学反应类型与特征

化学反应类型与特征化学反应是化学变化的基本形式之一。
在我们的日常生活中,化学反应无处不在,它们对于我们理解和改变物质世界起着重要作用。
在化学研究和实践中,了解化学反应的类型和特征非常重要。
本文将介绍几种常见的化学反应类型及其特征。
一、氧化还原反应氧化还原反应是指化学物质中的原子或离子的氧化态和还原态发生变化的反应。
在这类反应中,电子从一个物质转移到另一个物质,同时伴随着反应物的氧化和还原。
氧化还原反应是化学反应中最常见和重要的类型之一。
其特征包括:1. 氧化反应:某个物质失去电子或增加氧原子。
2. 还原反应:某个物质获得电子或减少氧原子。
3. 氧化剂:能使其他物质氧化的物质。
4. 还原剂:能使其他物质还原的物质。
二、酸碱中和反应酸碱中和反应是指酸和碱之间发生的反应,生成盐和水。
这类反应中,酸和碱的氢离子和氢氧根离子互相结合,形成水分子。
酸碱中和反应的特征包括:1. 酸:具有酸性质的物质,能提供氢离子(H+)。
2. 碱:具有碱性质的物质,能提供氢氧根离子(OH-)。
3. 酸碱中和:酸和碱的氢离子和氢氧根离子相互结合,生成水分子。
4. 盐:酸和碱中和反应的产物,由阳离子和阴离子组成。
三、置换反应置换反应是指在反应中,原有物质中的某个离子被新的离子取代的反应。
常见的置换反应包括单一取代反应和双重取代反应。
其特征包括:1. 单一取代反应:反应物中的一个元素被其他元素取代。
2. 双重取代反应:反应物中的两个元素相互取代。
3. 离子置换:反应中的原子或离子发生排列重组。
四、加合反应与析合反应加合反应是指两个或多个物质结合形成一个新的物质的反应。
析合反应则是指一个物质分解为两个或多个新物质的反应。
加合反应与析合反应的特征包括:1. 加合反应:物质间的原子或离子结合,形成新的化合物。
2. 析合反应:一个物质分解为两个或多个化合物。
3. 反应热效应:加合反应常常伴随放热,析合反应常常吸收热量。
五、聚合与分解反应聚合反应是指在反应中,小分子结合成大分子的过程。
常见的化学反应类型及其特征

常见的化学反应类型及其特征在我们的日常生活和科学研究中,化学反应无处不在。
从食物的消化到工业生产中的各种过程,化学反应都扮演着至关重要的角色。
了解常见的化学反应类型及其特征,有助于我们更好地理解世界、解决问题和推动科学技术的发展。
一、化合反应化合反应是指两种或两种以上的物质生成一种新物质的反应。
简单来说,就是多个“小伙伴”手拉手变成了一个“大集体”。
例如,氢气和氧气在点燃的条件下发生化合反应生成水:H₂+O₂点燃 2H₂O。
化合反应的特征通常表现为反应物的种类增多,生成物的种类减少。
在这个过程中,往往会伴随着能量的变化,可能是吸热,也可能是放热。
二、分解反应与化合反应相反,分解反应是一种物质生成两种或两种以上其他物质的反应。
就好像一个“大集体”分裂成了多个“小伙伴”。
比如,电解水生成氢气和氧气:2H₂O 通电 2H₂↑ + O₂↑ 。
分解反应的特征是反应物的种类减少,生成物的种类增多。
同样,也会有能量的变化。
三、置换反应置换反应是一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应。
可以想象成是“单质小伙伴”和“化合物小伙伴”交换了“伙伴”。
例如,铁和硫酸铜溶液反应生成硫酸亚铁和铜:Fe + CuSO₄=FeSO₄+ Cu 。
置换反应的特征是单质和化合物反应生成新的单质和新的化合物。
在金属活动性顺序表中,位于前面的金属能够把位于后面的金属从它们的盐溶液中置换出来。
四、复分解反应复分解反应是由两种化合物互相交换成分,生成另外两种化合物的反应。
这就像是两个“化合物小伙伴”互相交换了“部分成员”。
比如,盐酸和氢氧化钠反应生成氯化钠和水:HCl + NaOH =NaCl + H₂O 。
复分解反应要发生,通常需要满足一定的条件,比如生成物中要有沉淀、气体或水生成。
五、氧化还原反应氧化还原反应是在反应前后元素的氧化数具有相应的升降变化的化学反应。
这种反应涉及到电子的转移。
比如,铜在空气中加热生成氧化铜:2Cu + O₂加热 2CuO ,在这个反应中,铜失去电子被氧化,氧气得到电子被还原。
九年级常见物质化学式和化学方程式
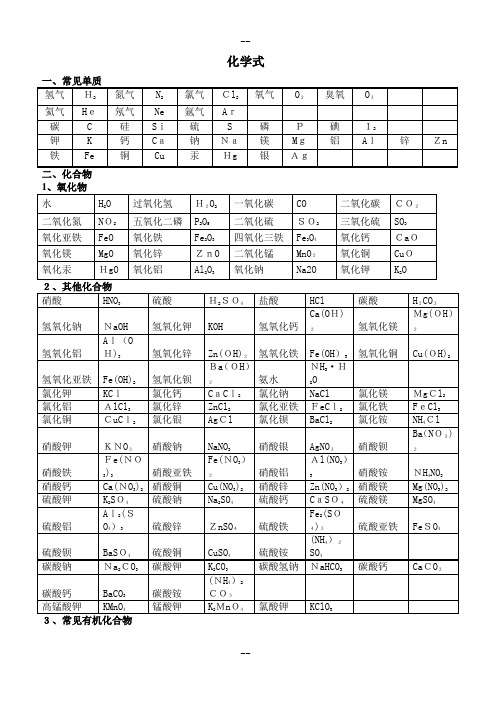
化学式化学方程式一、化合反应1、红磷在空气(或氧气)中燃烧:4P + 5O2 2P2O52、氢气在空气中燃烧生成水:2H2 + O22H2O3、硫磺在空气(或氧气)中燃烧:S +O2 SO24、镁条在空气(或氧气)中燃烧:2Mg + O22MgO5、铁丝在氧气中燃烧:3Fe + 2O2 Fe3O46、木炭在空气(或氧气)中完全燃烧:C + O2 CO27、木炭不充分燃烧:2C + O22CO8、一氧化碳燃烧:2CO + O22CO29、二氧化碳和水反应生成碳酸:CO2+ H2O== H2CO310、二氧化碳通过灼热的炭层:CO2+ C 2CO11、氧化钙与水反应:CaO+ H2O == Ca(OH)212、铝与氧气反应:4Al + 3O2== 2Al2O3二、分解反应13、高锰酸钾制氧气:2KMnO4 K2MnO4+ MnO2+ O2↑14、氯酸钾制氧气:2KClO3 2KCl + 3O2↑15、双氧水制氧气:2H2O22H2O + O2↑16、电解水:2H2O 2H2↑+ O2↑17、碳酸分解:H2CO3H2O + CO2↑18、高温煅烧石灰石:CaCO3CaO+CO2↑三、置换反应19、铜和硝酸银溶液反应:Cu + 2AgNO3 == 2Ag + Cu(NO3)220、铜和硝酸汞溶液反应:Cu + 2HgNO3 == 2Hg + Cu(NO3)221、锌和硫酸铜溶液反应:Zn +CuSO4 == Cu + ZnSO422、锌和氯化铜溶液反应:Zn + CuCl2== Cu + ZnCl223、铁和氯化铜溶液反应:Fe + CuCl2== Cu+ FeCl224、铁和硫酸铜溶液反应:Fe + CuSO4 == Cu + FeSO425、铝和硫酸铜溶液反应:2Al + 3CuSO4==Cu +Al2(SO4)326、锌和稀硫酸反应制取氢气:Zn + H2SO4== ZnSO4+ H2↑27、铁和稀硫酸反应制取氢气:Fe + H2SO4== FeSO4+ H2↑28、镁和稀硫酸反应制取氢气:Mg + H2SO4== MgSO4+ H2↑29、铝和稀硫酸反应:2Al + 3H2SO4== Al2(SO4)3+ 3H2↑30、锌和稀盐酸反应制取氢气:Zn + 2HCl== ZnCl2+ H2↑31、铁和稀盐酸反应制取氢气:Fe + 2HCl==FeCl2+ H2↑32、镁和稀盐酸反应制取氢气:Mg + 2HCl== MgCl2+ H2↑33、铝和稀盐酸反应:2Al +6HCl == 2AlCl3+ 3H2↑34、木炭还原氧化铜:C+2CuO 2Cu +CO2↑35、木炭还原氧化铁:3C + 2Fe2O34Fe+ 3CO2↑36、木炭还原四氧化三铁:2C+ FeO 3Fe + 2CO2↑37、氢气还原氧化铜:H2+ CuO Cu + H2O↑点燃点燃点燃点燃点燃点燃点燃△MnO2△MnO2通电高温高温高温CuS高温高温点燃点燃--四、复分解反应(一)酸 + 碱→盐+水38、氢氧化钠与盐酸反应:NaOH + HCl== NaCl+ H2O39、氢氧化钠与硫酸反应:2NaOH + H2SO4== Na2SO4+ 2H2O40、氢氧化铝治疗胃酸过多:Al(OH)3 + 3HCl == AlCl3+ 3H2O41、氢氧化镁与硫酸反应:Mg(OH)2 + H2SO4== MgSO4+ 2H2O42、氢氧化钙与硫酸反应:Ca(OH)2+H2SO4== CaSO4+ 2H2O43、氢氧化钙与盐酸反应:Ca(OH)2 +2HCl == CaCl2+ 2H2O44、氢氧化铜与硫酸反应:Cu(OH)2+ H2SO4== CuSO4+ 2H2O45、氢氧化铜与盐酸反应:Cu(OH)2+ 2HCl == CuCl2+ 2H2O46、氢氧化铁与盐酸反应:Fe(OH)3 + 3HCl == FeCl3+ 3H2O47、氢氧化铁与硫酸反应:Fe(OH)3 + 3H2SO4== Fe2(SO4)3+ 3H2O(二)酸+盐→另一种酸+ 另一种盐48、盐酸与硝酸银溶液反应:HCl + AgNO3 == AgCl↓+ HNO349、氯化钡溶液与硫酸溶液反应:BaCl2+ H2SO4== BaSO4↓+2HCl50、硝酸钡溶液与硫酸溶液反应:Ba(NO3)2+ H2SO4== BaSO4↓+2HNO351、碳酸钠与稀盐酸:Na2CO3+ 2HCl == 2NaCl+ H2O + CO2↑52、碳酸钠与稀硫酸:Na2CO3+ H2SO4== Na2SO4+ H2O +CO2↑53、碳酸氢钠与稀盐酸:NaHCO3 + HCl == NaCl+ H2O + CO2↑54、碳酸氢钠与稀硫酸:2NaHCO3+ H2SO4==Na2SO4+2H2O +2CO2↑55、石灰石与稀盐酸反应制取二氧化碳:CaCO3+2HCl = CaCl2+H2O+CO2↑56、碳酸钾与稀盐酸:K2CO3+ 2HCl == 2KCl+ H2O + CO2↑57、碳酸钾与稀硫酸:K2CO3+ H2SO4== K2SO4+ H2O+CO2↑(三)碱 + 盐→另一种碱 + 另一种盐58、硫酸铜溶液和氢氧化钠溶液:CuSO4+2NaOH = Na2SO4+Cu(OH)2↓59、氯化铜溶液和氢氧化钠溶液:CuCl2+2NaOH = 2NaCl+Cu(OH)2↓60、氯化铁溶液和氢氧化钠溶液:FeCl3+3NaOH==Fe(OH)3↓+3NaCl61、硫酸铁和氢氧化钠溶液:Fe2(SO4)3+6NaOH==2Fe(OH)3↓+3Na2SO462、碳酸钠溶液与氢氧化钙溶液:Na2CO3+ Ca(OH)2== CaCO3↓+2NaOH63、碳酸钠溶液与氢氧化钡溶液:Na2CO3+ Ba(OH)2==BaCO3↓+2NaOH64、硫酸铜和氢氧化钡溶液:CuSO4+ Ba(OH)2== BaSO4↓+ Cu(OH)2↓(四)盐 + 盐→两种新盐65、硝酸银溶液与氯化钠溶液反应:AgNO3+ NaCl== AgCl↓+ NaNO366、氯化钡溶液与硫酸钠溶液反应:BaCl2+ Na2SO4=BaSO4↓+2NaCl67、氯化钙溶液与碳酸钠溶液反应:CaCl2+ Na2CO3= CaCO3↓+2NaCl68、氯化钡溶液与碳酸钠溶液反应:BaCl2+ Na2CO3= BaCO3↓+ 2NaCl--五、其他反应类型(一)金属氧化物+酸→盐 + 水69、稀盐酸清洗铁锈:6HCl + Fe2O3== 2FeCl3+ 3H2O70、稀硫酸清洗铁锈:3H2SO4+ Fe2O3== Fe2(SO4)3+ 3H2O71、氧化铜与稀硫酸反应:CuO +H2SO4== CuSO4+ H2O72、氧化铜与稀盐酸反应:CuO + 2HCl== CuCl2+ H2O73、氧化钙与稀硫酸反应:CaO + H2SO4== CaSO4+ H2O74、氧化钙与稀盐酸反应:CaO +2HCl==CaCl2+ H2O(二)非金属氧化物+碱→盐+ 水75、二氧化碳通入澄清石灰水中:CO2+ Ca(OH)2== CaCO3↓+ H2O76、氢氧化钠在空气中变质:CO2+ 2NaOH = Na2CO3+ H2O77、澄清石灰水吸收二氧化硫:SO2 + Ca(OH)2== CaSO3↓+ H2O78、氢氧化钠溶液吸收二氧化硫:SO2 + 2NaOH = Na2SO3+ H2O79、氢氧化钠溶液与三氧化硫:SO3 + 2NaOH = Na2SO4+ H2O(三)其它80、一氧化碳还原氧化铜:CO + CuO Cu + CO281、冶铁原理(赤铁矿):3CO + Fe2O32Fe +3 CO282、冶铁原理(磁铁矿):4CO + Fe3O43Fe +4CO283、酒精燃烧:C2H5OH + 3O22CO2+ 3H2O84、甲烷燃烧:CH4 + 2O2CO2+ 2H2O85、葡萄糖氧化:C6H12O6+ 6O26H2O +6CO2△点燃点燃△△酶--。
化学方程式的反应类型特点

化学方程式的反应类型特点化学方程式是化学反应的表达方式,通过化学方程式可以了解反应物与生成物的种类、比例以及反应的类型特点。
化学方程式可以分类为物质的组分发生变化类型、化学反应方式类型、氧化还原反应类型和酸碱中和反应类型等等。
下面将分别介绍这些反应类型的特点。
一、物质的组分发生变化类型1. 合成反应合成反应是指两个或多个反应物反应生成一个产物的化学反应。
一般形式为:A + B → AB。
例如,氢气和氧气反应生成水:2H2 + O2 → 2H2O2. 分解反应分解反应是指一个反应物分解成两个或多个产品的化学反应。
一般形式为:AB → A + B。
例如,过氧化氢分解成水和氧气:2H2O2 → 2H2O + O23. 双替反应双替反应是指两种化合物中的阳离子和阴离子互相交换位置而生成的两种新化合物的化学反应。
一般形式为:AB + CD → AD + CB。
例如,氯化银和硝酸钠反应生成氯化钠和硝酸银:AgCl + NaNO3 → AgNO3 + NaCl4. 置换反应置换反应是指一种金属或非金属元素取代了另一种金属或非金属元素的化学反应。
一般形式为:A + BC → AC + B。
例如,铁和盐酸反应生成氢气和氯化铁:Fe + 2HCl → FeCl2 + H2二、化学反应方式类型1. 氧化反应氧化反应是指物质与氧气反应生成氧化物的反应。
一般形式为:A + O2 → AO。
例如,铁与氧气反应生成氧化铁:4Fe + 3O2 → 2Fe2O32. 还原反应还原反应是指物质失去氧元素或得到氢元素的反应。
一般形式为:A + B → AB + H2O。
例如,铁(III)氧化物与氢气反应生成铁和水:Fe2O3 + 3H2 → 2Fe + 3H2O三、氧化还原反应类型氧化还原反应是指氧化剂与还原剂之间电子的转移反应。
氧化剂接受电子,还原剂失去电子。
这是一种常见的反应类型,例如,金属与酸反应和金属与非金属氧化物反应等。
四、酸碱中和反应类型酸碱中和反应是指酸与碱反应生成盐和水的反应。
九年级化学化合反应的特点和表达式

化合反应的特点和表达式化合反应指的是由两种或两种以上的物质反应生成一种新物质的反应。
其中部分反应为氧化还原反应,部分为非氧化还原反应。
此外,化合反应一般释放出能量。
其中部分反应为氧化还原反应(如:3Fe+2O2==点燃==Fe3O4),部分为非氧化还原反应(如:CaO+SO3==高温==CaSO4)。
注意:不是所有的化合反应都是放热反应。
特征:多变一表达式:a+b=ab初中常见化合反应:1.金属+氧气→金属氧化物很多金属都能跟氧气直接化合。
例如常见的金属铝接触空气,它的表面便能立即生成一层致密的氧化膜,可阻止内层铝继续被氧化。
4Al+3O2=2Al2O32.非金属+氧气→非金属氧化物经点燃,许多非金属都能在氧气里燃烧,如:C+O2CO23.金属+非金属→无氧酸盐许多金属能与非金属氯、硫等直接化合成无氧酸盐。
如 2Na+Cl22NaCl4.氢气+非金属→气态氢化物因氢气性质比较稳定,反应一般需在点燃或加热条件下进行。
如 2H2+O22H2O5.碱性氧化物+水→碱.多数碱性氧化物不能跟水直接化合。
判断某种碱性氧化物能否跟水直接化合,一般的方法是看对应碱的溶解性,对应的碱是可溶的或微溶的,则该碱性氧化物能与水直接化合。
如:Na2O+H2O=2NaOH. 对应的碱是难溶的,则该碱性氧化物不能跟水直接化合。
如CuO、Fe2O3都不能跟水直接化合。
6.酸性氧化物+水→含氧酸. 除SiO2外,大多数酸性氧化物能与水直接化合成含氧酸。
如: CO2+H2O=H2CO37.碱性氧化物+酸性氧化物→含氧酸盐Na2O+CO2=Na2CO3。
大多数碱性氧化物和酸性氧化物可以进行这一反应。
其碱性氧化物对应的碱碱性越强,酸性氧化物对应的酸酸性越强,反应越易进行。
8.氨+氯化氢→氯化铵氨气易与氯化氢化合成氯化铵。
如:NH3+HCl=NH4Cl9.硫和氧气在点燃的情况下形成二氧化硫S+O2SO210.特殊化合反应公式 A+B+…+N→X(有些化合反应属于燃烧反应)例如:铁+氧气四氧化三铁 3Fe+2O2Fe3O4化合反应的实验举例氢气和氯气化合反应制取氯气制取氯气在通风橱内进行。
初中化学化学反应公式

初中化学化学反应公式化学反应是指物质由一种或多种物质转化为其他物质的过程。
化学反应可以用化学反应方程式来表示。
在初中化学中,学生们会学到一些常见化学反应的方程式,下面将介绍一些常见的化学反应。
1.酸碱中和反应:酸碱中和反应是指酸和碱反应生成盐和水的过程。
一般情况下,酸和碱的化学式分别为HA和BOH,反应方程式可以表示为:HA+BOH→BA+H2O例如,氢氧化钠(NaOH)和盐酸(HCl)反应生成氯化钠(NaCl)和水(H2O)的方程式为:NaOH+HCl→NaCl+H2O2.金属与非金属的反应:金属与非金属的反应是指金属与非金属元素反应生成化合物的过程。
例如,金属钠(Na)与非金属氯(Cl)反应生成氯化钠(NaCl)的方程式为:2Na+Cl2→2NaCl3.酸与金属的反应:酸与金属的反应是指酸与金属反应生成盐和氢气的过程。
一般情况下,酸的化学式为HA,金属的化学式为M,反应方程式可以表示为:HA+M→MA+H2例如,盐酸(HCl)与锌(Zn)反应生成氯化锌(ZnCl2)和氢气(H2)的方程式为:2HCl+Zn→ZnCl2+H24.酸与碱的反应:酸与碱的反应是指酸和碱反应生成盐和水的过程。
一般情况下,酸的化学式为HA,碱的化学式为BOH,反应方程式可以表示为:HA+BOH→BA+H2O例如,硫酸(H2SO4)与氢氧化钠(NaOH)反应生成硫酸钠(Na2SO4)和水(H2O)的方程式为:H2SO4+2NaOH→Na2SO4+2H2O5.酸与碳酸盐的反应:酸与碳酸盐的反应是指酸与碳酸盐反应生成盐、水和二氧化碳的过程。
一般情况下,酸的化学式为HA,碳酸盐的化学式为MCO3,反应方程式可以表示为:HA+MCO3→MACO3+H2O+CO2例如,盐酸(HCl)与碳酸钠(Na2CO3)反应生成氯化钠(NaCl)、水(H2O)和二氧化碳(CO2)的方程式为:2HCl+Na2CO3→2NaCl+H2O+CO2这些是初中化学中的一些常见化学反应方程式,学生们在学习化学时会接触到更多的反应方程式。
初中化学反应方程式总结

初中化学反应方程式总结化学是一门研究物质变化和转化的科学,而反应方程式是化学反应中用化学式和符号表示的化学变化过程。
掌握反应方程式对于化学学习的进展非常重要。
本文将总结初中化学中常见的反应方程式,帮助读者更好地掌握这一知识点。
一、酸碱反应方程式酸碱反应是指酸和碱之间的化学反应。
常见的酸碱反应方程式有以下几种形式:1. 酸与碱中和反应:酸 + 碱→ 盐 + 水例如:HCl + NaOH → NaCl + H2O2. 碱金属与酸反应:硷金属 + 酸→ 盐 + 氢气例如:2Na + 2HCl → 2NaCl + H23. 碳酸盐与酸反应:碳酸盐 + 酸→ 盐 + 二氧化碳 + 水例如:CaCO3 + 2HCl → CaCl2 + CO2 + H2O二、氧化还原反应方程式氧化还原反应是指电子在反应中的转移过程,包括氧化和还原两个方面。
常见的氧化还原反应方程式有以下几种形式:1. 金属与非金属氧化物反应:金属 + 氧化物→ 金属氧化物例如:2Mg + O2 → 2MgO2. 非金属与金属氧化物反应:非金属 + 金属氧化物→ 相应的酸例如:C + CuO → CO2 + Cu3. 金属与酸反应:金属 + 酸→ 相应的盐 + 氢气例如:Zn + 2HCl → ZnCl2 + H24. 过氧化物分解反应:过氧化物→ 氧气 + 相应的氧化物例如:2H2O2 → O2 + 2H2O三、沉淀反应方程式沉淀反应是指在反应中形成不溶于溶液中的沉淀。
常见的沉淀反应方程式有以下几种形式:1. 阳离子与阴离子交换反应:阳离子1 + 阴离子1 + 阳离子2 + 阴离子2 → 沉淀 + 相应的盐例如:Ba2+ + SO42- + Na+ + Cl- → BaSO4↓ + NaCl2. 阳离子与阴离子反应:阳离子1 + 阴离子→ 沉淀例如:Ag+ + Cl- → AgCl↓四、放热反应方程式放热反应是指在反应过程中放出热能。
常见的放热反应方程式有以下几种形式:1. 燃烧反应:燃料 + 氧气→ 二氧化碳 + 水 + 热能例如:C3H8 + 5O2 → 3CO2 + 4H2O + 热能2. 酸与碱中和反应(放热性):酸 + 碱→ 盐 + 水 + 热能例如:HCl + NaOH → NaCl + H2O + 热能3. 溶解反应(放热性):固体 + 溶剂→ 溶液 + 热能例如:NaOH(s) + H2O(l) → NaOH(aq) + 热能五、光合作用反应方程式光合作用是指光能转化为化学能的反应过程。
九年级化学酸碱盐知识点总结(含物质分类和四大反应类型解析以及常见物质的名称和化学式)

1初中化学酸碱盐知识点总结(含物质分类和四大反应类型解析以及常见物质的名称和化学式)一、物质的分类:二、各类物质的主要化学性质: 1.单质: 1)金属:2)非金属 + 氧气 → 氧化物2.氧化物:1)酸性氧化物:2)碱性氧化物:3)水: 3.酸:4.碱:5.盐:0 +2 Fe → Fe 氧气→氧化物金属+ 酸→盐+氢气(①H 前面的金属;②不能是浓硫酸和硝酸) 盐→盐+金属(①排在前面的金属;②可溶性盐) 酸性氧化物+水→酸 碱→盐+水(可溶性碱) 碱性氧化物+ 水→碱(可溶性碱)酸→盐+水 酸性氧化物→酸水+ 碱性氧化物→碱(可溶性碱)CuSO 4→CuSO 4·5H 2O石蕊变红;酚酞不变色 金属→盐+氢气(①H 前面的金属;②不能是浓硫酸和硝酸) 酸+ 碱性氧化物→盐+水 碱→盐+水 盐→酸+盐(可溶反应物能生成↓、↑、H 2O ;难溶反应物能生成↑、H 2O ) 石蕊变蓝;酚酞变红(可溶性碱)酸性氧化物→盐+水(可溶性碱) 酸→盐+水 盐→盐+碱(反应物必须可溶且生成物之一必须是不溶物) 碱+ 金属→盐+金属(①排在前面的金属;②可溶性盐) 酸→盐+酸(可溶反应物能生成↓、↑、H 2O ;难溶反应物能生成↑、H 2O )碱→盐+碱(反应物必须可溶且生成物之一必须是不溶物) 盐→盐+盐(反应物必须可溶且生成物之一必须是不溶物) 盐+ 金 属:Fe 、Cu 、Mg 、Al 单 质 稀有气体:He 、Ne 、Ar非金属 纯净物 酸性氧化物:CO 2、SO 2、SO 3 氧化物 碱性氧化物 其它氧化物:H 2O 、CO 、Fe 3O 4 化合物 酸 物质 碱 盐 混合物:空气、水煤气、煤、石油、天然气、石灰石 可溶盐:K +、Na +、NH 4+、NO 3-、SO 42-(除BaSO 4)、Cl - (除AgCl) 难溶盐:AgCl 、BaSO 4、CaCO 3、BaCO 3、Ag 2CO 3 可溶碱:NaOH 、KOH 、Ba(OH)2、Ca(OH)2 难溶碱:Cu(OH)2、Fe(OH)3、Mg(OH)2 无氧酸:HCl 、H 2S 含氧酸:H 2SO 4、HNO 3、H 2CO 3、H 3PO 4 可溶:K 2O 、Na 2O 、BaO 、CaO 难溶:CuO 、Fe 2O 3、MgO 固态非金属:C 、S 、P气态非金属:H 2、O 2、Cl 2、N 2三、化学反应的基本类型:1)化合反应:(有单质时化合价改变)⑴单质+单质→化合物Mg + O2 = P + O2 =⑵单质+化合物→化合物 C + CO2 =⑶化合物+化合物→化合物CaO + H2O = CuSO4 + H2O =2)分解反应:(有单质时化合价改变)⑴氧化物分解H2O = HgO =⑵酸分解H2CO3 =⑶盐分解KMnO4 = KClO3 =CaCO3 = CuSO4·5H2O =3)置换反应:(化合价一定改变)⑴金属+酸→盐+氢气(①H前面的金属;②不能是浓硫酸和硝酸)Fe + HCl = Al + H2SO4 =⑵金属+盐→盐+金属(①排在前面的金属;②可溶性盐)Fe + CuSO4 = Cu + AgNO3 =⑶金属氧化物+H2(或C)→金属+水(或CO2)CuO + H2 = C + Fe2O3 =4)复分解反应:(化合价一定不变)⑴碱性氧化物+酸→盐+水Fe2O3 + HCl = CuO + H2SO4 =⑵酸+碱→盐+水NaOH + H2SO4 = Fe(OH)3 + HCl =⑶酸+盐→盐+酸(可溶反应物能生成↓、↑、H2O;难溶反应物能生成↑、H2O)H2SO4 + BaCl2 = HCl + CaCO3 =⑷碱+盐→碱+盐(反应物必须可溶且生成物之一必须是不溶物)Ca(OH)2 + Na2CO3 = NaOH + FeCl3 =⑸盐+盐→盐+盐(反应物必须可溶且生成物之一必须是不溶物)CaCl2 + K2CO3 = Ba(NO3)2 + Na2SO4 =※不属于四种基本类型的反应:⑴金属氧化物+CO→金属+CO2Fe2O3+ CO =⑵碱+酸性氧化物→盐+水(可溶性碱)NaOH + CO2 =⑶有机物+O2→H2O+CO2C2H5OH + O2 =☆氧化还原反应:得到氧的物质被氧化,发生氧化反应,是还原剂;失去氧的物质被还原,发生还原反应,是氧化剂。
水和干冰反应化学式

水和干冰反应化学式
水和干冰反应是日常生活中常见的一种化学反应,它是由两种极性情况下的反应结果。
水和干冰反应的化学式表达为:H2O(s) + CO2(s) → CO2(aq) + H2O(l)。
这种反应的物理性质在于,当水和干冰参与反应时,水会升华变成汽水,而干冰则会由固态转变为液体状态,二者转化过程迅速而又安全有效。
这是一种物理反应,反应物不发生化学变化,仅仅是物质的比例发生改变。
该过程的宏观表现形式是由汽水中浮现的白色“雪花”状的小单位,该“小单位”
就是溶解在汽水中的干冰。
当水滴状的干冰接触到汽水的表面,加热后会产生气泡,然后扩大,呈现出白色晶莹剔透的样子。
该反应以气态的方式向外释放,显示出明显的破坏能力,也可以说是活性化能量。
在温度和压力稳定时,该反应会结束,汽水会不断对温度和压力有所变化,最终凝结在干冰的表面上,形成连绵的结晶。
水和干冰反应是一种原子间的能量变化过程,反应物之间的现象反映出物质发生转变的特征。
该反应是一种迅速而有益的化学反应,不仅能使汽水温度下降,更可以产生视觉上极其美观的连绵结晶,对于人们来说无疑是一种视觉盛宴,成为水果软饮料中添加美味与视觉效果的美丽注释。
燃烧反应的类型与特征

燃烧反应的类型与特征燃烧(combustion)是指燃料与氧气或其他氧化剂在适当条件下进行的放热反应,产生大量能量和二氧化碳、水等物质。
燃烧是生活中常见的化学反应之一,不同类型的燃烧反应具有不同的特征和表现形式。
本文将介绍燃烧反应的几种常见类型以及它们的特征。
一、明火燃烧明火燃烧是人们日常生活中最常见的燃烧形式,也是最直观的燃烧形象。
明火燃烧的特征是有明显的火焰和火光,并伴有明确的热能释放。
明火燃烧需要燃料、氧气和一定的活动性,如花柴等可燃物置于明火中所产生的燃烧现象。
明火燃烧是一个复杂的过程,其中涉及许多细节的化学反应。
燃料物质在明火中发生氧化反应,产生热能和火焰,热能以光和热的形式释放出来。
明火燃烧的能量既可以用于供人们的日常生活,也可以用于工业生产。
二、隐火燃烧隐火燃烧,顾名思义,指的是在没有明显火焰和火光的情况下进行的燃烧反应。
隐火燃烧的典型例子是木炭的燃烧。
在没有外部燃烧源的情况下,木炭与空气中的氧气进行反应,产生热能,但没有显著的火焰。
隐火燃烧具有一些独特的特点。
首先,由于没有明显的火焰,隐火燃烧的热能主要通过传导和对流进行传输。
其次,隐火燃烧的温度相对较低,热能释放较为缓慢。
此外,隐火燃烧产生的烟雾相对较少,具有较好的环境友好性。
三、爆炸爆炸是一种剧烈而迅速的燃烧反应,其特征是产生巨大的声响、冲击波以及大量的热能和气体产物。
爆炸常常发生在可燃气体、液体或固体与氧气或其他氧化剂形成可燃混合物的情况下。
爆炸反应需要燃料、氧气和源源不断的火花或脉冲能量作为引爆源。
当火花或脉冲能量达到一定的能量阈值时,反应迅速进行,生成大量的热能和气体产物,并伴随着巨大的声响和冲击波。
四、自燃自燃是指一些物质在特定条件下,无需外部点火源而自动燃烧的现象。
自燃现象经常发生在易燃液体或固体,如某些油类、木材、碳等。
自燃反应的特征是无需外界燃烧源的直接点燃,而是由于物质自身的特性引起的。
一些物质具有较低的自燃温度,当遇到氧气或其他氧化剂时,可以自动发生反应,释放出热能。
初中化合反应的特点

初中化合反应的特点化合反应是化学变化过程中最基本的类型之一,它是指两种或两种以上的物质进一步反应,生成一种或多种新的物质。
化合反应包括物质间原子、离子、分子之间相互结合形成新的物质。
这些新物质通常具有新的物理和化学性质,与原来的物质有明显的差异。
下面将介绍初中化合反应的特点。
1.原子结合成分子在化合反应中,原子之间通过共价键或离子键结合在一起,形成稳定的分子结构。
这些分子可以是元素之间的结合,也可以是不同元素之间的结合。
例如,氧气分子(O2)就是两个氧原子共价键结合在一起形成的,氯化钠(NaCl)则是钠离子和氯离子通过离子键结合形成的。
2.生成新的物质化合反应会生成新的物质,这些新物质通常具有不同于原始物质的性质。
例如,氧气和氢气反应生成水分子,水与氢气和氧气的性质完全不同。
新生成的物质可能是一种或多种,取决于反应物的种类和比例。
3.能量变化化合反应中常伴随着能量变化,可以是放热反应也可以是吸热反应。
放热反应会释放出热量,使反应时的温度升高,而吸热反应则吸收外界的热量,会使反应时的温度下降。
这种加热或降温现象是化学反应进行的重要特征之一4.化学式的变化化合反应中,反应物的化学式会发生变化,生成物的化学式也会有所不同。
通过观察反应过程中的物质种类和数量的变化,可以得到反应的化学方程式,用来描述反应的型式和组成。
5.反应速率化合反应的速率取决于反应物的性质、浓度、温度等因素。
通常情况下,反应物浓度越高、温度越高,反应速率越快。
反应速率的快慢也会影响到产物的生成速度和反应过程的进行。
6.反应的平衡化合反应通常会达到化学平衡状态,即反应物与生成物之间的浓度或活性物质的比例在一定条件下保持稳定。
在化学平衡状态下,反应物和生成物之间的转化速率相等,虽然反应仍在进行,但是反应系数不再发生明显的变化。
总之,初中化合反应具有上述特点,通过学习化合反应的基本理论和实验方法,可以更好地理解不同物质之间的化学变化过程,为进一步学习化学知识打下基础。
酚酞跟碱的化学反应式

酚酞跟碱的化学反应式酚酞跟碱是化学反应过程中常见的两种物质,在实验室和工业生产中都有广泛的应用。
它们之间可通过某些化学反应进行转化,即酚酞可以通过与碱反应产生新的物质。
这种化学反应称为酚酞跟碱的化学反应”。
本文将介绍这种化学反应的基本原理,产物的性质以及其在实验室和工业应用中的作用。
酚酞跟碱的化学反应的基本原理可以通过以下方程式表达:C_6H_5OH + NaOH C_6H_5ONa + H_2O这是一种水解反应,也就是说,酚酞与碱反应可以生成水和新的物质,即上面的公式中C_6H_5ONa。
与《固体碱反应》中碱类催化剂一样,本反应中NaOH可以作为催化剂,以加快反应速率,减少反应温度。
本反应产生的化合物(C_6H_5ONa)具有可溶性特征,可以在水溶液中融化。
它的溶解度与其他盐的溶解度一样,可根据溶液的浓度和温度变化而变化。
另外,它的溶解度也可以通过增加溶液中酚酞的浓度来改变;如果溶液中酚酞的浓度较大,则新生成的C_6H_5ONa的溶解度会增加。
除了上述性质外,C_6H_5ONa还具有其他特性,例如抗氧化性。
它可以有效抑制有机物中氧化反应的进行,从而防止物质的氧化变质,并能保持物质的稳定性。
此外,C_6H_5ONa还可以用于工业应用,如制造甘油酯用于润滑剂的生产,合成催化剂的制造,耐蚀剂的制备等。
以上主要介绍了酚酞跟碱的化学反应中的主要特性,包括它的化学反应式、产物的性质,以及它的实验室和工业应用。
遵循反应原理,科学家可以利用这种化学反应来生产新物质,它们可以用于各种工业应用,也可以用于研究化学反应和化学催化。
最后,通过分析和理解酚酞跟碱反应的原理,可以更好地控制并优化这种反应,以求得更高品质和更安全的产物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常見化學反應式與物質特徵 常見化學方程式:
(一)化合反應:A+B→C
(二)分解反應:C→A+B+....
(五)電解及電池反應
常見物質的特徵:
(一)顏色、氣味:
1.紅色:紅磷、Cu、Fe2O3
2.黃色:S、含有Fe3+鹽的溶液
3.藍色:CuSO4·5H2O、含有Cu2+鹽的溶液
4.黑色:木炭C、Fe粉、氧化銅CuO、二氧化錳MnO2、氧化鐵Fe3O4
5.白色:BaSO4、AgCl、MgO、P2O5、CaO、NaOH、Ca(OH)2、CaCO3、KCl、NaCl、
BaCO3、CuSO4、Na2CO3、NaHCO3……等
6.無色氣體:空氣、O2、H2、CO2、CO、CH4、N2、SO2
7.刺激性氣味氣體:SO2、NH3、HCl、HNO3。
8.無色:乾冰以及大部分酸、鹼、鹽的溶液和酒精、乙酸的溶液。
(二)焰色:
1.非金屬:氫氣(淡藍色火焰)、硫(藍紫色火焰)、磷(黃色火焰)
2.金屬:鈉(黃色火焰)、鎂(耀眼白光)、鋅(黃綠色火焰)、
銅(綠色火焰,本身不燃燒)
(三)物質的學名、俗名及對應的化學式:
Hg汞(水銀)、CO2二氧化碳(乾冰)、CO一氧化碳(煤氣)、CH4甲烷(沼氣天然氣)、CaO氧化鈣(生石灰)、Ca(OH)2氫氧化鈣(熟石灰、消石灰)、CaCO3碳酸鈣(石灰石、大理石、灰石、石灰岩)、NaCl氯化鈉(食鹽)、C2H5OH乙醇(酒精)、CH3COOH乙酸(醋酸)、NaOH氫氧化鈉(燒鹼、苛性鈉)、Na2CO3碳酸鈉(純鹼、蘇打)、NaHCO3碳酸氫鈉(小蘇打)、HCl氫氯酸(鹽酸)、K2CO3碳酸鉀(草木灰主要成分)、HCOOH甲酸、CaSO4硫酸鈣(石膏)。
