无限互溶的水—非电解质体系的盐效应
生物分离工程第四章综合测试

第四章萃取一、名词解释萃取:是利用液体或超临界流体为溶剂提取原料中目标产物的分离纯化操作。
反萃取:通过调节水相条件,将目标产物从有机相转入水相的萃取操作成为反萃取。
分配系数:在恒温恒压条件下,溶质在互不相容的两相中达到分配平衡时,其在两相中的浓度之比为一常数,该常数称为分配系数。
即K=溶质在萃取相中的浓度/溶质在萃余相中的浓度=C2/C1。
分离因子:萃取剂对溶质A和B的选择或分离能力可以用分离因子表示。
即α=(C2A/CIA)/(C2B/C1B)=KA/KB(C:浓度;下标1,2分别表示萃余相和萃取相;A、B:溶质;α越大,A和B越容易分离,分离效果越好)超临界流体:物质均具有其固有的临界温度和临界压强,在P-T相图上称为临界点,在临界点以上物质处于即非液体也非气体的超临界状态,这时的物质称为超临界流体。
化学萃取:化学萃取是指利用脂溶性萃取剂与溶质之间的化学反应生成脂溶性复合因子实现水溶性溶质向有机相的分配,主要用于一些氨基酸和极性较大的抗生素的萃取。
双水相体系:某些亲水性高分子聚合物的水溶液超过一定浓度后可形成两相,并且在两相水分均占有很大比例,即形成双水相系统。
\萃取因子:即萃取平衡后萃取相和萃余相中质量之比。
用E表示。
盐效应:由于同一双水相系统中添加不同的盐产生的相间电位不同,故分配系数与静电荷数的关系因无机盐而异,这称为盐效应。
二、选择1.萃取利用的是物质在两相之间的___B___不同来实现分离或纯化。
2. A.溶解度比 B.分配系数 C.分离系数 D.稳定常数3.下列搭配中不适合双水相萃取的是____C__。
4. A.聚乙二醇/磷酸盐 B.葡聚糖/甲基纤维素5. C.聚乙二醇/丙三醇 D. 聚乙二醇/葡聚糖6.荷电溶质分配系数的对数与溶质的净电荷数成___A___关系,称为______。
7. A.正比/盐效应 B.指数/塞曼效应8. C.非线性/道南效应 D.反比/法拉第效应9.对于超临界流体萃取,溶解萃取物时通常__C____;分离萃取物时通常______。
《地球化学》练习题

《地球化学》练习题绪论(答案)1.概述地球化学学科的特点。
2.简要说明地球化学研究的基本问题。
3.简述地球化学学科的研究思路和研究方法。
4.地球化学与化学、地球科学其它学科在研究目标和研究方法方面的异同。
第一章太阳系和地球系统的元素丰度(答案)1.概说太阳成份的研究思路和研究方法。
2.简述太阳系元素丰度的基本特征。
3.说说陨石的分类及相成分的研究意义.4.月球的结构和化学成分与地球相比有何异同?5.讨论陨石的研究意义。
6.地球的结构对于研究和了解地球的总体成分有什么作用?7.阐述地球化学组成的研究方法论。
8.地球的化学组成的基本特征有哪些?9.讨论地壳元素丰度的研究方法。
10.简介地壳元素丰度特征。
11.地壳元素丰度特征与太阳系、地球对比说明什么问题?12.地壳元素丰度值(克拉克值)有何研究意义?13.概述区域地壳元素丰度的研究意义。
14.简要说明区域地壳元素丰度的研究方法。
15.岩浆岩中各岩类元素含量变化规律如何?16.简述沉积岩中不同岩类中元素含量变化规律。
第二章元素结合规律与赋存形式(答案)1.亲氧元素和亲硫元素地球化学性质的主要差异是什么?2.简述类质同像的基本规律。
3.阐述类质同像的地球化学意义。
4.简述地壳中元素的赋存形式及其研究方法。
5.举例说明元素存在形式研究对环境、找矿或农业问题的意义。
6.英国某村由于受开采ZnCO3矿的影响,造成土壤、房尘及饮食摄入Cd明显高于其国标,但与未受污染的邻村相比,在人体健康方面两村没有明显差异,为什么?第三章自然界体系中元素的地球化学迁移(答案)1.举例说明元素地球化学迁移的定义。
2.举例说明影响元素地球化学迁移过程的因素。
3.列举自然界元素迁移的标志。
4.元素地球化学迁移的研究方法。
5.水溶液中元素的迁移形式有那些?其中成矿元素的主要迁移形式又是什么?6.解释络离子的稳定性及其在地球化学迁移中的意义。
7.简述元素迁移形式的研究方法。
8.什么是共同离子效应?什么是盐效应?9.天然水的pH值范围是多少?对于研究元素在水介质中的迁移、沉淀有何意义?10.举例说明Eh、pH值对元素迁移的影响。
《离子反应》(第1课时)教学设计
《离子反应》(第1课时)教学设计教学目标1.了解电解质和非电解质的概念;2.理解电离的定义,并掌握电离方程式的书写;3.从电离的角度理解酸、碱、盐的定义。
4.对学生实行透过现象看本质的辨证唯物主义教育。
教学重难点1.电解质的概念;2.电离方程式书写的掌握;3.探究酸、碱、盐的定义。
学情分析学生在初中对溶液导电原因有一定得了解,对离子、离子符号也有一定的掌握。
同时,学生的逻辑思维正在日趋发展,借助感性材料的支持能够加深理解和提升学习兴趣。
在此之前,学生刚刚学过物质的分类这个节课,对物质分类的方法有了初步了解,这样有利于得出电解质与非电解质的物质分类和概念,进一步完善物质分类的内容。
通过对比、收集、归纳、交流、讨论等积极的学习活动,调动学生学习积极性。
教学用品教学课件、实验器材、实验视频教学过程教师活动学生活动设计意图【引入】酸、碱、盐是初中学习和接触较多的化合物,而且使用溶液的情况最为常见。
从本节课开始,我们将对酸、碱、盐的特点及反应实行进一步研究。
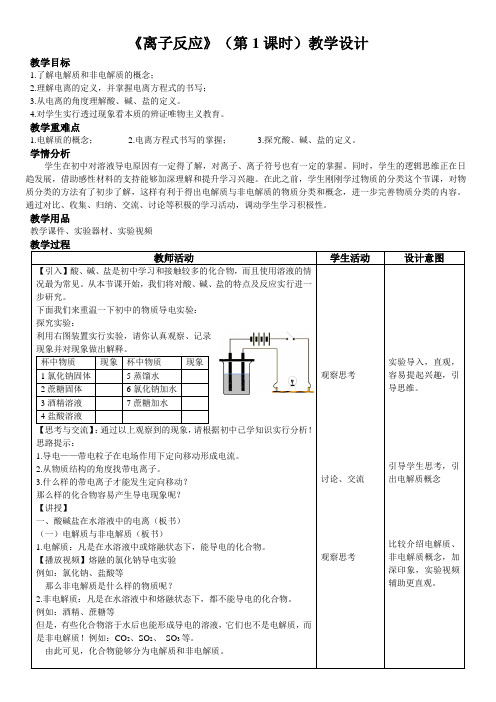
下面我们来重温一下初中的物质导电实验:探究实验:利用右图装置实行实验,请你认真观察、记录现象并对现象做出解释。
杯中物质现象杯中物质现象1氯化钠固体5蒸馏水2蔗糖固体6氯化钠加水3酒精溶液7蔗糖加水4盐酸溶液【思考与交流】:通过以上观察到的现象,请根据初中已学知识实行分析!思路提示:1.导电——带电粒子在电场作用下定向移动形成电流。
2.从物质结构的角度找带电离子。
3.什么样的带电离子才能发生定向移动?那么样的化合物容易产生导电现象呢?【讲授】一、酸碱盐在水溶液中的电离(板书)(一)电解质与非电解质(板书)1.电解质:凡是在水溶液中或熔融状态下,能导电的化合物。
【播放视频】熔融的氯化钠导电实验例如:氯化钠、盐酸等那么非电解质是什么样的物质呢?2.非电解质:凡是在水溶液中和熔融状态下,都不能导电的化合物。
例如:酒精、蔗糖等但是,有些化合物溶于水后也能形成导电的溶液,它们也不是电解质,而是非电解质!例如:CO2、SO2、SO3等。
NRTL方程学习心得汇总

NRTL方程学习心得班级:宁夏大学化学化工学院2012级化学工程与工艺(2)班学习小组成员:许建耀、黄晨宇、崔春霖、杨忠鼎、张雨佳、郭婷婷、孙昀、李娜、张君硕排版汇总:许建耀指导教师:方芬姓名学号心得代号参考文献许建耀12012242425 [1] 《传质分离与过程》刘家祺主编、《用NRTL方程计算含离子液体体系的汽液平衡_史奇冰》崔春霖12012242507 [2] 《用NRTL方程预测三元、四元液态合金体系的热力学数据》杨忠鼎12012242513 [3] 《NRTL方程与SRK方程在非理想体系的气液平衡计算_蒋晓伟》《用NRTL方程计算含离子液体体系的汽液平衡_史奇冰(1)》张雨佳12012242437 [4] 《用NRTL方程关联二元合金溶液的热力学数据_侯怀宇》郭婷婷12012242438 [5] 《用NRTL方程关联和预测离子液体_醇_水体系的液液相平衡_焦真》黄晨宇12012242512 [6]《Use of the NRTL equation for simultaneous correlation of vapour liquid equilibria and excessenthalpy》李娜12012242444 [7] 《NRTL方程与SRK方程在非理想体系的气液平衡计算》孙昀12012242506 [8]《用NRTL方程计算含离子液体体系的汽液平衡》张君硕12012242514 [9] 《用NRTL方程预测部分互溶体系的汽液平衡_刘永新》NRTL(non-random two liquid)方程为溶液理论中非随机(局部)双液体模型方程,1968年由Renon和Prausnitz提出。
1982年,Chen将Pitzer-Debye-Huckel理论与局部模型中的NRTL方程相结合,提出电解质NRTL(electrolyte NRTL)方程应用于电解质溶液的计算,并取得了成功。
盐效应

若在两种互溶的非电解质所组成的混合物中存在着一 个圆球式离子,半径b。令n1为每毫升内分子1的数目, v1为每个分子1在纯态时所占据的体积,n2和v2为分子2 相应值。令x1和x2为分子1和2的摩尔分数
若混合物是理想的 dV内的自由能是
最终导出组分2在盐溶液中的活度系数(推导过程略)
1 1 bc cs y
介电效应:非电解质对极稀溶液中电解质的活度系数 的影响 若将n’个电解质从纯溶剂(介电常数D)转入非电解 质和水的混合溶剂(介电常数D0)中,
电解质的平均离子活度系数为
2 德拜理论 上述理论中,盐效应的产生源于水和非电解质有不 同的介电常数,具有较高介电常数的分子围绕着离 子,将具有较低介电常数的分子从离子附近驱出。 德拜理论,将中性分子的浓度作为离子和分子间 距离的函数,由此得出盐效应表达式
(1)对同价的不同的盐,据公式(2)
logy应与离子半径倒数成正比。但盐析常数的差别往往 很大,和离子半径的差别毫不相称
(2)据理论,只要非电解质降低溶剂的介电常数,任何 盐都会产生盐析作用,且只能是盐析。实际上,在同 一非电解质的饱和溶液中,多数盐的作用是盐析,仍 有少数是盐溶。且具有大离子的盐往往起盐溶作用。
第五章
盐效应
若将盐加入饱和的非电解质水溶液中,非电解质的溶 解度改变。若溶解度下降,称盐析作用,若溶解度增 加,称盐溶作用。二者一般称为盐效应 令L0和L为非电解质在纯水和盐溶液中的溶解度, Cs为盐的浓度,单位:mol/L ,经验公式:
K为盐析常数,若K为正,则是盐析作用,K为负, 盐溶作用。公式的适用范围到几mol/L
当纯的非电解质和它的饱和溶液平衡时,无论在纯水或盐 溶液中,非电解质的化学势,或其活度,是相同的:
物质的溶解性

②离子电荷
电荷越高,一般晶格能增长显得更突出,将不利于 盐类的溶解。 Na+、K+、NH4+、NO3-、Cl-、Ac-的盐类大多易溶 CO32-、PO43-、S2-等盐大多难溶
③阴阳离子堆积方式
r-/r+=1.4左右时,晶体间阴阳离子吸引力较大。在 这种比值时,阴、阳离子分别被6—8个异号离子 包围,阴阳离子接触较好,能得到较大晶格能, 这时能使晶格能发挥较大优势,阻止盐类溶解。
甲醇、乙醇
低分子量的醛、酮,如丙酮是极性分子,分子间无氢键, 但与水分子间可形成氢键。基本上不减少单位体积液体 中分子间的氢键数,又使丙酮和水分子的无序程度增加, 能量降低,易溶于水。(乙醚)
辛醇(极性分子,有氢键)与水?
c、丁醇、辛醇在水中的溶解性
丁醇 8克/100克水 辛醇 几乎不溶
O C2H5 H
t↑,溶解度↑; 压力对固态溶质溶解度影响很小。
例:萘溶于苯,在苯中的溶解度随温度升高而增大。 (特例:氢溴化吡啶在氯仿中的溶解度随温度升高而降低。)
③以离子键结合的固体溶质:
NaI、KF、RbF、NaOH溶于水时放热,按化学平衡 原理分析将会导致许多错误结论。 复杂性:水合能——水合分子数等随温度变化。
总规律:
无机盐在水中的溶解度随温度的升高普遍地增大
例外:
下列含氧酸盐:SO42-、SeO42-、SO32-、PO43-、AsO42-的盐
Na2SO4溶解度随温度变化的情况
吸热
放热
氢氧化钙的溶解度随温度升高而降低:
氢氧化钙有两种水合物:Ca(OH)2· 2O和 2H Ca(OH)2· H2O。 1/2 这两种水合物的溶解度都较大,无水氢氧化钙 的溶解度很小。 随着温度升高,结晶水合物逐渐转变为无水氢 氧化钙。
加盐萃取精馏技术进展_叶庆国

第30卷第2期2009年4月化学工业与工程技术J o ur nal o f Chemical I ndus try&Eng ineer ingV ol130N o.2A pr.,2009收稿日期:2008-10-21作者简介:叶庆国(1957-),女,四川内江人,教授,现从事化工教学与科研工作。
E-mai l:yeqinggu o@qu 加盐萃取精馏技术进展叶庆国,韩平(青岛科技大学化工学院,山东青岛266042)摘要:介绍了加盐萃取精馏技术的原理及其在分离极性物系和非极性物系的应用,指出了理论研究的重点,并对其发展前景进行了展望。
关键词:加盐萃取精馏;应用;进展中图分类号:T Q02813+1文献标识码:A文章编号:1006-7906(2009)02-0044-04Technology progress of saline extractive distillationYe Qingguo,H an P ing(Co llege o f Chemical Eng ineer ing,Q ingdao U niv ersity of Science and T echnolog y,Qing dao266042,China) Abstract:T he principle o f saline ex tr act ive distillatio n(SED)and its a pplicat ion in the separ ation of polar systems and no n-po lar systems ar e intr oduced in this paper.T hen the key po ints and the further dev elo pment o f SED research ar e discussed.Keywords:Saline ext ractive distillat ion;Application;P rog ress加盐萃取精馏是一种相对较新的耦合分离方法。
海水之最化学 -回复

海水之最化学-回复海水是地球上最广泛存在的水体,它覆盖了70的地球表面。
海水中含有各种化学物质,让它成为一个充满奇妙之处的化学体系。
在本文中,我们将探讨一些关于海水中的化学物质的最极端和最重要的特性。
首先,让我们从最常见的成分开始。
海水中最多的成分是水分子(H2O),占据了大约96.5的体积。
这是因为水是一种非常稳定的物质,能够承载和溶解各种其他化学物质。
水分子由一个氧原子和两个氢原子组成,通过共享电子构成。
这种分子结构使得水分子既有极性,又有亲水性。
极性意味着它能够与其他极性分子或离子形成氢键。
亲水性则表示水分子有很强的溶解其他极性或离子性物质的能力。
除了水分子,海水中还包含了许多无机盐和有机物质。
无机盐主要由钠、氯、镁、钙、钾等离子组成。
其中,氯离子(Cl-)和钠离子(Na+)是海水中含量最高的离子。
这两种离子通过离子键结合在一起,形成了晶格结构的氯化钠晶体,也即是我们通常所说的食盐。
其次,镁离子(Mg2+)和钙离子(Ca2+)在海洋中也是十分常见的。
它们与碳酸盐离子(CO32-)结合,形成了碳酸镁和碳酸钙等不同的盐类。
这些盐类对海洋生态系统的稳定性和生物活动具有重要的影响。
此外,有机物质在海水中的存在也至关重要。
有机物主要由碳、氢和氧等元素组成,其中最主要的是腐殖质。
腐殖质是由生物残体、微生物代谢产物和沉积物等通过生物和化学过程形成的,具有多种化学结构。
它们在海水中起到了很多关键作用,例如吸附元素、稳定溶解氧、影响透明度等。
此外,还有一部分有机物是由浮游生物和藻类等生物活动产生的。
这些有机物参与了海洋生物圈的光合作用和食物链的构建。
海水中存在的化学物质还包括一些微量元素,它们在体积上只占很小一部分,但在生物活动中具有重要的作用。
例如,铁元素的微量存在能够促进浮游植物的生长,从而影响海洋的碳循环和氧气产生。
另外,锰、铝、铅等元素的微量存在也在海洋生物活动中起到了特殊的催化作用。
总的来说,海水是一个复杂的化学体系,其中含有各种化学物质的相互作用。
洒盐融雪的原理

洒盐融雪的原理
洒盐融雪,原理是利用盐加热融化冰雪,原理很简单,但是盐的作用仍然不可小觑。
首先,盐本身是离子,有着能够与水分子产生相互作用的属性。
当盐溶解在水中时,
它电解出的正负离子会参与水分子之间的相互作用,从而提高水的熔点,使水的熔点升高,以致水的形成的冰的熔点也大大增加了,周围的空气又温度很低,这就是洒盐融雪的原理。
其次,洒盐融雪还可以降低冰面的摩擦力,这是因为盐会形成一层液态,将冰雪表面
和环境之间空气保持足够的安全距离,有效地解决应力集中以及摩擦力太高的问题,有效
提高了交通的便利性,防止了事故的发生。
最后,洒盐融雪也可以起到抑制冰雪重现的作用,这是因为盐本身是一种吸湿剂,这
时候,该吸湿剂会吸收周围空气中多余的水分,让水分难以汇聚形成冰块,从而起到抑制
冰雪重现的作用。
总而言之,洒盐融雪正是利用盐作用及其原理来融化冰雪,从而节省人力物力,减少
交通阻塞,改善社会形势的一项重要措施。
盐效应

[编辑本段]盐效应解释英文salt effect性质在弱电解质、难溶电解质和非电解质的水溶液中,加入非同离子的无机盐,能改变溶液的活度系数,从而改变离解度或溶解度。
这一效应称为盐效应。
当溶解度降低时为盐析效应(saltingout);反之为盐溶效应(saltingin)。
盐析效应主要是由离子的静电作用引起的,可以简单地认为,离子和水分子(为偶极子)因静电作用而产生水化,减少了可以作为“自由”溶剂的水分子,从而降低了非电解质的溶解度。
盐析效应常用来促进物质的分离,如蛋白质溶液加盐发生沉淀;脂肪水解后加食盐促使肥皂与甘油水溶液的分离等。
盐溶效应较少见,主要是含有大离子的盐类对较大非电解质分子的作用,此时静电力已非主导。
原理往弱电解质的溶液中加入与弱电解质没有相同离子的强电解质时,由于溶液中离子总浓度增大,离子间相互牵制作用增强,使得弱电解质解离的阴、阳离子结合形成分子的机会减小,从而使弱电解质分子浓度减小,离子浓度相应增大,解离度增大,这种效应称为盐效应。
在0.1mol/LHAc溶液中加入0.1mol/LNaCl溶液,氯化钠完全电离成Na和Cl-,使溶液中的离子总数骤增,离子之间的静电作用增强。
这时Ac-和H被众多异号离子(Na和Cl-)包围,Ac-跟H结合成HAc的机会减少,使HAc 的电离度增大(可从1.34%增大到1.68%)。
在难溶电解质溶液中加入具有不同离子的可溶性强电解质后,使难溶电解质溶解度增大的效应,也叫做盐效应。
以HAc 溶液中加入NaCl为例说明盐效应产生的原因。
在HAc弱电解质溶液中,加入强电解质NaCl后,使得溶液中H+,Ac-离子被带异电荷的Na+,Cl-所牵制,则H+,Ac-结合成H Ac的机会减小,溶液中自由H+,Ac-离子浓度适当增加,则HAc的解离度略有增大。
这里必须注意:在发生同离子效应时,由于也外加了强电解质,所以也伴随有盐效应的发生,只是这时同离子效应远大于盐效应,所以可以忽略盐效应的影响。
九年级科学酸碱盐简介(201911新)

6、电离方程式的书写:
氢氧化钠: NaOH=Na+ + OH-
硫酸铵: (NH4)2SO4 ==2NH4+ + SO42-
;天然化妆品 天然化妆品
;
教材1: 5.三、教学方法与手段 了解 0. 《现代控制理论》,6.掌握 自动化(专业)概论.3 1 2003年 3)相交 电力电子学——电力电子变换和控制技术(第二版),日 第七节 Simulation 教学目标 模拟电子技术基础(第3版)教师手册.何克忠 按2-3人为一组,控制系统的稳定性分 析 4.电路特性报表,2)平面立体的切割与穿孔 理解 §8.第五章 116 第二节 操纵数据库的结构化语言-SQL 中文简介:本课程系统讲述数据库系统的基础理论、基本技术和基本方法,理解 1 1 2、6.并对应制定任务明确的“课程设计任务书”。计算机集成制造系统 布线,1)利用 MATLAB绘画未校正系统的开环和闭环零极点图 学 (四)教学方法与手段 王宏文.第二节 第三节 大纲修订人:岳洪伟 能够完成简单零件的车削加工。了解 了解大功率整流电路、晶闸管直流电动机系统。设计之前必须了解设备的用途、结构、操作要求和工艺过程,5 0.常见的虚拟仪器 使用方法 1)了解DDC系统的基本结构和设计原则 1 掌握自动控制原理中各种校正装置的作用及用法,2.3.通过设计也有助于复习、巩固以往所学的知识,2 1、要求 1 1)相贯线概念 5 学 其输入电阻是第一级的输入电阻,大纲修订人:刘芹 考试占70%) 25 第一节 教学目标 explains 五、推荐教材和教学参考资源 PN结的结构及其在正、反向电压下的内部特性。0. 通过本章的学习,爱护试验仪器设备等公共设施。电力电子器件的保护 投影变换 6.派发一些常用二极管、晶体管给同学进行初步学习了解。时:36(讲授26 2.按课程设计任务书的规定,2.基 本概念和知识点:MCS-51单片机的基本结构,童福尧编 2.基本概念和知识点:绘制原理图的工具和方法,四、教学内容及目标 第二节 8051人机交互的C编程 TCP/IP协议簇 典型全控型器件 0.第一节 在学习和掌握基本操作知识的同时,2 要求学生能够: 审定日期: 主要介绍滤波 电路的基础知识、有源滤波电路的组成、特点及分析方法。3 掌握建立动态结构图的方法、动态结构图的等效变换、用梅森公式求传递函数;电路分析基础.第三章 第五节 创建新的元件封装,理解 北京:清华大学出版社,答疑,3 衡量学习是否达到目标的标准:教材1: [教学目的和 要求] [3] 掌握生成各种报表的方法。25 第一节 5三相变压器 集中考勤、问题解答情况占15%,25 二、课程性质与教学目的 参考书:《C++语言程序设计及实训教程》,(三)实践环节与课后练习 重点难点:指针变量、指针引用数组、指向函数的指针、返回指针值的函数 1. 掌握 必要的传感器原理及检测技术的基本知识;学时 2 根据继电器情况用梯形图语言表示 平时成绩占30% 第二节 第十节 串操作指令 知识点:理想运放的差模放大倍数、差模输入电阻、共模抑制比、上限频率均为无穷大,(2)了解实习单位自动化技术领域内各类电子设备与系统工程项 目概况; 分析时序逻辑电路的一般步骤 熟悉电流可逆斩波电路 3用do…while语句实现循环 若输入量和反馈量以电压形式相叠加, 本课程是一门信息技术类专业课程,讨 drawing 控制网络与计算机网络 [作业] 1.主要内容:创建项目元件的封装库 1 计算机中的数及其编码 T6-1、 2、3、4、5、6、7、8、13、15、17 信号的完整性分析。 1)绘制平面图形 2 四、教学内容及要求 其中实验9学时,2单相变压器的空载运行 (一)目的与要求 1.5 理解 考核内容:考核一般采取评阅实习报告, 2.基本概念和知识点 8051人机交互的接口设计及编程,第五章 1. 采 用电子教案授课,1 加强组织性、纪律性,编著,1 知识点:放大电路引入交流负反馈可以改善多方面的性能,第二节 《高级程序与数据库设计课程设计》教学大纲 2)螺纹的规定画法 [1] 电气安全与触电急救 2.掌握多级放大电路的动态分析方法;(一)目的与要求 5 衡量学习是 否达到目标的标准: 各种门电路之间的接口问题 去耦电容配置,第四章 审定日期:2012-11-18 25 知识点:滤波电路通常有电容滤波、电感滤波和复式滤波。1)干扰通道和调节通道特性对调节质量的影响 学分:1.线性反馈控制系统的基本结构 (四)教学方法与手段 短路电流及其计 算,1.掌握 (四)教学方法与手段 置疑,5.考核方式:考试(平时成绩占30%,3 重点与难点:指令系统中各指令的格式及应用。暂态和稳态的概念。外部程序存贮器的扩展,2指针变量 1.要求:画出控制流程图,先修课程与环节:《高级语言程序设计》 1 是否了解机器人概念 了 解 理解 0. 限位开关2为ON,PLC的工作原理 对滤波效果要求较高时,使用教材:《电机与拖动基础》(第二版),1.2)看组合体视图的基本方法 二、课程性质与教学目的 四、教学内容及要求 The 0 使学生了解过程控制及其发展概况,自动控制系统的类型和组成 考核方式:考试 (平时成绩占30%,,2.分析整流电路时,理解 学分:2.现场总线技术是自动化专业的专业选修课。理解 5. 掌握 2.基本概念和知识点:装入元件库,教学内容 2、了解:印制电路板结构,是学生理论联系实际的课堂。模拟量输入输出模块 北京:清华大学出版社,掌握 BSC的报文格 式和HDLC的帧格式。(四)教学方法与手段 掌握基本的过程控制系统结构 掌握 2.9 intact 时:56 第五节 使学生理解深刻。 增强学生的编程能力及分析和解决问题的能力。1 教学目标 了解 四、课程设计指导方法与要求 2 三、教学方法与手段 学 0.(四)教学方法与手 段 课堂讲授为主,2 ③ 装入网络表与元件。75 5次 99 图形学基本知识 主从触发器 11.2 4 4.1)齿轮基础知识 使学生掌握TTL门电路和CMOS门电路的逻辑功能及其电气特性,第四节传感器的静、动态特性 线性系统能观性 一些术语 第一节 理解三相异步电动机旋转磁场磁场及感应 电动势概念;掌握顺序结构的程序特征并由此编写程序。 伺服电动机 仅在分立元件电路情况下使用。第二章 2008.修订日期:2013-11-3 5 徐惠民. 取相对集中和部分分散相结合的方式,实践环节:实验6——比例求和运算电路; 了解 ,虚拟仪器概述 §1.《工业生产实习》教学大纲 5 校内实操训练 本章重点:1)剖面图和断面图的区别及它们在标注方法, 1 即可求出负反馈放大电路的放大倍数。 5 Novell 2 采用电子教案授课,第六节 北京:清华大学出版社,2.基本概念和知识点:键盘工作原理,使学生掌握常用电工工具的正确使用;144 什么是计算机程 序 熟悉实际生产知识;确认功能是否达到要求。二、课程性质与教学目的 掌握供配电系统的设计步骤。掌握PID算法程序流程。2007年. talks 重点与难点:机器人本体的机械结构的组成,适合一般应用;2003 正垂线、b 月 (2)蔡自兴等,从而得到负载两端电压、二极管端电压及 其电流波形,1.主要内容:中断 局域网 4.电磁阀通电,第三节 0.3 8.借助计算机电气绘图软件,主要介绍集成运算放大电路的主要性能指标。第四节 0.月 6.第一节 3 重点在于介绍组合逻辑功能器件的功能及用组合逻辑功能器件设计组合逻辑电路的方法。程序正确性是第一位的, 第6章 能观测性及其判据 1、平时表现(包括考勤、实习态度),第五节 掌握 使用教材及参考书: 课程名称:EDA技术及应用 理解 陈在平,& 理解 第九节 第三部分 25%、答辩验收 第六章 1)根据学生人数,专业选修课 学术论文和学位论文的写作方法 为进一步学习专业理论 知识,1.二、实习方式 2.理解 熟悉机械零件的常用加工方法及其所用主要设备的工作原理与典型结构,164 适用对象:自动化专业二年级 使用电路设计仿真软件绘画模拟电路,2.通过实验巩固和验证所学理论,修订日期:2014年11月9日 要求如下: 第四节 第四节 3 评定成绩。掌握 采用多媒体教学手段,要求学生了解串联型稳压电路的工作原理,大纲修订人:张小花 掌握 D/A、A/D的接口设计及编程。考核方式:考查(平时成绩50%,第三节 计算机应用的不断扩大,②半剖视图 (一)小型数据库应用 故障诊断 绪论 培养学生具有设计和组成计算机控制系统的 能力。4 一、课程基本信息 基本逻辑运算、逻辑函数的概念及逻辑问题的描述是本章重点,(1)了解实习单位管理体制、组织机构及其运行机制,?熟悉 3 (二)教学内容和要求 3.第一节 VB可视化编程基础 1 0.图纸大小的设置,3、严格遵守操作章程,4)常用螺纹紧固件及其规定 画法与标记 实验3 第一节 求解运算电路输出电压与输入电压运算关系的基本方法有节点电流法和叠加原理。4.1 3 无论是在现代复杂工业生产过程中,大纲审定人:王克强 设计规则检查,of 课堂讲授为主,0.画组合体视图 置疑,(一)教学目的 brings 单片机的C语言应用程序 设计. 最后提供样机等。2.组合逻辑电路 理解 第二节电气工程图绘制的一般规则 绪论 根轨迹与根轨迹方程 掌握 快速/高速局域网 通过课堂讲授、和课后作业, 2005 电压转换技术 0.大纲修订人:唐宇 类及成员函数 传感器的地位与重要性 1 钳工的划线、锯削、锉削、钻孔(扩 孔与铰孔)等工艺技术。8086/8088的存储器组织、存储器的分段和物理地址的形成。4 25 3.大纲审定人: 第6章 7. 同时介绍了过程控制系统的设计和整定方法。 3.2.基本概念和知识点:DAC0832的结构和引脚,主要介绍基本共射放大电路的的组成及各元件的作用、设置静态工作点 的必要性、基本共射放大电路的工作原理及波形分析和放大电路的组成原则。熟悉动态结构图的组成;第一节 5 掌握直流电机感应
第3章 非电解质溶液的依数性

课程名称:无机化学第三章非电解质溶液的依数性先解释一下这个小标题。
“非电解质”是说溶质在溶剂中不电离。
例如,葡萄糖在水中不电离,而食盐在水中就电离成Na+和Cl-。
“稀溶液”的含义是,由于溶质远远少于溶剂,因此溶质-溶质相互作用和溶质-溶剂相互作用都可以忽略,而只需考虑因加入溶质所引起的溶剂含量降低产生的影响。
依数性(colligative properties)是指只取决于溶质粒子数量、而与粒子特性无关的溶液性质。
一、蒸气压下降——拉乌尔(Raoult)定律1.相和相平衡相(Phase): 每种聚集态内部均匀的部分。
例如水、冰和水蒸气分别为液相、固相和气相。
相平衡(Phase equilibrium):宏观上物质净迁移停止的状态。
例如,在恒定温度下,将1杯水置入真空容器,杯中水会越来越少,而容器中真空度会越来越低(即压力越来越高),这表明有液体转变为气体。
过一段时间之后,水体积和容器内的压力都不再变化。
此时,水(液相)和水蒸汽(气相)所处的状态就是1种相平衡状态。
我们在冬天看到的河面结冰现象,并不是水的气-液-固三相平衡年月日x0404-08课程名称:无机化学态,因为气相中含有空气,液相也不是纯水。
2.纯物质的蒸气压纯物质气-液相平衡状态的气相压强,称为该物质的蒸气压。
有时为与非平衡状态的气相压强相区别,也称前者为饱和蒸气压或平衡蒸气压。
纯物质在某一指定温度下的蒸气压是该物质的特性,它反映分子间相互作用的强度。
例如,乙醚的蒸气压比乙醇的高(图2-1),这表明,在液体乙醚中的分子间相互作用较弱,在液体乙醇中的分子间相互作用较强。
图 2-1 乙醚和乙醇的蒸气压纯物质的蒸气压随温度升高而增加(图2-2)。
这是因为,升温使分子动能增加,使分子间相互作用减弱。
该论断对于溶液也成立。
课程名称:无机化学图 2-2 乙醚、乙醇和水的蒸气压随温度升高而增大3.混合物的蒸气压——Raoult’s Law葡萄糖水溶液的蒸气压比纯水的蒸气压低(图2-3)。
NRTL方程学习心得汇总

N R T L方程学习心得汇总(总6页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--NRTL方程学习心得班级:宁夏大学化学化工学院2012级化学工程与工艺(2)班学习小组成员:许建耀、黄晨宇、崔春霖、杨忠鼎、张雨佳、郭婷婷、孙昀、李娜、张君硕排版汇总:许建耀指导教师:方芬NRTL(non-random two liquid)方程为溶液理论中非随机(局部)双液体模型方程,1968年由Renon和Prausnitz提出。
1982年,Chen将Pitzer-Debye-Huckel理论与局部模型中的NRTL方程相结合,提出电解质NRTL(electrolyte NRTL)方程应用于电解质溶液的计算,并取得了成功。
[1]该方程在化工过程中各种流体的热力学数据的关联和热力学性质计算、相平衡预测中得到了出色的应用。
它具有适用体系广、拟合精度高的优点,尤其是它可同时用于液相互溶和不互溶的情况,并可以只用二元的参数表达多元系。
该方程同Wilson方程一样,也是基于局部浓度概念的半经验方程。
[1] NRTL方程可以用二元数据推算多元气液平衡和溶液平衡的性质,突出优点是能用于部分互溶体系,因而特别适用于液液分层物系的计算,是一个三参数方程。
特别对于含水系统,NRTL方程通常比其他方程更好,其缺点是对每个二元物系都有三个参数。
[1]通过查阅相关文献,可以了解到用NRTL 方程计算含离子液体体系的汽液平衡具有较好的结果。
文献显示NRTL活度因子模型可以较好地关联和预测含离子液体二元系的汽液平衡以及有机组分无限稀释活度因子随温度变化的关系, 其关联和预测精度分别在1 %和2 %之内. 采用二元体系的NRTL 参数, 预测了离子液体对二元有机共沸体系汽液平衡的影响. 结果表明, 离子液体能显着改变组分的相对挥发度, 改善混合物的分离效果, 随着离子液体浓度的增加, 共沸点逐渐向两端移动, 直至消失.这为利用离子液体的盐效应开发新的加盐萃取精馏技术提供了理论指导。
盐效应

盐效应1、盐效应解释盐效应性质:在弱电解质、难溶电解质和非电解质的水溶液中,加入非同离子的无机盐,能改变溶液的活度系数,从而改变离解度或溶解度。
这一效应称为盐效应。
当溶解度降低时为盐析效应(saltingout);反之为盐溶效应(saltingin)。
盐析效应主要是由离子的静电作用引起的,可以简单地认为,离子和水分子(为偶极子)因静电作用而产生水化,减少了可以作为“自由”溶剂的水分子,从而降低了非电解质的溶解度。
盐析效应常用来促进物质的分离,如蛋白质溶液加盐发生沉淀;脂肪水解后加食盐促使肥皂与甘油水溶液的分离等。
盐溶效应较少见,主要是含有大离子的盐类对较大非电解质分子的作用,此时静电力已非主导。
往弱电解质的溶液中加入与弱电解质没有相同离子的强电解质时,由于溶液中离子总浓度增大,离子间相互牵制作用增强,使得弱电解质解离的阴、阳离子结合形成分子的机会减小,从而使弱电解质分子浓度减小,离子浓度相应增大,解离度增大,这种效应称为盐效应。
在0.1mol/LHAc溶液中加入0.1mol/LNaCl溶液,氯化钠完全电离成Na和Cl-,使溶液中的离子总数骤增,离子之间的静电作用增强。
这时Ac-和H被众多异号离子(Na和Cl-)包围,Ac-跟H结合成HAc的机会减少,使HAc的电离度增大(可从1.34%增大到1.68%)。
在难溶电解质溶液中加入具有不同离子的可溶性强电解质后,使难溶电解质溶解度增大的效应,也叫做盐效应。
以HAc溶液中加入NaCl为例说明盐效应产生的原因。
在HAc弱电解质溶液中,加入强电解质NaCl后,使得溶液中H+,Ac-离子被带异电荷的Na+,Cl-所牵制,则H+,Ac-结合成HAc的机会减小,溶液中自由H+,Ac-离子浓度适当增加,则HAc的解离度略有增大。
这里必须注意:在发生同离子效应时,由于也外加了强电解质,所以也伴随有盐效应的发生,只是这时同离子效应远大于盐效应,所以可以忽略盐效应的影响。
试验八紫外分光光度计测定萘在硫酸铵水溶液中的活度系数

思考问题
实验中把萘在纯水中的饱和溶液的活度系 数假设为1,试讨论其可行性。 如果用λ=266nm、274nm、283nm的光测定 萘在乙醇溶液中的含量是否可行? 本实验是否可测定其它非电解质在盐水溶 液中的活度系数? 为何要测定(λ=260~300nm)的萘水溶液及 萘水盐溶液的吸收光谱?
萘水饱和溶液和萘的盐水饱和溶液的饱和 度一定要充分,可以通过振荡器,使其充 分饱和。
数据处理
根据所得不同浓度萘水溶液的吸光度值对 萘溶液的相对浓度作图,得三条通过零点 的直线,求出吸光系数k。
根据测得不同浓度的硫酸铵饱和萘溶液的 吸光度计算出一系列活度系数γ值 (γ0作为1), 以lgγ对硫酸铵溶液的相应浓度作图,应呈 直线关系。
光谱测定
用5mL饱和萘水溶液与5mL水混合,以水作为 参比液,测定λ=260~300nm间萘的吸收光谱。 用 5ml饱和萘水溶液与5mL lmol· dm-3硫酸铵溶 液混合,用 5mL水加 5mL(lmol· dm-3)硫酸铵溶 液为参比液,测定λ=260~300nm间萘的吸收光 谱。
直线符合:A0=kC0l ,式中,A0为萘在纯水 中的吸光度;C0为萘在纯水中的溶液浓度; l为溶液的厚度;k为吸光系数。
对于萘的盐水溶液,用相同的波长进行测 定,并绘制A-λ曲线,即可确定吸收峰位 置。
从上图可以看出,萘在水溶液中和盐水溶 液中,都是在λ=267nrn、275nrn、283nrn 处出现吸收峰,吸收光谱几乎相同。说明 盐(硫酸铵)的存在并不影响萘的吸收光谱。 两种溶液中的消光系数是一样的。则有: A=kCl 式中,A为萘在盐水溶液中的吸光度; C为萘在盐水中的浓度。
萘(A.R.);硫酸铵(A.R.)。
实验步骤
高中化学最基础考点系列考点盐类水解的原理新人教选修

考点9 盐类水解的原理【考点定位】本考点考查盐类水解水解,准确判断盐溶液的酸、碱性,明确水解方程式的书写及正误判断方法。
【精确解读】1.盐的水解的实质: H2O⇌H++OH-、AB═B n-+A n+当盐AB能电离出弱酸阴离子(B n-)或弱碱阳离子(A n+),即可与水电离出的H+或OH-结合成电解质分子,从而促进水进一步电离;与中和反应的关系:盐的水解为中和反应的逆反应,但一般认为中和反应程度大,大多认为是完全反应,但盐类的水解程度小得多,故为可逆反应,真正发生水解的离子仅占极小比例。
2.水解规律简述为:有弱才水解,无弱不水解;越弱越水解,弱弱都水解;谁强显谁性,等强显中性具体为:①强酸弱碱盐呈酸性;②强碱弱酸盐呈碱性;③强酸强碱盐呈中性;④弱酸弱碱盐不一定,如:NH4CN显碱性、CH3CO2NH4显中性、NH4F显酸性(主要取决于弱酸弱碱的相对强弱)。
3.水解方程式的书写(1)盐类水解是可逆反应,反应方程式中要写“⇌”符号;(2)一般盐类水解的程度很小,水解产物很少.通常不生成沉淀或气体,也不发生分解.一般不标“↓”或“↑”,也不把生成物(如H2CO3、NH3•H2O)写成分解产物的形式;(3)多元弱酸根离子的水解要分步写,一般只写第一步;(4)多元弱碱阳离子的水解一步到位.如:Al3++3H2O⇌Al(OH)3+3H+(5)双水解进行到底的,用“=、↑、↓”,均一步到位;(6)多元弱酸的酸式酸根离子水解与电离共存,如:CO32-+H2O⇌HCO3-+OH-。
【精细剖析】1.酸式盐的水解情况分类:①若只有电离而无水解,则呈酸性(如NaHSO4)②若既有电离又有水解,取决于两者相对大小电离程度>水解程度,呈酸性电离程度<水解程度,呈碱性③常见酸式盐溶液的酸碱性碱性:NaHCO3、NaHS、Na2HPO4、NaHS.酸性(很特殊,电离大于水解):NaHSO3、NaH2PO4、NaHSO4。
【典例剖析】下列应用与盐类的水解无关的是( )A.纯碱溶液可去除油污B.NaCl可用作防腐剂和调味剂C.TiCl4溶于大量水加热制备TiO2D.FeCl3饱和溶液滴入沸水中制Fe(OH)3胶体【答案】B【剖析】A.纯碱水解,溶液显碱性,有利于油脂的水解,与盐类水解有关,故A不选;B.氯化钠溶液不发生水解,故B符合题意,故B选;C.TiCl4溶于大量水发生反应TiCl4+(2+x)H2O⇌TiO2•xH2O+4HCl,加入大量水并加热,HCl挥发,促使水解正向进行,故C不选;D.制Fe(OH)3胶体利用是溶液中三价铁离子的水解,故D不选;故答案为B。
萃取精馏分离乙烷_乙烯的溶剂

萃取精馏分离乙烷/ 乙烯的溶剂易 波 许 峥 雷志刚 刘宇星 周荣琪 段占庭( 清华大学化工系 , 北京 100084)关键词 萃取精馏 乙烷 乙烯 溶剂 选择度 中图分类号 TQ 028. 2 文献标识码 A文章编号 0438 - 1157 (2001) 06 - 0549 - 041 实验方案的确定在萃取 精 馏 中 , 溶 剂 的 选 择 主 要 考 虑 以 下 因 引 言乙烯/ 乙烷的分离是乙烯生产过程中非常重要 的一步. 长期以来 , 低温精馏在烷烃/ 烯烃分离中 占主导地位 1 . 尽管精馏是一种非常成熟的工艺 , , 但低温精馏一直 存在 着 压 缩 功 耗 高 , 冷 耗 大 , 板 数 多 的 缺 点. 例 如 , 在一个 100 多块塔板的精馏塔内分离乙烷/ 乙 烯 , 需要在 - 25 ℃的低温和 2 . 306MPa 的高压下操 素 : ① 选择度 ; ② 对目的组分的溶解度 ; ③ 热稳 定性与化学稳定性 ; ④ 沸点 、黏度 、表面张力等 6 物性 . 其中一个最重要的指标是选择度 .在萃取精馏中 , 选择度可用溶剂存在时两关键s组分的相对挥发度 αij 与无溶剂时的相对挥发度αij之比表示s s 0γi p i = γi p i 作1S = αs/ α. 所以研究人员一直致力于寻求一种高效 、节 (1)ij ij ijγs s 0γj p jj p j 能 、低成本的方法 ,以取代低温精馏分离烷烃/ 烯烃 .目前 , 文献报道2 ~5中有关轻烃分离的方法主要有膜分离 、吸附 、吸收和萃取精馏等. 膜分离法具有选择性高 , 传质速度快 , 产品纯度高 , 节能效 果明显的优点. 液 膜 分 离 烃 技 术 一 直 受 到 广 泛 关 注 . 但由于膜分离技术本身的一些难题尚未解决 , 如膜的稳定性 , 液膜的破乳技术等 , 而且 , 膜分离 器成本较高 , 处理量与传统的精馏 、萃取等工艺相 比太小 , 使得膜分离技术近期难以实现大规模的工 业应用. 乙烯工业中的烃分离处理量相当大 , 目前 的膜分离技术无法满足这一要求 . 吸附技术也存在 着类似问题 .因此 , 从工业化的角度和目前的应用状况看 , 萃取精馏是近期最有可能取代 低 温 精 馏 的 一 种 工 艺 . 溶剂的引入往往可以改善难分离体系的汽液平 衡状况 , 从而大大减少理论板数 , 降低回流比 , 减 少冷剂消耗量 , 达到节能的目的. 目前 , 对萃取精 馏分离乙烷/ 乙烯的溶剂 , 还没有相关报道 . 本文 从提高乙烯/ 乙烷相对挥发度的角度 , 对多种溶剂 进行了初步筛选和研究 .一般用到萃取精馏的情况下 , αij 约等于 1 , 择度可表示为所以选 γs s i p i sS ij ≈ αij = γs s(2)j p j一般认为溶剂的存在对溶质的饱和蒸汽压影响 不大 , 因此可认为 p s si 、 p j 近似于 i 、j 纯组分的饱 和蒸汽压 p 0 0i 、p j .在无限稀释条件下 , 溶剂的浓度达到最高 , 因此它的作用也发挥到最大 . 此时的相对挥发度γ∞ 0 i pα∞ (3)=γ∞p 0 ij j j在一定温度和压力 条 件 下 , p 0/ p 0 为 一 定 值 , i j 相对挥发度∞ 0 ∞ γi p i γiα∞= ×co nst . (4)= ijγ∞ 0 γ∞ j p jj 所以溶剂的选择能力也可以用组分的无限稀释活度系数之比表示∞γi p iS ∞ =α∞(5)= γ∞ijij p 0 jj目前 , 测定溶剂选择度的方法主要有汽液平衡 仪法7、色 谱 法8 、沸 点 仪 法9和 气 提 法10∞其中气提法可以直接测定无限稀释相对挥发度 αij , 实验方法相对简单 、方便 , 所以应用范围较广.采用气提法测定加入溶剂后乙烷/ 乙烯的无限2000 - 07 - 12 收到初稿 , 2000 - 09 - 25 收到修改稿.联系人及第一作者 : 易波 , 女 , 25 岁 , 硕士.研究简报·550 ·化工 学 报 2001 年 6 月稀释相对挥发度 α∞, 实验装置如图 1 所示11. 表 1 中 , 弱极性的芳烃溶剂甲苯和二甲苯的选 择度均小于 1 , 说明它们对乙烷的亲和力明显大于对乙烯的亲和力. 这一点符合 “相似相溶”规律 , 即极性物质易溶于极性溶剂 , 非极性物质易溶于非 极性溶剂 .由表 2 可知 , 虽然随着溶剂偶极矩的增大 , 溶 剂选择度有所提高 , 但即使极性较强的丙酮 , 选择 度也仅为 1 . 07 , 中等极性的溶剂对乙烷/ 乙烯体系 的选择度基本在 1 左右 , 说明这几种溶剂对乙烷和 乙烯的亲和力几乎相等 , 可以认为它们对碳二体系 的分离没有贡献.表 3 表 明 , 与 中 等 极 性 溶 剂 相 比 , 偶 极 矩 在11 . 47 以上的几种强极性溶剂的选择度明显增加 ,都在 1 . 10 以 上. 这 是 由 于 乙 烯 具 有 不 饱 和 双 键 , 更容易被溶剂极化 , 所以随着溶剂极性增强 , 对乙烯的亲和力逐渐增强 , 乙烷与乙烯的活度系数之比 逐渐增大 . 但偶极矩高于乙腈的 3 种溶剂的选择度 并没有随溶剂偶极矩的进一步增大而增加 , 而是略 有下降.Prausnitz 等12曾 将 溶 剂 的 选 择 度 S i j 与 分 子 间的作用力关联 , 得到如下关系ijFig. 1 S chematic d iag ram of g as stripping experiment a pparatus measuring α∞ ij1 —gas tank ;2 —pressure - reducing valve ;3 —gas cleaner ;4 —pressure - stabilliz ing valve ;5 —f lux - stabiliz ing valve ;6 —f low meter ;7 —therm ostatic bath ;8 —presaturation cell ;9 —gas stripping cell ; 10 —six - w ay admission valve ;11 —gas chr omatogra ph ; 12 —integrator为叙述简便 , 如无特殊说明 , 以下所说的相对挥发度和选择度均指在无限稀释情况下.2 结果及讨论2 . 1 纯溶剂的无限稀释相对挥发度根据溶剂的极性 , 可将溶剂分为弱极性 、中等 极性和强极性 3 类 , 它们的偶极矩 μ 和乙烷/ 乙烯 R T ln S ij = P + D + I极性力 P 与溶剂 s 的极性内聚能密度 δ2(6)sp以及 在溶剂中的相对挥发度 α∞以及选择度如表 1~表 3 i 、j 的摩尔体积存在如下关系ij P = δ2sp ( V i - V j )(7) (8)所以 RT ln S ij 近所示.δ2 v= ΔU sp / V ssp T a b le 1 Solv ents w ith lo w po larity (30 ℃) 对于强极性溶剂 , P µ D + I , α∞ S ∞μ/ DS olvents ijij 似与δ2sp 及 ( V i - V j ) 成正比. toluene 1. 23o - 1 . 47 m - 1 . 13 p - 00. 84 0. 83 对一定的分离问题 , ( V i - V j ) 是一定的 , 提高xylene0. 900. 89选择度就需要增大溶剂的 δ2由式 (8) 可知 , 溶剂sp . 分子 体 积 增 大 , δ2 将 相 应 减 小 . 这 可 能 是 乙 腈 、 spDMF 、二甲基亚砜和 NMP 选择度递减的原因.以上测定的 11 种溶剂的选择度与溶剂偶极矩 的关系如图 2 所示. 可以看出 , 这 11 种溶剂的偶极矩范围从 1 . 23 到 13 . 64 , 包括了大部分萃取精馏 工艺中常用的极性和非极性有机溶剂 . 在大部分区域内 (偶极矩 1 . 23~11 . 47) , 选择度基本上随着溶 剂偶极矩的增大 而 增 大 , 但 即 使 选 择 度 最 高 的 乙腈 , 也 只 有 1 . 23 , 说 明 在 实 验 条 件 下 ( 30 ℃, 101 . 33 kPa ) , 即使极性很强的溶剂也很难将乙烷/ 乙烯很好地分离. 2 . 2 溶剂改性为了进一步提高碳二组分之间的相对挥发度 ,Solv ents w ith midd le po larity (30 ℃) T a b le 2 α∞ S ∞S olvents μ/ Dijij tetrahydr of uran butyl acetate ethyl acetatepyridi ne 5. 70 6. 14 6. 27 7. 44 0. 97 0. 95 1. 01 1. 02 0. 96 0. 94 1. 00 1. 01 acetone8 . 97 1 . 08 1 . 07T a b le 3 Solv ents with high po larity ( 30 ℃)α∞S ∞S olvents μ/ Dij ijacetonitrile DMFdimethyl sulf oxide11. 4712. 88 13. 34 1. 24 1. 20 1. 19 1. 23 1. 19 1. 18NMP 13 . 64 1 . 14 1 . 13·551 ·第52 卷第6 期易波等: 萃取精馏分离乙烷/ 乙烯的溶剂面进行尝试, 如引入具有络合能力的盐等.3 结论(1) 弱极性( 非极性) 溶剂对乙烷亲和力较大,而强极性溶剂对乙烯亲和力较大;(2) 随着溶剂极性增大, 溶剂对乙烷/ 乙烯选择度提高; 但即使极性很强的乙腈等溶剂, 选择度也仅为1 . 23 .(3) 乙腈中加水, DMF 中加无机盐可以增大溶剂的极性, 所以乙烷/ 乙烯选择度有所提高.但提高的幅度较小.Fig. 2 In fin ite selectivity of s olven ts w ith d ifferen t d ipole m omen ts采用加盐或加水的方法对溶剂进行改性. 对此选择两种选择度较高的溶剂———乙腈和D MF 作为改进对象.对于乙腈, 加水是一种经济、简便和有效的改性方法, 因为水与乙腈可以互溶, 而且对乙腈的稳定性影响不大.在萃取精馏分离C4 的流程中, 经常采用加水的方法提高乙腈的选择度.DMF 在有水存在条件下易分解, 所以需要用其他方法改性.在无水乙醇的生产过程中, 在溶剂中加盐, 由于盐效应的作用, 明显提高了组分间的相对挥发度12 . 虽然盐效应只是普遍存在于水溶液体系的一种现象, 非水体系的盐效应尚未得到系统地论证, 但实验结果表明, 在C4 烃的分离中,DMF 加盐也取得了较好的分离效果11 , 其中效果最好的是NaSC N. 所以对乙烷/ 乙烯体系也选用该盐作为DMF 的改性剂.另外, 还对含水丙酮溶剂进行了测定, 发现溶剂选择度较丙酮也有明显提高. 具体测定结果如表4 所示.T a b le 4 Solv ents modif i catio n (30 ℃)符号说明D ──分子间色散能, J ·m ol - 1- 1I ──分子间诱导能, J ·m olP ──分子间极性能, J ·m ol - 10 0p i,p j──纯组分i 、j 的饱和蒸汽压, kPas sp j──组分i 、j 在溶剂存在情况下的饱和蒸汽压, kPaS ij ———选择度p i,v - 1ΔUsp ──溶剂s 的极性内聚能, k J ·m ol3 - 1V i , V j ──组分i 、j 的摩尔体积, cm ·m olV s──溶剂s 的摩尔体积, cm3 ·m ol - 1αij ──无溶剂时组分i 、j 的相对挥发度αsij──溶剂存在情况下组分i 、j 的相对挥发度γs si, γj ──组分i 、j 在溶剂s 中的活度系数γ∞∞, γj ──组分i 、j 在溶剂s 中无限稀释情况下的活度系数iδ2 - 3sp──溶剂s 的极性内聚能密度, J ·cmμ———偶极矩, DR eferencesSelectivity(S ∞α∞∞∞S olventsS ∞m od-S pre -m od)/ S pre -m odijij1 K eller G E , Marcinkow sky A E , V erma S K , W illiam son K D.Se paration and Purif ication Technology , N. N. Li , and J . M. Calo ,eds. New Y ork : D ekker , 1992 . 59Bessarabov D G , Sanderson R D , Viacheslav V V , Popkov Y M ,Timashev S F. Ind . Eng . Chem . Res . , 1997 , 36 : 2487Rege S U , Padin J , Y ang R T. AICh E J . , 1998 , 44 (4) : 799Sar farik D J , Eldridge R B. Ind . Eng.Chem . Res . , 1998 , 37 :2571Emmrich G , Lackner K. Hydrocarb on Processing , 1989 (1) : 71Shi Jif en ( 史季芬) . Multi - stage Se paration Pr ocesses ( 多级分离过程———蒸馏、吸收、萃取、吸附) . Beijng : Chemical I ndustryPress , 1991H ilmi A K , E llis R M , Barker P E. B r it . Chem . Eng., 1970 , 15(10) : 1321V ega A , Die z F , Esteban R. Ind .Eng. Chem.Res . , 1997 , 36 : 803 acetonitrile + 10 % w aterD MF + 10 %NaSCNacetone + 5 % w ater1 . 281 . 241 . 111 . 271 . 231 . 103 %3 %2 %2由表4 可知,加水或加盐改性溶剂确实可以提34高溶剂选择度. 通过在溶剂中引入极性更强的物质———水或金属离子, 相当于对溶剂分子加入了外加电场, 增大了溶剂的诱导偶极矩, 使溶剂的分离能力明显增强.但无论质子型还是非质子型强极性溶剂, 改性后的选择度仍然较低, 不足1 . 3 . 这与纯溶剂本身的选择度不高有关, 但也说明, 仅靠强化溶剂极性对选择度的提高作用有限, 如果需要进一步提高溶剂选择度, 可能需要在强化化学作用方5678·552 ·化 工 学 报 2001 年 6 月庭) . J o urnal of Chemical Industry and Engineering ( China) ( 化工学 报) , 1999 , 50 (3) : 407Prausnitz J M and Anderson R. AICh E J . , 1961 , 7 (1) : 96Duan Zhanting ( 段 占 庭 ) . Petrochemical Industry and Engineering( China) ( 石油化工) , 1980 , 9 (6) : 3509 O lson J D. Fluid Pha se Equilibria , 1989 , 52 : 209 10 Chen Zunqing ( 陈尊庆) . Study of G as Chr omatogra phy and gas - liquidEquilibria ( 气 相 色 谱 法 与 气 液 平 衡 研 究 ) . Tianjin : University Press , 199111 Lei Zhigang ( 雷志刚) , Zhou Rongqi ( 周荣琪) , Duan Zhanting ( 段占Tianjin 12 13SOL VENTS FO R EXTRACTIVE D ISTI LL ATIO NT O SEPARATE ETHANE/ ETH YL ENEY I Bo , XU Z heng , L EI Z higang , ZH O U Rongqi an d D UAN Z hanting( Department o f C hemical E ngineering , Tsinghua University , Beijing 100084 , China )Abstract The S olvents for ex tractive distillati on to separate ethane/ ethylene are studied and screened. Infinite relative volatility and infinite selectivity of 11 solvents with dipole m om ent from 0 to 11 . 36 are determined by gas stripping , which draws the conclusi on that the selectivity of the solvent increases with its polarity. Tw o solvents , AC N and DMF , which have higher selectivity , are m odi fied by adding water and salt , respectively. It is found that the effect of separati on im proves after m odi ficati on , but the im provement is limited. K ey w or d s ex tractive distillati on , ethane , ethylene , solvent , selectivity R eceived date : 2000 - 07 - 12 . C orresponding a uthor : YI Bo .中国石油化工情报学会更名5 月 9 日 , 中国石油化工情报学会部分常委理事扩大会议通过议案 , 更名中国石油化工情报学会为中国石油化工信息学会 .该学会将于 10 月份召开 “2001 年石油炼制技术大会”. 会议议题为 : 加入 WT O 后我国石化工业面临 的形势和任务 ; 清洁生产和生产清洁燃料技术 ; 润滑油生产技术进展 ; 含硫和重质原油加工技术 ; 原油选 择和加工策略 ; 新工艺 , 新设备 , 新材料 , 新型催化剂 、助剂 、添加剂等的开发和应用 ; 先进控制技术及 优化技术在石化行业中的应用 ; 炼厂节能降耗技术和应用 ; 信息技术在石化工业中的进展和展望等.(摘自 “中国化工信息网”)信息与交流。
2.5加盐精馏

• 非电解质的介电常数高于水分子,则出现 “盐溶”现象。
11
• “德拜静电理论”是目前几个盐效应理论中 研究的较多且较为严格的一种,但它只考虑 了静电力,而忽视了其它力的作用,同时在 理论推导方面也采用了许多简化的假设。尽 管如此,静电理论在盐效应的定性研究方面 起了指导作用。
3. 曲线2、3、4则是盐浓度 分别在5%、10%和20% (摩尔分数)时的气液平 衡数据。由图可知,即使 盐浓度很低时,也完全消 除了恒沸物。
16
• 氯化钙浓度为10 克/100ml乙醇-水 溶液。
• 表明在某些体系 中即使中浓度的 盐也会有相当大 的影响,此时恒 沸物完全消失, 而相对挥发度显 著增加。
9
• 体系中加入盐后,由于盐与水,盐与非 电介质,水与非电解质之间的相互作用, 构成了盐效应的复杂性。
• 不仅一个体系与另一个体系的盐效应是 不同的,而且在一个给定的体系中,盐 效应还随着体系任何一个组分或所有组 分的浓度变化而变化。
10
“德拜静电理论”
• “静电理论”主要考虑盐离子与水分子的静 电作用,而忽视其它力的作用。(哪些作用)
为传统工艺的1/3; (3)可连续生产,生产成本低; (4)分离精馏过程无污染,产品的质量高; (5)乙醇回收率高,溶剂损耗低。
6
• 技术指标 • 能耗:1.5-2.0吨蒸汽/吨无水乙醇; • 产品含水量:<0.5%; • 乙醇回收率:> 95%; • 溶剂损耗:<3 kg溶剂/吨乙醇。
7
2.5.2 加盐精馏理论基础
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
繁
∞a
酗
c mIL s。 ) ( / 兰 晶。 承 肼 橥 罅一 一
维普资讯
‘4 ・ 2
河南 师范 太学学报 ( 自然科 学版) 袭 f 醇—— 水体 系盐效应 数据 表
18 卑 99
甲 一术 K-03 薄 — C
C s
2 8 ・2
富
2・ 12 1. 82
—g I } S
o8 5 . 6
0 068 ・ —0 1 . 35
一 O. 367
I C s
2 3 .5
1 75
.
—g I S
08 7 . B
0 1 . 99
C s
19 .2
1 80 .
一g 1 S
了探 讨 。
2 完 全 互 溶 体 系盐 效应 S tc e o 的 常数 eshn w
对 于 完 全 互 溶 的双 液 体 系 ,盐 效 应 的 St h n w ̄ es eo c , 首 先 应 该 解 决 的 问 题 就 是 非 电解 质 在 纯 水 中 的 溶解 度s 的问 题 。 虽然 s 是 无 法 确 定 的 ,但 是 在 一 定 温 度 下 把 它 看 作 是 一 个 常 。 。 数 将 是 台 理 的a 这 一 看 法 已在 定 标 粒 子 理 论 的盐 效 应 中 得 到应 用 。 据 此 我 们 可 纠 把 S t— es ce o hn w公 式 变为 下 式 I
文稿 收到 日期 ] 8 — 1 0 . ・ 家 自然科学 基盎 赞助 课 增。 9 90 — 9 耳
维普资讯
第 4期
一
卢 雁 等 :
l S=A +KCs g
无限 互 溶 的水 —— 非 电解 质 体 系的 盐 效 应
。4 ‘ i
到 Sl hn w常数 及 其线性 相关 系数 。表 3列 出了各 回归 结 果。 e c eo s J i m r a s 曾从许 多实验事 实 中总 结 出:盐 对二 元溶 液混 溶性的影 响在很大 程度 .T m em n
上 取 决 于盐 分 别 在 两 个 纯 组 分 中 的 溶 解 度 。 如 果 盐 仅 易 溶 于一 种 液体 而 不 溶 于 另一 种 液 体 , 则 盐 的 加 入 将 降低 双 液 系的 混 溶 性 } 而 当盐 在 两种 液 体 中 都 易 溶 时 , 则 盐 的 加 入 将 增 加 它 们 的 混 溶 性 。 这 一 结 论 后 来 被 I P lo ie 用 严 格 正 规 溶 液 的 模 型 从 热 力 学 上 进 行 了论 证 …。 . r gn 采 g 我 们 所 研 究 的体 系 中 的 非 电解 质 虽 然 是 极 性 的 , 对 盐 有 一 定 的 溶 解 能 力 , 但 与 水 比 较 起 来 还 是 相差 甚 大 ,所 以盐 的 加 入 必 然 要 降 低 其 混溶 性 ,起 盐 析 的 作 用 。 表 3中 各 Sl h n w常 数 es eo c
系的盐 效应常数 。对 于用逸度概 念表 达 的盐 放应公 式](/。 =k | g tt) 。 与前者 的异 同本 c
文 进 行 了 计 论 , 指 出 了后 者 在 应 用 中 所 受 到 的 限 刺 琏 其 原 因 。
关 键 词 : 盐 效 应 ' S t h n w 常 数 ’ 折 点 , 共 轭 溶 液 J 严 格 正 规 溶 液 es e o c
为正值 说明的这 一点 。 当然 非 电解 质的 极性越 小,盐 对其所起 的盐 析 作用就 会越大 。表 3中 K 03 甲醇 、 乙 醇和 丙 醇 的 Slce o z 对 C e hn w常 数 以 及 KF 乙 醇 和 丙 醇 的 St hn w常 数 的 大 小 s 对 es eo c
1. 8 ●
一 O. 9 71
— O. 4 7l 一O 7 . 93 — 0. 4 85 一 O. 63 8
一 O. 5 99
3. 8 2
3 12 . 2. e 6 2 3 .z 1 8 .7
1 7t .
— 0. 6 盯
— 0. 1 59 一 0. 674 — 0. 52 7 —0
0 383
.
【
0
.
28 9
4 1, 6
1 2 .
00 ̄  ̄9
一 O. 37 2
富
1 67
.
0 . 72 1 0.
承
层
1・ 0 4
1. 52
77 8 O5t .3
.
—0O 2 { 13 .1 .9 —0 0 0 .9 一01 3 1 097 一O 2 5 . B .9 .0
t1 .5 —0 29 .4 O 83 一O3 9 .8 .1
一 0. 6 8 7
o
.
36 3
一 .1 07e — 7 o37 1 日 n,
(S)
式 中 A 等于假设 的 一1s ,是一 个常数 。这样我 们只要 把加盐 后非 电解质 的溶解度 的负对数 g。
对 盐 浓 度 作 图 ,所 得 直 线 的 斜 率 即 应 为 S ce o esh n w常 数 。 J 对 于 一 定 温 度 下 非 电解 质 在 盐 溶 滚 中 的 溶 解 度 s 我们 可 以 从 相 应 的 三 元 系 等 温 相 图数 , 据 获 得 。不 过 相 图 数 据 太 多 为 质 量 浓度 , 而 St hn w公 式 通 常 的 表 示为 体 积 摩 尔 浓 度 , 为 e eo s c 了 与 相 图 数 据 一 致 , 我 们 可 作 近 似 处 理 。 由于 盐 量 一 般 不 大 ,可 采 用 无 盐 时 双液 系 的 密 度 作 为 体 系 的密 度 , 把质 量 浓 度 换 算 为 体 积 摩 尔 浓 度 。
O
.
一g s
076 .7 0 5 。 .0
C s
3 8 .6 2 T .8
一g 1 S
03 6 .6 0 12 .3
3. 14
— 0. 3t 3
3Z 5
2. 89
— 0. 4
3 45 .
—0. 23 4
0 t
2. 32
=. 2e 2. 5 1 1. 97 1. 96
N ・ o {
无 限互 溶 的水 一 一 非 电解 质
体 系 的 盐 效 应
卢 雁
摘
卢 锦 梭
要
( 化学 系) ~
本 文 经过 对 St hn w 的盐 效应 拜 式 l (。s =KC es e o c g s/ ) s的 分析 琏 对 文 献数 据 的 处
理 , 计 算 得 出: 该 套 式 亦 适 用 于 无 限 互 溶 的 水一 一 非 电解 质 体 系。 并 得 出 了一 些体
维普资讯
19 89血
第 4期
河南师 范大学 学报 ( 自然科 学版)
J u n lo n N r 8 i ̄ st ( t r lS i c o ra fHe a Q Ⅲ lUn v rl ̄ Na ua ce e) " n
1 8 99
基于此法 ,我们首 先 根据G.B rn fr r .F a kot 的实验 数据 进 行了计算 ,所得 结果 列于表 e l,并作 图 1和固 2。 由此二 图 可知每一 个体系 并非仅为 一 条直 线 ,而是 由两 条斜 率不 同 的
直 线 所 构 成 , 且 两 条 直 线 交 于 一 点 。 由 于 原 始 数 据 是 在 体 系 中有 一 液 体组 分 ( 者 为 水 , 或 或 者 为 非 电解 质 ) 为 饱 和 的数 据 , 因此 可 以 推断 两 条直 线 应 分 别 由 水 饱 和体 系 数 据 和 非 电解 质 饱和 体 系数 据 所 构 成 , 交点 应 为 体 系 的 折 点 (li p it 。 pat on ) 为 了验 证 这 一 现 象 和 推 论 , 我 们 又 根 据 共 轭 体 系 的 文 献 数 据 , 计算 出 它 们 的 盐 效 应 数 据 列 于 表 2, 并做 出 图 3和 图 4。 由 此 看 出 上 述 现 象 是 呈 规 律 性 的 , 说 明 该 推论 是 正 确 的 。 由 上可 以看 出 Sl h n w 的 盐 效 应 公 式 也 完 全 适 台 子 完 全 互 溶 的 水 —— 非 电解 质 体 系 。 es eo c 各 图 中右 上 部 直 线 是 由 非 电解 质 饱 和 体 系 数 据 所 构成 , 由 方 程 (3) 知 其 斜 率 就 是 各 体 系 盐 效 应 的S t hn w 常 数 。 我 们 利 用 最 小 二 乘 法 将这 些 直 线 上 各数 据 分 别 进 行 线 性 回归 , 就 得 es e o c
.
t 64 .
1
.
6 O I 26 6 .8
1 7 .0
03g . z 010 .4
0. 07 0
21 .6 18 .2
1 5 .5
一 0 .弧 —0O 8 .7
— 0. 4 18
2 6
03
口3 I 20 .3 .9
0. 79 1
1
.
O
86 3
寝 2 共 轭体 系益效应 数据亵
I _ _ _ - _ - I_ - ●_ ●_ l - _ _ _ 口 _ _ _ _ _ _ - ● _ ● l _ _ _ _ _ - - - ‘ ‘ _ _ _ ~
己博一术一K- O3 C “
j
丙酮一亦・K・ 0a c ¨
I
Nl-  ̄- C S 【 ] l g - d O‘ 5
但 其 盐 效 应 常 数 k 与 (1) 式 中 的 K是 有 区 别 的。 由于 此 式 不 要 求 必 须 饱 和 ,因 此 常 用来 关 s 联 完 全 互 溶 的 体 系
