两种质粒中gus基因在植物细胞和根癌农杆菌中的表达特性研究_英文_
GUS报告基因

报告基因●定义报告基因 (reporter gene)是一种编码可被检测的蛋白质或酶的基因,也就是说,是一个其表达产物非常容易被鉴定的基因。
把它的编码序列和基因表达调节序列相融合形成嵌合基因,或与其它目的基因相融合,在调控序列控制下进行表达,从而利用它的表达产物来标定目的基因的表达调控,筛选得到转化体。
特征作为报告基因,在遗传选择和筛选检测方面必须具有以下几个条件:(1)已被克隆和全序列已测定;(2)表达产物在受体细胞中本不存在,即无背景,在被转染的细胞中无相似的内源性表达产物;(3)其表达产物能进行定量测定。
●应用在植物基因工程研究领域,已使用的报告基因有以下几种:胭脂碱合成酶基因(nos)、章鱼碱合成酶基因(ocs)、新霉素磷酸转移酶基因(nptⅡ)、氯霉素乙酰转移酶基因(cat)、庆大霉素转移酶基因、葡萄糖苷酶基因、荧光酶基因等。
nos、ocs这两个基因是致瘤土壤农杆菌(Agrobacterium tumfaciens)的Ti质粒特有的,对Ti质粒进行改造,用相应的致瘤农杆菌转化植物体时,如果外源基因转入植物体中,则这两种报告基因在植物根茎叶中均能表达,不受发育调控,检测时直接用转化体提取液进行纸电泳,染色后在紫外光下观察荧光即可。
nptⅡ、cat及庆大霉素转移酶基因,均为抗生素筛选基因,相关的酶可以对底物进行修饰(磷酸化、乙酰化等),从而使这些抗生素失去对植物生长的抑制作用,使得含有这些抗性基因的转化体能在含这些抗生素的筛选培养基上正常生长,也可以用转化体提取液体,外用同位素标记,放射自显影筛选转化体。
目前常用的一种报告基因是β-D-葡萄糖苷酶基因,该酶催化底物形成β-D-葡萄糖苷酸,它在植物体中几乎无背景,组织化学检测很稳定,可用分光光谱、荧光等进行检测。
荧光酶基因(luc)是1985年从北美荧火虫和叩头虫cDNA 文库中克隆出来的,该酶在有ATP、Mg2+、O2和荧光素存在下发出荧光,这样就可用转基因植物整株或部分直接用X-光片或专门仪器进行检测。
GUS报告基因范文

GUS报告基因范文GUS报告基因是一种用于筛选转基因植物的报告基因。
它在植物细胞内表达的酵素β-葡萄糖苷酶(β-Glucuronidase,GUS),能够将葡萄糖醛酸(X-Gluc)转化为蓝色产物。
通过观察和分析植物组织的GUS活性,可以判断是否发生了基因转化。
下面将详细介绍GUS报告基因的特点、应用以及实验方法。
1.GUS报告基因的特点(1)GUS基因来自于大肠杆菌,它很少在真核生物中表达,因此不会对植物正常生长发育产生影响。
(2)GUS基因编码的酵素活性能够方便、快速地用染色剂标记出来,实验结果直观可见。
(3)转GUS基因的步骤相对简单,转化率较高,且不需要使用昂贵的设备。
2.GUS报告基因的应用(1)植物转基因筛选:通过观察和分析转基因植物的GUS活性,可以确定哪些植株成功地转化了外源基因。
(2)基因调控研究:GUS报告基因可以用来研究目的基因的表达调控机制,例如在转基因植物中瞬时表达GUS基因,观察其在各种组织和发育阶段的表达情况,可以推测目的基因的启动子活性。
(3)信号传导途径研究:通过构建GUS基因的操纵,可以研究植物信号传导途径中特定基因的表达情况,进而了解信号传导途径的效率和调节机制。
3.实验方法以下是GUS报告基因实验的一般步骤:(1)构建GUS载体:将GUS基因与适合的植物表达载体进行连接,形成GUS转化载体。
(2)遗传转化:将GUS转化载体导入要进行转基因植物研究的植物细胞中,使用适当的生物技术方法(如冲击法、农杆菌介导法)实现遗传转化。
(3)植物筛选:选择经过转化的植株进行分析,通常可以通过PCR、Southern blot、Western blot等技术检测GUS基因的存在。
(4)组织切片染色:收集不同部位的植物组织,例如叶片、根、花等,制作切片。
使用X-Gluc作为底物加入切片中,观察蓝色染色产物的形成。
(5)定量分析:通过测定GUS活性,使用亲合素、含有底物的液体培养基等方法,可以 quantitatively 地测定GUS酶活性。
花粉管通道法转基因技术在果树上的研究进展

花粉管通道法转基因技术在果树上的研究进展果树的基因转化研究早在1988年,首先在核桃上取得突破,McGranahan等获得了转gus基因核桃再生植株。
此后,果树转基因工程研究日益发展,许多果树获得了转基因植株,但是与农作物的转基因工程研究相比,果树转基因工程还是远远处于落后状态。
最难转化的禾谷类,现在也已经有多种作物进入转基因的商业化生产阶段,而果树仅有一例转基因植物进入田间试验(方宏筠等,1999)。
我国在樱桃、草莓、苹果等果树转基因方面做了许多研究工作,并都获得了转化目的基因的转基因植株,特别是樱桃的转抗菌肽基因已由农业部批准进入田间实验,该项研究处于国际领先水平。
1988年第一株转基因核桃(Juglans regia L.)在美国诞生为利用基因工程改变果树特定性状、培育果树新品种奠定了实践基础。
相对于农作物而言,果树转基因技术及研发相对滞后转化体系仍有待进一步完善,但果树基因工程也有其突出的优势。
目前,我国已在荔枝、番木瓜、苹果、柑橘、梨、桃、香蕉、猕猴桃、葡萄、樱桃、草莓的果树上展开了遗传转化技术的研究,转化方法主要包括农杆菌介导法和基因枪轰击的方式,获得了部分转基因植株。
在果树等林木育种中,花粉管通道法的相关研究少有报道,仅见钟启宏等采用花粉管通道导入方法,将欧洲黑杨的一个克隆片段导入泡桐,最终获得了3株可含50μg/mL的Kan培养基上生长的幼苗。
侯立群(2000)等利用花粉管通道发进行核桃转基因研究,只是获得了畸形果植株,但尚未完成分子鉴定等。
山东农业大学张玲(2004)利用花粉管通道法对杏转化抗寒基因相关研究。
由于果树,栽培环境复杂、生产周期长,且主要为风媒传粉植物,与作物相比,在影响树种自身遗传多样性等方面,其潜在的生态风险性可能更大。
随着果树转基因成功事例逐年增加,转基因果树的生态安全性问题也越发受到重视。
由于花粉管通道法进行转化的供体可以是植物总DNA,即利用自然界现有的具目的性状的外源DNA或基因进行遗传转化,其实质相当于远缘杂交。
农杆菌EHA105转化条件的优化及水稻愈伤组织遗传转化体系的初步建立

农杆菌EHA105转化条件的优化及水稻愈伤组织遗传转化体系的初步建立:以质粒PBI121和gfp作为外源DNA转化农杆菌EHA105,通过对EHA105生长状态的测定,并对重悬液Cacl浓度,速冻时间和热处理温度等实验条件逐一进行筛2选,以确定EHA105的最优转化条件。
然后,分别用被转化的农杆菌侵染水稻愈伤组织。
结果表明,农杆菌 OD值接近0.6经过20mmol/L Cacl2重悬细胞,液氮速冻5600分钟后于28?处理5分钟,农杆菌的转化效率最高。
愈伤组织经GUS染色或荧光观察,外源基因已经转入水稻种子中。
农杆菌;水稻愈伤组织;遗传转化: Agrobacterium tumefaciens EHA105 was transformed by the plasmid PBI121 and gfp. To difine the best experimental conditions for transformationof A.tumefaciens the growth rate of the A.tumefaciens EHA105 was measured ,andthe concentration of resuspension solution,freezing time and the thawingtemperature were tested. And then infected mature rice in order to inducecallus with Agrobacterium tumefaciens respective .Result: By resuspended inCaclbuffer, frozen in liquid nitrogen for 5 min and thawed in 28? for 5 2min, the efficiency of transformation was the best. The callus was dyed byGUS or seen by fluorescence, which can testify that exterior gene has beentransferred into rice.Agrobacterium tumefaciens; rice callus; Genetic transformation水稻是世界上重要的粮食作物,并已为分子生物学研究的模式作物之一。
根癌农杆菌介导的玉米幼胚遗传转化体系

根癌农杆菌介导的玉米幼胚遗传转化体系李金红;付莉;关晓溪;霍岩;陶承光;史振声【摘要】为建立以潮霉素为选择标记的农杆菌(Agrobacterium tumefaciens)介导的玉米高效遗传转化体系,本研究利用携带pMDC141-CYP79A1(含GUS基因)质粒的农杆菌浸染玉米A188幼胚,共培养7d后通过GUS基因瞬时表达率,研究农杆菌的菌液浓度、热激时间和浸染时间等因素对玉米幼胚遗传转化效率的影响.研究结果表明:随着农杆菌的菌液浓度的增加、热激时间和浸染时间的延长,GUS表达效率均呈现先增后减的趋势;当农杆菌菌液的OD600为0.8、热激预处理时间3min和浸染时间5min时,其GUS瞬时表达率均最高,分别为46.8%、46.4%和51.7%.并在最佳条件下将GUS基因转入到玉米幼胚,以潮霉素为选择标记,进行3次选择培养,将重新分化的抗性愈伤组织进一步分化成苗,获得56株潮霉素抗性植株,经PCR分子鉴定,获得22株阳性植株,初步建立根癌农杆菌介导的高效玉米幼胚遗传转化体系,为以抗潮霉素基因作为筛选标记的玉米遗传转化和基因功能验证提供技术基础,获得的抗潮霉素转化植株为玉米育种提供新材料.%In order to establish efficient Agrobacterium tumefaciens mediated transformation system, the marker of hygromycin for maize A188 was used as the receptor material,Agrobacterium that carried pMDC141-CYP79A1 plasmids was used to infect the immature embryos. The genetic transformation efficiency of maize immature embryo on Agrobacterium-tumefaciens concentration, heat shocking time and infection time with Agrobacterium were studied. The GUS activity analysis of immature embryos indicated that Agrobacterium-tumefaciens concentration, pretreatment time of heat shocking time, infection time of GUS transient expression rate increasedfirstly and then decreased. With Agrobacterium-tumefaciens suspension OD600 nm of 0.8, pretreat time of heating time of 3 min on 43 ℃ and infection time of 5 min, the highest GUS transient expression rates were 46.8%, 46.4% and 51.7%, respectively. Under the optimal condition, the GUS gene was transformed into immature embryos, hygromycin was used to act selective marker, maize immature embryos were selected for 3 times and the redifferentiation of resistant callus was further differentiated into seedlings, and 56 resistant plant were obtained, 22 positive through PCR detection. An Agrotacteriun-mediated genetic transformation system of immature embryos was established. A technical basis was provided for the genetic transformation of maize and gene function verification, and a new material for maize breeding was obtained from the transgenic plant.【期刊名称】《沈阳农业大学学报》【年(卷),期】2018(049)003【总页数】6页(P266-271)【关键词】玉米;幼胚;根癌农杆菌;遗传转化;GUS【作者】李金红;付莉;关晓溪;霍岩;陶承光;史振声【作者单位】辽宁省农业科学院创新中心,沈阳 110161;沈阳农业大学特种玉米研究所,沈阳 110161;锦州医科大学食品学院,辽宁锦州 121000;遵义师范学院生物与农业科技学院, 贵州遵义 563000;辽宁省农业科学院创新中心,沈阳 110161;锦州医科大学食品学院,辽宁锦州 121000;辽宁省农业科学院创新中心,沈阳110161;沈阳农业大学特种玉米研究所,沈阳 110161【正文语种】中文【中图分类】S336;S513随着生物技术的不断发展,利用转基因技术对玉米(Zea mays L.)遗传性状的改良已经成为一种重要的途径[1],而高效遗传转化体系的建立是开展转基因玉米研究的基础[2-3]。
两种植物组织特异性基因表达方法分析

两种植物组织特异性基因表达方法分析目前研究人员已经在不同植物中分离并证实了多种具有组织表达特异性的启动子,以下是搜集整理的一篇相关,欢迎阅读参考。
ﻭ多细胞生物体内存在不同类型的器、组织、细胞,它们有各自的特性,担负着不同的功能。
例如,植物根表皮中的根毛细胞,主要负责从周围土壤中吸收水分与矿质营养。
与这一功能相适应,它们在发育过程中向外突起管状结构以增加其表面积和吸收水分、养分的能力(Grier-son和Schiefelbein2002);植物根里的内皮层细胞在发育过程中通过特殊的细胞壁加厚和特定部位胼胝质的沉积凯氏带,阻止矿质养分向维管束和地上部分渗透,控制皮层和维管柱之间的物质运输;在茎和叶片中,保卫细胞可以调节内部叶肉细胞与外部环境之间的气体交换,这一过程需要依赖周围细胞通过K离子交换来创造一个调节气孔关闭与打开的膨压(Raschke和Fellows1971)。
这些不同类型器、组织、细胞的,以及它们之间功能的差异,在很大程度上取决于特异性表达的基因。
因此,研究不同器、组织、细胞中呈特异性表达的基因,对了解植物生长发育调控机理,细胞类型与功能之间的关系都有重要意义。
此外,研究组织特异性表达的基因的调控机理,可帮助我们构建植物组织特异性表达体系,有目的地在特定器、组织、细胞中表达特定靶基因,以便进行靶基因功能分析。
组织特异性表达技术在植物基因工程中具有一定的应用前景,如利用植物的特定组织细胞合成所需要的代谢产物,还可以用于作物改良的基因工程等.组织特异性表达技术是近年来植物学研究中的一个重要领域(Ubeda-Tomas等2008;Plett等2010;Duan等2013)。
ﻭ本文主要介绍目前被广泛使用的两种植物组织特异性基因表达方法,即特定启动子驱动法和GAL4/UAS激活标签法.ﻭ1组织特异性启动子驱动法ﻭ1.1植物组织特异性启动子启动子是一段位于功能基因5 端上游的DNA序列,包含特定的保守序列,长度因基因而异。
农杆菌介导的植物遗传转化技术的研究

农杆菌介导的植物遗传转化技术的研究植物遗传转化技术是一项广泛应用于作物改良和生物制药领域的重要技术手段。
其中农杆菌介导的植物遗传转化技术是目前最为常用和成熟的一种转化方法。
本文将对农杆菌介导的植物遗传转化技术的研究进行介绍和探讨。
一、农杆菌介导的植物遗传转化技术原理农杆菌(Agrobacterium tumefaciens)是一种土壤杆菌,是一种天然的植物病原菌。
它通过菌体上存在的Ti质粒(tumor-inducing plasmid)和T-DNA(transfer DNA)片段,将外源DNA片段导入植物细胞并整合到植物基因组中,导致细胞核内出现转化的植物细胞。
因此,农杆菌介导的植物遗传转化技术也被称为农杆菌转化。
农杆菌介导的植物遗传转化技术包括以下几个步骤:农杆菌感染植物细胞、T-DNA整合进入植物细胞、T-DNA片段内的外源DNA导入植物细胞基因组、以及转化细胞的筛选和检测等。
其中,农杆菌感染植物细胞是整个转化过程的关键步骤,需要通过构建合适的载体和适当的农杆菌菌株,使其能够有效地感染到目标植物细胞。
二、农杆菌介导的植物遗传转化技术的研究进展农杆菌介导的植物遗传转化技术已经被广泛应用于许多作物品种的改良和基因功能研究中。
例如,利用农杆菌转化技术可将外源基因导入烟草、玉米、水稻、小麦、大豆等许多重要的作物中,实现对它们特性的改良。
在农杆菌介导的植物遗传转化技术的研究和应用中,也出现了许多问题。
其中,影响转化效率的因素包括转化载体、农杆菌菌株、植物品种、转化条件等。
此外,还存在着难以破解的难题,例如植物细胞壁难以透过、转化后细胞的不稳定性、外源基因的稳定性等。
为了提高转化效率和成功率,许多研究者着眼于改进农杆菌转化系统,包括构建新的载体、筛选适合的农杆菌菌株、研究植物细胞壁和农杆菌感染机制等。
一些新型转化技术,例如粒子轰击法、激光微加工技术和等离子膜处理技术等,也被尝试用于植物遗传转化中,但它们还需要进一步的研究和优化。
3PlantCARE数据库htt...

摘要启动子是基因表达调控重要的元件,启动子的活性间接反映了它所控制的基因表达。
组织特异性启动子作为启动子的一种,可以启动外源基因在受体植物的特定组织器官中高效表达,减少不必要的浪费。
WRKY基因家族是在植物中起特异作用的一类转录调控因子,它被证明了参与植物的抗病反应,还影响植物的衰老、抗胁迫以及生长和发育。
本实验克隆了一个玉米WRKY基因的启动子,采用GUS报告基因对WRKY 基因的启动子功能进行了分析,通过启动子的删减实验,水稻的遗传转化及组织的GUS染色,取得如下结果:1、根据网上预测的WRKY基因设计引物,从玉米(玉米品种B73)中扩增了该基因的启动子部分,命名为P2880,在启动子顺式作用元件预测网站上分析该启动子序列,预测到存在TATA盒、CAAT盒和GATA盒等多个作用元件。
2、克隆出WRKY基因上游的启动子并且克隆了4个5’端缺失启动子,5个启动子的长度依次为2880bp、1812bp、1254bp、680bp和355bp。
将5个启动子与含有GUS报告基因的质粒pCAMBIA1301连接并构建了pCAM2880GUS和4个5’端缺失启动子载体,将缺失载体分别命名为pCAM1812GUS、pCAM1254GUS、pCAM680GUS和pCAM355GUS。
3、用农杆菌介导法将所有植物表达载体转化水稻,获得了37棵转基因植株。
由实验结果可知,pCAM2880GUS载体对应的转基因植株愈伤组织染色结果为蓝色,而pCAM1812GUS、pCAM1254GUS、pCAM680GUS、pCAM355GUS载体对应的转基因植株的愈伤组织均未染上蓝色,由此可知P2880启动子的核心区域位于转录起始位点前2880bp至1812bp之间。
综上所述,本研究克隆了一个玉米WRKY基因启动子,并发现该启动子是一个愈伤特异性启动子,而目前WRKY基因未有愈伤组织表达特异性的报道,该启动子的克隆对玉米相关基因功能研究具有重要的意义。
根癌农杆菌介导的真菌遗传转化研究进展

根癌农杆菌介导的真菌遗传转化研究进展根癌农杆菌介导的真菌遗传转化(Agrobacterium tumefaciens-mediated transformation, ATMT)是一种常用的真菌遗传转化技术,它利用根癌农杆菌作为介导者,将目标DNA转移到真菌细胞中,从而改变真菌的遗传特性。
近年来,ATMT技术在真菌遗传转化研究中得到了广泛应用,并取得了许多进展。
ATMT技术的基本原理是将目标DNA插入到根癌农杆菌的转化质粒中,然后通过存在于转化质粒中的跨界转座系统(T-DNA)将目标DNA转移到真菌细胞中。
跨界转座系统是根癌农杆菌特有的一个DNA片段,可以携带外源基因插入到真菌基因组中的随机位置。
真菌细胞会利用此外源基因来表达目标基因,并产生相应的遗传变化。
ATMT技术的优点之一是转化效率较高,可以成功转化多种真菌。
研究人员已经成功地将ATMT技术应用于多种真菌,包括担子菌门(如酵母菌、拟南芥黄链菌等)、接合菌门(如粘帚菌、丝状菌等)和半知菌门(如滑子菌、刺球菌等)。
ATMT技术也可以用于转化真菌中的不同类型的细胞,包括营养体、分生孢子和菌丝等。
近年来,ATMT技术在真菌遗传转化研究中的进展主要包括以下几个方面:ATMT技术的转化效率得到了极大的提高。
研究人员通过优化转化条件和转化质粒的构建,使ATMT技术的转化效率大幅提高,从而提高了转化真菌的成功率。
ATMT技术在真菌功能基因组学研究中的应用取得了重要进展。
ATMT技术可以通过插入性突变的方式,破坏真菌中的特定基因并观察其对真菌生长、代谢和病原性等特性的影响,从而帮助研究人员深入了解真菌的功能基因组。
ATMT技术的潜力在农业和医学领域也得到了广泛关注。
ATMT技术可以用于改良农作物和药用真菌,使其具有抗性和高产性等优良特性,从而提高农作物和药物的产量和质量。
ATMT技术在真菌遗传转化研究中已取得了显著的进展。
随着该技术的不断改进和优化,相信ATMT技术将在真菌研究和应用中发挥越来越重要的作用。
植物基因工程中的常用启动子 _3231

植物基因工程中的常用启动子 _3231 植物基因工程中的常用启动子植物基因工程中常用的启动子按其作用方式及功能可分为三类:组成型启动子(constitutive promoter )、诱导型启动子(inducible promoter) 和组织特异性启动子(tissue – specific promoter)。
这种分类大体上反映了它们各自的特点, 但在某些情况下,一种类型的启动子往往兼有其它类型启动子的特性。
1 组成型启动子组成型启动子在所有组织中都启动基因表达,具有持续性,不表现时空特异性;RNA和蛋白质表达量也是相对恒定的。
它包括异源和内源组成型启动子两类。
植物基因工程中应用的异源组成型启动子主要有CaMV35S启动子(来源于烟草花叶病毒基因),能在大部分植物中对异源基因进行启动表达,完整的CaMV35S启动子是植物基因工程中应用最为广泛的组成型启动子之一,如在马铃薯、拟南芥、烟草、蘑菇、毛白杨等植物中的转基因应用。
常用的还有来自农杆菌的Nos和Ocs启动子。
内源启动子主要有水稻肌动蛋白(actin)和玉米泛素(ubiquitin)基因的启动子,这些启动子可以更有效地驱动外源基因在单子叶植物中的表达。
Naomi等分别从拟南芥的色氨酸合酶β亚基基因和植物光敏色素基因中克隆了相应启动子,用其代替CaMV 35S启动子,在转基因烟草中也取得了很好的表达效果。
用这些启动子代替CaMV 35S启动子,可以更有效地在单子叶植物中驱动外源基因的转录。
组成型启动子已经广泛地应用于双子叶植物、单子叶植物以及真菌等的基因工程中。
但是由于组成型启动子驱动的基因在植物各组织中均有表达,应用中逐渐暴露出一些问题。
例如外源基因在整株植物中表达,产生大量异源蛋白质或代谢产物在植物体内积累,打破了植物原有的代谢平衡,有些产物对植物并非必需甚至有毒,因而阻碍了植物的正常生长,甚至导致死亡(karlowaki et al., 2003; Ehasani et al., 2003; Miyao et al., 2003)。
根癌农杆菌介导的真菌遗传转化研究进展

根癌农杆菌介导的真菌遗传转化研究进展根癌农杆菌介导的真菌遗传转化是一种常用的真菌遗传改造方法,具有操作简便、高效率、单拷贝整合等优点,可用于真菌基因敲除、基因敲入、表达融合蛋白等多个方面的研究,已成为真菌遗传改造领域中不可或缺的技术手段之一。
本文将对根癌农杆菌介导的真菌遗传转化技术进行综述和展望。
根癌农杆菌介导的真菌遗传转化方法(Agrobacterium-mediated transformation, AMT)是利用土壤细菌根癌农杆菌(Agrobacterium tumefaciens)的T-DNA转移系统将外源DNA 导入到真菌基因组内的一种遗传转化方法。
通常,AMT方法分为三个步骤:(1)将目标真菌菌株的孢子或体细胞暴露于含有外源DNA、根癌农杆菌以及诱导剂(如乙酰丙酮)的悬浮液中,使其吸附根癌农杆菌,并通过植物激素的作用促进真菌细胞分裂和分化;(2)将真菌悬浮液分别在培养液和选择性培养基上培养,去除未受到转化的真菌样本,并选育出转化的真菌菌株;(3)通过PCR、Southern blotting等方法检测和鉴定转化真菌的基因型。
目前,AMT方法已被广泛应用于多种真菌,如神经鞘菌属、烟霉属、木霉属、豆角霉属等,为研究真菌生物学和遗传学提供了有力支持。
根癌农杆菌转移DNA的机理主要分为两步:(1)形成T-DNA;(2)将T-DNA导入到植物细胞中。
形成T-DNA的过程包括:第一步,根癌农杆菌感知到植物的存在,释放细菌素以感染植物表面细胞,侵入植物细胞后会释放琥珀酸,琥珀酸激活VirA蛋白,VirA磷酸化VirG蛋白;第二步,磷酸化的VirG与ChvE结合,T-DNA负链转录起始因子(nptⅡ)在VirE2的协助下被VirD2切割,一段所需基因和启动子序列就会包括在质粒上;第三步,VirE2将T-DNA协同转移入目标细胞,并与VirD2一起构成一种被称为转移复合体的结构。
在AMT方法中,真菌细胞表面的亲和配体可以结合到根癌农杆菌的T-DNA转移复合体,从而将外源DNA导入到真菌细胞中。
GUS基因在农杆菌和甜瓜中的表达差异研究

技 术 园艺作 物 育种 中的 应 用 。E malto igi7@ 1 6 cm。 - i:axn l 7 2 .o n 收稿 日期 :O 8 1 8 2 O 一O 一O
因应用最多 。但是 目前关于 G US在农 杆菌 中是 否表达 的研究很 少 , 多用 ห้องสมุดไป่ตู้ 很 US基 因作 为 报告 基 因的文献 也
报 ,0 0 1 ( ) 1 813 2 0 , 7 2 :6 —7 .
[] 沈永 宝 , 季森 . 杏 、 栗 不 同组 织 D 6 施 银 板 NA提 取 [] 南 京 林 业 大 学 J. 学报( 自然科 学 版) 20 ,5 6 :08. ,0 12()8—2 [] CakM , 红 雅 , 礼 嘉 .植 物 分 子 生 物 学一 手 册 实 验 E , 7 lr S 顾 瞿 M] 北
G S基 因存 在 于 某 些 细 菌 体 内 , U 编码 J 3 一葡 糖 苷 酸 性 , 多 细 菌 及 真 菌 也 缺 乏 内源 G 许 US活 性 , 而 G S 因 U
酶(— u uo i s; US , 酶是一种 水解酶 , G c rn aeG )该 d 能催 化
许多 J 3 一葡糖 苷酸 酶类 物质 的水 解 。在转 基 因研 究 中,
(. olg fLf cec ,S uh s ies y 1C l eo i S in e o twetUnv ri ,Ch n qn 0 7 5 e e t o g ig 4 0 1 ,Chn ;2 De t fCh mi r LLf i c ,Qi xn nT a h r ’ ia . p.o e s y 8 i S e e t ec n a ia ec es n
基于Gateway技术的植物表达载体的构建

基于Gateway技术的植物表达载体的构建郭姗姗;张蒙;单卫星【摘要】[目的]为方便基于植物瞬时表达技术的高通量功能基因筛选,利用Gateway技术实现植物表达载体和表达文库的构建,将35S启动子和Gateway技术入门载体pDONR222的同源重组区连接到植物表达载体pCAMBIA0380上,构建Gateway技术兼容的植物表达载体.[方法]分别扩增35S启动子与pDONR222上attP特异识别序列之间的功能区,并将其依次连人根癌农杆菌(Agrobacterium tume faciens)介导的植物表达载体pCAM-BIA0380的多克隆位点区,利用带有attB特异识别区域的GUS基因,对构建的载体功能进行测试.[结果]成功构建了基于Gateway技术的植物表达载体p1104D;载体重组基因的选择性测试结果表明,p1104D对目的基因片段的大小无严格选择性;载体重组效率测试结果表明,p1104D重组平均滴度为5.11×105cfu/mL;GUS报告基因瞬间表达试验结果表明,改造后的载体可以实现目标基因的顺利表达.[结论]基于Gateway技术的植物表达载体p1104D的构建,为实现cDNA文库的高效构建和目标基因的高通量功能筛选提供了可能,有望推动植物-病原互作研究中关键基因的鉴定与克隆.【期刊名称】《西北农林科技大学学报(自然科学版)》【年(卷),期】2010(038)011【总页数】7页(P161-166,172)【关键词】Gateway技术;植物表达载体;瞬时表达;功能克隆【作者】郭姗姗;张蒙;单卫星【作者单位】西北农林科技大学生命科学学院,陕西,杨凌,712100;西北农林科技大学植物保护学院,陕西,杨凌,712100;西北农林科技大学植物保护学院,陕西,杨凌,712100;西北农林科技大学植物保护学院,陕西,杨凌,712100;陕西省农业分子生物学重点实验室,陕西,杨凌,712100【正文语种】中文【中图分类】Q785由Invitrogen公司开发的Gateway技术是一种通用型克隆方法,其基于λ噬菌体位点特异性重组系统,利用位点特异重组构建入门载体[1-3],整个过程没有限制性内切酶和连接酶的参与。
根癌农杆菌Ti质粒课件
①Ti共整合载体由两个质粒组成,其中一个是E.coli质粒中间载体, 另一个是御甲Ti质粒组成.
②农杆菌中两个质粒形成一个大的共整合载体.
③共合体的形成频率与两个质粒的重组频率有关,相对较低.
④必须用Southern杂交或PCR对大的共整合体质粒进行检测
⑤构建是比较困难.
第一节 根癌农杆菌Ti质粒基因转化载体 的构建
第一节 根癌农杆菌Ti质粒基因转化载体 的构建
• 1.基于pBR322同源序列的共整合载体的构建策略
• (2)中间载体与受体Ti质粒的同源重组
pGV1103中间表达载体导入农杆菌后,由于两种质粒中都带
有pBR322同源序列,因此少部分质粒发生重组和交换,使少数 中间载体整合到pGV3850的T-DNA区域内,形成一个大的共整 合载体.没有被整合的中间表达载体由于不能在农杆菌中复制, 它将会随着农杆菌的分裂增殖而自行消失.
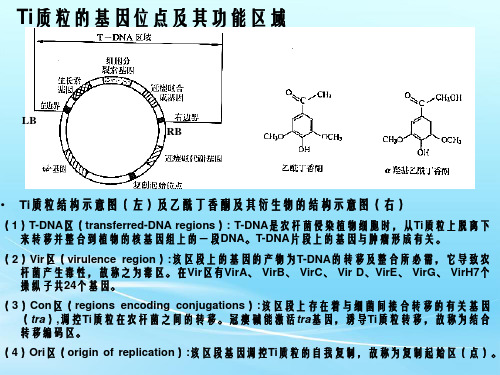
(2)Vir区(virulence region):该区段上的基因的产物为T-DNA的转移及整合所必需,它导致农 杆菌产生毒性,故称之为毒区。在Vir区有VirA、 VirB、 VirC、 Vir D、VirE、 VirG、 VirH7个 操纵子共24个基因。
(3)Con区(regions encoding conjugations):该区段上存在着与细菌间接合转移的有关基因 (tra),调控Ti质粒在农杆菌之间的转移。冠瘿碱能激活tra基因,诱导Ti质粒转移,故称为结合 转移编码区。
• 三、Ti共整合转化载体的构建 • (二)Ti共整合转化载体的类型和构建策略
基于中间载体与受体Ti质粒重组序列的不同,共整合载体 可分为以pBR322序列为同源序列的转化载体系统和基于左边 界内部同源区(LIH)的转化载体系统,即SEV系统.
根癌农杆菌

根瘤菌科,农杆菌属
(Agrobacterium):
——革兰氏阴性菌,侵染植物伤口进 入细胞后,将T-DNA插入植物基因 组中,导致植物产生冠瘿瘤或毛状 不定根,干扰植物的正常生长
-根癌农杆菌(A. tumefaciens)
Ti质粒(tumor-inducing plasmid) (广泛使用)
纯化和稳定遗传 -不需要特殊的专用设备
缺点: -只能以T-DNA插入的方式导入寄主细胞,没
有方向性
33
也称微弹轰击法:将外源DNA包 被在微小的金粒或钨粒表面,然后 在高压的作用下微粒被高速射入受 体细胞或组织。微粒上的外源 DNA进入细胞后,整合到植物染 色体上,从而实现基因的转化。
可将基因枪分为三种类型: 第一类是以火药作为动力; 第二类是以高压气体作为动力; 第三类是以高压放电作为动力。
14
杀虫晶体蛋白的杀虫作用机理
当昆虫吞食后,ICP在昆虫中肠的碱性消化液和胰蛋 白酶作用下,变成有活性的毒蛋白,并与昆虫中肠 上皮细胞上的特异性受体结合,全部或部分嵌合于 细胞膜中形成离子通道,造成膜穿孔,细胞渗透平 衡受到破坏,代谢终止,昆虫停止进食,最后脱水 死亡。
由于ICP要形成有活性的毒蛋白,必须同时具备碱性 条件和特定的蛋白酶才能产生,因此人畜不受影响。
34
基因枪
35
1) 提高植物的农业价值(产量、品质、抗性)和园艺 价值(花色、花形、花期),eg. 抗虫棉、转基因 矮牵牛等;
2) 作为生物反应器生产某些重要蛋白质和次生代谢物 质,eg. 生长激素、干扰素、白介素-2、 乙肝疫苗、表皮 生长因子等;
3) 研究基因在发育及其他生理生化过程与代谢途径中 的作用
13
Bt能杀死宿主昆虫主要靠其芽孢和毒素(杀虫晶体蛋白, Bt)。
拟南芥防御素基因PDF1.2启动子与GUS重组载体的构建与转化

拟南芥防御素基因PDF1.2启动子与GUS重组载体的构建与转化刘志霞;周舟;蔡薇;程姣;任春梅【摘要】PDF1.2基因在植物的防御系统中扮演着重要的角色,其编码产生的植物防御素参与了植物对真菌入侵、病毒感染、不良环境等逆境胁迫的防御反应.试验利用从拟南芥中通过PCR扩增和克隆的该基因启动子构建GUS报告基因的表达载体,通过根癌农杆菌浸渍转化法将表达报告基因转入拟南芥中,筛选获得了转化植株.获得以下主要结果:(1)成功克隆了拟南芥PDF1.2基因的启动子并将其与带GUS 标记基因的载体进行了融合,得到了重组的融合载体;(2)成功的将带GUS标记基因的拟南芥PDF1.2基因启动子融合载体转入到拟南芥植株中并利用其自带抗性标记筛选到了抗性植株;(3)利用GUS染色技术检测了转基因植株中PDF1.2基因启动子的表达情况.%PDF1.2 gene plays an important role in plant defense systems,the plant defensins encoded by PDF1.2 gene participates in plant defensive response against to adversity stress such as fungal invasion,viral infection and adverse environment conditions.The promoter of PDF1.2 gene that amplified and cloned by PCR from Arabidopsis was used to construct the expression vector of GUS reporter gene in this experiment,then the expression reporter gene was transformed into Arabidopsis through agrobacterium tumefaciens transformation method and the transformed plants was obtained by screening.The main results were showed as follows:1.The promoter of Arabidopsis PDF1.2 gene was successfully cloned and fused with the vector carrying GUS report gene to obtain a recombinant fusion vector;2.The reconstructive vector wastransferred into Arabidopsis thaliana and the transgenic plants were screened successfully;3.The expression of the promoter of PDF1.2 gene in transgenic plants was detected by GUS staining.【期刊名称】《作物研究》【年(卷),期】2018(032)002【总页数】4页(P131-134)【关键词】载体构建;PDF1.2基因;克隆;转化【作者】刘志霞;周舟;蔡薇;程姣;任春梅【作者单位】湖南农业大学生物科学技术学院,长沙410128;湖南农业大学生物科学技术学院,长沙410128;湖南农业大学生物科学技术学院,长沙410128;湖南农业大学生物科学技术学院,长沙410128;湖南农业大学生物科学技术学院,长沙410128;作物基因工程湖南省重点实验室,长沙410128【正文语种】中文【中图分类】Q785PDF1.2基因是一个广泛存在于植物中与抗逆相关的基因[1~4]。
农杆菌介导鱼腥草遗传转化的主要影响因素

农杆菌介导鱼腥草遗传转化的主要影响因素董燕;张莹;来慧丽;周联;王培训【摘要】目的:研究鱼腥草遗传转化的影响因素,以提高转化效率,获得转基因植株.方法:通过分析GUS报告基因的瞬时表达和外植体愈伤分化情况比较菌株质粒组合、菌液浓度、侵染时间、预培养时间、共培养时间、抗生素种类和浓度等因素对转化的影响,应用PCR和Southern blot技术鉴定转基因植株基因组中的外源基因.结果:菌液浓度A600为0.3、26℃侵染15min条件下侵染,添加乙酰丁香酮有利于转化,适宜的预培养时间和共培养时间与菌株/质粒组合有关,农杆菌LBA4404/pBI121优于EHA105/pCAMBIA1305.2组合.经条件优化,转化外植体的GUS染色阳性率在60%~80%之间,经鉴定外源基因已整合到转基因鱼腥草基因组中.结论:通过影响因素的优化研究,获得了鱼腥草转基因植株,为培育鱼腥草基因工程新品种奠定了基础.【期刊名称】《中医药信息》【年(卷),期】2010(027)004【总页数】6页(P27-32)【关键词】鱼腥草;农杆菌;转化;影响因素【作者】董燕;张莹;来慧丽;周联;王培训【作者单位】广州中医药大学免疫与分子生物学技术研究室,广东,广州,510405;广州中医药大学免疫与分子生物学技术研究室,广东,广州,510405;广州中医药大学免疫与分子生物学技术研究室,广东,广州,510405;广州中医药大学免疫与分子生物学技术研究室,广东,广州,510405;广州中医药大学免疫与分子生物学技术研究室,广东,广州,510405【正文语种】中文【中图分类】R282.718.12农杆菌介导的基因转化方法已在多种药用植物中实现了遗传转化,如百合、广藿香、人参、美国洋参等,而以鱼腥草为转基因受体进行遗传转化的研究尚未见研究报道。
转基因受体材料的种类和生长状态、农杆菌感染能力、菌株质粒组合、添加创伤反应诱导物以及通过改变创伤方式、增强受体材料被感染能力等因素对转化频率影响较大,直接影响转化结果。
农杆菌种类

农杆菌种类
农杆菌是一类细菌,主要属于农杆菌属(Agrobacterium),是一组植物致病细菌。
农杆菌以其在植物中转移外源DNA的能力而著名,这一特性被广泛用于植物基因工程和农业生物技术。
以下是一些常见的农杆菌种类:
1.Agrobacterium tumefaciens(土壤农杆菌):是最为
研究广泛的农杆菌之一,也是应用最为广泛的一种。
它能感染
多种植物,导致植物发生肿瘤病。
2.Agrobacterium rhizogenes(根癌农杆菌):与土壤农
杆菌类似,但主要引起植物的根生癌病。
3.Agrobacterium vitis:引起葡萄树发生类似农杆菌引
起的肿瘤的病害。
4.Agrobacterium rubi:引起覆盆子和黑莓等植物的肿
瘤病。
5.Agrobacterium larrymoorei:是一种新发现的农杆菌,
与土壤农杆菌密切相关。
这些农杆菌种类具有一些共同的特征,例如它们都能够通过植物细胞表面的创伤进入植物细胞,将外源DNA转移到植物细胞中,导致植物细胞发生改变。
这一特性使得农杆菌成为植物基因工程的有力工具,用于引入外源基因到植物细胞中,实现植物的遗传改良。
植物发根培养

存在的问题及措施
有些植物发根难诱导,各转化系统相对独立,无模式系统
大量筛选菌种,采用合适的外植体,综合利用各种理化因子
有些发根生长不太快,有些难以维持正常的形态,常出现脱 分化形成愈伤组织或分化出幼苗、胚状体等现象,致使生产 能力下降、培养失败
采用合适的培养方法,必要时调节营养及激素水平,使发根维持 正常的形态及快速生长和次生物质生产能力
生长迅速 激素自养 分化程度高 遗传性状稳定 稳定性和生长迅速的特点是工业化生产梦寐以求 的,也是细胞培养和一般器官培养所不能兼备的 很多次生代谢产物仅在特定的器官或组织中形成, 即只有分化才伴随次生代谢过程的进行,发根中 含有相应的次生代谢物含量明显比培养的细胞高 近三分之一传统药材的药用部位是根,发根培养 系统在传统药材生产中具有更重要的意义
Seminar II
植物发根培养
导师:虞星炬 研究员 张 卫 研究员 学生:曲均革
植物是自然界中最好的化工厂
目前超过100,000种化合物被从植物 中鉴定,并以每年约4,000种新化合 物的速度增加 植物次生代谢物质大多具有生物活性, 被用作医药品、化妆品、食品添加剂 等
植物次生代谢物的获得
D
C G B A
RB Hairy root genes and opine synthase
vir
Ri
opine catabolism
ori
Ri质粒感染过程
1.
发根农杆菌感染植物伤口后,受伤的植物细胞合成特 殊的小分子化合物,诱导Ri质粒的Vir区基因群活化; 在Vir区基因表达产生的酶作用下T-DNA被切下;
其它
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
基因组学与应用生物学,2009年,第28卷,第1期,第34-38页Genomics and Applied Biology,2009,Vol.28,No.1,34-38Research Report研究报告Study on Expression Character of gus Gene Contained in two Different Plas-mids on Plant Cell and Agrobacterium tumefaciensHuang Yonghong1Mei Mei2Zeng Jiwu1Zhou Birong1Xia Rui1Yi Ganjun1*1Fruit Research Institute,Guangdong Academy of Agricultural Science,Guangzhou,510640;2Jiaozhou Bureau of Agriculture,Qingdao,266300*Corresponding author,yiganjun@Abstract Using the Agrobacterium tumefaciens EHA105containing two different plasmids pBI121and pCAM-BIA2301to transform cucumis melon cotyledons respectively,and using a histochemical essay was used to identify the transient expression of gus gene on the cotyledons,callus induced from the cotyledons and the bacterium suspension,the expression characters of gus gene included in different plasmid victors on plant cells and bacterium cells were studied.The results showed different expression characters were possessed in different plasmid vectors. The gus gene contained in the pBI121was expressed not only in the plant cells,but also in the Agrobacterium tumefaciens cells;while the one included in the pCAMBIA2301was not expressed in the Agrobacterium tumefa-ciens cells but in the plant cells.Keywords gus gene,Plant cell,Agrobacterium tumefaciens,Plasmid vector两种质粒中gus基因在植物细胞和根癌农杆菌中的表达特性研究黄永红1梅眉2曾继吾1周碧容1夏瑞1易干军1*1广东省农业科学院果树研究所,广州,510640;2山东省胶州市农业局,青岛,266300*通讯作者,yiganjun@摘要以含有基因转化操作过程中常用的两种质粒载体pBI121和pCAMBIA2301的根癌农杆菌EHA105为材料,分别转化甜瓜子叶,应用组织化学方法检测了甜瓜子叶和子叶培养后的愈伤组织及根癌农杆菌菌液的瞬时转化效果,研究了两种不同的质粒载体上所含的gus基因在根癌农杆菌中和植物细胞中的表达特性。
结果表明,不同质粒载体上所含的gus基因的表达特性不同,质粒载体pBI121上所含的gus基因既能在植物细胞中能表达,也能在根癌农杆菌细胞中表达,而质粒载体pCAMBIA2301上所含的gus基因能在植物细胞中表达,但是不能在根癌农杆菌细胞中表达。
关键词gus基因,植物细胞,根癌农抗菌,质粒载体GUS(β-glucuronidase),a kind of hydrolase that catalyzes many chemical reactions of GUS-like zy-molytes,is encoded by gus gene.The advantages of it are mainly in followings:(1)It possesses very stable quality;(2)It needs no coenzyme to express activity;(3)It has no special requirement for ions;(4)The opti-mum pH is5.2~8.0;(5)It has certain heat stability(it's half life is2h at55℃).Moreover,it can be made quanti-tative assay by fluorescence spectrophotometer or used for localization of gene with histochemical method.It is with far-ranging applicability because there is a little or little content of intrinsic GUS-like activities in m any life-form systems and it has high sensitivity(jia and wang,1998).Until now,the gene has still being widely used for gene engineering and genetic transformation, especially in the experiments made use of its transient expression to determine and optimize various factors that influence transformation efficiency.The gus gene has been successfully applied in genetic transformation of plants such as flowers(Chin et al.,2007;Mishiba et al., 2005),rice(Lüet al.,2007),Cotton(Tohidfar et al.,2005), fruits(Kayim et al.,2004),Grass(Ge et al.,2007;Nan-dakumar et al.,2007),medical use plant(Tiwari et al., 2008)and even algae(Tan et al.,2005).However,the reports on the different expression char-acters of gus gene contained in different plasmid vec-tors were been seen for some reasons,which led to false results sometimes and cause the waste of time and resources in the end in plant genetic transforma-tion practices.The aim of the investigation reported here is to study different expression characters of gus genes con-tained in different plasmid vectors using two plasmid vectors in common use named pBI121and pCAMBIA-2301(Figure1)to find out the real expression characters and make good use of the reporter gene in plant genetic transformation.1Materials and Methods1.1Plant materialThe seeds of Cucumis melon GT-1were bought at the seed market.Agrobacterium tumegaciens strain At. -EHA105、engineering bacterium pBI121/At.EHA105 and pCAMBIA2301/At.EHA105were stored atprovincFigure1Gene diagram of T-DNA region of plasmid vector pBI121and pCAMBIA2301ial key laboratory on new technology of fruit and veg-etable.The seeds were shelled and surface-sterilized in 70%ethanol for15s,followed by a treatment with 0.1%corrosive sublimate for7min.After being rinsed in sterile distilled water for4times,they were placed on the sterile filter paper to dry and inoculated on the MS medium containing no plant hormone.Finally they were cultured in a simulate climate box which was con-trolled25℃under a(16/8h)(day/night)photoperiod with light intensity of3000Lx.All MS mediums were supplemented with3%sucrose,and solidified with0.7% agar.The pH of the mediums was adjusted to7.0with 1mol/L NaOH before autoclaving for25min at121℃.1.2Bacterium preparationAt.EHA105from a fresh plate colony was grown at 28℃overnight in liquid YEPmedium containing25mg/L Rifampicin and25mg/L Streptomycin.And pBI121/ At.EHA105and pCAMBIA2301/At.EHA105picked from a single colony on a fresh plate were cultured at 28℃overnight in liquid YEP medium containing25mg/L Rifampicin,25mg/L Streptomycin and50mg/L Kanamycin.All bacterial cells were collected by cen-trifugation and resuspended in MS liquid medium to a final OD560=0.15.All the bacterial suspensions were di-vided in two parts,one for the transformation of Cucumis melon and the other for the staining reaction of GUS.1.3Cucumis melon transformationCotyledon explants were excised from5-day-old germfree seedlings and the cuts were1mm away from hypocotyls.Then the excised cotyledons were cut trans-versely at the middle into two pieces,the adaxial halives of which were used for transformation.The prepared cotyledon explants were immersed in the three sorts of bacterial suspensions for15min respectively,blotted up on a filter paper and then placed on co-culture medium. On the selection induction medium supplemented with 75mg/L Kana,callus was inducted after about2weeks. The activity of gus gene expressed in the cotyledon was determined after they were co-cultured with the bacteri-um for4days and that in the callus were tested when they were inducted on the induction medium using hisStudy on Expression Character of gus Gene Contained in two Different Plasmids on Plant Cell两种质粒中gus基因在植物细胞和根癌农杆菌中的表达特性研究35基因组学与应用生物学Genomics and Applied Biology tochemical method according to Jefferson(1987).And GUS in the bacterial cells was detected at the same time by the same way.1.4GUS assayA histochemical assay to detect GUS activity was performed on the cotyledons co-cultured with the bac-terium for4days,the callius inducted on the induction medium and one of the bacterial suspensions.These tis-sues were immersed in X-Gluc solution(Jefferson, 1987),placed under a mild vacuum for10min,and then incubated overnight at37℃.The tissues were soaked in70%ethanol for several hours to remove chlorophyll before observation.2Results and Analysis2.1The expression character of gus gene expressed in the plant cellsIn the experiment,the activities of gus gene in the Cucumis melon callus explants immersed in the three sorts of bacterial suspension were determined by histo-chemical method after co-culturing for4days.And the results were showed in Figure2.There was no blue color on the explants with Agrobacterium tumefaciens At.E-HA105,while there were lots of them on those im-mersed in the engineering bacterium pCAMBIA2301/ At.EHA105and pBI121/At.EHA105.Agrobacterium tumegaciens strain At.EHA105was a vector without gus gene,so the explants with it also contained no gus gene.The X-gluc was not hydrolyzed when it met the explants treated with the bacterium.Simultaneously, the fact that staining reaction could not happen on these explants suggested there was no endogenous gus gene background in the Cucumis melon plant,that was to say,it was feasible that gus gene was used as a reporter gene for the transformation of Cucumis melon.The blue colors on the explants immersed in engineering bacterium pCAMBIA2301/At.EHA105or pBI121/At. EHA105showed that the activities of gus genes in the both engineering bacterium were expressed and the GUS was produced.However,it had no enough evi-dence to say the blue color was in the plant cells and the materials were transformed bacause that the bacterial cells was still in the explants,and it was not safe to say whether the gus gene can be expressed in the bacterial cells or not.This resulted in inconvenience in the iden-tification of putative transformants in gene engineering and genetic transformation.2.2The expression character of gus gene expressed in the bacterial cellsTo fin d out that the activities of gus genes were expressed in the plant cells or in the bacterial cells,an-ther experiment was designed to make sure the exact location where the indigo blue dye was.The result was showed in following(Figure2G):The staining reaction happened in the bacterial suspension pBI121/At.E-HA105instead of At.EHA105or pCAMBIA2301/At.Figure2The expression of gus gene contained in the different plasmid vectorsNote:A,D:The cotyledon(A)and calli(D)immersed in engineer-ing bacterium pBI121/At.EHA105had staining reaction;B,E:The cotyledon(B)and calli(E)immersed in engineering bacterium pCAMBIA2301/At.EHA105had staining reaction too;C,F:The cotyledon(C)and calli(F)immersed in Agrobacterium tumega-ciens At.EHA105had no staining reaction;G:The expression of gus gene contained in the different plasmid vectors on the bacteri-um cells;Left:Staining reaction does not happen in Agrobacterium tumegaciens At.EHA105;Middle:Staining reaction does not hap-pen in engineering bacterium pCAMBIA2301/At.EHA105, Right:Staining reaction happens in engineering bacteriumpBI121/At.EHA10536EHA105.That the Indigo blue dye did not exist in the bacterial suspension At.EHA105suggested there was no endogenous gus gene background in the Agrobacteri-um tumegaciens At.EHA105.And the color response in engineering bacterium pCAMBIA2301/At.EHA105 and pBI121/At.EHA105showed the expression charac-ters of the gus genes in the two plant expression vectors were different bining the results2.1 with2.2,a conclusion could be drawn that all the stain-ing reactions in the Cucumis melon callus explants were not resulted f rom Agrobacterium tumegaciens At.E-HA105and the plant materials but from the plant ex-pression vectors pCAMBIA2301and pBI121.The ac-tivity of gus gene in the plant expression vectors pCAMBIA2301could be expressed in plant cells,but not in the bacterial cells.However,that in the plant ex-pression vectors pBI121could be expressed not only in the plant cells,but also in the bacterial cells.Therefore, when the gus genes the expression characters of which are like that in the plant expression vectors pCAMBI-A2301are used for gene engineering and genetic trans-formation,it is certain that the blue color is in plant cells and the transformants are obtained if the staining reaction happens in the explants,adventitious buds or com plete shoots.On the contrary,if the gus genes whose expression characters are the same as that in the plant expression vectors pBI121are applied for the ge-netic transformation,it is not sure that the transgenic plants are recovered even if the plant cells or tissues turn blue.The reason is that it doesn't make certain the blue color is in the plant cells or in the bacterial cells if the bacterial cells are not sure to be thoroughly elimi-nated from the plant materials.In addition,it doesn't guarantee the transgenic materials are obtained also in the situation that the instruments used in the experiment are contaminated by the bacterium.So the phenomenon of false positive should be considered when the gus gene as that in plant expression vector pBI121is used in the experiment and the putative transgenic plants are supposed to be further determined by other means.3DiscussionThe gus gene has been used more and more in the field of the biology engineering since Jefferson(1987) firstly applied it as a report gene in the plant genetic transformation in1987.From the experiment,we know there are two types of gus gene expression character: the one like that within pBI121can be expressed both in the plant cells and in the bacterial cells;and the other one such as that contained in the pCAMBIA2301is only expressed in plant cells.Therefore,it is important to know well which type of gus gene is used in experi-ment.An advisable protocol can be made and ideal re-sults can be gotten without too many time and sources wasted when we are familiar with the gus gene expres-sion character.Since the gus gene can be expressed in Agrobac-terium tumegaciens cells,it is necessary to make certain whether there are Agrobacterium tumegaciens cells in the materials or not before the putative materials would be tested by the method to avoid false positive.The methods to check whether Agrobacterium tumegaciens exists in the callus or the transgenic buds are showed as followings:(1)To homogenize the putative transgenic buds,spread it on a YEP medium plate,and observe whether bacterial cells grown on the plate(Kaneyoshi et al.,1994);(2)To stab several several times in and around the putatively transformed callus with a inocula-tion loop and streak on a LB medium plate,then ob-serve whether bacterial cells can grow on the plate (Franklin et al.,1993);(3)To plasmolyze the putative transgenic callus and dye them with X-gluc,and then observe the blue color was inside the cells or in the in-tercellular spaces of the callus cultures(Franklin et al., 1993).According to the principle that the shearing char-acter of intron doesn't exist in prokaryotes but in the eu-karyote,a section of plant intron was introduced into gus gene by Vancanneyt et al.(1990)to make gus gene expressed in eukaryotic cells instead of prokaryotic cells.The gus gene containing a section of intron can e-liminate false positive resulted from the Agrobacterium tumegaciens,so the problem of false positive phe-nomenon can be solved thoroughly.From our experi-ment,we recognize the gus gene in the pCAMBI-A2301is an intron-containing one while that in the pBI121is not.Therefore,the former can guarantee theStudy on Expression Character of gus Gene Contained in two Different Plasmids on Plant Cell两种质粒中gus基因在植物细胞和根癌农杆菌中的表达特性研究37基因组学与应用生物学Genomics and Applied Biology accuracy in the experiment easily.However,we suggest through the experiment above that at least two elemen-tary problems should be solved before the gus gene is to be used in the transgenic transformation:the one is to know whether the endogenous gus gene background ex-ists in the materials including both the plant and bacteri-um;the other one is to know well which type of gus gene is to be used in the experiment,namely the gus gene is expressed in both plant cells and bacterial cells or only in plant cells.Thus,the corresponding measures can be taken to ensure the experiment to go on well in the sub-sequent identification of the putative transgenic plants.ReferencesChin D.P.,Mishiba K.,and Mii M.,2007,Agrobacterium-medi-ated transformation of protocorm-like bodies in Cymbidium, Plant Cell Rep,26(6):735-743Franklin C.I.,Trieu T.N.,Cassidy B.,Dixon R.A.,and Nelson R.S., 1993,Genetic transformation of green bean callus via A-grobacterium mediated DNA transfer,Plant Cell Reports,12(2):74-79Ge Y.X.,Cheng X.F.,Hopkins A.,and Wang Z.Y.,2007,Gener-ation of transgenic Lolium temulentum plants by Agrobac-terium tumefaciens-mediated transformation,Plant Cell Rep., 26(6):783-789Jefferson R.A.,1987,Assaying chimeric genes in plants:the GUS gene fusion system,Plant Molecular Biology Reporter,5(4): 387-405Jia S.R.,and Wang Z.X.,1998,Genetic transformation mediated by Agrobacterium,In:Mang K.Q.,(ed),Agricultural bio-engineering,Chemical Industry Press,Beijing,China,pp.85-115(贾士荣,王志兴,1998,农杆菌介导的植物遗传转化,见:莽克强,主编,1998,农业生物工程,化学工业出版社,中国,北京,pp.85-115)Kaneyoshi(Hiramatsu)J.,Kobayashi S.,Nakamnra Y.,Shigemo-to N.,and Doi Y.,1994,A simple and efficient gene transfersystem of trifoliate orange(Poncirus trifoliata Raf.),Plant Cell Reports,13:541-545Kayim M.,Ceccardi T.L.,Berretta M.J.G.,Barthe G.A.,and Derrick K.S.,2004,Introduction of a citrus blight-associated gene into Carrizo citrange[Citrus sinensis(L.)Osbc.×Poncirus tri-foliata(L.)Raf.]by Agrobacterium-mediated transformation, Plant Cell Rep.,23(6):377-385LüS.Y.,Gu H.Y.,Yuan X.J.,Wang X.M.,Wu A.M.,Qu L.J., and Liu J.Y.,2007,The GUS reporter-aided analysis of the promoter activities of a rice metallothione in gene reveals different regulatory regions responsible for tissue-specific and inducible expression in transgenic Arabidopsis,Trans-genic Res.,16(2):177-191Mishiba K.,Chin D.P.,and Mii M.,2005,Agrobacterium-mediat-ed transformation of Phalaenopsis by targeting protocorms at an early stage after germination,Plant Cell Rep.,24(5): 297-303Nandakumar R.,Chen L.,and Rogers S.M.D.,2007,A stable and reproducible transformation system for the wetland monocot Juncus accuminatus(bulrush)mediated by Agrobacterium tumefaciens,In Vitro Cell.Dev.Biol.-Plant,43:187-194 Tan C.Q.,Qin S.,Zhang Q.,Jiang P.,and Zhao F.Q.,2005,Es-tablishment of a micro-particle bombardment transformation system for Dunaliella salina,J.Microbiol.,43(4):361-365 Tiwari R.K.,Trivedi M.,Guang Z.C.,Guo G.Q.,and Zheng G., 2008,Agrobacterium rhizogenes mediated transformation of Scutellaria baicalensis and production of flavonoids in hairy roots,Biologia plantarum,52(1):26-35Tohidfar M.,Mohammadi M.G.,and Ghareyazie B.,2005,A-grobacterium-mediated transformation of cotton(Gossypium hirsutum)using a heterologous bean chitinase gene,Plant Cell,Tissue and Organ Culture,83(1):83-96 Vancanneyt G.,Schmidt R.,O'Connor-Sanchez A.,Willmitzer L., and Rocha-Sosa M.,1990,Construction of an intron-con-taining marker gene:Splicing of the intron in transgenic plants and its use in monitoring early events on Agrobac-terium-mediated plant transformation,Mol.Gen.Genet., 220(2):245-25038。
