2018年高考化学知识点双向细目表修正版
高考化学知识点双向细目表

8化肥农药与污染
空气,土壤,水污染
55
9精细化工
表面活性剂
本文来自布克网:()
范文栏目:/fanwen/
个人总结栏目:/fanwen/grzj/
有机反应
43
6以烷、烯、炔和芳香烃的代表物为例,比较它们在组成、结构、性质上的差异。
有机物的类型,结构与性质
44
7认识卤代烃、醇、酚、醛、羧酸、酯典型代表物的组成和结构特点,知道它们的转化关系。
45
8认识糖类的组成和性质特点
46
9能说出氨基酸的组成、结构特点和主要化学性质,了解蛋白质的组成、结构和性质
高考化学知识点双向细目表
序号
内容标准
涉及相关概念及主要知识
必修模块
1
认识摩尔是物质的量的基本单位。
摩尔
2
初步学会根据物质的组成和性质对物质进行分类。
单质、化合物、有机化合物、无机化合物
3
知道胶体是一种常见的分散系
分散系、胶体
4
知道酸、碱、盐在溶液中能发生电离,通过实验事实认识离子反应及其发生的条件
酸碱盐电解质非电解质、强弱电质、电离
10
通过生产、生活中的实例了解化学能与热能的相互转化
放热反应、吸热反应、反应热
11
举例说明化学能与电能的转化关系及其应用
原电池、电解池
12
认识化学反应的速率和化学反应的限度
化学反应速率、化学反应限度
13
了解甲烷、乙烯、苯等的主要性质,知道乙醇、乙酸、糖类、油脂、蛋白质的组成和主要性质
有机化合物种类、反应
盐类的水解
24
能描述沉淀溶解平衡,知道沉淀转化的本质
沉淀溶解平衡
2018年全国卷IⅡⅢ高考化学双向细目表完整版.doc
高考一、考试中途应饮葡萄糖水大脑是记忆的场所,脑中有数亿个神经细胞在不停地进行着繁重的活动,大脑细胞活动需要大量能量。
科学研究证实,虽然大脑的重量只占人体重量的2%-3%,但大脑消耗的能量却占食物所产生的总能量的20%,它的能量来源靠葡萄糖氧化过程产生。
据医学文献记载,一个健康的青少年学生30分钟用脑,血糖浓度在120毫克/100毫升,大脑反应快,记忆力强;90分钟用脑,血糖浓度降至80毫克/100毫升,大脑功能尚正常;连续120分钟用脑,血糖浓度降至60毫克/100毫升,大脑反应迟钝,思维能力较差。
我们中考、高考每一科考试时间都在2小时或2小时以上且用脑强度大,这样可引起低血糖并造成大脑疲劳,从而影响大脑的正常发挥,对考试成绩产生重大影响。
因此建议考生,在用脑60分钟时,开始补饮25%浓度的葡萄糖水100毫升左右,为一个高效果的考试加油。
二、考场记忆“短路”怎么办呢?对于考生来说,掌握有效的应试技巧比再做题突击更为有效。
1.草稿纸也要逐题顺序写草稿要整洁,草稿纸使用要便于检查。
不要在一大张纸上乱写乱画,东写一些,西写一些。
打草稿也要像解题一样,一题一题顺着序号往下写。
最好在草稿纸题号前注上符号,以确定检查侧重点。
为了便于做完试卷后的复查,草稿纸一般可以折成4-8块的小方格,标注题号以便核查,保留清晰的分析和计算过程。
2.答题要按先易后难顺序不要考虑考试难度与结果,可以先用5分钟熟悉试卷,合理安排考试进度,先易后难,先熟后生,排除干扰。
考试中很可能遇到一些没有见过或复习过的难题,不要蒙了。
一般中考试卷的题型难度分布基本上是从易到难排列的,或者交替排列。
3.遇到容易试题不能浮躁遇到容易题,审题要细致。
圈点关键字词,边审题边画草图,明确解题思路。
有些考生一旦遇到容易的题目,便觉得心应手、兴奋异常,往往情绪激动,甚至得意忘形。
要避免急于求成、粗枝大叶,防止受熟题答案与解题过程的定式思维影响,避免漏题,错题,丢掉不该丢的分。
(完整word)2013-2018年全国卷高考化学双向细目表(超全)

中
12
6
元素周期表及周期律
√
中
13
6
电化学的综合运用
√
√
难
非选择题
26
14
1.实验基本操作及仪器识别
2.方程式的书写,实验分析
3.实验综合考察
√
√
√
中难
27
14
1.氧化还原反应方程式的书写
2.流程图分析
3.电极反应式的书写
4.中和滴定,氧化还原反应方程式的书写
√
√
中难
28
15
1.盖斯定理,速率计算
√
√
中
36
15
流程推断,反应类型判断,分子式书写,官能团,核磁共振氢谱
√
√
中
2017年全国卷I高考化学双向细目表
题号
分数
知识目标
能力目标
试题体现的
主要化学思想
备注
2017考纲要求的核心考点
接受、吸收、整合信息能力
分析和解决
问题的能力
化学实验与
探究的能力
选择题
7
6
有机物的化学组成
√
考察必备知识
8
6
化学实验操作方法(弘扬中华优秀传统文化)
√
选做题
35
15
紫光的波长、能层符号、电子云轮廓图的形状、杂化类型、几何构型、配位数、晶胞的不同取法
√
√
36
15
有机物的推断、名称、反应类型、化学反应方程式的书写、同分异构体的书写、合成路线的设计
√
√
2016年全国Ⅰ卷双向细目表
2.平衡移动,K的计算,
√
√
中难
2018年全国高考理综I(乙)卷化学命题双向细目表
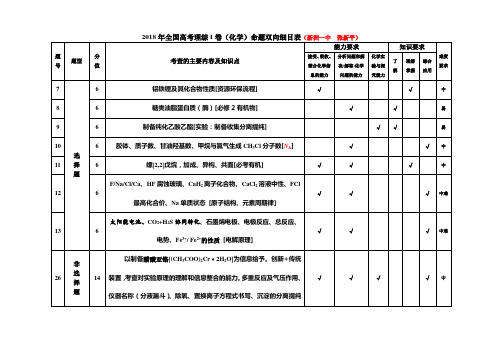
能力要求
题 号 题型 分 值
知识要求
化学实 了 理解 掌握 综合 要求 解 究能力 应用 验与探 难度
考查的主要内容及知识点
接受、 吸收、 分析问题和解 整合化学信 息的能力 决(解答)化学 问题的能力
7 8 9 10 11 选 择 题
中
操作、装置缺陷。 [无机实验] 生产 Na2S2O5 为背景的工艺流程题, 主要考查了 NaHSO3 过饱和溶液经 27 14 结晶脱水、过饱和溶液的获得、电解原理及电极反应式、信息型化学方 程式、氧化还原离子方程式、S 守恒的计算等。 [概理+元化+计算] N2O5 为硝化剂的一种新型的绿色硝化技术为背景的化学反应原理题。 考查涉及氧化产物判断、盖斯定律计算(△H) 、分压及依据分压计算速 28 15 率、平衡常数,温度对体系分压及平衡的影响,有效碰撞、活化能等。 [概理+计算] 锂及其相关化合物/电子排布图及其能力高低、 离子半径大小及其原因、
C12H18O3、ห้องสมุดไป่ตู้成乙醇酯的试剂、条件、同分异构体及结构简式书写(核 磁共振氢谱) 、含氧官能团的名称羟基和醚键、苯甲醇为起始原料制备
√
√
√
√
中
苯乙酸苄酯的合成路线[选 5]
√ √ √ √ √ √ √ √
√
中
易
易
√ √
中
中
12
6 最高化合价、Na 单质状态 [原子结构、元素周期律] 太阳能电池、CO2+H2S 协同转化、石墨烯电极、电极反应、总反应、
√
√
√
中难
13
6 电势、Fe / Fe 的性质 [电解原理]
双向细目表(化学)
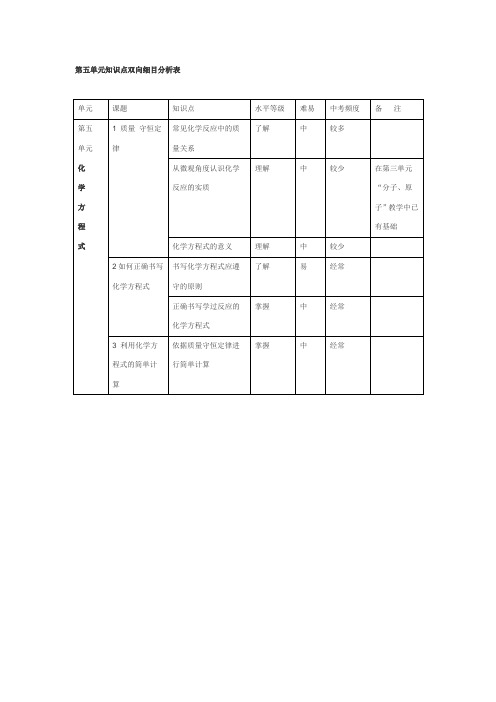
单元
课题
知识点
水平等级
难易
中考频度
备注
第五
单元
化
学
方
程
式
1质量守恒定律
常见化学反应中的质量关系
了解
中
较多
从微观角度认识化学反应的实质
理解
中
较少
在第三单元“分子、原子”教学中已有基础
化学方程式的意义
理解
中
较少
2如何正确书写化学方程式
书写化学方程式应遵守的原则
了解
易
经常
正确书写学过反应的化学方程式
掌握
中Hale Waihona Puke 经常3利用化学方程式的简单计算
依据质量守恒定律进行简单计算
掌握
中
经常
有机化学双向细目表
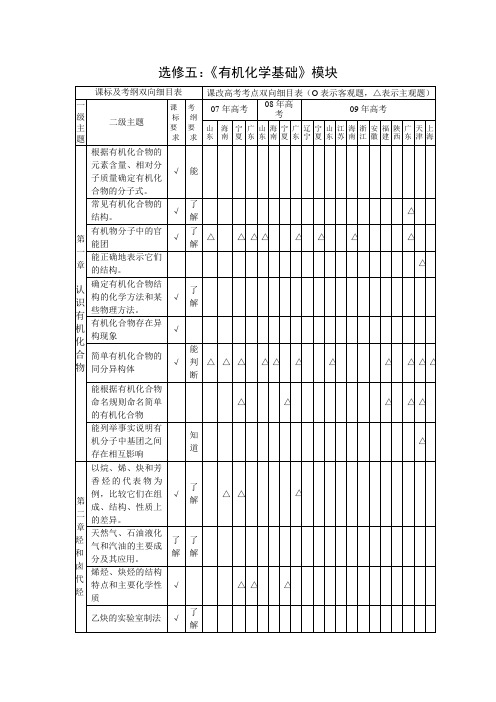
课标及考纲双向细目表
课改高考考点双向细目表(O表示客观题,△表示主观题)
一级主题
二级主题
课标
要求
考纲
要求
07年高考
08年高考
09年高考
山东
海南
宁夏
广东
山东
海南
宁夏
广东
辽宁
宁夏
山东
江苏
海南
浙江
安徽
福建
陕西
广东
天津
上海
第一章
认识有机化合物
根据有机化合物的元素含量、相对分子质量确定有机化合物的分子式。
了解
了解
油脂的概念、结构
了解
油脂的化学性质、油脂的氢化及皂化反应等概念
葡萄糖、蔗糖、淀粉、纤维素的组成和重要性质
掌握
第五章
进入合成有机高分子化合
合成高分子的组成与结构特点
了解
简单合成高分子的结构分析其链节和单体
能依据
△
加聚反应和缩聚反应的特点
了解
△
△
新型高分子材料的性能及其在高新技术领域中的应用
了解
合成高分子化合物在发展经济、提高生活质量方面的贡献。
√
能
常见有机化合物的结构。
√
了解
△
有机物分子中的官能团
√
了解
△
△
△
△
△
△
△
△
能正确地表示它们的结构。
△
确定有机化合物结构的化学方法和某些物理方法。
√
了解
有机化合物存在异构现象
√
简单有机化合物的同分异构体
√
能判断
△
△
化学单元知识点双向细目分析表.doc

易
第八单元知识点双向细目分析表
单元
课题
知识点
水平等级
难易
中考频度
备注
第八单元
1>金属
仁常见金
了解
易
经常
在考题中出现的
材料
属的物理
形式是:区分物质
性质
的物理性质和化
学性质
2、认识合
了解
易
偶尔
出现形式是:区分
金,了解
纯净物和混合物
合金的用
途
2、
1>金属与
掌握
中
经常
1、铁生锈的条件、
的化学
氧气反应
铝制品的保护
途及炼制原理;
了解
易
物质发生化学变化的同吋,伴随着能量的变化一—吸热或放热;化学能对于人类的意义;燃料充分燃烧的条件。
理解
中
3、伽
燃料对环境的影响
煤、石油及其产品如汽车
燃料等的燃烧对环境的影
响;
了解
易
偶尔
污染空气的主要气体及原
因;酸雨的危害及形成原
因;
了解
易
清洁能源及其使用优点;开发清洁能源的途径和意义。
掌握
难
经常
2
实验室制取二氧化碳的原理
掌握
中
经常
实验室制二氧化碳装置(发生、除杂、
收集)的确定(探究)
掌握
难
经常
二氧化碳的检验与验满
理解
易
经常
3
CO与CO2的组成与性质的关系
了解
易
偶尔
二氧碳的密度(比空气大)
掌握
中
经常
二氧化碳的溶解性
了解
中
化学试题双向细目表
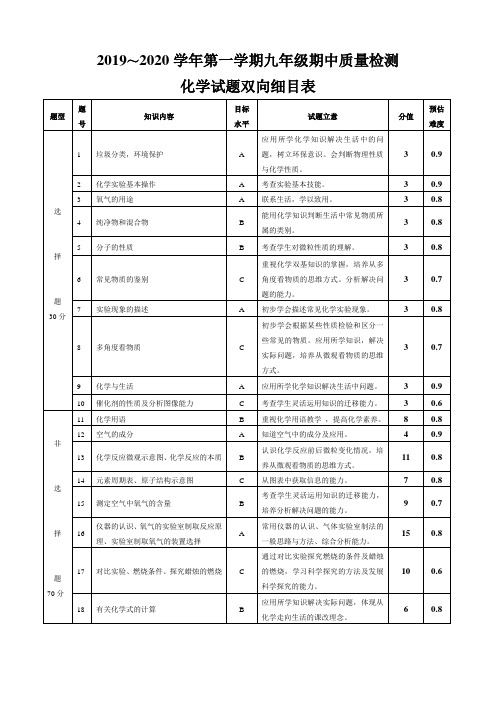
题号
知识内容
目标水平
试题立意
分值
预估难度
选
择
题
30分
1
垃圾分类,环境保护
A
应用所学化学知识解决生活中的问题,树立环保意识。会判断物理性质与化学性质。
3
0.9
2
化学实验基本操作
A
考查实验基本技能。
3
0.9
3
氧气的用途
A
联系生活,学以致用。
3
0.8
4
纯净物和混合物
B
能用化学知识判断生活中常见物质所属的类别。
11
0.8
14
元素周期表、原子结构示意图
C
从图表中获取信息的能力。
7
0.8
15
测定空气中氧气的含量
B
考查学生灵活运用知识的迁移能力,培养分析解决问题的能力。
9
0.7
16
仪器的认识、氧气的实验室制取反应原理、实验室制取氧气的装置选择
A
常用仪器的认识、气体实验室制法的一般思路与方法、综合分析能力。
15
0.8
3
0.7
9
化学与生活
A
应用所学化学知识解决生活中问题。
3
0.9
10
催化剂的性质及分析图像能力
C
考查学生灵活运用知识的迁移能力。
3
0.6
非
选
择
题
70分
11
化学用语
B
重视化学用语教学,提高化学素养。
8
0.8
12
空气的成分
A
知道空气中的成分及应用。
4
0.9
13
化学反应微观示意图、化学反应的本质
高中化学双向细目表

序号
内容
知道
了解
理
解
应
用
第一
章
物质结构儿糸周期
律
第一节
元素周期表
1、元素周期表的结构以及
周期、族等概念
V
2、原子结构与元素在周期
表中位置间的关系
V
3、通过对碱金属、卤族元素性质的探究,理解元素性质与原子结构以及元素在周期表中的位置的相互关系,掌握碱金属和卤族元糸的相似性和递变性
1、乙醇的物理性质,乙酸和乙酸乙脂的物理性质
2、乙醇的生理作用和工业制法
3、理解乙醇的结构,通过分析乙醇的结构式掌握乙醇在发生化学反应时的断键位置,从而推断乙醇所具有的化学性质
V
4、乙酸的物理性质以及它
与人们生活的关系
5、通过分析乙醇和乙酸的结构式,掌握它们发生脂化反应的原理以及实验的操作方法,分析实验现象,会熟练地书写该化学方程式
V
第二节
化学能与电能
1、火力发电中的能量转化
V
2、原电池的原理
V
3、氧化还原反应是使化学
能转换为电能的关键
V
4、通过对原电池装置的分析,掌握原电池正、负极判断方法
V
5、通过原电池装置来判断
金属的活动性顺序
V
6、几种发展中的化学电源
V
7、学会自己设计原电池
V
第三节
化学反应的速率和限度
1、化学反应速率的涵义及
V
4、掌握蛋白质的基本性质,认识蛋白质是生命现象最基本的物质基础
V
第四
章
化学与可持续发展
第一节
开发利用金属矿物和海水
资源
1、了解金属冶炼的一般原理,理解金属冶炼方法的选择同金属活动性的关系,了解常见金属的冶炼方法
高中化学命题双向细目表

高中化学命题双向细目表【实用版】目录1.高中化学命题双向细目表的定义与作用2.高中化学命题双向细目表的内容3.如何编制高中化学命题双向细目表4.高中化学命题双向细目表的应用正文高中化学命题双向细目表是一种考查高中化学知识和能力的工具,它通过列举各项知识和能力,帮助教师和命题者明确考试内容和考试要求,从而更好地指导学生学习和备考。
本文将从高中化学命题双向细目表的定义与作用、内容、如何编制以及应用等方面进行详细阐述。
一、高中化学命题双向细目表的定义与作用高中化学命题双向细目表是一种详细列举高中化学知识点和能力的表格,它包含知识内容和能力要求两个方面,有助于命题者明确考试范围,合理设置题目,同时也有助于学生了解考试内容,进行有针对性的复习。
二、高中化学命题双向细目表的内容高中化学命题双向细目表主要包括以下内容:1.知识内容:涵盖高中化学的所有知识点,如有机化学、无机化学、化学反应原理、化学平衡、电解质溶液等。
2.能力要求:包括理解能力、应用能力、分析能力、综合能力等。
三、如何编制高中化学命题双向细目表在编制高中化学命题双向细目表时,应遵循以下原则:1.遵循教学大纲和考试大纲:确保所列知识点和能力要求与教学大纲和考试大纲一致。
2.合理安排题目类型和分值:根据知识点和能力要求的重要程度,合理安排各类题目的比例和分值。
3.注重试题的科学性和客观性:试题应科学、客观、公正,避免出现偏题、怪题。
四、高中化学命题双向细目表的应用高中化学命题双向细目表在教学和考试中有广泛应用,主要表现在:1.帮助教师和命题者明确考试内容和要求,合理设置题目。
2.帮助学生了解考试内容,进行有针对性的复习。
3.有助于提高考试的科学性和客观性。
高考化学双向细目表

9题涉及
12题综合周期律、表
31
以第3周期为例,掌握同一周期内元素性质(如:原子半径、化合价、单质及化合物性质)的递变规律与原子结构的关系;以I A 和ⅦA 族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
8,选择,6分,,简单27,综合元素化合物15分
28元素周期律和元素化合物知识共15分难度中等及中上
29题综合卤代烃、酯类、烯烃类,醛类主要官能团反应
12酚、酯考查,官能团计算30题共15分有机推断
13有机综合迁移能力,烯烃复分解30题综合推断,增加了未知知识点推导未知知识点的给规律题型
71
了解石油化工、农副产品化工、资源综合利用及污染和环保的概念。
72
了解在生活和生产中常见有机物的性质和用途。
73
9,选择,6分,
13离子反应量变关系
41
理解盐类水解的原理。了解盐溶液的酸碱性。
10综合电离水解
中上难度
8涉及
42
理解原电池原理。初步了解化学电源。了解化学腐蚀与电化学腐蚀及一般防腐蚀方法。
10主要电解综合原电池
43
理解电解原理。了解铜的电解精练、镀铜、氯碱工业等反应原理。
10,选择,6分,
元
素
及
其
化
合
物
常
见
金
属
元
素
的
性
质
44
了解金属钠的物理性质,掌握钠和镁化学性质。
45
从原子的核外电子排布,理解ⅠA 、ⅡA族元素(单质、化合物)的相似性和递变性。
46
以氢氧化钠为例,了解重要的碱的性质和用途。了解钠的重要化合物。
47
了解金属的通性,金属冶炼的一般原理。初步了解金属的回收和资源保护。
化学双向细目表
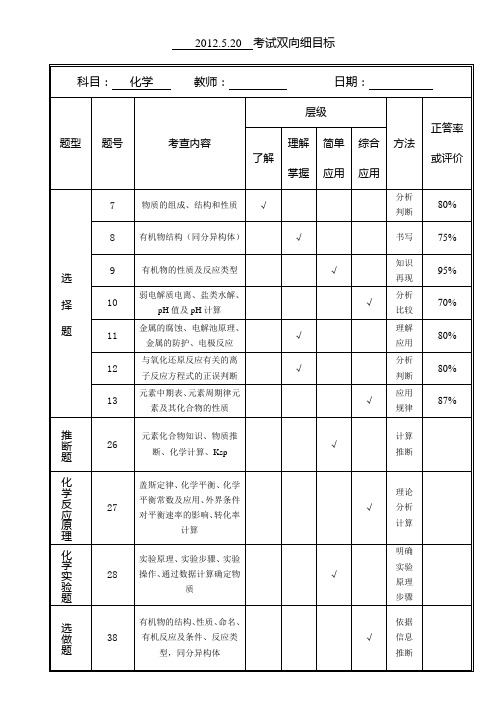
28
实验原理、实验步骤、实验操作、通过数据计算确定物质
√
明确实验原理步骤
选做题
38
有机物的结构、性质、命名、有机反应及条件、反应类型,同分异构体
√
依据信息推断
2012.5.20考试双向细目标
科目:化学教师:日期:
题型
题号
考查内容
层级
方法
正答率或评价
了解
理解
掌握
简单应用
综合
应用
选 择 题
7
物质的组成、结构和性质
√
分析判断
80%
8
有机物结构(同分异构体)
√
书写
75%
9
有机物的性质及反应类型
√
知识再现
95%
10
弱电解质电离、盐类水解、pH值及pH计算பைடு நூலகம்
√
分析
比较
70%
11
金属的腐蚀、电解池原理、金属的防护、电极反应
√
理解
应用
80%
12
与氧化还原反应有关的离子反应方程式的正误判断
√
分析
判断
80%
13
元素中期表、元素周期律元素及其化合物的性质
√
应用
规律
87%
推断题
26
元素化合物知识、物质推断、化学计算、Ksp
√
计算推断
化学反应原理
27
盖斯定律、化学平衡、化学平衡常数及应用、外界条件对平衡速率的影响、转化率计算
√
理论分析计算
高考化学知识点双向细目表ok

高考化学知识点双向细目表
高考知识要求的三个层次(高层次包含低层次):
了解:对所学化学知识有初步认识,能够正确复述、再现、辨认或直接使用。
下表标为“A”。
理解(掌握):领会所学化学知识的含义及其适用条件,能够正确判断、解释和说明有关化学现象和问题,即不仅“知其然”,还能“知其所以然”。
下表标为“B”。
综合应用:在理解所学各部分化学知识的本质区别与内在联系的基础上,运用所掌握的知识进行必要的分析、类推或计算,解释、论证一些具体的化学问题。
下表标为“C”。
高中化学必修1双向细目表精编版

⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯最新料介绍⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯必修 1 命题详目表认知能力预实题题分计测章考点知了理应号型值难难道解解用度度必 1 、化学实验安全√修-+)√2、常有离子查验( Cl 、SO42-、CO32-、Al3+、Fe3+、NH41 3 、分别提纯的方法(过滤、蒸发、蒸馏、萃取)√第 4 、物质的量、阿伏伽德罗常数√一 5 、配制必定物质的量浓度的溶液√章 6 、物质的质量、摩尔质量、物质的微粒数、物质的量、√气体摩尔体积、物质的量浓度等之间的关系必7 、物质的分类方法√修8 、胶体、丁达尔效应√1 9 、离子反响√第10 、离子共存√二11 、氧化复原反响√章12 、举例说明生产、生活中常有的氧化复原反响√必13 、钠、铝、铁、铜等金属及其重要化合物的物理性质√修14 、钠、铝、铁、铜等金属与氧气、水、酸、碱、盐溶液√1反响的共性和个性第15 、氧化钠、氧化铝、氧化铁、氧化铜等金属氧化物与水、√三酸、碱溶液的反响章16 、氢氧化铝、氢氧化铁、氢氧化亚铁的制备√17 、碳酸钠、碳酸氢钠在水中的溶解性、热稳固性、与酸√的反响,及它们的鉴识方法18 3+ 3 +2+之间的互相转变√、 Fe 的氧化性; Fe 和 Fe必19 、氯、氮、硫、硅等非金属及其重要化合物的物理性质√修20 、氯气的化学性质√⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯最新料介绍⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯1 21、 S、SO2、 H2SO3、 H2SO4 √第22 、硅、二氧化硅、硅酸盐√四23 、 N2、NO2、 HNO3 √章24 、氨气、氨水、铵盐√25 、次氯酸 ,浓硫酸 ,浓硝酸的强氧化性√。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常 见 无 机 物 及 其 应 用
常见金属元素 (如Na、Mg、 Al、Fe、Cu 等) 常见非金属元 素(如H、C、 N、O、Si、S 、Cl等)
58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74
√
电解质溶液
53 54 55 56 57
了解溶液pH的含义及其测定方法,能进行pH的简单计算。 理解弱电解质在水溶液中的电离平衡。能利用电离平衡常数进行相关计算。 盐类水解的原理、影响盐类水解程度的主要因素、盐类水解的应用。 了解离子反应的概念、离子反应发生的条件。掌握常见离子的检验方法。 了解难溶电解质的沉淀溶解平衡。理解溶度积(Ksp)的含义,能进行相关的计算。 以上各部分知识的综合应用 常见金属的活动性顺序。 了解常见金属及其重要化合物的制备方法。掌握其主要性质及其应用。 合金的概念及其重要应用。 常见非金属单质及其重要化合物的制备方法。 常见非金属单质及其重要化合物的主要性质及其应用。 常见非金属元素单质及其重要化合物对环境质量的影响。 以上各部分知识的综合应用 有机化合物中碳的成键特征。 了解有机化合物的同分异构现象。能正确书写简单有机化合物的同分异构体。 常见有机反应类型。 甲烷、乙烯、苯等有机化合物的主要性质及其重要应用。 氯乙烯、苯的衍生物等在化工生产中的重要作用。 乙醇、乙酸的结构和主要性质及重要应用。 糖类、油脂、蛋白质的组成和主要性质及其重要应用。 常见高分子材料的合成反应及其重要应用。 以上各部分知识的综合应用 化学实验是科学探究过程中的一种重要方法。 化学实验室常用仪器的主要用途和使用方法。 掌握化学实验的基本操作。能识别化学品标志。了解实验室一般事故的预防和处理方法。 常见气体的实验室制法(包括所用试剂、仪器、反应原理和收集方法)。 掌握常见物质进行检验、分离和提纯的方法。掌握溶液配制方法。 以上各部分知识的综合应用
√ √ √ √ √ √ √ √ √ √
√ √ √ √
√ √ √ √
常见有机物及其应 用
√ √ √
√
√ √ √ √
√
化学实验
75 76 77 78
√ √ √ √
根据化学实验的目的和要求,能做到:设计实验方案;正确选用实验装置;掌握控制实验条件的方法;预测或描述实验现象、分析或处理实验数据 √ 了解原子核外电子的运动状态、能级分布和排布原理。能正确书写1~36号元素原子核外电子、价电子的电子排布式和轨道表达式。 √ √ 电离能的含义,并能用以说明元素的某些性质。 电子在原子轨道之间的跃迁及其简单应用。 了解电负性的概念,并能用以说明元素的某些性质。 离子键的形成,能根据离子化合物的结构特征解释其物理性质。 共价键的形成、极性、类型(σ 键和π 键),配位键的含义。 能用键能、键长、键角等说明分子的某些性质 杂化轨道理论及简单的杂化轨道类型(sp、sp2、sp3)。 能用价层电子对互斥理论或者杂化轨道理论推测简单分子或离子的空间结构。 范德华力的含义及对物质性质的影响。 氢键的含义,能列举存在氢键的物质,并能解释氢键对物质性质的影响。 晶体的类型,不同类型晶体中结构微粒、微粒间作用力的区别。 晶格能的概念,晶格能对离子晶体性质的影响。 分子晶体结构与性质的关系。 了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。 理解金属键的含义,能用金属键理论解释金属的一些物理性质。了解金属晶体常见的堆积方式。 了解晶胞的概念,能根据晶胞确定晶体的组成并进行相关的计算。 能根据有机化合物的元素含量、相对分子质量确定有机化合物的分子式。 了解常见常见有机化合物的结构。了解有机物分子中的官能团,能正确表示它们的结构。 确定有机化合物结构的化学方法和某些物理方法(如质谱、红外光谱、核磁共振氢谱等)。 能正确书写有机化合物的同分异构体(不包括手性异构体)。 能根正确命名简单的有机化合物。 √ √ √ √ √ √ √ √ √ √ √ √ √
2018年最新高考化学知识点双向细目表
分类 序号 1 化学学科特点和基 本研究方法 2 3 4 5 6 物质的组成性 质和分类 7 8 9 10 11 12 13 化学用语及常 用计量 14 15 16 17 18 19 溶液 20 21 22 23 24 25 26 化 物质结构和元 学 素周期律 基 本 概 念 和 基 础 理 论 27 28 29 30 31 32 33 34 35 36 化学反应与能 量 37 38 39 40 41 42 43 44 45 化学反应速率 和化学平衡 46 47 48 49 50 51 52 电解质溶液 知 识 点 内 容 化学的主要特点是在原子、分子水平上认识物质。化学可以识别、改变和创造分子。 科学探究的基本过程,学习运用以实验和推理为基础的科学探究方法。认识化学是以实验为基础的科学 物质组成、结构和性质的关系。化学反应的本质、基本原理以及能量变化等规律。 定量研究方法是化学发展为一门科学的重要标志。 化学与生活、材料、能源、环境、生命、信息技术等的关系。“绿色化学”的重要性。 分子、原子、离子、原子团等概念的含义; 物理变化与化学变化的区别与联系。 混合物和纯净物、单质和化合物、金属和非金属的概念 酸、碱、盐、氧化物的概念及其相互联系。 熟记并正确书写常见元素的名称、符号、离子符号。 熟悉常见元素的化合价。能根据化合价正确书写化学式(分子式),或根据化学式判断化合价。 原子结构示意图、电子式、分子式、结构式和结构简式的表示方法。 相对原子质量、相对分子质量的定义,并能进行有关计算。 质量守恒定律。 能正确书写化学方程式、离子方程式,并能进行有关计算。 物质的量(n)及其单位摩尔(mol)、摩尔质量(M)、气体摩尔体积(Vm)、物质的量浓度(c)、阿伏加德罗常 √ 数(N A )的含义。 能根据微粒(原子、分子、离子等)物质的量、数目、气体体积(标准状况下)之间的相互关系进行有关 计算。 溶液的含义。 √ 溶解度、饱和溶液的概念。 溶液浓度的表示方法。 溶液中溶质的质量分数和物质的量浓度的概念,并能进行有关计算。 配制一定溶质质量分数溶液和物质的量浓度溶液的方法。 胶体是一种常见的分散系。溶液和胶体的区别。 元素、核素和同位素的含义。 原子构成。原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。 原子核外电子排布规律。 元素周期律的实质。 元素周期表(长式)的结构(周期、族)及其应用。 以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系 以IA和ⅦA族为例,掌握同一主族元素性质递变规律与原子结构的关系。 金属、非金属在元素周期表中的位置及其性质递变规律。 化学键的定义。离子键、共价键的的形成。 氧化还原反应的本质。常见的氧化还原反应。 常见氧化还原反应的配平和相关计算。 化学反应中能量转化的原因及常见的能量转化形式。 化学能与热能的相互转化。吸热反应、放热反应、反应热等概念。 热化学方程式的含义,能正确书写热化学方程式。 能源是人类生存和社会发展的重要基础。化学在解决能源危机中的重要作用。 焓变(Δ H)与反应热的含义。 盖斯定律,并能运用盖斯定律进行有关反应焓变的计算。 原电池和电解池的构成、工作原理及应用。能书写电极反应和总反应方程式。 常见电源的种类及其工作原理。 金属发生电化学腐蚀的原因、金属腐蚀的危害以及防止金属腐蚀的措施。 化学反应速率的概念和定量表示方法。能正确计算化学反应的转化率(α )。 反应活化能的概念,催化剂的重要作用。 化学反应的可逆性及化学平衡的建立。 掌握化学平衡的特征。了解化学平衡常数(K)的含义,能够用化学平衡常数进行相关计算。 外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,能用相关理论解释其一般规律 化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。 电解质的概念、强电解质和弱电解质的概念。 电解质在水溶液中的电离,以及电解质的导电性。 水的电离,离子积常数。 √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ √ 了解 √ √ √ √ √ √ √ √ √ 理解 综合 应用
原子结构与元 素性质
79 80 81 82 83 84 85 86 87 88 89 90
√
√ √ √
物 化学键与分子 结构 质 结 构 与 分子间作用力 性 与物质的性质 质
晶体结构与性 质
91 92 93 94 95 96
有机化合物的 组成与结构
97 98 99
√ √
√ √ √ √ √
100 有机分子中官能团之间存在相互影响。 有 机 101 烷、烯、炔和芳香烃的结构与性质。 化 102 卤代烃、醇、酚、醛、羧酸、酯的结构与性质,以及它们之间的相互转化。 烃及其衍生物 学 基 的性质与应用 103 烃类及衍生物的重要应用以及烃的衍生物合成方法。 础 104 根据信息能设计有机化合物的合成路线。 糖类、氨基酸 105 糖类、氨基酸和蛋白质的组成、结构特点、主要化学性质及应用。 和蛋白质 106 糖类、氨基酸和蛋白质在生命过程中的作用。 107 合成高分子的组成与结构特点。能依据简单合成高分子的结构分析其链节和单体。 合成高分子 108 加聚反应和缩聚反应的含义。 109 合成高分子在高新技术领域的应用以及在发展经济、提高生活质量方面中的贡献。
