1ARBUZOV 反应
有机人名反应(pdf版)

迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:
反应实例
14
参考文献
[1] [2] [3] [4] E. Beckmann, Ber., 1886, 19,988; 1887, 20, 1507. W. Z. Heldt, Org. Reactions, 1960, 11, 1~156. J. Kenyonn, A. Campbell, J. Chem. Soc., 1946, 25. J. Kenyonn, D. P. Young, J. Chem. Soc., 1941, 263.
Bucherer 反应
反应机理
20
反应实例
参考文献
[1] [2] [3] [4] [5] [6] [7] H. T. Bucherer, J. Prakt. Chem ., 1904, 69(2), 49. H. T. Bucherer, J. Prakt. Chem ., 1904, 70(2), 345. H. T. Bucherer, J. Prakt. Chem ., 1907, 75(2), 249. H. T. Bucherer, J. Prakt. Chem ., 1905, 75(2), 433. N. L. Drake, Org. Reactions, 1942, 1, 105. A. Rieche, H. Seeboth, Ann., 1960, 638, 66, 43, 76. H. Seeboth, Angew. Chem. Int. Ed., Engl., 1967, 6, 307-317.
X
Y Yurev 反应
Z
Zeisel 甲氧基测定法
Arbuzov 反应
亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:
有机化学人名反应机理全解

人名反应1.Arbuzov反应(Michaelis-Arbuzov重排)2.Arndt-Eistert反应3.Baeyer-Villiger氧化重排4.Beckmann重排5.Birch还原6.Bischler-Napieralski合成法7.Bouveault-Blanc还原8.Bucherer反应9.Cannizzaro反应10.Chichibabin反应11.Chugaev反应12.Claisen重排13.Claisen缩合反应14.Claisen-Schmidt反应15.Clemmensen还原bes合成法17.Cope重排18.Cope消除19.Corey-House合成法20.Cristol反应21.Curtius重排22.Darzen反应23.Demjanov重排24.Dieckmann反应25.Diels-Alder反应26.Döebner-Miller合成法27.Edman降解法28.Eschweiler-Clarke反应29.Favorski重排30.Fischer吲哚合成法31.Friedel-Crafts烷基化反应32.Friedel-Crafts酰基化反应33.Fries重排34.Gabriel合成法35.Gatterman反应(1)36.Gatterman反应(2)37.Gatterman-Koch反应38.Gomberg-Bachmann反应39.Hantzsch吡啶合成法40.Hantzsch吡咯合成法41.Haworth反应42.Hell-Volhard-Zelinsky反应43.Hell-Volhard-Zelinskyα-溴化法44.Henry反应45.Hinsberg反应46.Hofmann重排(Hofmann降解)47.Hofmann烷基化48.Hofmann消除反应49.Houben-Hoesch反应50.Hunsdiecker反应51.Knoevenagel反应52.Knorr合成法53.Kochi反应54.Kolbe反应55.Kolbe-Schmidt反应56.Kucherov反应57.Leuckart反应58.Lossen重排59.Mannich反应60.McMurry反应61.Meerwein-Ponndorf-Verley还原62.Michael加成反应tkin重排64.Nazarov反应65.Oppenauer氧化66.Paal-Knorr合成法67.Perkin反应68.Pschorr反应69.Reformatsky反应70.Reimer-Tiemann反应71.Ritter反应72.Robinson增环反应73.Rosenmund还原74.Sandmeyer反应75.Schiemann反应76.Schmidt重排77.Shapiro反应78.Simmons-Smith反应79.Skraup合成法80.Smiles重排81.Stephen还原82.Stevens重排83.Strecker氨基酸合成法84.Tiffeneau-Demjanov重排85.Ullmann反应86.Vilsmeier反应87.von Richter重排88.Wacker氧化反应89.Wagner-Meerwein重排90.Williamson合成法91.1,2-Wittig重排92.Wittig反应93.Wittig-Horner反应(Emmons反应、Horner-Emmons反应、Wadsworth-Emmons反应)94.Wolff重排95.Wolff-Kisher-黄鸣龙还原96.Wurtz反应97.Wurtz-Fittig反应Arbuzov反应亚磷酸三烷基酯与卤代烷或其衍生物反应生成烷基膦酸酯和一个新的卤代烷的反应称为Arbuzov反应,也称Michaelis-Arbuzov重排。
有机人名反应大全

索引:Arbuzov反应Arndt-Eister反应Baeyer-Villiger 化氧Beckmann 重排Birch 原还Bischler-Napieralski 合成法Bouveault-Blanc原还Bucherer 反应Cannizzaro 反应Chichibabin 反应Claisen 合反酯缩应Claisen-Schmidt 反应Clemmensen 原还bes 合成法Cope 重排Cope 消除反应Curtius 反应Dakin 反应Darzens 反应Demjanov 重排Dieckmann 合反缩应Elbs 反应Eschweiler-Clarke反应Favorskii 反应Favorskii 重排Friedel-Crafts基化烷反应Friedel-Crafts基化酰反应Fries 重排Gabriel 合成法Gattermann 反应Gattermann-Koch反应Gomberg-Bachmann反应Hantzsch 合成法Haworth 反应Hell-Volhard-Zelinski反应Hinsberg 反应Hofmann 基化烷Hofmann 消除反应Hofmann 重排(降解)Houben-Hoesch 反应Hunsdiecker 反应Kiliani 化增法氰碳Knoevenagel 反应Knorr 反应Koble 反应Koble-Schmitt 反应Leuckart 反应Lossen反应Mannich 反应Meerwein-Ponndorf反应Meerwein-Ponndorf反应Michael 加成反应Norrish I和II型裂解反应Oppenauer 化氧Paal-Knorr 反应Pictet-Spengler合成法Pschorr 反应Reformatsky 反应Reimer-Tiemann 反应Reppe 合成法Robinson 反缩环应Rosenmund 原还Ruff 降反递应Sandmeyer 反应Schiemann 反应Schmidt 反应Skraup 合成法Sommelet-Hauser 反应Stephen 原还Stevens 重排Strecker 基酸合成法氨Tiffeneau-Demjanov 重排Ullmann 反应Vilsmeier 反应Wagner-Meerwein 重排Wacker 反应Williamson 合成法Wittig 反应Wittig-Horner 反应Wohl 降反递应Wolff-Kishner-黄鸣龙反应Yurév 反应Zeisel 甲基定法氧测Arbuzov(加成)反应磷酸三基作核代作用,生成基酸二基和一新的代:亚烷酯为亲试剂与卤烷烷膦烷酯个卤烷代反,其活性次序:卤烷应时为R'I >R'Br >R'Cl 。
有机人名反应(pdf版)

Bischler-Napieralski 合成法
反应机理
17
反应实例
参考文献
[1] [2] [3] [4] [5] A. Bis, 26, 1903. R. H. Manske, Chem. Rev ., 1942, 30, 146. F. W. Bergstrom, Chem. Rev ., 1944, 35, 218. W. M. Whaley, Org. Reactions, 1951, 6, 75-150. B. S. Thyagarajan, Chem. Rev . 1954, 54, 1033. [6] C. Reby, J. Gardent, Bull. Soc. Chim. France, 1972,
Baeyer-Villiger 氧化
11
反应机理
12
反应实例
参考文献
[1]S. L. Friess, Rex Pinson Jr., J. Amer. Chem. Soc., 1952, 74, 1302. [2] S. L. Friess, J. Amer. Chem. Soc., 1949, 71, 2571. [3] C. H. Hassall, Org. Reactions, 1957, 9, 73-106. [4] S. L. Friess, P. E. Frankenburg, J. Amer. Chem. Soc.,1952, 74, 2679. [5] J. Meinwald, J. J. Tufariello, J. J. Hurst, J. Org. Chem., 1964, 29, 2914.
G Gabriel 合成法 Gattermann 反应 Gattermann-Koch 反应 Gomberg-Bachmann 反应
有机化学人名反应大全

一、Arbuzov 反应亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:卤代烷反应时,其活性次序为:R′I 〉R′Br〉R′Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a—卤代醚、a- 或b-卤代酸酯、对甲苯磺酸酯等也可以进行反应.当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:如果反应所用的卤代烷R’X的烷基和亚磷酸三烷基酯(RO)3P 的烷基相同(即R' = R),则Arbuzov 反应如下:这是制备烷基膦酸酯的常用方法。
除了亚磷酸三烷基酯外,亚膦酸酯RP(OR')2和次亚膦酸酯R2POR' 也能发生该类反应,例如:反应机理一般认为是按S N2 进行的分子内重排反应:反应实例二、Arndt-Eister反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸.反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例三、Baeyer--—-Villiger反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O—O键异裂.因此,这是一个重排反应具有光学活性的3-—-苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸.反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
这类氧化剂的特点是反应速率快,反应温度一般在10~40℃之间,产率高。
michaelis-arbuzov机理

Michaelis-Arbuzov机理
Michaelis-Arbuzov机理是一种化学反应机理,描述了三价磷酸酯和烷基卤化物合成五价烷基磷酸酯的过程。
这个反应通常被称为Arbuzov反应,也称为Michaelis-Arbuzov反应。
在Michaelis-Arbuzov反应中,三价磷酸酯首先对卤代烃进行亲核攻击,形成鏻盐中间产物。
然后,卤离子作为亲核试剂进攻鏻盐,鏻盐分解脱去烃基,得到最终产物五价烷基磷酸酯。
这个反应的第一步是亲核进攻,生成鏻盐中间产物。
鏻盐通常不稳定,在加热条件下容易发生C−O键断裂,生成膦酸酯。
卤离子在反应中充当亲核试剂,与鏻盐发生反应,促使鏻盐分解并释放出烃基。
值得注意的是,当A和B为R、RO或Ar时,中间产物鏻盐一般不稳定,在室温下即可分解为膦酸酯。
而当A和B为ArO时,生成的鏻盐十分稳定,只有在高温下或在碱性条件下才能分解。
总之,Michaelis-Arbuzov机理描述了三价磷酸酯和烷基卤化物合成五价烷基磷酸酯的反应过程,涉及亲核进攻、鏻盐形成和分解等步骤。
这个反应在有机合成中具有重要的应用价值。
反应机理2

R
N H
R
N H
CH3
+ CO2 + H+
or
HCHO NH2 HCOOH N CH2 N OH H2O N
25. Favorskii重排(
O
作用下重排得到羧酸,酯或酰胺的反应)
Cl
α-卤代(Cl or Br)酮在强碱(NaOH, NaOEt or NaNH2)
COOCH3 NaOMe
反应机理
X R O H R O H O R'
得到醇或醛地反应)
1) R'2BH R 2) H2O2, NaOH R OH
反应机理
H R B R' R' R H R' B R' anti-Malkovnicov syn-addition R H R' B
R' O OH
H R' R' B OH R O
-
-
R
O
B R'
R'
OOH R
O
OR' B OR'
体专一性)
MeOOC + COOMe MeOOC H H H COOMe
COOMe COOMe
COOMe COOMe
反应机理
H
+ Ts
23.
Enamine(烯胺)反应(二级胺与具有α-H的醛,酮发生反应)
O H3C + H N H3C O H3C Br H3C
N
N
H3O+
反应机理
O C C H H N R R OH C C N R H R R N R
EtOOC H3C N
COOEt CH3
经典有机化学反应机理大全

O OH H
COOEt
-EtO-
O
H EtOOC
-H+
O
H+
O
-CO2
O
COOEt
H HOOC
22. Diels-Alder反应(共轭二烯与亲二烯体发生环加成得到六元环, 反应具有立体专一性)
MeOOC +
COOMe
H COOMe
MeOOC H
COOMe
H COOMe
反应机理
COOMe
H COOMe
+ Ts
23. Enamine(烯胺)反应(二级胺与具有α-H的醛, 酮发生反应)
O H3C
H +N
O H3O+ H3C
N H3C
Br
N
H3C
反应机理
O
H
CC + NR
H
R
OH CCNR HR
R NR
24. Eschweiler-Clark反应(将伯胺, 仲胺和甲醛及甲酸还原性甲 基化制备叔胺)
=R
EtOH e-
R HH
EtOH
HH
EtOH
-R
R
HH
HH
10. Bouveault-Blanc反应(酯在钠-醇体系中先还原成醛, 再进一步 还原为伯醇)
RCOOR'
Na RCH2OH
EtOH
反应机理
O R OR'
Na
O
EtOH OH
Na
OH EtOH
R OR'
R OR'
R OR'
H R OR'
重要的有机反应机理
1. Arndt-Eistert反应(重氮甲烷与酰氯作用形成 -重氮酮,在Ag离 子催化下酰基碳烯 重排得到烯酮。烯酮水解得到多一个碳的羧酸)
Arbuzov reaction

Arbuzov ReactionMichaelis-Arbuzov ReactionThe reaction of a trialkyl phosphate with an alkyl halide to produce an alkyl phosphonate. The first step involves nucleophilic attack by the phosphorus on the alkyl halide, followed by the halide ion dealkylation of the resulting trialkoxyphosphonium salt.This reaction sees extensive application in the preparation of phosphonate esters for use in the Horner-Emmons Reaction.Mechanism of the Arbuzov ReactionRecent LiteratureGeneration of Phosphoranes Derived from Phosphites. A New Class of Phosphorus Ylides Leading to High E Selectivity with Semi-stabilizing Groups in Wittig OlefinationsV. K. Aggarwal, J. R. Fulton, C. G. Sheldon, J. de Vicente, J. Am. Chem. Soc., 2003, 125, 6034-6035.Reliable and Versatile Synthesis of 2-Aryl-Substituted Cinnamic AcidEstersA. Ianni, S. R. Waldvogel, Synthesis, 2006, 2103-2112.米歇尔–阿尔布佐夫反应Michaelis–Arbuzov反应,又称Arbuzov反应(阿尔布佐夫反应)三价磷化合物在卤代烷的影响下,转变为五价磷化合物。
有机化学命名反应概要(修订版)
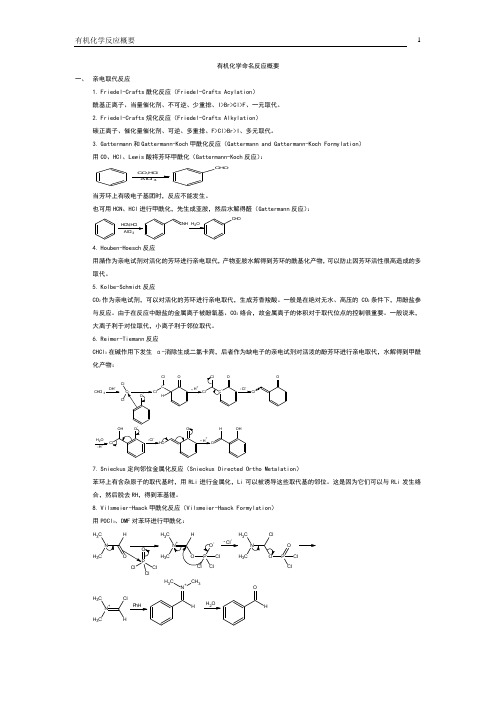
有机化学命名反应概要一、 亲电取代反应1. Friedel-Crafts 酰化反应(Friedel-Crafts Acylation ) 酰基正离子、当量催化剂、不可逆、少重排、I>Br>Cl>F 、一元取代。
2. Friedel-Crafts 烷化反应(Friedel-Crafts Alkylation ) 碳正离子、催化量催化剂、可逆、多重排、F>Cl>Br>I 、多元取代。
3. Gattermann 和Gattermann-Koch 甲酰化反应(Gattermann and Gattermann-Koch Formylation ) 用CO 、HCl 、Lewis 酸将芳环甲酰化(Gattermann-Koch 反应):CO,H Cl AlCl 3C H O当芳环上有吸电子基团时,反应不能发生。
也可用HCN 、HCl 进行甲酰化,先生成亚胺,然后水解得醛(Gattermann 反应):HCN,HCl AlCl 3NH OH 2CHO4. Houben-Hoesch 反应用腈作为亲电试剂对活化的芳环进行亲电取代,产物亚胺水解得到芳环的酰基化产物,可以防止因芳环活性很高造成的多取代。
5. Kolbe-Schmidt 反应CO 2作为亲电试剂,可以对活化的芳环进行亲电取代,生成芳香羧酸。
一般是在绝对无水、高压的CO 2条件下,用酚盐参与反应。
由于在反应中酚盐的金属离子被酚氧基、CO 2络合,故金属离子的体积对于取代位点的控制很重要。
一般说来,大离子利于对位取代,小离子利于邻位取代。
6. Reimer-Tiemann 反应CHCl 3在碱作用下发生α-消除生成二氯卡宾,后者作为缺电子的亲电试剂对活泼的酚芳环进行亲电取代,水解得到甲酰化产物:CHCl 3OH-C ClCl O-OC -ClClHH+~C -OClCl Cl--OClO H 2H+-O-Cl OHCl--OO H H+~OHOH7. Snieckus 定向邻位金属化反应(Snieckus Directed Ortho Metalation )苯环上有含杂原子的取代基时,用RLi 进行金属化,Li 可以被诱导这些取代基的邻位。
鳌合反应名词解释

鳌合反应名词解释
鳌合反应(ArbuzovReaction)是一种重要的氨基有机反应,它最早是由俄罗斯科学家Ivan Arbuzov在20世纪50年代提出的,用于将一种称为次甲酸酯的碳氢化合物转化为一种叫做甲酸酯的碳氢化合物。
它一般由三个步骤组成:首先,利用两个碱催化剂和一种叫做 thiophosgene的活性化合物,将次甲酸酯水解成烷基硫醇和碳氢酸;其次,将烷基硫醇和碳氢酸做化学反应,形成甲酸酯;最后,再次将碱催化剂和thiophosgene加入,使反应回到次甲酸酯。
鳌合反应的主要优点在于,它可以在易于控制的条件下,有效地将次甲酸酯转化为甲酸酯。
出于这个原因,它被用于制造各种优质的药物,如口服降血脂药、抗肿瘤药物和抗心病药物等。
其中,有一个比较知名的抗肿瘤药物奥米酸(Omeprazole)就是采用鳌合反应合成的。
鳌合反应利用的是活性化过程,其催化剂和活性化合物被认为是反应的关键因素。
因此,如何选择适当的催化剂和活性化合物,以及如何优化鳌合反应,变得越来越受到科学家们的重视。
在这方面,一些新型催化剂和活性化合物如稀土金属抗酸剂被开发出来,从而大大提高了反应效率。
此外,由于它使用的是加成和水解过程,它可以相对安全地将次甲酸酯转化为甲酸酯,且可以准确控制反应的产物组成,这使它有更广泛的应用前景。
总之,鳌合反应是一种重要的氨基有机反应,它可以有效、精确
地将次甲酸酯转化为甲酸酯,并因此应用于制造优质的药物。
新型催化剂和活性化合物的开发,将有助于进一步优化鳌合反应,并使之更适用于现代制药工业。
arbuzov反应 催化剂

arbuzov反应催化剂英文回答:Arbuzov reaction is a chemical reaction that involves the conversion of an organic ester into an organophosphorus compound. This reaction is catalyzed by a phosphite ester, which acts as a Lewis acid catalyst. The reaction proceeds through a nucleophilic substitution mechanism, where the phosphorus atom of the phosphite ester attacks the carbonyl carbon of the organic ester, resulting in the formation of a new P-C bond.One example of the Arbuzov reaction is the conversion of ethyl bromoacetate into diethyl phosphonate. In this reaction, triethyl phosphite is used as the catalyst. The reaction proceeds as follows:1. The phosphorus atom of triethyl phosphite acts as a Lewis acid catalyst and coordinates with the carbonyl oxygen of ethyl bromoacetate.2. The nucleophilic phosphorus atom attacks the carbonyl carbon of ethyl bromoacetate, resulting in the formation of a tetrahedral intermediate.3. The bromide ion leaves, leading to the formation ofa phosphonium intermediate.4. The phosphonium intermediate undergoes a rearrangement, resulting in the formation of diethyl phosphonate and triethyl phosphate.The Arbuzov reaction is widely used in organic synthesis to introduce phosphorus-containing groups into organic molecules. It is particularly useful in the synthesis of phosphonates, which are important intermediates in the production of pharmaceuticals, agrochemicals, and flame retardants.中文回答:Arbuzov反应是一种化学反应,涉及将有机酯转化为有机磷化合物。
铜粉 arbuzov反应

铜粉 arbuzov反应
铜粉 Arbuzov 反应是一种重要的有机合成方法,它可以通过铜粉作为催化剂将烷基卤化物与金属有机物反应,生成相应的烷基膦酸酯化合物。
本文将对铜粉 Arbuzov 反应的原理、机理以及应用进行详细介绍。
铜粉 Arbuzov 反应的原理是利用铜粉作为催化剂,将烷基卤化物与金属有机物反应,生成相应的烷基膦酸酯化合物。
该反应通常在惰性气氛下进行,以避免氧气和水分的干扰。
铜粉 Arbuzov 反应的机理主要分为两步:首先,铜粉与烷基卤化物反应生成烷基铜中间体;然后,烷基铜中间体与金属有机物发生反应,生成烷基膦酸酯化合物。
铜粉 Arbuzov 反应的应用广泛,可以用于有机合成中的碳-磷键构建。
烷基膦酸酯化合物是重要的有机合成中间体,可以进一步转化为其他有机化合物,如醛、酮、酸等。
此外,铜粉 Arbuzov 反应还可以用于制备含磷化合物的合成,如磷膦酸酯、磷酸酯等。
在实际应用中,铜粉 Arbuzov 反应需要注意以下几点:首先,选择合适的底物和金属有机物是关键,不同的底物和金属有机物会影响反应的效率和产物的选择性;其次,反应条件的选择也很重要,包括反应温度、反应时间、溶剂等;最后,反应后的产物需要进行适当的纯化和分离,以得到高纯度的产物。
总结起来,铜粉 Arbuzov 反应是一种重要的有机合成方法,可以用于碳-磷键构建和含磷化合物的合成。
在实际应用中,需要选择合适的底物和金属有机物,并注意反应条件的选择和产物的纯化。
铜粉Arbuzov 反应的发展将进一步推动有机合成领域的研究和应用。
谈亚磷酸及其衍生物分子的arbuzov重排

谈亚磷酸及其衍生物分子的arbuzov重
排
亚磷酸(H3PO3)是一种酸性无机化合物,具有三个氧原子和三个氢原子的分子结构。
它的衍生物包括亚磷酸铵(NH4H3PO3)和亚磷酸钠(NaH3PO3)等。
亚磷酸及其衍生物的arbuzov重排是指在温和条件下,亚磷酸及其衍生物的分子发生重排反应,生成新的化合物。
这种重排反应是通过亚磷酸中的磷原子发生转移而实现的。
例如,在温和条件下,亚磷酸可以与甲醇发生重排反应,生成磷甲酸(H3PO2CH3)和水(H2O)。
这个重排反应的化学方程式如下:
H3PO3 + CH3OH → H3PO2CH3 + H2O
同样,亚磷酸铵也可以与甲醇发生重排反应,生成磷甲酸铵(NH4H3PO2CH3)和水(H2O)。
这个重排反应的化学方程式如下:
NH4H3PO3 + CH3OH → NH4H3PO2CH3 + H2O
希望这些信息能帮助你了解亚磷酸及其衍生物的arbuzov重排的相关内容。
有机人名反应-反应机理

EtONa
CO2Et _ O
CO2Et O
CO2Et
35
Leuchart 反应
反应式:
O O
H2N
HCONH4
36
机理:
Leuchart 反应
O HOCH NH
+ NH2
+ NH2
O_ HO
NH2 + CO2
37
Eschweiler-Clarke反应
反应式:
38
Eschweiler-Clarke反应
3)β-H的消除;
4)催化剂的再生:加碱催化 使重新得到Pd(0)配合物。
氧化加成步骤后是插入反应,而不是 亲核置换反应;
产物通过-H消除获得,而其他偶联 反应是通过还原消除获得。
54
3. Heck 反应的催化体系
1.钯配合物
1)Heck反应的催化活性物种是零价钯有机配合物,零价的 Pd(PPh3)4,Pd2(dba)3是常用的催化剂。 2)常用制备简便、稳定的二价钯Pd(OAc)2,PdCl2(PhCN)2, PdCl2(PPh3)2, 甚至PdCl2等作为催化剂前体,加入膦配体后 在反应中被还原成零价钯活性物种。
机理:
39
Eschweiler-Clarke反应
反应实例:
40
由不多于2个碳的化合物合成
NH2
N
完成下列反应
OH
N
OH
41
LiO OLi
CO2
H+
O
BrCH2CH3
LiCH2CH3
HCOONH4
NH2
HCHO
HCOOH
N
42
Vilsmeier 反应 反应式:
arbuzov反应条件

arbuzov反应条件
Arbuzov反应是一种由俄罗斯化学家Arbuzov发现的有机反应,主要用于合成有机磷化合物。
该反应需要以下条件:
1. 热力学条件:该反应需要高温下进行,通常在150-250°C之间。
2. 反应物条件:反应物需要是三个组分,分别是有机卤化物、三甲基磷和碱。
3. 反应条件:这种反应需要在无水无氧的条件下进行。
通常采用氩气气氛或惰性气体保护反应体系。
4. 活化条件:由于三甲基磷的核磁质子信号非常弱,需要通过加入少量的活化剂来促进反应。
常用的活化剂包括碘化物和过氧化氢等。
总的来说,Arbuzov反应条件较为苛刻,需要一定的实验技巧和操作经验。
但是,该反应可以高效地合成各种有机磷化合物,在有机合成中具有广泛的应用前景。
- 1 -。
亚磷酸烷基酯

亚磷酸烷基酯
亚磷酸烷基酯是一类有机化合物,属于亚磷酸的酯衍生物。
亚磷酸烷基酯在化学反应中具有一定的应用,例如在Arbuzov反应中,亚磷酸三烷基酯与卤代烷或其衍生物反应,生成烷基磷酸酯和新卤代烷。
这是一个SN2亲核取代反应的例子。
亚磷酸烷基酯的结构中含有亚磷酸根基团(P(=O)(OR)2),其中R代表烷基。
这类化合物通常由亚磷酸与醇在适当条件下反应制得。
此外,亚磷酸烷基酯还可以作为配体与金属形成配合物,或在有机合成中用作试剂和催化剂。
它们在农药、润滑油添加剂以及阻燃剂等领域也有一定的应用。
由于亚磷酸烷基酯具有一定的化学活性和特殊的物理性质,它们在工业和科研中都有着重要的地位。
Arbuzov_reaction

Arbuzov Reaction Michaelis-Arbuzov ReactionThe reaction of a trialkyl phosphate with an alkyl halide to produce an alkyl phosphonate. The first step involves nucleophilic attack by the phosphorus on the alkyl halide, followed by the halide ion dealkylation of the resulting trialkoxyphosphonium salt. This reaction sees extensive application in the preparation of phosphonate esters for use in the Horner-Emmons Reaction.Mechanism of the Arbuzov ReactionRecent LiteratureGeneration of Phosphoranes Derived from Phosphites. A New Class of Phosphorus Ylides Leading to High E Selectivity with Semi-stabilizing Groups in Wittig Olefinations V. K. Aggarwal, J. R. Fulton, C. G. Sheldon, J. de Vicente, J. Am. Chem. Soc., 2003, 125, 6034-6035.Reliable and Versatile Synthesis of 2-Aryl-Substituted Cinnamic AcidEsters A. Ianni, S. R. Waldvogel, Synthesis, 2006, 2103-2112.米歇尔–阿尔布佐夫反应Michaelis–Arbuzov 反应,又称 Arbuzov 反应(阿尔布佐夫反应)三价磷化合物在卤代烷的影响下,转变为五价磷化合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
反应实例
参考文献
[1] A. E. Arbuzov, J. Russ. Phys. Chem. Soc., 1906, 38, 687. [2] A. Michaelis, Ber., 1898, 31, 1048. [3] Organic Reactions, 1951, 6, 276. [4] D. Redmore, Chem. Rev., 1971, 71, 317.
ห้องสมุดไป่ตู้
如果反应所用的卤代烷 R'X 的烷基和亚磷酸三烷基酯 (RO)3P 的烷基相同 (即 R' = R) , 则 Arbuzov 反应如下:
这是制备烷基膦酸酯的常用方法。
除了亚磷酸三烷基酯外,亚膦酸酯 RP(OR')2 和次亚膦酸酯 R2POR'也能发生该类反应,例如:
反应机理
一般认为是按 SN2 进行的分子内重排反应:
Arbuzov 反应
亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:
卤代烷反应时,其活性次序为:R'I >R'Br>R'Cl。除了卤代烷外,烯丙型或炔丙型卤化物、卤代醚、或卤 代酸酯、对甲苯磺酸酯等也可以进行反应。当亚磷酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最 少的基团。 本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:
