中考化学总复习专题分类突破专题五工艺流程题训练
2020中考化学押题之题型突破5 工艺流程题word教师解析版3.28

2020中考化学专题题型突破(五)工艺流程题题型解读工艺流程题的特点是给出某个生产实际问题的解决流程,把书本知识糅合在整个流程中对学生进行考查。
题目有的以操作名称作为框图形成流程的主线,有的以物质作框,有的以设备作框。
最常见的是以操作名称为主线,物质随着操作流程发生变化。
题目中通常还包含简单的实验设计,一般为物质的制备、提纯或对样品的定性、定量分析实验。
1.资源背景(1)海水资源,如海水制盐、氯碱工业、海水提镁等。
(2)制碱与石灰石工业。
(3)空气资源,如合成氨工艺流程。
(4)矿产资源,如冶炼钢铁、制取铜等。
(5)化石燃料,如有机合成工艺。
(6)化工(实验)废液,如提取金属或盐。
2.考查内容(1)化学反应原理(化学方程式的书写及反应类型)。
(2)实验操作的名称及要点(过滤、蒸发、结晶等)。
(3)流程中的物质转化与循环。
(4)工艺流程评估及改进。
3.方法点拨(1)步骤:读正文,找信息,明确目的;精读流程,弄懂原理,理解操作;先局部,后全盘,逐步深入。
(2)涉及混合物的除杂、分离、提纯等有关实验基础知识及操作时,要认真在流程(图)中找到主要物质和混有的杂质,分析当加入某一试剂后能与什么物质反应,产物是什么,用什么方法才能除去杂质,真正理解每步所加试剂或操作的目的。
(3)关注“箭头”及方框内的信息:箭头进入的是投料(即反应物),出去的是生成物(包括主产物和副产物)。
(4)关注“三线”和“核心”,如图T5-1所示:图T5-1题型探究类型1 提纯回收类此类试题以从混合物中运用物理、化学的方法提纯、回收某种纯净物为主要目的,考查分离、除杂的原理及过滤、蒸发等基本操作。
最常见的情景是从粗盐中提取精盐和从冶炼工业的废渣中提取某种金属或盐。
解题技巧:解题时主要运用“分离、除杂”的思想,关注除杂的顺序及除去某种杂质时所加试剂的“量”(一般是过量),且后面加入的试剂要能除去前面加入的过量的试剂。
1 、实验室有一份氯化钠和氯化钡混合物样品。
2023年中考化学专题复习 工艺流程题

流程题考法一 般包括两个方 面:
一.是以制备某物质为目的的流程题;
二.是以实验为目的的流程题,主要 是对混合物的除杂、分离和提纯。
例题分析
例1:某热电厂用脱硫得到的石膏(CaSO4•2H2O)生产K2SO4肥料的流程如下
(1)石膏中S的化合价是 +6 ;
脱硫过程的化学方程式为2CaCO3+2SO2+O2+4H2O=2CaSO4•2H2O+2 CO2 。
有 烧杯 、 漏斗 、玻璃棒 。如果实验结束发现液体仍然浑浊,应进行
的操作是 重新过滤 ,原因可能有 滤纸破损
、 烧杯不干净 。
2.结晶的方法有 蒸发结晶 、 降温结晶; 从海水中获得食盐晶体采用 蒸发结晶 法, 因为 氯化钠的溶解度受方法是 降温结晶 ,具体的步骤是溶解、蒸发浓缩、降温结晶、过滤。
3.玻璃棒在化学实验中用途广泛,写出下列实验中玻璃棒的作用
(1)溶解食盐使用玻璃棒目的 搅拌,加快溶解速率
搅拌,使液体受热均匀、防止液体飞溅
(2)蒸发结晶时使用玻璃棒 引流
(3)过滤使用玻璃棒作用
加快散热,加快反应速率
(4)稀盐酸和烧碱溶液反应时用玻璃棒搅搅拌拌,目防的止局部过热引起酸飞溅 (5)稀释浓硫酸时使用玻璃棒 引流 、
中进行的原因是 浓氨水易挥发,防止氨气逸出污染环境
。
(5)该工艺可以循环利用的物质有 CaCO3 (写1种),副产品NH4Cl与 NaOH溶液混合微热,产生的气体能使湿润的红色石蕊试纸变 蓝 色。
(6)最后对得到的晶体洗涤目的是 洗去表面可溶性杂质NH4Cl ,洗涤的试剂可
选用 BC
A.30的热水
B.0℃的水
A.能与酸反应
B.能与碱反应
工艺流程图题

节能环保
分类专练
类型1 回收利用类(10年3考)
1.(2021安徽15题6分)某燃煤电厂产生的固体废弃物粉煤灰中含有较多的氧化铝。从粉煤灰中提取氧化铝的工艺流程如下。
(3)“煅烧”过程发生反应的化学方程式为____________________________,反应类型是__________。
碳酸钙(或 <m></m> )
(2)实验室里进行操作②、操作③均用到的玻璃仪器是________。
玻璃棒
(3)“反应池”中发生主要反应的化学方程式是______________________________ ___ 。
(4)“制浆”中发生反应的基本反应类型是__________。
(3)“酸浸”过程中发生反应的化学方程式为___________________________。
(4)“操作 ”包含蒸发浓缩、__________、过滤、洗涤、干燥等一系列操作。
冷却结晶
(1)“研磨”的目的是____________________________________。
增大反应物的接触面积,使反应更充分
(1)“灼烧”的主要目的是_________________。
将 转化为
(2)“酸溶”发生反应的化学方程式为_____________________________,反应类型为____________。
复分解反应
(3)“转化”生成气体 <m></m> 的成分为_______________。
蒸发(或蒸发结晶)
蒸发皿
搅拌散热,防部温度过高造成液滴飞溅
能力点4 工艺流程的评价
从成本角度考虑:所用原料价格低廉或将废弃物转化为有用的物质,流程中耗能较少,实现了物质、能量的循环利用。从环保角度考虑:无污染、无腐蚀、三废(废气、废渣、废水)的处理;利用绿色能源等。
中考化学题型突破方案题型训练工艺流程题

中考化学题型突破方案题型训练工艺流程题嘿,同学们,今天我要给大家带来一份超级实用的中考化学题型突破方案,特别是工艺流程题的专项训练!跟着我,让你的化学成绩飙升,成为班级里的化学学霸!一、认识工艺流程题工艺流程题是中考化学中的重点题型,主要考察同学们对化学实验操作的理解、分析和应用能力。
这类题目通常以实际生产或实验室操作为背景,给出一系列操作步骤,要求同学们分析每个步骤的目的、原理和结果。
二、解题步骤1.仔细阅读题目,了解背景信息和问题要求。
2.分析每个操作步骤,理解其目的和原理。
3.根据步骤之间的逻辑关系,推导出最终结果。
4.将分析过程和结果用简洁明了的语言表述出来。
三、训练方案1.熟悉常见工艺流程(1)实验室制备氧气:过氧化氢分解制氧气、高锰酸钾加热制氧气、氯酸钾加热制氧气。
(2)实验室制备二氧化碳:大理石与盐酸反应制二氧化碳。
(3)分离混合物:过滤、蒸发、蒸馏、萃取等。
(4)提纯物质:重结晶、沉淀、过滤等。
2.突破关键步骤(1)反应原理:理解每个步骤中发生的化学反应,包括反应物、物和反应条件。
(2)操作方法:掌握各种实验操作方法,如加热、冷却、过滤、蒸馏等。
(3)结果分析:分析每个步骤的结果,判断是否符合预期。
3.实战演练例1:实验室制备氧气(1)写出反应方程式。
(2)加热前为什么要预热试管?(3)收集氧气时,为什么导管要伸到集气瓶的底部?(4)实验结束后,为什么不能立即熄灭酒精灯?例2:分离混合物(1)进行的操作是什么?为什么?(2)如何判断沉淀已经完全?(3)蒸发过程中,为什么要不断搅拌?(4)蒸发结束后,如何判断溶液已经蒸干?(1)是否理解了每个步骤的目的和原理?(2)是否掌握了各种实验操作方法?(3)是否能够清晰地表述分析过程和结果?四、写在同学们,工艺流程题并不是那么可怕,只要我们掌握了解题方法和技巧,勤加练习,一定能够在中考中取得好成绩!加油吧,让我们一起成为化学学霸!别忘了收藏这份方案,有空就拿出来看看,相信它会成为你中考化学路上的得力!注意事项一:不要忽略反应原理的重要性解决办法:遇到工艺流程题,要搞清楚每个步骤背后的化学反应原理。
2023年中考化学一轮热点突破专题五---工艺流程题

和钛。下列说法不正确的是( B
)
A.步骤①中可以加入石灰乳
B.步骤②和④中发生的反应都是复分解反应
C.该流程中氯化镁可以循环利用
D.步骤④中氩气作保护气是因为其化学性质稳定
类型三
物质的分离、提纯和除杂
1.解题思路
本质就是对混合物的除杂、分离、提纯。
(1)首先,找出要得到的主要物质是什么,混有哪些杂质。
6.对流程进行评价
(1)安全性和简便性:若反应中会产生可燃性物质,应注意做好防护措施,如通风和远离火源;尽量选
用较温和的反应条件,避免高温和高压等复杂条件。
(2)环保性:是否符合“绿色化学”理念,环保、低碳方案优先。
(3)经济实用性:应遵循原料廉价易得、反应能耗低、产率或原料的利用率高等原则。
7.解题关键
化学方程式。
(4)若有陌生的内容,尝试回归题目,在题目中寻找答案。
2.流程中箭头的意义
(1)进箭头
:箭头进入的是投料(即反应物),若该框图出现在起始位置,则表示原料的预处理。
(2)出箭头
出去的箭头一般指的是生成物,通常过滤操作之后会有两个出箭头,其中一个代表滤
渣(固体),一个代表滤液。
(3)回箭头
稀有气体、氮气等性质稳定,可以用作保护气,隔绝空气,防止生成物被氧化。
5.陌生化学方程式的书写
根据箭头方向,箭头进入的是反应物,出去的是生成物(包括主产物和副产物)。若从已知信息中找
到的反应物和生成物不满足质量守恒定律,可在反应物或生成物中加入水,然后进行配平,还应注意
反应条件的有关信息;若在空气中煅烧或通入空气,则还需考虑空气中的氧气是否参与反应。
Ba(OH)2溶液 。
(3)流程Ⅲ为海水“制碱”。滤液A中碳酸氢钠是否饱和?
中考化学专题复习工艺流程题(共25张PPT)

自我总结:
1.流程题的结构 题头(引入信息)→题干(提取信息,应用解题)→题尾(得到产品)
2.解题方法和思路
检测促动
练习1含锌废渣和各种锌矿(如菱锌矿)都有着重要的用途 I.以含锌废渣(主要成分为ZnO,杂质为FeO﹑CuO)为原料制备 七水硫酸锌(ZnSO4·7H2O)的流程如下。
⑴粉碎的目的是 增大接触面积,加快反应速率,充分反。应
①调节废水pH;②过滤;③蒸发浓缩;④
结晶池中结晶;⑤收集晶体,洗涤、干燥
(1)调节废水pH时,适宜加
入
.(填序号)
a.Fe
b.Cu
c.Ca(OH)2
(2)实验室中,完成过滤操作需要的玻 璃仪器有玻璃棒、漏斗 和 烧杯 ,过滤 和蒸发操作中玻璃棒的作用分别 是 引流 、搅拌,使受热均.匀,防止液 滴飞溅
ห้องสมุดไป่ตู้
是
.
(2)以电石渣[主要成分为Ca(OH)2,还含有少量 MgO等杂质为原料制备高纯CaCO3的流程如下:
①如图为NH4Cl浓度对钙、镁浸出率的影响(浸出率
=×100%).可知:较适宜的NH4Cl溶液的质量分数
为
10% ;浸取时主要反应的化学方程式
为
2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O.
(3)已知:Cu+2H2SO4(浓)==△===CuSO4+SO2↑+2H2O。从 环保和经济的角度分析,对比途径Ⅰ、Ⅱ,途径Ⅰ的优点有不产
生有害气体和____硫__酸__的__利__用__率__高__(_合__理__均__可__)_。
解题思路
工艺流程题
阅读 题头 ,了解原料、产品,确定目的。 精读 流程图 ,逐步分析,弄懂原理。 根据 问题 ,获取信息,逐一解答。
九年级化学 中考复习专题 化学工艺流程图 习题练习(包含答案)

化学工艺流程图题题型之一金属资源的回收与利用1.废旧电路板中主要含有塑料、铜和锡(Sn)等,为实现对锡的绿色回收,设计如下工艺流程:已知:Sn+SnCl4===2SnCl2。
(1)塑料属于___________(填“有机物”或“无机物”)。
(2)SnCl2中锡元素的化合价是________。
(3)铜的金属活动性比锡的________(填“强”或“弱”);固体A中一定含有的金属元素是________。
(4)写出步骤②发生反应的化学方程式______________________,其基本反应类型是____________。
(5)相比于直接焚烧废旧电路板回收金属,该工艺的主要优点是___________(回答一点)。
2.金属钛广泛用于航空航天工业、化工、医疗等领域。
用钛铁矿(主要成分为FeTiO3)制取钛并获得副产品A的主要工艺流程如图1所示:图1图2请回答下列问题:(1)构成金属钛的微粒是_______(填“分子”“原子”或“离子”),H2TiO3中钛元素的化合价为______。
(2)反应②需持续通入氩气,氩气的作用是______________________。
(3)反应③的产物除红色固体A外,还有两种组成元素相同且相对分子质量相差16的气体,则该反应的化学方程式为______________________。
(4)反应①②③中属于分解反应的是___________。
(5)对反应③进行改进,可直接生产锂离子电池的电极材料LiFePO4,工艺流程如图2所示。
写出“高温煅烧”由FePO4制备LiFePO4的化学方程式_________________________________。
3.某金属冶炼厂的管道烟泥中含有少量铜、锌、硫等单质。
现欲回收铜和锌,并对硫进行环保处理,主要步骤如图所示:已知:加热的条件下,Zn、Cu都可以与氧气反应生成相应的金属氧化物。
(1)烟泥最初处理需要除油污,用洗涤剂除油污的过程中发生了_________现象。
2021年中考化学工艺流程题专项训练(word版,含答案)
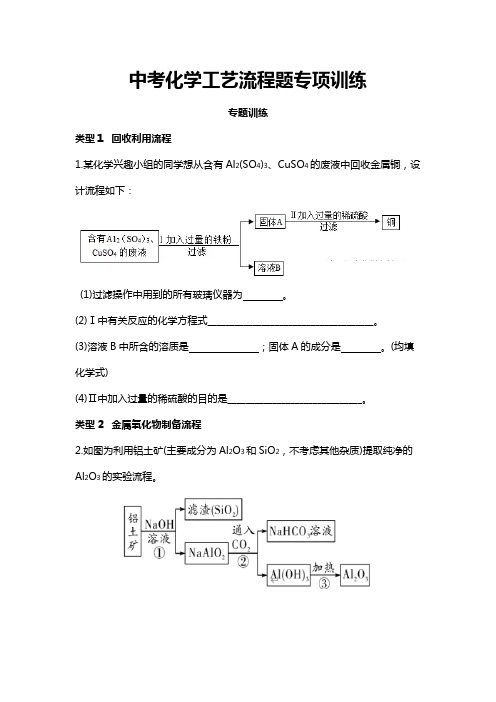
中考化学工艺流程题专项训练专题训练类型1 回收利用流程1.某化学兴趣小组的同学想从含有Al2(SO4)3、CuSO4的废液中回收金属铜,设计流程如下:(1)过滤操作中用到的所有玻璃仪器为。
(2)Ⅰ中有关反应的化学方程式_____________________________________。
(3)溶液B中所含的溶质是;固体A的成分是。
(均填化学式)(4)Ⅱ中加入过量的稀硫酸的目的是______________________________。
类型2 金属氧化物制备流程2.如图为利用铝土矿(主要成分为Al2O3和SiO2,不考虑其他杂质)提取纯净的Al2O3的实验流程。
(1)通过步骤①可得出SiO2的性质有。
(写出一条即可)(2)步骤①发生的反应为2NaOH+Al2O3=== 2NaAlO2+X,X的化学式为。
(3)步骤②得到的副产物为NaHCO3,请写出NaHCO3的一种用途。
(4)步骤③得到Al2O3和另一种常见的氧化物,请写出该反应的化学方程式,该反应的基本反应类型是。
类型3 海水资源的利用流程3. 海洋中有丰富的水生生物和化学资源,海带就是其中之一。
从海带中提取碘的流程如下:(1)写出④中氧化物的名称。
(2)第①步中将“干海带灼烧”的目的是。
(3)实验室进行溶解操作时,玻璃棒的作用是。
(4)海带灰烬中含有碳酸钾,为了使溶液呈弱酸性,加入硫酸酸化,发生反应的化学方程式为。
类型4 石灰石工业流程4. 碳酸钙可用石灰石制备,某同学设计了制备碳酸钙流程如下:(石灰石中的杂质在常温下不分解也不溶于水)(1)纯碱属于(填“碱”或“盐”)。
(2)A的化学式是。
写出步骤②发生反应的化学方程式。
(3)该反应中未涉及到的基本反应类型为。
(4)熟石灰在农业上的一种用途是。
类型5 矿产资源利用流程5.某矿石主要成分是MgO,含少量的Fe2O3、CuO和SiO2杂质。
用该矿石制备Mg(OH)2的工艺流程简图如下:回答下列问题:(1)步骤①和步骤②均用到的操作是。
初中中考化学专项突破训练:工艺流程题

中考化学专项突破训练:工艺流程题1.垃圾处理厂对生活垃圾进行处理与综合利用的部分流程如图:资料1:垃圾焚烧产生的烟气中含有SO2、HCl等气体。
资料2:+2价的铁元素容易被空气中的氧气氧化。
(1)步骤①中,主要发生了三个反应,分别是(写出反应的化学方程式)、和Fe + Fe2(SO4)3= 3FeSO4(2)步骤②中,将所得FeSO4溶液在氮气环境中蒸发浓缩、降温结晶、(填操作名称),得到FeSO4晶体,其中氮气的作用是。
(3)步骤③中,焚烧垃圾发电实现了能转变为电能。
(4)步骤④中,石灰浆的作用是。
(5)若一定量的废气中含有3.2g二氧化硫,吸收这些二氧化硫至少需要多少克氢氧化钙?(请写出计算过程)2.用废铁屑制备铁红(主要成分为Fe2O3)和K2SO4的部分流程如图所示:(1)加过量NH4HCO3反应时温度不宜过高的原因为______。
(2)反应Ⅰ生成的气体化学式是______。
(3)K2SO4和NH4Cl在农业生产中都可做______。
(4)为检验K2SO4中是否混有Cl-,要先加入足量______溶液,静置后再加向上层清液中滴加少量______溶液。
(5)在空气中灼烧FeCO3的化学方程式为______。
3.某科研小组对废弃辉铜矿(主要含有Cu2S、ZnO及一些不溶性杂质)进行物质提纯以实现废物综合利用。
部分实验流程如下:请根据上述实验流程回答下列问题:(1)“焙烧”(加热而又不使熔化)中生成CuO和SO2,该气体直接排放会使雨水pH小于,形成酸雨。
(2)“酸浸”时发生的反应类型是。
(3)“置换”时反应的方程式为(写出一个即可)。
滤渣2的成分为(填化学式)。
(4)“氧化”时高锰酸钾溶液和双氧水(过氧化氢溶液)都能将Fe2+氧化为Fe3+,从绿色化学角度考虑物质A选用较合适。
(5)聚合硫酸铁常用于净水,其化学式可表示为[Fe a(OH)b(SO4)c]n。
实验测得某聚合硫酸铁中铁离子与硫酸根离子的质量比为7∶15,则b∶a= 。
中考化学工艺流程题练习题及答案

中考化学工艺流程题练习题及答案一、中考化学流程题1.某废酸液主要含H2SO4和FeSO4,研究人员利用CaCO3消耗部分酸,再加入廉价的电石渣(主要成分是CaO),通过一系列操作可得到磁性铁,成本较低且有利于保护环境。
工艺流程如下:(1)该废酸液的pH_______7(填“<”或“>”)。
操作Ⅰ的名称为_______。
(2)电石渣转化为石灰乳的过程会_______。
(填“吸收”或“放出”)热量。
(3)“沉铁”过程中,溶液中的FeSO4和石灰乳中的Ca(OH)2发生复分解反应,写出该反应的方程式_______。
(4)磁性铁是铁的一种氧化物,且为磁铁矿的主要成分,其化学式为_______。
(5)研究发现,“沉铁”后,溶液的pH对磁性铁产率的影响如下表。
欲获得高的产率,最适宜的pH为_______。
pH较低时产率较低的主要原因是_______。
溶液的pH 6.0 6.57.07.58.09.0产物颜色黄褐色黄褐色较黑很黑很黑灰黑色产率(%)43.950.686.293.092.391.62.某硫酸厂产生的烧渣(主要含 Fe2O3、FeO 及少量 SiO2)可用于制备FeSO4•7H2O和还原铁粉,其流程如图。
Ⅰ.写出“酸溶”中发生的任一反应的化学方程式___________。
Ⅱ.“滤渣”的主要成分是___________(填化学式)。
Ⅲ.“还原”时,FeS2 被氧化的化学方程式是:7Fe2(SO4)3+FeS2+8H2O=15FeSO4+8___________。
Ⅳ.经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到 FeSO4•7H2O、FeSO4•4H2O和FeSO4•H2O。
硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在 56.7℃、64℃温度下可同时析出两种晶体)。
温度/℃010305056.76064708090溶解度14.017.025.033.035.235.335.633.030.527.0 /S析出晶FeSO4•7H2O FeSO4•4H2O FeSO4•H2O体若从硫酸亚铁溶液中结晶析出FeSO4•7H2O 晶体,应控制的结晶温度(T)的范围为___________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题五工艺流程题类型一物质的制备1.(2017·江西)碱式碳酸镁是一种新型阻燃剂,其工业制备流程如下:第1题图(1)常温下向某溶液中加入少量的NH4HCO3固体,固体不能溶解,则该溶液为NH4HCO3的________(填“饱和”或“不饱和”)溶液。
(2)操作1的名称是________,“一系列操作”中包括蒸发,实验室中蒸发溶液时用玻璃棒搅拌的作用是____________________________________________。
(3)副产品氯化铵与氢氧化钠反应,生成的一种可直接进入上述流程循环利用的物质是____________________________________________________。
2.(2016·江西)高锰酸钾是常用的氧化剂。
如图是实验室模拟工业上制备高锰酸钾晶体的操作流程:第2题图(1)完成操作③所需要的玻璃仪器是__________________________________(填一种即可);实验中通过操作②所析出高锰酸钾晶体,说明高锰酸钾的溶解度随温度升高而__________。
(2)操作流程中可循环利用的物质是__________________________。
(3)氢氧化钾、二氧化锰和氧气在高温条件下煅烧,生成锰酸钾和水,该反应的化学方程式为_________________________________________________。
3.超细碳酸钙可用于生产钙片、牙膏等产品。
利用碳化法生产超细碳酸钙的主要流程如下:第3题图(1)石灰石主要成分的化学式为______________。
(2)乳化池中,生石灰与水发生反应,其化学方程式为________________________________________。
(3)过筛的目的是拦截________(填“大于”或“小于”)筛孔直径的颗粒。
(4)碳化塔中反应的化学方程式为____________________________________。
4.(2018·宜春模拟)MnO2是一种既不溶于水也不溶于稀硫酸的重要无机功能材料,粗MnO2(含有较多的MnO2和MnCO3)的提纯是工业生产的重要环节。
下图是某研究性学习小组在实验室中模拟工业上粗MnO2转化为纯MnO2的工艺流程。
第4题图请回答下列问题:(1)操作A的名称是________;蒸发操作中玻璃棒的作用是_______________。
(2)NaClO3中氯元素的化合价为________价。
(3)写出粗Mn O2样品加稀H2SO4时产生CO2的化学方程式__________________________________________________________________________________。
(4)该流程中可以循环利用的物质是H2SO4和______________。
5.南海、钓鱼岛及其附属海域是我国固有领土,蕴藏着丰富的海洋资源,我国制碱工业先驱侯德榜发明了“侯氏制碱法”,在充分利用海洋资源的基础上,结合“侯氏制碱法”的基本原理,可模拟实现工业生产纯碱的过程如下(某些反应产物已略去)。
第5题图请回答下列问题:(1)操作a的名称是________。
(2)反应③的化学方程式是__________________________________________;反应②为________(填“吸热”或“放热”)反应。
(3)向精制饱和食盐水中通入两种气体的顺序为:先通氨气形成饱和铵盐水,然后在加压的条件下通入二氧化碳,这样操作的目的是________________________________________________。
(4)该流程中可以循环利用的物质是二氧化碳和__________________。
6.(2018·赣州六校联考)硅酸钠(Na2SiO3)是我国优先发展的精细化学产品。
用某种石英砂矿石(主要成分是SiO2,还含有少量的CuO、Na2SO4、Na2CO3)。
工业上制备硅酸钠晶体的流程如下:查阅资料:SiO2既不溶于水,也不与盐酸反应;Na2SO4、Na2CO3均易溶于水。
请问答:第6题图(1)“研磨”的目的是______________________________________________。
(2)实验室的过滤操作中必须用到的玻璃仪器有:烧杯、漏斗、__________,过滤时发现过滤速率缓慢,可能原因是_______________________________。
(3)“酸浸”过程中发生反应的化学方程式为___________________________________________________。
(4)“碱浸”时加入的碱液应选用____________(填化学式)溶液。
7.(2018·扬州)空气是宝贵的自然资源,如图是以空气等为原料合成尿素[CO(NH2)2]的流程。
请按要求回答相关问题:第7题图(1)空气属于__________(填“纯净物”或“混合物”),X是空气中含量最多的气体,其分子式为________。
(2)图中分离空气的过程属于________变化(填“物理”或“化学”)。
(3)空气中含有的少量稀有气体的化学性质________(填“活泼”或“稳定”)。
(4)实验室用大理石和稀盐酸制取二氧化碳的化学反应方程式为________________________________________________________________________;二氧化碳的密度比空气______(填“大”或“小”)。
(5)①天然气的主要成分是CH4,天然气属于________再生资源(填“可”或“不可”)。
②点燃CH4之前应____________。
8gCH4完全燃烧消耗32 gO2,生成a gCO2和18 gH2O,则a=________。
③由CH4在该流程中的作用表明:化学反应中发生物质变化的同时也会伴随有________变化(填“能量”或“原子个数”)。
(6)尿素属于________(填“氮肥”“磷肥”或“钾肥”);写出NH3合成尿素的化学反应方程式______________________________________________。
类型二物质的回收利用1.(2015·江西)炼铁产生的废渣中含有大量CuS及少量铁和铁的化合物,工业上以该废渣为原料生产CuCl2的流程图如下:第1题图(1)操作1:粉碎。
粉碎的目的是________________________。
(2)操作2:焙烧。
高温条件下,通入空气,CuS和Na Cl反应生成了CuCl2和Na2SO4,化学方程式为_____________________________________________。
(3)操作3:________(填操作名称)。
(4)流程图中能循环利用的物质是____________。
2.(2018·吉安一模)某工厂产生的烧渣(主要含FeO、Fe2O3,还有一定量的SiO2)可用于制备七水合硫酸亚铁晶体(FeSO4·7H2O),其工艺流程如下:第2题图查阅资料SiO2不溶于水,也不与稀硫酸反应。
(1)“浸取”步骤中,FeO、Fe2O3和稀硫酸发生反应的化学方程式分别为FeO+H2SO4=== FeSO4+H2O、_____________________________________________。
(2)为提高“浸取”步骤的反应速率,可采取的具体措施有____________________________________________________。
(3)“还原”步骤的目的是将Fe3+转化为Fe2+,试剂X可用SO2或Fe。
①若试剂X是SO2,转化原理为SO2+Fe2(SO4)3+2Y=== 2FeSO4+2H2SO4,则Y的化学式是______________。
②若试剂X是Fe,转化原理为Fe+Fe2(SO4)3=== 3FeSO4。
测得“还原”后溶液的pH明显增大,其原因是_____________________________________________。
3.(2018·安徽)废旧电路板中主要含有塑料、铜和锡(Sn)等,为实现对其中锡的绿色回收,某工艺流程如下。
第3题图已知:Sn+SnCl4=== 2SnCl2(1)SnCl4中锡元素的化合价是________。
(2)铜的金属活动性比锡的______(填“强”或“弱”),固体A中一定含有的金属元素是________。
(3)写出步骤②发生反应的化学方程式_______________________________。
(4)相比于直接焚烧废旧电路板回收金属,该工艺的主要优点是________________________________________________________________________(回答一点即可)。
4.(2018·福建)某矿山酸性废水(主要含硫酸、硫酸铁、硫酸铜和硫酸锌等)为原料,通过下述流程可将废水中的铁、铜和锌分步沉淀,实现回收利用。
第4题图(1)步骤①中,加入Ca(OH)2有两个作用。
一是中和废水中的硫酸,该反应的化学方程式为_______________________________________________________________。
二是将硫酸铁转化为Fe(OH)3,该反应属于______________(填基本反应类型)。
(2)步骤③中,锌泥中最主要的含锌化合物的化学式为__________________。
(3)为分步回收铁、铜、锌等金属资源且直接得到铜单质,只需改变上述流程中的某步骤加入的试剂即可。
该步骤和应加入的试剂分别是______________。
5.(2018·重庆A)某工厂的废水中含有MgSO4和FeCl3,技术人员逐渐加入NaOH溶液调节废水的pH,先后分离出两种沉淀,并通过系列处理得到有价值的产品。
操作流程如下图所示。
第5题图(1)固体A与某酸反应的化学方程式为____________________________________________________。
操作②时,当______________________即可停止加热。
(2)固体B加热的产物是两种常见氧化物,则另一种氧化物的化学式为______。
(3)溶液a除了可能含有NaOH外,还一定含有的溶质是__________________(填化学式)。
类型三物质的分离与提纯1.(2018·江西样卷)某氯化钾样品含有杂质氯化钙和氯化镁,实验室提纯流程如下:第1题图(1)操作A的目的是使样品____________,X溶液中溶质是________________。
