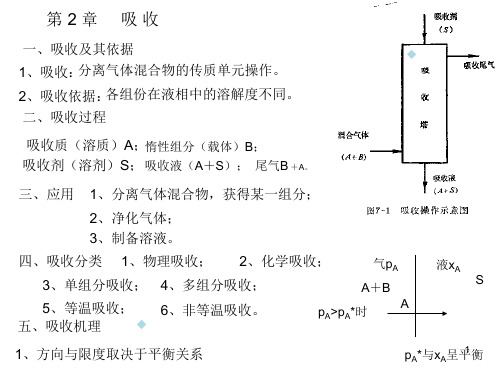
《化工传质与分离过程》第二章 气体吸收
化工原理之气体吸收

化工原理之气体吸收气体吸收是化工过程中常用的一种物理操作,它指的是将气体从气相吸收到液相中。
气体吸收广泛应用于环境工程、化工工艺、能源工程等领域,例如废气处理、石油炼制、烟气脱硫等。
一、气体吸收的基本原理气体吸收的基本原理是气体和液体之间的质量传递过程。
气体吸收的过程中,气体溶质分子通过气相和液相之间的传质界面传递到溶液中,从而实现气体从气相到液相的转移。
气体吸收的速度由以下几个因素决定:1.液相溶剂的性质:液相溶剂的挥发性、表面张力、黏度和溶解度等性质都会影响气体吸收的速度。
通常情况下,挥发性较强的溶剂对气体的吸收速率较快。
2.溶剂和气体溶质之间的亲和力:溶剂和气体溶质之间的亲和力越强,气体吸收速度越快。
3.传质界面的面积和传质界面的厚度:传质界面的面积越大,气体吸收速度越快;传质界面的厚度越薄,气体吸收速度越快。
4.溶解度:气体的溶解度越高,气体吸收速度越快。
5.气体浓度梯度:气体浓度梯度越大,气体吸收速度越快。
二、气体吸收的设备常见的气体吸收设备包括吸收塔、吸收柱和吸附塔等。
1.吸收塔:吸收塔是最常用的气体吸收设备之一,它主要由一个塔体和填料层组成。
气体通过底部进入吸收塔,液体从塔顶滴入塔体中。
在填料层的作用下,气体和液体之间的接触面积增加,从而促进气体的传质。
通过提供充分的接触时间和表面积,吸收塔可以实现高效的气体吸收。
2.吸收柱:吸收柱通常用于含有反应过程的气体吸收。
与吸收塔类似,吸收柱也包含一个塔体和填料层。
区别在于,吸收柱还包括一个液相反应器,用于在吸收气体的同时进行反应。
3.吸附塔:吸附塔是另一种常用的气体吸收设备,主要用于吸附分离等工艺中。
吸附过程通过吸附剂将目标气体吸附在其表面上实现。
吸附塔通常由多个吸附层和吸附剂床组成,气体从底部进入吸附塔,经过吸附剂床后,被吸附物质从气相转移到固相中,从而实现气体吸附。
三、气体吸收的应用气体吸收在化工工艺中有着广泛的应用。
1.废气处理:气体吸收是一种有效的废气处理方法,可用于去除废气中的有害污染物,如二氧化硫、氮氧化物等。
化工原理(下)第2章吸收

向传递,这种现象称为涡流扩散。
J A ,e
dc A De dz
J A ,e——涡流扩散速率,kmol/(m2·s);
De ——涡流扩散系数,m2/s。
注意:涡流扩散系数与分子扩散系数不同,不是物性 常数,其值与流体流动状态及所处的位置有 关。
总扩散通量:
dc A J A (D De ) dz
Dc dc A NA c c A dz
——微分式
在气相扩散
pA cA RT
c p RT
dpA Dp NA RT ( p pA ) dz
z
0
N A dz
pA2
p A1
Dp dpA RT ( p - pA )
p p A2 Dp NA ln RTz p p A1
液相:
NA= J A DAB
dc A dz
D N A (c A1 c A2 ) z
(3)讨论
1) N A p A1 p A2
2)组分的浓度与扩散距离z成直线关系。
p
p
pB1 pA1
pB2
pA2
0 扩散距离z
z
2.单向扩散及速率方程 (1)总体流动:因溶质A扩散
JA NMcA/c
易溶气体 难溶气体
一、亨利定律的表达式
4. Y ~ X关系
X x 1 X
由
得
Y y 1 Y
Y* X m 1 Y * 1 X
整理得
简化得
mX Y* 1 1 m X
对于低组成吸收
Y * mX
1 m X
1
一、亨利定律的表达式
亨利定律表达式可改写为以下形式:
化工原理吸收
(-2 27
液相: N Az D L ' cC sm (ic-c )作k业L(:ic-复c习)所讲(2 。-218 4 )
2.2.6 吸收过程的机理
1、双膜理论
(1)目的:建立传质速率方程。
(2)双膜理论 ①传质过程
②双膜理论基本论点:
1)相界面,滞流膜层,分子扩散;
2)相界面处达于平衡;
3)流体主体为湍流, dc A 0,膜层内存在 dc A 。
式中: D — 分子扩散系数,m2/s;
(2 -26)
DE一 涡流扩散系数,m2/s;
dcA/dz 一 沿z方向的浓度梯度,kmol/m4;
J — 扩散通量,kmol/(m2·s)。
DE不是物性,与湍动程度有关。
气相: N AR D G T p P B z( m- p p i)k G (- p p i)
NA不涉及传递形式。
推导NA计算式:
NA=JA
-D
dCA dZ
- D dpA RT dZ
(2-15)
稳定过程,NA为常数。因而
dp A dZ
NA
Z
D
dZ-
pA2dpA
0
RTpA1 dZ
也是常数, 故pA~Z为直线关系。
N AR DT (A P Z -1P A)2
(2 -16
9
二、一组分通过另一停滞组分的扩散
平衡分压
p*
一、亨利(Henry)定律
P总不高,T一定, p*=E x (2-1)
x
实际浓度
说明:1、 p*、x 、E(亨利系数,压强单位 )
推导:1m3:
2、适用于 t 一定,理想溶液。E为该 t 下纯溶质p°;
化工原理第二章 吸收.

2.2.1平衡溶解度
⑴溶解度曲线 对 单组 分 物 理 吸收 的 物 系 ,根 据 相 律 ,自 由 度 数 F 为 F=CΦ +2=3-2+2=3(C=3,溶质A,惰性组分B,溶剂S,Φ =2,气、液两 相),即在温度 t ,总压 p ,气、液相组成共4个变量中,由3个自 变量(独立变量),另1个是它们的函数,故可将平衡时溶质在气 相中的分压 pe 表达为温度 t ,总压 p 和溶解度 x 的函数:
2.1概述
①溶剂应对被分离组分(溶质)有较大的溶解度,或者说在 一定的温度与浓度下,溶质的平衡分压要低。这样,从平衡角度 来说,处理一定量混合气体所需溶剂量较少,气体中溶质的极限 残余浓度亦可降低;就过程数率而言,溶质平衡分压↓,过程推 动力大,传质数率快,所需设备尺寸小。 ②溶剂对混合气体中其他组分的溶解度要小,即溶剂应具备 较高的选择性。若溶剂的选择性不高,将同时吸收混合物中的其 他组分,只能实现组分间某种程度的增浓而不能实现较为完全的 分离。 ③溶质在溶剂中的溶解度应对温度的变化比较敏感,即不仅 在低温下溶解度要大,平衡分压要小,而且随着温度升高,溶解 度应迅速下降,平衡分压应迅速上升。这样,被吸收的气体容易 解吸,溶剂再生方便。
2.1概述
④溶剂的蒸汽压要低,不易挥发。一方面是为了减少溶剂在 吸收和再生过程的损失,另一方面也是避免在气体中引入新的杂质。 ⑤溶剂应有较好的化学稳定性,以免使用过程中发生变质; ⑥溶剂应有较低的粘度,不易产生泡沫,以实现吸收塔内良 好的气液接触和塔顶的气液分离。 ⑦溶剂应尽可能满足价廉、易得、无毒、不易燃烧等经济和 安全条件。 实际上很难找到一个理想得溶剂能够满足上述所有要求,应 对可供选择得溶剂做全面得评价,以便作出经济、合理得选择。 ⑹吸收操作得经济性 吸收总费用=设备(塔、换热器等)折旧费+操作费(占比重大)
化工原理 PPT 第2章 吸收

中溶质达到饱和,组成不再增加为止,这种状
态称为相际动平衡,简称相平衡或平衡。 平衡分压:平衡状态下气相中的溶质分压,又称饱和 分压。
平衡组成:平衡状态下液相中的溶质组成,又称饱和
组成。
14
溶解度 C A :气体在液体中的饱和组成。
2.溶解度的意义 1)表明一定条件下,吸收过程可能达到的极限 程度;
m
202 .6 p
从气相分析 y*=mx=23.94×0.01=0.24<y=0.3 故SO2必然从气相转移到液相,进行吸收过程。 y 0.3 x* 0.0125 m 23.94 以液相摩尔分数表示的吸收推动力为: ∆x=x*-x=0.0125-0.01=0.0025 以气相摩尔分数表示的吸收推动力为: ∆y= y - y*=0.3-0.24=0.06
1.判断传质进行的方向
①气、液相组成(yi,xi)在平衡线上方(P点): 相对于液相组成xi 而言, 气相浓度为过饱和 ( yi yi* ),溶质 A 由气 相向液相转移。 相对于气相组成yi 而言, 液 相 浓 度 欠 饱 和 ( xi xi* ),故液相有吸 收溶质 A 的能力。
y yi
释放溶质
P
yi* f ( xi )
yi*
o xi
吸收溶质
xi*
x
结论:若系统气、液相组成(yi , xi)在平衡线上方,则体系 将发生从气相到液相的传质,即吸收过程。
27
②气、液相组成(yi,xi)在平衡线下方(Q点): 相对于液相组成xi 而言 气相浓度为欠饱和 * ( yi y),溶质 A 由液相 i 向气相转移。 相对于气相组成yi而言实 际液相浓度过饱和 ( xi xi* ),故液相有释放 溶质 A 的能力。
化工原理下册第二章吸收2

17
结论
•加压和降温有利于吸收操作 •减压和升温有利于解吸操作
减压、升温
吸收
加压、降温
解吸
18
2.1.2
亨利定律
一、pi-xi关系
总压不高时,在一定温度下,稀溶液上方气相中溶质的平衡分 压与溶质在液相中的摩尔分率成正比,其比例系数为亨利系数。
p Exi
* i
亨利定律
pi* ——溶质在气相中的平衡分压,kPa;
三小
挥发性小 粘度小 腐蚀小
技术经济性
29
2.1.4
相平衡在吸收过程的应用:
1、过程传质进行的方向的判定:
●当p>p* = E · x ( or x < x* )时,过程为吸收过程。 ●当p<p* = E · x ( or x > x* )时,过程为解吸过程。
30
实质上,吸收还是解吸主要取决于溶质在气相中的实际分压 与其液相的平衡分压间的关系而定。
c
W M
M
M
M S (1 x) M A x
MS
c E H HM S
H
EM S
H的讨论
C A Hp * A
T H
溶解度 H
22
三、xi-yi关系
yi mxi
m与E的关系 :
*
m——相平衡常数,无因次。
p pyi
* i
*
pyi Exi
f c 2 3 2 2 3
10
C A f (T , P, PA ) x A f (T , P, y A )
在总压不高,P<5atm时
(NEW)贾绍义《化工传质与分离过程》(第2版)笔记和考研真题详解

目 录绪 论
0.1 复习笔记
0.2 名校考研真题详解第1章 传质过程基础1.1 复习笔记
1.2 名校考研真题详解第2章 气体吸收
2.1 复习笔记
2.2 名校考研真题详解
第3章 蒸 馏
3.1 复习笔记
3.2 名校考研真题详解第4章 气液传质设备
4.1 复习笔记
4.2 名校考研真题详解第5章 液-液萃取
5.1 复习笔记
5.2 名校考研真题详解第6章 固体物料的干燥
6.1 复习笔记
6.2 名校考研真题详解
第7章 其他传质与分离过程7.1 复习笔记
7.2 名校考研真题详解
绪 论
0.1 复习笔记
一、传质分离方法的分类
依据物理化学原理的不同,传质分离过程可分为平衡分离和速率分离两大类。
1平衡分离过程
平衡分离过程是指借助分离媒介(如热能、溶剂、吸附剂等),使均相混合物系统变为两相体系,再以混合物中各组分在处于平衡的两相中分配关系的差异为依据而实现分离的过程。
根据两相状态的不同,平衡分离过程可分为:
(1)气液传质过程,如吸收(或脱吸)、气体的增湿和减湿。
(2)汽液传质过程,如液体的蒸馏和精馏。
(3)液液传质过程,如萃取。
(4)液固传质过程,如结晶(或溶解)、浸取、吸附(脱附)、离子交换、色层分离、参数泵分离等。
(5)气固传质过程,如固体干燥、吸附(脱附)等。
在平衡分离过程中,i组分在两相中的组成关系常用分配系数(又称相平衡比)K i来表示,即
K i值的大小取决于物系特性及操作条件(如温度和压力等)。
组分i和j的分配系数K i和K j之比称为分离因子αij,即。
《传质与分离工程》第二章 吸收第六次课

y 2 y 2 y e 2 y 2 mx 2 0 .0025
ym
0 .0167 0 .0025 ln 0 .0167
0 .0025
0 .00748
0 .0167
Z V
y1 y 2
K ya ym
102 .3 kmol
67 kmol h 1 m 3 h 1
V 770/18 42.8kmol m2 h1
Z
V KGa P
1 1 mV
ln1
mV L
y1 y2
Байду номын сангаас
mx2 mx2
mV
L
L
KGa
20kmol m2 h1 3m101.3kPa
1
1 0.9
20
ln1
0.42
0.06 0.0006
0.42
42.8
0.4615kmol m3 h1 kPa1
(1)出塔溶液浓度 x1 ; (2)用平均推动力法求填料层高度 Z ; (3)用吸收因数法求 Z 。
首先列出已知条件,并用公式符号和标准单位表达出来。
y2
x2
此题中: x2 0 , y1 0.05 , V 1500 22.4 67 kmol h 1
0.95 , a 93 m 2 m -3 , H 1 / 5.78 m kN kmol 1 V
m
M
s s H
P
1000 18
kg kg
m 3 kmol
5 . 78 m kN 1 101 . 3 kN
kmol m 2
1
3 . 17
L 1 . 5 y 1 y 2 1 . 5 0 . 05 0 . 0025 4 . 518
化工原理-气体吸收_图文

• 气体的溶解度与温度有关,一般来说,温度下降则气体的 溶解度增高。
溶解度曲线:在一定温度、压力下,平衡时溶质在气相和液 相中的浓度的关系曲线。例:图2-2,2-3,2-4。
本章以分析单组分的等温物理吸收为重点,以便掌握最基本 的原理。
• 气体吸收是物质自气相到液相的转移,这是一种传质过程。 • 混合气体中某一组分能否进入溶液里,既取决于该组分的分压,
也取决于溶液里该组分的平衡蒸汽压。如果混合气体中该气体的 分压大于溶液的平衡蒸汽压,这个组分便可自气相转移至液相, 即被吸收。由于转移的结果,溶液里这个组分的浓度便增高,它 的平衡蒸汽压也随着增高,到最后,可以增高到等于它在气相中 的分压,传质过程于是停止,这时称为气液两相达到平衡。 • 反之,如果溶液中的某一组分的平衡蒸汽压大于混合气体中该组 分的分压,这个组分便要从溶液中释放出来,即从液相转移到气 相,这种情况称为解吸(或脱吸)。 • 所以根据两相的平衡关系可以判断传质过程的方向与极限,而且 ,两相的浓度距离平衡愈远,则传质的推动力愈大,传质速率也 愈大。 • 吸收操作的分析,应该从气液两相的平衡关系与传质速率关系着 手,本章各节即如此展开讨论。
y
相对于气相浓度而言实
际液相浓度过饱和
(x>x*),故液相有释放
o
溶质 A 的能力。
y*=f(x)
吸收溶质
Q
释放溶质
x* x x
结论:若系统气、液相浓度(y,x)在平衡线下方,则体系将 发生从液相到气相的传质,即解吸过程。
传质过程的方向
气、液相浓度(y,x)处于
化工原理下2-1气体吸收的相平衡关系
6
Y Y , 能发生吸收 推动力为 ,
*
Y Y * 0.266 0.133 0.113
1000kg / m 3 H EM S 4.81 106 kPa 0.018kg / m ol 0.0116m ol/(m 3 kPa)
c pH 21.3kPa 0.0116 /(m kPa) 0.247mol/ m mol
Y 0.266 6 X 5.6 10 4 m 4.75 10
*
X * X , 能发生吸收 推动力为 , X * X (5.6 2.81) 106 2.79106
小结 • 判断传质的方向,不能简单地把气液相的浓 度进行对比,而把某相的实际浓度和另一相 “换算”的平衡浓度相比较。 • 由于气、液相的浓度表示方式多样,传质过 程的推动力的表达方式多样。 • 在图上,要能够直观地理解推动力。
整理得:
mX Y 1 (1 m) X
当溶液组成很低时,(1-m)X <<1,简化为:
Y mX
小结:亨利定律的表达式 pi pi Exi xi E
ci p H
i
ci Hpi
y mxi
Yi mX i
20
i
xi
yi m
Yi m
X i
②难溶气体。
E大
2. p~c 关系
若溶质在气、液相中的组成分别以分压 p、摩尔 浓度c表示,则亨利定律可写成:
c p H
式中 c:溶液中溶质的体积摩尔浓度,kmol/m3; p*:气相中溶质的平衡分压,kPa; H:溶解度系数,kmol/(m3· kPa)。 注意 溶解度 ~ 溶解度系数 H大 ① 易溶气体; ② 难溶气体。 H小
化工分离过程-吸收及解吸

—吸收率;Aj—第j板上的吸收因子;N
—理论板数
v N +1 - v1 = A1 A2 A3 AN + A2 A3 AN + + AN
v N +1
A1 A2 A3 AN + A2 A3 AN + + AN + 1
- l0 ( A2 A3 AN + A3 A4 AN + + AN + 1) v N +1 A1 A2 AN + A2 A3 AN + + AN + 1
简捷计算主要应用场合: (1)设计的初始阶段,为严格计算提供初值; (2)对操作进行粗略分析。
简捷计算法的常见类型: (1)平均吸收因子法(掌握) (2)平均有效吸收因子法(不要求) (3)蒸出(解吸)因子法(不要求)
重点介绍并掌握吸收因子法
复习: 吸收过程计算的图解梯级法
Y
YN+1 (gas in)
Horton-Franklin方程
关联了吸收率、吸收因子和理论板数
平均吸收因子法
各板吸收因子相同,并采用全塔平均吸收因 子代替各板上的吸收因子,以A表示。
Horton-Franklin方程可简化为: 相对吸收率
v N +1 - v1 = AN +1 - A =
v N +1 - v0 AN +1 - 1
l N + v1 = l0 + v N +1 l N = AN v N
vN
=
v N +1 - v1 + l0 AN
(3-71)
1 . .
n-1
vn
l n-1 n
化工原理-气体吸收

Y * mX
2019/11/18
projects of Dr.Hao
15
2––1––3 吸收剂的选择
• 吸收剂性能的优劣,是决定吸收操作效果是否良好的关键。如果吸收 的目的是制取某种溶液作成品,例如用HCl气生产盐酸,吸收剂只能 用水,自然没有选择的余地,但如果目的在于把一部分气体从混合物 中分离出来,便应考虑选择合用的吸收剂问题。
• 惰性气体(inert gas)或载体:不溶或难溶 组分,以B表示。
• 吸收剂(absorbent):吸收操作中所用的 溶剂,以S表示。
• 吸收液(strong liquor):吸收操作后得到 的溶液,主要成分为溶剂S和溶质A。 混合尾气
• 吸收尾气(dilute gas):吸收后排出的气 (A+B) 体,主要成分为惰性气体B和少量的溶质 A。
• 气体吸收是溶质先从气相主体扩散到气液界面, 再从气液界面扩散到液相主体的传质过程。
2019/11/18
projects of Dr.Hao
17
2––2––1 气液相际传质理论
一、传质过程的方向
气、液相浓度(y,x)在平
衡线上方(P点):
y
相对于液相浓度 x 而言, y
气相浓度为过饱和
(y>y*),溶质 A 由气相
2019/11/18
projects of Dr.Hao
6
本章以分析单组分的等温物理吸收为重点,以便掌握最基本 的原理。
• 气体吸收是物质自气相到液相的转移,这是一种传质过程。 • 混合气体中某一组分能否进入溶液里,既取决于该组分的分压,
也取决于溶液里该组分的平衡蒸汽压。如果混合气体中该气体的 分压大于溶液的平衡蒸汽压,这个组分便可自气相转移至液相, 即被吸收。由于转移的结果,溶液里这个组分的浓度便增高,它 的平衡蒸汽压也随着增高,到最后,可以增高到等于它在气相中 的分压,传质过程于是停止,这时称为气液两相达到平衡。 • 反之,如果溶液中的某一组分的平衡蒸汽压大于混合气体中该组 分的分压,这个组分便要从溶液中释放出来,即从液相转移到气 相,这种情况称为解吸(或脱吸)。 • 所以根据两相的平衡关系可以判断传质过程的方向与极限,而且, 两相的浓度距离平衡愈远,则传质的推动力愈大,传质速率也愈 大。 • 吸收操作的分析,应该从气液两相的平衡关系与传质速率关系着 手,本章各节即如此展开讨论。
第2章气体吸收

1.00 107T 1.75( 1 1 )0.5
D
MA MB p[(VA )1/3 (VB )1/3 ]2
D T 1.75 p
T ,D ; P , D
❖液体中分子扩散系数 10-5~5×10-5cm2/s
D=f(种类,T,浓度, 粘度) ;P对其影响小
DT
由H~E关系
H Ms E
30℃时CO2在水中的亨利系数 E =1.88×105kPa
因CO2是难溶于水的气体,因而溶液的浓度很低,
溶液密度和摩尔质量可按纯水计算,
即ρ=1000kg/m3, Ms=18
代入公式中可得
c*
Ms
E
p
1000 18 1.88 105
30.4
8.98 103kmol/ m3
(4)若 P↑,m↓, x* ↑,Δx↑
第二节 传质机理与传质速率
两个基本问题:
一是过程的极限,取决于吸收的相平衡关系 另一是过程的速率。
气液传质过程的三个基本步骤:
①溶质由气相主体 相界面(相内传质) ②溶质组分在界面上发生溶解进入液相 (相际传质) ③由界面 液相主体(相内传质)
溶解过程较易进行,其阻力很小。总传质过程 速率将由相内传质传质速率所决定。
某些产品的制取。如制酸工业中用水分别 吸收混合气体中的HCl、SO3和NO2制取盐酸、 硫酸和硝酸。
废气的治理。排放的废气含有对人体和环 境有害的物质,如SO2、H2S等。选择适当的 工艺和溶剂进行吸收是废气治理中应用较广 的方法。
二、气体吸收的基本原理与流程
吸收 —— 根据气体中各组分在某液体溶剂中 的溶解度不同而将气体混合物进行分离的单元 操作。
化工单元操作-传质过程(吸收)

Y1 液气比
B
L/V
(L V
)
m
in
B* 最小 液气比
20.5.24
最小液气比的计算
L V
min
Y1 Y2 X1* X 2
X*1——与Y1相平衡的液相组成。
3、吸收剂用量
L Y , Z ,设备费 V
L Y , Z ,设备费 ,并不总有效 V
L ,再生费
工业生产中,确定吸收剂用量或液气比的选择、调节 、控制主要从以下几个方面考虑:
气液接触面积。
第四节 吸收过程的计算
全塔物料衡算
目的 :确定各物流之间的量的关系 以及设备中任意位置两物料 组成之间的关系。
对单位时间内进出吸收塔的A的物 质量作衡算
VY1 LX 2 VY2 LX1
V,Y2 L,X2
V,Y L,X
V,Y1 L,X1 逆流吸收
20.5.24
V——通过吸收塔的惰性气体量,kmol/s; L——通过吸收塔的吸收剂量,kmol/s; Y1、Y2—进塔、出塔气体中溶质A的比摩尔分数 X1、X2 —出塔、进塔溶液中溶质A的比摩尔分数
•亨利定律用数学表达式为
p*=Ex 式中 p*——溶质在气相中
的平衡分压,Pa;
x—溶质在液相中的摩尔分
率;
E—亨利系数,Pa。
对于给定物系,亨利系数E随温 度升高而增大。在同一溶剂中 ,易溶气体的E值很小,而难溶 气体的E值很大。常见物系的亨 利系数可从手册中查到。
吸收机理——双膜理论
双膜理论模型
1、液气比不能小于最小液气比
2、为保证填料层的充分湿润,喷淋密度(单位时间 内,单位塔截面积上所接受的吸收剂量)不能太小 。
3、当操作条件发生变化时,为达到预期的吸收目的 ,应及时调整液气比。
第1章2节 化工传质与分离过程
p*=c/H
y*=mx
Y=
Y*=
mX 1+(1-m)X
EM S
m=E/P
液相中溶质A的摩尔数 液相中溶剂S的摩尔数
气相中溶质A的摩尔数 气相中惰性组分B的摩尔数
第二章 吸收>>2.2传质机理与吸收速率
吸收过程
气相主体-相界面(单向传质) 界面溶解 界面--液相主体 单相内的传质是基础
单相内的传质机理
NA D ( p A1 p A 2 ) RTz
则传质速率为:
NA
D ( p A1 p A 2 ) RTz
NA
D P (pA1 -pA2) RTz pBm
总体流动使A传递速率增加
适合描述理想的精馏过程,传递速率等于扩散通量
NA
D P (pA1 -pA2) RTz pBm
适合描述理想的吸收或解吸过程,B不进入液相,S不进入气相
化工传质与分离过程
第二章 吸收>>回顾:概述及气-液相平衡
吸收剂S
吸收基本概念:
溶质A 载体或惰性气体B 混合气体 (A+B) 吸 收 塔
吸收尾气 (B+少量A)
吸收液 (A+S)
吸收基本原理:
物理吸收: 各组分溶解度差异 溶质气相分压(浓度)小于平衡值,解吸 溶质气相分压(浓度)大于平衡值,吸收
第二章 吸收>> 2.2.2气态中的定态分子扩散
>>一组分通过另一停滞组分的扩散(2)
由于气相中B在传质方向上的静通量NB=0 即:NB=JB+ N(cB/c)=0 -JB= N(cB/c)
dc J B= D B dz
N
dc c D B cB dz
分离过程-吸收
作全塔物料衡算
v1 lN vN 1 l0
FLGC
由式(4-20)和上式得
vN 1 v1 vN AN l0 A1 A2 .... AN A2 A3 .... AN ... AN vN 1 vN 1 A1 A2 .... AN A2 A3 .... AN ... AN 1 l0 A2 .... AN A3 A4 ... AN .... AN 1 (4 24) .................... vN 1 A1 A2 .... AN A2 A3 .... AN ... AN 1
5、关键组分 6、
e Na
1个 1
2个
4
FLGC
二、有利条件
吸收作用发生在相接触面之间,因此要提高 吸收效果,必须从增加吸收过程的推动力和相
接触表面积两方面入手。 增大相间接触表面,就是使气、液两相能进 行良好接触,应尽可能地将气、液两相分散。
当组分在气相中的浓度 yi 大于与液 相成平衡的气相浓度y*时,则该组分便 可由气相转入液相,达到吸收的目的。 这时 y-y* 即是吸收过程的推动力。 增大推动力对吸收过程有利。 如何增加推动力?
FLGC
第四章
吸收过程
概述及图解法多组分
4-1 吸收的用途及分类
一、吸收过程分类 二、吸收过程应用 4-2 吸收的特点及有利条件 一、吸收的特点 二、吸收的有利条件 4-3 图解法多组分吸收计算
吸收计算
FLGC
4.1 概述 吸收的用途及分类
吸收是化工生产中分离气体混合物的重要方法之一。 吸收:它是根据气体混合物中各组分在液体中溶解度 的不同,而达到分离目的的传质过程。 吸收时所用的液体溶剂称为吸收剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
p Ex
溶解度 注意
E — 亨利系数,kPa
亨利系数
E小 E大
~
易溶气体 难溶气体
一、亨利定律的表达式
2. p ~ c关系 若溶质在气、液相中的组成分别以分压p、摩 尔浓度 c 表示,亨利定律为
c p* H — 溶解度系数,kmol/(m3· kPa) H
溶解度 注意
~ 溶解度系数
一、吸收的相际传质过程
吸收过程:溶质 A 从气相传递到液相的过程 ① 组分 A 从气相主体扩 散到相界面; ② 在相界面上组分 A 由 气相转入液相; ③ 组分 A 由相界面转入 液相主体。
吸 收 通 量
相际传质过程
二、吸收过程的传质机理模型
描述吸收过 程的传质机理模 型—双膜模型。
双膜模型示意图
吸 收 塔
气体混合物
形成两相体系的方法 引入一液相(吸收剂) 传质原理 各组分在吸收剂中溶 解度不同。
原料气 A+B
溶液 S+A
二、气体吸收的流程
气体吸收过程在吸收塔中进行。 吸收过程 逆流操作 并流操作
吸收过程:溶质溶解于吸收剂中 解吸过程:溶质从溶液中释放出 吸收
解吸
具有吸收剂再生的连续吸收流程
第二章 气体吸收
2.1 吸收过程概述 2.1.1 吸收的原理与流程 2.1.2 气体吸收的分类与应用
一、气体吸收的分类
气体吸收过程的分类方法
按被吸收 组分数目 按吸收有 无化反
按溶质组 成的高低 按吸收的 温度变化
单组分吸收 物理吸收
多组分吸收 化学吸收 √
低组成吸收 高组成吸收 等温吸收
√
气体 吸收
推导可得亨利定律表达式各系数间的关系如下:
E~H 关系 E~m 关系 H~m 关系
H EM S
E m P
溶液 密度 溶剂 S 的摩尔 质量
1 H PM S m
第二章 气体吸收
2.1 吸收过程概述 2.2 吸收过程的相平衡关系 2.2.1 气体在液体中的溶解度 2.2.2 亨利定律
2.2.3 相平衡关系在吸收中的应用
加压和降温 减压和升温
有利于 吸 收操作 有利于 解吸操 作
第二章 气体吸收
2.1 吸收过程概述 2.2 吸收过程的相平衡关系 2.2.1 气体在液体中的溶解度 2.2.2 亨利定律
一、亨利定律的表达式
1. p ~ x关系
若溶质在气、液相中的组成分别以分压p、摩 尔分数x表示,亨利定律为
第二章 气体吸收
2.1 吸收过程概述 2.1.1 吸收的原理与流程 2.1.2 气体吸收的分类与应用 2.1.3 吸收剂的选择
吸收剂的选择
吸收剂选择的原则
溶解度 吸收剂对溶质组分的溶解度要大。 选择性 吸收剂应对溶质组分有较大溶解度,而
对混合气体中的其它组分溶解度甚微。
挥发度 吸收剂的蒸汽压要低,即挥发度要小。
Y y 1 Y
Y* X m 1 Y * 1 X
整理得
简化得
mX Y* 1 1 mX
对于低组成吸收
Y * mX
1 m X 1
一、亨利定律的表达式
亨利定律表达式可改写为以下形式:
p x* E c* Hp y x* m
Y X* m
二、各系数间的关系
气体(A+B)
A 溶解 A 逸出
xA
液体 S
气体在液体 中的溶解度
p A
p A f (xA )
pA
平衡方程 溶解度曲线
~ x A曲线
易溶
400
50
氨在水中的溶解度
中等溶解度
68
50
二氧化硫在水中的溶解度
难溶
0.002
50
氧在水中的溶解度
二、温度、压力对溶解度的影响
温度的影响 对同一溶质,在相同的气相分压下,溶解度 随温度的升高而减小。 压力的影响 对同一溶质,在相同的温度下,溶解度随气 相分压的升高而增大。 注意
以液相示的传质 推动力
y*
x x * x
x x * x
x*
吸收推动力示意图
三、指明传质进行的极限
对于逆流吸收塔 Y2 X2
气相出口最低组成
Y2 min Y2* mX 2
液相出口最大组成
X 1max
* X1
Y1 m
Y1
X1
第二章 气体吸收
2.1 吸收过程概述 2.2 吸收过程的相平衡关系 2.3 吸收过程的速率关系 2.3.1 吸收过程的机理
第二章 气体吸收
学习目的 与要求
通过本章的学习,应掌握吸收的基本概念和 吸收过程的平衡关系与速率关系;掌握低组成气 体吸收的计算方法;了解吸收系数的获取途径和 解吸过程的概念与计算方法。
第二章 气体吸收
2.1 吸收过程概述 2.1.1 吸收的原理与流程
一、气体吸收的原理
分离物系
尾气 B(含微量A) 吸收剂 S
第二章 气体吸收
2.1 吸收过程概述 2.2 吸收过程的相平衡关系 2.3 吸收过程的速率关系 2.3.1 吸收过程的机理 2.3.2 吸收速率方程式
一、膜吸收速率方程式
1.气膜吸收速率方程式
N A k G ( p pi )
p pi NA 1 / kG
N A k y y yi
比较得
k x Ck L
练 习 题 目
思考题
1.温度和压力对吸收过程的平衡关系有何影响?
2.亨利定律为何具有不同的表达形式 ?
3.亨利定律的适用条件是什么 ?
4.相平衡关系在吸收过程中有何作用? 作业题: 1、2、3
粘度
其它
吸收剂在操作温度下的粘度要低。 无毒、无腐蚀、不易燃易爆、不发泡、冰 点低、价廉易得,且化学性质稳定。
第二章 气体吸收
2.1 吸收过程概述 2.2 吸收过程的相平衡关系 2.2.1 气体在液体中的溶解度
一、溶解度曲线
在一定温度和压力下,令 某气体混合物(A+B)与液体 S 接触。 达平衡状态时 液相组成 气相分压
N A k L (ci c)
ci c NA 1/ k L
N A k x xi x
xi x NA 1/ k x
液膜阻力
1/ k L 1/ k x
一、膜吸收速率方程式
由
c Cx
ci Cxi
N A kL (ci c) kL (Cxi Cx) kLC( xi x)
√
非等温吸收
√
二、气体吸收的工业应用
气体吸收的应用场合 净化或精制气体 示例:合成氨工艺中合成气中的净化脱碳。 制取某种气体的液态产品 示例:用水吸收氯化氢气体制取盐酸。 回收混合气体中所需的组分 示例:用洗油处理焦炉气以回收芳烃。
工业废气的治理
示例:废气中含有SO2、H2S等有害气的脱除。
y yi NA 1/ k y
气膜阻力
1 / kG
1/ k y
一、膜吸收速率方程式
由道尔顿分压定律
p Py
pi Pyi
N A kG ( p pi ) kG ( Py Pyi ) kG P( y yi )
比较得
k y Pk G
一、膜吸收速率方程式
2.液膜吸收速率方程式
H大 H小
易溶气体 难溶气体
一、亨利定律的表达式
3. y ~ x关系 若溶质在气、液相中的组成分别以摩尔分数 y、x表示 ,亨利定律为
y* mx
溶解度 注意
m — 相平衡常数
相平衡常数
m小 m大
~
易溶气体 难溶气体
一、亨利定律的表达式
4. Y ~ X关系
X x 1 X
由
得
一、判断传质进行的方向
设某瞬时,气相中溶质的实际组成为y,溶液 中溶质的实际组成为x。 若
y y*
x x*
若
传质方向由气相到液相 进行吸收过程
传质方向由液相到气相 进行解吸过程
y y*
x x*
二、确定传质的推动力
以气相表示的传质 推动力
y*=mx
y y y *
y y y *
