东莞备战高考化学知识点过关培优 易错 难题训练∶氯及其化合物
高考化学氯及其化合物的综合热点考点难点含详细答案

高考化学氯及其化合物的综合热点考点难点含详细答案一、高中化学氯及其化合物1.氯气是一种重要的化工原料,氯气及其化合物在自来水的消毒、农药的生产、药物的合成都有着重要的应用。
(1)NaClO中Cl的化合价为____,有较强的___(填氧化、还原)性。
(2)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,SO2被氧化为SO42-,此反应的离子方程式为____。
②ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为____。
【答案】+1 氧化 2ClO3-+SO2=2ClO2+SO42- 2:5【解析】【分析】(1)根据化合物中正负化合价的代数和为0;根据次氯酸盐中Cl的化合价分析判断;(2)①KClO3与SO2在强酸性溶液中反应生成ClO2、硫酸根离子;②根据得失电子守恒计算。
【详解】(1)NaClO中Na为+1价,O为-2价,化合物中总化合价为0,则Cl为+1价;次氯酸盐中+1价的氯元素易得到电子,具有较强氧化性,故答案为:+1;氧化;(2)①KClO3与SO2在强酸性溶液中反应可制得ClO2,根据氧化还原反应的规律,同时应生成硫酸钾,反应的离子方程式为:2ClO3-+SO2=2ClO2+SO42-,故答案为:2ClO3-+SO2=2ClO2+SO42-;②ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,反应中ClO2为氧化剂,Cl 元素化合价由+4价降低为-1价,Mn2+为还原剂,元素化合价由+2价升高到+4价,氧化剂和还原剂得失电子数目相等,则氧化剂和还原剂的物质的量之比为2∶5,故答案为:2∶5。
【点睛】本题的易错点为(2)②,要注意氧化还原反应的计算的一般方法的应用,解答本小题,也可以书写出反应的方程式再分析计算。
2.现有A、B、C、D四种气体,A是密度最小的气体,B在通常情况下呈黄绿色,把四种气体分别通入酸化的硝酸银溶液中,通入B、D气体时立即出现白色沉淀,纯净的A可以在B中安静地燃烧,发出苍白色的火焰并生成D。
(完整版)氯及其化合物知识点

氯及其化合物一、氯元素的原子结构与自然界的存在氯元素位于周期表__周期__族,在自然界中的主要存在形:。
二、活泼的氯气1、氯气的物理性质:色有气味的体,毒,溶于水.2、氯气的化学性质① 与金属单质的反应:与钠反应方程式。
现象是。
与铁反应方程式。
现象是 .与铜反应方程式 .现象是。
② 与氢气的反应:化学方程式:,反应现象:氢气在氯气中燃烧 ;氯气与氢气的爆炸实验 .思考:在初中我们是如何定义燃烧的?现在通过氢气与氯气的燃烧实验,你有什么新的认识?③与水的反应:与水反应的离子方程式:,说明:氯气与水反应很微弱,且未可逆反应.思考:氯水的成分及性质?氯水的保存方法?④次氯酸的性质:a、一元弱酸(比弱)b、强氧化性(应用:)c、不稳定(见光或受热分解):化学方程式: 。
⑤与碱的反应Cl2 + _NaOH - 。
(常用于除去多余氯气)离子方程式: 。
漂白液主要成分是 .漂白粉的制法: 。
其主要成分: ,有效成分: 。
漂白原理:ClO-+ H+ = HClO(实际漂白者),Ca(ClO)2 +_HCl(稀)= 。
Ca(ClO)2 +CO2 +H2O = 。
思考:抗洪救灾中防疫部门,向灾民发放的漂白粉片或漂粉精用于饮用水消毒。
漂粉精为何要密封保存在阴暗处?(一)卤素的原子结构共同点:原子的最外层均为个电子,都易个电子而表Array现性;不同点:核电荷数逐渐;电子层数逐渐 ;原子半径依次,得电子能力逐渐;单质氧化性逐渐。
(二)单质的物理性质:随卤素核电荷数增加,其原子结构递变而使卤素单质的物理性质呈规律性变化。
从F2 →I21、颜色逐渐,状态从→→。
2、单质的溶解性——除氟外(与水剧烈反应)在水中溶解度都较,都易溶于有机溶剂,右表列出Cl2、Br2、I2在不同溶剂中的颜色。
(三)卤素单质的化学性质(相似性及递变性)由于最外层均为个电子,极易电子,因此卤素都是剂,在自然界均只以态存在。
但随着电子层数递增,原子半径渐 ,核对外层电子的引力渐,得电子能力渐,其氧化性逐渐,主要表现:。
精选高考化学易错题专题复习氯及其化合物

精选高考化学易错题专题复习氯及其化合物一、 高中化学氯及其化合物1.已知Cl 2在70℃的NaOH 水溶液中,能发生氧化还原反应后可生成NaClO 与NaClO 3现有63.9g Cl 2,将其通入到足量70℃的NaOH 水溶液中,反应完全后测得溶液中NaClO 与NaClO 3的物质的量比为4:1,并得到500mL 溶液。
(1)写出Cl 2在70℃的NaOH 水溶液中发生上述反应的化学方程式______。
(2)计算完全反应后溶液中NaClO 、NaClO 3物质的量浓度____、______。
【答案】9Cl 2+14NaOH=4NaClO+NaClO 3+9NaCl+7H 2O 0.8mol/L 0.2mol/L【解析】【分析】先通过氯元素化合价的对比判断NaClO 与NaClO 3是氧化产物,氯气得电子化合价降低的产物是还原产物,所以还原产物是氯化钠,根据氧化还原反应中得失电子数相等配平方程式,从而得出反应中被氧化的Cl 2与被还原的Cl 2的物质的量之比。
【详解】(1)该反应中NaClO 与NaClO 3是氧化产物,氯化钠是还原产物,反应完全后测得溶液中NaClO 与NaClO 3的物质的量比为4:1,根据氧化还原反应中得失电子数相等配平方程式,所以该方程式为:9Cl 2+14NaOH=4NaClO+NaClO 3+9NaCl+7H 2O ;(2)49.7g Cl 2的物质的量为63.9g 71g /mol=0.9mol ,根据反应9Cl 2+14NaOH=4NaClO+NaClO 3+9NaCl+7H 2O 可知,生成NaClO 与NaClO 3的物质的量分别为0.9mol 40.4mol 9⨯=、0.9mol 10.1mol 9⨯=,完全反应后溶液中NaClO 、NaClO 3物质的量浓度分别为0.4mol 0.8/0.5mol L L =、0.1mol 0.2/0.5mol L L=。
高考化学培优专题复习氯及其化合物练习题及答案

高考化学培优专题复习氯及其化合物练习题及答案一、高中化学氯及其化合物1.Cl2通人70℃的NaOH水溶液中,发生氧化—还原反应,反应完成后,测得溶液中NaClO与NaClO3的物质的量之比为4∶1,则:(1)配平溶液中所发生反应的化学方程式:____Cl2+______NaOH=____NaCl+____NaClO3+_____NaClO+____ ____(2)反应中的氧化产物为_________________。
(3)已知生成0.1mol NaClO,反应中转移的电子总数是__________ mol,若溶液的体积正好为100mL,则溶液中NaCl的物质的量浓度为________ mol/L。
【答案】7149147 NaClO 3 NaClO 0.225 2.25【解析】【分析】【详解】(1)据题设条件,先定NaClO、NaClO3的化学计量数为4、1,再利用化合价升降法:升高总数为4×1+1×5=9,降低总数为1,配平得7Cl2+14NaOH=9NaCl+NaClO3+4NaClO+7H2O;(2)分析反应得氧化剂、还原剂均为Cl2,Cl元素被氧化生成NaClO3与NaClO,氧化产物为NaClO3与NaClO;(3)由反应知每转移9mol电子,生成4molNaClO,则生成0.1molNaClO,反应中转移的电子总数是0.225mol,同时生成NaCl为0.225mol,若溶液的体积正好为0.1L,则溶液中NaCl 的物质的量浓度为2.25mol·L-1。
2.已知A是一种金属单质,B溶液能使酚酞试液变红,且焰色反应呈黄色;D、F相遇会产生白烟。
A、B、C、D、E、F间有如下变化关系:(1)写出A、B、C、E的化学式:A__________,B__________,C__________,E__________。
(2)写出E→F反应的化学方程式_________;写出B→D反应的化学方程式_________。
备战高考化学培优 易错 难题(含解析)之氯及其化合物含答案
备战高考化学培优 易错 难题(含解析)之氯及其化合物含答案一、 高中化学氯及其化合物1.已知Cl 2在70℃的NaOH 水溶液中,能发生氧化还原反应后可生成NaClO 与NaClO 3现有63.9g Cl 2,将其通入到足量70℃的NaOH 水溶液中,反应完全后测得溶液中NaClO 与NaClO 3的物质的量比为4:1,并得到500mL 溶液。
(1)写出Cl 2在70℃的NaOH 水溶液中发生上述反应的化学方程式______。
(2)计算完全反应后溶液中NaClO 、NaClO 3物质的量浓度____、______。
【答案】9Cl 2+14NaOH=4NaClO+NaClO 3+9NaCl+7H 2O 0.8mol/L 0.2mol/L【解析】【分析】先通过氯元素化合价的对比判断NaClO 与NaClO 3是氧化产物,氯气得电子化合价降低的产物是还原产物,所以还原产物是氯化钠,根据氧化还原反应中得失电子数相等配平方程式,从而得出反应中被氧化的Cl 2与被还原的Cl 2的物质的量之比。
【详解】(1)该反应中NaClO 与NaClO 3是氧化产物,氯化钠是还原产物,反应完全后测得溶液中NaClO 与NaClO 3的物质的量比为4:1,根据氧化还原反应中得失电子数相等配平方程式,所以该方程式为:9Cl 2+14NaOH=4NaClO+NaClO 3+9NaCl+7H 2O ;(2)49.7g Cl 2的物质的量为63.9g 71g /mol =0.9mol ,根据反应9Cl 2+14NaOH=4NaClO+NaClO 3+9NaCl+7H 2O 可知,生成NaClO 与NaClO 3的物质的量分别为0.9mol 40.4mol 9⨯=、0.9mol 10.1mol 9⨯=,完全反应后溶液中NaClO 、NaClO 3物质的量浓度分别为0.4mol 0.8/0.5mol L L =、0.1mol 0.2/0.5mol L L=。
2020-2021备战高考化学复习《氯及其化合物》专项综合练习含详细答案

2020-2021备战高考化学复习《氯及其化合物》专项综合练习含详细答案一、高中化学氯及其化合物CO-、Cl-中的一种或几种,为鉴别其中所含离子,现进1.某溶液中可能含有K+、Na+、23行如下实验:请回答下列问题:(1)原溶液中一定存在的离子是______(填离子符号,下同),一定不存在的离子是______________,可能存在的离子是__________________。
(2)为进一步确定原溶液中可能存在的离子是否存在,应进行的实验操作及判断依据是_________CO- K+ Cl-取原溶液,向溶液中加入硝酸银溶液,有白色沉淀生成,【答案】Na+和23再加入足量稀硝酸,若白色沉淀不消失,则原溶液中存在Cl-,若白色沉淀消失,则原溶液中不存在Cl-【解析】【分析】CO-能和盐酸反应生钠的焰色反应是黄色,钾的焰色反应(透过蓝色钴玻璃)是紫色;23成气体。
检验Cl-的试剂是稀硝酸和硝酸银溶液。
【详解】(1)根据焰色反应显黄色、透过蓝色钴玻璃无紫色,说明含有Na+、无K+;加入盐酸有气体产生,说明存在CO32-,但不能确定是否有Cl-;则原溶液中一定存在Na+和CO32-,一定不存在K+,可能存在的是Cl-。
(2)要检验是否存在Cl-选用AgNO3溶液和稀HNO3,所进行的操作和判断的依据为:取原溶液,向溶液中加入硝酸银溶液,有白色沉淀生成,再加入足量稀硝酸,若白色沉淀不消失,则原溶液中存在Cl-,若白色沉淀消失,则原溶液中不存在Cl-。
2.室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可按下面框图进行反应。
又知D溶液为黄色,E溶液为无色,请回答:(1)A是__________,B是__________,C是_______________(填写化学式)。
(2)反应①的化学方程式为_______________________________。
(3)反应③的化学方程式为________________________________________。
高考化学知识点过关培优训练∶氯及其化合物含答案

高考化学知识点过关培优训练∶氯及其化合物含答案一、 高中化学氯及其化合物1.一定量氢气在氯气中燃烧,所得混合物用1100mL3.00mol L NaOH -⋅溶液恰好完全吸收,测得溶液中含有NaClO 的物质的量为0.0500 mol 。
(1)所得混合物与NaOH 溶液反应的离子方程式______(2)所得溶液中NaCl 的物质的量为________。
(3)所用氯气和参加反应的氢气的物质的量之比()()22n Cl :n H =________。
【答案】2H OH H O -++=、22Cl 2OH Cl ClO H O ---+=++ 0.250 3:2【解析】【分析】由溶液中含有0.0500 mol 次氯酸钠可知,氢气在氯气中燃烧时,氯气过量,反应得到氯化氢和氯气的混合气体。
【详解】(1)氯化氢和氯气的混合气体被氢氧化钠溶液吸收时,氯化氢与氢氧化钠溶液发生中和反应生成氯化钠和水,氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为OH —+H += H 2O ,Cl 2+2OH —=Cl —+ClO —+H 2O ,故答案为:OH —+H += H 2O ,Cl 2+2OH —=Cl—+ClO —+H 2O ;(2)根据溶液电中性原则可知:n (Na +)=n (Cl -)+n (ClO -),n (Cl -)=n (Na +)-n (ClO -)=0.1L ×3.00mol/L-0.0500mol=0.250mol ,则所得溶液中NaCl 的物质的量为0.250mol ,故答案为:0.250;(3)根据Cl 原子守恒可知,n (Cl 2)=12×n (NaOH )=0.15mol ,由氯气与氢氧化钠溶液反应的化学方程式可知,生成0.0500 mol 次氯酸钠消耗过量氯气0.0500 mol ,则与氢气反应的氯气为0.15mol-0.05mol=0.1mol ,氢气在氯气中燃烧的化学方程式为H 2+Cl 22HCl ,由化学方程式可知氢气的物质的量为0.1mol ,故氯气和参加反应的氢气的物质的量之比n (Cl 2):n (H 2)=0.15mol :0.1mol=3:2,故答案为:3:2。
备战高考化学知识点过关培优 易错 难题训练∶氯及其化合物附答案解析

备战高考化学知识点过关培优易错难题训练∶氯及其化合物附答案解析一、高中化学氯及其化合物1.KClO3和浓盐酸在不同温度下反应,发生以下两个反应。
其变化可表示为反应1:2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O反应2:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O(1)已知反应1的还原产物为黄绿色的二氧化氯,该反应中被还原的是_________(填化学式),产生0.1mol Cl2时,转移的电子的物质的量为_____。
(2)反应2中氧化产物和还原产物的物质的量之比是_____。
(3)上述反应中浓盐酸表现的性质是(填写编号):反应1中为_________,反应2中为_________。
①只有还原性②还原性和酸性③只有氧化性④氧化性和酸性(4)将少量氯气通入NaBr溶液中,发生反应的离子方程式是Cl2+2Br-=2Cl-+Br2。
将少量氯气通入FeBr2溶液中,发生反应的离子方程式是Cl2+2Fe2+=2Cl-+2Fe3+,将少量氯气通入FeI2溶液中,发生反应的离子方程式是Cl2+2I-=2Cl-+I2,这个事实说明上述反应中具有还原性粒子I-、Br-、Cl-、Fe2+的还原性由强到弱的顺序是________,标况下,将22.4LCl2通入2L0.5 mol/L的FeBr2溶液中,发生反应的离子方程式_____________标况下,将22.4LCl2通入2 L0.5mol/L的FeI2溶液中,发生反应的离子方程式_____________。
【答案】KClO3 0.2mol 5:1 ②② I->Fe2+>Br->Cl- 2Cl2+2Fe2++2Br-=2Fe3++4Cl-+Br2 Cl2+2I-=2Cl-+I2【解析】【分析】(1)同一元素的物质发生氧化还原反应时遵循:高高低低规律。
(2)同一元素的物质发生氧化还原反应时,产物中元素的化合价规律是:可相聚,不相交。
备战高考化学培优 易错 难题(含解析)之氯及其化合物

备战高考化学培优易错难题(含解析)之氯及其化合物一、高中化学氯及其化合物1.肼(N2H4)作为火箭发动机的燃料,可通过反应NaClO+ 2NH3 = N2H4 + NaCl+ H2O制取。
某化学兴趣小组尝试在实验室制取N2H4,设计了如下实验:(1)制备NaClO溶液,装置如图所示。
(已知:3Cl2 + 6NaOH Δ5NaCl+ NaClO3 + 3H2O)①仪器A的名称是________________。
②连接好装置,装药品之前,必须进行的一项操作是_________。
③圆底烧瓶内发生反应的化学方程式为_______________;当生成71g氯气时,被氧化的HCl为_________mol。
试管内发生反应的离子方程式为_________。
④饱和食盐水的作用是_____________,冰水的作用是____________。
(2)将NaClO溶液倒入烧杯中,持续通入NH3制取N2H4。
制取氨气的化学方程式为_______。
(3)火箭发射时用N2H4作燃料,用N2O4助燃,燃烧生成两种可参与大气循环的物质。
写出该反应的化学方程式______________。
【答案】分液漏斗检查装置的气密性 MnO2 + 4HCl(浓)ΔMnCl2 + Cl2↑+ 2H2O 2 Cl2 +2OH-= Cl-+ ClO-+ H2O 除去Cl2中的HCl气体防止溶液温度过高发生副反应 2NH4Cl+Ca(OH)2ΔCaCl2 + 2NH3↑+ 2H2O 2N2H4 + N2O4点燃3N2 + 4H2O【解析】【分析】(1) ①根据仪器的构造判断;②检查装置的气密性,以防止漏气;③该装置是用来制备氯气的,MnO2 与浓盐酸反应生成MnCl2 、 Cl2和H2O;试管内氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;④饱和食盐水的作用是除去Cl2中的HCl气体,冰水的作用是防止溶液温度过高发生副反应;(2) 实验室利用加热氯化铵和氢氧化钙混合固体制取氨气;(3)火箭发射时用N2H4作燃料,用N2O4助燃,燃烧生成两种可参与大气循环的物质氮气和水蒸气。
精选高考化学易错题专题复习氯及其化合物含答案解析

精选高考化学易错题专题复习氯及其化合物含答案解析一、高中化学氯及其化合物1.(1)室温时,在下列物质中:①Na ②Cl2 ③Na2O ④FeCl2溶液⑤NaHCO3 ⑥蔗糖⑦NH3 ⑧NaCl晶体⑨HClO ⑩Fe(OH)2属于碱性氧化物的是(用序号填写,下同) _______,属于酸的是_____,属于强电解质的是______,属于非电解质的是_______,能导电的是________。
(2)Na2O2与CO2的反应化学方程式__________;(3)向硫酸氢钠溶液中逐滴加入氢氧化钡溶液到中性,请写出发生反应的离子方程式______。
(4)制取漂白粉的反应化学方程式_________;其有效成分是_______;【答案】③⑨③⑤⑧⑥⑦①④ 2Na2O2+2CO2=2Na2CO3+O2 2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O Ca(ClO)2【解析】【分析】(1)碱性氧化物:能与酸反应只生成一种盐和水,主要包括绝大多数金属氧化物;酸:电离时产生的阳离子全部都是氢离子的化合物;强电解质:在水溶液中或熔融状态下能发生完全电离的化合物;非电解质:在水溶液中或熔融状态下不发生电离的化合物;能导电的物质有大多数金属单质或存在有自由移动电荷的物质;根据物质特点结合定义解答;(3)向硫酸氢钠溶液中逐滴加入氢氧化钡溶液到中性,除生成水,还应该生成Na2SO4和BaSO4沉淀;(4)漂白粉的有效成分为次氯酸钙,利用氯气和冷的消石灰反应制取漂白粉。
【详解】(1)Na2O能够与酸反应生成盐和水,属于碱性氧化物;HClO电离产生的阳离子都是氢离子,属于酸; Na2O、NaHCO3、NaCl晶体在水溶液或者熔融状态下能完全电离而导电,都是化合物,都属于强电解质;蔗糖、NH3,本身不能电离产生自由移动的离子,是化合物,都属于非电解质;钠含有自由电子,氯化亚铁溶液含有自由移动的离子,都能导电;故属于碱性氧化物的是③;属于酸的是⑨;属于强电解质的是③⑤⑧;属于非电解质的是⑥⑦;能导电的是①④;(2)Na2O2与CO2的反应生成碳酸钠和氧气,发生反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2;(3)向硫酸氢钠溶液中逐滴加入氢氧化钡溶液到中性,除生成水,还应该生成Na2SO4和BaSO4沉淀,则发生反应的离子方程式为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;(4)工业上利用氯气和冷的消石灰反应制取漂白粉,发生反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,其有效成分是Ca(ClO)2。
冲刺必备最新高考化学不可不知的大考点 考点 氯及其化合物

考点31氯及其化合物1.知道氯气的物理性质。
2.了解氯气及其化合物的性质3.知道氯水的消毒和漂白原理4.学会Cl—的检验方法5.理解卤族元素原子结构及其单质性质的递变性一、氯元素的原子结构与自然界的存在氯元素位于周期表__周期__族,在自然界中的主要存在形态:。
全球海洋中含盐左右,主要为、。
二、活泼的氯气1、氯气的物理性质:色有气味的体,毒,溶于水。
实验室中应怎样闻气体:。
2、氯气的化学性质由氯的原子结构示意图可知氯元素的性质如何?进而能否预测氯气的化学性质又怎样?为什么?。
1与金属单质的反应:与钠反应方程式。
现象是。
与铁反应方程式。
现象是。
与铜反应方程式。
现象是。
2与氢气的反应:化学方程式:,反应现象:氢气在氯气中燃烧;氯气与氢气的爆炸实验。
3Cl2和红磷反应:化学方程式:,反应现象。
结论:分析以上反应中氯元素价态的变化也可得知:氯气是一种强氧化性物质,常氧化剂。
思考:在初中我们是如何定义燃烧的?现在通过氢气与氯气的燃烧实验,你有什么新的认识?4与水的反应:与水反应的离子方程式:,说明:氯气与水反应很微弱,且未可逆反应。
思考:1、氯水的成分?(氯水参加反应时,能表现多种性质)2、氯水的保存方法?5次氯酸的性质:a、一元弱酸(比弱)b、强氧化性(、、)c、不稳定(见光或受热分解):化学方程式:。
⑥与碱的反应Cl2+ _NaOH ——。
(常用于除去多余氯气)离子方程式:。
漂白液主要成分是。
漂白粉的制法:。
其主要成分:,有效成分:。
漂粉精的有效成分:。
漂白原理:ClO—+ H+= HClO(实际漂白者),Ca(ClO)2+_HCl(稀)= 。
Ca(ClO)2+CO2+H2O = 。
思考:抗洪救灾中防疫部门,向灾民发放的漂白粉片或漂粉精用于饮用水消毒。
漂粉精为何要密封保存在阴暗处?三、氯离子的检验1、填写下列表格:2、原理:被检液中滴入少量酸化,再滴入溶液,若产生,则可断定溶液中含有氯离子。
不可用盐酸酸化,酸化目的是防止(、、、)影响。
备战高考化学专题《氯及其化合物》综合检测试卷附答案

备战高考化学专题《氯及其化合物》综合检测试卷附答案一、 高中化学氯及其化合物1.已知Cl 2在70℃的NaOH 水溶液中,能发生氧化还原反应后可生成NaClO 与NaClO 3现有63.9g Cl 2,将其通入到足量70℃的NaOH 水溶液中,反应完全后测得溶液中NaClO 与NaClO 3的物质的量比为4:1,并得到500mL 溶液。
(1)写出Cl 2在70℃的NaOH 水溶液中发生上述反应的化学方程式______。
(2)计算完全反应后溶液中NaClO 、NaClO 3物质的量浓度____、______。
【答案】9Cl 2+14NaOH=4NaClO+NaClO 3+9NaCl+7H 2O 0.8mol/L 0.2mol/L【解析】【分析】先通过氯元素化合价的对比判断NaClO 与NaClO 3是氧化产物,氯气得电子化合价降低的产物是还原产物,所以还原产物是氯化钠,根据氧化还原反应中得失电子数相等配平方程式,从而得出反应中被氧化的Cl 2与被还原的Cl 2的物质的量之比。
【详解】(1)该反应中NaClO 与NaClO 3是氧化产物,氯化钠是还原产物,反应完全后测得溶液中NaClO 与NaClO 3的物质的量比为4:1,根据氧化还原反应中得失电子数相等配平方程式,所以该方程式为:9Cl 2+14NaOH=4NaClO+NaClO 3+9NaCl+7H 2O ;(2)49.7g Cl 2的物质的量为63.9g 71g /mol =0.9mol ,根据反应9Cl 2+14NaOH=4NaClO+NaClO 3+9NaCl+7H 2O 可知,生成NaClO 与NaClO 3的物质的量分别为0.9mol 40.4mol 9⨯=、0.9mol 10.1mol 9⨯=,完全反应后溶液中NaClO 、NaClO 3物质的量浓度分别为0.4mol 0.8/0.5mol L L =、0.1mol 0.2/0.5mol L L=。
精选高考化学易错题专题复习氯及其化合物含详细答案

精选高考化学易错题专题复习氯及其化合物含详细答案一、高中化学氯及其化合物1.(1)室温时,在下列物质中:①Na ②Cl2 ③Na2O ④FeCl2溶液⑤NaHCO3 ⑥蔗糖⑦NH3 ⑧NaCl晶体⑨HClO ⑩Fe(OH)2属于碱性氧化物的是(用序号填写,下同) _______,属于酸的是_____,属于强电解质的是______,属于非电解质的是_______,能导电的是________。
(2)Na2O2与CO2的反应化学方程式__________;(3)向硫酸氢钠溶液中逐滴加入氢氧化钡溶液到中性,请写出发生反应的离子方程式______。
(4)制取漂白粉的反应化学方程式_________;其有效成分是_______;【答案】③⑨③⑤⑧⑥⑦①④ 2Na2O2+2CO2=2Na2CO3+O2 2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O Ca(ClO)2【解析】【分析】(1)碱性氧化物:能与酸反应只生成一种盐和水,主要包括绝大多数金属氧化物;酸:电离时产生的阳离子全部都是氢离子的化合物;强电解质:在水溶液中或熔融状态下能发生完全电离的化合物;非电解质:在水溶液中或熔融状态下不发生电离的化合物;能导电的物质有大多数金属单质或存在有自由移动电荷的物质;根据物质特点结合定义解答;(3)向硫酸氢钠溶液中逐滴加入氢氧化钡溶液到中性,除生成水,还应该生成Na2SO4和BaSO4沉淀;(4)漂白粉的有效成分为次氯酸钙,利用氯气和冷的消石灰反应制取漂白粉。
【详解】(1)Na2O能够与酸反应生成盐和水,属于碱性氧化物;HClO电离产生的阳离子都是氢离子,属于酸; Na2O、NaHCO3、NaCl晶体在水溶液或者熔融状态下能完全电离而导电,都是化合物,都属于强电解质;蔗糖、NH3,本身不能电离产生自由移动的离子,是化合物,都属于非电解质;钠含有自由电子,氯化亚铁溶液含有自由移动的离子,都能导电;故属于碱性氧化物的是③;属于酸的是⑨;属于强电解质的是③⑤⑧;属于非电解质的是⑥⑦;能导电的是①④;(2)Na2O2与CO2的反应生成碳酸钠和氧气,发生反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2;(3)向硫酸氢钠溶液中逐滴加入氢氧化钡溶液到中性,除生成水,还应该生成Na2SO4和BaSO4沉淀,则发生反应的离子方程式为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;(4)工业上利用氯气和冷的消石灰反应制取漂白粉,发生反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,其有效成分是Ca(ClO)2。
2020-2021【化学】化学 氯及其化合物的专项 培优 易错 难题练习题附答案

2020-2021【化学】化学氯及其化合物的专项培优易错难题练习题附答案一、高中化学氯及其化合物1.通常用的漂白粉是次氯酸钙,氯化钙和氢氧化钙所组成的水合复盐,是由Cl2与消石灰制成的。
有关反应如下:2Cl2+3Ca(OH)2→Ca(ClO)2·CaCl2·Ca(OH)2·H2O+H2O(1)漂白粉的有效成分是_____________________;(2)上述反应中,化合价有变化的元素是 _________ ;(3)漂白粉在潮湿的空气中放置会慢慢失效,有关反应方程式为 _______,_______。
光照2HCl+O2↑【答案】Ca(ClO)2 Cl Ca(ClO)2+2H2O+2CO2 →Ca(HCO3)2+2HClO 2HClO−−−→【解析】【分析】【详解】(1)漂白粉是由Cl2与消石灰反应2Cl2+3Ca(OH)2=Ca(ClO)2·CaCl2·Ca(OH)2·H2O+H2O制成的,其组成是次氯酸钙,氯化钙和氢氧化钙所组成的水合复盐,其有效成分是Ca(ClO)2;(2)由Cl2与消石灰反应2Cl2+3Ca(OH)2=Ca(ClO)2·CaCl2·Ca(OH)2·H2O+H2O中,化合价有变化的元素是Cl2中的Cl由0价变成Ca(ClO)2中+1价,CaCl2中的-1价,所以化合价有变化的元素是Cl;(3)漂白粉在潮湿的空气中放置会慢慢失效,是因为Ca(ClO)2与空气中的水蒸气和二氧化碳反应,生成了HClO又分解了,所以反应的方程式为光照2HCl+O2↑。
Ca(ClO)2+2H2O+2CO2→Ca(HCO3)2+2HClO;2HClO−−−→2.KClO3和浓盐酸在不同温度下反应,发生以下两个反应。
其变化可表示为反应1:2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O反应2:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O(1)已知反应1的还原产物为黄绿色的二氧化氯,该反应中被还原的是_________(填化学式),产生0.1mol Cl2时,转移的电子的物质的量为_____。
高考化学复习氯及其化合物专项易错题及详细答案

高考化学复习氯及其化合物专项易错题及详细答案一、高中化学氯及其化合物1.通常用的漂白粉是次氯酸钙,氯化钙和氢氧化钙所组成的水合复盐,是由Cl2与消石灰制成的。
有关反应如下:2Cl2+3Ca(OH)2→Ca(ClO)2·CaCl2·Ca(OH)2·H2O+H2O(1)漂白粉的有效成分是_____________________;(2)上述反应中,化合价有变化的元素是 _________ ;(3)漂白粉在潮湿的空气中放置会慢慢失效,有关反应方程式为 _______,_______。
光照2HCl+O2↑【答案】Ca(ClO)2 Cl Ca(ClO)2+2H2O+2CO2 →Ca(HCO3)2+2HClO 2HClO−−−→【解析】【分析】【详解】(1)漂白粉是由Cl2与消石灰反应2Cl2+3Ca(OH)2=Ca(ClO)2·CaCl2·Ca(OH)2·H2O+H2O制成的,其组成是次氯酸钙,氯化钙和氢氧化钙所组成的水合复盐,其有效成分是Ca(ClO)2;(2)由Cl2与消石灰反应2Cl2+3Ca(OH)2=Ca(ClO)2·CaCl2·Ca(OH)2·H2O+H2O中,化合价有变化的元素是Cl2中的Cl由0价变成Ca(ClO)2中+1价,CaCl2中的-1价,所以化合价有变化的元素是Cl;(3)漂白粉在潮湿的空气中放置会慢慢失效,是因为Ca(ClO)2与空气中的水蒸气和二氧化碳反应,生成了HClO又分解了,所以反应的方程式为光照2HCl+O2↑。
Ca(ClO)2+2H2O+2CO2→Ca(HCO3)2+2HClO;2HClO−−−→2.氯及其化合物在工农业生产和人类生活中有着重要的作用。
回答下列问题:(1)25℃时将氯气溶于水形成“氯气-氯水”体系,该体系存在多个含氯元素的平衡关系,其中之一为:Cl2(溶液)+H2O HClO+H++Cl-,体系中Cl2(溶液)、HClO和ClO-三者的物质的量分数(α)随pH(酸碱度)变化的关系如图所示。
2020-2021备战高考化学知识点过关培优 易错 难题训练∶氯及其化合物

2020-2021备战高考化学知识点过关培优 易错 难题训练∶氯及其化合物一、 高中化学氯及其化合物1.通常用的漂白粉是次氯酸钙,氯化钙和氢氧化钙所组成的水合复盐,是由Cl 2与消石灰制成的。
有关反应如下:2Cl 2+3Ca(OH)2→Ca(ClO)2·CaCl 2·Ca(OH)2·H 2O+H 2O (1)漂白粉的有效成分是_____________________;(2)上述反应中,化合价有变化的元素是 _________ ;(3)漂白粉在潮湿的空气中放置会慢慢失效,有关反应方程式为 _______,_______。
【答案】Ca(ClO)2 Cl Ca(ClO)2+2H 2O+2CO 2 →Ca (HCO 3)2+2HClO 2HClO −−−→光照2HCl+O 2↑【解析】【分析】【详解】(1)漂白粉是由Cl 2与消石灰反应2Cl 2+3Ca(OH)2=Ca(ClO)2·CaCl 2·Ca(OH)2·H 2O+H 2O 制成的,其组成是次氯酸钙,氯化钙和氢氧化钙所组成的水合复盐,其有效成分是Ca(ClO)2;(2)由Cl 2与消石灰反应2Cl 2+3Ca(OH)2=Ca(ClO)2·CaCl 2·Ca(OH)2·H 2O+H 2O 中,化合价有变化的元素是Cl 2 中的Cl 由0价变成Ca(ClO)2 中+1价,CaCl 2 中的-1价,所以化合价有变化的元素是Cl ;(3)漂白粉在潮湿的空气中放置会慢慢失效,是因为Ca(ClO)2与空气中的水蒸气和二氧化碳反应,生成了HClO 又分解了,所以反应的方程式为Ca(ClO)2+2H 2O+2CO 2→Ca (HCO 3)2+2HClO ;2HClO −−−→光照2HCl+O 2↑。
2.(1)单质钠是一种______色的金属,密度比水______(大/小),钠在自然界中以______(化合/游离)态存在;金属钠与水反应的化学方程式:______,金属钠在空气中燃烧生成______色的______(化学式),其生成物与水反应的化学方程式:______。
高考化学氯及其化合物的综合热点考点难点及答案解析

高考化学氯及其化合物的综合热点考点难点及答案解析一、高中化学氯及其化合物1.Cl2通人70℃的NaOH水溶液中,发生氧化—还原反应,反应完成后,测得溶液中NaClO与NaClO3的物质的量之比为4∶1,则:(1)配平溶液中所发生反应的化学方程式:____Cl2+______NaOH=____NaCl+____NaClO3+_____NaClO+____ ____(2)反应中的氧化产物为_________________。
(3)已知生成0.1mol NaClO,反应中转移的电子总数是__________ mol,若溶液的体积正好为100mL,则溶液中NaCl的物质的量浓度为________ mol/L。
【答案】7149147 NaClO 3 NaClO 0.225 2.25【解析】【分析】【详解】(1)据题设条件,先定NaClO、NaClO3的化学计量数为4、1,再利用化合价升降法:升高总数为4×1+1×5=9,降低总数为1,配平得7Cl2+14NaOH=9NaCl+NaClO3+4NaClO+7H2O;(2)分析反应得氧化剂、还原剂均为Cl2,Cl元素被氧化生成NaClO3与NaClO,氧化产物为NaClO3与NaClO;(3)由反应知每转移9mol电子,生成4molNaClO,则生成0.1molNaClO,反应中转移的电子总数是0.225mol,同时生成NaCl为0.225mol,若溶液的体积正好为0.1L,则溶液中NaCl 的物质的量浓度为2.25mol·L-1。
2.氯及其化合物在工农业生产和人类生活中有着重要的作用。
回答下列问题:(1)25℃时将氯气溶于水形成“氯气-氯水”体系,该体系存在多个含氯元素的平衡关系,其中之一为:Cl2(溶液)+H2O HClO+H++Cl-,体系中Cl2(溶液)、HClO和ClO-三者的物质的量分数(α)随pH(酸碱度)变化的关系如图所示。
备战高考化学氯及其化合物综合题及答案
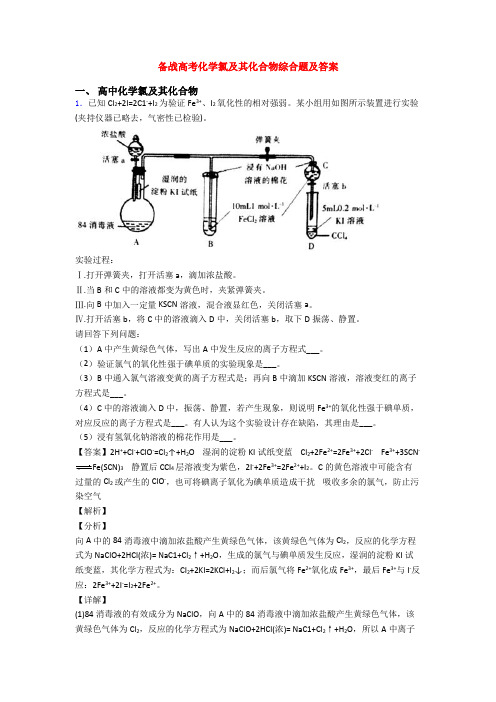
备战高考化学氯及其化合物综合题及答案一、高中化学氯及其化合物1.已知Cl2+2I=2C1-+I2为验证Fe3+、I2氧化性的相对强弱。
某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验过程:Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.向B中加入一定量KSCN溶液,混合液显红色,关闭活塞a。
Ⅳ.打开活塞b,将C中的溶液滴入D中,关闭活塞b,取下D振荡、静置。
请回答下列问题:(1)A中产生黄绿色气体,写出A中发生反应的离子方程式___。
(2)验证氯气的氧化性强于碘单质的实验现象是___。
(3)B中通入氯气溶液变黄的离子方程式是;再向B中滴加KSCN溶液,溶液变红的离子方程式是___。
(4)C中的溶液滴入D中,振荡、静置,若产生现象,则说明Fe3+的氧化性强于碘单质,对应反应的离子方程式是___。
有人认为这个实验设计存在缺陷,其理由是___。
(5)浸有氢氧化钠溶液的棉花作用是___。
【答案】2H++Cl-+ClO-=Cl2↑+H2O 湿润的淀粉KI试纸变蓝 Cl2+2Fe2+=2Fe3++2Cl- Fe3++3SCN-Fe(SCN)3静置后CCl4层溶液变为紫色,2I-+2Fe3+=2Fe2++I2。
C的黄色溶液中可能含有过量的Cl2或产生的ClO-,也可将碘离子氧化为碘单质造成干扰吸收多余的氯气,防止污染空气【解析】【分析】向A中的84消毒液中滴加浓盐酸产生黄绿色气体,该黄绿色气体为Cl2,反应的化学方程式为NaClO+2HCl(浓)= NaC1+Cl2↑+H2O,生成的氯气与碘单质发生反应,湿润的淀粉KI试纸变蓝,其化学方程式为:CI2+2KI=2KCl+I2↓;而后氯气将Fe2+氧化成Fe3+,最后Fe3+与I-反应:2Fe3++2I-=I2+2Fe2+。
【详解】(1)84消毒液的有效成分为NaClO,向A中的84消毒液中滴加浓盐酸产生黄绿色气体,该黄绿色气体为Cl2,反应的化学方程式为NaClO+2HCl(浓)= NaC1+Cl2↑+H2O,所以A中离子方程式为:2H++Cl-+ClO-=Cl2↑+H2O;(2)根据装置图中的试剂,验证氯气的氧化性强于碘单质的实验现象是:湿润的淀粉KI试纸变蓝,发生反应的化学方程式为:CI2+2KI=2KCl+I2↓;(3)B中的溶液变为黄色,B中反应为Cl2将Fe2+氧化成Fe3+,B中发生反应的离子方程式为Cl2+2Fe2+=2Cl-+2Fe3+;再向B中滴加KSCN溶液,溶液变红的离子方程式是:Fe³⁺ + 3SCN⁻ =Fe(SCN)₃ (血红色);(4)将C中溶液滴入D中,关闭活塞b,取下D振荡,若产生现象:静置后CCl4层溶液变为紫色,则说明Fe3+的氧化性强于碘单质,反应的离子方程式为2Fe3++2I-=I2+2Fe2+;但C的黄色溶液中可能含有过量的Cl2或产生的ClO-,也可将碘离子氧化为碘单质造成干扰,此为实验设计存在缺陷,要验证Fe3+的氧化性强于I2必须排除Cl2的干扰;(5)由于Cl2有毒会污染大气,浸有NaOH溶液的棉花作用是:吸收氯气等有毒气体,防止污染空气,发生反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
东莞备战高考化学知识点过关培优易错难题训练∶氯及其化合物一、高中化学氯及其化合物1.高锰酸钾是一种典型的强氧化剂。
(1)在用 KMnO4酸性溶液处理固体 Cu2S 时,发生的反应如下:8MnO4-+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O①还原产物为_____。
②被氧化的元素是_____③氧化剂与还原剂的物质的量之比为_____④每生成 2.24 L(标况下)SO2,转移电子数目是_____(2)用 KMnO4酸性溶液处理固体 CuS 时,也可将 CuS 反应成 Cu2+和 SO2。
写出该离子反应方程式_____(3)15.8g KMnO4,加热分解后剩余固体 15.0 g。
该剩余固体与足量的浓盐酸在加热条件下充分反应,生成单质气体 A,产物中锰元素以 Mn2+存在,则气体 A 的物质的量为_____mol。
【答案】Mn2+ Cu、S 8:5 0.8N A 6MnO4-+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O 0.2【解析】【分析】(1)结合氧化还原反应的知识分析即可;(2)用 KMnO4酸性溶液处理固体 CuS 时,也可将 CuS 反应成 Cu2+和 SO2,同时得到还原产物Mn2+,结合电子守恒、电荷守恒和原子守恒写出发生反应的离子方程式;(3)15.8g KMnO4,加热分解后剩余固体 15.0 g,减少的质量为氧气的质量,在反应后的残留固体中加入足量的浓盐酸,继续加热,收集到气体为氯气,根据电子转移守恒,整个过程中,Mn元素获得电子等于O元素、Cl元素失去的电子,据此分析。
【详解】(1)在8MnO4-+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O中Mn元素从+7价降为+2价,发生还原反应,而Cu2S中Cu元素从+1价升高为+2价,S元素从-2价升高为+4价,发生氧化反应;①由分析知,还原产物为Mn2+;②被氧化的元素是Cu2S中Cu、S两元素;③氧化剂为KMnO4,还原剂为Cu2S,两者的物质的量之比为8:5;④Cu2S中Cu元素从+1价升高为+2价,S元素从-2价升高为+4价,则1molCu2S完全被氧化,转移8mol电子;2.24 L(标况下)SO2的物质的量为2.24?L22.4?L/mol=0.1mol,反应中转移电子的物质的量为0.8mol,电子数目是0.8N A;(2)用 KMnO4酸性溶液处理固体 CuS 时,也可将 CuS 反应成 Cu2+和 SO2,同时得到还原产物Mn2+,结合守恒法得发生反应的离子方程式为6MnO4-+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O;(3)15.8g KMnO4,加热分解后剩余固体 15.0 g,减少的质量为氧气的质量,m(O2)=15.8g-15.0g=0.8g,n(O2)=0.8g32g/mol=0.025mol;在反应后的残留固体中加入足量的浓盐酸,继续加热,收集到气体为氯气,根据电子转移守恒,整个过程中,Mn元素获得电子等于O元素、Cl元素获得的电子,则设氯气的物质的量为xmol,n(KMnO4)=15.8g158g/mol=0.1mol,电子转移守恒可得:0.1mol(7-2)=4n(O2)+2(Cl2),即0.1×(7-2)=4×0.025+2x,解得:x=0.2mol。
2.(1)室温时,在下列物质中:①Na ②Cl2 ③Na2O ④FeCl2溶液⑤NaHCO3 ⑥蔗糖⑦NH3 ⑧NaCl晶体⑨HClO ⑩Fe(OH)2属于碱性氧化物的是(用序号填写,下同) _______,属于酸的是_____,属于强电解质的是______,属于非电解质的是_______,能导电的是________。
(2)Na2O2与CO2的反应化学方程式__________;(3)向硫酸氢钠溶液中逐滴加入氢氧化钡溶液到中性,请写出发生反应的离子方程式______。
(4)制取漂白粉的反应化学方程式_________;其有效成分是_______;【答案】③⑨③⑤⑧⑥⑦①④ 2Na2O2+2CO2=2Na2CO3+O2 2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O Ca(ClO)2【解析】【分析】(1)碱性氧化物:能与酸反应只生成一种盐和水,主要包括绝大多数金属氧化物;酸:电离时产生的阳离子全部都是氢离子的化合物;强电解质:在水溶液中或熔融状态下能发生完全电离的化合物;非电解质:在水溶液中或熔融状态下不发生电离的化合物;能导电的物质有大多数金属单质或存在有自由移动电荷的物质;根据物质特点结合定义解答;(3)向硫酸氢钠溶液中逐滴加入氢氧化钡溶液到中性,除生成水,还应该生成Na2SO4和BaSO4沉淀;(4)漂白粉的有效成分为次氯酸钙,利用氯气和冷的消石灰反应制取漂白粉。
【详解】(1)Na2O能够与酸反应生成盐和水,属于碱性氧化物;HClO电离产生的阳离子都是氢离子,属于酸; Na2O、NaHCO3、NaCl晶体在水溶液或者熔融状态下能完全电离而导电,都是化合物,都属于强电解质;蔗糖、NH3,本身不能电离产生自由移动的离子,是化合物,都属于非电解质;钠含有自由电子,氯化亚铁溶液含有自由移动的离子,都能导电;故属于碱性氧化物的是③;属于酸的是⑨;属于强电解质的是③⑤⑧;属于非电解质的是⑥⑦;能导电的是①④;(2)Na2O2与CO2的反应生成碳酸钠和氧气,发生反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2;(3)向硫酸氢钠溶液中逐滴加入氢氧化钡溶液到中性,除生成水,还应该生成Na2SO4和BaSO4沉淀,则发生反应的离子方程式为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;(4)工业上利用氯气和冷的消石灰反应制取漂白粉,发生反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,其有效成分是Ca(ClO)2。
【点睛】电解质是指在水溶液中或熔融状态下能导电的化合物,例如酸、碱、盐、活泼金属氧化物等,凡在上述情况下不能导电的化合物叫非电解质,例如非金属氧化物、一些氢化物和一些有机物如蔗糖和酒精等;特别注意能导电的不一定是电解质,且非电解质的水溶液也可能导电,如CO2的水溶液导电,是因为生成碳酸的缘故;另外电解质和非电解质都是化合物,既要排除单质又要排除混合物。
3.下列各物质是中学化学中常见的物质,甲为常见金属单质,丙为黄绿色的单质气体,乙、丁是常见无色气态非金属单质,其它均为化合物,C常温下为一种液体,B、D分别为黑色粉末和黑色晶体,G为淡黄色固体,J为生活中常见的调味品,I为红褐色固体,F为棕黄色溶液。
①是实验室制取丁的反应之一。
各物质间的转化如下图所示,回答下列问题(部分生成物未列出):(1)物质I的化学式为________;F中阴离子是______________;(2)反应①的化学方程式为为____________;(3)B与K的反应是实验室制取丙的反应,其离子方程式为____________;(4)反应②的化学方程式为_____________;(5)若E与G以物质的量比为1:1投入足量水中,反应的化学方程式为_________;生成1mol气体转移电子的个数为__________。
【答案】Fe(OH)3 Cl- 2H2O22MnO2H2O+O2 MnO2+4H++2Cl-ΔMn2++Cl2↑+2H2O 3Fe +4H2O(g)高温Fe3O4 +4H2 4FeCl2+4Na2O2 + 6H2O = 4Fe(OH)3↓+8NaCl + O2↑ 6N A【解析】【分析】丙为黄绿色单质气体,所以丙为Cl2,B与K的反应是实验室制取丙的反应,且B为黑色粉末,则B为MnO2,K为HCl;①是实验室制取丁的反应之一,则该反应为双氧水在二氧化锰的催化作用下制取氧气的反应,所以C为H2O,丁为氧气;G为淡黄色固体,且可以生成氧气,则G应为Na2O2,则J为生活中常见的调味品,应为NaCl,I为红褐色固体应为Fe(OH)3;F为棕黄色溶液,应含Fe3+,E与氯气反应可生成F,则F为FeCl3,E为FeCl2;氯化铁可以与单质铁反应生成氯化亚铁,所以甲为铁单质,Fe可以在高温条件下与水反应生成氢气和四氧化三铁,所以乙为氢气,D为Fe3O4。
【详解】(1)根据分析可知物质I 为Fe(OH)3;F 中阴离子为Cl -;(2)反应①为双氧水在二氧化锰的催化作用下制取氧气,方程式为2H 2O 22MnO 2H 2O+O 2;(3)实验室利用浓盐酸和二氧化锰共热制取氯气,方程式为:MnO 2+4H ++2Cl -ΔMn 2++Cl 2↑+2H 2O ;(4)反应②为Fe 在高温条件下与水蒸气反应生成氢气和四氧化三铁的反应,方程式为:3Fe + 4H 2O(g)高温Fe 3O 4 +4H 2;(5)E 为FeCl 2,G 为Na 2O 2,过氧化钠有强氧化性可氧化亚铁离子为铁离子,被还原时-1价的氧被还原成-2价,二者1:1反应,说明氧化产物不止有Fe 3+,再联系过氧化钠可以与水反应生成氧气,可知产物中应还有氧气,Na 2O 2自身发生氧化还原反应,所以E 与G 以物质的量比为1:1投入足量水中,反应方程式为4FeCl 2+4Na 2O 2 + 6H 2O = 4Fe(OH)3↓+8NaCl + O 2↑。
【点睛】解决此类题目要根据物质的性质、特征作为突破口进行推断,例如本题中“丙为黄绿色单质气体”,则丙为Cl 2,“F 为棕黄色溶液”,则其溶液中应含有Fe 3+,学生平时的学习中要注意多积累一些有特殊性质的物质。
4.某溶液的溶质可能由下列离子组成:H +、SO 42-、CO 32-、Cl ―、Na +、Ba 2+中的一种或几种。
某同学做如下实验来确定溶液的成分:①向溶液中加入过量的BaCl 2溶液,有白色沉淀产生,过滤。
②向①中的滤液里加入AgNO 3溶液,有白色沉淀产生。
③将足量稀盐酸加入①的沉淀中,沉淀部分消失,有气体产生。
依据以上实验回答下列问题:(1)原溶液中一定有__________________。
(2)一定没有__________________。
(3)可能含有_____________。
(4)如果要确定原溶液中是否存在该离子,应选用试剂是__________________。
A .稀硝酸 B .Ba (NO 3)2 C .AgNO 3 D .Na 2CO 3(5)写出中沉淀消失的离子方程式________________。
【答案】SO 42-、CO 32-、Na + H +、Ba 2+ Cl - BC BaCO 3+2H +=Ba 2++H 2O +CO 2↑【解析】【详解】①向溶液中加入过量的BaCl 2溶液,有白色沉淀产生,过滤,则含SO 42-、CO 32-中的一种或都有,则一定没有Ba 2+;②将①中滤液里加入AgNO 3溶液,有白色沉淀产生,白色沉淀为AgCl ,但引入氯离子,则不能确定原溶液中是否含Cl -;③将①中的沉淀加入稀盐酸中,沉淀部分消失,有气体产生,则一定含SO42-、CO32-,则没有H+,因溶液不显电性,则一定含Na+;综上所述:(1)一定含SO42-、CO32-、Na+;(2)一定没有H+、Ba2+;(3)可能含有Cl-;(4)若要确定Cl-是否存在,应首先排除SO42-和CO32-的干扰,故原溶液中加入硝酸钡除去SO42-和CO32-,过滤后往滤液中加入硝酸银,若有白色沉淀生成,则证明原溶液中含有Cl-,故答案为BC;(5)碳酸钡与稀盐酸反应生成氯化钡和二氧化碳气体,离子反应方程式为:BaCO3+2H+=Ba2++H2O+CO2↑。
