化工原理第四章第四节
化工原理第四章传热

4-2.2
平面壁的稳态热传导
t Q R
dt Q A d
单层平面壁的稳态热传导
t1
△t
1、过程分析 假设Ⅰ:一维稳态热传导,即t=f(x) 假设Ⅱ:无限大平壁 A 2、模型 Q (t t )
1 2
A
Q
t2
可改写为:
t t Q A R
Am,3 2 rm,3l
Ф
t4
数学模型
★
1 1 Am,1
t1
t4
其中,
t1
Am,1 2 rm,1l Am,2 2 rm,2l
rm ,1
t4 Ф
r r r2 r1 r r rm ,2 3 2 rm ,3 4 3 r r r4 ln 2 ln 3 ln r1 r2 r3
非稳态传热——传热面各点温度t、传热速率Q 、热通量q等 物理量不仅为位置的函数,同时也随时间而改变。 Q, q, t……=f (x,y,z, τ)
化工原理
等温面 在温度场中,温度相同的各点组成的面。
等温面
温度梯度 等温面法线方向上的温度变化率。
t1>t2
对于一维稳定温度场, t=f(x),温度梯度表示为:
★ Q
t t t R 2 lrm Am
其中,
r2 r1 rm r ln 2 r1
Am 2 rml
rm——半径的对数平均值;当r2/r1<2时,rm≈ (r1+r2)/2
化工原理
多层圆筒壁的热传导
Q t1 t4 t t 3 2 R Am 2 Am,2 3 Am,3
dt grad (t ) d
化工原理第二版第四章答案

化工原理第二版第四章答案
第四章化学反应工程
1. 什么是化学反应工程?
化学反应工程是一门研究如何控制和优化化学反应的工程学科。
它研究如何控制反应条件,如温度、压力、流量和物料比例,以及如何优化反应系统的性能,以获得最佳的反应结果。
2. 什么是反应动力学?
反应动力学是研究反应过程的进展速度和反应结果的科学。
它研究反应物之间的相互作用,以及反应物的变化如何影响反应
过程的速度和结果。
3. 什么是反应器?
反应器是一种用于进行化学反应的装置。
它可以是一个容器,用于混合反应物,或者是一个反应系统,用于控制反应条件,如
温度、压力和流量。
4. 什么是反应器设计?
反应器设计是指根据反应物的性质和反应条件,设计出一个
反应器,以满足反应的要求。
它包括反应器的结构、材料、尺寸
和操作参数等。
5. 什么是反应器优化?
反应器优化是指根据反应物的性质和反应条件,优化反应器
的参数,以获得最佳的反应结果。
它包括反应器的结构、材料、
尺寸和操作参数等。
6. 什么是反应器模拟?
反应器模拟是指使用计算机模拟反应器的运行情况,以预测
反应器的性能。
它可以用来预测反应器的反应结果,以及反应器
的参数如何影响反应结果。
7. 什么是反应器控制?
反应器控制是指使用计算机控制反应器的运行情况,以调节
反应器的参数,以获得最佳的反应结果。
它可以用来控制反应器
的温度、压力、流量和物料比例等参数,以获得最佳的反应结果。
化工原理内容概要-第4章

《化工原理》内容提要第四章吸收1. 基本概念1)吸收的目的:①回收或捕获气体混合物中的有用组分;②除去有害成分。
2)吸收的依据:气体混合物中各组分间某种物理和化学性质的差异。
3)吸收操作必须解决的问题:①选择合适的溶剂;②提供适当的传质设备;③溶剂的再生。
4)物理吸收:吸收时,溶质与溶剂不发生明显的化学反应。
5)化学吸收:吸收时,溶质与溶剂或溶液中的其它物质发生化学反应。
6)吸收分类:单组分吸收/多组分吸收;等温吸收/非等温吸收。
7)溶解度:气液两相处于平衡状态时,溶质在液相中的平衡含量。
8)溶解度曲线:确定温度下,溶质在气相中的分压p e与液相中的摩尔分数x 的关联曲线。
9)对吸收过程:(y-y e)为以气相摩尔分数差表示的吸收传质推动力;(x e-x)为以液相摩尔分数差表示的吸收传质推动力。
10)吸收过程物质传递的三个步骤:①溶质由气相主体传递到两相界面即气相内的物质传递;②溶质在相界面上的溶解,由气相转入液相,即界面上发生的溶解过程。
③溶质自界面被传递至液相主体,即液相内的物质传递。
相界面上的溶解推动力很小,可认为其推动力为零,则相界面上气、液组成满足相平衡关系。
11)吸收过程物质传递的机理包括两种:①分子扩散;②对流传质。
12)主体流动:气相主体与界面之间产生微小压差,压差促使混合气体向界面的流动。
扩散流是分子微观运动的宏观结果,它所传递的是纯组分A 或纯组分B。
13)扩散系数与体系物性、体系的温度、总压或浓度有关。
14)对气体物系,D与绝对温度T的1.81次方成正比,与压强p成反比。
15)对很稀的非电解溶液,D与T成正比,与μ成反比。
16)对流传质:流动流体与相界面之间的物质传递。
17)化学吸收:通常指溶质气体A溶于溶液后,即与溶液中不挥发的反应剂B组分进行化学反应的过程。
18)常用解吸方法:气提解吸(载气解吸);减压解吸;加热解吸。
19)填料塔的结构:气体出口;液体进口;液体分布器;填料压板;填料(塔壁);液体再分布器;填料支承板;气体进口;液体出口(除沫器)。
化工原理第四章

4.1 液液相平衡
(2)杠杆规则
如图4-2所示,将质量为 krg、组成为
xS 的混合物系R与质量为e kg、组成为
y
x、A
A、
y、xB、B
y,S
的混合物系E相混合,得到一个质量为m kg、组成
为 z A 、z B、 z的S 新混合物系M,其在三角形坐标图
中分别以点R、E和M表示。M点称为R点与E点的和
称为共轭相,联结两共轭液相相点的直线称为联 结线,如图4-3中的RiEi线(i=0,1,2,……n)。显然 萃取操作只能在两相区内进行。
图4-3 溶解度曲线
4.1.2 三角形相图
溶解度曲线可通过下述实验方法得到:在一定温度下, 将组分B与组分S以适当比例相混合,使其总组成位于 两相区,设为M,则达平衡后必然得到两个互不相溶的 液加层入,适其量相的点溶为质RA0并、E充0。分在混恒合温,下使,之向达此到二新元的混平合衡液,中静 置加分入层溶后质得A,到重一复对上共述轭操相作,,其即相可点以为得R到1、nE+11,对然共后轭继相续的 相由点两R相i、变E为i (i一=0相,1时,2,,…其…组n成),点当用加K入表A示的,量K使点混称合为液混恰溶好点 或分层点。联结各共轭相的相点及K点的曲线即为实验 温度下该三元物系的溶解度曲线。
4.1.2 三角形相图
设溶质A可完全溶于B及S,但B与S为部分互溶, 其平衡相图如图4-3所示。此图是在一定温度下 绘制的,图中曲线R0R1R2RiRnKEnEiE2E1E0称为溶 解度曲线,该曲线将三角形相图分为两个区域: 曲线以内的区域为两相区,以外的区域为均相区。
位于两相区内的混合物分成两个互相平衡的液相,
4.1 液液相平衡
三角形坐标图内任一点代表一个三元混合物系。例如M点即表示由A、B、S三个组 分组成的混合物系。其组成可按下法确定:过物系点M分别作对边的平行线ED、HG 、KF,则由点E、G、K可直接读得A、B、S的组成分别为: =0.4、=0.3、=0.3;也可由 点D、H、F读得A、B、S的组成。在诸三角形坐标图中,等腰直角三角形坐标图可直 接在普通直角坐标纸上进行标绘,且读数较为方便,故目前多采用等腰直角三角形 坐标图。在实际应用时,一般首先由两直角边的标度读得A、S的组成及,再根据归 一化条件求得。
化工原理吸收塔的计算

填料层高度=传质单元高度×传质单元数
(1)传质单元数(以NOG为例)
•定义:NOG
Y1 dY Y2 Y Y *
气相总传质单元数
NOG
Y1 dY Y2 Y Y *
Y1 Y2 (Y Y *)m
气相组成变化 平均传质推动力
• 传质单元数的意义:
反映了取得一定吸收效果的难易程度。
当所要求的(Y1-Y2)为一定值时,平均吸收推动力(YY*)m越大,NOG就越小,所需的填料层高度就越小。
(2)传质单元高度
•定义:
H OG
G Kya
气相总传质单元高度,m。
•传质单元高度的意义:
完成一个传质单元分离效果所需的填料层高度,
反映了吸收设备效能的高低。
•传质单元高度影响因素:
填料性能、流动状况
四、吸收塔的操作计算 1.吸收过程的强化
Y1
Y*1
Y2
T △Y2
Y*2
O X2
B △Y1
X1
吸收推动力 NA 吸收阻力
目标:提高吸收过程的推动力; 降低吸收过程的阻力。
从L、G、m、X2、Y1、Y2着手。
其它因素: 1)降低吸收剂入口温度; 2)提高吸收的压力; 3)提高流体流动的湍动程度; 4)改善填料的性能。
Y1 dY Y2 Y
NOG
Y1 Y1
Y2 Y2
ln
Y1 Y2
X1
NOG
Y1 Y2 Ym
Ym (Y1 Y2)/ ln Y1 / Y2
注意: •平均推动力法适用于平衡线为直线,逆流、并流 吸收皆可。 •平衡线与操作线平行时,
Ym Y1 Y2 X m X1 X 2
(化工原理)第四节 传热计算

平均温度差法-11
平均温度差法-12
平均温度差法-13
平均温度差法-14
平均温度差法-15
平均温度差法-16
对于1-2型(单壳程双管程)换热器, 可用下式计算
对于1-2n型,也可近似使用
平均温度差法-17
(三)流向的选择
在两流体进、出口温度各自相同的条件下,逆流时的平均温度 差最大,并流时最小,其它流向介于两者之间。逆流优于并流 和其它流型。当换热器的传热量Q及总传热系数一定时,采用 逆流流动,所需的换热器的传热面积最小
选择的传热面积不同,总传热系数不同 dQ=Ki(T-t)dSi=KO(T-t)dS0=Km(T-t)dSm
K面i、积的KO总、传K热m—系—数基,于W管/(m内2•表℃面);积、外表面积和内外表面平均 S面i 、积S,m0、2。Sm——换热器管内表面积、外表面积和内外侧的平均
dQ及(T-t)和选择的基准面积无关,故
dQ=K(T-t)dS=KΔtdS
平均温度差法-7
(3)总传热系数K为常量,即K值不随换热器的管长而变化;
平均温度差法-8
平均温度差Δtm等于换热器两端处温度 差的对数平均值
当 Δt2/Δt1≤2时,可以用算术平均温度差代替对 数平均温度差,
并流流动, 该式是计算逆流和并流时的 平均温度差Δtm的通式。
d均i、直d径o、,mdm——管内径、外径和内外径的平
总传热速率微分方程和总传热系 数-4
二、总传热系数
(一)、总传热系数的数值范围
总传热系数K值主要取决于流体的物性、传 热过程的操作条件及换热器的类型
总传热速率微分方程和总传热系 数-6
(二)、总传热系数的计算式
通过管壁之任一截面的热传导速率
化工原理课后答案(中国石化出版社) 第4章 固体流态化和气力输送

第四章固体流态化和气力输送1.在内径为1.2m的丙烯腈流化床反应器中,堆放了3.62t磷钼酸铋催化剂,其颗粒密度为1100kg/m3,堆积高度为5m,流化后床层高度为10m。
试求:(1)固定床空隙率;(2)流化床空隙率;(3)流化床的压降。
2.流化床干燥器中颗粒的直径为0.5mm,密度为1400kg/m3,静止床高为0.3m。
热空气在床中的平均温度为200℃,试求流化床的压降及起始流化速度。
空气可假设为常压下的干空气,颗粒视为球形,ε可取为0.4。
mf3.某气—固流化床反应器在623K,压强152kPa条件下操作,此时气体的粘度μ=3.13×l0-5Pa·s,密度ρ=0.85kg/m3,催化剂颗粒直径为0.45mm,密度为1200kg/m3。
为确定其起始流化速度,现用该催化剂颗粒及30℃的空气进行流化实验,测得起始流化速度为0.049m/s,求操作状态下的起始流化速度。
30℃下空气的粘度和密度分别为:μ=1.86×l0-5Pa·sρ=1.17kg/m3。
4.平均直径为0.2mm的催化剂颗粒,在200℃的气流中流化,气体的物理性质可以近似地视为与空气相同。
颗粒的特性如下:密度球形度固定床空隙率开始流化时空隙率操作气速取为0.15mm直径的颗粒带出速度的0.4倍,已估计出此时流化床的=0.65.试求:空隙率εf(1)起始流化速度;(2)操作气流速度;(3)流化数:(4)操作气速下每米流化床的压降;(5)膨胀比。
5.大小均匀的球形颗粒由气体携带以Gs/G=4的比例通过一很Dt=0.1m的水平管子,颗粒的直径为0.8mm,密度ρ=2000kg/m3,气体的密度ρ=1kg/m3,粘度μ=2×l0-5Pa·s。
计算沉积速度。
6.混合颗粒的粒径在0.06-1mm之间,在一根Dt=0.12m的水平管中以Gs/G=4的固气比进行气力输送。
气体及固体的性质与上题相同,试计算其沉积速度。
化工原理 第四章

第二节 过滤
若滤饼需要洗涤,可将洗水压人洗水通道,经洗涤板 角端的暗孔进入板面与滤布之间。此时,应关闭洗涤板下 部的滤液出口,洗水便在压力差推动下穿过一层滤布及整 个厚度的滤饼,然后再横穿另一层滤布,最后由过滤板下 部的滤液出口排出,这种操作方式称为横穿洗涤法,其作 用在于提高洗涤效果。洗涤结束后,旋开压紧装置并将板 框拉开,卸出滤饼,清洗滤布,重新组合,进入下一个操 作循环。 板框压滤机优点是构造简单,制造方便、价格低;过 滤面积大,可根据需要增减滤板以调节过滤能力;推动力 大,对物料的适应能力强,对颗粒细小而液体较大的滤浆 也能适用。缺点是间歇操作,生产效率低;卸渣、清洗和 组装需要时间、人力,劳动强度大,但随着各种自动操作 的板框压滤机的出现,这一缺点会得到一定程度的改进。
第二节 过滤
(2)多孔性固体介质 是素瓷、金属或玻璃的烧结物、 塑料细粉粘结而成的多孔性塑料管等, 适用于含粘软性 絮状悬浮颗粒或腐蚀性混悬液的过滤,一般可截留粒径1~ 3μm的微细粒子。 (3)粒状介质 是由各种固体颗粒(砂石、木炭、石棉) 或非编织纤维(玻璃棉等)堆积而成。适用于深层过滤,如 制剂用水的预处理。 (4)微孔滤膜,是由高分子材料制成的薄膜状多孔介 质。适用于精滤,可截留粒径0.01μm以上的微粒,尤其适 用于滤除0.02~10μm的混悬微粒。
第二节 过滤
图4-4 滤板和滤框
第二节 过滤
2.转鼓真空过滤机 转筒真空过滤机为连续式真空过滤设备,如图4-5所示。 主机由滤浆槽、篮式转鼓、分配头、刮刀等部件构成。篮 式转鼓是一个转轴呈水平放置的圆筒,圆筒一周为金属网 上履以滤布构成的过滤面,转鼓在旋转过程中,过滤面可依 次浸入滤浆中。转筒的过滤面积一般为5~40m2,浸没部分 占总面积的30%~40%,转速约为0.1~3r/min。转鼓内沿径 向分隔成若干独立的扇形格,每格都有单独的孔道通至分 配头上。转鼓转动时,籍分配头的作用使这些孔道依次与 真空管及压缩空气管相通,因而,转鼓每旋转一周,每个扇 形格可依次完成过滤、洗涤、吸干、吹松、卸饼等操作。
化工原理整理知识点

第一章 流体传递现象➢ 流体受力:表面力和体积力体积力/场力/质量力:为非接触力,大小与流体的质量成正比表面力:为接触力,大小与和流体相接触的物体(包括流体本身)的表面积成正比, ➢ 流场概念:场和流场;矢量场和标量场;梯度第一节 流体静力学1-1-2 压力流体垂直作用于单位面积上的力,称为流体的静压强,又称为压力。
在静止流体中,作用于任意点不同方向上的压力在数值上均相同。
压力的单位(1) 按压力的定义,其单位为N/m 2,或Pa ;(2) 以流体柱高度表示,如用米水柱或毫米汞柱等。
标准大气压的换算关系:1atm = 1.013×105Pa =760mmHg =10.33m H 2O 压力的表示方法表压 = 绝对压力-大气压力 真空度 = 大气压力-绝对压力 1-1-3 流体静力学基本方程 静力学基本方程:压力形式 :)(2112z z g p p -+=ρ能量形式 :gz p g z p 2211+=+ρρ适用条件:在重力场中静止、连续的同种不可压缩流体。
(1)在重力场中,静止流体内部任一点的静压力与该点所在的垂直位置和流体的密度有关,而与该点所在的水平位置和容器的形状无关。
(2)在静止的、连续的同种液体内,处于同一水平面上各点的压力处处相等。
液面上方压力变化时,液体内部各点的压力也将发生相应的变化。
(3)物理意义:静力学基本方程反映了静止流体内部能量守恒与转换的关系,在同一静止流体中,处在不同位置的位能和静压能各不相同二者可以相互转换,但两项能量总和恒为常量。
应用:1. 压力和压差的测量 (1)U 形压差计:gR p p )(021ρρ-=- 若被测流体是气体,可简化为:021ρRg p p ≈-U 形压差计也可测量流体的压力,测量时将U 形管一端与被测点连接,另一端与大气相通,此时测得的是流体的表压或真空度。
(2)倒U 形压差计 ρρρRg Rg p p ≈-=-)(021(3)双液体U 管压差计)(21C A Rg p p ρρ-=- 2. 液位测量3. 液封高度的计算第二节 流体动力学1-2-1 流体的流量与流速 一、流量体积流量V S 单位时间内流经管道任意截面的流体体积, m 3/s 或m 3/h 。
化工原理第四章讲稿PPT课件

2020/9/30
17
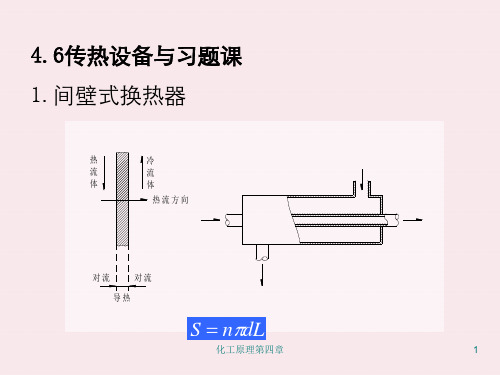
3、间壁式换热
间壁式换热的特点是冷、热流体被一固体隔开,分别在壁 的两侧流动,不相混合,通过固体壁进行热量传递。 传热过程可分为三步: •热流体将热量传给固体壁面(对流传热) •热量从壁的热侧传到冷侧(热传导) •热量从壁的冷侧面传给冷流体(对流传热) 壁的面积称为传热面,是间壁式换热器的基本尺寸。
q t1 t3
b1
1
r0
b2
2
接触热阻与接触面的材料,表面 粗糙度及接触面上压强等因素有 关。
2020/9/30
42
2020/9/30
39
2、多层平壁的稳定热传导
Q
1S
t1
t2 b1
t1 b1
1S
t1 R1
2S
t2 b2
t3
t2 b2
t2 R2
2S
3S
t3
t4 b3
t3 b3
t3 R3
3S
2020/9/30
40
t1 QR1,t2Q2R,t3 QR3
Qt1t2 t3 R1R2 R3
b1
SdLn
d——管径可分别用管内径di,管外径d0或平均直径dm来表示。 则对应的传热面积分别为管内侧面积Si,外侧面积S0或平均面 积Sm
2020/9/30
25
六、传热速率与热通量
传热速率(热流量 )Q :
单位时间内通过传热面的热量,单位为w。
热通量(又称为热流密度或传热速度)q :
单位传热面积的传热速率。单位为w/m2
35
2、固体的导系数
纯金属的导热系数一般随温度的升高而降低, 金属的导热系数大都随纯度的增加而增大。 非金属的建筑材料或绝热材料的导热系数随密度增加而增 大,也随温度升高而增大。
化工原理课后习题答案详解第四章

第四章多组分系统热力学4.1有溶剂A与溶质B形成一定组成的溶液。
此溶液中B的浓度为c B,质量摩尔浓度为b B,此溶液的密度为。
以M A,M B分别代表溶剂和溶质的摩尔质量,若溶液的组成用B的摩尔分数x B表示时,试导出x B与c B,x B与b B之间的关系。
解:根据各组成表示的定义4.2D-果糖溶于水(A)中形成的某溶液,质量分数,此溶液在20 ︒C时的密度。
求:此溶液中D-果糖的(1)摩尔分数;(2)浓度;(3)质量摩尔浓度。
解:质量分数的定义为4.3在25 ︒C,1 kg水(A)中溶有醋酸(B),当醋酸的质量摩尔浓度b B介于和之间时,溶液的总体积。
求:(1)把水(A)和醋酸(B)的偏摩尔体积分别表示成b B的函数关系。
(2)时水和醋酸的偏摩尔体积。
解:根据定义当时4.460 ︒C时甲醇的饱和蒸气压是84.4 kPa,乙醇的饱和蒸气压是47.0 kPa。
二者可形成理想液态混合物。
若混合物的组成为二者的质量分数各50 %,求60 ︒C 时此混合物的平衡蒸气组成,以摩尔分数表示。
解:质量分数与摩尔分数的关系为求得甲醇的摩尔分数为根据Raoult定律4.580 ︒C是纯苯的蒸气压为100 kPa,纯甲苯的蒸气压为38.7 kPa。
两液体可形成理想液态混合物。
若有苯-甲苯的气-液平衡混合物,80 ︒C时气相中苯的摩尔分数,求液相的组成。
解:根据Raoult定律4.6在18 ︒C,气体压力101.352 kPa下,1 dm3的水中能溶解O2 0.045 g,能溶解N2 0.02 g。
现将 1 dm3被202.65 kPa空气所饱和了的水溶液加热至沸腾,赶出所溶解的O2和N2,并干燥之,求此干燥气体在101.325 kPa,18 ︒C下的体积及其组成。
设空气为理想气体混合物。
其组成体积分数为:,解:显然问题的关键是求出O2和N2的Henry常数。
18 ︒C,气体压力101.352 kPa下,O2和N2的质量摩尔浓度分别为这里假定了溶有气体的水的密度为(无限稀溶液)。
化工原理第四章两流体间传热过程的计算

【特点】平行而同向。
6/28/2020
并流
逆 流 【特点】方向相反且平行。
6/28/2020
折流换热器 【特点】既存在并流,又存在逆流。
6/28/2020
【特点】两种流体的流向垂直交叉。
6/28/2020
喷淋蛇管(错流)式换热器
7、并、逆流操作的平均温度差 在如下假定条件下(稳定传热过程):
Δtm ——两流体的平均温度差,℃
6/28/2020
2、热量衡算式
【衡算前提】
(1)换热器绝热良好;
(2)热损失可忽略。
【衡算系统】热交换器;
【衡算基准】单位时间;
【衡算式】热流体放出的热量等于冷流体得到的热
量。即:
Q热=Q冷
6/28/2020
二、Q值的确定——计算热负荷
1、什么是热负荷 【定义】达到工艺要求的控制参数所应交换的热量 ,即: ①热流体放出的热量; ②冷流体得到的热量。 【作用】由热负荷可以确定传热速率。
6/28/2020
T1
t2
T2
t1
(1)单侧变温
【特点】在热交 换过程中,一侧 温度保持不变, 另一侧温度发生 变化。
6/28/2020
(2)双侧变温 【特点】在热交 换过程中,两侧 温度均发生变化 。
6/28/2020
【特点】局部温度差Δt 沿传热面而变化。
在面积为dA两 侧,可视为恒
Δt=T-t
R=20 15 10 6.0 4.0 3.0 2.0 1.8 1.6 1.4 1.2
1.0 0.8 0.6 0.4 0.2
1.0 0.9
0.8
ψ
0.7
0.6
0.5
(化工原理)第四节 传热计算

平均温度差法-2
一、恒温传热时的平均温度差
换热器的间壁两侧流体均有相变化时,就是 恒温传热。
Q =KS(T-t)=KSΔt
二、变温传热下的平均温度差
1.逆流和并流时的平均温度差
逆流 与 并流
平均温度差法-3
平均温度差法-4
由换热器的热量衡算微分式知:
根据前述的假定
(1)传热为稳定操作过程; (2)两流体的比热为常量(可取进、出口的平均值);
逆流另一优点是换热器面积相同时,可节省加热介质的用量。 这是因为逆流时,热流体的出口温度T2可降至的接近冷流体的 进口温度t1 ;而采用并流操作时,只能降到接近冷流体的出口 温度t2,即逆流时热流体的温降较并流时为大,因此逆流加热 介质用量较少。同理逆流时冷流体的温升较并流时大,故冷却 介质的用量可少些
换热器的热量衡算和传热速率方程的微 分式为:
对于热流体,上式可改写为:
传热单元数法-5
上式的积分式称为基于热流体的传热单 元数,用NTU表示,即 :
对于冷流体,换热器的传热单元数 (NTU)c为:
传热单元数法-7
三、传热效率和传热单元数的关系
总传热速率方程为 Q=KSΔtm
若冷流体为最小值流体
平均温度差法-5
如果将Q对T或t作图,由上式可知 Q-T和 Q-t是 直线关系,可分别表示为:
T=mQ+k 及 t=m’Q+k’
上两式相减,得:
T -t =Δt=(m-m’)Q +(k-k’) 式中m、k、m’、k’分别为Q-T和Q-t直线的斜
率和截距。
平均温度差法-6
Q-Δt的直线的斜率为
一、传热效率ε
换热器的传热效率的ε定义为:
传热单元数法-2
化工原理第四章第四节讲稿

dQ T t1 t2 t3
R
R1 R2 R3
1 1 b 1
KdS0 0dS0 dSm i dSi
若以外表面为基准
1 1 bdS0 dS0 dS d dl
K 0 dSm idSi dS0 dSm d0 dm , dS0 dSi d0 di
2021/3/12
10
1 1 bd0 d0
若管壁内侧表面上的污垢热阻分别用Rsi和Rs0表示,根据 串联热阻叠加原则,
2021/3/12
1
K
1
0
RS 0
bd
dm
RSi
d0 d0
d0
idi
12
当管壁热阻和污垢热阻均可忽略时,
111
K i 0
若 i>>0
则
1 1
K o
•总热阻是由热阻大的那一侧的对流传热所控制。
•提高K值,关键在于提高对流传热系数较小一侧的α。
tm t tm,逆 0.92 43.7 40.20C
又冷却水终温提到350C, 逆流时:100 40
35 15 65 25
t m,逆
65 25 ln 65
41.90C
25
2021/3/12
29
P 35 25 0.235 100 15
R 100 40 3.0
35 15
32
五、传热面积的计算
1、传热系数K为常数
S Q Ktm
其中: Q WCCP,C (t2 t1) WhCP,h (T1 T2 )
2、传热系数K为变数
dS dQ WCCP,C dt K (T t) k(T t)
2021/3/12
33
积分 :
S
t2
化工原理第四章第四节

Q1 Q2
Q1——单位时间内热流体放出的热量,W或kW。
Q2——单位时间内冷流体吸收的热量,W或kW。
应用:计算换热器的传热量(热负荷)。
2020/5/1
B
5
1、冷、热流体在传热过程中均不发生相变化 (1)比热法
热流体单位时间内放出的热量为:
Q 1qm 1cp1 T1T2
qm1——热流体的质量流量,kg·s-1。
热流体放出的热量为: Q1 qm1r1
r1——饱和蒸汽的冷凝潜热,J·kg-1。
冷流体吸收的热量为:Q2 qm2r2
r2——饱和液体的汽化潜热,J·kg-1。
2020/5/1
B
9
(2)冷、热流体有一侧发生相变化,另一侧不 发生相变化。
若热流体发生相变化:
a、热流体仅发生相变化,不发生温度变化
Q q m 1 r 1 q m 2 c p 2t2 t1
他形式流动。
当换热器的传热量Q、总传热系数K相同的条
件下,采用逆流操作,所需A最小。
2020/5/1
B
40
2)逆流可以节省冷却介质或加热介质的用量。
以 物 料 被 加 热 为 例 , qm 1qm c2 p c 1pT 21 t 2T 2t1
当给定加热任务,qm2、t2、t1确定,T1一般
已知,qm1仅由T2决定。
B
1
已知:T1、 T2、 cp1、 qm1
t1、 t2、 cp2
2020/5/1
求: qm2
B
2
第四节 总传热过程的分析计算
2020/5/1
B
3
总传热过程的计算
热量衡算
总传热速率方程
总传热系数
平均温度差
化工原理第四章第四节讲稿

微元面积dS的传热情况
两流体的温差为△t t T t
通过微元面dS的传热量为 :
a
d K T Q t d K t S dS b
dQWhcphdT
dT dQ
c
Whcph
d t d T t d d T t(e)
冷流体的温升 两流体的最初温差
R T1 T2 t2 t1
热流体的温降 冷流体的温升
计算P,R的值后,可查图得到φ△t的值
2020/1/13
例:通过一单壳程双管程的列管式换热器,用冷却水冷 却热流体。两流体进出口温度与上例相同,问此时的传热 平均温差为多少?又为了节约用水,将水的出口温度提高到 35℃,平均温差又为多少? 解:
0.01m 422K/W
K7.4 0W /m 2K
K值增加的百分率 KK10% 070.437.510% 087.8%
K
37.5
2020/1/13
四、传热的平均温度差
恒温差传热:传热温度差不随位置而变的传热
传热 变温差传热:传热温度差随位置而改变的传热
并流 :两流体平行而同向的流动
又冷却水终温提到350C, 逆流时:100 40
35 15 65 25
tm,逆
65 25 65
41.90C
ln
25
2020/1/13
P 3525 0.235 10015
R 10040 3.0
3515
查图得:t 0.86
tm0.8 64.9 1 31.60C
5) 流体通过管壁的传热包括: 6) 1) 热流体在流动过程中把热量传递给管壁的对流传热
化工原理第四章
化工原理第四章
11
化工原理第四章
12
(2)U型管换热器 特点:管内清洗困难
化工原理第四章
13
(3)浮头式换热器 结构较为复杂,成本高,消除了温差应力,应用广泛。
化工原理第四章
14
2.板式换热器
1)夹套式换热器
化工原理第四章
15
Ø 结构:夹套式换热器主要用于反应过程的加热 或冷却,是在容器外壁安装夹套制成。
Ø 优点:结构简单。
Ø 缺点:传热面受容器壁面限制,传热系数小。 为提高传热系数且使釜内液体受热均匀,可在釜 内安装搅拌器。也可在釜内安装蛇管。
化工原理第四章
16
2)板式换热器
化工原理第四章
17
化工原理第四章
18
化工原理第四章
19
3)螺旋板式换热器(逆流)
化工原理第四章
20
化工原理第四章
21
化工原理第四章
42
4.7.3 各种间壁式换热器的比较和传热的强 化途径
1.各种间壁式换热器的比较
视具体情况,综合考虑择优选定。
化工原理第四章
43
(1)加大流速; (2)增强流体的扰动; (3)在流体中加固体颗粒; (4)采用短管技术; (5)防止结垢和及时清除垢层。 原则:抓住影响强化传热的主要矛盾,结合设备结 构、动力消耗、检修操作等,采取经济合理的强化 方法。
Ø 优点:结构简单,便于防腐,能承受高压。
Ø 缺点:由于容器体积比管子的体积大得多,因此管外 流体的表面传热系数较小。为提高传热系数,容器内 可安装搅拌器。
化工原理第四章
6
(2)喷淋式
化工原理第四章
7
Ø 结构:多用于冷却管内的热流体。将蛇管成排 地固定于钢架上,被冷却的流体在管内流动,冷 却水由管上方的喷淋装置中均匀淋下,故又称喷 淋式冷却器。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
r1——饱和蒸汽的冷凝潜热,J·kg-1。
冷流体吸收的热量为:Q2 qm2r2
r2——饱和液体的汽化潜热,J·kg-1。
2020/5/2
.
(2)冷、热流体有一侧发生相变化,另一侧不 发生相变化。
若热流体发生相变化:
a、热流体仅发生相变化,不发生温度变化
Q q m 1 r 1 q m 2 c p 2t2 t1
Q q m 1 r 1 q m 1 c p 1 T 1 T 2 q m 1 r 1 q m 1 c p 1 T S T 2
1 5 0 0 2 2 2 9 1 0 3 1 5 0 0 4 .1 9 6 1 0 3 1 1 1 5 0
3 6 0 0
3 6 0 0
1.035106W
或K0
1
b
1 d0 1
d0
0 dm i di
——基于外表面积总传热系数计算公式
那么:
K i ? Km ?
2020/5/2
.
3、污垢热阻
在总计算传热系数K时,一般不能忽略污垢
热阻,常采用污垢热阻的经验值(P149表4-6)
对于平壁,若壁面两侧的污垢热阻分别为Rd1 和Rd2,则
11
b
1
K1Rd1Rd22
QKoAotm
QKmAmtm
2020/5/2
.
三、总传热系数
1、总传热系数K的来源
(1)生产实际的经验数据:表4-7(P332) (2)实验测定 (3)分析计算
2020/5/2
.
2、总传热系数K的计算 以传热面积A1为基准的总传热系数为
1 1bdA1 1 dA1
K1 1 dAm 2 dA2
——总传热系数的通式 表明:传热过程的总热阻=各串联热阻的叠加
.
2020/5/2
已知:T1、 T2、 cp1、 qm1
t1、 t2、 cp2
求: qm2
.
第四节 总传热过程的分析计算
2020/5/2
.
总传热过程的计算
Hale Waihona Puke 热量衡算总传热速率方程
总传热系数
平均温度差
传热面积的计算
2020/5/2
传热计算举例
.
一、热量衡算
冷、热流体在间壁式换热器中进行热交换时 ,若热损失可忽略,则在单位时间内热流体放 出的热量等于冷流体吸收的热量。即:
(1)试求总传热系数;
(2)保持其他条件不变,试分别计算将α1提高一倍时 的Ki’值;将α2提高一倍时的Ki’’值。
2020/5/2
.
解:(1)以外表面积为基准的总传热系数为
K 101 0R d0bd dm 0R did d0 i 1i d d0 i
b、热流体发生相变化同时发生温度变化
Q q m 1 r 1 q m 1 c p 1 T s T 2 q m 2 c p 2 t 2 t 1
2020/5/2
.
例:试计算压力为150kPa、流量为1500kg·h-1的饱
和水蒸气冷凝至50℃的水时所放出的热量。
解:由附录7(P332)查得,饱和水蒸气在压力
2020/5/2
.
若传热面为平壁,总传热系数为:
1 1b1
K 1 2
对于圆筒壁,以管外表面为基准的总传热系数为
1
K0
1bdA0 1dA0
0 dAm i dAi
dA ddL
d A0 d Am d0 dm
dA0 dAi d0 di
2020/5/2
.
1 1bd0 1d0
K0 0 dm i di
2020/5/2
.
二、总传热速率方程
经推导:
QKAtm
K——换热器的平均总传热系数,W·m-2·℃-1。
也可写成: Q t m 1
KA
2020/5/2
1 ——总传热热阻
KA .
注意:其中K必须和所选择的传热面积A相 对应。
若间壁为圆筒壁,则以不同传热面积为基准的 总传热速率方程为:
QKiAitm
Q1 Q2
Q1——单位时间内热流体放出的热量,W或kW。
Q2——单位时间内冷流体吸收的热量,W或kW。
应用:计算换热器的传热量(热负荷)。
2020/5/2
.
1、冷、热流体在传热过程中均不发生相变化 (1)比热法
热流体单位时间内放出的热量为:
Q 1qm 1cp1 T1T2
qm1——热流体的质量流量,kg·s-1。
2020/5/2
.
对于圆筒壁,若圆筒壁内、外表面的污垢热 阻分别用Rdi和Rd0表示,则
K 101 0R d0bd dm 0R did d0 i 1i d d0 i
2020/5/2
.
例:有一套管换热器,由φ25×2.5 mm的钢管组成。 CO2在管内流动,α1= 40 W·m-2·℃-1。冷却水在管外流 动α2= 3000 W·m-2·℃-1,钢管的导热系数λ= 45 W·m-2·℃-1 ,冷却水测的污垢热阻Rd2= 0.21×10-3 m2·℃·W-1,CO2 侧的污垢热阻Rd1= 0.53×10-3 m2·℃·W-1。
.
(2)热焓法 热流体单位时间内放出的热量为
Q 1qm 1H 1H 2
H1、H2—分别为热流体在温度为T1、T2时的焓值,J·kg-1。
冷流体单位时间内吸收的热量为
Q 2qm 2h2h1
h1、h2——分别为冷流体在温度为t1、t2时的焓值,J·kg-1。
2020/5/2
.
2、冷、热流体在传热过程中发生相变化 (1)冷、热流体均仅发生相变化
为 150kPa 时 的 温 度 为 TS=111℃ , 冷 凝 潜 热 为
rh=2229kJ·kg-1。
蒸汽冷凝时,要放出潜热,又要放出显热。
依题意知,冷凝水由TS=111℃降温至50℃,则
定性温度为 T1115080.5oC
2020/5/2
2.
由附录3查得水在80.5℃时的定压比热为
所以
cp14.196kJkg1oC1.
cp1——热流体的平均定压比热,J·kg-1·℃-1 。
2020/5/2
.
冷流体单位时间内吸收的热量为:
Q2qm2cp2(t2t1)
qm2——冷流体的质量流量,kg·s-1。
cp2——冷流体的平均定压比热,J·kg-1·℃-1 。
工程上,以定性温度下的定压比热代替平均 定压比热进行计算。
2020/5/2
例:有一列管式换热器,用冷却水使流量为
2000kg·h-1的硝基苯从82℃冷却至27℃,冷却 水由15℃升至35℃,试求冷却水用量。已知硝 基苯的平均定压比热cp1=1.58kJ·kg-1·℃-1, 水 的 平 均 定 压 比 热 cp2=4.179kJ·kg-1·℃-1 。
设备热损失可忽略。
2020/5/2
