新版GMP对除菌过滤工艺及验证的要求
新版GMP车间洁净度级别及监测
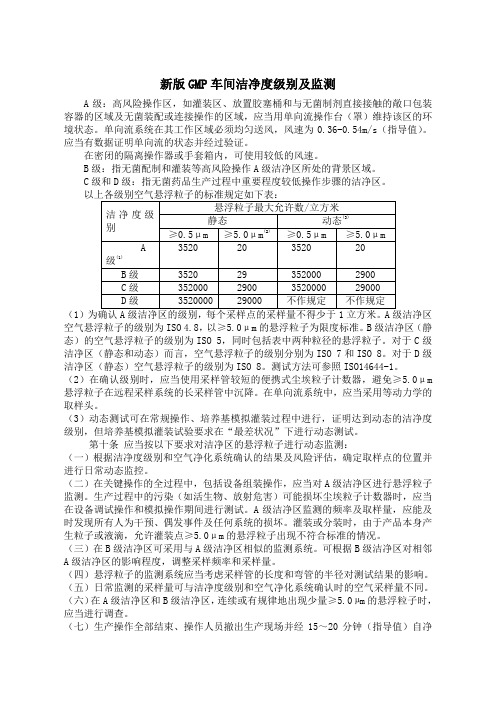
新版GMP车间洁净度级别及监测A级:高风险操作区,如灌装区、放置胶塞桶和与无菌制剂直接接触的敞口包装容器的区域及无菌装配或连接操作的区域,应当用单向流操作台(罩)维持该区的环境状态。
单向流系统在其工作区域必须均匀送风,风速为0.36-0.54m/s(指导值)。
应当有数据证明单向流的状态并经过验证。
在密闭的隔离操作器或手套箱内,可使用较低的风速。
B级:指无菌配制和灌装等高风险操作A级洁净区所处的背景区域。
C级和D级:指无菌药品生产过程中重要程度较低操作步骤的洁净区。
(1)空气悬浮粒子的级别为ISO 4.8,以≥5.0μm的悬浮粒子为限度标准。
B级洁净区(静态)的空气悬浮粒子的级别为ISO 5,同时包括表中两种粒径的悬浮粒子。
对于C级洁净区(静态和动态)而言,空气悬浮粒子的级别分别为ISO 7和ISO 8。
对于D级洁净区(静态)空气悬浮粒子的级别为ISO 8。
测试方法可参照ISO14644-1。
(2)在确认级别时,应当使用采样管较短的便携式尘埃粒子计数器,避免≥5.0μm 悬浮粒子在远程采样系统的长采样管中沉降。
在单向流系统中,应当采用等动力学的取样头。
(3)动态测试可在常规操作、培养基模拟灌装过程中进行,证明达到动态的洁净度级别,但培养基模拟灌装试验要求在“最差状况”下进行动态测试。
第十条应当按以下要求对洁净区的悬浮粒子进行动态监测:(一)根据洁净度级别和空气净化系统确认的结果及风险评估,确定取样点的位置并进行日常动态监控。
(二)在关键操作的全过程中,包括设备组装操作,应当对A级洁净区进行悬浮粒子监测。
生产过程中的污染(如活生物、放射危害)可能损坏尘埃粒子计数器时,应当在设备调试操作和模拟操作期间进行测试。
A级洁净区监测的频率及取样量,应能及时发现所有人为干预、偶发事件及任何系统的损坏。
灌装或分装时,由于产品本身产生粒子或液滴,允许灌装点≥5.0μm的悬浮粒子出现不符合标准的情况。
(三)在B级洁净区可采用与A级洁净区相似的监测系统。
新版GMP对工艺验证要求及思路

新版GMP对工艺验证要求及思路内容工艺验证的新思路工艺验证的新思路工艺验证应当证明一个生产工艺按照规定的工艺参数能够持续生产出符合预定用途和注册要求的产品。
中国2010版收集并评估从工艺设计阶段一直到商业化生产的数据用这些数据确立科学证据证明该工艺能够始终如一地生产出优质产品。
FDA2011书面化的证据证明工艺在所建立的参数范围内能有效和重复生产出符合预期标准和质量属性的医药产品。
EU2001规定的工艺能始终如一地生产出符合预期标准和质量属性的产品。
PIC/S2001确认的定义证明厂房、设施、设备能正确运行并可达到预期结果的一系列活动。
验证的定义证明任何操作规程或方法、生产工艺或系统能够达到预期结果的一系列活动。
第一百三十八条企业应当确定需要进行的确认或验证工作以证明有关操作的关键要素能够得到有效控制。
确认或验证的范围和程度应当经过风险评估来确定。
第一百三十九条企业的厂房、设施、设备和检验仪器应当经过确认应当采用经过验证的生产工艺、操作规程和检验方法进行生产、操作和检验并保持持续的验证状态。
第一百四十条应当建立确认与验证的文件和记录并能以文件和记录证明达到以下预定的目标一设计确认应当证明厂房、设施、设备的设计符合预定用途和本规范要求二安装确认应当证明厂房、设施、设备的建造和安装符合设计标准三运行确认应当证明厂房、设施、设备的运行符合设计标准四性能确认应当证明厂房、设施、设备在正常操作方法和工艺条件下能够持续符合标准五工艺验证应当证明一个生产工艺按照规定的工艺参数能够持续生产出符合预定用途和注册要求的产品。
第一百四十一条采用新的生产处方或生产工艺前应当验证其常规生产的适用性。
生产工艺在使用规定的原辅料和设备条件下应当能够始终生产出符合预定用途和注册要求的产品。
第一百四十二条当影响产品质量的主要因素如原辅料、与药品直接接触的包装材料、生产设备、生产环境或厂房、生产工艺、检验方法等发生变更时应当进行确认或验证。
默克密理博除菌过滤验证

过滤工艺相关法规及验证内容解析时优默克密理博验证实验室认识我们使用的过滤器⏹折叠式⏹膜在支撑材料间⏹热熔⏹2-5种结构材料议题与过滤相关的法规及指南检查缺陷及解决方案如何进行过滤器验证世界各国GMP法规要求进行过滤器验证⏹US GMP 21 CFR Parts 210 & 211美国GMPAppropriate written procedures…shall be established and followed. Suchproceduresshall include validation of any sterilization process必须建立和跟进相应的证明性文件….,,这些文件中包括所有的除菌工艺的验证文件。
⏹EU GMP Annex 1 Sterile Medicinal Products欧盟GMP 无菌药品附录All sterilization processes should be validated.所有除菌工艺必须进行验证。
⏹Australian TGA GMP澳大利亚TGA GMPFiltration processes used as the sterilizing step for products should bevalidated.除菌级的过滤工艺应该验证。
⏹Health Canada GMP加拿大GMPDocumented evidence is available establishing validation and validity ofeachsterilization process.每步除菌工艺必须要有验证其有效性的证明性文件。
FDA法规对过滤器验证的要求FDA Aseptic Processing Guidelines (2004) FDA无菌工艺指南•Filter validation should be conducted using the worst case conditions, (pH, temperature, flow rate, pressures etc.)挑战试验必须模拟最差工艺条件• Challenge fluid should simulate product as closely as in practice 挑战液应该尽可能保持和实际产品相同中国新版GMP附录1第四十一条过滤器应当尽可能不脱落纤维。
新版GMP车间洁净度级别及监测

新版GMP车间洁净度级别及监测A级:高风险操作区,如灌装区、放置胶塞桶和与无菌制剂直接接触的敞口包装容器的区域及无菌装配或连接操作的区域,应当用单向流操作台(罩)维持该区的环境状态。
单向流系统在其工作区域必须均匀送风,风速为0.36-0.54m/s(指导值)。
应当有数据证明单向流的状态并经过验证。
在密闭的隔离操作器或手套箱内,可使用较低的风速。
B级:指无菌配制和灌装等高风险操作A级洁净区所处的背景区域。
C级和D级:指无菌药品生产过程中重要程度较低操作步骤的洁净区。
(1)空气悬浮粒子的级别为ISO 4.8,以≥5.0μm的悬浮粒子为限度标准。
B级洁净区(静态)的空气悬浮粒子的级别为ISO 5,同时包括表中两种粒径的悬浮粒子。
对于C级洁净区(静态和动态)而言,空气悬浮粒子的级别分别为ISO 7和ISO 8。
对于D级洁净区(静态)空气悬浮粒子的级别为ISO 8。
测试方法可参照ISO14644-1。
(2)在确认级别时,应当使用采样管较短的便携式尘埃粒子计数器,避免≥5.0μm 悬浮粒子在远程采样系统的长采样管中沉降。
在单向流系统中,应当采用等动力学的取样头。
(3)动态测试可在常规操作、培养基模拟灌装过程中进行,证明达到动态的洁净度级别,但培养基模拟灌装试验要求在“最差状况”下进行动态测试。
第十条应当按以下要求对洁净区的悬浮粒子进行动态监测:(一)根据洁净度级别和空气净化系统确认的结果及风险评估,确定取样点的位置并进行日常动态监控。
(二)在关键操作的全过程中,包括设备组装操作,应当对A级洁净区进行悬浮粒子监测。
生产过程中的污染(如活生物、放射危害)可能损坏尘埃粒子计数器时,应当在设备调试操作和模拟操作期间进行测试。
A级洁净区监测的频率及取样量,应能及时发现所有人为干预、偶发事件及任何系统的损坏。
灌装或分装时,由于产品本身产生粒子或液滴,允许灌装点≥5.0μm的悬浮粒子出现不符合标准的情况。
(三)在B级洁净区可采用与A级洁净区相似的监测系统。
除菌过滤系统验证方案

xxxxx制药有限公司GMP文献验证方案审批表除菌过滤系统验证方案验证方案目录1.概述2.验证目旳3.验证范畴4.验证部门职责5.采用旳文献5.1《中国药典》xxxx版x部xx页5.2药物生产质量管理规范(xxxx年修订)5.3药物生产验证指南(xxxx)5.4无菌制剂质量风险控制验证5.5原则操作程序5.6质量原则5.7检查原则操作程序5.8取样原则工作程序6. 生产操作过程简述7. 验证程序7.1除菌过滤系统验证7.2灭菌后产品检查除菌过滤系统验证方案1.概述xxxx注射剂是我公司生产近上市品种,也是药典品种,是用于xxx病、xxxxxx、xxxxxxx 等旳治疗旳一种液体制剂。
该产品旳特点是药效明确,药性稳定、安全。
确认除菌过滤0.22μm聚醚砜筒式滤芯,使微生物旳截留达到除菌过滤目旳,因此在该产品旳整体工艺设计上采用微生物残存概率百万分之一(SAL=10-6),并采用105℃、30分钟灭菌方式,使最后产品符合质量规定。
采用旳工艺方案流程如下:原料药→浓配液→稀配液→除菌过滤→灌装→轧盖→灭菌→成品附图(一)为此,验证小组对所用旳0.22μm聚醚砜筒式滤芯除菌过滤系统进行了验证,以保证按本工艺流程生产出来旳产品品质稳定、安全有效。
2.验证目旳除菌过滤系统在整个工艺流程中旳地位是极其重要旳,我们通过它来达到药液中除菌旳目旳。
这套系统自身旳合理性对产品质量保证也有重要影响。
因此,我们通过对该系统作前验证,来建立有科学根据,且有可靠质量保证旳过滤除菌系统,以维持全套工艺流程旳稳定性。
3.验证范畴:输液车间用于稀配岗位所用旳0.22μm除菌过滤系统。
4.验证部门职责:验证负责部门职责5.采用旳文献5.1《中国药典》xxxx年版x部xx页5.2药物生产质量管理规范(xxxx年修订)5.3药物生产验证指南(xxxx)5.4无菌制剂质量风险控制验证5.5原则操作程序5.6取样原则工作程序5.7检查原则操作程序6.验证需用旳硬件、软件6.1硬件6.1.1过滤系统设备及组件过滤系统组件及设备旳构成:6.2.1 工艺验证内容及可接受原则对本过滤系统工作旳验证,在内容上,重要涉及如下三部分内容:a.对微生物旳截留验证。
除菌过滤系统验证方案

除菌过滤系统验证方案1. 概述XXX剂是我公司获得“国家中药保护品种”称号的一种液体制剂。
该产品的特点是药效明确,药性稳定、安全、卫生、外观澄清。
因此在该产品的整体工艺设计上采用了非最终灭菌方式,并用棕色半透明塑料容器盛装。
我们拟采用的工艺方案如下:原药液→粗配液→精配液→除菌过滤→无菌灌装→成品。
为此,我们验证小组对所用的除菌过滤系统进行了验证,以确保按本工艺流程生产出来的产品品质稳定、安全卫生,且外观澄清度也符合规定。
1.1验证对象液体制剂车间配制岗位所用的除菌过滤系统,1.2验证方法我们采取前验证方法进行验证。
1.3验证目的除菌过滤系统在我们整个工艺流程中的地位是极其重要的,我们通过它来达到药液中除菌的目的。
这套系统本身的合理性对产品质量保证也有重要影响。
因此,我们通过对该系统作前验证,来建立有科学依据,且有可靠质量保证的过滤除菌系统,以维持全套工艺流程的稳定性。
2. 验证小组结构2.1参与部门生产部、质量保证部2.2 参与人员3. 验证需用的硬件、软件3.1硬件3.1.1过滤系统组件及设备过滤系统组件及设备的构成如下:3.1.2计量仪器一览表3.2工艺验证内容及可接受标准4. 验证过程对本过滤系统工作的验证,在内容上,主要包括以下四部分内容:a.对微生物的截留验证。
b.对有效成分的截留验证。
c.滤膜完整性验证起泡点试验。
d.可溶出成分的卫生安全性验证。
4.1对微生物的截留验证4.1.1验证目的用过滤含有定量指示细菌的培养基,模拟实际过滤工艺的方法来确认除菌过滤器的过滤能力。
4.1.2指示菌a. 缺陷假单孢菌ATCC19146(由上海第二医科大学科技发展有限公司提供),该菌平均直径0.3μm。
它不能穿透孔径为0.22μm的滤膜。
指示菌量=过滤器膜面积(㎝2)×107个/㎝2我们所用0.22μ聚醚砜滤芯的有效过滤面积为0.7㎡故所需指示菌量为:7000(㎝2)×107=7×1010个b. 由上海第二医科大学科技发展有限公司提供的缺陷假单孢菌规格为1010个/菌片,所以我们投入的指示菌量为七片菌片。
无菌制剂 第2版(药品gmp指南)过滤工艺

无菌制剂第2版(药品gmp指南)过滤工艺在药品生产过程中,无菌制剂的过滤工艺是至关重要的环节之一。
它涉及到的知识点很多,本文将重点介绍无菌制剂第2版(药品gmp 指南)中的过滤工艺,以帮助读者更好地了解这一领域。
一、过滤工艺简介过滤工艺是无菌制剂生产过程中的关键环节,其目的是去除溶液中的微粒、细菌等杂质,以确保产品质量和安全性。
根据药品生产质量管理规范(GMP)的要求,无菌制剂的过滤工艺必须遵循严格的操作规程和质量标准。
二、过滤介质的选择过滤介质是过滤工艺的核心部分,其选择直接影响到过滤效果和产品质量。
在无菌制剂的生产中,常用的过滤介质包括深层过滤介质、膜过滤介质等。
选择合适的过滤介质需要根据产品特性和生产工艺进行综合考虑。
三、过滤工艺流程无菌制剂的过滤工艺流程一般包括预处理、过滤和后处理三个阶段。
预处理的目的是去除溶液中的大颗粒杂质,以保证过滤介质的正常工作。
过滤阶段是整个流程的核心,通过过滤介质去除微粒、细菌等杂质。
后处理阶段则是对过滤后的溶液进行质量检测和清洁处理,以确保产品质量符合标准。
四、过滤工艺的质量控制质量控制是无菌制剂过滤工艺的重要环节,它涉及到生产过程中的各个环节。
首先,需要对过滤介质进行定期检测和维护,以保证其正常工作。
其次,需要对生产环境进行严格控制,确保无菌生产条件。
此外,需要对产品进行质量检测,包括微粒含量、细菌含量等方面的检测。
五、总结无菌制剂的过滤工艺是无菌制剂生产中的关键环节之一,其质量控制直接关系到产品的质量和安全性。
在实际生产中,我们需要根据产品特性和生产工艺选择合适的过滤介质和流程,并严格遵守操作规程和质量标准。
只有这样,才能确保无菌制剂的质量和安全性,为患者提供安全有效的药品。
新版GMP对工艺验证要求及思路

新版GMP对工艺验证要求及思路内容工艺验证的新思路工艺验证的新思路工艺验证应当证明一个生产工艺按照规定的工艺参数能够持续生产出符合预定用途和注册要求的产品。
中国2010版收集并评估从工艺设计阶段一直到商业化生产的数据用这些数据确立科学证据证明该工艺能够始终如一地生产出优质产品。
FDA2011书面化的证据证明工艺在所建立的参数范围内能有效和重复生产出符合预期标准和质量属性的医药产品。
EU2001规定的工艺能始终如一地生产出符合预期标准和质量属性的产品。
PIC/S2001确认的定义证明厂房、设施、设备能正确运行并可达到预期结果的一系列活动。
验证的定义证明任何操作规程或方法、生产工艺或系统能够达到预期结果的一系列活动。
第一百三十八条企业应当确定需要进行的确认或验证工作以证明有关操作的关键要素能够得到有效控制。
确认或验证的范围和程度应当经过风险评估来确定。
第一百三十九条企业的厂房、设施、设备和检验仪器应当经过确认应当采用经过验证的生产工艺、操作规程和检验方法进行生产、操作和检验并保持持续的验证状态。
第一百四十条应当建立确认与验证的文件和记录并能以文件和记录证明达到以下预定的目标一设计确认应当证明厂房、设施、设备的设计符合预定用途和本规范要求二安装确认应当证明厂房、设施、设备的建造和安装符合设计标准三运行确认应当证明厂房、设施、设备的运行符合设计标准四性能确认应当证明厂房、设施、设备在正常操作方法和工艺条件下能够持续符合标准五工艺验证应当证明一个生产工艺按照规定的工艺参数能够持续生产出符合预定用途和注册要求的产品。
第一百四十一条采用新的生产处方或生产工艺前应当验证其常规生产的适用性。
生产工艺在使用规定的原辅料和设备条件下应当能够始终生产出符合预定用途和注册要求的产品。
第一百四十二条当影响产品质量的主要因素如原辅料、与药品直接接触的包装材料、生产设备、生产环境或厂房、生产工艺、检验方法等发生变更时应当进行确认或验证。
药厂滤芯GMP认证简介

• 2.药品生产质量管理规范(2010年修订) • • 2011年3月1日后新建的药企应符合新版 GMP要求; • • 现有药品生产企业无菌药品的生产,应在 2013年12月31 • 日前达到新版GMP要求; • • 其他类别药品的生产则均应在2015年12月 31日前实现。 • • 滤芯验证既工艺认证既模拟最差的工艺条 件
五.4除菌过滤器的重复使用
• • 过滤器的使用者首先需要参考生产商提供的 使用手册,重点考 • 虑过滤器可以耐受的累积灭菌周期和正确的灭 菌操作过程,防 • 止因为过滤器超限度使用而危害无菌生产过程。 使用者应当根 • 据具体的使用工艺要求进行风险评估和选择。 • • 不管是药液过滤,生产用气体过滤,呼吸器 滤芯都建议一次性 • 使用,若需要重复使用,则需要说明理由既验 证
四.6各种滤芯测试方法
• • • • • • 聚四氟乙烯滤芯 • 聚醚砜滤芯 • 聚偏二氟乙烯滤芯 • 尼龙滤芯 • 聚丙烯滤芯
滤芯选型及泡点参数
• • • • • • • • • • 常用滤芯的泡点值: 名称扩散流泡点适用工艺 0.22um聚醚砜≥0.35MPa 终端除菌 0.45um聚醚砜≥0.24MPa 除菌预过滤 0.22um尼龙≥0.30MPa 终端除菌 0.45um尼龙≥0.18MPa 除菌预过滤 0.22um亲水性聚四氟乙烯≥ 0.35MPa 终端除菌 (介质为纯水测试) 0.22um聚四氟乙烯≥0.07MPa(以95%乙醇为测试液) 空气除菌过滤或水浸入法(介质为纯水测试)
• • • • • • • • • • • • • •
• 第五十七条应当尽可能缩短药液从开始配置到灭菌(或除菌过滤) 的间隔时间。应当根据产品的特性及贮存条件建立相应的间隔时间控 制标准。 • 第六十二条可采用湿热、干热、离子辐射、环氧乙烷或过滤除菌 的方式进行灭菌。每一种灭菌方式都有其特定的适用范围,灭菌工艺 必须与注册批准的要求相一致,且应当经过验证。 • 第六十三条任何灭菌工艺在投入使用前,必须采用物理检测手段 和生物指示剂,验证其对产品或物品的适用性及所有部位达到了灭菌 效果。 • 第六十四条应当定期对灭菌工艺的有效性进行再验证(每年至少 一次)。设备重大变更后,须进行再验证。应当保存再验证记录。 • 第九十八条纯化水、注射用水储罐和输送管道所用材料应当无毒、 耐腐蚀;储罐的通气口应当安装不脱落纤维的疏水性除菌滤器;管道 的设计和安装应当避免死角、盲管。
解读新版GMP对原料药工艺设备的要求

解读新版GMP对原料药工艺设备的要求0引言原料药是指药品在进一步加工成针剂、片剂、胶囊等注射或口服剂型前的药品主要成分,原料药包括化学合成药物及生物化学制品等。
原料药的生产是集化学制药工艺、生物制药工艺、化工机械、自动控制、计算机过程控制技术、微生物学等专业于一体的一个多学科、多专业交叉行业。
原料药品种众多,其生产方法也各不相同,有全合成、半合成、生物发酵技术、提取技术等。
为保证生产的原料药质量不受加工过程的影响,对有关生产装备及过程需要有特殊的设施及要求,以保证药品在加工过程中,这些装备及设施不会带来杂质及污染。
作为生产原料药的主要工艺设备,一般有如下特点:(1)生产流程长,工艺复杂,设备种类多;(2)每一产品所需的原辅材料种类多,许多原料和生产过程中的中间体是易燃、易爆、有毒或腐蚀性很强的物质,对防火、防爆、劳动保护以及设备等方面有严格的要求;(3)产品质量标准高(纯度高、杂质可允许的含量极微、无菌要求),对原料和中间体要严格控制其质量,对设备要求其密闭生产、高效、多功能、提高连续性和自动化水平,从而减少杂质及微生物的污染;(4)要求设备或系统具有优异的废物处理或环保方面的性能。
2010版GMP 大幅提高了对原料药特别是无菌原料药生产的控制要求,对生产设备的要求也有很大提高,本文将对原料药主要生产设备进行讨论[1]。
1典型原料药设备概述由于原料药的生产与化工单元操作十分类似,相关的工艺设备原理也基本一致,只是由于GMP的要求,对工艺设备在可清洁性、密闭性、材质和参数的控制精度上要求更高。
根据原料药生产的各个单元操作,原料药工艺设备分类叙述如下[2]:1.1用于合成反应、发酵、提取、结晶、计量与物料储存的设备发酵罐、反应罐、提取罐、结晶罐、储罐、计量罐等都属于上述设备。
解读新版GMP对原料药工艺设备的要求张志峰黄曙光何云龙(奥星制药设备(石家庄)有限公司,河北石家庄050000)摘要:对典型的原料药设备进行了详细的阐述,并结合新版GMP对无菌原料药工艺设备的特殊要求,为原料药设备的设计、选型提供了借鉴。
《化学药品注射剂灭菌无菌工艺研究及验证指导原则》

化学药品注射剂灭菌/无菌工艺研究及验证指导原则目录一、概述 (3)二、注射剂湿热灭菌工艺 (4)(一)湿热灭菌工艺的研究 (4)1.湿热灭菌工艺的确定依据 (4)2.微生物污染的监控 (7)(二)湿热灭菌工艺的验证 (9)1.物理确认 (9)2.生物学确认 (13)3.基于风险评估的验证方案设计 (16)三、注射剂无菌生产工艺 (16)(一)无菌生产工艺的研究 (16)1.除菌过滤工艺的研究 (16)2.无菌分装工艺的研究 (18)(二)无菌生产工艺的验证 (18)1.除菌过滤工艺验证 (19)2.无菌工艺模拟试验 (21)1/ 29四、附件 (24)五、参考文献 (27)2/ 291一、概述2无菌药品是指法定药品标准中列有无菌检查项目的制3剂和原料药,一般包括注射剂、无菌原料药及滴眼剂等。
4从严格意义上讲,无菌药品应不含任何活的微生物,但由5于目前检验手段的局限性,绝对无菌的概念不能适用于对6整批产品的无菌性评价,因此目前所使用的“无菌”概念,7是概率意义上的“无菌”。
特定批次药品的无菌特性只能通8过该批药品中活微生物存在的概率低至某个可接受的水平,即无菌保证水平(Sterility Assurance Level, SAL)来表征,910而这种概率意义上的无菌需通过合理设计和全面验证的灭11菌/除菌工艺过程、良好的无菌保证体系以及在生产过程中12执行严格的药品生产质量管理规范(GMP)予以保证。
13本指导原则主要参考国内外相关技术指导原则和标准14起草制订,重点对注射剂常用的灭菌/无菌工艺,即湿热灭15菌为主的终端灭菌工艺(terminal sterilizing process)和无16菌生产工艺(aseptic processing)的研究和验证进行阐述,17旨在促进现阶段化学药品注射剂的研究和评价工作的开展。
18本指导原则主要适用于无菌注射剂申请上市以及上市后变19更等注册申报过程中对灭菌/无菌工艺进行的研究和验证工作,相关仪器设备等的验证及常规再验证不包括在本指2021导原则的范围内。
药品生产质量管理规范(新版GMP)附录:无菌药品

药品生产质量管理规范(新版GMP)附录:无菌药品第一章范围第一条无菌药品是指法定药品标准中列有无菌检查项目的制剂和原料药,包括无菌制剂和无菌原料药。
第二条本附录适用于无菌制剂生产全过程以及无菌原料药的灭菌和无菌生产过程。
第二章原则第三条无菌药品的生产须满足其质量和预定用途的要求,应当最大限度降低微生物、各种微粒和热原的污染。
生产人员的技能、所接受的培训及其工作态度是达到上述目标的关键因素,无菌药品的生产必须严格按照精心设计并经验证的方法及规程进行,产品的无菌或其它质量特性绝不能只依赖于任何形式的最终处理或成品检验(包括无菌检查)。
第四条无菌药品按生产工艺可分为两类:采用最终灭菌工艺的为最终灭菌产品;部分或全部工序采用无菌生产工艺的为非最终灭菌产品。
第五条无菌药品生产的人员、设备和物料应通过气锁间进入洁净区,采用机械连续传输物料的,应当用正压气流保护并监测压差。
第六条物料准备、产品配制和灌装或分装等操作必须在洁净区内分区域(室)进行。
第七条应当根据产品特性、工艺和设备等因素,确定无菌药品生产用洁净区的级别。
每一步生产操作的环境都应当达到适当的动态洁净度标准,尽可能降低产品或所处理的物料被微粒或微生物污染的风险。
第三章洁净度级别及监测第八条洁净区的设计必须符合相应的洁净度要求,包括达到“静态”和“动态”的标准。
第九条无菌药品生产所需的洁净区可分为以下4个级别:A级:高风险操作区,如灌装区、放置胶塞桶和与无菌制剂直接接触的敞口包装容器的区域及无菌装配或连接操作的区域,应当用单向流操作台(罩)维持该区的环境状态。
单向流系统在其工作区域必须均匀送风,风速为0.36-0.54m/s(指导值)。
应当有数据证明单向流的状态并经过验证。
在密闭的隔离操作器或手套箱内,可使用较低的风速。
B级:指无菌配制和灌装等高风险操作A级洁净区所处的背景区域。
C级和D级:指无菌药品生产过程中重要程度较低操作步骤的洁净区。
以上各级别空气悬浮粒子的标准规定如下表:新版GMP附录无菌药品注:(1)为确认A级洁净区的级别,每个采样点的采样量不得少于1立方米。
除菌过滤器的验证要求

除菌过滤器的验证要求细菌的去除性能FDA将除菌级过滤器定义为“当过滤器用不小于107/cm2个缺陷假单胞菌(Brevundimonas diminuta ATTC 19146)进行过滤挑战试验时,下游滤过液被证明是无菌。
”除菌过滤器必须首先符合FDA这一要求,而且必须模拟实际生产中最恶劣的条件,即挑战到细菌堵塞过滤器(压差大于0.35MPa),这样的过滤器就是通常所说的0.2um 或0.22um除菌过滤器。
完整性测试除菌过滤器必须可以进行非破坏性完整性试验,FDA建议过滤前后都要进行,而所用完整性试验数据标准必须与过滤器破坏性试验,如细菌挑战试验相关联,并留有足够的安全系数,扩散流,起泡点,水侵入法,压力衰减试验都是FDA容许的完整性试验方法。
过滤操作条件确定保持除菌性能时,最恶劣的操作条件,即最高最低操作温度,压力,粘度,pH,离子强度等。
过滤器所有材质过滤器所用材料,如滤膜,保护罩,支撑无纺布,密封圈等需符合USP Class Ⅵ121℃塑料生物安全性试验标准。
颗粒清洁度过滤器需用注射用水冲洗后符合美国药典(United States Pharmacopeia,USP)颗粒清洁度的要求,无纤维脱落。
溶剂萃取物用有关溶剂萃取后,萃取后需符合USP关于氧化物含量的要求。
过滤器消毒批次记录必须保证易于进行工艺追踪和质量控制。
除菌过滤器的验证程序(1)确定过滤产品的目标品种确认过滤前常见细菌类型,微生物含量,颗粒含量,过滤后目标是无菌,无颗粒(或无支原体,无病毒等)(2)确定过滤产品的生产工艺及物理化学参数。
如pH,粘度,温度,表面张力,离子强度及变化范围等。
每一批次液体批量,处理时间,过滤器入口压力,过滤器出口压力等。
(3)所选过滤器的评价除菌过滤器评价项目基本上是根据过滤器供货商提供的数据(一般以验证指南Validation Guide 或产品介绍形式提供)进行,其内容包括:a.材料的安全性;b.液体中细菌挑战试验数据;c.完整性测试方法及标准值;d.消毒条件(方法,温度及时间等);e.使用条件(最高容许压力,化学兼容性);f.最终试验证书。
欧盟GMP附录-对除菌过滤的14条要求

欧盟GMP附录.对除菌过滤的14条要求本文对欧盟GMP附录《无菌药品生产》中除菌过滤相关的条款进行了总结,其中液体除菌过滤方面有14条要求,如下:1、如果产品不能在其最终容器中进行灭菌,则溶液或液体应通过除菌级过滤器(最大孔径0.22 μm,经过适当验证能得到无菌滤液)过滤进行灭菌,然后无菌灌装到预先灭菌的容器中。
所选择的过滤器应确保与产品相容并符合上市许可。
延伸:选择除菌过滤的前提条件是一一产品不能进行最终灭菌。
选择的除菌滤器,其相容性需要经过确认。
2、可在整个生产过程的多个环节使用预过滤器和/或除菌级过滤器,以确保在最终除菌过滤器前液体中的微生物限度低且受控。
由于除菌过滤工艺和其他灭菌工艺相比有潜在的额外风险,应通过除菌滤器进行额外过滤,且应尽可能靠近灌装点,过滤工艺应被视为污染控制策略(CCS)的一部分。
延伸:最终除菌过滤前需要取样测试待过滤液体的微生物限度,应低于IOCFU/IOOmL最终除菌过滤应尽可能靠近分装点,同时在污染控制策略中应描述产品最终除菌过滤的位置及选择依据。
当由于特殊原因不能在分装前设置除菌过滤时(比如:添加佐剂的疫苗或除菌过滤大幅降低活性蛋白时..),应有对应的分析及研究以支持相应的工艺。
3、过滤系统组件的选择及其在过滤系统内的互连和布置,包括预过滤器,应基于产品的关键质量属性,并经过论证和记录。
过滤系统应尽量减少纤维和颗粒的产生,不会导致或产生不可接受的杂质,不能有改变产品质量和功效的特性。
同样,过滤器特性应与液体相容,且不受待过滤产品的不利影响。
应评估产品成分的吸附和过滤器成分的提取/浸出。
延伸:过滤系统应根据在工艺中接触溶液的特点进行评估,以选择可提取物测试、吸附性、浸出物测试、兼容性的测试范围,通常接触产品活性成分的滤器应进行浸出物测试及吸附性测试,如果仅接触其他溶液,应考虑进行可提取物测试。
同时,还要考虑滤器是否会引入其他杂质。
4、过滤系统的设计要点:允许在经过验证的工艺参数范围内操作。
新GMP下的液体除菌过滤解决方案

本文通过比较中外GMP法规要求,将新版GMP对液体除菌过滤的相关规定概况为四个方面,并提出解决方案;对目前业界广泛关注的相关除菌过滤(器)的相关验证工作,也在文章中进行了详细的陈述和列示。
新版GMP(GMP(2010))相比GMP(98)在很多方面,对制药生产中的硬件设置、软件管理和人员培训,都提出了更高的要求;而且,因为新版GMP也在很大程度上参照了欧盟和WHO(世界卫生组织)的GMP,因而称其为“国际接轨"的GMP也是恰当的.严格意义上的液体“除菌过滤”工艺,即指因为产品具有不稳定性,不能采用包括热灭菌在内的、被监管部门认可的最终灭菌方法,而采用过滤除菌的方法,并要求滤出液无菌的工艺过程。
因其在无菌保障方面固有的高风险性,新版GMP与国际药品生产监管法规一样,对除菌过滤给予了高度关注。
本文将通过比较中外GMP法规要求,将新版GMP对液体除菌过滤的相关规定概况为四个方面,并提出解决方案;对目前业界广泛关注的相关除菌过滤(器)的相关验证工作,也会在文章后半部分,就应当考虑的项目,进行比较详细的陈述和列示。
灭菌方法决策和除菌过滤的固有风险目前中国和西方医药监管部门,在总结长期制药实践经验的基础上,对各种认可的药品灭菌方法进行了规定,并对制药企业应当如何进行选择,在基于风险的原则上,提出了决策判断的顺序和原则。
新版GMP在“附录1无菌药品”中设置了“第十一章灭菌工艺”,其中第六十二条规定:“可采用湿热、干热、离子辐射、环氧乙烷或过滤除菌的方式进行灭菌。
”该条的规定,明确了“除菌过滤”是一种可选择的灭菌方法,并且也在此条中对附录1中后续行文提到“灭菌方式”和“灭菌工艺”时的范围,进行了规定。
有关上述灭菌方法在制药实践中的选择顺序,新版GMP附录1第六十一条规定:“无菌药品应当尽可能采用加热方式进行最终灭菌,……”,欧盟GMP附录1“无菌药品的生产”第83条,有相同的表述。
在其后“第十二章灭菌方法”中,新版GMP的编排就是按照从湿热灭菌、干热灭菌、辐射灭菌、环氧乙烷灭菌到过滤除菌的顺序依次进行的,也与欧盟GMP附录1的编排顺序一致。
除菌过滤验证的技术要求

除菌过滤验证的技术要求【技术要求】A. 除菌级过滤器的细菌截留验证细菌挑战实验验证过滤器滤膜的级别并采用有代表性的挑战微生物证明其从某产品或该产品家族中完全去除微生物。
除菌级过滤器的验证需要考虑两个主要因素:●滤膜级别,使用可适用的标准化试验或类似的方法以细菌挑战的方式进行。
●工艺验证,由过滤器的使用者或指派的实验设施(例如,过滤器的生产者或合同实验室),使用有代表性的微生物进行挑战,证明过滤器在生产条件下,可以完全去除每个产品或产品家族中的微生物。
应建立针对每个产品组的科学解释并可能需要在实施验证前经合适的监管机构审查。
这两种过滤器测试理念是不能互换的,并应当被独立验证。
这些测试的目的是为了证明过滤生产过程产生无菌的滤出液。
B. 影响细菌截留的因素应对可能影响细菌截留的因素进行风险评估,包括但不限于:(1)过滤器源的因素,包括过滤器类型、结构、基础聚合物、表面改性化学、孔径分布和过滤膜的厚度等。
(2)工艺源的因素生产工艺、产品或者料液对挑战微生物的生存性、理化形态的影响;实际微生物污染水平决定缺陷假单胞菌是否可以作为相关微生物;产品或者软磁材料料液中的实际微生物污染水平(是否低于10CFU/100ml)影响过滤除菌工艺的设计和效能;还应考虑潜在的因产品配方或工艺条件,影响微生物的细胞大小或其它生理和形态学特性,从而造成微生物穿透的情况。
应考虑评估的工艺源因素:●流体组分(配方、表面活性剂、添加剂)●流体性质(pH值、粘度、渗透压,离子强度)●工艺条件(时间、温度、压差、流速、灭菌方法和重复使用)●产品、料液和生产环境中实际微生物污染的特点和水平C. 气体除菌过滤器对于气体除菌过滤器的细菌截留要求,尚没有统一的标准。
但是,液体细菌挑战被认为是气体除菌过滤器的“最差条件”,因而,参照液体除菌级过滤器执行的细菌截留验证是被广泛接受的。
其它可以选择的方法,包括细菌(孢子)气溶胶挑战和噬菌体/病毒气溶胶挑战试验。
新版GMP对除菌过滤的要求

新版GMP对除菌过滤的要求新版GMP对除菌过滤的要求和相关解决⽅案灭菌⽅法的选择(⼀)新版GMP§附录1 ⽆菌药品§第⼗⼀章灭菌⼯艺§第六⼗⼀条⽆菌药品应当尽可能采⽤加热⽅式进⾏最终灭菌,最终灭菌产品中的微⽣物存活概率(即⽆菌保证⽔平,SAL)不得⾼于10-6。
采⽤湿热灭菌⽅法进⾏最终灭菌的,通常标准灭菌时间F0值应当⼤于8分钟,流通蒸汽处理不属于最终灭菌。
§对热不稳定的产品,可采⽤⽆菌⽣产操作或过滤除菌的替代⽅法灭菌⽅法的选择(⼆)新版GMP附录1 ⽆菌药品第七⼗五条§(⼀)可最终灭菌的产品不得以过滤除菌⼯艺替代最终灭菌⼯艺。
如果药品不能在其最终包装容器中灭菌,可⽤0.22µm(更⼩或相同过滤效⼒)的除菌过滤器将药液滤⼊预先灭菌的容器内。
由于除菌过滤器不能将病毒或⽀原体全部滤除,可采⽤热处理⽅法来弥补除菌过滤的不⾜。
§(⼆)应当采取措施降低过滤除菌的风险。
宜安装第⼆只已灭菌的除菌过滤器再次过滤药液,最终的除菌过滤滤器应当尽可能接近灌装点除菌过滤的使⽤(⼀)新版GMP附录1 ⽆菌药品§第五⼗⼋条应当根据所⽤灭菌⽅法的效果确定灭菌前产品微⽣物污染⽔平的监控标准,并定期监控。
必要时,还应当监控热原或细菌内毒素。
欧盟GMP§80. 灭菌之前应当监测微⽣物污染⽔平。
应当建⽴与所使⽤⽅法效率相关的,灭菌之前的污染限值。
对于⽆菌灌装产品和最终灭菌产品均应按批进⾏微⽣物污染⽔平分析§7. Special Items (特别事项)对于过滤灭菌⽽⾔,必须在申请⽂件中注明过滤之前容许的微⽣物污染⽔平的最⼤值。
⼤多数情况下,药品中可以接受的⽔平为10 CFU/100 ml,取决于待过滤药品体积与过滤器直径的相对⽐例。
如果达不到上述要求,有必要利⽤细菌截留过滤器进⾏预过滤,以达到⾜够低的微⽣物污染⽔平。
除菌过滤的使⽤(⼆)新版GMP附录1 ⽆菌药品§第五⼗七条应当尽可能缩短药液从开始配制到灭菌(或除菌过滤)的间隔时间。
除菌过滤系统验证方案及报告

1概述:注射剂生产中常用的微孔滤膜过滤器有两种:圆盘形过滤器和圆筒形过滤器,我公司生产中使用的滤器为圆筒形微孔滤膜过滤器,圆筒形过滤器滤膜的材料为聚砜,孔径分别为0.22um和0.45um,0.45um滤膜用于去除微粒,0.22um用于去除细菌。
本验证针对0.22um微孔滤膜过滤器进行除菌过滤系统去除微生物的能力确认,方案是在所有仪器经过校验,软硬件均符合GMP生产要求的基础上、在10000级HAVC系统环境下进行的。
为了保证无菌,我厂采用多级串联的方式进行除菌过滤。
无菌过滤器去除微生物的能力须用平均直径为0.3um的缺陷假单孢菌进行挑战性试验来证实。
2范围:无菌灌装制剂车间配置岗位所用的除菌过滤系统。
3目的:对该系统作前验证,来建立有科学依据,且有可靠质量保证的过滤除菌系统,以维持全套工艺流程的稳定性。
4职责:验证小组:负责验证方案的审批,验证数据及结果的审核,验证报告的审批,发放检验证证书。
质保部:负责起草验证方案,验证的协调工作,以保证按本验证方案规定项目顺利进行,建立设备档案。
质检科:负责取样,检验并根据检验结果填写记录,出具验证报告,报验证委员会批准,检验用仪器、仪表校正。
生产部:负责验证方案、验证报告的会审会签,配合动力设备部及指导针剂制剂车间完成有关验证工作。
设动部:参加会签验证方案、验证报告,负责设备的安装调试及仪器、仪表的校正,并做好相应记录,起草设备的使用、维护保养操作规程车间:负责配制间洁工作,安装环境符合设计要求,起草设备清洁标准操作规程,配合好动力设备部实施好各项验证工作。
5过程对本过滤系统工作的验证,主要包括以下两部分内容:滤膜气泡点试验,微生物挑战试验。
5.1滤膜完整性验证为增加流通量,过滤芯子要用表成张力较低的液体“预湿润”。
尽管湿润可能要增大压力强制进行,但为了安全,不使滤膜破损及保证充分湿润,滤芯还是应该预先浸湿。
压力表1外壳滤芯排污阀阀门21缓慢加压到0.31kg/cm2,控制30s,观察滤器的气泡处。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
分类
测试名称
测试实施者
破坏性
细菌挑战测试
起泡点测试,扩散测试 ,保压实验,水侵入法
制造商
非破坏性
制造商及使用者
现代中药制药论坛搜集
应该在什么时候做完整性测试?
n
灭菌前?
n
灭菌后,过滤前使用前?
n
过滤后?
什么时候检测完整性?
现代中药制药论坛搜集
预过滤 澄清过滤
培养基预过 滤及除菌过 滤
除菌过滤
大/小容量注射剂 LVP and SVP
现代中药制药论坛搜集
预过滤
除菌过滤
API原料药
现代中药制药论坛搜集
N FF - Sterilization
气体除菌
澄 N FF - B ulk 清过滤
5
根据过滤阶段
现代中药制药论坛搜集
孔径逐渐减小的过滤系 列
澄清
在过滤系列开始是最大 的过滤容量
预滤
在过滤系列终端是最大 的过滤截留率
除菌
3 根据过滤阶段 Filtration stage
现代中药制药论坛搜集
主要除菌过滤器应该放在无菌区还是有菌区?
第七十五条 非最终灭菌产品的过滤除菌应当符合以下要 求: (一)可最终灭菌的产品不得以过滤除菌工艺替代最终灭 菌工艺。如果药品不能在其最终包装容器中灭菌,可用 0.22μm(更小或相同过滤效力)的除菌过滤器将药液 滤入预先灭菌的容器内。由于除菌过滤器不能将病毒或 支原体全部滤除,可采用热处理方法来弥补除菌过滤的 不足。
19:54
产品是否可以121℃湿热灭菌15分钟
否 是
产品是否可以湿热灭菌F0≥8 分钟,达到SAL≤10-6
否 是
(一)使用高压 灭菌锅121℃15 分钟 (二)使用湿 热灭菌F0≥8 分钟 (三)无菌过滤 和无菌加工结合 使用
产品处方是否可以通过微生 物滞留过滤器过滤
否 是
(四)使用无菌组分 配制和灌封
BP = ----------------d 这里 k =形状校正因子 γ = 表面张力 θ = 接触角 d = 孔径
P1 Air
σ θ
P2 d Water
测试起泡点的方法
现代中药制药论坛搜集
冲洗
加压
增加压力直到连续起泡在下游出现
扩散流检测原理
现代中药制药论坛搜集
Sterile Gas Filter
P1 P2
F1 “Redundant”
F2 “Primary”
P3
Filling Line Waste Line
Drug Product Flow
16
现代中药制药论坛搜集
19:54
第十二章 灭菌方法
第七十五条 非最终灭菌产品的过滤除菌应当符合以下要 求: (二) 应采取措施降低过滤除菌的风险。宜安装第二个 已灭菌的除菌过滤器再次过滤药液,最终的除菌过滤滤 器应尽可能接近灌装点。
PDA Technical Report n° 26 PDA技术报告26号
“... It generally is regarded as a cGMP requirement that filters or filter systems routinely be integrity tested both prior to and after use.“ use 一般认为过滤前后的常规性完整性检测是现行GMP的要求. EU GMP “The integrity of the sterilised filter should be verified before use and should be confirmed immediately after use by an appropriate method such as bubble point, diffusive flow or pressure hold test.”对于已灭菌的滤器的完整性检测应该 test 在使用前和使用后立即执行,例如泡点,扩散流及压力保持试验.
17
现代中药制药论坛搜集
19:54
冗余过滤的设计
快捷方式 到 过滤设计 Application_book_1_10_2004.ppt.lnk
18
现代中药制药论坛搜集
19:54
第十二章 灭菌方法
第七十五条 非最终灭菌产品的过滤除菌应当符合以下要 求: (三)除菌过滤器使用后,必须采用适当的方法立即对其 完整性进行检查并记录。常用的方法有起泡点试验、扩 散流试验或压力保持试验。
第十二章 灭菌方法
第七十五条 非最终灭菌产品的过滤除菌应当符合以下要 求: (二) 应采取措施降低过滤除菌的风险。宜安装第二个 已灭菌的除菌过滤器再次过滤药液,最终的除菌过滤滤 器应尽可能接近灌装点。
14
什么是双级过滤?什么是冗余过滤?
Bioburden reduction
现代中药制药论坛搜集
起泡点测试原理
现代中药制药论坛搜集
起泡点是气体从湿润的最大膜孔快速流 出的压力
压力
σ θ
P2 d Water
空气
起泡点显示过滤结构内保持液体的力的 大小
最传统的非破坏性测试
现代中药制药论坛搜集
起泡点等式
起泡点可表达为:
4 . k . γ . cos θ
FDA对无菌过滤工艺的指南
“Normally, integrity testing of the filter is performed prior to processing, after the filter apparatus has already been assembled and sterilized.” 正常情况下, 滤器应在过滤前,即组装好后,且灭菌后执行完整性检测. “It is important that the integrity testing be conducted after filtration to detect any filter leaks or perforations that might have occurred during the filtration.”非常重 要的是:在过滤后对滤器进行完整性检测,从而查看滤器是否泄漏和膜已破损.
Binding吸附
FTIR R eference Spectrum of Polycarbonate
现代中药制药论坛搜集
19:54
新版GMP对除菌过滤 工艺及验证的要求
1
现代中药制药论坛搜集
19:54
第十二章 灭菌方法
第七十五条 非最终灭菌产品的过滤除菌应当符合以下要 求: (一)可最终灭菌的产品不得以过滤除菌工艺替代最终灭 菌工艺。如果药品不能在其最终包装容器中灭菌,可用 0.22μm(更小或相同过滤效力)的除菌过滤器将药液 滤入预先灭菌的容器内。由于除菌过滤器不能将病毒或 支原体全部滤除,可采用热处理方法来弥补除菌过滤的 不足。
施 加 压 力
P1 Air
σ θ
P2 d Wate r L L
P0 P A
扩散流测试方法
现代中药制药论坛搜集
上游压力
压缩空气
下游监测气流速度
侵入法
现代中药制药论坛搜集
2.6
2.6
2.6
2.6
0
bar
0
bar
0
bar
0
bar
P atm
4
现代中药制药论坛搜集
19:54
第十二章 灭菌方法
第七十五条 非最终灭菌产品的过滤除菌应当符合以下要 求: (一)可最终灭菌的产品不得以过滤除菌工艺替代最终灭 菌工艺。如果药品不能在其最终包装容器中灭菌,可用 0.22μm(更小或相同过滤效力)的除菌过滤器将药液 滤入预先灭菌的容器内。由于除菌过滤器不能将病毒或 支原体全部滤除,可采用热处理方法来弥补除菌过滤的 不足。
19:54
Sterilizing filtration
P 1
P 1
NMT 10 cfu / 100 ml
P 1
P 1
P 1
P 2
Redundant
As required
P 1
P 1
P 2
In series
As required
15
冗余过滤
现代中药制药论坛搜集
19:54
C larificatio n
预C larificatio n 过滤
N FF - S olven t
种子培养 entor Ferm
Seed
发
Ferm entor
酵
有机溶剂萃取 Extraction
Solvent
层 析/活性碳/溶剂沉淀
N FF预过滤 C larificatio n
预 larificatio n 过滤 C
n
n
n
n
根据过滤阶段
现代中药制药论坛搜集
n
坚强,硬不易碎,更薄 曲折的通道 65%-75%开孔率 大小排除-颗粒截流与流速和压力无关 无菌过滤器必须具有大于99.99999%截流
n
n
n
n
0.22um的意义
现代中药制药论坛同灭菌工艺的无菌保证能力
过度杀 灭法 残存概 率法 流通蒸 汽法 除菌 过滤法 Fo>12 10-6 Fo>8 10-6
现代中药制药论坛搜集
热稳定性好的产品 以杀灭微生物作为实现无菌的手段 热稳定性一般产品 工艺过程将防止产品被耐热菌污染放在首位, 而不是仅依赖最终灭菌去消除污染
10
根据过滤阶段
现代中药制药论坛搜集
n
可能有纤维脱落 截留率小于95% 厚度(3-30毫米),通常有吸附 较大的承污能力 例如-玻璃纤维,线绕式,压板式 压力承载范围
