2013年九年级化学下册 第九单元 课题1 饱和溶液教学课件 新人教版(新课标)
合集下载
初中化学人教九年级下册第九单元 溶液 - 溶液的形成PPT

+
溶剂
胶体
浊液
特点:
不分散的随意相混
不均一、不稳定
以分子形式分散
溶质微粒直径<1nm
以阴阳离子形式分散
分散质微粒直径1~100nm
悬浊液
乳浊液
分散质微粒直径>100nm
振荡
纯净物
溶液
物质
混合物
→
特点:
……
均一、稳定
水+油
静置
P31
→
乳浊液
固体小颗粒分散到液体里形成的混合物
胶体
。
分散系
(如:泥水)
悬浊液
(先脱水CuSO4·5H2O = CuSO4+5H2O,再以Cu2+、SO42—形式分散)
♥我会说~~~
溶液
硫酸铜溶液
溶质
CuSO4
溶剂
H 2O
已知溶液溶质&溶剂
双氧水
已知溶质&溶剂溶液
石灰水
75%酒精
硝酸
H2O2 Ca(OH)2 C2H5OH HNO3
H 2O
H 2O
H 2O
H 2O
I2的CCl4溶液
分层
分层
水和植物油中
加2-3滴洗涤剂
分层
不分层
静置后
倒出液体试管
是否干净
分层
不干净
不分层
比较干净
✌乳化现象
洗涤剂去油污 — 乳化作用 (形成乳浊液)
植物油
和水
(大油滴)
洗涤剂
乳化作用
(乳浊液)
【不均一、不稳定,要分层】
原理:将大
油滴分散成
小油滴
能用水冲
洗干净
溶剂
胶体
浊液
特点:
不分散的随意相混
不均一、不稳定
以分子形式分散
溶质微粒直径<1nm
以阴阳离子形式分散
分散质微粒直径1~100nm
悬浊液
乳浊液
分散质微粒直径>100nm
振荡
纯净物
溶液
物质
混合物
→
特点:
……
均一、稳定
水+油
静置
P31
→
乳浊液
固体小颗粒分散到液体里形成的混合物
胶体
。
分散系
(如:泥水)
悬浊液
(先脱水CuSO4·5H2O = CuSO4+5H2O,再以Cu2+、SO42—形式分散)
♥我会说~~~
溶液
硫酸铜溶液
溶质
CuSO4
溶剂
H 2O
已知溶液溶质&溶剂
双氧水
已知溶质&溶剂溶液
石灰水
75%酒精
硝酸
H2O2 Ca(OH)2 C2H5OH HNO3
H 2O
H 2O
H 2O
H 2O
I2的CCl4溶液
分层
分层
水和植物油中
加2-3滴洗涤剂
分层
不分层
静置后
倒出液体试管
是否干净
分层
不干净
不分层
比较干净
✌乳化现象
洗涤剂去油污 — 乳化作用 (形成乳浊液)
植物油
和水
(大油滴)
洗涤剂
乳化作用
(乳浊液)
【不均一、不稳定,要分层】
原理:将大
油滴分散成
小油滴
能用水冲
洗干净
九年级下册化学饱和溶液.ppt
单位:克
一定温度下,某固体物质在100克溶剂(通常溶剂是水) 中达到饱和状态时所溶解的质量,就叫做这种溶质在这 种溶剂中的溶解度。
例:蔗糖在20℃时的溶解度是203.9g。
在20℃时,100g水中溶解203.9g蔗糖,溶液达到饱 在20℃时,100g水中最多可溶解203.9g蔗糖。
巩固练习:
• 例1,某物质在20ºC的溶解度为21.5克, 其含义是什么?
0.1克硝酸钾,能否说明氢氧化钙、硝酸钾的 溶解性相同?
固1、体要物比质较的不溶同固解体度物四质要溶素解:性的大小一定要满足的
条件是:
条定件温:、在定一溶定剂温量度、下达到饱和状态三个前提条件。 标2、准比:较在不10同0克固溶体剂物中质的溶解性,我们比较的是:
状态相:同达温到度饱下和,状等态质量的水中,达到饱和状态时溶解 的固体的质量。
9
饱 吃 没
饱了 吃
加入 桔子精
加热
放入 冰箱
真渴呀!来杯桔子汁。
知识拓展:
● 在一定温度下,在某种溶质的饱和溶液 中 还可以溶解其他溶质。
● 溶液的饱和、不饱和与溶液的浓稀之间 的关系
① 对于不同溶质来说,浓溶液不一定是饱和 溶液,稀溶液也不一定是不饱和溶液。
② 对于同一种溶质的溶液来说,在一定温度 时饱和溶液比不饱和溶液要浓。
3.同一种物质在同一溶剂中的溶解性与温 度有关。
影响物质溶解性的因素
1.溶质本身的种类 2.溶剂本身的种类 3.温度
2020/4/3
6
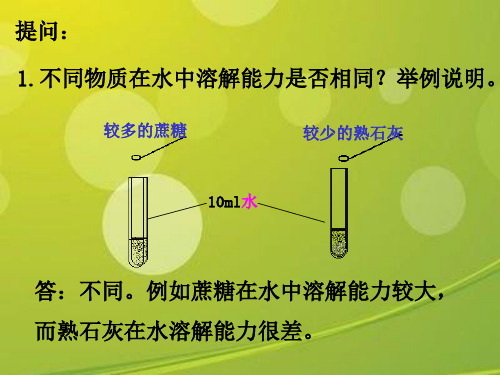
[实验探究] 硝酸钾溶于水
• 1.向10ml水中加入少量的硝酸钾固体
• 2.向1的试管中继续加入硝酸钾固体, 至试管底部有不容物出现。
• 3.向2的试管中加入水,振荡,现象。
一定温度下,某固体物质在100克溶剂(通常溶剂是水) 中达到饱和状态时所溶解的质量,就叫做这种溶质在这 种溶剂中的溶解度。
例:蔗糖在20℃时的溶解度是203.9g。
在20℃时,100g水中溶解203.9g蔗糖,溶液达到饱 在20℃时,100g水中最多可溶解203.9g蔗糖。
巩固练习:
• 例1,某物质在20ºC的溶解度为21.5克, 其含义是什么?
0.1克硝酸钾,能否说明氢氧化钙、硝酸钾的 溶解性相同?
固1、体要物比质较的不溶同固解体度物四质要溶素解:性的大小一定要满足的
条件是:
条定件温:、在定一溶定剂温量度、下达到饱和状态三个前提条件。 标2、准比:较在不10同0克固溶体剂物中质的溶解性,我们比较的是:
状态相:同达温到度饱下和,状等态质量的水中,达到饱和状态时溶解 的固体的质量。
9
饱 吃 没
饱了 吃
加入 桔子精
加热
放入 冰箱
真渴呀!来杯桔子汁。
知识拓展:
● 在一定温度下,在某种溶质的饱和溶液 中 还可以溶解其他溶质。
● 溶液的饱和、不饱和与溶液的浓稀之间 的关系
① 对于不同溶质来说,浓溶液不一定是饱和 溶液,稀溶液也不一定是不饱和溶液。
② 对于同一种溶质的溶液来说,在一定温度 时饱和溶液比不饱和溶液要浓。
3.同一种物质在同一溶剂中的溶解性与温 度有关。
影响物质溶解性的因素
1.溶质本身的种类 2.溶剂本身的种类 3.温度
2020/4/3
6
[实验探究] 硝酸钾溶于水
• 1.向10ml水中加入少量的硝酸钾固体
• 2.向1的试管中继续加入硝酸钾固体, 至试管底部有不容物出现。
• 3.向2的试管中加入水,振荡,现象。
人教版九年级化学下册 第九单元 溶液 第1课时 饱和溶液与不饱和溶液(课件)

学 具 准 备 水、氯化钠固体、硝酸钾固体、烧杯(若干)、玻璃
棒、酒精灯、铁架台、石棉网等。
课前自学准备
预习检测
1. 一定温度 下,向一定量 溶剂 里加入某种溶质, 当溶质 不能继续溶解 时,所得到的溶液叫做这种 溶质的饱和溶液;还能 继续溶解这种溶质 的溶液, 叫做这种溶质的不饱和溶液。
2. 一般情况下,饱和溶液可以通过升温和增加溶剂 的方法转化为不饱和溶液,不饱和溶液可以通过 增加溶质、蒸发溶剂或降温 的方法转化为饱和 溶液。
海水晒盐其工业过程可大致表示为如下:
食盐
氯化钠
海 水
贮
蒸
水
发
池
池
结 晶 池
母液
多种化工产品
析出晶体后的溶液叫母液,对于析出的溶质来说 是饱和溶液。
课堂教学展示
典例剖析
例 海水提取食盐的方法主要为“盐田法”,其过 程如下:
(1)上图中①是 蒸发 池(填“蒸发”或“冷却”)
。
AC
(2)下列分析正确的是
提问
如何判断一种溶液是否饱和呢?
保持温度和溶剂不变
能继续溶解溶质则是不饱和溶液; 不能继续溶解溶质则是饱和溶液。
提问
1.有什么方法使不饱和溶液变为饱和溶液? 2.有什么方法使饱和溶液变为不饱和溶液?
不饱和溶液
增加溶质或降低溶液 温度或蒸发溶剂
注意特殊物质: Ca(OH)2
饱和溶液
增加溶剂或 改变升高温度
知识点2 结晶
讨论 海水晒盐的过程是怎样的?试类比KNO3晶
体的析出作简要说明。
海水在太阳下水分 慢慢蒸发,结晶析 出NaCl晶体
结晶 已溶解的溶质以晶体的形式从溶液中析出的过程 叫结晶。 结晶的方法:降温结晶法和蒸发结晶法。
九年级化学下册 第九单元 溶液 9.2 溶解度 9.2.1 饱和

3.应用——海水晒盐: (1)原理:利用日光和风力使水分蒸发,食盐结晶析出。 (2)大致过程如下:
【微点拨】 结晶析出后所得的母液是食盐的饱和溶液。
考点 饱和溶液与不饱和溶液的判断及相互转化 1.判断的依据:
2.饱和溶液与不饱和溶液的转化: (1)大多数情况下,固体物质在一定量水中溶解的最大 量随温度的升高而增大,故其饱和溶液与不饱和溶液存 在如下转化关系:
(2)由于熟石灰在一定量水中溶解的最大量随温度的升 高而降低,故Ca(OH)2饱和溶液与不饱和溶液之间存在如 下转化关系:
【延伸探究】 饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液吗? 提示:溶液的饱和与不饱和与溶液的浓和稀没有必然的 联系。饱和溶液不一定是浓溶液,不饱和溶液不一定是 稀溶液。
【典例】(2017·绍兴中考)某次蔗糖溶解实验过程如 图所示,不考虑水分蒸发,下列判断错误的是 ( )
世纪金榜导学号00434054
A.②中溶液是饱和溶液 B.③中溶液一定是不饱和溶液 C.②③中溶液的浓度不相同 D.③中溶液的溶质质量大于②中溶液的溶质质量
【精讲精析】解答本题需明确以下四点: (1)②中含有不溶解的物质,一定是饱和溶液;(2)③中 溶液可能是饱和溶液,也可能是不饱和溶液;(3)②中的 溶质比③中溶质少,溶剂质量相同,所以②③中溶液的 浓度不相同;(4)③中固体全部溶解,②中固体未全部溶 解,所以③中溶液的溶质质量大于②中溶液的溶质质量。
课题2 溶 解 度 第1课时 饱和溶液
一、饱和溶液和不饱和溶液 1.定义:在_一__定__温__度__下,向_一__定__量__溶__剂__里加入某种溶 质,当_溶__质__不__能__继__续__溶__解__时,所得到的溶液叫做这种 溶质的饱和溶液;_还__能__继__续__溶__解__的溶液,叫做这种溶 质的不饱和溶液。
九年级化学下册第九单元溶液课题2溶解度第1课时饱和溶液教案(新版)新人教版

在今后的教学中,我将继续关注学生的学习需求,调整教学策略,努力提高教学质量。同时,加强对学生的个别辅导,关注学生的个体差异,确保每个学生都能在化学学习中取得进步。
板书设计
-在板书设计中,以“溶解度”为核心,将饱和溶液、不饱和溶液的定义和判断方法作为重点内容。
-使用清晰的图表或流程图来展示溶解度曲线的变化规律,帮助学生直观理解溶解度与温度、压力的关系。
3.确定教学媒体使用:利用多媒体课件展示溶解度曲线图,帮助学生直观理解溶解度变化。提供在线资源,让学生访问相关实验视频和案例研究,扩展学习视野。运用互动式白板,进行实时提问和解答,激发学生思考和参与。
教学过程设计
1.导入环节(5分钟)
-教师通过展示一杯盐水和一杯糖水的图片,让学生观察并提问:“你们能区分这两杯水吗?为什么?”
-教师给出几个有关饱和溶液和不饱和溶液的问题,让学生进行练习。
-学生独立完成练习,教师选取部分进行讲解和分析。
7.课堂小结(3分钟)
-教师对本节课的主要内容进行小结,强调重点知识点。
-学生跟随教师一起回顾本节课的学习内容。
8.作业布置(2分钟)
-教师布置作业,要求学生巩固本节课所学知识,并预习下一节课的内容。
-教师巡回指导,解答学生实验中遇到的问题。
4.小组讨论(5分钟)
-学生分组讨论实验结果,共同得出饱和溶液与不饱和溶液的判断标准。
-每组选代表进行汇报,总结讨论成果。
5.课堂提问(5分钟)
-教师针对本节课的重点内容进行提问,检查学生对知识的掌握程度。
-学生回答问题,教师给予评价和解答。
6.巩固练习(5分钟)
九年级化学下册第九单元溶液课题2溶解度第1课时饱和溶液教案(新版)新人教版
科目
板书设计
-在板书设计中,以“溶解度”为核心,将饱和溶液、不饱和溶液的定义和判断方法作为重点内容。
-使用清晰的图表或流程图来展示溶解度曲线的变化规律,帮助学生直观理解溶解度与温度、压力的关系。
3.确定教学媒体使用:利用多媒体课件展示溶解度曲线图,帮助学生直观理解溶解度变化。提供在线资源,让学生访问相关实验视频和案例研究,扩展学习视野。运用互动式白板,进行实时提问和解答,激发学生思考和参与。
教学过程设计
1.导入环节(5分钟)
-教师通过展示一杯盐水和一杯糖水的图片,让学生观察并提问:“你们能区分这两杯水吗?为什么?”
-教师给出几个有关饱和溶液和不饱和溶液的问题,让学生进行练习。
-学生独立完成练习,教师选取部分进行讲解和分析。
7.课堂小结(3分钟)
-教师对本节课的主要内容进行小结,强调重点知识点。
-学生跟随教师一起回顾本节课的学习内容。
8.作业布置(2分钟)
-教师布置作业,要求学生巩固本节课所学知识,并预习下一节课的内容。
-教师巡回指导,解答学生实验中遇到的问题。
4.小组讨论(5分钟)
-学生分组讨论实验结果,共同得出饱和溶液与不饱和溶液的判断标准。
-每组选代表进行汇报,总结讨论成果。
5.课堂提问(5分钟)
-教师针对本节课的重点内容进行提问,检查学生对知识的掌握程度。
-学生回答问题,教师给予评价和解答。
6.巩固练习(5分钟)
九年级化学下册第九单元溶液课题2溶解度第1课时饱和溶液教案(新版)新人教版
科目
九年级下册化学饱和溶液PPT教案

(3)100克水能溶解0.1克氢氧化 钙也能溶解0.1克硝酸钾,能否说
第14页/共57页
明氢氧化钙、硝酸钾的溶解性相
固1、体要物比质较的不溶同解固体度物四质要溶素解:性的大小一定要满足的
条件是:
条定件温:、在定一溶定剂温量度、下达到饱和状态三个前提条件。 标2、准比:较在不10同0克固溶体剂物中质的溶解性,我们比较的是:
3
0
2
0
硼酸
5、在80℃时氯化钠、氯化钾、氯化 铵、硼酸的溶解度由大到小的顺序是
__氯__化__铵__、__氯__化_钾__、__氯__化__钠_、__硼__酸___ __。
1 0
0 10 2 0
30 4 0
50 60 7 80 9 100 温度/℃
0
0
第30页/共57页
/ /
溶 200
解
度 190
温度(t)
第28页/共57页
.
/
溶 200 解 度 190
g 硝 酸 铵
180
170
160
150
140
130
120
110
100
9 0 8 0 7 0 6 0 5 0 4 0 3 0 2 0 1 0
0 10 2 0
固体的溶解度曲线:
1、横坐标60,纵坐标110 的交
硝
酸
钠
点表示什么意义?
A.
2.比较硝酸钠与硝酸钾的溶
想一想: 0℃时,氧气的溶解度为0.049的含义是什么 ?
在0℃,压强为101kPa时,1体积水最多能溶解 0. 049体积氧气
1标准大气压下,20℃时部分气体的溶解度
是一个比值,无单位。
第25页/共57页
第14页/共57页
明氢氧化钙、硝酸钾的溶解性相
固1、体要物比质较的不溶同解固体度物四质要溶素解:性的大小一定要满足的
条件是:
条定件温:、在定一溶定剂温量度、下达到饱和状态三个前提条件。 标2、准比:较在不10同0克固溶体剂物中质的溶解性,我们比较的是:
3
0
2
0
硼酸
5、在80℃时氯化钠、氯化钾、氯化 铵、硼酸的溶解度由大到小的顺序是
__氯__化__铵__、__氯__化_钾__、__氯__化__钠_、__硼__酸___ __。
1 0
0 10 2 0
30 4 0
50 60 7 80 9 100 温度/℃
0
0
第30页/共57页
/ /
溶 200
解
度 190
温度(t)
第28页/共57页
.
/
溶 200 解 度 190
g 硝 酸 铵
180
170
160
150
140
130
120
110
100
9 0 8 0 7 0 6 0 5 0 4 0 3 0 2 0 1 0
0 10 2 0
固体的溶解度曲线:
1、横坐标60,纵坐标110 的交
硝
酸
钠
点表示什么意义?
A.
2.比较硝酸钠与硝酸钾的溶
想一想: 0℃时,氧气的溶解度为0.049的含义是什么 ?
在0℃,压强为101kPa时,1体积水最多能溶解 0. 049体积氧气
1标准大气压下,20℃时部分气体的溶解度
是一个比值,无单位。
第25页/共57页
九年级化学下册 第9单元 课题2《溶解》饱和溶液课件

结果:
熟石灰的饱和溶液
[总结二] 同一物质, 相同温度,饱和溶 液比不饱和溶液 要浓
浓度小
第六页,共十二页。
[练习二]
1、在一定温度下,某物质(wùzhì)的饱和溶液一定是(
)
A.非常浓的溶液;
B.增加该溶质,能继续溶解的溶液;
C.非常稀的溶液;
D.增加该溶质,不能继续溶解的溶液。
2.在其它条件不变的情况下,要使接近饱和溶液的硝酸钾溶液达到
饱和溶液,下列措施达不到目的的是(
)
A.降低溶液温度;
B.加入(jiārù)溶质硝酸钾;
C.升高溶液的温度;
D.蒸发溶液中的溶剂
第七页,共十二页。
概念
概念
饱和溶液
升温或增加溶剂 不饱和溶液
降温.减少溶剂.加溶质
浓溶液
第八页,共十二页。
稀溶液
知识点总结(zǒngjié)
1.海水晒盐的方法是: 蒸发 。 2.饱和溶液是指:在一定(晶zhēn温gf度ā下)结,在一定量的
。 (róngyè)一定来自7.对于同种溶质来说,在相同温度下其饱和溶液
比不饱和溶液浓。
8.析出晶体后的溶液一定是 饱和溶液 。 9.20°C时KNO3降温后有晶体析出,在次过程中分析,溶质、溶液、溶
剂这三个量是如何变化的
溶剂不变、溶质变小、溶质质量分 数变小
10.向氯化钠的饱和溶液中,加入食盐晶体则分析,溶质、溶液、溶剂 这三个量是如何变化的
里溶剂 不在溶解某种溶质的。溶液
3.不饱和溶液是指 在一定 下温,度在一定量的 里 溶剂 能继续溶解某种溶.质的溶液
4.不饱和溶液通常通过 加溶、质
降、温 可蒸转发水化为饱和溶液。
5.饱和溶液通常通过 加溶剂 、
九年级化学下册 第九单元 溶液 9.2 溶解 第1课时 饱和溶液课件初中

0.17 g,现有甲、乙两只烧杯各盛100 g水,在20 ℃时,分别进行如下实验:
(1)在甲烧杯中加入30 g食盐,充分搅拌后,得到溶液甲,则甲为
溶液。由于此溶液中溶质含量较
,所以属于
溶液。
(2)在乙烧杯中加入1 g熟石灰,充分搅拌后得浑浊液体,过滤得到溶液乙,则
乙为
溶液。由于此溶液中溶质含量较
,所以属于
第十一页,共十一页。
溶液。
由实验可知,对于不同溶质来说,浓溶液 是不饱和溶液。
(1)不饱和 多 浓
是饱和溶液,稀溶液 关闭
(2)饱和 少 稀 不一定 不一定
第十页,共十一页。
(dá答答à案案n)
内容 总结 (nèiróng)
课题2 溶解度。浓、稀溶液与饱和、不饱和溶液的区别与联系。B.在一定温度下,一 定量的溶剂里,不能再溶解该溶质的溶液。D.在一定温度下,一定量的溶剂里,还能再溶解该 溶质的溶液。因溶液未达到饱和,在一定温度下还能继续溶解该溶质,故B错误,D正确。关 闭。C.在一定条件下,饱和溶液与不饱和溶液之间可以相互转化。D.某溶液中有不溶解的 溶质存在(cúnzài),该溶液一定为饱和溶液。A.温度不变时,向该溶液中加入少量水,结果溶液 变稀
是( )
A.往食盐水中加食盐
B.往食盐水中加水
C.往食盐水中加入饱和食盐水
D.加热食盐水
关闭
A
第七页,共十一页。
(dá答答à案案n)
1
2
3
4
5
3.证明某KCl溶液在10 ℃时已经达到饱和状态的方法是( )
A.温度不变时,向该溶液中加入(jiārù)少量水,结果溶液变稀
B.取少量该溶液,降温到10 ℃以下时,有KCl晶体析出 C.取少量该溶液升温,无KCl晶体析出
九年级化学下册 第九单元 课题2 第1课时 饱和溶液与不饱和溶液课件

的质量___不__变_。(填“不变”“增加”或“减少”)
2021/12/11
第二页,共十二页。
【小试(xiǎo shì)身手】 1.20 ℃时,100 g 水中最多能溶解 36 g 食盐,则下列说法 正确(zhèngquè)的是()。 A.食盐(shíyán)的溶解度是 36 g B.20 ℃时食盐的溶解度是 36 g C.食盐的溶解度是 100 g D.食盐的溶解度是 136 g 答案:B
注意:①“饱和”“不饱和”是相对的,随溶剂质量、溶
质质量和温度的变化而变化。
②某物质的饱和溶液只是不能继续溶解这种物质,但是还
可能继续溶解其他物质。
2021/12/11
第五页,共十二页。
2.饱和溶液(róngyè)的影响因素。 物质不能无限制(xiànzhì)地溶解在一定量的溶剂中,物质的溶解的 量与溶剂的量及温度(wēnd续溶解的溶液,叫做这种溶质的______
不饱和
溶液(róngyè)。
2.热的溶液冷却后,已溶解在溶液中的________从溶液质中
以__晶__体__的__形__式_析出,这一过程叫做______。结晶
3.在一定温度下,向硝酸钾的饱和溶液中加入少量硝酸钾
固体后,溶液中溶质的质量______,不溶变剂的质量______,溶不液变
B.改变条件可以使不饱和溶液变成饱和溶液
C.室温下,与固体溶质共存的溶液一定是这种溶质的饱 和溶液
D.在温度升高时,某物质的饱和溶液一定能继续溶解该
物质
点拨:对绝大多数固体物质而言,升高温度,饱和溶液会
变为不饱和溶液,可以继续溶解该溶质。但对饱和石灰水是个
特例。
答案:D
2021/12/11
第九页,共十二页。
九年级化学人教版下册《溶解度(第1课时饱和溶液)》课件

5. 向盛有等质量水的甲、乙、丙三个烧杯中分别加入15 g、 30 g、30 g蔗糖固体,充分搅拌后静置,现象如图9-2-4所示。 下列说法正确的是( B ) A.甲、丙烧杯中的溶液一定属于不饱和溶液 B.可用升温的方法使乙烧杯中剩余的固体溶解 C.乙、丙烧杯中溶质的质量相等 D.蔗糖的溶解能力随温度的升高 而减小
实验小组
一二三四
水的质量/g
50 50 50 50
所取NaCl的质量/g
15 20 25 30
剩余NaCl的质量/g
0 2 7 12
4. 如图9-2-3所示是有关硝酸钾溶液的实验操作及变化情况。 下列说法正确的是( D ) A.操作Ⅰ一定是降温 B.操作Ⅰ一定是加溶质 C.③中一定不能溶解其 他溶质 D.③是饱和溶液
实验
是___一__定___的。改变
9-5 ③再加15 mL水,搅拌 未_溶__解__的__氯__化__钠__全__部__溶__解_ __溶__剂____的量可以改变溶 解的溶质的量
操作
①加入5 g硝酸 钾,搅拌
(2) 实验 9-6
②再加5 g硝酸 钾,搅拌 ③加热
④再加5 g硝酸 钾,搅拌
⑤冷却
现象 ____硝__酸__钾__全__部__溶__解________
【实践活动·跨学科融合】 6. 如图9-2-5所示,一物体悬挂在饱和NaCl溶液中,在恒温条 件下向烧杯内溶液中分别加入下列物质(悬挂物不参与反应) 。请说明弹簧秤读数变化情况(填“变大”“不变”或“变小 ”)。 (1)如果加入NaCl晶体,弹簧秤读数__不__变________。 (2)如果加入蒸馏水,弹簧秤读数__变__大________。 (3)如果加入KNO3晶体,弹簧秤读数___变__小_______。
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
20ml水
加5g
氯化钠
搅拌
溶解
再加5g氯化钠 再加5ml水
部分溶解 又溶解
溶质在定量溶剂中溶解的质量随温度变化的情况? 活 动 探 究 二
20ml水
加5g 硝酸钾
搅拌溶解 再加5g硝酸钾
再加5g硝酸钾 加热又 部分溶解 溶解
又溶解
饱和溶液 T ℃定 量的水
不能再溶解 该溶质
饱和溶液:在一定温度下,向一定量溶剂里加入某 种溶质,当溶质不能继续溶解时,所得到的溶液叫做该 溶质的饱和溶液。
不饱和溶液
注:以上为通常情况,不适合所有的物质。
如何将硝酸钾溶液中的溶质硝酸钾提取出来?
较高温度下的 硝酸钾溶液
烧杯底部有 晶体析出
降温结晶:又叫冷却热饱和溶液 结晶: 溶质从溶液中析出的过程叫结晶。
蒸发结晶
走进生活
1.汗水带有咸味是因为汗水中溶有无机盐。 2.被汗水浸湿的衣服晾干后,常出现白色的斑迹,是因 为水蒸发后,溶解的无机盐结晶析出。
交流和讨论
怎样判断一种溶液是不是饱和溶液? 1. 如果溶液中有少量未溶解的溶质,则是饱和溶液;
2. 加少量的溶质,溶质能继续溶解的是不饱和溶液,
不能溶解的是饱和溶液。
饱和溶液可以转变成不饱和溶液吗?不饱和溶液可 以转变成饱和溶液吗?如能转化,怎样转化?
增加溶剂,升高温度
饱和溶液
增加溶质,蒸发溶剂,降低 温度
的蒸发,当表面的食盐溶液达到饱和时,食盐就从溶液
中结晶析出。所以过一段时间就能发现咸菜的表面有一
层白色晶体。
1.在一定温度下,一定量的溶剂里不能再继续溶解某种溶 质的溶液称为该物质的饱和溶液 2通常情况 饱和溶液
增加溶质,蒸发溶剂,降低 温度
增加溶剂,升高温度
不饱和溶液
3.从溶液中析出晶体的过程称为结晶,结晶分为蒸发结晶
加溶质
搅拌
继续加溶质 部分 溶解
T ℃定 量的水
不饱和 溶液
饱和 溶液
还能继续溶解该溶质的溶液叫做这种溶质的不饱和溶液。
氯化钠与硝酸钾在水中的溶解
饱和溶液和不饱和溶液
在一定的温度下,一定量的溶剂里,ห้องสมุดไป่ตู้能再继续溶
解某种溶质的溶液,叫做这种溶质的饱和溶液。 还能继续溶解某种溶质的溶液,叫做这种溶质的不 饱和溶液。
和降温结晶
我们在分给他人幸福的同时,也能正
比例地增加自己的幸福。
知识点一、饱和溶液
【典例1】 (2010·南宁中考)下列关于饱和溶液的说法中,
错误的是( D ) A.在温度不变时,KNO3饱和溶液不能再溶解KNO3晶体 B.改变条件可以使不饱和溶液变成饱和溶液 C.室温下,与固体溶质共存的溶液一定是这种溶质的饱和溶液 D.在温度升高时,某物质的饱和溶液一定能继续溶解该物质
知识点二、饱和溶液与不饱和溶液的转化
【典例1】使一杯接近饱和的硝酸钾溶液变饱和,下列
措施中错误的是( D B.蒸发掉一部分水 C.降温至有固体析出 D.升高温度 )
A.加入适量的硝酸钾固体
1.在一定 ______下,一定量的_______里 _______再继 温度 溶剂 不能 续溶解某种溶质的溶液叫饱和溶液。 2.要使饱和硝酸钾溶液变成不饱和溶液,可采取的措施 有: (1)_________。 加水 (2)_________。 升温
课题2 溶解度
第1课时 饱和溶液
1.通过实验探究,建立饱和溶液与不饱和溶液的概念 2.了解饱和溶液与不饱和溶液相互转化的方法 3.了解结晶现象
猜一猜
在一定条件下,溶质能不能无限的溶解在溶剂里?溶
液能“吃饱”吗?
定量水溶解食盐
一、饱和溶液
溶质溶解的质量随溶剂质量变化的情况? 活 动 探 究 一
3.在温度为t℃时,某物质的饱和溶液一定是( D ) A.稀溶液 C.浓溶液 B.含有100g溶剂的溶液 D.不能再溶解该物质的溶液
4.某物质的饱和溶液中,加入一些该溶质的固体,则下列
说法正确的是( C )
A.溶质质量减少 C.固体质量不变 B.溶液质量增大 D.溶质质量增加
5.如果将咸菜放置在空气中,过一段时间发现咸菜的表 面有一层白色晶体析出。请简要解释其原因。 咸菜的表面有食盐溶液,放置在空气中,水分会不断
