510K球囊
宫腔球囊扩张导管国标

宫腔球囊扩张导管国标宫腔球囊扩张导管(简称宫腔球囊导管)是一种在妇科手术中广泛使用的器械,用于宫腔扩张、检查和操作。
国标是指该器械所需符合的国家标准。
本文将从宫腔球囊导管的定义、分类、作用、国标制定以及相关注意事项进行详细介绍,旨在加深对宫腔球囊导管的理解。
宫腔球囊导管是一种柔软的管状器械,形状类似于导尿管。
其主要由管腔和球囊两部分组成。
管腔的长度、直径和形状可以根据手术需要进行选择。
球囊位于导管末端,并可以通过充气来扩张。
宫腔球囊导管在手术中通常通过阴道插入,通过宫颈进入宫腔,然后通过充气球囊来扩张宫腔,以便进行宫腔检查、手术和操作。
根据不同的目的和要求,宫腔球囊导管可以分为多种类型。
常见的有宫腔扩张导管、宫腔镜扩张导管和宫腔插管。
其中,宫腔扩张导管主要用于宫腔扩张和手术操作;宫腔镜扩张导管则用于辅助腔镜检查和手术;宫腔插管则用于宫腔内种植和输注。
宫腔球囊导管的主要作用是扩张宫腔,使医生能够清楚地观察宫腔内的情况,并进行手术和操作。
其扩张宫腔的机制是通过充气球囊来实现的。
当球囊被充气时,会逐渐扩张,从而使导管的外径增大,宫腔的直径也相应增加。
通过宫腔扩张,医生可以更好地进行宫腔检查、子宫内膜切除、取出子宫内膜异位病变等操作。
为了确保使用安全和效果,宫腔球囊导管有一系列的国家标准制定,以规范其质量和使用。
国标要求宫腔球囊导管应符合特定的物理和化学性能要求,并且需要进行相关的技术评价和测试。
其中,物理性能要求包括尺寸、容量、压力承受能力等;化学性能要求包括材料的生物相容性和无毒性等。
通过符合国家标准,可以保证宫腔球囊导管的质量和安全性,并为临床手术提供可靠的支持。
在使用宫腔球囊导管时,还需要注意一些事项。
首先,需要选择适合手术需要的导管尺寸和类型。
其次,需要针对每位患者进行个体化的使用和操作,以确保操作的准确性和有效性。
此外,在使用过程中需要细致观察患者的生命体征,及时处理可能出现的并发症和不良反应。
《一次性使用宫腔压迫球囊》编制说明(征求意见稿)一

《一次性使用宫腔压迫球囊》编制说明(征求意见稿)一、工作简况1、任务来源根据国家药监局综合司关于印发2019年医疗器械行业标准制修订项目计划的通知药监综械注[2019]23号文有关内容,医疗器械行业标准制订项目《一次性使用宫腔压迫球囊》(以下简称项目)已列入“2019 年中央补助地方医疗器械标准制修订项目”中,由全国计划生育器械标准化技术委员会归口,国家食品药品监督管理局上海医疗器械质量监督检验中心承担项目管理。
(计划项目号:N2019043-sh)2、协作单位《一次性使用宫腔压迫球囊》行业标准由上海市医疗器械检测所、河南省医疗器械检验所、江苏奥博金医药科技有限公司、扬州强健医疗器材有限公司、库克(中国)医疗贸易有限公司、上海衡仪器厂有限公司共同负责制订,上海市医疗器械检测所、扬州强健医疗器材有限公司、上海衡仪器厂有限公司共同验证。
(注:除了第一起草单位,其他起草单位排名未定,主要依据对标准的贡献而定)3、主要工作过程2019年3月,《一次性使用宫腔压迫球囊》行业标准起草小组成立,对行业标准的起草、时间节点、任务分工进行了部署;《一次性使用宫腔压迫球囊》行业标准起草小组统一思想,安排《一次性使用宫腔压迫球囊》行业标准起草小组(工作组草案)起草的技术框架和注意事项;2019年3月22日,在江苏盐城召开了2019年度行业标准《一次性使用宫颈扩张器第3部分球囊式》和《一次性使用宫腔压迫球囊》制修订第一次工作组会议,会议介绍了标准制修订程序,明确了各个起草单位的任务分工以及注意事项,并初步确认了标准的主要技术内容以及制修订的时间。
2019年3月-4月,工作组进行多次交流与修改,形成《一次性使用宫腔压迫球囊》行业标准(工作组讨论稿);2019年5月,征求部分生产企业、委员以及检测单位的意见,共发出15份征求意见单,收到45条意见。
秘书处对45条意见进行了归类和分析,对《一次性使用宫腔压迫球囊》行业标准(工作组讨论稿)进行修改,形成了《一次性使用宫腔压迫球囊》行业标准(草案);2019年6月28号,在江苏盐城召开了2019年度行业标准《一次性使用宫颈扩张器第3部分球囊式》和《一次性使用宫腔压迫球囊》制修订第二次工作组会议,对《一次性使用宫腔压迫球囊》进行了修改,形成了《一次性使用宫腔压迫球囊》行业标准(征求意见稿);2016年7月20日—9月31日,《一次性使用宫腔压迫球囊》(征求意见稿)征求意见。
药物球囊临床应用效果评价的方法与指标

药物球囊临床应用效果评价的方法与指标药物球囊是一种被广泛应用于心血管疾病治疗的介入器械,它通过充气或充液的方式,将药物输送至患病部位,进而起到治疗作用。
在临床应用中,如何评价药物球囊的治疗效果,对于指导治疗方案的制定、临床疗效的监测和疗效比较具有重要意义。
药物球囊临床应用效果评价主要有两个方面的内容,即直接评价和间接评价。
直接评价是指直接观察和测量药物球囊治疗后的效果,包括病情改善程度、治愈率、复发率等指标。
间接评价是通过观察药物球囊治疗前后其他相关指标的变化来判断治疗效果,如患者的症状、体征、生化指标等。
下面将详细介绍几个常用的药物球囊临床应用效果评价方法与指标。
一、直接评价方法与指标1. 病情改善程度评价病情改善程度评价是最常见的药物球囊临床应用效果评价方法。
通过观察患者的症状、体征以及影像学检查等指标的变化,来评估药物球囊治疗的效果。
常用的评价指标有症状缓解程度、影像学检查指标改善程度等。
2. 治愈率评价治愈率评价是针对某些可完全治愈的疾病而言的,如药物球囊治疗冠心病的治愈率评价。
治愈率是指通过药物球囊治疗后,患者病情完全缓解,不再需要进一步治疗的比例。
对于冠心病等慢性病来说,治愈率的评价相对较低,通常以其他指标为主。
3. 复发率评价复发率评价是长期评价药物球囊治疗效果的指标之一。
复发率是指在一定时间内,经过药物球囊治疗后,患者病情再次恶化或复发的比例。
通过观察患者是否出现复发情况,可以评估药物球囊治疗的持久性和稳定性。
二、间接评价方法与指标1. 生化指标评价生化指标是评价药物球囊临床应用效果的重要指标之一。
常用的生化指标包括血压、血红蛋白、血脂、血糖等。
通过观察这些指标的变化,可以判断药物球囊治疗对患者病情的改善程度。
2. 心电图评价心电图是观察患者心脏功能和心律的主要手段之一。
药物球囊治疗某些心血管疾病后,可以通过心电图的变化评估其治疗效果。
比如,药物球囊治疗心绞痛的患者,在治疗后心电图上可能会出现ST段改善、心肌缺血改善等特征。
球囊扩张导管(PTCA)510(K)注册申报常见问题及讨论

164中西医结合心血管病杂志Cardiovascular Disease Journal of integrated traditionalChinese and Western Medicine2018 年 5月 C 第 6 卷第 15 期May. C 2018 V ol. 6 No. 15球囊扩张导管(PTCA)510(K)注册申报常见问题及讨论史艳艳(上海熠品质量技术服务有限公司,上海 201101)【摘要】目的 通过对球囊扩张(PTCA)导管510(k)注册申报中常见问题进行分析,以提高相关申请人对此类产品注册申报资料编写的质量和加快FDA审评审批效率。
方法 依据FDA法规21CFR对医疗器械准入的要求及作者参与提交此类产品遇到的常见问题进行总结,对共性及多发性问题进行归纳分析,提供法规要求下的解决思路,为申请人或企业提供参考。
结果 作者比较系统、全面地阐述球囊扩张(PTCA)导管510(k)注册申报中常见的问题,并给出常见问题的法规出处及解决方法,为其他申请人或企业的注册申报工作给予有效指引。
结论 企业作为注册申请人,应加强对法规、标准和指导原则等文件的学习,提高申报资料编写质量,最终提升FDA对此类产品注册审评审批的工作效率。
【关键词】球囊扩张导管;510(k);注册申报;生物相容性;实质性等同;货架寿命;模拟运输安全有效【中图分类号】TH789 【文献标识码】B 【文章编号】ISSN.2095-6681.2018.15.164.03 Common problems and Discussion on registration of balloon dilatationcatheter (PTCA) 510 (K)SHI Yan-yan(Shanghai Yi Pin Quality Technical Service Co,Ltd.,Shanghai 201101,China)【Abstract】Objective Through the Percutaneous Transluminal Coronary Angioplasty (PTCA) Catheter 510 (k) registered in the declaration,analyzes common problems in order to improve the relevant applicant registered declaration data to edit this kind of product quality and speed up the efficiency for examination and approval of FDA review.Methods According to the FDA regulations ,21 CFR requirement for admittance of medical apparatus and instruments,and the author participate in submitting such products summarizes common problems,to analyze the problems of the common and multiple,provide solution under the regulations,to provide the reference for the applicant or enterprises.Results The author is more comprehensively and systematically the Percutaneous Transluminal Coronary Angioplasty (PTCA) Catheter 510 (k) registered in the declaration of common problems,and give citations and solutions to common problems of laws and regulations,to work on other applicants or enterprises registered declare to give effective guidance.Conclusion The registered applicants,should strengthen the laws,regulations,standards and guidelines and other documents of learning,improve the quality of files,eventually improve the FDA registration review to this kind of product approval to work efficiency.【Key Words】Percutaneous Transluminal;Coronary Angioplasty (PTCA);510 (k);Substantive Equivalence;Registration Declaration;Biocompatibility;Shelf Life;Simulation Transportation Safety and Efficiency球囊扩张(Percutaneous Transluminal Coronary Angioplasty,PTCA)导管(以下简称PTCA导管)是一种特殊的医用导管,主要结构由球囊和导管构成。
一次性使用球囊宫颈扩张器产品技术要求康尔乐医疗

2. 性能指标2.1 外观与结构2.1.1外表面应清洁无杂质,不应有加工缺陷和表面缺陷;导管本体不应有扭结。
2.1.2无明显划痕、裂纹、剥落、锋棱及毛刺。
2.1.3尖端应圆滑且应有一定的光滑度。
2.2 尺寸应符合表1的要求。
2.3单向阀单向阀锥度尺寸应符合GB/T 1962.1-2015半刚性鲁尔锥度的规定。
2.4 断裂力每一试验段的断裂力应符合表2的规定。
2.5 连接牢固性宫颈扩张器各连接处应能承受15N的轴向静拉力,持续15s,应无断裂和脱离。
2.6 水合性材料判定制造宫颈扩张器的高分子材料应为非水合性材料。
2.7 无泄漏经反复充盈试验,导管或球囊不应有泄漏或损坏痕迹,如突出或爆裂。
2.8 球囊容积球囊容积应能达到100mL。
2.9 无菌产品经环氧乙烷灭菌后应无菌。
2.10 化学性能2.10.1 易氧化物检验液与空白液相比, 0.002mol/L高锰酸钾溶液消耗量之差应不大于2.0ml。
2.10.2 重金属宫颈扩张器的检验液中钡、铬、铜、铅、锡总重金属含量不得超过1μg/ml。
2.10.3 酸碱度宫颈扩张器检验液与空白对照液的pH值之差应不超过1.5。
2.10.4 环氧乙烷残留量宫颈扩张器若经环氧乙烷灭菌,出厂时环氧乙烷残留量不应超过10μg/g。
2.11 球囊可靠性在室温下,每个球囊充入规定容积的水后,应呈现苹果状鼓起;充水后的球囊浸入0.9%生理盐水中,并置于37℃±2℃水浴12h,然后在止逆阀上挂上1Kg砝码将球囊悬挂于专用装置,每个球囊保持1min并观察,球囊应无泄漏。
510K Summary of Safety and effectiveness

510(K) 安全性和有效性总结申请人:泰科医疗集团全球业务外科器械部(经营名称:柯惠),米德尔顿大道60北哈芬,康乃狄克06473电话:(203)492-5352联系人:Frank Gianelli项目经理,注册专员准备日期:2009.10.29商品名/专有名:Autosuture TM腔镜下切割吻合器及一次性钉匣通用名/常用名:可植入钉匣切割吻合器器械分类名称:钉匣,可植入参照器械:Autosuture TM腔镜下切割吻合器(K083519;K061095)产品描述:此510(K)展示了一种新型三排钉钉仓,可用于市面上Autosuture TM腔镜下切割吻合器,产品描述参照材料K083519。
黑色钉仓除在超厚组织中建议钉高大小为4.0,4.5,5.0mm外,其他与参照材料中的三排钉钉仓组件具有完全相同的设计特征。
黑色钉仓组件建议长度为45mm和60mm。
适用范围:Autosuture TM腔镜下切割吻合器适用于腹部、妇产、小儿以及胸部外科手术中组织的切除、横断和吻合。
也可用于肝脏实质、肝脏血管和胆囊管道的切除和横断。
注:腔镜下切割吻合器及一次性钉匣适用于腔镜下切割吻合器,吻合器不附单独说明。
技术特征:应用于超厚组织的腔镜下切割吻合器及一次性钉匣与基于吻合器技术的钉仓本质相同。
此外,在超厚组织切除和横断时,一次性黑色三排钉钉仓可以为外科医生提供additionaloffering.材质:A utosuture TM腔镜下切割吻合器及一次性钉匣的所有零部件材料符合ISO 10993-1性能参数:测试与体内性能评估表明,腔镜下切割吻合器及一次性钉匣在与Autosuture TM腔镜下切割吻合器配合使用时是安全有效的,符合适用范围。
外科设备部泰科医疗集团(经营名称:柯惠)代收:Frank Gianelli先生项目经理,注册专员米德尔顿大道60北哈芬,康乃狄克06473回复:K093410商品名/器械名:Autosuture TM腔镜下切割吻合器及一次性钉匣条款号:21 CFR 878.4750条款名:可植入钉匣条款分类:II类产品编号:GDW有效期截止日:2009.10.30受理日期:2009.11.2亲爱的Gianelli先生:我们已经评审了上述申请上市器械的510(K)文件,并认定器械与1976年5月28日(医疗器械修正案制定日期)之前合法上市的参照器械或被FD&C Act分类为无需上市前批准(PMA)的器械是等价器械(附件使用说明所示)。
球囊扩张导管(PTCA)510(K)注册申报常见问题及讨论

球囊扩张导管(PTCA)510(K)注册申报常见问题及讨论目的通过对球囊扩张(PTCA)导管510(k)注册申报中常见问题进行分析,以提高相关申请人对此类产品注册申报资料编写的质量和加快FDA审评审批效率。
方法依据FDA法规21CFR对医疗器械准入的要求及作者参与提交此类产品遇到的常见问题进行总结,对共性及多发性问题进行归纳分析,提供法规要求下的解决思路,为申请人或企业提供参考。
结果作者比较系统、全面地阐述球囊扩张(PTCA)导管510(k)注册申报中常见的问题,并给出常见问题的法规出处及解决方法,为其他申请人或企业的注册申报工作给予有效指引。
结论企业作为注册申请人,应加强对法规、标准和指导原则等文件的学习,提高申报资料编写质量,最终提升FDA对此类产品注册审评审批的工作效率。
标签:球囊扩张导管;510(k);注册申报;生物相容性;实质性等同;货架寿命;模拟运输安全有效【Abstract】Objective Through the Percutaneous Transluminal Coronary Angioplasty (PTCA)Catheter 510 (k)registered in the declaration,analyzes common problems in order to improve the relevant applicant registered declaration data to edit this kind of product quality and speed up the efficiency for examination and approval of FDA review.Methods According to the FDA regulations ,21 CFR requirement for admittance of medical apparatus and instruments,and the author participate in submitting such products summarizes common problems,to analyze the problems of the common and multiple,provide solution under the regulations,to provide the reference for the applicant or enterprises.Results The author is more comprehensively and systematically the Percutaneous Transluminal Coronary Angioplasty (PTCA)Catheter 510 (k)registered in the declaration of common problems,and give citations and solutions to common problems of laws and regulations,to work on other applicants or enterprises registered declare to give effective guidance.Conclusion The registered applicants,should strengthen the laws,regulations,standards and guidelines and other documents of learning,improve the quality of files,eventually improve the FDA registration review to this kind of product approval to work efficiency.【Key Words】Percutaneous Transluminal;Coronary Angioplasty (PTCA);510 (k);Substantive Equivalence;Registration Declaration;Biocompatibility;Shelf Life;Simulation Transportation Safety and Efficiency球囊扩张(Percutaneous Transluminal Coronary Angioplasty,PTCA)导管(以下简称PTCA导管)是一种特殊的医用导管,主要结构由球囊和导管构成。
药物球囊产品技术要求

药物球囊产品技术要求
药物球囊产品技术要求一般包括以下几个方面:
1. 材料要求:药物球囊产品应采用符合医用器械材料要求的、无毒、无刺激和无过敏反应的材料。
常用的材料有医用级硅胶、聚氨酯等。
2. 结构设计要求:药物球囊设计应合理,包括球囊的尺寸、形状和容量等。
球囊应具有良好的扩张性能,能够正确部署在目标位置。
3. 药物释放要求:球囊内部应配备适量的药物,并确保药物的释放速率和持续时间符合治疗需求。
药物应均匀分布在球囊表面,并能够通过球囊材料的透过性进行释放。
4. 温度和压力要求:药物球囊应能够在常温下正常使用,并能承受一定的压力,以保证球囊的稳定性和安全性。
5. 注射器和导丝的结合要求:药物球囊通常需要配备注射器和导丝,注射器和导丝的结合部分应设计合理,确保使用时的连接牢固可靠,不会出现意外脱落或漏药情况。
6. 操作要求:药物球囊产品应易于操作,具备一定的易用性,方便医务人员正确使用。
此外,产品还应提供详细的使用说明书,为用户提供正确的使用方法。
需要注意的是,药物球囊产品的技术要求可能会因不同的应用
领域、产品类型和治疗目标而有所不同,因此在实际设计和制造过程中,需综合考虑相关标准和规范,确保产品满足医疗和安全要求。
医用球囊研究进展

到目前为止,医用球囊绝大多数是由高分子材料制作的。最初的医用球囊是用软质聚氯乙烯 (PVC)制作,跟今天的球囊相比,这种球囊具有较厚的壁,但耐压能力却低。随着科学家在高分
子材料中的不断筛选、探索,在 80 年代初期到中期[3],交联聚乙烯(PE)和聚对苯二甲酸乙二醇 酯(PET)制作的球囊因其耐压能力和壁厚得到了很大改善,在很大程度上取代了 PVC 成为了新 的球囊材料。PET 制作的球囊耐压最高可以达到 27atm,而壁厚却可低至 0.0002"到 0.002";而交 联 PE 制作的球囊虽然耐压不能和 PET 相比,但其形状稳定性极佳,当交联度达到一定水平后,在 使用压力范围内,其直径和长度的变化低于 5%。虽然 PET 和交联 PE 部分解决了球囊耐压和形状 保持能力,但其硬度太大,而球囊在完成扩张前通常都要经过弯曲复杂的血管,若不能顺利到达病 变部位,再好的耐压能力和形状保持能力也是枉然。在 80 年代末至 90 年代初,尼龙和聚亚安酯材 料开始应用于球囊的制作,尼龙球囊强度比 PET 球囊低,形状保持能力比交联 PE 低,但比他们都 要柔软,同时其耐压能力和形状保持能力完全能满足医用球囊的要求,目前尼龙在球囊材料中占有 很大的份额。
大动脉
覆膜支架的后扩 张
25-40mm
球囊体积为 30-55cc
2-6atm
胆道
扩张胆道
4-10mm
15-30mm
6-10atm
胃肠系统
扩张
6-20mm
50-80mm
1.8-8atm
3.2.2部分非标准球囊在管腔内介入手术中的应用
随着球囊应用范围的不断拓展,对其性能及结构要求越来越高,不同应用目的对球囊分类也越 来越细。目前新结构的球囊热点之一即变径球囊[4],变径球囊有以下两种结构,分别称为台阶球囊、 锥度球囊。台阶球囊是指球囊的工作段有不同的直径,一个球囊可能有两种甚至三种不同的直径。 台阶球囊最初是针对分叉病变而设计。治疗分叉病变,通常采用的是 kissing balloon 技术,如图2 -1的a所示,用两个球囊同时扩张分叉处的两根血管,此时球囊对吻处因两个球囊重叠,容易导 致此处血管过渡扩张而受伤,导致术后血管的再狭窄。若采用变径球囊设计,减小重叠部分的球囊 直径,则可以在一定程度上减小这种无谓的伤害,而在图2-1的b中,主血管和分支血管的直径 差异大,支架置入术中,若选用大尺寸的球囊进行支架扩张,可能撕裂分支血管,选用小尺寸的球 囊进行支架扩张,不能治疗主血管的病变,术后容易造成主血管的再次狭窄甚至闭塞,而采用台阶
球囊额定爆破压

球囊额定爆破压
摘要:
一、球囊额定爆破压的定义和作用
二、球囊额定爆破压的计算方法
三、影响球囊额定爆破压的因素
四、球囊额定爆破压在实际应用中的意义
正文:
球囊额定爆破压是指球囊在承受压力时,达到预定压力值时发生破裂的最大压力值。
它在医疗器械、汽车安全气囊、航空航天等领域有着广泛的应用。
球囊额定爆破压的计算方法有多种,其中较为常见的是根据球囊的材料、尺寸、厚度等因素,结合一定的理论模型进行计算。
一般来说,计算出的额定爆破压值会留有一定的安全余量,以确保球囊在实际使用过程中能够安全可靠。
影响球囊额定爆破压的因素主要包括材料性能、制作工艺、使用环境等。
其中,材料性能是影响球囊额定爆破压的最主要因素,不同的材料具有不同的强度和韧性,因此在设计和制作球囊时需要根据实际应用场景选择合适的材料。
在实际应用中,球囊额定爆破压具有重要意义。
例如,在医疗器械中,球囊额定爆破压可以保证治疗过程中对病变部位施加适当的压力,从而达到治疗目的;在汽车安全气囊中,球囊额定爆破压是决定气囊能否在事故中有效展开的关键参数。
药物球囊设计要点

药物球囊设计要点
设计药物球囊时,需要考虑以下要点:
1. 材料选择:选择适合药物球囊制作的材料,如医用硅胶或聚氨酯等,要确保材料无毒、无刺激性,并且能够与药物兼容。
2. 尺寸和形状:根据药物的剂量和使用要求确定球囊的尺寸和形状。
尺寸不宜过大,方便患者吞咽,并且能够容纳足够的药物。
3. 壁厚和强度:球囊的壁厚要能够承受压力,确保药物不会泄露或溢出。
同时,球囊的强度要足够,不易被压破或损坏,以确保药物的稳定性和效果。
4. 球囊附加功能:根据药物的特性和使用需求,可以考虑为球囊设计附加功能,如可控释放药物、延时释放等。
5. 包装和储存:球囊的包装要便于储存和使用,防止污染和损坏。
可采用气密密封包装或易于打开的包装形式。
6. 清洁和消毒:球囊应易于清洁和消毒,以确保患者使用安全和卫生。
7. 兼容性和稳定性:球囊材料和药物要能够相互兼容,且球囊要确保药物的稳定性,不会影响药物的药效和品质。
8. 使用便利性:球囊的设计要方便患者使用,易于吞咽和排空,
同时要注意球囊的贴合性,以防止药物在使用过程中溢出。
总之,药物球囊的设计要考虑药物特性、使用要求和患者需求,确保药物的安全性、有效性和便利性。
FDA充气球囊510K

Public H ealth ServiceFood and Drug Administration 9200Page 2 - Ms. Laetitia BernardPlease be advised that FDA's issuance of a substantial equivalence determination does not mean that FDA has made a determination that your device complies with other requirements of the Act or any Federal statutes and regulations administered by other Federal agencies. You must comply with all the Act's requirements, including, but not limited to: registration and listing (21 CFR Part 807); labeling (21 CFR Part 801); good manufacturing practice requirements as set forth in the quality systems (QS) regulation (21 CFR Part 820); and if applicable, the electronic product radiation control provisions (sections 53premarket notification. The FDA finding of substantial equivalence of your device to a legally marketed predicate device results in a classification for your device and thus, permits your device to proceed to the market.If you desire specific advice for your device on our labeling regulation (2 1 CFR Partcontact the Office of Compliance at (301) 594-4639. Additionally, for questions on the promotion and advertising of your device, please contact the Office of Compliance at (301) 594-4639. Other general information on your responsibilities under the Act may be obtained from the Division of Small Manufacturers, International and Consumer Assistance at their toll free number (800) 638-2041 or at (301)443-6597 or at its Internet addressSincerely yours,Original 5 IUseDevice Name:DOLPHIN INFLATION DEVICEIndications for Use:CFR 80 1 Subpart D) (2 1 CFKPAGE OF NEEDED)Concurrence ofDivision o f Cardiovascular Devices。
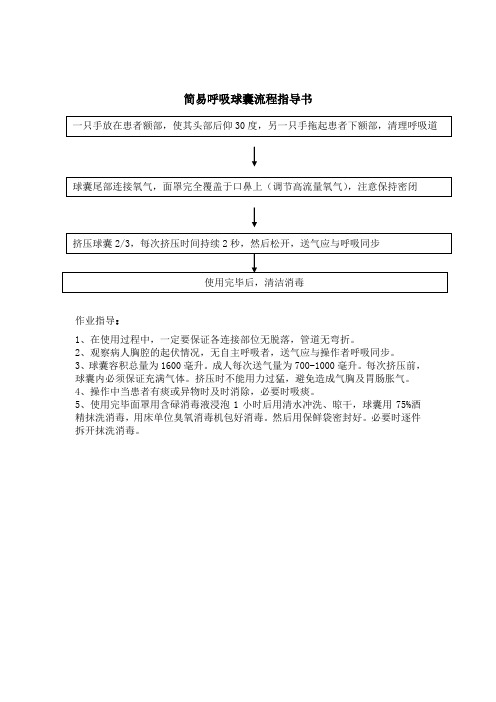
简易呼吸球囊流程指导书
简易呼吸球囊流程指导书
作业指导:
1、在使用过程中,一定要保证各连接部位无脱落,管道无弯折。
2、观察病人胸腔的起伏情况,无自主呼吸者,送气应与操作者呼吸同步。
3、球囊容积总量为1600毫升。
成人每次送气量为700-1000毫升。
每次挤压前,球囊内必须保证充满气体。
挤压时不能用力过猛,避免造成气胸及胃肠胀气。
4、操作中当患者有痰或异物时及时消除,必要时吸痰。
5、使用完毕面罩用含碌消毒液浸泡1小时后用清水冲洗、晾干,球囊用75%酒精抹洗消毒,用床单位臭氧消毒机包好消毒。
然后用保鲜袋密封好。
必要时逐件拆开抹洗消毒。
【领“冠”之路】结构、分类到应用!一文读懂球囊的基础知识

【领“冠”之路】结构、分类到应用!一文读懂球囊的基础知识随着冠脉介入技术的不断发展,相关器械也在不断涌现并改进,但是直至今天,球囊仍是冠脉介入治疗中不可或缺的工具。
今天我们简略的介绍球囊的结构、分类、性能以及应用中的注意事项。
01球囊的结构及分类各类球囊的总体结构基本相同,分为球囊尖端、球囊、连接段、推送杆等(图一)。
目前多数球囊采用尼龙材料制造。
球囊尖端的外径、硬度及长度可影响球囊通过病变的能力,现临床多为锥形设计并采用激光焊接技术连接。
球囊标记为不透X线的金属焊接点,通常直径1.5mm或更小的球囊只有一个标记点,位于球囊中部,直径2.0mm及以上的球囊有两个标记点,分别位于球囊两端。
球囊表面的涂层物质可以降低球囊通过病变时的摩擦力,目前多采用亲水涂层材料。
连接段连接球囊及推送杆,对球囊的推送性、抗折能力有很大影响,目前所用球囊基本加入中心钢丝增强连接段支持力。
推送杆目前由金属杆或高分子材料结合中心钢丝构成。
图一球囊结构示意图1.1快速交换球囊也称单轨(monorail)球囊,是目前冠脉介入治疗中应用最为广泛的球囊类型(图二)。
此类球囊仅临近球囊尖端部分约15至30cm 长的导管可沿着导丝同轴滑行(即导丝走形在球囊导管的中心腔内),其余推送杆没有导丝通过的内腔,配合使用标准长度的180-195cm导丝,单人即可快速简便的送入或退出球囊。
其缺点为无法通过球囊导管交换导丝,以及在处理复杂病变时对导丝支撑较弱。
图二快速交换球囊的结构1.2 整体交换球囊又称OTW(over the wire)球囊,球囊导管全程均有可以通过导丝的内腔,球囊导管全体均沿导丝滑行(图三)。
其优点为可通过球囊导管中心腔交换导丝,而且在导丝通过闭塞或迂曲病变时可以为导丝提供很好地支撑。
缺点为送入和退出球囊时较为不便,需要使用300cm的长导丝撤出球囊,或使用小球囊在指引导管内锚定导丝(trapping法)或使用Nanto法(用充满生理盐水的压力泵在OTW 球囊尾端维持10至14atm加压)撤出球囊,单人难以操作,需要一至两名助手配合完成。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Traditional 510(k) report 510O(k) Summary - Section 5
diagnostic device (e.g., balloon dilatation catheters, artherectomy devices, sent delivery systems, intravascular ultrasound devices.)
Traditional 510(k) report 510(k) Summary - Section 5
510(k) summary
JUL
-
1 2011ຫໍສະໝຸດ This 510(k) Summary is being submitted in accordance with the requirement of SMDA 1990 and 21 CIFR 807.92. Sponsor: Name: Address:
Lynn Fu Building 11, Lishan Industrial Park, Xinghai Aye, Nanshan District, Shenzhen, Guangdong, 518052, China.
Proposed Device: ANT Inflation Device/ ANT Inflation Device Compact Pack Trade Name: Angiographic injection/system Common Name: Classification Name: Balloon Inflation Device 11 Device Class: Regulation Number: 870-1650 MAV Device Code: Predicate Device: INDIEFLATIOR PLUS 30 Inflation Device and PLUS 30 PRIORITY PACK as cleared in K962495. Intended Use: The ANT Inflation Device is intended for use during vascular procedures in conjunction with interventional device such as balloon catheters to create and monitor pressure in the balloon catheter. The ANT Inflation Device Compact Pack is a combination of the ANT Inflation Device and ANT Inflation Device Accessory Pack. -ANT Inflation Device: See description above. -NT Inflation Device Accessory Pack: The Accessory Pack is recommended for use during vascular procedures in conjunction and/or
Shenzhen ANT Hi-Tech Industrial Co., Ltd. c/o Ms. Lynn Eu Building 11, Lishan Industrial Park Xinghai Ave., Nanshan District Shenzhen, Guangdong China 518052JU
Shenzhen ANT Hi-Tech Industrial Co., Ltd Building 11, Lishan Industrial Park, Xinghai Aye, Nanshan District, Shenzhen, Guangdong, 518052, China. Telephone number: 86-755-86060992 86-755-86060991 Fax Number: Date: Correspondent: Contact person: Address: May 25, 2011
DEPARTMENT OF HEALTH & HUMAN SERVICES
Ptiblic Health Service
Food and Drug Administration 10903 New Hampshire Avenue Document Control Room -W066-G609 Silver Spring, MD 20993-0002
k0'-ozcqr ,ozt/I
Device Description: ANT Inflation Device is a single-use, sterile device used in cardiovascular procedures to inflate and deflate balloon catheters. Pressure can be monitored via a pressure gauge. The manually operation of the device is achieved by the manipulation of a large handle to drive a piston housed within the body of the device. Careful and controlled inflation is achieved by rotating the handle clockwise. During inflation a unique cam locking mechanism maintains pressure up to 3O ATM. ANT Inflation Device Accessory Compact Pack contains a hemostasis valve, a torque device, and a guide wire introducer. The hemostasis valve is designed to provide a port for interventional system. The guide wire introducer is used to facilitate placement of a guide wire tip through the hemostasis valve. The torque device is designed to hold the guide wire and provide a handle for manipulating. Summary of the Studies Performance test: Accuracy of pressure gauge::Completely packaged devices are chose as the test samples. Filled them with water and connected to a calibrated pressure gauge, then pressurized to 3 settings, 4ATM, 16ATM, 27ATM, read the pressure and compared it to the calibrated gauge reading. This test showed the results comparable to other commercially device. Leak test: Test samples were pressurized with water at 1ATM, 15ATM, 3OATM, and maintained 2 minutes. When immerse the samples into water, bubble occur indicate a leakage of the device. This test shows the connection of the device is comparable to other commercially device. Competence test: attach the finished device to a legally marked catheter, and monitor the pressure during inflation and deflation. This test showed the results comparable to other commercially device. Biocompatibility test: ANT Inflation Device, when connected to a competent device such as a balloon catheter, is a closed system and does not delivery contrast or fluids to the circulation system. ANT Inflation Device Accessory Pack may contact the blood path indirectly as an external communicating device. Both of them meet the
ISO010993-5 ISO 10993-10
ISO 10993-10 ISO 10993-11 ISO 10993A4 ISO 10993A4 ISO 10993-4 ISO 10993-4 ISO 10993A4
Clinical Tests: Not Applicable Substantial Equivalence: Based on the intended use, summary of the studies, the subject device, ANT Inflation Device/ ANT Inflation Device Compact Pack, meet the requirements that are considered adequate for its intended use and is substantially equivalent to the INDEFLATIOR PLUS 30 Inflation Device and PLUS 30 PRIORITY PACK.
