CDE 药物临床试验登记填写指南(V1.1版)
药物临床试验登记与信息公示平台使用说明V1.0版

2.2.3 如何阅读查询结果 查询结果列表的页面展示
3
查询结果列表和二级查询功能
图 5 查询结果列表页面的搜索框
图 6 二级查询功能即在前次查询词下方增加高级查询所有字段的展示 在查询结果列表页面的最上方(图 5)中,可看到用户输入的查询词。单击“二级查询”,
可在前次查询词下方增加高级查询所有字段的展示(图 6),此时,如上所述,可通过“高 级查询功能”增加查询词,进一步精确前次查询结果,缩小前次查询结果范围。例如,前次 查询词为“糖尿病”,单击“二级查询”,“药物类型”选择“化学药物”进行二级查询,查询结 果为平台公示的治疗糖尿病的化学药物临床试验列表。 查询结果排序方式
2.2.2 高级查询 高级查询是指通过定义两个或更多平台给定的查询字段以明确查询内容,使查询结果
更符合用户想要得到的结果。在初级查询框内点击“高级查询”将进入“高级查询页面”(图 4)。用户可在“高级查询页面”进行“高级查询”,另外,对查询结果进行“二级查询”的功能 也是通过高级查询功能实现的。图 4 中点击“查询帮助”时,同样进入帮助和链接模块中并 定位于“如何查询药物临床试验”该问题及其解释。
在高级查询页面,预设了“登记号”、“适应症”、“试验方案编号”、“药物名称”、“药物 类型”、“申办者”、“登记号”、“伦理委员会”、“主要研究者”、“临床参加机构”、“试验状态”11 个查询字段,用户可在相应字段后的文本框内输入或选择查询条件,从而缩小查询结果范 围,提高查询结果的精确性。在上述查询字段的选项中,“药物类型”和“试验状态”以下拉 列表形式展现,用户只需选择其中某项即可,不需手动填写。用户定义一个或多个查询字 段和内容后(不需要每次都全部填写所有查询字段),点击"查询"进行高级查询操作。
药物临床试验登记填写指南(V2

药物临床试验登记填写指南(V2.0版)国家药品监督管理局药品审评中心2020年7月目录1一、简要说明 (4)2二、登记表填写指南 (6)3(一)题目和背景信息 (7)41.登记号(不可更新项、公示项) (7)52.相关登记号(可更新项、公示项) (7)63.药物名称*(不可更新项、选择公示项) (7)74.曾用名(可更新项、选择公示项) (7)85.药物类型*(不可更新项、公示项) (8)96.受理号/备案号*(不可更新项、选择公示项) (8)107.批件号(备案号)/批准日期(默示许可日期/备案日期)*(不可更11新项、不公示项) (8)128.适应症*(不可更新项、公示项) (8)139.试验专业题目*(不可更新项、公示项) (9)1410.试验通俗题目*(可更新项、公示项) (9)1511.试验方案编号*(不可更新项、公示项) (9)1612.试验方案编号重复原因(可更新项、不公示项) (9)1713.方案最新版本号*(可更新项、公示项) (9)1814.版本日期*(可更新项、公示项) (10)1915.是否联合用药*(不可更新项、公示项) (10)2016.联合用药受理号和联合用药批准证明*(不可更新项、不公示项)21 (10)22(二)申请人信息 (10)231.申请人名称(不可更新项、公示项) (10)242.联系人姓名*(可更新项、公示项) (10)253.联系人座机*(可更新项、公示项) (11)264.联系人手机号(可更新项、公示项) (11)275.联系人Email*(可更新项、公示项) (11)286.联系人邮政地址*(可更新项、公示项) (11)297.联系人邮编*(可更新项、公示项) (11)308.经费来源*(可更新项、不公示项) (11)31(三)临床试验信息 (12)321.试验目的*(不可更新项、公示项) (12)332.试验设计* (12)343.受试者信息 (15)354.试验分组 (15)365.终点指标 (17)376.数据安全监查委员会(DMC)*(可更新项、公示项) (18)387.为受试者购买试验伤害保险*(可更新项、公示项) (18)39(四)研究者信息 (19)401.主要研究者信息(可更新项、公示项) (19)412.各参加机构信息(可更新项、公示项) (20)42(五)伦理委员会信息*(不可更新项、公示项) (20)43(六)试验状态信息 (21)441.试验状态*(可更新项、公示项) (21)452.试验人数 (23)463.受试者招募及试验完成日期(不可更新项、公示项) (24)47(七)临床试验方案*(不可更新项、不公示项) (24)48(八)临床试验结果摘要(不可更新项、公示项) (25)49(九)其他附件(不可更新项、不公示项) (25)50(十)登记人及其联系方式 (25)515253一、简要说明54本指南是根据国家药品监督管理局《药品注册管理办法》(国家市场监督55管理总局令第27号)关于药物临床试验登记与信息公示的要求和药品审评中心56(以下简称“药审中心”)《药物临床试验登记与信息公示管理规范(试行)》57(以下简称“登记规范”)的要求以及对“药物临床试验登记与信息公示平台”(以58下简称“登记平台”)的总体目标要求,结合网络实现的具体设计而起草。
药物临床试验机构备案信息平台_操作手册与填报详情

药物临床试验机构备案管理信息平台系统操作手册(V1.2 版)市南方科宇科技2019 年12 月文档信息版本记录目录第一章系统总体说明 (1)1.系统功能综述 (1)1.2系统角色划分 (1)1.3系统主要流程 (2)第二章注册与登录 (3)2.1 注册 (3)2.1.1 统一注册平台 (3)2.1.2 新用户 (5)2.1.3 老用户 (15)2.2 登录 (20)2.2.1 系统登录 (20)2.2.2 首页 (25)第三章机构注册管理 (27)3.1 待核对 (27)3.2 已核对 (29)第四章药物机构备案管理 (31)4.1 机构信息维护(机构填报人) (31)4.1.1 基本信息 (32)4.1.2 组织管理机构 (34)4.1.3 备案专业 (36)4.1.4 伦理委员会 (39)4.1.5 年度总结 (40)4.16接受境外药监部门检查情况报告表 (40)4.17提交备案部审核 (42)第五章咨询单位联系方式 (44)第一章系统总体说明1.1系统功能综述本系统采用JAVA 开发语言,使用B/S 架构。
为了达到更好的使用效果,建议使用 Windows7 及以上版本的操作系统;IE9.0 及以上的浏览器,如使用360 浏览器,请使用极速模式;屏幕分辨率建议设置为1366*768 及以上。
表1.1-1 功能模块表表1.2-1 角色划分表角色角色说明请。
查询监督检查信息。
系统管理员拥有系统所有权限。
图1.3-1 系统主要流程图第二章注册与登录通过https:///web/index 网址,进入国家药品监督管理局网上办事大厅,至少完成法人账号和一个个人账号的注册。
1.新用户:首次使用本系统的临床试验机构,账号注册成功后,需要在本系统中补充资料,并等待监管部门核对,补充资料核对通过后,才能登录系统。
2.老用户:之前已在本系统成功注册的临床试验机构,需要完成新注册的法人账号和一个个人账号,与本系统之前注册的审和填报账户之间的绑定。
《药物临床试验机构工作总结报告填报指南》

.列表说明备案专业/试验现场的变更情况,列出新增、取消或变更地址的专业/试验现场;对新增专业/试验现场 的自评估情况进行概述。
.列表说明主要研究者的变更情况,分专业列出主要研究者的新增或取消的情况;说明新增主要研究者参加3个 药物临床试验的情况。
口无口有变更如有变更,请填下表:
注:类别包括制度、S。P,填写变更前和变更后的文件名称,如变更前和变更后文件名称相同,可填写版本号及 版本日期以示区别。
.其他情况说明
四、质量控制实施情况
.质控实施数量统计
质控实施项目数:一个
质控实施项目数占总项目数的百分比:—
质控实施总次数:次
.说明机构对主要研究者的临床试验管理效能与其承担试验项目类型和数量、参加研究人员数量和经验、受试者 人群类型和数量等进行匹配度分析的情况(如采取的评估方式、评估结果等),以及机构相应的质量管理措施
I.接受国内药品监管部门检查情况
口否口是接受国内药品监管部门检查次数:次如接受过国内药品监管部门检查,请填下表:
注:检查类型包括首次监督检查、日常监督检查、有因检查、药品注册核查、其他检查等。
2.接受境外药品监管部门检查情况
口否口是接受境外药品监管部门检查次数:次如接受过境外药品监管部门检查,请填下表:
.应通过表格的方式总结上一年度开展的药物临床试验项目情况(包括上一年度启动和完成项目,以及其他在研 项目),收集数据截止时间为上一年的12月31日,主要内容如下:
明确试验基本信息,包括品种名称、注册申请人、药品注册分类、机构类型(明确本机构为组长单位或参加单 位)、药物临床试验登记号、国家局药物临床试验批件号/通知书编号/生物等效性试验备案号、试验方案名称、试验 方案编号;
药物临床试验机构备案信息平台操作手册及填报详情

药物临床试验机构备案管理信息平台系统操作手册(V1.2 版)厦门市南方科宇科技有限公司2019 年12 月精品文档文档信息版本记录目录第一章系统总体说明 (1)1. 系统功能综述 (1)1.2 系统角色划分 (1)1.3 系统主要流程 (2)第二章注册与登录 (3)2.1 注册 (3)2.1.1 统一注册平台 (3)2.1.2 新用户 (5)2.1.3 老用户 (15)2.2 登录 (20)2.2.1 系统登录 (20)2.2.2 首页 (25)第三章机构注册管理 (27)3.1 待核对 (27)3.2 已核对 (29)第四章药物机构备案管理 (31)4.1 机构信息维护(机构填报人) (31)4.1.1 基本信息 (32)4.1.2 组织管理机构 (34)4.1.3 备案专业 (36)4.1.4 伦理委员会 (39)4.1.5 年度总结 (40)4.16 接受境外药监部门检查情况报告表 (40)4.17 提交备案内部审核 (42)第五章咨询单位联系方式 (44)第一章系统总体说明1.1系统功能综述本系统采用JAVA 开发语言,使用B/S 架构。
为了达到更好的使用效果,建议使用Windows7 及以上版本的操作系统;IE9.0 及以上的浏览器,如使用360 浏览器,请使用极速模式;屏幕分辨率建议设置为1366*768 及以上。
表 1.1-1 功能模块表1.2系统角色划分表 1.2-1 角色划分表1.3系统主要流程图 1.3-1 系统主要流程图第二章注册与登录通过https:///web/index 网址,进入国家药品监督管理局网上办事大厅,至少完成法人账号和一个个人账号的注册。
1. 新用户:首次使用本系统的临床试验机构,账号注册成功后,需要在本系统中补充资料,并等待监管部门核对,补充资料核对通过后,才能登录系统。
2. 老用户:之前已在本系统成功注册的临床试验机构,需要完成新注册的法人账号和一个个人账号,与本系统之前注册的内审和填报账户之间的绑定。
药物临床试验登记与信息公示平台介绍及常见问题分析_黄钦

《赫尔 辛 基 宣 言 》是 人 体 医 学 研 究 的 国 际 伦 理 准则,其要求临床试验信息必须在首例受试者入组 前对公众公示,还要求不论阳性或阴性的试验结果 均须公示[1]。通过对试验研究信息的公示,有助于 药物研发人员了解整个行业的研发动态,了解和借 鉴他人的研发理念和技术方法。此外,对临床试验 进行登记和信息公示也是研究人员和监管部门对社
[关键词] 药物; 临床试验; 登记; 公示 [中图分类号] R95 [文献标志码] C [文章编号] 1003 - 3734( 2014) 23 - 2721 - 04
Introducing the platform for registry and publicity of drug clinical trials and analyzing the common questions in trial registry
2721 中国新药杂志 2014 年第 23 卷第 23 期
Chinese Journal of New Drugs 2014,23( 23)
这项工作开展以来,我们发现登记人在平台登 记和信息填写的具体操作中,存在一些常见的共性 问题,为此有必要对平台的设计思路和搭建过程予 以介绍,同时针对广大登记人遇到的常见问题进行 答复说明,希望帮助相关人员更好地理解和做好这 项工作。 1 平台搭建的设计思路和简要过程
子账户对其下创建试验的管理功能与主账户的 相同。但是,子账户只能对其下创建的试验进行管 理,不能查看主账户中的其他信息,包括主账户的企 业信息、联系人信息以及其他试验信息等。另外,每 个子账户只能单独管理,不能合并。 2. 1. 4 转让方进行变更试验申办者操作时找不到 该功能键以及转让方能否看到受让方填写的试验信 息 登记表中的“申办者名称”系来源于 CDE 数据 库“申请表 ”中 的 申 请 人 名 称,由 系 统 自 动 关 联,且 登记人不可修改。若发生批件转让,会导致自动关 联的申办者名称与实际批件持有人不符。为解决该 问题,系统设置了“变更试验申办者”功能。发生批 件转让时,可 以 通 过 该 功 能 将 登 记 表 内 的“申 办 者 名称”项变更为受让方名称。
药物临床试验登记填写指南(V1.1版)

药物临床试验登记填写指南(V1.1版)国家食品药品监督管理总局药品审评中心二〇一四年十二月一日目录12一、简要说明 (1)3二、登记表填写指南 (3)4(一)题目和背景信息* (3)登记号 (3)5临床试验批件号及批准日期* (4)6适应症* (4)7试验通俗题目* (4)8试验专业题目* (4)9试验方案编号* (5)10临床申请受理号* (5)11药物名称* (5)12药物类型* (6)1314(二)申办者信息* (6)申办者名称* (6)15联系人相关信息* (6)16试验项目经费来源* (7)1718(三)临床试验信息* (7)试验目的* (7)19试验设计* (8)20受试者信息 (10)21试验分组* (11)22终点指标 (14)23数据安全监察委员会(DMC)* (15)24为受试者购买试验伤害保险* (15)25(四)第一例受试者入组日期 (15)2627(五)试验终止日期 (16)28(六)研究者信息* (16)主要研究者信息* (16)29各参加机构信息* (17)30(七)伦理委员会信息* (17)3132(八)试验状态* (18)进行中 (18)33已完成 (18)34主动暂停 (18)35被叫停 (19)3637(九)试验信息的登记人及其联系方式* (19)一、简要说明38本指南是根据国家食品药品监督管理总局2013年第28号公告“关于药物临39床试验信息平台的公告”(以下简称“28号公告”)的要求以及药品审评中心(以40下简称“药审中心”)对“药物临床试验登记与信息公示平台”(以下简称“平台”)41的总体目标要求,结合网络实现的具体设计而起草。
42本指南用于指导临床试验申办者指定的登记人完整如实地填写临床试验的43相关信息,完成药物临床试验信息的登记操作。
临床试验申办者应指定特定登记44人实施试验登记和保证所登记试验信息的真实完整。
登记人在进行试验登记时须45注意以下事项:461、根据28号公告要求:凡获国家食品药品监督管理总局临床试验批件47并在我国进行临床试验(含生物等效性试验、PK试验、I、Ⅱ、Ⅲ、48Ⅳ期试验等)的,均应在本平台进行登记和信息公示。
cde申报资料模板

cde申报资料模板
以下是一些关于CDE申报资料的信息和注意事项:
CDE是药品审评中心的简称,是国家药品监督管理局下属的一个机构,负责药品审评和注册等工作。
在向CDE提交药品注册申请时,需要按照规定的格式和要求提交申报资料,以确保申请能够顺利通过审评。
申报资料的格式和要求因申请类型和药品种类的不同而有所不同,但一般包括以下内容:
1. 药品注册申请表:包括申请人信息、药品基本信息、研究情况、临床试验情况等。
2. 药学研究资料:包括药学研究总结、药学研究报告、质量标准、工艺研究资料、稳定性研究资料等。
3. 临床研究资料:包括临床试验总结、临床试验报告、伦理审查报告等。
4. 综述资料:包括药品概述、药学研究综述、临床研究综述、国内外文献综述等。
5. 其他资料:包括申请人资质证明文件、药品制造和质量控制证书等。
在准备申报资料时,需要注意以下几点:
1. 确保资料完整、真实、准确,符合规定的格式和要求。
2. 按照规定的顺序和要求整理资料,确保审评人员能够顺利查阅和理解。
3. 重视药学研究和临床研究的科学性和规范性,确保数据真实可靠。
4. 注意保护知识产权,避免侵犯他人专利或商标。
5. 在提交申请前,进行自查和审核,确保没有遗漏或错误。
如果您需要更具体的帮助,建议您查阅CDE官方网站或咨询专业人士。
药物临床试验登记与信息公示平台使用说明V 版

药物临床试验登记与信息公示平台使用说明(V1.0版)国家食品药品监督管理总局药品审评中心二〇一四年十二月一日目录1.简介 (1)2.平台使用说明 (1)2.1 首页 (1)2.2 试验公示和查询 (2)2.2.1 初级查询 (2)2.2.2 高级查询 (3)2.2.3 如何阅读查询结果 (3)2.2.4 如何使用查询结果 (7)RSS订阅功能的使用 (7)下载查询结果 (8)打印查询结果 (9)2.3 试验登记 (9)2.3.1 主账户注册 (9)2.3.2 账户管理 (10)账户管理 (10)预登记 (11)退出 (12)2.3.3 受理号表格 (12)新增试验 (12)变更试验申办者 (13)2.3.4 临床试验列表 (13)2.3.5登记表填写 (15)2.4 帮助和链接 (16)2.5 信息统计 (17)2.6 关于平台 (19)1.简介“药物临床试验登记与信息公示平台”(简称“平台”)是基于国家食品药品监督管理总局(CFDA)的药物临床试验批准数据,对获准在我国开展的所有药物临床试验实行登记与社会公示的信息平台。
根据国家食品药品监督管理总局2013年9月6日发布的第28号公告要求,临床试验方案的关键信息必须在第一例受试者入组前公示,并且在临床试验过程中若这些关键信息发生变化,需在平台做相应更新。
为了帮助用户科学和便捷使用网站各项功能,根据平台当前功能设计撰写本文档。
平台网站共包含七个模块:首页、试验公示和查询、试验批准信息、试验登记、帮助和链接、信息统计以及关于平台。
本说明基于以上七个模块介绍平台的各项功能,指导用户如何有效浏览、科学查询和使用平台信息,指导试验登记人进行药物临床试验信息登记和公示。
查询试验时主要使用的是“试验公示和查询”模块,在本文第2.2章节介绍操作方法。
登记试验信息时使用的是“试验登记”模块。
在本文第2.5章节介绍方法。
2.平台使用说明2.1 首页平台首页自上而下分为五个部分(图1):一是菜单栏上方的平台中英文标题和简介,以及阐述重要问题的“郑重声明”和“重要提示”链接。
cde申报资料模板

cde申报资料模板CDE(China Drug Evaluation)申报资料是指在中国进行药物注册申报时所需要提交的相关材料。
这些资料主要用于对药物的安全性、有效性和质量进行评价,并最终决定是否批准该药物上市。
为了帮助申报人员准备相应的申报资料,以下是一份相关参考内容,供申报人员参考。
一、企业资质文件1.1 企业营业执照副本复印件1.2 企业生产许可证副本复印件1.3 企业药品生产许可证副本复印件1.4 企业药品GMP证书复印件二、研究开发资料2.1 药物研发计划:包括研究目标、研究设计、研究方案等相关信息2.2 药物临床试验资料:包括临床试验计划、试验结果、药物临床安全性评估等信息2.3 临床试验伦理委员会批准文件及委员会评估报告2.4 药物质量控制文件:包括药物的质量标准和质量控制方法等信息2.5 药物不良反应监测和报告文件:包括不良反应的监测和报告方法、不良反应事件的报告记录等信息三、药物监管文件3.1 药物批准文件:包括国内外相关药物批准文件的复印件3.2 国内外相关药物市场情况的调查分析报告四、药物学资料4.1 药物化学和配方学资料:包括药物的化学结构、化学性质以及配方的成分和比例等信息4.2 药物制剂学资料:包括药物的制剂形式、质量控制和稳定性等信息4.3 药物药理学资料:包括药物的作用机制、药效学、药动学以及药物之间的相互作用等信息4.4 药物毒理学资料:包括药物的急性毒性、亚急性毒性、慢性毒性以及生殖毒性等信息五、药物临床试验资料5.1 药物临床试验同意书和知情同意书5.2 药物临床试验方案和研究计划5.3 药物临床试验结果的统计分析报告5.4 药物临床试验的不良反应监测和报告文件六、药物充分性和适应性资料6.1 药物充分性资料:包括药物的临床试验结果、药物安全性和有效性的评价等信息6.2 药物适应性资料:包括药物的适应症、用法和用量等信息以上是CDE申报资料模板的相关参考内容,具体的申报要求还需要根据相关法规和CDE的相关通知进行调整。
药物临床试验机构备案信息平台操作手册及填报详情

药物临床试验机构备案管理信息平台系统操作手册(版)厦门市南方科宇科技有限公司2019 年12 月文档信息版本记录目录第一章系统总体说明 (1)1.系统功能综述 (1)1.2系统角色划分 (1)1.3系统主要流程 (2)第二章注册与登录 (3)注册 (3)统一注册平台 (3)新用户 (5)老用户 (15)登录 (20)系统登录 (20)首页 (25)第三章机构注册管理 (27)待核对 (27)已核对 (29)第四章药物机构备案管理 (31)机构信息维护(机构填报人) (31)基本信息 (32)组织管理机构 (34)备案专业 (36)伦理委员会 (39)年度总结 (40)4.16接受境外药监部门检查情况报告表 (40)4.17提交备案内部审核 (42)第五章咨询单位联系方式 (44)第一章系统总体说明1.1系统功能综述本系统采用 JAVA 开发语言,使用 B/S 架构。
为了达到更好的使用效果,建议使用 Windows7 及以上版本的操作系统;及以上的浏览器,如使用 360 浏览器,请使用极速模式;屏幕分辨率建议设置为 1366*768 及以上。
表功能模块表表角色划分表角色角色说明请。
查询监督检查信息。
系统管理员拥有系统所有权限。
1.3系统主要流程图系统主要流程图第二章注册与登录通过网址,进入国家药品监督管理局网上办事大厅,至少完成法人账号和一个个人账号的注册。
1.新用户:首次使用本系统的临床试验机构,账号注册成功后,需要在本系统中补充资料,并等待监管部门核对,补充资料核对通过后,才能登录系统。
2.老用户:之前已在本系统成功注册的临床试验机构,需要完成新注册的法人账号和一个个人账号,与本系统之前注册的内审和填报账户之间的绑定。
无论是新用户还是老用户,最终法人账号应绑定为系统的内审账户,个人账号应绑定为系统的填报账户。
2019 年12 月1 日,随着《药物临床试验机构管理规定》(以下简称《规定》)的发布,“医疗器械临床试验机构备案管理信息系统”升级为“药物和医疗器械临床试验机构备案管理信息系统”,开放药物临床试验机构备案功能,原来已经在“医疗器械临床试验机构备案管理信息系统”中完成账号申请的,并且已经在国家药品监督管理局网上办事大厅完成账号绑定的,可直接选择子系统进行后续操作;如果没有在国家药品监督管理局网上办事大厅完成账号绑定的,按照老用户进行后续操作。
药物临床试验登记和信息公示平台使用手册

药物临床试验登记和信息公示平台使用手册1概述药物临床试验是药物研发的重要组成部分,为加强药品临床试验管理,中心开发了“药物临床试验登记和信息公示平台”栏目。
平台的建立是中心推进并落实临床研究“全链路”监管系统建设的具体举措,将有助于中心加强对国内药品临床研究的管理,有助于规范申请人的临床研究行为,为临床研究过程的动态监管创造条件。
平台由“临床试验信息公示”、“临床试验登记”和“中心内部管理”三部分组成。
“临床试验信息公示”将对申请人登记的临床试验信息和已批准临床技术管理信息中属于需向社会公开的部分予以公开;“临床试验登记”是申请人依据获批的临床试验批件,按要求填写临床试验信息,直至最终完成临床试验提交中心备案;“中心内部查询管理”是中心对申请人填写的临床试验信息进行有效的备案管理,为申报生产阶段的技术审评提供更有效的信息支持。
2药物临床试验登记2.1企业登录途径一:企业访问药品审评中心网站(),如图1所示,在网站主页“用户登录”区输入正确的“账号”、“密码”及“验证码”,“登录”进入申请人之窗,点击左侧的“临床试验品种”栏目,如图2所示。
然后点击“新增试验项目”则弹出“新增试验项目”对话框,如图3所示,填写受理号后点击“提交”,即进入该品种的临床试验登记页面,如图4所示。
图1图2图3……图4途径二:企业可以直接登录中心网站主页,如图1所示,直接点击“临床试验登记与公示”栏目进入“药物临床试验登记和信息公示平台”,如图5 所示。
点击“临床试验登记”则直接转入申请人之窗登录窗口,登录申请人之窗后即可按照途径一的步骤进入“临床试验信息登记单”页面,如图4所示。
图52.2药物临床试验登记进入“临床试验信息登记单”页面后,企业可以根据登记单要求填写相关信息,其中*号标记项为首次必填信息。
企业填写完相关信息后可以点击“保存”保存已填写的信息,此时保存的信息并不对外公示,企业仍可以对保存后的部分信息进行更改;点击“提交”则提交并对外公示已填写的信息,提交后部分信息也可以更改;点击“关闭”则不保存此次填写的信息,临床试验信息登记单如图4所示。
药物临床试验登记表
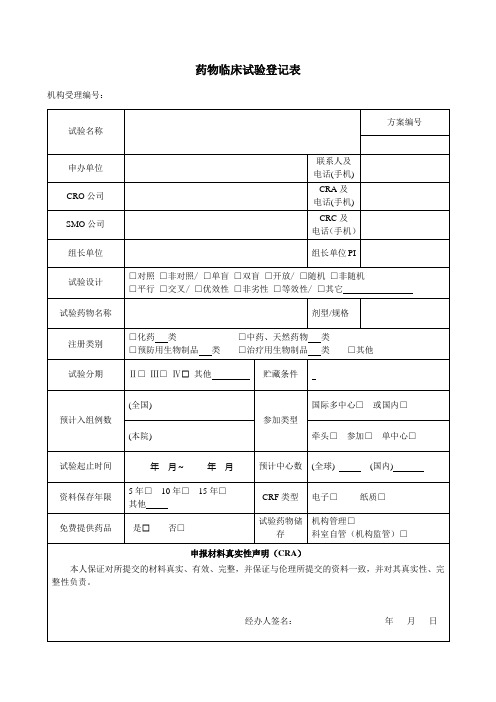
试验分期
Ⅱ□型
国际多中心□或国内□
(本院)
牵头□参加□单中心□
试验起止时间
年 月~年月
预计中心数
(全球)(国内)
资料保存年限
5年□10年□15年□
其他
CRF类型
电子□纸质□
免费提供药品
是□否□
试验药物储存
机构管理□
本人已审阅所有临床试验资料,并保证所提交的材料真实、有效、完整。同意并确认上述人员参加该临床试验。遵照GCP和方案要求,保证试验过程真实规范。
主要研究者签字:年月日
(此由机构填写)
机构意见:经形式审查资料合格。
资料管理员签字:审查人签字:年月日
注:1.表格完成后请发送电子版至机构邮箱:*******************,机构登记表正反面打印。
药物临床试验登记表
机构受理编号:
试验名称
方案编号
申办单位
联系人及
电话(手机)
CRO公司
CRA及
电话(手机)
SMO公司
CRC及
电话(手机)
组长单位
组长单位PI
试验设计
□对照□非对照/□单盲□双盲□开放/□随机□非随机
□平行□交叉/□优效性□非劣性□等效性/□其它
试验药物名称
剂型/规格
注册类别
□化药类□中药、天然药物类
2.研究团队要求:人员组成至少有:PI;Sub I 1名;研究护士1名;药物管理人员1名。研究团队成员必须经过GCP培训,具有省级及以上GCP证书。
如为研究者发起的临床试验,请填写下列几项:(如适用)
研究发起单位
发起研究者姓名
第三方赞助单位
cde 申报资料 撰写要求

cde 申报资料撰写要求
(原创实用版)
目录
1.引言:简述 cde 申报资料的重要性和必要性
2.cde 申报资料的具体要求:
a.内容要求
b.格式要求
c.撰写技巧
3.申报资料的注意事项:
a.数据准确性
b.结构清晰
c.语言表达
4.结论:cde 申报资料的撰写对于药品注册的重要性
正文
cde 申报资料是药品注册过程中必不可少的一部分,它是药品监管部门对药品进行审批的重要依据。
因此,cde 申报资料的撰写要求十分严格,需要遵循一定的规范和要求。
首先,cde 申报资料的内容要求非常明确。
申报资料需要详细描述药品的研发过程、药理作用、药代动力学、临床试验结果等信息,这些信息是药品监管部门评估药品安全性、有效性的重要依据。
因此,申报资料的内容必须真实、准确、完整。
其次,cde 申报资料的格式要求也很严格。
申报资料需要按照规定的格式进行排版,例如,文字、表格、图片等需要按照一定的顺序排列,以便于药品监管部门进行审阅。
在撰写 cde 申报资料时,还有一些技巧需要注意。
例如,申报资料的语言表达需要简洁明了,避免使用过于复杂的术语,以免影响审阅效率。
此外,申报资料的结构也需要清晰,方便药品监管部门快速了解药品的信息。
在申报资料的撰写过程中,还需要注意以下几个问题。
首先,申报资料中的数据必须准确无误,不能存在任何虚假信息。
其次,申报资料的结构需要清晰,以便于药品监管部门进行审阅。
最后,申报资料的语言表达需要清晰明了,避免使用过于复杂的术语。
总的来说,cde 申报资料的撰写对于药品注册的重要性不言而喻。
CDE 药物临床试验登记填写指南(V1.1版)

药物临床试验登记填写指南(V1.1版)国家食品药品监督管理总局药品审评中心二〇一四年十二月一日目录12一、简要说明 (1)3二、登记表填写指南 (3)4(一)题目和背景信息* (3)登记号 (3)5临床试验批件号及批准日期* (4)6适应症* (4)7试验通俗题目* (4)8试验专业题目* (4)9试验方案编号* (5)10临床申请受理号* (5)11药物名称* (5)12药物类型* (6)1314(二)申办者信息* (6)申办者名称* (6)15联系人相关信息* (6)16试验项目经费来源* (7)1718(三)临床试验信息* (7)试验目的* (7)19试验设计* (8)20受试者信息 (10)21试验分组* (11)22终点指标 (14)23数据安全监察委员会(DMC)* (15)24为受试者购买试验伤害保险* (15)25(四)第一例受试者入组日期 (15)2627(五)试验终止日期 (16)28(六)研究者信息* (16)主要研究者信息* (16)29各参加机构信息* (17)30(七)伦理委员会信息* (17)3132(八)试验状态* (18)进行中 (18)33已完成 (18)34主动暂停 (18)35被叫停 (19)3637(九)试验信息的登记人及其联系方式* (19)一、简要说明38本指南是根据国家食品药品监督管理总局2013年第28号公告“关于药物临39床试验信息平台的公告”(以下简称“28号公告”)的要求以及药品审评中心(以40下简称“药审中心”)对“药物临床试验登记与信息公示平台”(以下简称“平台”)41的总体目标要求,结合网络实现的具体设计而起草。
42本指南用于指导临床试验申办者指定的登记人完整如实地填写临床试验的43相关信息,完成药物临床试验信息的登记操作。
临床试验申办者应指定特定登记44人实施试验登记和保证所登记试验信息的真实完整。
登记人在进行试验登记时须45注意以下事项:461、根据28号公告要求:凡获国家食品药品监督管理总局临床试验批件47并在我国进行临床试验(含生物等效性试验、PK试验、I、Ⅱ、Ⅲ、48Ⅳ期试验等)的,均应在本平台进行登记和信息公示。
CDE格式——精选推荐

化学药药学资料CTD格式电子文档标准(试行)本标准用于规范按CTD格式申报的化学药药学资料的电子文档。
包括药学研究主要信息汇总表和申报资料。
1. 编辑软件版本使用Microsoft Office Word 2003版或更高版本。
2. 字体、字号、行间距和字体颜色2.1 字体中文字体推荐使用宋体;英文字体推荐使用Times New Roman(化学结构式中的英文字体除外)。
2.2 字号字号通常要求使用小四号字。
叙述性文字推荐使用小四号字,表格推荐使用五号字,避免使用更小号字。
在选择表格的字号时需考虑如下两方面:在同一张页面上显示相对完整的信息;保证字迹清晰、容易阅读。
脚注推荐使用五号字体。
2.3 行间距行间距通常为单倍行距。
2.4 字体颜色推荐使用黑色字体,超文本链接建议使用蓝色。
3. 页面方向适当的页面方向可以方便审评专家阅读,文档应设臵适于阅读和打印的页面方向。
纵向页面能够正常显示时,页面应设臵为纵向方向;纵向页面无法完整显示时,应设臵为横向显示。
不应设臵旋转页面。
4. 页面大小4.1 纸张大小页面设臵纸张大小为A4。
4.2 页边距纵向页面:左边距至少为2.5cm,以避免在打印和装订过程中遮盖信息。
上边距至少为2cm,其他边距设臵为至少1cm。
横向页面:上边距至少为2.5cm,右边距至少为2cm,其他边距设臵为至少1cm。
页眉和页脚的信息应在上述页边距内显示,保证文本在打印或装订中不丢失信息。
5. 文档结构目录必须要构建文档结构目录和正文目录,应根据CTD结构标出所有文本标题层级。
文档结构目录显示的标题层级关系应和正文目录一致,正文目录应标示各层级标题页码。
目录中列出的项目可以包括表格、数字、出版物、其他参考文献和附件,可以设臵超文本链接或书签进行导航。
6. 图表图表在文档中能够正常显示,可直接插入在文档中;也可采取添加附件以超文本链接方式查阅图表。
7. 文档中的超文本链接为保证超文本链接的效果,请使用相对路径创建超文本链接,应避免用绝对路径链接的方式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
药物临床试验登记填写指南(V1.1版)国家食品药品监督管理总局药品审评中心二〇一四年十二月一日目录12一、简要说明 (1)3二、登记表填写指南 (3)4(一)题目和背景信息* (3)登记号 (3)5临床试验批件号及批准日期* (4)6适应症* (4)7试验通俗题目* (4)8试验专业题目* (4)9试验方案编号* (5)10临床申请受理号* (5)11药物名称* (5)12药物类型* (6)1314(二)申办者信息* (6)申办者名称* (6)15联系人相关信息* (6)16试验项目经费来源* (7)1718(三)临床试验信息* (7)试验目的* (7)19试验设计* (8)20受试者信息 (10)21试验分组* (11)22终点指标 (14)23数据安全监察委员会(DMC)* (15)24为受试者购买试验伤害保险* (15)25(四)第一例受试者入组日期 (15)2627(五)试验终止日期 (16)28(六)研究者信息* (16)主要研究者信息* (16)29各参加机构信息* (17)30(七)伦理委员会信息* (17)3132(八)试验状态* (18)进行中 (18)33已完成 (18)34主动暂停 (18)35被叫停 (19)3637(九)试验信息的登记人及其联系方式* (19)一、简要说明38本指南是根据国家食品药品监督管理总局2013年第28号公告“关于药物临39床试验信息平台的公告”(以下简称“28号公告”)的要求以及药品审评中心(以40下简称“药审中心”)对“药物临床试验登记与信息公示平台”(以下简称“平台”)41的总体目标要求,结合网络实现的具体设计而起草。
42本指南用于指导临床试验申办者指定的登记人完整如实地填写临床试验的43相关信息,完成药物临床试验信息的登记操作。
临床试验申办者应指定特定登记44人实施试验登记和保证所登记试验信息的真实完整。
登记人在进行试验登记时须45注意以下事项:461、根据28号公告要求:凡获国家食品药品监督管理总局临床试验批件47并在我国进行临床试验(含生物等效性试验、PK试验、I、Ⅱ、Ⅲ、48Ⅳ期试验等)的,均应在本平台进行登记和信息公示。
492、关于预登记:28号公告要求,登记人须在临床试验获得批准后1个50月内完成预登记。
预登记成功后可获得预登记号,预登记号以CDEL 51开头,后附8位阿拉伯数字。
预登记操作详见下文及相应网页的帮52助链接。
533、关于“提交说明”:28号公告要求,临床试验若在获批准1年内未54完成首次信息公示的,须提交说明。
通过在成功预登记后生成的受55理号表格中点击“提交文档”按键上传说明文件。
每年可上传1个56说明文件。
574、一个临床试验对应一个试验方案编号,只能登记一条记录。
方案编58号一旦确定不可变更,必须注明版本号。
若试验过程中,该编号试59验方案的版本发生了变化,则仅可更新版本号,不可变更方案编号。
605、登记的信息首次保存后获得平台自动赋予的具有唯一性身份标识的61“登记号”,此后对于该临床试验信息的增加和更新均在该登记号的62记录上操作。
636、根据28号公告要求,每个试验信息的首次登记、提交及公示必须在64第一例受试者入组前完成。
登记人在获得伦理委员会结论后,应尽65早完成首次登记和提交。
为预留审核时间,应在第一例受试者入组66前至少30天完成首次提交操作。
677、试验信息须经过药审中心工作人员的规范性和逻辑性审核方予以公68示,但这种规范性和逻辑性的审核并不意味着药审中心与申办者就69临床方案的科学合理性达成某种承诺和契约。
708、试验信息完成首次公示后,若1年内无任何信息更新,需在登记表71最下方的“相关说明”处简要说明原因。
729、临床试验信息登记表所列条目均为必须填写的试验信息。
除特别说73明外,其余条目信息均对公众公示。
根据内容和性质又分为首次必74填项(首次提交时必须登记的信息,否则无法提交)和首次选填项(首75次提交时若暂无此项信息,可以不填);不可更新项(条目内容一经76公示后便不可更新)和可更新项(条目内容在公示后可以根据试验77情况进行更新)。
78首次必填项:临床试验批件号及批准日期、适应症、试验通俗/专业79题目、试验方案编号、临床申请受理号、药物名称、药物类型、申80办者信息(申办者名称、联系人相关信息和试验项目经费来源)、试81验目的、试验设计、受试者信息(除实际入组人数外)、试验分组、82主要终点指标及评价时间、数据安全监察委员会、为受试者购买试83验伤害保险、研究者信息(主要研究者信息和各参加机构信息)、伦84理委员会信息、试验状态和试验信息的登记人及其联系方式。
85首次选填项:次要终点指标及评价时间、第一例受试者入组日期、86实际入组人数和试验终止日期。
87不可更新项:适应症、试验专业题目、临床申请受理号、药物类型、88申办者名称、试验目的、试验设计、受试者年龄、受试者性别、健89康受试者、目标入组人数、实际入组人数、试验分组、终点指标、90第一例受试者入组日期和试验终止日期。
91可更新项:相关登记号、试验通俗题目、试验方案编号、药物名称92曾用名、申办者联系人相关信息、试验项目经费来源、受试者入选/ 93排除标准、试验药和对照药的生产地/生产日期/批号、数据安全监94察委员会、为受试者购买试验伤害保险、主要研究者信息、各参加95机构信息、伦理委员会信息和试验状态。
可更新项的信息内容在试96验过程中如有变更,应在30天内完成更新及公示。
97二、登记表填写指南98本指南的编写顺序与平台“试验登记”模块中的临床试验信息登记表的条目99顺序一致;首次必填项的条目以“*”标记。
进行登记操作时,按“保存”键仅100在平台保存已完成填写的信息,但不提交,对于不可更新项仍可以修改;按“提101交”键则将本次登记内容提交至药审中心待审核,审核过程中无法编辑登记内容,102只能查看;按“打印”键则打印整个登记表内容,包括所有已填和未填内容;按103“下载”键则可以下载完整登记表;按“返回”键则关闭当前登记表页面。
登记104人可进行多次保存但不提交的操作以备因信息不确定或短时无法完成填写登记105的情况。
106107(一)题目和背景信息*108登记号109登记号是该临床试验具有专属唯一性的身份标识,即一个临床试验对应一110个登记号,反之亦然。
111试验信息填写后首次保存即由平台系统按照编号原则自动赋予登记号。
登记112号格式为“CTR********”,其中“CTR”是来源于“Clinical Trials Register”113各首字母的简称,3个字母后为8位阿拉伯数字,前4位为该临床试验登记的年份,114后4位为该试验在本年份登记的流水号。
同一个药物名称或临床申请受理号可能115开展多个临床试验,则具有多个登记号。
116举例:“CTR20130012,指在2013年进行首次登记的第12个药物临床试验。
117如果试验药的其他临床试验已经在平台内进行过登记,即已经具有平台赋予118的其他试验登记号,则需在平台自动赋予的登记号下方的“相关登记号”文本框119内登记该试验药其他所有临床试验的登记号,包括已完成的试验和未完成的试验, 120不同登记号之间以“;”号间隔。
121举例:“登记号:CTR20130012(平台自动赋予的登记号)122相关登记号:CTR20120009;CTR20120056”123124临床试验批件号及批准日期*125在相应处分别对应填写国家食品药品监督管理总局批准的该临床试验批件126号及批准日期。
该试验包含多个批件时,需填写所有批件的相关信息,填写顺序127与预登记上传多个批件时的要求一致。
128129适应症*130该临床试验所针对的主要疾病状态,其中的医学术语关键词应参考和采用普131遍应用的美国国立医学图书馆(NLM)编订的MeSH主题词填写,适应症的描述应132清晰简洁,避免缩写和简略语。
(不可更新项)133134试验通俗题目*135公示平台的设计中,为针对不同的受众,临床试验题目分为“通俗和专业”136二种表达方式,均要求填写。
通俗题目由非专业词汇描述,应可被非专业的一般137公众理解其含义。
请勿超过25个汉字。
138举例:“评价手足口病疫苗的安全性和有效性研究”;139“格列美脲与二甲双胍合用时对糖尿病患者饭后新陈代谢的影响研究”。
140141试验专业题目*142试验专业题目应通过准确的医学术语进行专业的描述。
请勿超过50个汉字。
143(不可更新项)144举例:“评价人肠道病毒71型(EV71)灭活疫苗安全性和有效性的随机、双145盲、安慰剂对照的III期临床试验”;146“格列美脲与二甲双胍联用对2型糖尿病患者餐后的β细胞功能、新陈代谢147和氧化应激的影响研究”。
148149试验方案编号*150试验方案编号是临床试验申办者对某个试验方案自行编码的代号,须与临151床申请技术审评时的申报资料一致。
需注意一个试验方案对应一个专属编号。
152举例:“GSK025”;“CP12-0922”153154临床申请受理号*155申请开展临床试验时的申报受理号。
该信息将由平台系统自动关联,不需登156记人填写。
但登记人需选择该条目是否愿意被公示。
157如果该试验包含有其他受理号而未被登记人用以选择进行登记操作的,即未158由平台自动关联入登记表的受理号,需在自动关联的临床申请受理号下方“相关159受理号”文本框内登记所有其他受理号,不同受理号之间以“;”号间隔。
比如以160下情况:试验中的试验药包含多个规格、一个规格一个受理号,即该试验包含多161个受理号,而登记人登记该试验时只需选择其中一个受理号进行登记操作,其余162登记号则需填写到“相关受理号”文本框内。
163举例:“临床申请受理号CXHL*****01(登记人选择并由系统自动关联入登记164表中),相关受理号:CXHL*****02;CXHL*****03”165166药物名称*167指申请开展临床试验时的申报药物的名称。
该信息将由平台系统自动关联,168不需登记人填写。
169如果试验药曾使用过不同于平台自动关联入登记表的名称,如在该试验药的170其他临床试验中,或在临床申请技术审评的申报资料中所使用的名称,或通用名171等,需在上述平台自动关联的药物名称下方的“曾用名”文本框内登记所有其他172名称。
173登记人需选择该条目是否愿意被公示。
如选择“不公示”,则该项下“药物174名称”和“曾用名”均不公示,此时,该项信息公示为“试验分组”项下第一行175的“试验药名称”,此信息由登记人填写。
176药物类型*177按照申请临床时所定义的药物类型,在中药/天然药物、化学药物或生物制178品中勾选其一。
