临床试验项目管理系统53页PPT
药物临床试验文件管理PPT课件

建立完善的文件管理制度,明确 文件的分类、保存期限、使用权 限等,确保文件的完整性和安全 性。
文件管理的原则与目标
原则
真实、准确、完整、安全、可追溯。
目标
确保药物临床试验文件的真实性、完整性和可靠性,保障受试者的权益和安全, 提升药物研发的质量和效率。
02
药物临床试验文件的种 类与内容
试验方案与相关文件
培训方法
采用理论讲授、实例演示、角色扮演 、互动讨论等多种教学方法,使受训 人员更好地理解和掌握药物临床试验 文件管理的知识和技能。
培训效果评估与改进
评估方式
通过考试、问卷调查、小组讨论等方式,对受训人员的药物 临床试验文件管理知识和技能进行评估。
反馈与改进
根据评估结果,及时向受训人员反馈,针对不足之处进行补 充和改进,提高培训效果和质量。同时,不断优化培训计划 和内容,以适应药物临床试验文件管理的最新法规和要求。
随着技术的不断发展,药物临床试验文件的存储与保 管方式也在不断变化。为了适应这种变化,应定期评 估现有存储和保管技术的优缺点,并及时更新技术和 设备。此外,应关注新技术的发展趋势,以便及时采 用更高效、安全、可靠的存储与保管方式。
文件的检索与利用
总结词:高效便捷
详细描述:为了方便对药物临床试验文件的检索与利用,应建立完善的检索系统和方法。这包括关键 词、受试者编号、试验阶段等检索条件,以便快速找到所需的文件。同时,应提供多种检索方式,以 满足不同用户的需求和提高检索效率。
文件的存储与保管
总结词:长期保存
详细描述:药物临床试验文件的存储与保管应遵循长期保存的原则。根据相关法规和指导原则的要求,有些文件需要保存一 定的期限,如不良事件报告需要保存至药品上市后监管期结束。因此,应采取适当的措施,确保文件能够长期保存并随时可 查。
药品临床试验管理规范ppt课件

9.
研究中的药品应按GMP要求生产、处理与保存, 并应按照批准了的试验方案中的规定使用。
能确保临床试验各方面质量的具有操作规程的 工作系统应加以实施。
ICH指导原则(ICH-GCP)
• • • • • • • • • 内容目录 前言 1. 专业术语名词解释 2. ICH-GCP基本原则 3. 机构审查委员会/独立的伦理委员会 3.1 职责 3.2 组成,功能与操作 3.3 工作程序 3.4 记录
ichichgcp31职责32组成功能与操作33工作程序34记录ichgcp续141研究者的资格与认同42适当的研究条件43对受试者的医疗责任44与irbiec对话45对试验方案的依从性46试验药品47随机化步骤或试验中失盲48受试者知情同意书49记录与报告410进展报告411安全性报告412提前终止试验与试验暂停413试验研究者的总结报告ichgcp51确保质量与质量控制52合同研究组织cro53医学专长54试验设计55试验管理数据处理与记录保管56试验研究者选择57现有与试验有关的责任与功能的分配58对受试者与研究者的补偿59试验费用510向管理当局的报告提交书511irbiec审批件512有关研究中药品的信息资料513研究中药品的制造包装标签与编码ichgcp514研究中药品的供应与管理515记录通路516安全性情报517药物不良反应报告518监视monitoring5181目的5182监视员的选择与资格5183监视范围与性质5184监视员职责5185监视程序5186监视报告ichgcp519监察audit5191目的5192监察人员的选择与资格5193监察程序520缺乏依从性521提前终止或试验暂停522临床试验研究报告523多中心临床试验ichgcp续561一般资料信息62背景资料信息63试验目的与本项试验目的64试验设计65受试者的选择与剔除66受试者的治疗67疗效评价68安全性评价69统计分析ichgcp610原始资料文件的直接通路611质量控制与确保质量的程序612伦理考虑613数据处理与记录保管614经费与保险615发表政策616增补ichgcp续771简介721标题页
[课件]临床试验文件管理PPT
![[课件]临床试验文件管理PPT](https://img.taocdn.com/s3/m/fc0a36f176a20029bd642dab.png)
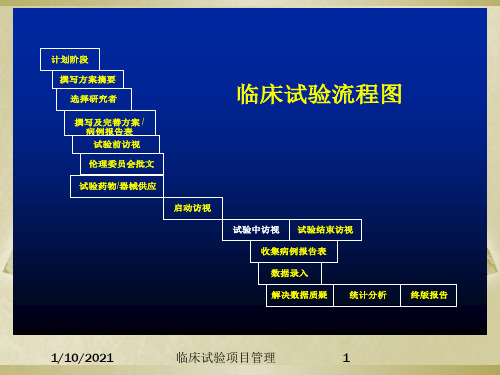
计划阶段 撰写方案摘要 选择研究者 撰写及完善方案 / 病例报告表 试验前访视 伦理委员会批文 试验药物供应 启动访视 试验中访视 试验结束访视
临床试验流程图
收集病例报告表 数据录入 解决数据质疑 统计分析 终版报告
临床试验项目的基本要素
产品
(临床试验报告)
时间表
资源
临床试验项目的生命周期
安全性:
药品不良事件 药品不良反应 严重不良事件的报告
试验药物:
存储、使用和发放记录完整 试验药物仅用于试验人群
–药检报告:
临床试验药品需药检报告 更换批号,应该有相应的药检报告 厂家药检报告可接受
D a te o f B ir th DD Race: W h ite M M YY B la c k
Sex C h in e s e
O th e r : s p e c ify :
V IT A L S IG N S W e ig h t ( w ith o u t s h o e s ) (k g ) S ittin g B lo o d P r e s s u r e a n d H e a r t/P u ls e R a te P r io r to a n y b lo o d p r e s s u r e m e a s u r e m e n ts b e in g ta k e n , s u b je c ts s h o u ld h a v e r e s te d in t h e c lin ic f o r a t le a s t 5 m in u t e s . B lo o d p r e s s u r e m u s t b e m e a s u r e d in t h e s a m e a r m a t e a c h v is it. H a v e b lo o d p r e s s u r e a n d h e a r t/p u ls e r a te b e e n ta k e n a t th is v is it? No end o f th e C R F . Is th e r e a n y c lin ic a lly s ig n ific a n t a b n o r m a lity ? No Yes A rm : p le a s e r e c o r d d e ta ils in S ig n ific a n t M e d ic a l/S u r g ic a l H is to r y p a g e . L e ft R ig h t Yes P le a s e r e c o r d th e r e s u lts in th e V ita l S ig n s L o g a t th e H e ig h t (m )
临床试验项目管理培训课件
1/10/2021
临床试验1项3 目管理
文件管理(3)
试验结束阶段
试验用药的回收和销毁 CRF的回收及数据的质疑 试验文件完整性的确认 伦理委员会的通报 临床试验的报告
1/10/2021
临床试验1项4 目管理
临床试验项目管理要素
文件管理
进度管理
质量管理 风险管理 1/10/2021
临床试验1项5 目管理
Have blood pressure and heart/pulse rate been taken at this visit?
No
Yes
Please record the results in the Vital Signs Log at the
end
of the CRF.
Is there any clinically significant abnormality?
病史(患病时间等) 目前身体状况、伴随疾病和用药 近期停止用药时间(满足方案要求) 受试者参加临床试验号/签署知情同意书 访视日期 实验室/X-线等结果 试验用药数量及伴随治疗记录
1/10/2021
临床试验9项目管理
1/10/2021
临床试验1项0 目管理
Protocol 265805/249
批文(CFDA批文、伦理委员会批件及其成员) 签字合同(研究者合同、财务规定) 试验器械药品器械接收单和检测报告 实验室文件(正常值范围、质控证明) 研究者简历、研究者授权表及相关文件
1/10/2021
临床试验5项目管理
临床试验方案:
方案的形成过程中需申办者 与研究者讨论,并严格遵守 中国注册法规要求。
计划阶段 撰写方案摘要 选择研究者
临床试验项目管理系统WeTrial-CTMS

4‘ ....We苦ial智能临床研究云平台e丁!!♂'智能临床研究云平台数据临床研究项目涉及多组织、多角色,地理分布广、项目周期长、投入大、规范要求高。
在传统临床研究项目管理模式下,信息逐级传递,高度依赖各环节执行者的专业经验与责任心,信息不及时、不透明、失真,事后管理、被动干预,导致临床研究I页目协作效率低下,过程中易出现很多问题,给项目管理带来巨大挑战和风险。
为此,智能临床研究云平台“WeTrial”应运而生:以临床试验项目为核心,通过多万亘联,打通各业务一线执行者与管理者,使二者“零”距离零误差即时、高效沟通,有效控制运营风险,大幅提升项目质量与效率,重构临床研究项目的执行与管理模式。
We T rial让临床试验更简单产目概述ntroauce。
1独特优势以顶目为核心,多万E 联、高效协同;目标拆解更细,满足顶目精细化执行与管理,结果可控;信息实时更新、分层输出,充分满足各层级需求,高效管理、助力决策,轻松洞察凤险;注重绩效管理,深挖个体潜能,提高团队执行为;移动E 联,随时随地协同;以用户为导向的交E 设计,简单易用。
02产晶理念E联、高效、规范、高质03........严晶愿景让临床研究更简单,更智能!执行与管理融为一体Scene Contrast场景对比管理层项目经理中心管理受试者/访视管理通过会议昕取j口匠,了解项目情况;依据汇报来做分析和管理决策;干预管理措施靠逐层传达。
无法实时了解项目真实全面情况;决策管理不及时;干预管理措施布达周期长,反馈不及时,缺乏有效监管依赖于CRA 汇报,对中心的实际情况缺乏了解;人员异动工作交接不全;文档缺失,不合格现象十分严重;各项目数据分散在邮件、报告、excel 中;大量数据汇总、分析工作繁琐;任务分配、问题跟踪,资源调配缺乏有效依据CRA 定期东奔西跑,到各个中心现场监查;发现和协调解决问题。
成本高,效率低,事后管理,质量风ll-6飞主陀!Lie司CRC 通过培训,了解项目方案,自行计划、协调安排访视工作;事后汇报和记录数据;访视执行要求,访视执行的完整与核心数据结果不能及时掌握F 是否被检查确认不清楚智能临床研究云平台随时随地掌握组织各项目运营情况;扁平管理,快速决策、平预、执行;减少内部沟通成本,优化组织内部运作效率,提升组织竞争力各中心进展、受试者详情、访视执行情况、监查、蓓置情况、安全性事件、文档情况、人员绩效展现等,一目了然,系统自动汇总、份析,即回呈现问题。
临床试验项目管理医学PPT课件

1
计划阶段 撰写方案摘要 选择研究者 撰写及完善方案 / 病例报告表 试验前访视 伦理委员会批文 试验药物/器械供应 启动访视 试验中访视 试验结束访视
临床试验流程图
收集病例报告表 数据录入 解决数据质疑 统计分析 终版报告
2
临床试验项目的基本要素
产品
(临床试验报告)
时间表
资源
• 方案+CRF • 参与人员 • 机构口碑
21
质量管理(2)-质量就是生命
试验进行阶段质量管理:
• 监察 • 稽查 • CRC
22
• 确认受试者符合入组标准; • 确认试验按试验方案进行所有访视;
• 随时纠正违背方案的事件。
23
质量管理(3)-质量就是生命
试验结束阶段质量管理:
• 数据和统计
VITAL SIGNS Weight (without shoes) (kg) Sitting Blood Pressure and Heart/Pulse Rate Prior to any blood pressure measurements being taken, subjects should have rested in the clinic for at least 5 minutes. Blood pressure must be measured in the same arm at each visit. Have blood pressure and heart/pulse rate been taken at this visit? No end of the CRF. Is there any clinically significant abnormality? No Yes Arm : please record details in Significant Medical/Surgical History page. Left Right Yes Please record the results in the Vital Signs Log at the Height (m)
《临床试验项目管理》课件

3
制定计划
根据实际情况,制定多部门间的相关计划和协调方案,实现多部门间的协同合作 和管理。
临床试验项目管理的未来发展趋势
技术区块链技术将应 用到临床研究中
利用区块链技术建立查处临床 研究中的数据造假问题,促进 临床研究的透明与诚信。
经费
经费预算和使用方面,更加注 重效率和利用率,采用数字记 账和纪录等技术提升经费的评 估和审批效率。
时间分配
合理安排试验时间表,建立时间点监控机制,及时调整计划,保持试验进度和效果的协调性。
执行监督
细化制定实施规范、流程、操作手册,加强现场监督,并及时反馈和汇报试验计划、时间表 和执行情况。
预算和资源管理
预算管理
合理制定预算,降低费用,控 制风险,最终保证试验的顺利 进行和预算的有效利用。
人力资源
风险许可
采用风险、不确定和时间的综 合考虑方法,及时评估和批准 新样本,为临床试验研究提供 更高效和科学的统筹管理。
管理人员的职业道路和发展方向
1 进修学习
通过科目考试、技能考核等方式提升自己的专业背景和管理技能,培养和提升自己的管 理层次。
2 现场培训
通过参加项目、实验安排等现场实训,在实践中不断进取、提高实际操作能力和经验。
试验材料和设备的采购和管理
试验材料 药品 仪器设备 实验材料
采购和管理需求
统一保管、分类存储,符合GMP/GCP的标准, 保证药品的质量可控。
检查、维护及运输设备,保证仪器设备的整体性、 精准性和可用性。
标明采集时间、采集者等数据,建立实验材料样 本库,确保数据的可追溯性和与后续数据的高度 可比性
3 内部审核
机构内部根据规定要求进行内部审核,确保临床试验项目管理流程及时产生审查、申报 和内部审核文件。
临床试验项目管理PPT演示课件

文件管理(2)
• 临床试验进行阶段:
• 更新文件 • 填写后的知情同意书、CRF • 严重不良事件报告及原始文件 • 受试者筛选表登记表 • 试验药品管理记录表
14
文件管理(3)
试验结束阶段
• 试验用药的回收和销毁 • CRF的回收及数据的质疑 • 试验文件完整性的确认 • 伦理委员会的通报 • 临床试验的报告
试验结束阶段进度管理:
• CRF收集 • 数据录入 • 统计分析 • 临床报告 • 机构盖章
19
临床试验项目管理要素
文件管理 进度管理 质量管理 风险管理
20
质量管理(1)-质量就是生命
试验开始阶段质量管理:
• 方案+CRF • 参与人员 • 机构口碑
21
质量管理(2)-质量就是生命
试验进行阶段质量管理:
Subject Number
Subject Initials
Screening
Visit Date DD MM YY
DEMOGRAPHY
Date of Birth
DD MM YY
Race:
White
Black
Sex
Male
Female
Chinese
Other: specify:
VITAL SIGNS
15
临床试验项目管理要素
文件管理 进度管理 质量管理 风险管理
1准备(方案+CRF+基本文件) • 人员准备(医院筛选+统计) • 物资准备(试验器械+对照器械)
17
进度管理(2)
试验进行阶段进度管理:
• 定期随访 • 定期填表 • 感情沟通
18
临床试验数据管理ppt课件

数据盲态审核: 申办方、研究者、数据管理人员和统计
分析师在盲态下共同最终审核数据中未解决的问题,并按 照临床试验方案进行统计分析人群划分、核查严重不良事 件报告与处理情况记录等。
Deparment of Biostatistics, SJTU, School of Medicine
xx
7
三、试验数据的标准化
信息标准化-互通性:电子病历-跨机构、跨区域、跨领域
建立统一的临床数据标准体系
I. 数据/信息交换标准:
CDISC(临床数据交换标准)、HL7(医院信息传输 议) 、DICOM放射影像信息交换标准
II. 医学术语标准
LONIC(实验室检查结果代码)、 SNOMED(临床医 学术语)、ICD-10(疾病诊断分类代码) WHOART
xx
4
数据管理
一.数据管理相关人员的职责、资质和培训 二.管理系统的要求 三.试验数据的标准化 四.主要工作内容 五.数据质量的保障和评估 六.安全性数据及严重不良事件
《临床试验数据管理工作技术指南》 (2012年5月24日发布)
Deparment of Biostatistics, SJTU, School of Medicine
Deparment of Biostatistics, SJTU, School of Medicine
xx
19
建立数据库
Excel、Epidata…
根据病例报告表和统计分析计划书要求,在第 一份病例报告表送到以前,数据管理员应建立 数据库,并保证其完整、正确和安全。
数据管理员还应对每一份病例报告表进行初步 审核
数据保存:原始数据(如CRF)10yr;文档进行存档 数据保密及受试者个人私密:受保护医疗信息包含:姓名、
临床试验项目管理系统

GCP项目管理
GCP项目管理
客户信息管理
客户信息管理
研究中心管理
研究中心管理
伦理审查
受试者管理
受试者管理
试验监察
试验监查
药品管理
客户
公司
药品接收
药品回收
药品发放
研究中心
药品剩余量=药品接收总量-药品发放数量+药品回收数量
药品管理
物资管理
物资库存
公司
研究中心
物资领用
物资剩余量=物资库存量-物资领用量
百奥知临床试验项目管理系统 BioKnow GCPProject
北京百奥知信息科技有限公司 support@
临床试验数据管理PPT课件

30
增加受试者
31
增加访视
32
数据录入
33
不良事件
34
合并用药
35
编码
36
Q&A
37
后面内容直接删除就行 资料可以编辑修改使用 资料可以编辑修改使用
主要经营:网络软件设计、图文设计制作、发布广 告等 公司秉着以优质的服务对待每一位客户,做到让客 户满意!
致力于数据挖掘,合同简历、论文写作、PPT设计、 计划书、策划案、学习课件、各类模板等方方面面, 打造全网一站式需求
22
数据管理的基本模式
• 传统的纸质模式:
• 新型的电子模式(EDC):
23
纸质模式
Investigator
CRA
DM
BS
24
EDC模式
Investigator
CRA
EDC系统
BS
DM
25
电子数据采集(EDC)
• EDC系统是一个电子平台,用于采集药物临床研究中 的数据。 • 用户在EDC系统中进行数据录入,校验,进行医学/ 药学编码,审核,质检…从而使数据从纸质到电子, 数据从带有问题(Dirty)转为清洁(Clean)。达到可 以用于统计分析的要求。
• 行:记录:人/事 • 列:变量:指标/区分项
12
CDISC用例
13
数据库的确认(validation)
• 确认什么? 名称、类型是否与注释相一致,录入界面与规则是否 方便录入,软件的输出结果是否与录入内容相同等。
• 怎么确认? 例:创建一至两份模拟的病例报告表及其它相关材料, 按录入界面的指示将其录入数据库,然后输出数据库 内容,并与原始材料进行比较。
14
