大连理工2002物理化学期末(下) A
2002大连理工物理化学

2002大连理工物理化学2002大连理工物理化学2011年05月17日一、判定题(包括10小题,每小题1分,共10分),正确的在题前的括号内画“?”,错误的画“×”:( )1. 一定量理想气体,从相同的始态出发,分别经(i)尽热可逆膨胀; (ii) 尽热不可逆膨胀到的终态体积相同。
则(i)的终态温度比(ii)的终态温度低。
( )2. 催化剂既能加速反应,又能改变反应的DrGmy。
( )3. 在一定温度下,电解质溶液的电导率k与摩尔电导率Lm均随其浓度的增大而增大。
( )4. 使用可充电的化学电池播放录音机时,电池对外输出的电压小于电池的电动势;而对电池充电时,外加电压要大于其电动势。
( )5. 100℃,101 325Pa的H2O(l)向真空膨胀为同温同压的水蒸气为不可逆过程,所以DG<0。
( )6. 反应系统H2(g)+ O2(g)=H2O(g)在温度为T压力为py时,定温定压反应的摩尔焓[变] DrHm为H2O(g)的标准摩尔天生焓[变]DfHm y。
( )7. 由于化学反应的标准平衡常数只是温度的函数,所以只要温度不变,已达成的化学平衡不可能移动。
( )8. 由于大分子溶液是真溶液,是均相的热力学稳定系统,所以无丁达尔效应。
( )9. 稀溶液的依数性是指稀溶液的凝固点降低、沸点升高和渗透压的数值与溶液中所含溶质的分子(或离子)的数目(浓度)成正比,而与溶质分子(或离子)的性质无关。
( )10.鞍点是反应的最低能量途径上的最高点,但它不是势能面上的最高点,也不是势能面上的最低点。
1.二、选择题(包括8小题,每小题2分,共16分),选择正确答案的编号,填在题前的括号内:( )1.定温定压下,一定量纯物质由气态变为液态,则系统和环境的熵变为:(A)DS系>0,DS环<0 (B) DS系<0,DS环>0(C) DS系<0,DS环=0 (D) DS系>0,DS环=0( )2.一定量组成一定的均相系统,无非体积功且定温时,其吉布斯函数随压力的增大而(A) 增大 (B) 减小(C) 不变 (D) 无法确定( )3.20℃时,相同浓度(均为0.005mol×kg-1)的LaCl3,CaCl2和KCl三种电解质水溶液,离子均匀活度因子由大到小的顺序是:(A) LaCl3> CaCl2 >KCl (B) LaCl3 > KCl> CaCl2(C) CaCl2> LaCl3 >KCl (D) KCl > CaCl2 >LaCl3( )4. Al(NO3)3,Mg(NO3)2和NaNO3对AgI水溶胶的聚沉值分别为0.067mol×dm-3,2.60mol×dm-3和140mol×dm-3,则该AgI溶胶是:(A) 正溶胶 (B) 胶粒呈电中性 (C) 负溶胶 (D) 无法确定( )5.某平行反应含有主、副两个反应,主反应的产物为Y,活化能为E1;副反应的产物为Z,活化能为E2,且E1>E2 。
大连理工大学2005年物理化学(下)期末考试A卷

______级二、选择题(每小题2分,共14分)将正确答案的编号填在题前括号内( )1、有两个都是一级的平行反应AB C若反应开始时,系统中只具有A ,下列哪个关系式是错误的? (A) k 总=k 1+k 2;(B) E 总=E 1+E 2; (C) CB 21c c k k =; (D) 212/12ln k k t 。
+=( )2、质量摩尔浓度为b ,离子平均活度因子为γ±的MgSO 4溶液的活度a B 为:(A )γ±2(b / b )2 ; (B )2γ±2(b / b )2 ; (C )4γ±3(b / b )3 ; (D )8γ±4(b / b )4 。
( ) 3、电池Hg(l) | Zn(a 1) | ZnSO 4(a 2) | Zn(a 3) | Hg(l)的电动势:(A) 仅与a 1,a 3有关,与a 2无关;(B) 仅与a 1,a 2有关,与a 3无关; (C) 仅与a 2,a 3有关,与a 1无关;(D) 与a 1,a 2,a 3均无关。
( )4、用0.08 mol·dm -3 的KI 和0.1 mol·dm -3 的AgNO 3溶液以等体积混合制成的水溶胶,电解质CaCl 2 ,Na 3PO 4,MgSO 4对它的聚沉能力为:(A )Na 3PO 4 > CaCl 2 > MgSO 4 ;(B ) MgSO 4 > Na 3PO 4 > CaCl 2; (C )Na 3PO 4 > MgSO 4> CaCl 2 。
( )5、同种液体相同温度下,弯曲液面的蒸气压与平液面的蒸气压的关系是:(A ); )()()(凸凹毛细管中平p ,p p >>(B ); )()()(平凹毛细管中凸p ,p p >>(C )。
)()()(凹毛细管中平凸,p p p >>( )6、某反应,A →Y ,其速率系数k A =6.93min -1,则该反应物A 的浓度从1.0mol ⋅dm -3变到0.5 mol ⋅dm -3所需时间是:(A)0.2min ;(B)0.1min ;(C)1.0min 。
大连理工大学物理化学考研试题

大连理工大学一九九二年硕士生入学考试物理化学及物理化学实验试题一、是非题(包括7小题,每小题2分,共14分)认为正确的用“+”号;错误的用“-”号,于各小前括号内:()1、298K时,H2(g)的标准燃烧热与H20(l)的标准生成热数值上相等。
()2、亨利定律适用于稀溶液中的溶质,而且该溶质在气、液两相中的分子形态必须相同。
()3、半径为r的球形肥皂泡,所产生的附加压力ΔP=(γ为表面张力)()4、分子分散体系是热力学不稳定体系,而胶体分散体系是热力学稳定的体系。
()5、Boltzmann分布即是最可几分布,它可以代替平衡分布。
()6、热电偶的温差电势与热电偶的长度及粗细无关,而与两个接点的温度差有关。
()7、在对峙测定原电池电动势的实验中,当调节电位差计的工作电流时,如果工作电池和标准电池的正负极均接反了,则无论怎样调电阻,检流计的“光点”总是偏向一方。
二、填空题(包括8小题,每小题2分,共16分)在各个小题中画有横线处填上答案:焦-汤系数的定义为μH_______,若某气体的μH<0,则该气体节流后,温度______。
NaHCO3(s)在真空容器中部分分解为Na2CO3(s),H20(g),CO2(g),达到平衡时,该体系的相数φ=___;组分数c=___;自由度数f=___。
电解质的离子强度定义的I_______,1mol·kg-1的CaCl2水溶液I=_____mol·kg-1。
0.1mol·kg-1的CaCl2水溶液,离子平均系数γ±=0.219,则其离子平均活度a±=_____。
在测定二组分完全互溶体系的沸点-组成图的实验中,测定平衡时气、液两相的组成常用的仪器是_____,直接测定的物理量是_____。
在测定双液电池的电动势时,所用的盐桥中填入的电解质溶液通常是____溶液,其浓度必须是____的,该电解质的正负离子的______近似相等。
大连理工大学2004年物理化学(上)期末考试A卷
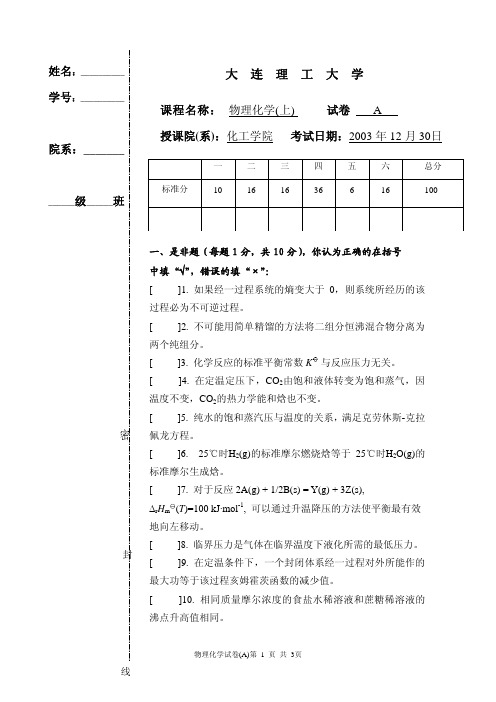
一、是非题(每题1分,共10分),你认为正确的在括号中填“√”,错误的填“×”:[ ]1. 如果经一过程系统的熵变大于0,则系统所经历的该过程必为不可逆过程。
[ ]2. 不可能用简单精馏的方法将二组分恒沸混合物分离为两个纯组分。
[ ]3. 化学反应的标准平衡常数K 与反应压力无关。
[ ]4. 在定温定压下,CO 2由饱和液体转变为饱和蒸气,因温度不变,CO 2的热力学能和焓也不变。
[ ]5. 纯水的饱和蒸汽压与温度的关系,满足克劳休斯-克拉佩龙方程。
[ ]6. 25℃时H 2(g)的标准摩尔燃烧焓等于25℃时H 2O(g)的标准摩尔生成焓。
[ ]7. 对于反应2A(g) + 1/2B(s) = Y(g) + 3Z(s),Δr H m \(T )=100 kJ·mol -1, 可以通过升温降压的方法使平衡最有效地向左移动。
[ ]8. 临界压力是气体在临界温度下液化所需的最低压力。
[ ]9. 在定温条件下,一个封闭体系经一过程对外所能作的最大功等于该过程亥姆霍茨函数的减少值。
[ ]10. 相同质量摩尔浓度的食盐水稀溶液和蔗糖稀溶液的沸点升高值相同。
姓名:__________ 学号:__________院系:_____________级______班大 连 理 工 大 学密封课程名称: 物理化学(上) 试卷 A授课院(系):化工学院 考试日期:2003年12月30日 一 二 三 四 五 六 总分 标准分 10 16 16 366 16 100 大 连 理 工 大 学课程名称: 物理化学(上) 试卷 A 授课院(系):化工学院 考试日期:2003年12月30日一 二 三 四 五 六 总分标准分 10 16 16 36 6 16 100二、选择题(每题2分,共16分),将你认为正确的选号填在题前括号内:[ ] 1. 在通常温度,NH 4HCO 3 (s)可发生分解反应 NH 4HCO 3 (s) == NH 3 (g) + H 2O (g) + CO 2 (g)现把1 kg 和20 kg NH 4HCO 3(s)分别装入两个预先抽空的小型密闭容器A 和B 中,在一定温度下经平衡后,则(1) 两容器中的压力相等; (2)A 内的压力大于B 内的压力; (3) B 内的压力大于A 内的压力;(4) 须经实际测定后才能判定哪个容器内的压力大。
大学化学专业《大学物理(下册)》期末考试试卷A卷 附答案

大学化学专业《大学物理(下册)》期末考试试卷A卷附答案姓名:______ 班级:______ 学号:______考试须知:1、考试时间:120分钟,本卷满分为100分。
2、请首先按要求在试卷的指定位置填写您的姓名、班级、学号。
一、填空题(共10小题,每题2分,共20分)1、质量分别为m和2m的两物体(都可视为质点),用一长为l的轻质刚性细杆相连,系统绕通过杆且与杆垂直的竖直固定轴O转动,已知O轴离质量为2m的质点的距离为l,质量为m的质点的线速度为v且与杆垂直,则该系统对转轴的角动量(动量矩)大小为________。
2、一质点沿半径R=0.4m作圆周运动,其角位置,在t=2s时,它的法向加速度=______,切向加速度=______。
3、已知质点的运动方程为,式中r的单位为m,t的单位为s。
则质点的运动轨迹方程,由t=0到t=2s内质点的位移矢量______m。
4、如图所示,轴沿水平方向,轴竖直向下,在时刻将质量为的质点由a处静止释放,让它自由下落,则在任意时刻,质点所受的对点的力矩=________ ;在任意时刻,质点对原点的角动量=_____________。
5、图示曲线为处于同一温度T时氦(原子量4)、氖(原子量20)和氩(原子量40)三种气体分子的速率分布曲线。
其中曲线(a)是________气分子的速率分布曲线;曲线(c)是________气分子的速率分布曲线。
6、同一种理想气体的定压摩尔热容大于定容摩尔热容,其原因是_______________________________________________。
7、沿半径为R的圆周运动,运动学方程为 (SI) ,则t时刻质点的法向加速度大小为________;角加速度=________。
8、设作用在质量为1kg的物体上的力F=6t+3(SI).如果物体在这一力的作用下,由静止开始沿直线运动,在0到 2.0 s的时间间隔内,这个力作用在物体上的冲量大小I=__________________。
物理化学期末考试试题库 (附答案与解析)

第一章热力学第一定律选择题1.关于焓的性质, 下列说法中正确的是()(A) 焓是系统内含的热能, 所以常称它为热焓 (B) 焓是能量, 它遵守热力学第一定律(C) 系统的焓值等于内能加体积功 (D) 焓的增量只与系统的始末态有关答案:D。
因焓是状态函数。
2.涉及焓的下列说法中正确的是()(A) 单质的焓值均等于零 (B) 在等温过程中焓变为零 (C) 在绝热可逆过程中焓变为零(D) 化学反应中系统的焓变不一定大于内能变化答案:D。
因为焓变ΔH=ΔU+Δ(pV),可以看出若Δ(pV)<0则ΔH<ΔU。
3.与物质的生成热有关的下列表述中不正确的是()(A) 标准状态下单质的生成热都规定为零 (B) 化合物的生成热一定不为零 (C) 很多物质的生成热都不能用实验直接测量(D) 通常所使用的物质的标准生成热数据实际上都是相对值答案:A。
按规定,标准态下最稳定单质的生成热为零。
4.下面的说法符合热力学第一定律的是()(A) 在一完全绝热且边界为刚性的密闭容器中发生化学反应时,其内能一定变化(B) 在无功过程中, 内能变化等于过程热, 这表明内能增量不一定与热力学过程无关(C)封闭系统在指定的两个平衡态之间经历绝热变化时, 系统所做的功与途径无关(D) 气体在绝热膨胀或绝热压缩过程中, 其内能的变化值与过程完成的方式无关答案:C。
因绝热时ΔU=Q+W=W。
(A)中无热交换、无体积功故ΔU=Q+W=0。
(B)在无功过程中ΔU=Q,说明始末态相同热有定值,并不说明内能的变化与过程有关。
(D)中若气体绝热可逆膨胀与绝热不可逆膨胀所做的功显然是不同的,故ΔU亦是不同的。
这与内能为状态函数的性质并不矛盾,因从同一始态出发,经绝热可逆膨胀与绝热不可逆膨胀不可能到达同一终态。
5.关于节流膨胀, 下列说法正确的是(A)节流膨胀是绝热可逆过程(B)节流膨胀中系统的内能变化(C)节流膨胀中系统的焓值改变(D)节流过程中多孔塞两边的压力不断变化答案:B6.在实际气体的节流膨胀过程中,哪一组描述是正确的:(A)Q >0, H=0, p < 0 (B)Q=0, H <0, p >0 (C)Q=0, H =0, p <0 (D)Q <0, H =0, p <0答案:C。
大连理工大物2作业答案_40-44

a (2)在− a 5 < x < 5 范围内,粒子出现的概率 2
1 3π cos( ) a 4
2
=
1 2a
p(−
a a <x< )= 5 5
a/5 −a/5
|ψ (x)| dx =
2
1 a
a/5
cos2
−a/5
3πx 1 dx = 2a a
a/5
1 + cos
0
3πx 1 a a 1 1 3 dx = + sin(3π/5) = + sin( a a 5 3π 5 3π
∞
1=
−∞
|ψ (x)| dx = |A|
2
2 0
∞
e−2ax dx =
1 |A|2 24、在宽度为a的一维无限深方势阱中运动的粒子定态波函数为ψ (x) =
2a 求:(1)基态粒子出现在 a 3 < x < 3 范围内的概率; (2)主量子数n = 2的粒子出现概率最大的位置。 解:可知定态波函数已归一化 2a (1)基态粒子出现在 a 3 < x < 3 范围内的概率
2、 粒 子 在 一 维 无 限 深 势 方 阱 中 运 动 , 图42-1 为 粒 子 处 于 某 一 能 态 的 波 函 数ψ (x)的 曲 线 ,(1)写出 粒 子 的 波 函 数;(2)用数学的方法求出粒子出现概率最大的位置。 解:(1)粒子的波函数: ψ (x) = 0,
大连理工大学,第五版,无机化学期末试卷A卷

HSU2008-2009学年度第一学期《无机化学》(本科)期末试卷(A)(时间120分钟)试卷编号: 2008772001-01院(系) 班 姓名 学号 得分一、选择题(每小题2分,共30分,每小题只有一个选项)1、气体液化必须在临界温度以下,根据下列气体的临界温度,判断在室温可液化的一组气体是( )①H 2 5.1K ②NH 3 408.4K ③CH 4 190.9K ④CO 2 304.1K ⑤ O 2 154.6KA ① ② ③B ③ ④ ⑤C ② ④D ① ④ 2、下列说法不正确的是( )A 电子衍射和氢光谱是说明微观粒子运动特点的两个重要实验;B 不准确关系是微观粒子波粒二象性的反映它限制了经典力学适用的范围;C 能量是量子化的,这个可用氢光谱的实验证实;D 量子力学中的波函数是原子轨道的同义词,故它和波尔轨道也是一样的。
3、判断下列元素在元素周期表中的位置,不正确的是( )A Mn 第四周期 第ⅦB 族d 区 B Zn 第四周期 第ⅠB 族ds 区C Sb 第五周期 第ⅤA 族p 区D W 第六周期 第ⅥB 族 d 区 4、下列各组量子数不合理的是( )A n=2 l=1 m=0B n=2 l=2 m= -1C n=3 l=0 m=0D n=4 l=2 m= -25、下列原子轨道中各有一个自旋方向相反的不成对电子,则沿x 轴方向可形成σ键的是( )A 22x x p p -B 224z s d -C 22y y p p -D 33xy xy d d - 6、下列各物质分子间的范德华力仅含色散力的是( )A H 2OB Br 2(l )C NH 3(l )D C 2H 5OH 7、下列结论或解释正确的是( )A 某一种物质熔点低,微溶于水,易溶于CCl 4,不导电,它一定是原子晶体;B KCl 易溶于水,而AgCl 难溶于水,其原因是KCl 是典型的离子晶体,而AgCl 由于Ag +较强的极化作用已有明显的共价性;C NaCl 的熔化主要是克服正负离子间的静电引力,而冰的熔点主要克服氢和氧之间的共价能力;D NaF 的熔点比KF 高,这是由于Na +的极化力比K +强。
大连理工2003物理化学期末(上) A

物理化学试卷(A) 共6页 第 1 页一、是非题(每小题2分,共16分)您认为正确的在括号中填“√”,错误的填“×”:( )1、一定量理想气体的热力学能是温度的单值函数。
( )2、绝热过程都是定熵过程。
( )3、一定温度下,同一反应的m r H ∆(T )一定大于)(m r T U∆。
( )4、100 ℃,101325 Pa 下的H 2O(l)变为同温同压下的H 2O(g),其ΔG m >0。
( )5、二组分理想液态混合物的总蒸气压大于同一温度下任一纯组分的蒸气压。
( )6、溶液的化学势等于溶液中各组分的化学势之和。
( )7、标准平衡常数变了则平衡必定移动, 反之, 平衡移动了, 标准平衡常数也一定改变。
( )8、对于任何气相反应,充入惰性气体与降低总压对平衡转化率的影响总是相似。
二、选择题(每小题2分,共16分)将正确答案的编号填在题前括号内( )1、1 mol 理想气体①经定温自由膨胀使体积增加1倍;②经定温可逆膨胀使体积增加1倍;③经绝热自由膨胀使体积增加1倍;④经绝热可逆膨胀使体积增加1倍。
在下列结论中正确的是;A. ΔS 1=ΔS 2=ΔS 3=ΔS 4;B. ΔS 1=ΔS 4,ΔS 2=ΔS 3;C. ΔS 1=ΔS 2=ΔS 3;ΔS 4=0D. ΔS 1=ΔS 2;ΔS 3=ΔS 4=0;( )2、对封闭体系来说,当过程的始态和终态确定后,下列各项中没有确定量值的是:A. Q+W ,B. Q ,C. W (Q =0) ,D. Q (W =0)( )3、对封闭的单组分均相系统,且W ’=0时,Tp G ⎪⎪⎭⎫⎝⎛∂∂的量值应该是: A. >0 B. <0 C.=0 D. 不能确定姓名:__________ 学号:__________院系:_______ ______级______班密封线物理化学试卷(A) 共6页 第 2 页( )4、下述各量中属于偏摩尔量的是:A.B)≠(C C S ,p, n Bn H ⎪⎪⎭⎫⎝⎛∂∂ B. )(,,B C n p T BC n S≠⎪⎪⎭⎫ ⎝⎛∂∂ C. )(,,B C n V T BC n G ≠⎪⎪⎭⎫⎝⎛∂∂ D.)(,,B C n p T B B C n U ≠⎪⎪⎭⎫ ⎝⎛∂∂ ( )5、二组分理想溶液,满足下列说法的是:A. 溶质、溶剂分子间无作用力B. △mix S = 0C. 该溶液的沸点升高D. 任一组分都符合拉乌尔定律( )6、25℃时,CH 4(g)在H 2O(l)和C 6H 6(l)中的亨利系数分别为4.18×109 Pa 和5.7×106 Pa ,则在相同的平衡气相分压p (CH 4)下, CH 4(g)在水中与在苯中的平衡组成为:A. x (CH 4,水) > x (CH 4,苯)B. x (CH 4,水) <x (CH 4,苯)C. x (CH 4,水) = x (CH 4,苯)( )7、在某温度下,一密闭的刚性容器中的PCl 5(g)达到分解平衡,若往此容器中充入N 2(g )使系统压力增大二倍,(此时体系仍可按理想气体处理)则PCl 5(g)的离解度将:A 、增大B 、减小C 、不变D 、视温度而定 ( )8、反应C(s) + 2H 2(g) = CH 4(g) 在1000K 时的1mr mol kJ 29.19-⋅=∆G ,当总压为100 kPa ,气相组成是H 2 70%,CH 4 20%,N 2 10%的条件下,上述反应将:A 、逆向进行,B 、正向进行,C 、平衡,D 、不定三、填空题(每空1分,共12分),在各题的“ ” 处填上答案:1、Q v =ΔU v 的应用条件是 , , 。
大连理工大学物理化学期末题1

( 4 ) GB与nB,nC有关,与T,p无关。
[ ]6. 在温度为T时,纯液体组分A和B的饱和蒸气压分别为 和 ,且 =3 ,若组分A和B形成理想液态混合物,当气液两相平衡时,气相中组分A和B的物质的量相等。则组分A在液相中的摩尔分数应是
试计算125℃时反应的标准摩尔焓变?rHm?,标准摩尔熵变?rSm?,及反应的标准平衡常数K?。
2 . [6分] 1 mol H2(g)与20 mol O2(g) 的燃烧反应在一个绝热等容的氧弹中进行。已知反应 H2(g) + O2(g) → H2O(g) 在298K下进行的标准摩尔反应焓变?rH ( 298K) = ?242.67 kJ?mol-1。 氧气及水蒸气的定容摩尔热容分别为CV, m(O2 , g) = 27.2 J?K-1?mol-1 , CV, m(H2O , g) = 31.38 J?K-1 ?mol-1,且不随温度而变。
p*( Hg,l )= Pa, Hg( l ) 的摩尔蒸发焓?vapH二组分凝聚系统为固态不互熔,液态完全互熔系统。熔点-组成图具有两个最低共熔点。一个为641 K (wB=0.08),另一个为620 K(wB=0.50)。在体系的熔点曲线上有一个最高点862 K(wB=0.16)。A,B 的熔点分别为924 K和692 K。
2. [2分] 10 mol 理想气体,由25 ℃,1.0 MPa膨胀到25 ℃,0.1 MPa,该过程系统的熵变 ?S= 。
3. [2分] C2H5OH(A)-H2O(B)所成的溶液中, xA=0.44。在323K时,总蒸汽压为 24.8 kPa,在气相中yA=0.57。 已知该温度下纯水的蒸汽压pB*=12.3 kPa。若以同温度同压力下的纯水为标准态,则该溶液中水活度因子为 。
大连理工大学物理化学期末试题

大连理工大学物理化学期末试题姓名:__________ 学号:__________ 院系:_______ ______级______班一、是非题(每小题1分,共8分),您认为正确的在括号中填“√”,错误的填“×”:( )1. 任何化学反应,反应参与物B的浓度随时间的变化率dcB/dt的绝对值都相同。
( )2. 元反应的反应物分子碰撞可能直接转化为生成物分子。
( )3. 弯曲液面的饱和蒸气压总是小于同温下平面液体的饱和蒸气压。
( )4. 液体的表面张力总是力图缩小液体的表面积。
( )5. 已知某反应的级数为二级,则该反应必是双分子反应。
( )6. 催化剂开辟了活化能较低的新途径,反应都按此新途径进行。
( )7. 物理吸附的吸附力是分子间力。
( )8. 无限稀薄时,HCl、KCl、NaCl三种溶液在相同温度、相同浓度、相同电场强度下,三种溶液中Cl-的迁移数相同。
二、选择题(每小题2分,共14分)将正确答案的编号填在题前括号内( ) 1、某反应的速率常数k=2.31×10-2s-1,初始浓度为1.0 mol•dm-3,则该反应的半衰期为:A 15 s;B 21.65 s;C 30 s;D 43.29 s;()2、在反应A B C,A D中,活化能Ea,1 >Ea,2 >Ea,3 ,C是所需要的产物。
从动力学角度考虑,为了提高产物C 的产量,选择反应温度时应选择。
A 较高反应温度;B 较低反应温度;C 适中反应温度;D 任意反应温度。
( ) 3、298 K时,当H2SO4溶液的浓度从0. 1mol•kg-1稀释到0. 01 mol•kg-1时,其摩尔电导率Λm将A.Λm增加;B.Λm减小;C.Λm不变;D. Λm变化无法确定()4、298 K,含Al3+、K+、H+ 离子的无限稀薄溶液中,离子摩尔电导率最大者为A. Al3+; B. K+; C. H+()5、某溶液中溶质B的浓度为cB(表面)>cB(体相),表明A dσ/dc>0,ΓB>0;B dσ/dc<0,ΓB>0;C dσ/dc<0,ΓB<0;D dσ/dc>0,ΓB<0。
中科院大连化学物理研究所2002试题与答案

中国科学院大连化学物理研究所二○○二年攻读硕士学位研究生入学考试物理化学及物理化学实验试题一、判断题(包括10小题,每小题1分,共10分)( )1. 一定量理想气体,从相同的始态出发,分别经(i )绝热可逆膨胀;(ii )绝热不可逆膨胀到的终态体积相同。
则(i )的终态温度比(ii )的终态温度低。
( )2. 催化剂既能加速反应,又能改变反应的r m G ∆。
( )3. 在一定温度下,电解质溶液的电导率κ与摩尔电导率m Λ均随其浓度的增大而增大。
( )4. 使用可充电的化学电池播放录音机时,电池对外输出的电压小于电池的电动势;而对电池充电时,外加电压要大于其电动势。
( )5. 100℃,101325 Pa 的H 2O(l )向真空膨胀为同温同压的水蒸气为不可逆过程,所以∆G <0。
( )6. 反应系统H 2(g)﹢12O 2(g)﹦H 2O(g)在温度为T 压力为p 时,定温定压反应的摩尔焓[变] r m H ∆为H 2O(g)的标准摩尔生成焓[变] f m H ∆。
( )7. 由于化学反应的标准平衡常数只是温度的函数,所以只要温度不变,已达成的化学平衡不可能移动。
( )8. 由于大分子溶液是真溶液,是均相的热力学稳定系统,所以无丁达尔效应。
( )9. 稀溶液的依数性是指稀溶液的凝固点降低、沸点升高和渗透压的量值与溶液中所含溶质的分子(或离子)的数目(浓度)成正比,而与溶质分子(或离子)的性质无关。
( )10. 鞍点是反应的最低能量途径上的最高点,但它不是势能面上的最高点,也不是势能面上的最低点。
一、判断题1.√ 2.× 3.× 4.√ 5× 6.× 7.× 8.× 9.√ 10.√二、选择题(包括8小题,每小题2分,共16分)( )1. 定温定压下,一定量纯物质由气态变为液态,则系统和环境的熵变为:A. S ∆系> 0,S ∆环< 0B. S ∆系< 0,S ∆环> 0C. S ∆系< 0,S ∆环﹦0D. S ∆系> 0,S ∆环﹦0( )2. 一定量组成一定的均相系统,无非体积功且定温时,其吉布斯函数随压力的增大而:A. 增大B. 减小C. 不变D. 无法确定( )3. 20℃时,相同浓度(均为0.005 mol·kg -1)的LaCl 3、CaCl 2和KCl 三种电解质水溶液,离子平均活度因子由大到小的顺序是:A. LaCl 3>CaCl 2>KClB. LaCl 3>KCl>CaCl 2C. CaCl 2>LaCl 3>KClD. KCl>CaCl 2>LaCl 3( )4. Al(NO 3)3,Mg(NO 3)2和NaNO 3对AgI 水溶胶的聚沉值分别为 0.067 mol·dm -3,2.6 mol·dm -3和140 mol·dm -3,则该AgI 溶胶是:A. 正溶胶B. 胶粒呈电中性C. 负溶胶D. 无法确定( )5. 某平行反应含有主、副两个反应,主反应的产物为Y ,活化能为1E ;副反应产物为Z ,活化能为2E ,且1E >2E ,则升高温度:A. 对生成Y 有利B. 对生成Z 有利C. 无影响D. 无法确定( )6. 水平放置的粗细均匀的毛细玻璃管中有一段汞柱,当在玻璃管右端稍稍加热时,管中汞柱将:A. 向左移动B. 向右移动C. 不移动D. 无法确定( )7. 与分子运动空间有关的分子运动的配分函数是:A. 振动配分函数B. 转动配分函数C. 平动配分函数D. 前三个配分函数均与分子运动空间无关( )8. 温度T 下,氯仿(A )和丙酮(B )形成非理想液态混合物,此二组分系统气液平衡时,气相压力为29398 Pa ,蒸气中丙酮的摩尔分数y B ﹦0.818,而该温度下纯氯仿的饱和蒸气压A p *﹦29571 Pa ,则以纯氯仿为标准态时在液相中氯仿的活度为a A为:A.0.500B.0.994C. 0.818D. 0.181二、选择题1.(B)2.(A)3.(D)4.(C)5.(A)6.(B)7.(C)8.(D)三、填空题(每空1分,共14分)1.无限稀薄的KCl和LiCl混合溶液中,Cl-离子的迁移数为0.505,Li+的迁移数为0.40,则该溶液中K+离子的迁移数为。
大连理工2003年物理化学期末(下)期末考试试卷A卷及答案

物理化学试卷(A) 共8页 第 1 页一、是非题(每小题2分,共12分)您认为正确的在括号中填“√”,错误的填“×”:( )1.液体表面张力的存在力图扩大液体的表面积。
( )2. NaOH 水溶液中,溶质在界面层中的浓度大于其在溶液本体中的浓度。
( )3.表面活性剂加入到水中时,表面活性剂分子优先在水中形成胶束。
( )4. 丁达尔现象可用来区分溶胶和小分子分散系统。
( )5. 有的光化学反应的量子效率小于1。
( )6. 催化剂能增大反应的平衡常数。
二、选择题(每小题3分,共15分)将正确答案的编号填在题前括号内 [ ]1. 一水平放置的毛细管内装有一定量的非润湿性液体,若该液体在管内一直向左方移动,说明此毛细管有何缺陷:A 左端内径大;B 右端内径大;C 无法判断。
[ ]2. 微小液滴的大小与其饱和蒸气压的关系为:A 液滴越小,其饱和蒸气压越大;B 液滴越小,其饱和蒸气压越小;C 饱和蒸气压与液滴的大小无关。
[ ]3. 定量纯理想气体系统, 在定温下随系统压力而改变的该理想气体分子的配分函数为 。
A: 转动配分函数, B: 振动配分函数,C: 平动配分函数, D: 电子配分函数,[ ]4. 在一定温度下,对于AgI 溶胶(稳定剂为KI ),下述几种电解质中聚沉能力最大的是:A KCl,B ZnSO 4,C Fe(NO 3)3;[ ]5. 0.1mol ·kg -1的CaCl 2水溶液,其离子平均活度因子±γ=0.219,则离子平均活度±a 为:姓名:__________ 学号:__________院系:_______ ______级______班密封线物理化学试卷(A) 共8页 第 2 页A 3.476×10-4;B 3.476×10-2 ;C 6.964×10-2 ;D 1.385×10-2 三、填空题(每空2分,共14分),在各题的“ ” 处填上答案: 1. 在一定条件下,如某分子的配分函数q 可表示为++=--kT kT e e q //105εε则在该条件下,系统中最概然分布在基态(能级为ε0)和第一激发态(能级为ε1)的分子数之比为 。
大连理工大学(已有10试题)

大连理工大学应用数学系数学分析2001——2005(2005有答案)高等代数2000——2005、2007(2005有答案)物理系数学物理方法2000——2005量子力学2000,2002——2005热力学与统计物理2000,2002——2005电动力学2000,2002——2005普通物理2000——2005光学(几何光学与波动光学)2000晶体管原理2000半导体材料2004——2005半导体器件2004——2005半导体物理2001——2002,2004——2005神经科学基础2004——2005生物统计学2004——2005生物物理学2004——2005工程光学2005微电子技术2003——2005离散数学及应用2000——2001(2000有答案)离散数学与数据结构2002——2005模拟电子技术2001——2005工程力学系材料力学1999——2001,2003——2005,2010(2010为回忆版)理论力学1995,1999——2001,2003——2005理论力学(土)2000土力学1999——2005自动控制原理(含现代20%) 1999——2005杆系结构静力学1998,2000弹性力学(不含板壳)1999——2004流体力学1999——2005流体力学(土)2004——2005流体力学基础2002——2005岩石力学1999——2000钢筋混凝土结构1999——2000工程流体力学2001,2004——2005水力学1999——2000,2002,2004——2005机械工程学院机械设计2001——2005(2001——2005有答案)机械原理1999——2000,2003——2005画法几何及机械制图2003——2005控制工程基础2001,2003——2005微机原理及应用(8086)1999——2000微机原理及应用(机)2004——2005微机接口与通讯及程序设计1999——2000模拟电子技术2001——2005离散数学及应用2000——2001(2000有答案)离散数学与数据结构2002——2005过程控制(含计算机控制)2000杆系结构静力学1998,2000微电子技术2003——2005系统工程概论1999——2002晶体管原理2000系统工程概论1999——2005管理基础知识1999——2001,2003——2005(2003——2005有答案)计算机组成原理(软)2005管理学基础2004——2005(2004——2005有答案)管理学2010(回忆版)材料力学1999——2001,2003——2005,2010(2010为回忆版)自动控制原理(含现代20%) 1999——2005材料科学与工程学院材料科学基础2003——2005,2010(2010为回忆版)机械设计2001——2005(2001——2005有答案)模拟电子技术2001——2005微电子技术2003——2005物理化学2004物理化学及物理化学实验1991——1993,2000,2002——2005(2002——2004有答案)胶凝材料学2001——2005硅酸盐物理化学2001——2002,2005杆系结构静力学1998,2000金属学2000金属热处理原理2000金属材料学2000钢筋混凝土结构1999——2000晶体管原理2000土木水利学院材料力学(土)2000,2003——2005材料力学1999——2001,2003——2005,2010(2010为回忆版)土力学1999——2005结构力学2000——2001,2003——2005水力学1999——2000,2002,2004——2005杆系结构静力学1998,2000理论力学(土)2000弹性力学(不含板壳)1999——2004流体力学1999——2005流体力学(土)2004——2005流体力学基础2002——2005岩石力学1999——2000钢筋混凝土结构1999——2000工程流体力学2001,2004——2005系统工程概论1999——2005工程经济学2004——2005无机化学2003——2005传热学2002,2004——2005工程力学2004——2005工程项目管理2004——2005建筑材料2005工程热力学2001——2002,2004——2005热工基础(含工程热力学和传热学)2003化工学院无机化学2003——2005物理化学2004物理化学及物理化学实验1991——1993,2000,2002——2005(2002——2004有答案)有机化学及实验2001,2003——2005高分子化学及物理2002——2005化工原理及化工原理实验2001——2005材料力学1999——2001,2003——2005,2010(2010为回忆版)工程流体力学2001,2004——2005硅酸盐物理化学2001——2002,2005热力学基础2005天然药物化学2005药剂学2005生物化学及生物化学实验1999——2005船舶工程学院船舶动力装置2002——2005船舶设计原理2001——2005水声学原理2002——2005船舶静力学2001——2005杆系结构静力学1998,2000电子与信息工程学院模拟电子技术2001——2005信号与系统(含随机信号20%)1999——2005 自动控制原理(含现代20%) 1999——2005工程光学2005通信原理2004——2005离散数学及应用2000——2001(2000有答案)离散数学与数据结构2002——2005离散数学与计算机组成原理2005离散数学与数据库原理2004——2005数据结构与计算机组成原理2004——2005计算机组成原理与计算机体系结构2004——2005 计算机组成原理与数字逻辑2000计算机组成原理(软)2005编译方法1999——2000操作系统1999——2001高等代数2000——2005过程控制(含计算机控制)2000微电子技术2003——2005微机接口与通讯及程序设计1999——2000系统工程概论1999——2005晶体管原理2000能源与动力学院汽车理论2000——2005机械原理1999——2000,2003——2005自动控制原理(含现代20%) 1999——2005化工原理及化工原理实验2001——2005普通物理2000高等代数2000——2005离散数学及应用2000——2001(2000有答案)离散数学与数据结构2002——2005运筹学基础及应用2004——2005计算机信息管理1999——2001,2004——2005 微电子技术2003——2005杆系结构静力学1998,2000系统工程概论1999——2005晶体管原理2000信息管理与信息系统2010(回忆版)管理学院计算机信息管理1999——2001,2004——2005 运筹学基础及应用2004——2005离散数学及应用2000——2001(2000有答案)离散数学与数据结构2002——2005公共经济学基础2004——2005,2010(2010为回忆版)过程控制(含计算机控制)2000微电子技术2003——2005系统工程概论1999——2002政治学原理2004——2005行政管理学2004——2005,2010(2010为回忆版)经济学基础2001——2005(2001——2005有答案)运筹学基础及应用2004——2005公共管理学2005社会保障学2004——2005管理学2010(回忆版)信息管理与信息系统2010(回忆版)人文社会科学学院经济学基础2001——2005(2001——2005有答案)管理基础知识1999——2001,2003——2005(2003——2005有答案)管理学基础2004——2005(2004——2005有答案)管理学2010(回忆版)系统工程概论1999——2002现代科学技术基础知识1999——2000,2004——2005思想政治教育学2004——2005马克思主义哲学原理2004——2005马克思主义哲学2001——2002西方哲学史2005哲学概论2004——2005科学技术史(含命题作文)2004——2005科学史、技术史、命题作文2001——2003政治学原理2004——2005行政管理学2004——2005,2010(2010为回忆版)传播学2004——2005新闻传播实务2004——2005民法学2004——2005法理学与商法总论2004——2005政治学2004——2005中外教育史2004——2005教育学2005中国近现代史2004——2005世界近现代史2004——2005电气工程及应用电子技术系电路理论2002——2005自动控制原理(含现代20%) 1999——2005过程控制(含计算机控制)2000微电子技术2003——2005系统工程概论1999——2005晶体管原理2000外国语学院二外德语2002,2004二外俄语2002——2004二外法语2004——2005二外日语2002——2004专业基础英语2003英汉翻译2003,2005英汉翻译与写作2004英语水平测试2004——2005二外英语2002——2005日语水平测试2004——2005翻译与写作(日)2004——2005专业基础日语2002——2003外国语言学与应用语言学(日语)专业综合能力测试2002——2003体育教学部运动生物力学2005人体测量与评价2004——2005生物学基础2005体质学2004——2005建筑艺术学院建筑设计(8小时)2000,2004——2005建筑设计原理1999——2000,2003建筑设计理论综合2004——2005城市建设史2002——2003中国与外国建筑史2000建筑构造与建筑结构1999——2000城市规划历史与理论2004——2005城市规划原理2003城市设计2002规划设计(8小时)2004-2005素描(8小时)2005泥塑(8小时)2005色彩(4小时)2005软件学院离散数学及应用2000——2001(2000有答案)离散数学与数据结构2002——2005离散数学与计算机组成原理2005离散数学与数据库原理2004——2005数据结构与计算机组成原理2004——2005计算机组成原理与计算机体系结构2004——2005计算机组成原理与数字逻辑2000计算机组成原理(软)2005编译方法1999——2000操作系统1999——2001环境与生命学院物理化学2004物理化学及物理化学实验1991——1993,2000,2002——2005(2002——2004有答案)化工原理及化工原理实验2001——2005硅酸盐物理化学2001——2002,2005基因工程原理2004——2005微生物学2004——2005细胞生物学2005环境化学2004——2005环境工程原理2004——2005,2010(2010为回忆版)分子遗传学2004——2005环境微生物2002经济系经济学基础2001——2005(2001——2005有答案)公共经济学基础2004——2005,2010(2010为回忆版)高科技研究院数学分析2001——2005(2005有答案)高等代数2000——2005数学物理方法2000——2005量子力学2000,2002——2005热力学与统计物理2000,2002——2005电动力学2000,2002——2005物理化学2004物理化学及物理化学实验1991——1993,2000,2002——2005(2002——2004有答案)硅酸盐物理化学2001——2002,2005微电子技术2003——2005。
大连理工期末理论力学A卷标准答案

理论力学期末考试答案及评分标准(A 卷)一、简答题,写出求解过程。
(共25分, 每题5分)1.(5分)ma F F F 24I I21I === 13I 4αmR F =,15I 8αmR F =()12121I 3842121ααmR R m M ==222I αmR M =2.(5分)0===BC AD AB F F FF F CD -=(压),F F AC 2=(拉)3.(5分)C a加速度图αa 1α惯性力图F I1F速度分析图速度分析:CA A C v v v +=,ωl v CA =,A Cx v v = 水平方向动量守恒:0=+Cx C A A v m v m 得0=A v动能定理:mgl J v m v m C C C A A =++222212121ω,得l g 3=ω 4.(5分)t R y A ωtan 4=t R y A ωω2sec 4= ,t A ωωω2sec 4= t t R y A ωωωtan sec 822= ,t t A ωωωαtan sec 822=5.(5分)(1)系统对D 轴的动量矩C C C C A AD D B B D J R v m R v m J R v m L ωω-⋅+++=2m m m B A 3==,m m C 2=,2mR J J D C ==v v v B A ==,R vD =ω, R v v C ω-=2511R m mvR L D ω-=(2)系统的动能22222222232292121212121R m vR m mv J v m v m J v m T C C C C A A D D B B ωωωω+-=++++=6.(5分)解:设滚子只滚不滑(纯滚动)A 卷∑=0iF Wδ,0=-B Fv M ωR v v B A ω2==RM F 2=二、(15分)∑=0x M ,()025.051025.030cos =⨯--⨯ F ,773.53310==F kN ∑='0z M ,()08.03.01054.030cos =⨯-⨯++⨯-Ay F F ,125.3825==Ay F kN ∑='0y F,()010530cos =-+++Cy Ay F F F ,125.23=Cy F kN∑='0z F ,030sin =--Cz Az F F F ,443.1635===Cz Az F F kN三、(15分)∑=0xF,0=Cx F∑=0yF ,0221=+--Cy F ql ql ,()↑=ql F Cy 25 ∑=0CM ,0232212=+-+⋅-⋅C M ql l ql l ql ,238qa M C =(逆时针)x四、(20分)(1)速度分析A 为动点,动系放在套筒D 上r e a v v v += 333a e ==⋅=A v v v m/s ,1a r ==v v m/s5.0363e 1===ADv ωrad/s 再以A 为基点,分析E 点速度EA A E v v v +=2621-=-=⋅-=AE v v A E ωrad/s(2)加速度分析A 为动点,动系放在套筒D 上C a a a a ++=r e a ,沿AB 方向投影得:C n tA a a a a -+= 30cos 60cos 30cos e e其中 23324121e =⨯=⋅=AD a n ωm/s 2,115.022r 1=⨯⨯==v a C ωm/s 2,解得:5.3e =ta m/s 2,347325.3e 1===AD a t αrad/s 2, 再以A 为基点,分析E 点加速度nEA t EA A E a a a a ++=沿水平方向投影得:2364121=⨯=⋅==AE a a nEAEx ωm/s 2 沿竖直方向投影得:3253634731=-⨯=-⋅=-=AE a a a A tEAEy αm/s 2 21325232222=⎪⎭⎫⎝⎛+⎪⎭⎫ ⎝⎛=+=EyEx E a a a m/s 2加速度分析图 A t EA 速度分析图 AEA五.(20分)解两杆运动微分方程为:21l F J Ay O ⋅=α, 2121ml J O =Ax Cx F ma =Ay Cy F mg ma -=30sin 3130cos 312⋅⋅-⋅⋅=l F l F J Ax Ay C α , 229132121ml l m J C =⎪⎭⎫ ⎝⎛=AD 杆的加速度关系n CA t CA A C a a a a ++=,0=n CAa ,231αl a tCA = 分别向x 、y 轴投影有:232130sin αl a a tCA Cx ==212230cos ααl l a a a tCA A Cy +=+=联立得l g 37421=α,l g37182=α4621-=-=⋅-=AE v v A E ωrad/s (向上)受力分析图Ay加速度分析图A。
大连理工2004物理化学期末(下)C
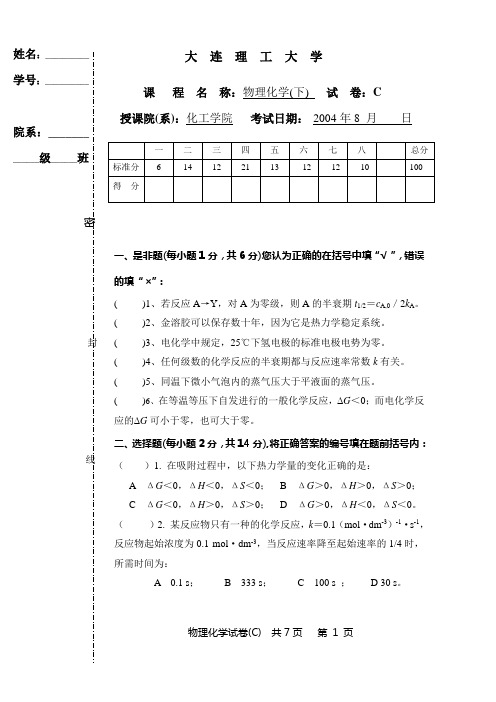
物理化学试卷(C) 共7页 第 1 页一、是非题(每小题1分,共6分)您认为正确的在括号中填“√”,错误的填“×”:( )1、若反应A →Y ,对A 为零级,则A 的半衰期t 1/2=c A,0/2k A 。
( )2、金溶胶可以保存数十年,因为它是热力学稳定系统。
( )3、电化学中规定,25℃下氢电极的标准电极电势为零。
( )4、任何级数的化学反应的半衰期都与反应速率常数k 有关。
( )5、同温下微小气泡内的蒸气压大于平液面的蒸气压。
( )6、在等温等压下自发进行的一般化学反应,∆G <0;而电化学反应的∆G 可小于零,也可大于零。
二、选择题(每小题2分,共14分),将正确答案的编号填在题前括号内: ( )1. 在吸附过程中,以下热力学量的变化正确的是:A ΔG <0,ΔH <0,ΔS <0;B ΔG >0,ΔH >0,ΔS >0;C ΔG <0,ΔH >0,ΔS >0;D ΔG >0,ΔH <0,ΔS <0。
( )2. 某反应物只有一种的化学反应,k =0.1(mol ·dm -3)-1·s -1,反应物起始浓度为0.1 mol ·dm -3,当反应速率降至起始速率的1/4时,所需时间为:A 0.1 s ;B 333 s ;C 100 s ;D 30 s 。
( )3. 反应速率系(常)数随温度变化的Arrhenius 经验式适用于: A 基元反应; B 基元反应和大部分非基元反应;C 非基元反应;D 所有化学反应。
姓名:__________ 学号:__________院系:_______ ______级______班密封线()4. 在一个连串反应A→Y→Z中,如果需要的是中间产物Y,那么为了得到产品的最高产率,应当:A 控制适当的反应时间;B降低反应物A的浓度; C 增加反应物A的浓度。
()5. 加入催化剂可使化学反应的下列物理量中改变的一个是:A 反应的标准摩尔焓变;B 标准平衡常数;C 反应标准摩尔熵变;D 反应的速率系数。
大学化学专业《大学物理(下册)》期末考试试题A卷 附答案

10、质量为m的物体和一个轻弹簧组成弹簧振子,其固有振动周期为T.当它作振幅为A的自由简谐振动时,其振动能量E=__________。
5、一个绕有500匝导线的平均周长50cm的细螺绕环,铁芯的相对磁导率为600,载有0.3A电流时, 铁芯中的磁感应强度B的大小为___________;铁芯中的磁场强度H的大小为___________ 。
6、设在某一过程P中,系统由状态A变为状态B,如果________________________________________,则过程P为可逆过程;如果_________________________________________则过程P为不可逆过程。
二、名词解释(共6小题,每题2分,共12分)
1、刚体:
2、定压摩尔热容:
3、布郎运动:
4、介质的极化:
5、光的吸收:
6、循环过程:
三、选择题(共10小题,每题2分,共20分)
1、下述说法中,正确的是( )。
A.本征半导体是电子与空穴两种载流子同时参予导电,而杂质半导体(n型或p型)只有一种载流子(电子或空穴)参予导电,所以本征半导体导电性能比杂质半导体好
大学化学专业《大学物理(下册)》期末考试试题A卷 附答案
姓名:______ 班级:______学号:______
考试须知:
1、考试时间:120分钟,本卷满分为100分。
2、请首先按要求在试卷的指定位置填写您的姓名、班级、学号。
一、填空题(共10小题,每题2分,共20分)
2022年大学化学专业《大学物理(下册)》期末考试试题 附解析

2022年大学化学专业《大学物理(下册)》期末考试试题附解析姓名:______ 班级:______ 学号:______考试须知:1、考试时间:120分钟,本卷满分为100分。
2、请首先按要求在试卷的指定位置填写您的姓名、班级、学号。
一、填空题(共10小题,每题2分,共20分)1、质量为M的物体A静止于水平面上,它与平面之间的滑动摩擦系数为μ,另一质量为的小球B以沿水平方向向右的速度与物体A发生完全非弹性碰撞.则碰后它们在水平方向滑过的距离L=__________。
2、长为、质量为的均质杆可绕通过杆一端的水平光滑固定轴转动,转动惯量为,开始时杆竖直下垂,如图所示。
现有一质量为的子弹以水平速度射入杆上点,并嵌在杆中. ,则子弹射入后瞬间杆的角速度___________。
3、一根无限长直导线通有电流I,在P点处被弯成了一个半径为R的圆,且P点处无交叉和接触,则圆心O处的磁感强度大小为_______________,方向为_________________。
4、同一种理想气体的定压摩尔热容大于定容摩尔热容,其原因是_______________________________________________。
5、质量为的物体,初速极小,在外力作用下从原点起沿轴正向运动,所受外力方向沿轴正向,大小为。
物体从原点运动到坐标为点的过程中所受外力冲量的大小为_________。
6、质量为m的物体和一个轻弹簧组成弹簧振子,其固有振动周期为T.当它作振幅为A的自由简谐振动时,其振动能量E=__________。
7、刚体绕定轴转动时,刚体的角加速度与它所受的合外力矩成______,与刚体本身的转动惯量成反比。
(填“正比”或“反比”)。
8、一个半径为、面密度为的均匀带电圆盘,以角速度绕过圆心且垂直盘面的轴线旋转;今将其放入磁感应强度为的均匀外磁场中,的方向垂直于轴线。
在距盘心为处取一宽度为的圆环,则该带电圆环相当的电流为________,该电流所受磁力矩的大小为________ ,圆________盘所受合力矩的大小为________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物理化学试卷(A) 共6页 第 1 页
一、是非题(每小题1分,共8分)。
您认为正确的在括号中填“√”,错
误的填“×”:
( )1 液体表面张力的方向与液面垂直。
( )2 BET 吸附定温式适用于物理吸附。
( )3 真实气体是离域子相依子系。
( )4 表面过剩物质的量不可能为零。
( ) 5 催化剂不改变反应的标准摩尔焓变。
( )6 一化学反应中,若反应物的浓度减少一半,其半衰期也减少 一半, 则该反应为二级反应。
( )7 一级反应即为单分子反应。
( ) 8 电解池的阴极平衡电极电势一定小于其实际电极电势,即 △φc, e <△φc 。
二、选择题(每小题2分,共10分)将正确答案的编号填在题前括号内 ( )1 胶体分散系统的分散质粒子大小范围是: A >1000 nm B < 1 nm C 1nm ~ 1000 nm
( )2 正则系综理想气体的系统配分函数Z 与分子配分函数q 的关系为:
A Z = q
B Z = q N
姓名:__________ 学号:__________
院系:_______ ______级______班
密
封
线
物理化学试卷(A) 共6页 第 2 页
C Z = q N /N !
D q = Z N /N !
( )3 物质的量浓度相同的下列物质的稀水溶液,能发生较强的正吸附的物质是:
A 硫酸,
B 硬脂酸,
C 甲酸,
D 苯甲酸
( )4 高度分散的小液滴的饱和蒸汽压p r *与温度T 的关系如图所示,r 为液滴的半径, 则r 的大小关系为:
A r 1 > r 2
B r 1 < r 2
C 无法确定r 的大小关系
( )5 在一水平放置的洁净的玻璃管内有一可自由移动的汞柱,今在汞柱左端轻轻加热,则毛细管内汞柱将: A 向左移动 B 向右移动 C 不移动
三、填空题(每空2分,共26分),在各题的“ ” 处填上答案: 1 等体积的0.1mol ·kg -1的LaCl 3与0.5mol ·kg -1的Na 2SO 4水溶液混合,混合溶液的离子强度I = 。
2 丁达尔(Tyndall )效应的实质是 。
3 下图是某液体在固体表面平衡后的状态, 请在图上画出接触角θ;气/固界面张力σs/g 与气/液界面张力σg/l 、及固/液界面张力σs/l 的关系为σs/g = 。
4 在外电场存在下,0.2 mol ·kg -1的LiCl 溶液,Cl -离子的迁移数为0.68,则Li +的迁移数t (Li +) = 。
5 等体积的0.005 mol ·dm -3 NaBr 与0.01 mol ·dm -3 AgNO 3溶液制备的溴化银溶胶,胶团结构为 。
若分别用Ca(NO 3)2和K 2SO 4溶液聚
{p r *}
r 1
r 2
{T
}
物理化学试卷(A) 共6页 第 3 页
沉,则前者的聚沉能力 后者(填“强于”,“弱于”,或“等于”。
6 电极 H +[a (H +)=1]|H 2(p =100kPa) |Pt 的E = 7 碰撞理论中阈能的物理意义是 。
8 链反应有两类: 和 。
其中引起链爆炸的是 。
9 大分子溶液的主要特征是 。
四、计算填空题(共35分),将计算结果填在“ ”处,勿需写计算过程: 1 (3分) 已知E (Cu 2+/Cu)=0.340V , E (Cu +/Cu)=0.522V; 则E (Cu 2+/Cu +)= 。
2 (3分)25℃时,NaOAc, HCl 和NaCl 的无限稀薄摩尔电导率Λ∞m 分别
为91.00×10-4 S · m 2·mol -1,426.2×10-4 S ·m 2·mol -1和126.5×10-4 S ·m 2·mol -1, 则HOAc 的Λ
∞
m (25℃)= 。
3 (4分)一化学反应,当温度由290K 上升至300K 时,其反应速率增大到原来的4倍,则该反应的活化能E a = 。
4 (5分) 400K 时某理想气体基态与第一激发态的能级ε0和ε1分别为1.8×10-20 J 和3.6×10-20 J ,相应的能级简并度g 0 =1和g 1 =3, 则基态与第一激发态上分子数之比n 0 / n 1= 。
5 (11分)Pt|H 2(100kPa)|HCl(b = 0.1 mol ·kg -1) ||KCl( b = 0.1 mol ·kg -1)| Ag Cl(s)|Ag(s), 测得25℃时,该电池的E MF = 0.3527V 。
已知25℃时 E ( Ag | Ag Cl |Cl -) =0.2225V , 假定b =0.1 mol ·kg -1的KCl 和HCl 两溶液中γ(Cl -)相等。
则:
(1)阳极反应 ;
阴极反应 ; 电池反应 ;
(2)25℃时, 0.1 mol ·kg -1的HCl 溶液的γ±
= ;
(3)1mol H 2 反应,25℃时, 该电池反应的K = ;
(4)若1mol H 2 反应,25℃时,则电池反应的△r G m = 。
密
封 线
物理化学试卷(A) 共6页 第 4 页
6(4分)25℃时, 用Zn 电极做阴极,电解a (Zn 2+)=0.2 的ZnSO 4水溶液,若Zn 2+在 Zn 电极上的超电势可忽略不计,则Zn 2+在Zn 电极上析出的实际电势 E (Zn 2+/Zn) = ,若在某一电流密度下H 2在Zn 极上的超电势为 0.7 V , 水溶液为中性, a (H +)=10-7, 则H +在Zn 电极上析出的实际电势
E(H +/H 2)= , 在述过程中在Zn 电极上先析出的是 ,为使电极上只析出Zn, 应控制溶液的pH 值在 。
已知E (Zn 2+/Zn ,25℃) = -0.763V 。
7(5分)气体A 在固体催化剂上发生表面单分子反应机理为:
若该反应为表面反应控制, 且A 在催化剂上吸附属Langmuir 吸附,则产物B 生成的反应速率方程为 ,若反应物及产物在催化剂表面上属弱吸附,则表观活化能与各元反应活化能的关系为E a(表观)= 。
五、计算题 (共15分) (要求:写出具体过程,求答案)
已知反应速率与产物浓度无关。
00.13K 108.10)s m ol dm ln(3
1131
+⨯-=••--T
k
00.12K
105.9)s mol dm ln(
3
1132
+⨯-=••--T
k
(1) 若c A,0=1.0 mol ·dm -3,计算500K 时A 转化60%所需时间?
* A + k 1,E 1 k -1, E -1 A * k 2, E 2
A *
B *
平行反应 A
k 1
k 2
Y Z
(2)若反应开始时系中只有A,为使产物中c Z/c Y=4,反应温度应为多少?
物理化学试卷(A) 共6页第5 页
密
封
线
物理化学试卷(A) 共6页第6 页。
