基础有机化学机理答案
邢其毅《基础有机化学》(第3版)(上册)课后习题-烯烃 亲电加成 自由基加成共轭加成(圣才出品)

十万种考研考证电子书、题库视频学习平台圣才电子书 第8章烯烃亲电加成自由基加成共轭加成习题8-1写出分子式为C 5H 6ClBr 和具有共轭结构的所有链形化合物的同分异构体及它们的中英文系统命名。
解:十万种考研考证电子书、题库视频学习平台圣才电子书习题8-2烯烃的顺反异构体在一定条件下可以相互转化,请设想三种使顺反异构体转换的方法,写出相应的反应式并阐明理由。
解:(1)在酸性条件下,与水加成,再脱水;(2)在500℃左右的高温下加热,烯短π键可断裂,发生构型转化;(3)与溴加成,后再在强碱作用下,脱除2分子HBr变成炔烃,最后用不同方法还原成烯烃。
反应式及理由略。
习题8-3写出溴与(Z)-2-戊烯加成的主要产物及相应的反应机理,分别用伞形式、锯架式、纽曼式费歇尔投影式来表示主要产物,该主要产物是苏型的还是赤型的?解:反应机理为:该产物是苏型的,其各种表示式如下:习题8-4写出(R)-4-甲基环己烯和溴加成的主要产物,并简述原因。
解:主要产物为:反应机理为:习题8-5写出(S)-3-甲基环己烯和溴加成的主要产物,并简述原因。
解:主要产物为:反应历程为:双邻位交叉构象是一种能量很高的禁阻构象,因此构型反转,得到热力学稳定的产物。
习题8-6写出1-甲基环己烯和溴加成的主要产物,并简述原因。
解:主要产物为:原因:双直键和双平键的构象相等,因为双直键的二溴化物有1,3—双直键的相互作用,但双平键的二溴化物中Br—C—C—Br为邻交叉型,有偶极—偶极的排斥作用,以上两种力能量几乎相等,互相抵消。
习题8-7完成下面的反应式,写出下列反应的反应机理。
解:反应机理如下:习题8-8写出下列化合物与溴的加成产物。
有机化学第三章反应机理

例如:
CH3 CH3
重排
CH3 C H CH2
CH3
C
CH3
由不够稳定的伯碳正离子重排为较稳定的叔碳
正离子。
4、碳负离子
由于烷基是供电子基团,所以碳负离子连接烷基 愈多,则愈不稳定(负电荷集中)。 碳负离子稳定性顺序为:
( CH3)3 C
由不够稳定的碳正离子重排为较为稳定的碳正离子。
CH3 CH3 CH CH CH2
H
CH3 CH3CHCHCH3
Cl
CH3 CH3CHCHCH3 Cl
CH3 CH3CHCHCH3
重排
CH3 CH3CCH2CH3
Cl
CH3 CH3CCH2CH3 Cl
( b ) 与卤素加成 ( Br2反式加成 )
实验事实:
R—X
RCO—X
SO3
(1)卤代反应历程 (Cl2 ,Br2 . FeCl3催化剂)
Br2
+
FeBr3
δ Br
+
δ BrFeBr3
Br
+
H
+
δ Br
+
δ BrFeBr3
-
FeCl4
H
Br
Br
+
H
(2)硝化反应历程
硝化反应通常在混酸(硝酸+硫酸)条件下进行。
H2SO4
+
HONO2
H
ONO2 H
+
HSO4
1° H 氯 代 2 5 ° ,h ν 溴 代 125° , hν 1 .0 1 .0 2° H 3 .8 82 3° H 5 .0 600
漫谈有机化学反应机理知到章节答案智慧树2023年湖南理工学院

漫谈有机化学反应机理知到章节测试答案智慧树2023年最新湖南理工学院第一章测试1.针对训练按照玻尔理论,当氢原子中电子由半径为r a的圆轨道跃迁到半径为n b的圆轨道上时,若n<r,则在跃迁过程中参考答案:氢原子要辐射一定频率的光子2.氢原子的核外电子从距核较近的轨道跃迁到距核较远的轨道过程中参考答案:原子要吸收光子,电子的动能减小,原子的电势能增大3.氢原子辐射出一个光子后,根据玻尔理论,下列说法中正确的是参考答案:氢原子核外电子的速率增大4.一个氢原子从n=3能级跃迁到n=2能级,该氢原子参考答案:放出光子,能量减少5.对原子轨道叙述错误的是参考答案:核外电子运动的轨迹6.参考答案:p x-p x7.s轨道和p轨道杂化的类型不可能有参考答案:sp4杂化8.原子轨道组合成分子轨道的线性组合三原则是(1)轨道总数保持不变,参与组合的原子轨道数目必须等于分子轨道数目(2)对称性匹配,即原子轨道对称性匹配时才能组成分子轨道(3)原子轨道必须沿着最大重叠的方向成键(4)原子轨道的能量必须相近参考答案:(2)(3)(4)9.价键理论和分子轨道理论相比,主要局限在于参考答案:难以描述具有电子离域体系的化合物的结构10.关于σ键和π键,下列叙述错误的是参考答案:σ键是强相互作用,π键是弱相互作用11.下列示意图表示乙烯中的C-H成键轨道,最合理的是参考答案:12.sp3杂化轨道的几何形状为参考答案:四面体13.关于色散力的描述中,不正确的是参考答案:色散力的强度通常大于分子间的氢键作用第二章测试1.顺-2-丁烯(1)和反-2-丁烯(2)经催化加氢都生成丁烷,下列哪张图正确地反映了上述两个反应过程中的能量变化(横坐标为反应进程)?参考答案:2.参考答案:3.下列哪张图正确表达了上述反应过程中的能量变化(横坐标表示反应进程)?参考答案:4.提高可逆反应产率,可采用下列哪种方法参考答案:分离出某一种产物5.参考答案:6.在一个吸热的两步的反应A→B→C中,第一步速度较慢,则整个反应的能量曲线是:参考答案:7.在三步反应A→B→C→D中,第二步最慢,第三步最快,则该反应的能量曲线为参考答案:第三章测试1.甲基自由基的碳原子采用sp2杂化,如下哪个结构图能准确代表其结构?参考答案:2.下列碳正离子最稳定的是:3.下列碳负离子最稳定的是参考答案:4.下列碳正离子最稳定的是参考答案:5.下列哪种碳正离子的稳定性最好6.参考答案:③>①>②第四章测试1.下列哪些不是自由基反应的特征?参考答案:酸碱对反应有明显的催化作用2.自由基反应中化学键发生参考答案:均裂3.将甲烷先用光照射,再在黑暗中与氯气混合,不能发生氯代反应。
有机化学答案

第一章绪论(一)用简练的文字解释下列术语。
(1)有机化合物(2)键能(3)极性键(4)官能团(5)实验式(6)构造式(7)均裂(8)异裂(9)sp2杂化(10)诱导效应(11)氢键(12)Lewis酸【解答】(1)有机化合物—碳氢化合物及其衍生物。
(2)键能—形成共价键的过程中体系释放出的能量,或共价键断裂过程中体系所吸收的能量。
(3)极性键—由不相原子形成的键,由于成键原子的电负性不同,其吸引电子的能力不同,使电负性较强原子的一端电子云密度较大,具有部分负电荷,而另一端则电子云密度较小,具有部分正电荷,这种键具有极性,称为极性键。
云对称地分布在两个成键原子之间,这种键没有极性,称为极性键。
(4)官能团—分子中比较活泼而容易发生反应的原子或基团,它常常决定着化合物的主要性质,反映化合物的主要特征。
(5)实验式—表示组成物质的元素原子最简整数比的化学式。
(6)构造式—表示分子构造的化学式。
(7)均裂—成键的一对电子平均分给两个成键原子或基团,这种断裂称均裂。
(8)异裂—成键的一对电子完全为成键原子中的一个原子或基团所占有,形成正、负离子,这种断裂称异裂。
(9)sp 2杂化—2s 轨道和两个2p 轨道杂化。
(10) 诱导效应—由于分子内成键原子的电负性不同,而引起分子中电子云密度分布不平均,且这种影响沿分子链静电诱导地传递下去,这种分子内原子间相互影响的电子效应,称为 诱导效应。
(11)氢键—当氢原子及电负性很强且原子半径较小的原子(如N ,O ,F等原子)相连时,电子云偏向电负性较大的原子,使氢原子变成近乎氢正离子状态,此时若及另一个电负性很强的原子相遇,则发生静电吸引作用,使氢原子在两个电负性很强的原子之间形成桥梁,这样形成的键,称为氢键。
(12)Lewis 酸—能够接受未共用电子对的分子或离子。
(二)下列化合物的化学键如果都为共价键,而且外层价电子都达到稳定的电子层结构,同时原子之间可以共用一对以上的电子,试写出化合物可能的Lewis 结构式。
有机化学课后习题答案第10-16章

第十章 醇和醚比较下列化合物在水中的溶解度,并说明理由4. CHOHCHOHGOH5.CH 3CfCH3而丙烷不能。
四、区别下列化合物。
1.CH 二CHCHOH 2.CH 3CHCHOH 3.CH 3CHCHCI解:烯丙醇丙醇 1-氯丙烷烯丙醇内醇 1 —氯丙烷溴水褪色不变 不变 浓硫酸溶解不溶CfCf CfCfOH (CH 3) 3COH1 —丁醇 2—甲基一2—丙醇OH1 2.CH3 ICH3- - CHO H3.OH仲醇,2—戊醇叔醇, 叔丁醇叔醇, 3, 5—二甲基一3—己醇4. I5.6.HOCH 2CH 2CH 2OH仲醇,4—甲基一2—己醇 伯醇1—丁醇OH8・仲醇,2—壬烯—5—醇1 .正丙醇2. 2 —甲基一2—戊醇3.二乙基甲醇1. CfCfCfOH2- HOCHCH 2CH 2OH3. CH 3OCHCH3解:溶解度顺 序如右:4> 2> 1> 3>5理由:羟基与水形成分子间氢键,羟基越多在水中溶解度越大,醚可与水形成氢键,2. CHjCfCHOHCH 解:2— 丁醇将下列化合物按伯仲叔醇分类,并用系统命名法命名。
伯醇1, 3 —丙二醇OH仲醇,异丙醇仲醇,1—苯基乙醇、预测下列化合物与卢卡斯试剂反应速度的顺序。
解:与卢卡斯试剂反应速度顺序如下:2—甲基—2 —戊醇>二乙基甲醇 >正丙醇a —苯乙醇立即变浑, 3 —苯乙醇加热才变浑。
合 物 的 脱 水 产 物。
3-丁烯-2-醇与溴化氢作用可能生成那些产物?试解释之。
解:反应产物和反应机理如下:2—」醇1—」醇2—甲基一2—丙醇卢卡斯试剂十分钟变浑加热变浑立即变浑3 —苯乙醇3. a 一苯乙醇解:与卢卡斯试剂反应,CH B CH2C(CH3)2 IAl 2O 3CH 3CH=C(CH )22.H 2SQ 厶(CH 3) 2CCHCHOHJ—■ /OH(CH 3)2C=CHCHOH3.4.5.七、 1 moleH 2O屮八 W^x^CH=CHCHCh 3CH?C (CH 3)C (CH3)CH 2CH BOH OHH +Al 2O 3比较下列各组醇和溴化氢反应的相对速度。
有机化学机理题及其答案

2较少,因为它无共轭烯键。3中间体碳正离子最稳定(既是烯丙,又是仲),所以3比1稍多。
:
29解释R-3-溴环己烯和溴加成学活性,2无光学活性(有对称面)。
30解释将2-或3-氯戊烷置于溶解有ZnCl2的浓盐酸中都得到2:1的2-和3-氯戊烷的混合物
解:
?
中间体碳正离子存在共振,产物为CH3OCH2CH=CHCH3以及CH2=CHCH(OCH3)CH3
25解释全氟叔丁基氯(CF3)3CCl很难进行亲核取代反应。
解
因为三氟甲基是强吸电子基,如果该氯代烃进行SN1反应,得到的碳正离子会很不稳定;如果进行SN2反应,三个三氟甲基位阻又大。所以进行SN1,SN2反应都很困难。
43
^
解
44
解
。
45
%
46
解
47
|
解:
48
解
49
$
解:
—
50
解
51
-
解
52
解
.
53
解
;
54
解
55
)
解
)
56
解
.
57
|
解
58
解
说明:羟醛缩合可逆。
|
59
解
<
说明:经过两步Michael加成。
60
~
解
说明:
中间体碳正离子特别稳定。产物是缩醛。缩醛碱性条件稳定,酸性条件下水解。这种缩醛的水解产物是羟基醛和醇。此反应可用于保护醇羟基。
链引发:
—
链传递:
链终止:
2 解释:甲醇和2-甲基丙烯在硫酸催化下反应生成甲基叔丁基醚CH3OC(CH3)3(该过程与烯烃的水合过程相似)。
有机化学课后习题答案

第二章 饱和烃习题 写出分子式为C 6H 14烷烃和C 6H 12环烷烃的所有构造异构体,用短线式或缩简式表示。
(P26) 解:C 6H 14共有5个构造异构体:CH 3CH 2CH 2CH 2CH 2CH 3CH 3CHCH 2CH 2CH 3CH 3CH 3CH 2CHCH 2CH 3CH 3CH 3CCH 2CH 3CH 3CH 3CH 3CH CHCH 3CH 3CH 3C 6H 12的环烷烃共有12个构造异构体:CH 3CH 3CH 3CH 3CH 3CH 2CH 3CH 3CH 33CH 2CH 3CH 3CH 2CH 3CH 2CH 2CH 3CH 3CH 3CH 3CH 3CH 3CH 3CH 9CH 3)2习题 下列化合物哪些是同一化合物哪些是构造异构体(P26) (1) CH 3C(CH 3)2CH 2CH 3 2,2-二甲基丁烷 (2) CH 3CH 2CH(CH 3)CH 2CH 3 3-甲基戊烷 (3) CH 3CH(CH 3)(CH 2)2CH 3 2-甲基戊烷 (4) (CH 3)2CHCH 2CH 2CH 3 2-甲基戊烷 (5)CH 3(CH 2)2CHCH 3CH 32-甲基戊烷(6) (CHJ 3CH 2)2CHCH 3 3-甲基戊烷解:(3)、(4)、(5)是同一化合物;(2)和(6)是同一化合物;(1)与(3)、(6)互为构造异构体。
习题将下列化合物用系统命名法命名。
(P29)(1)CH 3CH CHCH CH 2CH 2CH 3CH 3CH CH 3CH 23CH 31234567 2,3,5-三甲基-4-丙基庚烷(2)1234567CH 3CH CHCH CH 2CH 2CH 33CH CH 333 2,3-二甲基-4-异丙基庚烷(3)123456CH 3CH CHCH 2CHCH 3CH 3CH 3CH 32,3,5-三甲基己烷习题 下列化合物的系统命名是否正确如有错误予以改正。
有机化学 反应机理(整理版)
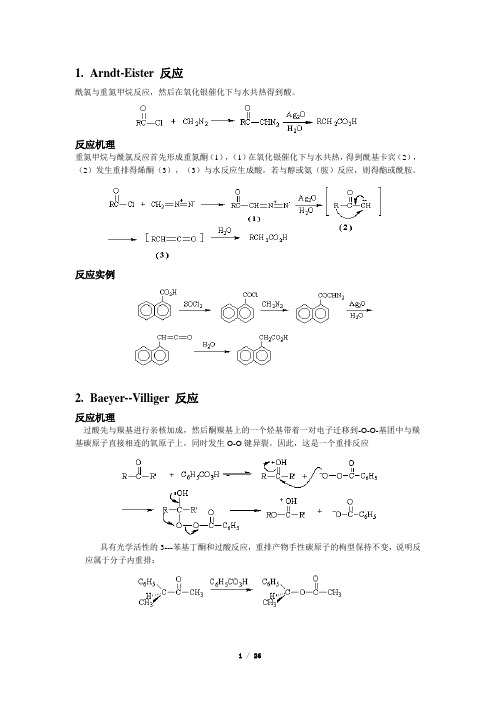
1.Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例2.Baeyer--Villiger 反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
这类氧化剂的特点是反应速率快,反应温度一般在10~40℃之间,产率高。
3.Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例4.Birch 还原芳香化合物用碱金属(钠、钾或锂)在液氨与醇(乙醇、异丙醇或仲丁醇)的混合液中还原,苯环可被还原成非共轭的1,4-环己二烯化合物。
反应机理首先是钠和液氨作用生成溶剂化点子,然后苯得到一个电子生成自由基负离子(Ⅰ),这是苯环的л电子体系中有7个电子,加到苯环上那个电子处在苯环分子轨道的反键轨道上,自由基负离子仍是个环状共轭体系,(Ⅰ)表示的是部分共振式。
有机化学习题答案
有机化学习题答案1 绪论1-1. 解:(d)。
因为H-O键中电负性相差最大,所以极性最大。
1-2. 解:(a) 含极性键分子:HF、BrCl、CH4、CHCl3、CH3OH(b) HF、BrCl、CHCl3、CH3OH是极性分子。
CH4不是极性分子,因为它分子中的各极性C-H相互抵消。
1-3. 解:1-4. 解:H2O的偶极-偶极吸引力和氢键较强。
1-5. 解:1-6. 解:1-7. 解:1-8. 解:2 烷烃答案2-1.解:分子中只含碳、氢两种元素的有机化合物称烃。
烃分子中碳原子之间仅以单键相互连接成链的称为饱和烃,也称烷烃。
烷烃中碳链为开链的称开链烷烃,而碳碳之间连接成环的称环烷烃。
烃分子中除碳碳单键外,还含碳碳双键(C=C)或碳碳叁键(C≡C)的称为不饱和烃。
2-2.解:当烷烃分子中去掉一个氢原子,生成的一价原子团称为烷基。
常见的烷基有:2-3.解:(1)3-甲基-3-乙基-6-异丙基壬烷(2)2,6-二甲基-3,6-二乙基辛烷(3)3-甲基-4-乙基已烷(4)2,5,6-三甲基辛烷(5)2,6,6-三甲基辛烷(6)5-甲基-5-乙基-4-异丙基-7-仲丁基十一烷烷烃的命名是先取代基后母体,取代基按顺序规则,优先基团后出现的原则排列在母体名称的前面。
相同取代基必须合并,表示取代基位置的阿拉伯数字必须写在相应取代基前面,阿拉伯数字与汉字之间必须用半字格一短横“-”隔开,阿拉伯数字之间用逗号“,”分开。
2-4.解:在烷烃分子中,某碳原子仅与一个其它碳原子相连接时称该碳原子为伯碳原子,当与两个其它碳原子相连接时称该碳原子为仲碳原子,当与三个及四个其它碳原子相连接时,分别称为叔碳原子和季碳原子。
伯、仲、叔碳原子上所连接的氢原子分别称为伯氢、仲氢和叔氢。
2-5.解:2-6.解:对相应烷烃各异构体中伯、仲、叔、季碳原子及伯、仲、叔氢原子的确证及对各异构体中氢原子的化学环境的比较是解此题的关键。
2-7.解:2-甲基丁烷的构造式为分子中具有四种不等价的氢原子,所以当氯取代时可以生成四种不同的一氯取代物:分子中也具有四种不等价的氢原子,同样可以生成四种一氯化取代物:2-8.解:根据季碳、叔碳和仲碳的定义,必须具有如下的状态:其中游离价表示必须与其他碳原子相连接。
邢其毅《基础有机化学》笔记和课后习题(含考研真题)详解(新型有机合成方法)

第25章新型有机合成方法25.1 复习笔记一、Heck反应1.定义卤代芳烃或烯烃与乙烯基化合物在过渡金属催化下形成碳碳键的偶联反应称为Heck 反应。
通常需要碱参与和在钯催化下进行。
2.机理Heck反应的机理如下所示:(1)零价或二价钯的催化剂前体被活化,生成能直接催化反应配位数少的零价钯。
(2)卤代烃对新生成的零价钯进行氧化加成。
这是一个协同过程,也是整个反应的决速步骤。
碘代芳烃反应最快,产率也较高,而且反应条件温和,时间短。
碘代、溴代以及氯代芳烃或烯烃的活性随着碳卤键的键能增加而递减,一般不使用氟代芳烃或烯烃进行Heck反应。
(3)第三阶段为烯烃的迁移插入,它决定了整个反应的区域选择性和立体选择性。
一般来说,烯烃上取代基空间阻碍越大,迁移插入的速率越慢。
如(4)整个循环的最后一步就是钯氢消除反应,生成取代烯烃和钯氢络合物。
后者在碱如三乙胺或碳酸钾等作用下重新生成二配位的零价钯,再次参与催化循环。
在此步骤中最重要的是反应的立体化学。
例如:3.应用Heck反应是合成带各种取代基的不饱和化合物最为有效的偶联方法之一。
对许多官能团如醛基、酯基、硝基等均有良好的兼容性。
利用分子内的Heck反应还可构筑稠环体系。
缺点:反应条件比较苛刻,需要比较严格的无氧操作,很多情况下对水也十分敏感。
二、Bergman环化反应1.定义共轭的烯二炔通过分子内环化生成1,4-苯双自由基或其类似物的一类环化反应称为Bergman环化反应,Bergman环化反应具有以下基本反应形式:启动该反应的关键反应条件是加热或者光照。
2.反应机理Bergman环化反应机理可以如下表示:在这个反应中,1,4-环已二烯作为氢供体使得1,4-苯双自由基不断地获得氢从而生成苯,苯不再可逆回到反应底物。
由于整个反应最终生成稳定的芳环体系,因此反应是放热的。
如果炔烃的取代基为丙基,则还会观察到三键被还原的产物出现,这说明反应与三键上的取代基有一定的关系:3.应用在构筑芳环体系、诱导烯烃的聚合以及药物化学等领域都有一定的应用价值。
有机化学人名反应机理全解

人名反应1.Arbuzov反应(Michaelis-Arbuzov重排)2.Arndt-Eistert反应3.Baeyer-Villiger氧化重排4.Beckmann重排5.Birch还原6.Bischler-Napieralski合成法7.Bouveault-Blanc还原8.Bucherer反应9.Cannizzaro反应10.Chichibabin反应11.Chugaev反应12.Claisen重排13.Claisen缩合反应14.Claisen-Schmidt反应15.Clemmensen还原bes合成法17.Cope重排18.Cope消除19.Corey-House合成法20.Cristol反应21.Curtius重排22.Darzen反应23.Demjanov重排24.Dieckmann反应25.Diels-Alder反应26.Döebner-Miller合成法27.Edman降解法28.Eschweiler-Clarke反应29.Favorski重排30.Fischer吲哚合成法31.Friedel-Crafts烷基化反应32.Friedel-Crafts酰基化反应33.Fries重排34.Gabriel合成法35.Gatterman反应(1)36.Gatterman反应(2)37.Gatterman-Koch反应38.Gomberg-Bachmann反应39.Hantzsch吡啶合成法40.Hantzsch吡咯合成法41.Haworth反应42.Hell-Volhard-Zelinsky反应43.Hell-Volhard-Zelinskyα-溴化法44.Henry反应45.Hinsberg反应46.Hofmann重排(Hofmann降解)47.Hofmann烷基化48.Hofmann消除反应49.Houben-Hoesch反应50.Hunsdiecker反应51.Knoevenagel反应52.Knorr合成法53.Kochi反应54.Kolbe反应55.Kolbe-Schmidt反应56.Kucherov反应57.Leuckart反应58.Lossen重排59.Mannich反应60.McMurry反应61.Meerwein-Ponndorf-Verley还原62.Michael加成反应tkin重排64.Nazarov反应65.Oppenauer氧化66.Paal-Knorr合成法67.Perkin反应68.Pschorr反应69.Reformatsky反应70.Reimer-Tiemann反应71.Ritter反应72.Robinson增环反应73.Rosenmund还原74.Sandmeyer反应75.Schiemann反应76.Schmidt重排77.Shapiro反应78.Simmons-Smith反应79.Skraup合成法80.Smiles重排81.Stephen还原82.Stevens重排83.Strecker氨基酸合成法84.Tiffeneau-Demjanov重排85.Ullmann反应86.Vilsmeier反应87.von Richter重排88.Wacker氧化反应89.Wagner-Meerwein重排90.Williamson合成法91.1,2-Wittig重排92.Wittig反应93.Wittig-Horner反应(Emmons反应、Horner-Emmons反应、Wadsworth-Emmons反应)94.Wolff重排95.Wolff-Kisher-黄鸣龙还原96.Wurtz反应97.Wurtz-Fittig反应Arbuzov反应亚磷酸三烷基酯与卤代烷或其衍生物反应生成烷基膦酸酯和一个新的卤代烷的反应称为Arbuzov反应,也称Michaelis-Arbuzov重排。
【邢其毅基础有机化学】【考研】反应机理

CH3Cl + Cl
H= -112. 9 kJ/mol Ea=8. 3 kJ/mol
链终止
Cl
CH3 Cl
+
Cl
+ CH3
Cl2
H3CCH3 H3CCl
+ CH3
2 饱和碳原子上的亲核取代反应
化合物分子中的原子或原子团被亲核试剂取代的反应称为亲 核取代反应。用 SN表示。在反应中,受试剂进攻的对象称为底物; 亲核的进攻试剂称为亲核试剂;在反应中离开的基团称为离去基 团;与离去基团相连的碳原子称为中心碳原子;生成物称为产物。 在上述反应中,若受进攻的对象是饱和碳原子,则称此类反应为 饱和碳原子上的亲核取代反应。
实例:卤代烃单分子亲核取代反应的反应机理(SN1)
R1 R2 R3 C Br R1 R2 C Br
R 2 R1
-Br-
慢
C+ R3 中间体
R1 R2 R3
Nu-
R3
快
反应物
R1 R2 R3 C Nu
过渡态
+
Nu
C
过渡态
R1 R2 R3 C Nu
过渡态
+
产物
Nu
C
R1 R2 R3
只有一种分子参与了 决定反应速率关键步骤的 亲核取代反应称为SN1 反 应。在SN1反应中,得到构 型翻转和构型保持两种产 物。
消除
*2 碳正离子机理
(CH3)3C-OH
+
OH
H+
(CH3)3COH2
O
+
-H2O
(CH3)3C+
O=C-R
OH
属于SN1机理
按SN1机理进 行反应,是烷 氧键断裂
有机化学反应机理13
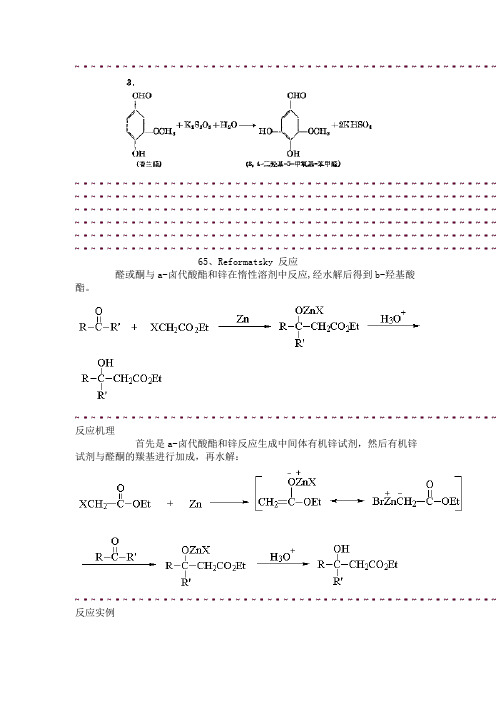
65、Reformatsky 反应醛或酮与a-卤代酸酯和锌在惰性溶剂中反应,经水解后得到b-羟基酸酯。
反应机理首先是a-卤代酸酯和锌反应生成中间体有机锌试剂,然后有机锌试剂与醛酮的羰基进行加成,再水解:反应实例66、Reimer-Tiemann 反应酚与氯仿在碱性溶液中加热生成邻位及对位羟基苯甲酸。
含有羟基的喹啉、吡咯、茚等杂环化合物也能进行此反应。
常用的碱溶液是氢氧化钠、碳酸钾、碳酸钠水溶液,产物一般以邻位为主,少量为对位产物。
如果两个邻位都被占据则进入对位。
不能在水中起反应的化合物可吡啶中进行,此时只得邻位产物。
反应机理首先氯仿在碱溶液中形成二氯卡宾,它是一个缺电子的亲电试剂,与酚的负离子(Ⅱ)发生亲电取代形成中间体(Ⅲ),(Ⅲ)从溶剂或反应体系中获得一个质子,同时羰基的α-氢离开形成(Ⅳ)或(Ⅴ),(Ⅴ)经水解得到醛。
反应实例酚羟基的邻位或对位有取代基时,常有副产物2,2-或4,4-二取代的环己二烯酮产生。
例如:67、Reppe 合成法烯烃或炔烃、CO与一个亲核试剂如H2O, ROH, RNH2,RSH,RCOOH等在均相催化剂作用下形成羰基酸及其衍生物。
许多过渡金属如Ni,Co,Fe,Rh,Ru,Pd等的盐和络合物均可作催化剂。
反应过程首先形成酰基金属,然后和水、醇、胺等发生溶剂解反应形成酸、酯、酰胺:68、Robinson 缩环反应含活泼亚甲基的环酮与a,b-不饱和羰基化合物在碱存在下反应,形成一个二并六员环的环系:反应机理本反应分为两步,第一步是Micheal加成反应,第二步是羟醛缩合反应。
反应实例69、Rosenmund 还原酰氯用受过硫-喹啉毒化的钯催化剂进行催化还原,生成相应的醛:反应物分子中存在硝基、卤素、酯基等基团时,不受影响。
反应实例。
有机化学答案解析_2到7章
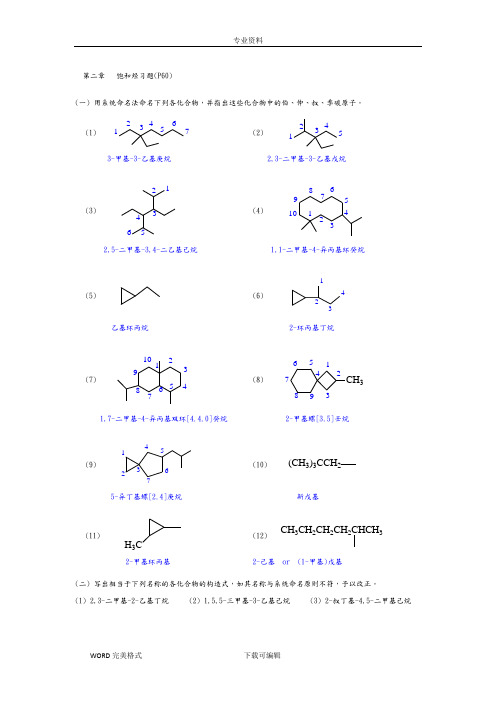
第二章饱和烃习题(P60)(一) 用系统命名法命名下列各化合物,并指出这些化合物中的伯、仲、叔、季碳原子。
(1) 1234567(2)123453-甲基-3-乙基庚烷2,3-二甲基-3-乙基戊烷(3)123456(4) 101234567892,5-二甲基-3,4-二乙基己烷1,1-二甲基-4-异丙基环癸烷(5) (6)1234乙基环丙烷2-环丙基丁烷(7)12345678910(8)123456789CH31,7-二甲基-4-异丙基双环[4.4.0]癸烷2-甲基螺[3.5]壬烷(9)1234567(10) (CH3)3CCH25-异丁基螺[2.4]庚烷新戊基(11)H3C (12)CH3CH2CH2CH2CHCH32-甲基环丙基2-己基 or (1-甲基)戊基(二) 写出相当于下列名称的各化合物的构造式,如其名称与系统命名原则不符,予以改正。
(1) 2,3-二甲基-2-乙基丁烷(2) 1,5,5-三甲基-3-乙基己烷(3) 2-叔丁基-4,5-二甲基己烷CH 3CCHCH 3CH 3CH 3CH 2CH 3CH 2CH 2CHCH 2C CH 3CH 3CH 3CH 3C 2H 5CH 3CCH 2CH C(CH 3)3CH 3CHCH 3CH 32,3,3-三甲基戊烷 2,2-二甲基-4-乙基庚烷 2,2,3,5,6-五甲基庚烷(4) 甲基乙基异丙基甲烷(5) 丁基环丙烷(6) 1-丁基-3-甲基环己烷CH CH 3CH 2CH 3CHCH 3CH 3CH 2CH 2CH 2CH 3CH 2CH 2CH 2CH 3CH 32,3-二甲基戊烷1-环丙基丁烷1-甲基-3-丁基环己烷(三) 以C 2与C 3的σ键为旋转轴,试分别画出2,3-二甲基丁烷和2,2,3,3-四甲基丁烷的典型构象式,并指出哪一个为其最稳定的构象式。
解:2,3-二甲基丁烷的典型构象式共有四种:( I )( II )( III )H CH 3CH 3CH 3HCH 3H CH 3CH 3CH 3C HH 3H CH 3CH 3CH 3CH 3H(最稳定构象)( IV )(最不稳定构象)( III )( II )H CH 3CH 3CH 3H H 3C H CH 3CH 3HC CH 3H 3H CH 3CH 3HCH 3CH 32,2,3,3-四甲基丁烷的典型构象式共有两种:CH 3H 3C CH 3CH 3H 3CCH 3CH 3CH 3CH 3CH 3C CH 3H 3(最稳定构象)( I )( II )(四) 将下列的投影式改为透视式,透视式改为投影式。
有机化学课后习题答案第四章

4章思考题4.1付-克烷基化反应的特点是什么?4.2解释什么叫定位基,并说明有哪三类定位基。
4.3解释定位效应。
4.4共振论对于共振结构式有何规定?4.5试说明芳香亲电取代反应的机理。
4.6甲苯和对二甲苯相比哪个对游离基卤代反应更活泼?试说明理由。
4.7用KMnO 4或心6。
7+『使PhCH s氧化成PhCOOH的反应产率很差,而由P-O2N-C6H4CH3 氧化成P-O2NC6H4COOH,同样的氧化反应却有较好的产率。
如何解释。
4.8回答下列问题。
(1)(1)环丁二烯只在较低温度下才能存在,高于35K即(如分子间发生双烯合成)转变为二聚体,已知它的衍生物二苯基环丁二烯有三种异构体。
上述现象说明什么?写出二苯基环丁二烯三种异构体的构造式。
(2)(2) 1,3,5,7-环辛四烯能使冷的高锰酸钾水溶液迅速褪色,和溴的四氯化碳溶液作用得到C s H8Br8a、它应具有什么样的结构?+ 2-b、b、金属钾和环辛四烯作用即得到一个稳定的化合物2K C8H8 (环辛四烯二负离子)。
这种盐的形成说明了什么?预期环辛四烯二负离子将有怎样的结构?解答4.1答:(1)因烷基正离子容易重排,易形成烷基异构化产物;(2)烷基可活化苯环,易使烷基化反应产物为多元取代产物;(3)烷基化反应是可逆反应,使得产物可能复杂化。
4.2答:苯环上已有一个取代基后,再进行亲电取代反应时,新进入的基团进入苯环的位置由环上原有取代基的性质决定,这个原有的取代基叫定位基。
定位基可分为三类,即(1)邻、对位定位基,如一OH、一NH 2、一NHCOCH 3、一CH3等,这类基团使苯环活化,并且使新引入的取代基在定位基的邻位和对位。
(2)间位定位基,如一NO2、—CN、—COCH 3' —COOH、—SO3H等,这类基团使苯环钝化,并使新引入的取代基在它的间位。
(3)卤素是一类特殊的定位基,它使苯环钝化,但都是邻、对定位基。
4.3答:邻、对位定位基的推电子作用是苯环活化的原因,这又可分为两种情况:①在与苯环成键的原子上有一对未共享电子,这对电子可以通过大n键离域到苯环上;②虽无未共享电子对,但能通过诱导效应或超共轭效应起推电子作用的基团,如甲基或其他烷基。
有机化学 联系及答案

1:临床上可用作重金属解毒剂的是()4.二巯基丁二酸钠2:酸性最强的是()3.3:能发生缩二脲反应的是()3.H2NCH2CONHCH2CONHCH34:蛋白质一级结构中,连接氨基酸残基的主要化学键是()5.肽键5:与Tollens试剂不能发生银镜反应的是()3.蔗糖6:鉴别环丙烷和丙烯,可采用()2.KMnO4溶液7:血液中的酮体是()4.8:室温下能与AgNO3/C2H5OH生成沉淀的是()4.C6H5CH2Cl9:不能发生醇醛缩合反应的是()3.苯甲醛10:化合物①PhCOCH2COCH3;②CH3COCH3;③CH3COCH2CO2CH3;④CH3COCH2COCH3,烯醇式结构含量由高到低的顺序是()2.1>4>3>2 11:某氨基酸在pH=7的溶液中带正电荷,其pI值()1.大于7 12:卵磷脂充分水解后,水解液中不存在的化合物是() 3.胆胺13:最容易水解的是()3.乙酰氯14:下列化合物没有光学活性的是()4.15:碱性最强的是(). 4.环己胺16:“福尔马林”的组成成分是()1.40%甲醛水溶液17:糖在人体内的储存形式是()2.糖原18:下列化合物中,烯醇化程度最大的是5.19:脑磷脂充分水解后,水解液中不存在的化合物是()2.胆碱20:下列化合物中,烯醇化程度最小的是()1.21:烯醇式结构含量由高到低的顺序是()4.2>4>3>122:(CH3CH2)3CH所含的伯、仲、叔氢原子的个数比是()4.9:6:123:下列化合物中,沸点最低的是()5.1-丁烯24:磺胺噻唑(消炎痛)分子中各氮原子的碱性强弱顺序为()5. (3)>(1)>(2) 25:酸性最强的是()3.乙酸26:酸性最强的是(). 2.乙二酸(草酸)27:(CH3CH2)3CH所含的伯、仲、叔碳原子的个数比是()1.3:3:128:酰化能力最强的是()4.CH3COCl29:能使苯环活化的定位基是()2.?OR30:下列化合物中,沸点最高的是()1.丁酸31:内消旋体没有旋光性,其原因是()3.分子中有对称因素32:非还原糖是()3.蔗糖33:下列取代基中,既是邻对位定位基又钝化苯环的是()5.?Cl34:在生理条件下,带正电荷的氨基酸是()5.赖氨酸35:不是维系蛋白质高级结构的化学键是()1.肽键1:含有β-糖苷键的是()2.. 纤维二糖4.. 乳糖5.纤维素2:RNA水解的最终产物包括()1..磷酸2..核糖3.胞嘧啶4.尿嘧啶3:α-D-吡喃葡萄糖和β-D-吡喃葡萄糖是()1.异头物2.端基异构体3.非对映体5.差向异构体4:有对映异构体的是()1.乳酸2.苹果酸4.酒石酸5:经硝酸氧化后,仍有光学活性的化合物是()1.果糖2.脱氧核糖3.甘露糖5.葡萄糖6:具有还原性的是()1.葡萄糖2.果糖4.麦芽糖7:存在构型异构体的化合物是()2.1,4-二溴环己烷3.1,2-二氯环戊烷4.1-甲基-2-氯环丁烷5.1-甲基-3-乙基环己烷8:属于共轭烯烃的是()1. 4.9:能使苯环活化的定位基是()2.-OR3.-NHCH310:能水解的化学键是()1.. 酐键3.. 酯键4.. 苷键5..酰胺键1:淀粉是由α-D-葡萄糖,通过α-1,6苷键连接而成的多糖。
有机化学反应机理

有机化学反应机理篇一:有机化学反应类型机理分析学生:张李越科目:化学第阶段第次课教师:王昭伦一、取代反应(1个原子或原子团下来,另一个原子或原子团上去,占据原来原子或原子团的位置,其他原子结构不变,下来的原子或原子团与另一原子或原子团结合)1.定义:有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应叫做取代反应。
2.种类:(1)卤代反应,有机物分子里的某些原子或原子团被和卤素原子所代替的反应。
例如:CH4+Cl2反应历程分析:注意:甲苯和溴发生卤代反应时,反应条件的不同决定了到底是烃基发生取代(光照)还是和苯环发生取代(铁作催化剂)。
CH3Cl+HCl如:+Cl2+Cl2(2)硝化反应,有机物分子里的某些原子或原子团被和-NO2所代替的反应,一般是苯环上的原子被-NO2取代。
例如:(3)成醚反应,醇分子之间脱水生成醚。
例如:a.链状(乙醚)b.环状(环氧乙醚)(4)酯化反应,醇和羧酸及无机含氧酸可以根据“酸失羟基醇失氢”的原则发生酯化反应。
例如:a.一元羧酸和一元醇反应CH3COOH+HOC2H5CH3COOC2H5+H2Ob.二元羧酸(或醇)和一元醇(或酸)反应:HOOCCOOH+HOC2H5HOOCCOOC2H5+H2OHOOCCOOH+2HOC2H5①生成小分子链状酯C2H5OOCCOOC2H5+2H2Oc.二元羧酸和二元醇的酯化反应HOOCCOOH+HOCH2CH2OH②生成环状酯HOOCCOOCH2CH2OH+H2O1杭州龙文教育科技有限公司③生成聚酯+2H2OnHOOCCOOH+nHOCH2CH2OHd.羟基酸的酯化反应①分子间反应生成小分子链状酯+(2n-1)H2O2CH3CH(OH)COOHCH3CH(OH)COOCH(CH3)COOH+H2O ②分子间反应生成环状酯+2H2O③分子内酯化反应生成内酯+H2Oe.无机酸和醇酯化生成酯(如生成硝酸甘油酯)+例如:卤代烃、酯类、糖类、蛋白质等(1)卤代烃的水解,例如:+3H2O(5)水解反应,故羧酸与醇的酯化反应与酯的水解,是一对逆反应,同时也同属一反应类型(2)酯的水解,例如:CH3COOCH2CH3+H2O (3)糖类的水解,例如:CH3COOH+CH3CH2OH(4)蛋白质的水解反应,蛋白质水解生成多肽或者氨基酸。
