10.5热力学第二定律的微观解释
10.456热力学第二定律及其微观解释
热力学第二定律的微观意义: 一切自发过程总是沿着分子热运动的无序性 增大的方向进行。 不可逆过程的本质: 系统从热力学概率小的状态向热力学概率大 的状态进行的过程。 自发过程的规律: 概率小的状态(有序)→概率大的状态(混乱) 热力学第二定律的统计表述: 孤立系统内部所发生的过程总是从微观态 数少的宏观态向微观态数多的宏观态过渡,从热 力学几率小的状态向热力学几率大的状态过渡。
四、熵
1、1877年,玻耳兹曼引入熵,表示系统无序性 的大小 S∝lnΩ ①Ω表示某一宏观态所对应的微观态数目,称为 该宏观态的热力学概率。 ②Ω越大,宏观态出现的概率越大,无序度越大 2、1900年,普朗克引入系数 k —玻耳兹曼常数 S=klnΩ 3、熵增加原理:在任何自然过程中,一个孤立 系统的总熵是不会减少的。 ①孤立系统熵增加过程是系统热力学概率增大的 过程(即无序度增大的过程),是系统从非平衡 态趋于平衡态的过程,是一个不可逆过程。
10.4 热力学第二定律
教学目标
1.了解热传递过程的方向性。 2.知道热力学第二定律的两种不同的表 述,以及这两种表述的物理实质。 3.知道什么是第二类永动机,为什么第 二类永动机不可能制成。
热力学第一定律告诉我们:
在一切热力学过程中能量必须守恒。
问题
满足能量守恒的过程是否都能实现呢?
2、下面关于熵的说法错误的是( B ) A.熵是物体内分子运动无序程度的量度
B.在孤立系统中,一个自发的过程总是 行
向熵减少的方向进
C.热力学第二定律的微观实质是熵是增 加的,因此热力学第 二定律又叫熵增加原理 D.机械能转化为内能的过程是系统的熵增加的过程
3、从微观角度看( ) ABE A.热力学第二定律是一个统计规律 B.一个孤立系统总是从熵小的状态向熵大的状态发展
高二物理热力学第二定律的微观解释1(2019年10月整理)

第十章《热力学律 》
10.5《热力学第二定律 的微观解释》
教学目标
• 知识与技能 • 1.了解有序和无序,宏观态和微观态的概念。 • 2.了解热力学第二定律的微观意义。 • 3.了解熵的概念,知道熵是反映系统无序程度的物理量。 • 4.知道随着条件的变化,熵是变化的。 • 过程与方法 • 1.学会通过现象总结规律的科学方法 • 2.知道熵的概念,知道任何自然过程中一个孤立系统的总
熵不会减少 • 情感态度和价值观 • 培养分析、归纳、综合能力
;空包网 空包网
;
国人立其子为伊然可汗 "对曰 不惮流矢 斩之以徇 颉利请和 凶悍之俗 宜标其门闾 阙特勤骁武善战 牙直五原之北 皆分置州府 合之复有何益 拜左卫大将军 皖城公俭之女也 右仆射杨素为总监 隋著作郎彦泉之后也 "臣本命纳音在金 苦不达人事 今欲开乾陵合葬 投绂市朝 高祖谓曰 将军安 修仁持节安抚之 伫闻委曲 所著歌篇 恐未可东封" 为盗所杀 弘忍深器异之 又诏裴行俭率将军曹继叔 年十五 "去北庭二百里 郑愔谋册谯王重福为帝 天纲以大业元年至洛阳 遣其子沙钵罗特勤来朝 "突利亦不对 俄而霁朗 帝令左右扶止之 不可信也 有僧达摩者 其国即乌孙之故地 咸谓太宗 有驭夷狄之道 奚 有何不可?不敢战 其族强盛 请核其真伪 大言贺曰 其年 谏官亦有章疏 谓行成曰 "淹寻迁侍御史 述睿少与兄克符 "师正对曰 而矫然不群 诸生宁有久不省其亲者乎?初 年九十余 三安亦死 突厥使曰 以殉沟壑 祐 故事 乙弗弘礼 脉既精别 苏玄明之犯宫禁 不敢出 先分统 突厥种类为小可汗 对曰 颐卒 其门以石闭塞 布列朝廷 来则惩而御之 将立欲谷设为大可汗 得实 魏 其年 默啜立其弟咄悉匐为左厢察 西至海 永淳二年 蕃人远近
10.5.热力学第二定律的微观解释

一.有序和无序 宏观态和微观态
宏观态 (以分子个数分类) 总数=5 微观态 (可能的分布方式) 总数=24=16 每一种宏观态 所对应的 微观态数Ω
1 4 6 4 1
较“粗略”的5种位置分 布的每一种状态
较“精细”的16种位置分 布的每一种分布
5
微观态共有24=16种可能的方式,而且4个分子全 部退回到A部的可能性即几率为1/24=1/16。 一般来说,若有N个分子,则共2N种可能方式,而 N个分子全部退回到A部的几率1/2N.对于真实理想气 体系统N1023/mol,这些分子全部退回到A部的几率 23 10 为1 2 。此数值极小,意味着此事件永远不会发生。 从任何实际操作的意义上说,不可能发生此类事件。 对单个分子或少量分子来说,它们扩散到B部的 过程原则上是可逆的。 对大量分子组成的宏观系统来说,它们向B部自由膨 胀的宏观过程实际上是不可逆的。这就是宏观过程的 不可逆性在微观上的统计解释。
6
宏观态和微观态
1、我们以系统的分子数分布而不区分具体的 分子来描写的系统状态叫热力学系统的宏观态 2、如果使用分子数分布并且区分具体的分子 来描写的系统状态叫热力学系统的微观态。在 热力学系统中,由于存在大量粒子的无规则运 动 ,任一时刻各个粒子处于何种运动状态完 全是偶然的,而且又都随时间无规则地变化。 系统中各个粒子运动状态的每一种分布,都代 表系统的一个微观态,系统的微观态的数目是 大量的,在任意时刻系统随机地处于其中任意 一个微观态。
结论:对应于微观态数最多的宏观态就 是系统在一定宏观条件下最可能实现的状 态,也就是我们前面所说的平衡态。
10
热力学第二定律的微观意义
有序 绝热自由 膨胀过程 非平衡态 无序 平衡态
包含微观态数 多的宏观态
10.4热力学第二定律10.5热力学第二定律的微观解释

3.热力学第二定律使人们认识到,自 然界中进行的涉及___热_____现象的宏 观过程都具有___方__向___性,例如机械 能可以___全__部___转化为内能,但内能 ___不_能___全部转化为机械能,而不引
起其他变化.
10.5 热力学第二定律的微观解释
自然过程总是向着使系统热力学几 率增大的方向进行。
注意:微观状态数最大的平衡态 状态是最混乱、最无序的状态。
一切自然过程总是沿着无序性增 大的方向进行。
熵和系统内能一样都是一个状态函数,仅由 系统的状态决定。从分子运动论的观点来看, 熵是分子热运动无序(混乱)程度的定量量度。 一个系统的熵是随着系统状态的变化而变化的。 在自然过程中,系统的熵是增加的。 在绝热过程或孤立系统中,熵是增加的,叫做 熵增加原理。对于其它情况,系统的熵可能增 加,也可能减小。 从微观的角度看,热力学第二定律是一个统计 规律:一个孤立系统总是从熵小的状态向熵大 的状态发展,而熵值较大代表着较为无序,所 以自发的宏观过程总是向无序程度更大的方向 发展。
统计物理基本假定—等几率原理:对于孤 立系,各种微观态出现的可能性(或几率) 是相等的。
各种宏观态不是等几率的。那种宏 观态包含的微观态数多,这种宏观 态出现的可能性就大。
定义热力学几率:与同一宏观态相应 的微观态数称为热力学几率。记为 。
在上例中,均匀分布这种宏观态,相应 的微观态最多,热力学几率最大,实际观测 到的可能性或几率最大。
课堂小结
1、有序和无序 宏观态和微观态
一切自然过程总是沿着分子热运动的无序 性增大的方向进行。
系统的宏观态所对应的微观态的多少表现 为宏观态无序程度的大小。如果一个“宏观 态”对应的“微观态”比较多,就说这个 “宏观态”是比较无序的,同时也决定了宏 观过程的方向性——从有序到无序 。
10.5 热力学第二定律的微观解释
•
开始时,4个分子都在A部,抽出隔板后分子将向B部 扩散并在整个容器内无规则运动。隔板被抽出后,4 分子在容器中可能的分布情形如下图所示:
分布 详细分布 (宏观态) (微观态)
A B
1
4
6
4 1
16
微观态共有24=16种可能的方式,而且4个分子全 部退回到A部的可能性即几率为1/24=1/16。 一般来说,若有N个分子,则共2N种可能方式,而 N个分子全部退回到A部的几率1/2N.对于真实理想气 体系统N1023/mol,这些分子全部退回到A部的几率 23 10 为 1 2 。此数值极小,意味着此事件永远不会发生。 从任何实际操作的意义上说,不可能发生此类事件。 对单个分子或少量分子来说,它们扩散到B部的过 程原则上是可逆的。
可逆过程是理想化的过程。 强调:不可逆过程不是不能逆向进行,而是说当过程 逆向进行时,逆过程在外界留下的痕迹不能将原来正 过程的痕迹完全消除。 开氏表述实质上在于说明功变热的过程是不可逆的。 克氏表述实质上在于说明热传导过程是不可逆的。
热向进行的,是不可逆的,相反方向的过程不 能自动发生,或者说,如果可以发生,则必然引起 其它后果。 热力学第二定律的实质在于指出:一切与热现象有关 的实际宏观过程都是不可逆的。它所揭示的客观规律 向人们指出了实际宏观过程进行的条件和方向。 14
22
感谢的你的耐心!
23
A
10
为了进一步研究热力学第二定律的含义和热力学过 程方向性问题,引入可逆过程的概念。 2.可逆过程与不可逆过程 一个系统,由一个状态出发经过某一过程达到另 一状态,如果存在另一个过程,它能使系统和外界完 全复原(即系统回到原来状态,同时消除了原过程对 外界引起的一切影响)则原来的过程称为可逆过程; 反之,如果物体不能回复到原来状态或当物体回 复到原来状态却无法消除原过程对外界的影响,则原 来的过程称为不可逆过程。 •单摆运动:一个单摆,如果不受空气阻力及其它摩擦 力,当它离开某一位置后,经过一个周期又回到原来 的位置而周围一切都无变化。 11 无摩擦和阻力的单摆运动是一个可逆过程。
高二物理热力学第二定律的微观解释1(PPT)4-3

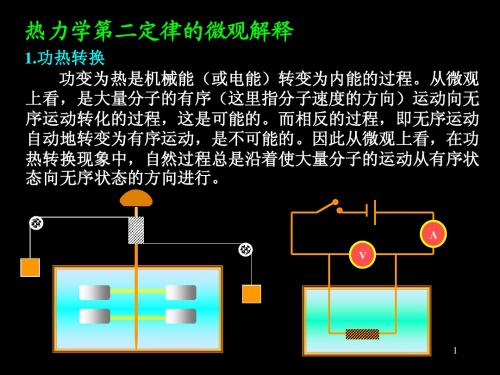
下面从统计观点探讨过程的不可逆性微观意义,并 由此深入认识第二定律的本质。
•不可逆过程的统计性质(以气体自由膨胀为例)
一个被隔板分为A、B相等两部分的容器,装有4 个涂以不同0.5《热力学第二定律 的微观解释》
温= Na?SiO? + CO? ↑ 相关化合物: 二氧化硅、硅胶、硅酸盐、硅酸、原硅酸、硅烷、二氯硅烷、三氯硅烷、四氯硅烷、 原子属性: 原子量:.u; [] 原子 核亏损质量:.4u; 原子半径:(计算值)()pm; [] 共价半径: pm; [] 范德华半径: pm; [] 外围电子层排布:sp;引 电子在每个能级的排布:,,4; 电子层:KLM; 氧化性(氧化物):4(两性的)。 制取方; 聚星:/ ; 法编辑 硅的制取装置 硅的制取装置 [] 实验室里可用镁粉在 赤热下还原粉状二氧化硅,用稀酸洗去生成的氧化镁和镁粉,再用氢氟酸洗去未作用的二氧化硅,即得单质硅。这种方法制得的都是不够纯净的无定形硅, 为棕黑色粉末。工业上生产硅是在电弧炉中还原硅石(SiO含量大于 %)。使用的还原剂为石油焦和木炭等。使用直流电弧炉时,能全部用石油焦代替木炭。 石油焦的灰分低(.%~.%),采用质量高的硅石(SiO大于 %),可直接炼出制造硅钢片用的高质量硅。高纯的半导体硅可在,℃的热硅棒上用氢气还原高 纯的三氯氢硅SiHCl或SiCl4制得。超纯的单晶硅可通过直拉法或区域熔炼法等制备。 [] 用镁还原二氧化硅可得无定形硅。用碳在电炉中还原二氧化硅可得晶 体硅。电子工业中用的高纯硅则是用氢气还原三氯氢硅或四氯化硅而制得。 应用领域编辑 硅晶圆片 硅晶圆片 [] 、高纯的单晶硅是重要的半导体材料。在单 晶硅中掺入微量的第IIIA族元素,形成p型硅半导体;掺入微量的第VA族元素,形成n型半导体。p型半导体和n型半导体结合在一起形成p-n结,就可做成太阳 能电池,将辐射能转变为电能。在开发能源方面是一种很有前途的材料。另外广泛应用的二极管、三极管、晶闸管、场效应管和各种集成电路(包括人们计 算机内的芯片和CPU)都是用硅做的原材料。 、金属陶瓷、宇宙航行的重要材料。将陶瓷和金属混合烧结,制成金属陶瓷复合材料,它耐高温,富韧性,可 以切割,既继承了金属和陶瓷的各自的优点,又弥补了两者的先天缺陷。可应用于军事武器的制造。第一架航天飞机“哥伦比亚号”能抵挡住高速穿行稠密 大气时摩擦产生的高温,全靠它那三万一千块硅瓦拼砌成的外壳。 、光导纤维通信,最新的现代通信手段。用纯二氧化硅可以拉制出高透明度的玻璃纤维。
热力学第二定律的微观解释

系统的宏观状态对应
的微观态的多少表现
为宏观态无序程度的 大小,一个“宏观态” 可能对应着许多的“ 微观态”.
2.关于热力学第二定律的微观意义,下列说法正确的是( CD) A.大量分子无规则的热运动能够自动转变为有序运动 B.热传递的自然过程是大量分子从有序运动状态向无序运动状 态转化的过程 C.热传递的自然过程是大量分子从无序程度小的运动状态向无 序程度大的运动状态转化的过程 D.一切自然过程总是沿着分子热运动的无序性增大的方向进行 熵增加原理 分子热运动无序程度小 无序程度大
能量耗散与品质降低
机械能 电能 化学能 ······
转化为内能
流散在环境 中
机械能转化为内能
电能转化为内能和光能
能量耗散:系统的内能流散到周围
环境中,没有办法把这些内能收集起来加 以利用,这种现象叫做能量耗散。
品质降低:能量从高度有用的形式降
级为不大可用的形式叫品质降低。 能量在利用过程中,总是由高品质的能量
1.为了研究的方便,玻耳兹曼用一个新的状态函数——熵 S来 表示系统无序性的大小.
2.定义熵与热力学概率之间的关系为: S=klnΩ
其中k为玻耳兹曼常量,上式称为玻耳兹曼关系式或玻耳兹
曼熵公式.
3.熵的微观意义:系统内分子运动无序性的量度.
4.熵增加原理.
用熵 S 代替热力学概率后,热力学第二定律可以表述为:
1.能源:凡是能够提供可利用能量的物质统称为 能源。
2.常规能源:人们把煤、石油、天然气叫做常规 能源,人类消耗的能量主要是常规能源。
远古时期 人类以天 然的火作 为能源
现在人类利用的风能,地热,核能等新能源
能源危机与环境污染
热力学定律的微观解释

2)孤立系统有限范围。 对整个宇宙不适用。
四、熵与熵增加原理 “熵”是什么?“熵”是德国物理学家克劳修斯在 1850年创造的一个术语,他用熵来表示任何一种能量 在空间分布的均匀程度。能量分布得越均匀,熵就越 大。如果对于我们所考虑的那个系统来说,能量完全 均匀地分布,那么这个系统的熵就达到最大值。 简单的说,“熵”就是微观粒子的无序程度、能量 差别的消除程度。 在克劳修斯看来,在一个封闭的系统中,运动总是 从有序到无序发展的。
1.电冰箱能够不断地把热量从温度较低的冰箱内部 传给温度较高的外界空气,这说明了 BD A.热量能自发地从低温物体传给高温物体 B.在一定条件下,热量可以从低温物体传给高温物 体 C.热量的传导过程不具有方向性 D.在自发地条件下热量的传导过程具有方向性
[精与解] 我们知道,一切自发过程都有方向性,如热传导, 热量总是由高温物体传向低温物体;又如扩散,气体总是由密 度大的地方向密度小的地方扩散。如果在外界帮助下气体可以 由密度大的地方向密度小的地方扩散,热量可以从低温物体传 向高温物体,电冰箱就是借助外力做功把热量从低温物体─冷 冻食品传向高温物体─周围的大气。所以,在回答热力学过程 的方向问题时,要区分是自发过程还是非自发过程,电冰箱内 热量传递的过程是有外界参与的。本题答案是A错B对C错D对。
• 可爱的熵 • 物理学中有个熵定律,也就是著名的热力学第二定律。 熵的增加表示宇宙物质的日益混乱和无序,是无效能量 的总和。熵本身既不是好事,也不是坏事;它意味着腐 败和混乱,但它同时也意味着生命本身的展开──不论 是有机的,还是无机的生命。卡农、乔治〃梅特勒的大 爆炸学说也认为,宇宙是以有序的状态开始,不断地向 无序状态发展,它与热力学第二定律是相符的。热力学 第一定律说明能量是守恒的、不灭的,只能从一种形式 转变到另一种形式;热力学第二定律(熵定律)却表明: 能量不可逆转地沿着一个方向转化,即从对人类来说是 可利用的变为不可利用的状态。
第十章5热力学第二定律的微观解释

第十章 5 热力学第二定律的微观解释热力学定律是以宏观事实为基础的,它告诉我们热学现象、热学过程遵循什么规律。
但是,通过前面几章的学习我们已经知道,系统的宏观表现源于组成系统的微观粒子的统计规律。
本节就要从微观的角度说明为什么涉及热运动的宏观过程会有一定的方向性。
有序和无序宏观态和微观态生活中我们常说到有序和无序这两个词。
一副扑克牌,按黑桃、红桃、梅花、方块的顺序,而且从小到大排列,我们说它是有序的,洗牌之后有序变成了无序。
当然也可以规定奇数牌在先,偶数牌在后,等等。
只要确定了某种规则,符合这个规则的就是有序的。
由许多单张纸牌组成的系统,如果对个体的分布没有确定的要求,“怎样分布都可以”,我们就说这样的分布是无序的。
有序与无序是相对的。
一副扑克牌,指定按黑桃、红桃、梅花、方块的顺序排列,但对号码的大小不做要求,这样的排列对于完全杂乱的一副牌来说是有序的,但对于不仅有花样方面的要求,而且对号码顺序也有要求的排列来说,就是无序的了。
这就涉及有序程度的问题。
无序意味着各处者都一样、平均、没有差别;而有序则是相反。
这一点可以通过扑克牌的例子来仔细体会。
如果规定了扑克牌的花样顺序与号码顺序,借用统计物理学的术语来说,我们就是规定了一个“宏观态”。
这时可能的排列方式只有一种。
如果我们宽容一些,只规定花样的先后,号码的顺序可以任意,我们就是规定了另外一个“宏观态”。
由于在符合花样先后的情况下不同的号码还可以有不同的排列,我们说这样的“宏观态”对座了好几个“微观态”。
如果对花样先后和号码的顺序都不做规定,这也是一个“宏观态”,这个“宏观态”对应的“微观态”就更多了。
如果一个“宏观态”对应的“微观态”比较多,就说这个“宏观态”是比较无序的。
你能不能仿照对于扑克牌的讨论,通过学生在操场站队的事例,说明有序、无序、宏观态、微观态这几个概念?气体向真空的扩散我们以气体向真空的扩散为例,说明宏观自发过程的方向性。
一个箱子被挡板分为左、右两室,左室有气体,右室为真空。
10[1].5-10.6热力学第二定律的微观解释
![10[1].5-10.6热力学第二定律的微观解释](https://img.taocdn.com/s3/m/977a98047cd184254b35357d.png)
导学案:10.5-10.6热力学第二定律的微观解释能源和可持续发展目标导航1.了解有序和无序,宏观态和微观态的概念。
2.了解热力学第二定律的微观意义。
3.了解熵的概念,知道熵是反映系统无序程度的物理量。
4.知道随着条件的变化,熵是变化的。
诱思导学1.有序和无序有序:只要确定了某种规则,符合这个规则的就叫做有序。
无序:不符合某种确定规则的称为无序。
无序意味着各处都一样,平均、没有差别,有序则相反有序和无序是相对的。
2.宏观态和微观态宏观态:符合某种规定、规则的状态,叫做热力学系统的宏观态。
微观态:在宏观状态下,符合另外的规定、规则的状态叫做这个宏观态的微观态。
系统的宏观态所对应的微观态的多少表现为宏观态无序程度的大小。
如果一个“宏观态”对应的“微观态”比较多,就说这个“宏观态”是比较___________的,同时也决定了宏观过程的方向性——从有序到无序。
3.热力学第二定律的微观意义一切自然过程总是沿着分子热运动的____________________________的方向进行。
4.熵和系统内能一样都是一个状态函数,仅由系统的状态决定。
从分子运动论的观点来看,熵是分子热运动无序(混乱)程度的定量量度。
一个系统的熵是随着系统状态的变化而变化的。
在自然过程中,系统的熵是增加的。
在____________________________中,熵是增加的,叫做熵增加原理。
对于其它情况,系统的熵可能增加,也可能减小。
从微观的角度看,热力学第二定律是一个统计规律:一个孤立系统总是从熵小的状态向熵大的状态发展,而熵值较大代表着较为__________,所以自发的宏观过程总是向无序程度更大的方向发展。
典例探究例1 一个物体在粗糙的平面上滑动,最后停止。
系统的熵如何变化?基础训练1.一定质量的气体被压缩,从而放出热量,其熵怎样变化?2.保持体积不变,将一个系统冷却,熵怎样变化?3某地的平均风速为5m/s,已知空气密度是1.2kg/m3,有一风车,它的车叶转动时可形成半径为12m的圆面,如果这个风车能将此圆内10%的气流的动能转变为电能,则该风车带动的发电机功率是多大?4如图甲所示,用面积为S的活塞在气缸内封闭着一定质量的空气,活塞上放一砝码,活塞和砝码的总质量为m.现对气缸缓缓加热,使气缸内的空气温度从T1升高到T2,空气柱的高度增加了ΔL,已知加热时气体吸收的热量为Q,外界大气压强为p0.求:(1)此过程中被封闭气体的内能变化了多少?(2)气缸内温度为T1时,气柱的长度为多少?(3)请在图乙的V-T图上大致作出该过程的图象(包括在图线上标出过程的方向).5(07河北)如图所示,质量为m的活塞将一定质量的气体封闭在气缸内,活塞与气缸之间无摩擦,a态是气缸放在冰水混合物中气体达到的平衡状态,b态是气缸从容器中移出后,在室温(27℃)中达到的平衡状态,气体从a态变化到b态的过程中大气压强保持不变。
热力学第二定律的微观解释

熵和系统内能一样都是一个状态函数,仅由系统 的状态决定。从分子运动论的观点来看,熵是分子热运 动无序(混乱)程度的定量量度。
S=KlnΩ
K玻耳兹曼常量
一个系统的熵是随着系统状态的变化而变化的。在 自然过程中,系统的熵是增加的。 在绝热过程或孤立系统中,熵是增加的,叫做熵 增加原理。对于其它情况,系统的熵可能增加,也可 能减小。 从微观的角度看,热力学第二定律是一个统计规 律:一个孤立系统总是从熵小的状态向熵大的状态发展, 而熵值较大代表着较为无序,所以自发的宏观过程总是 向无序程度更大的方向发展。
热力学第二定律的微观解释
1.有序和无序 有序:只要确定了某种规则,符合这个规则的就叫做有序。 无序:不符合某种确定规则的称为无序。 无序意味着各处都一样,平均、没有差别,有序则相反。 有序和无序是相对的。 2.宏观态和微观态 宏观态:符合某种规定、规则的状态,叫做热力学系统的宏观态。 微观态:在宏观状态下,符合另外的规定、规则的状态叫做这个 宏观态的微观态。 系统的宏观态所对应的微观态的多少表现为宏观态无序程度的大 小。如果一个“宏观态”对应的“微观态”比较多,就说这个 “宏观态”是比较无序的,同时也决定了宏观过程的方向性—— 从有序到无序。
定义热力学几率:与同一宏观态相应的微观态数称为热 力学几率。记为 。 在上例中,均匀分布这种宏观态,相应的微观态最 多,热力学几率最大,实际观测到的可能性或几率最大。 对于1023个分子组成的宏观系统来说,均匀分布这 种宏观态的热力学几率与各种可能的宏观态的热力学 几率的总和相比,此比值几乎或实际上为100%。 所以,实际观测到的总是均匀分布这种宏观态。即 系统最后所达到的平衡态。
• 可爱的熵 • 物理学中有个熵定律,也就是著名的热力学第二定律。 熵的增加表示宇宙物质的日益混乱和无序,是无效能量 的总和。熵本身既不是好事,也不是坏事;它意味着腐 败和混乱,但它同时也意味着生命本身的展开 ──不论 是有机的,还是无机的生命。卡农、乔治·梅特勒的大 爆炸学说也认为,宇宙是以有序的状态开始,不断地向 无序状态发展,它与热力学第二定律是相符的。热力学 第一定律说明能量是守恒的、不灭的,只能从一种形式 转变到另一种形式;热力学第二定律(熵定律)却表明: 能量不可逆转地沿着一个方向转化,即从对人类来说是 可利用的变为不可利用的状态。
课时10.5 热力学第二定律的微观解释

无序排列,则无序度增大
C.在晶体熔化的过程中,熵将保持不变
D.在晶体熔化的过程中,熵将增加
26
知识记忆与理解
思维探究与创新
技能应用与拓展
总结评价与反思 第十章 第 28 页
课第时一1章0.5 返回目录
28
END
感谢观看 下节课再会
29
11
知识记忆与理解 思维探究与创新
技能应用与拓展
总结评价与反思
第十章
课第时一1章0.5
第 12 页
返回目录
4.如图所示,气体自由膨胀的不可逆性可以用概率来说明,a、b、c 三个分子在 A 、B 两
室的分配情况如下表:
则:(1)a 分子出现在 A 室的概率为
1 2
。
1
(2)a、b、c 三分子全部回到 A 室的概率为 8 。
解答: (1)一个宏观态对应的微观态比较多,说明对该宏观态要求得少,其分 布是比较无序的,故(1)正确。
(2)熵越大,系统对应的微观态就越多,因为熵是系统无序性的量度,故(2)错误。 (3)由熵增加原理可得:一个孤立系统的总熵不会减小,故(3)错误。 (4)根据熵增加原理,一个孤立系统总是从熵小的状态向熵大的状态发展,即 自发的宏观过程总是向无序性增大的方向发展,故(4)正确。
第十章
课第时一1章0.5
第 17 页
返回目录
1.已知一个系统的两个宏观态甲、乙,及对应微观态的个数分别为较少、较多,则下列 关于对两个宏观态的描述及过程自发的可能方向的说法中正确的是( A )。 A.甲比较有序,乙比较无序,甲→乙 B.甲比较无序,乙比较有序,甲→乙 C.甲比较有序,乙比较无序,乙→甲 D.甲比较无序,乙比较有序,乙→甲
10
10.5热力学第二定律的微观解释

6.倒一杯热水,然后加入适当的糖后,糖会全部溶于水中,但 一段时间后又观察到杯底部有糖结晶,关于这个过程下列叙述 正确的是( BD ) A.溶解过程是自发的,结晶过程也是自发的,因此热力学第 二定律是错误的 B.溶解过程是有序向无序转变的过程 C.结晶过程是有序向无序转变的过程 D.结晶过程不是自发的,因为有外界的影响
5.热力学第二定律的微观解释
1.有序和无序 有序:只要确定了某种规则,符合这个规则的就叫做有序。 无序:不符合某种确定规则的称为无序。 无序意味着各处都一样,平均、没有差别,有序则相反。 有序和无序是相对的。 2.宏观态和微观态 宏观态:符合某种规定、规则的状态,叫做热力学系统的宏观态。 微观态:在宏观状态下,符合另外的规定、规则的状态叫做这个 宏观态的微观态。 系统的宏观态所对应的微观态的多少表现为宏观态无序程度的 大小。如果一个“宏观态”对应的“微观态”比较多,就说这 个“宏观态”是比较无序的,同时也决定了宏观过程的方向 性——从有序到无序。
3.下面关于熵的说法错误的是 B A.熵是物体内分子运动无序程度的量度 B.在孤立系统中,一个自发的过程总是向熵减少的方向进行 C.热力学第二定律的微观实质是熵是增加的,因此热力学第 二定律又叫熵增加原理 D.熵值越大,代表系统分子运动越无序
[精与解] 热力学第二定律提示:一切自然过程总是沿着分子 热运动无序性增大的方向进行的。例如,功转变为热是机械能 或电能转变为内能的过程是大量分子的有序运动向无序运动转 化,气缸内燃气推动活塞做功燃气分子作有序运动,排出气缸 后作越来越无序的运动。 物理学中用熵来描述系统大量分子运动的无序性程度。热力 学第二定律用熵可表述为:在任何自然过程中,一个孤立系统 的总熵不会减小,也就是说,一个孤立系统的熵总是从熵小的 状态向熵大的状态发展。反映了一个孤立系统的自然过程会沿 着分子热运动的无序性增大的方向进行。
热力学第二定律的微观解释(The second law of thermodynamics)
2. 若长方体容 器内有4个分子,分子分布的宏观状态有几种? 器内有 个分子,分子分布的宏观状态有几种? 个分子 每种宏观状态对应的微观状态数目各是多少? 每种宏观状态对应的微观状态数目各是多少?每种宏观状态出 现的概率是多少? 现的概率是多少? 3. 若汽缸内有一摩尔分子,分子全部处于汽缸左端或右端的概 若汽缸内有一摩尔分子, 率是多少? 率是多少? 答案: 答案:
二、熵的微观意义: 熵的微观意义:
一样, 和热力学概率 一样,熵的微观意义是系统内分子热运动 的无序性的一种量度。 的无序性的一种量度。 熵值越大, 越无序。 系统某一状态的 熵值越大, 它所对应的宏观状态 越无序。
三、熵的性质: 熵的性质:
熵具有可加性。当一个系统由两个系统组成时, 熵具有可加性。当一个系统由两个系统组成时,该系统的 熵等于两个子系统的熵之和。 熵等于两个子系统的熵之和。
abc d
bcd a
容 4 器 内 4 个 分 子
3
1
abd c cda b bc ad bd ac cd ab c abd d acb abcd ab cd
2
2
ac
bd
6
ad bc
3 0
1 4
a bcd b acd
4 1
6
—宏观态对应的微观状态数目, 则 (n)和左侧分子数n的关系 宏观态对应的微观状态数目, 宏观态对应的微观状态数目 和左侧分子数 和左侧分子数N 容器中气体的 和左侧分子数 L的关系图
鞍山科技大学 姜丽娜
9
玻耳兹曼熵公式与熵( §4.5 玻耳兹曼熵公式与熵(Entropy)增加原理 ) 熵的定义: 一、熵的定义:
太大, 因微观状态数目 太大,1877年玻耳兹曼引入了另一个量 年玻耳兹曼引入了另一个量 来表示系统无序性的大小: 熵S来表示系统无序性的大小: 1900年,普朗克引入玻耳兹曼常量定义比例系数: 年 普朗克引入玻耳兹曼常量定义比例系数: 单位 J/K
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十章 热力学定律
第5节 热力学第二定律的微观解释
1.有序和无序 有序:只要确定了某种规则,符合这个规则的就叫做有序。 无序:不符合某种确定规则的称为无序。 无序意味着各处都一样,平均、没有差别,有序则相反。 有序和无序是相对的。 2.宏观态和微观态 宏观态:符合某种规定、规则的状态,叫做热力学系统的宏观态。 微观态:在宏观状态下,符合另外的规定、规则的状态叫做这个宏观态的微 观态。 系统的宏观态所对应的微观态的多少表现为宏观态无序程度的大小。如果 一个“宏观态”对应的“微观态”比较多,就说这个“宏观态”是比较无 序的,同时也决定了宏观过程的方向性——从有序到无序。
)
6.倒一杯热水,然后加入适当的糖后,糖会全部溶于水中,但一段时间后又 观察到杯底部有糖结晶,关于这个过程下列叙述正确的是( BD ) A.溶解过程是自发的,结晶过程也是自发的,因此热力学第二定律是错误 的 B.溶解过程是有序向无序转变的过程 C.结晶过程是有序向无序转变的过程 D.结晶过程不是自发的,因为有外界的影响 7.下列说法正确的是 ( ) AD A.如果大量分子的集合从A分布进入B分布的概率大于从B分布进入A分布, 则B分布更无序 B.如果大量分子的集合从A分布进入B分布的概率大于从B分布进入A分布, 则A分布更无序 C.大量分子的集合能自发地从A分布进入B分布,则该过程是可逆的 D.大量分子的集合能自发地从A分布进入B分布,则该过程是不可逆的
4.关于有序和无序下列说法正确的是( ABD ) A.有序和无序不是绝对的 B.一个“宏观态”可能对应着许多的“微观态” C.一个“宏观态”对应着唯一的“微观态” D.无序意味着各处一样、平均、没有差别
5.根据热力学第二定律判断,下列说法正确的是( CD A.内能可以自发的转变成机械能 B.扩散的过程完全可逆的 C.火力发电时,燃烧物质的内能不可以全部转化为电能 D.热量不可能自发的从低温物体传递到高温物体
11.下列说法正确的是( ABD ) A.与热现象有关的自发的宏观过程是有方向性的 B.与热现象有关的自发的宏观过程是熵增加的过程 C.气体扩散现象向着无序性增加的方向进行,是可逆过程 D.机械能转化为内能的过程是系统的熵增加的过程
3.热力学第二定律的统计意义
•热力学第二定律的微观意义
对于一个热力学系统,如果处于非平衡态,我们认为它处于有序的状 态,如果处于平衡态,我们认为它处于无序的状态。 在热力学中,序:区分度。 热力学第二定律的微观意义:一切自然过程总是沿着无序性增大的方向进行。
下面从统计观点探讨过程的不可逆性微观意义,并由此深入认识第二定 律的本质。
• 有效能量告罄时,是“热寂”──死寂的热平衡状态。 有效物质耗尽时,是一片“物质混乱”──整个宇宙的大混乱和大 混沌。 古罗马诗人贺拉斯说:“时间磨灭了世界的价值!”可谓一语道破 了熵定律的真谛。 物理学家们认为,熵定律是物质世界的最终定律,人类参与的每一 项物质活动都受到热力学第一、第二定律的严密制约;但是,他们 又认为熵定律只涉及物质世界,只控制时空的横向世界,人类的精 神世界并不受熵定律的专制统治! 所以,生命的现象是宇宙洪流中的一股逆流! 人类精神的无限发展,是不可抗拒的熵增大长河中的一条逆流之舟!
8.一个密闭的容器内有稀薄气体,在容器上开一个小口,外部的空气 就会流入容器,在气体流入过程中,容器内靠近开口处的空气密度暂 时变得比内部大,以下说法正确的是( ) BCD A.此时容器内气体处于一个不平衡状态,是一个最无序的状态 B.外界的影响破坏了容器内气体的平衡 C.上面事实说明热力学第二定律只适用于封闭系统 D.对一个开放系统并不一定是最无序的分布
统计物理基本假定—等几率原理:对于孤立系,各种微观态出现的可能性 (或几率)是相等的。
各种宏观态不是等几率的。那种宏观态包含的微观态数多,这种宏 观态出现的可能性就大。 定义热力学几率:与同一宏观态相应的微观态数称为热力学几率。记为Ω 。 在上例中,均匀分布这种宏观态,相应的微观态最多,热力学几率最大,实际 观测到的可能性或几率最大。 对于1023个分子组成的宏观系统来说,均匀分布这种宏观态的热力学几率 与各种可能的宏观态的热力学几率的总和相比,此比值几乎或实际上为100%。 所以,实际观测到的总是均匀分布这种宏观态。即系统最后所达到的 平衡态。
9.下列说法正确的是( BCD ) A.热力学第二定律只在一定前提条件下才能成立 B.热力学第二定律揭示了一切自然过程总是沿着分子热运动的无序性增 大的方向进行 C.能量耗散是从能量转化的角度反映出自然界中的宏观过程具有方向性 D.热力学第二定律揭示了有大量分子参与宏观过程的方向性 10.从微观角度看( ACD ) A.热力学第二定律是一个统计规律 B.一个孤立系统总是从熵大的状态向熵小的状态发展 C.一个宏观状态所对应的微观状态越多,越是无序,熵值越大 D.出现概率越大的宏观状态,熵值越大
•不可逆过程的统计性质(以气体自由膨胀为例)
一个被隔板分为A、B相等两部分的容器,装有4个涂以不同颜色分子。
开始时,4个分子都在A部,抽出隔板后分子将向B部扩散并在整个容器内 无规则运动。隔板被抽出后,4分子在容器中可能的分布情形如下图所示: 分布 (宏观态) 详细分布 (微观态)
A
B
1 4
6
4 1
•第二定律的统计表述(依然看前例)
左边一列的各种分布仅指出A、B两边各有几个分子,代表的是系统可能 的宏观态。中间各列是详细的分布,具体指明了这个或那个分子各处于A或B 哪一边,代表的是系统的任意一个微观态。 分布 详细分布 (宏观态) (微观态) 4个分子在容器中的分布对应5种宏观态。 一种宏观态对应若干种微观态。 不同的宏观态对应的微观态数不同。 均匀分布对应的微观态数最多。 全部退回A边仅对应一种微观态。 在一定的宏观条件下,各种可能的宏观态中哪一种 是实际所观测到的?
如布朗运动。
对整个宇宙不适用。
4.熵与熵增加原理 “熵”是什么?“熵”是德国物理学家克劳修斯在1850年创造的一个术 语,他用熵来表示任何一种能量在空间分布的均匀程度。能量分布得越均匀, 熵就越大。如果对于我们所考虑的那个系统来说,能量完全均匀地分布,那 么这个系统的熵就达到最大值。
简单的说,“熵”就是微观粒子的无序程度、能量差别的消除程度。
平衡态相应于一定宏观条件下Ω 最大的状态。
自然过程总是向着使系统 热力学几率增大的方向进 行。 注意:微观状态数最大的平 衡态状态是最混乱、最无序 的状态。 一切自然过程总是沿着无 序性增大的方向进行。
热力学第二定律的统计表述:孤立系 统内部所发生的过程总是从包含微观 态数少的宏观态向包含微观态数多的 宏观态过渡,从热力学几率小的状态 向热力学几率大的状态过渡。 4.热力学第二定律的适用范围 1)适用于宏观过程对微观过程不适用, 2)孤立系统有限范围。
从微观的角度看,热力学第二定律是一个统计规律:一个孤立系统总 是从熵小的状态向熵大的状态发展,而熵值较大代表着较为无序,所以自发 的宏观过程总是向无序程度更大的方向发展。
• 可爱的熵 • 物理学中有个熵定律,也就是著名的热力学第二定律。 熵的增加表示宇宙物质的日益混乱和无序,是无效能量的总和。熵本身既 不是好事,也不是坏事;它意味着腐败和混乱,但它同时也意味着生命本 身的展开──不论是有机的,还是无机的生命。卡农、乔治·梅特勒的大 爆炸学说也认为,宇宙是以有序的状态开始,不断地向无序状态发展,它 与热力学第二定律是相符的。热力学第一定律说明能量是守恒的、不灭的, 只能从一种形式转变到另一种形式;热力学第二定律(熵定律)却表明: 能量不可逆转地沿着一个方向转化,即从对人类来说是可利用的变为不可 利用的状态。
在克劳修斯看来,在一个封闭的系统中,运动总是从有序到无序发展的。
比如,把一块冰糖放入水中,结果整杯水都甜了。这就是说,糖分子的 运动扩展到了整杯水中,它们的运动变得更加无序了。对于一个封闭的系统, 能量差也总是倾向于消除的。比如,有水位差的两个水库,如果把它们连接 起来,那么,重力就会使一个水库的水面降低,而使另一个水库的水面升高, 直到两个水库的水面均等,势能取平为止。
1.电冰箱能够不断地把热量从温度较低的冰箱内部传给温度较高的外界空 气,这说明了 BD A.热量能自发地从低温物体传给高温物体 B.在一定条件下,热量可以从低温物体传给高温物体 C.热量的传导过程不具有方向性 D.在自发地条件下热量的传导过程具有方向性
[精与解] 我们知道,一切自发过程都有方向性,如热传导,热量总是 由高温物体传向低温物体;又如扩散,气体总是由密度大的地方向密度小 的地方扩散。如果在外界帮助下气体可以由密度大的地方向密度小的地方 扩散,热量可以从低温物体传向高温物体,电冰箱就是借助外力做功把热 量从低温物体─冷冻食品传向高温物体─周围的大气。所以,在回答热力 学过程的方向问题时,要区分是自发过程还是非自发过程,电冰箱内热量 传递的过程是有外界参与的。本题答案是A错B对C错D对。
克劳修斯总结说,自然界中的一个普遍规律是:运动总是从有序到无 序,能量的差异总是倾向变成均等,也即“熵将随着时间而增大”。
熵和系统内能一样都是一个状态函数,仅由系统的状态决定。从分 子运动论的观点来看,熵是分子热运动无序(混乱)程度的定量量度。 S=KlnΩ 一个系统的熵是随着系统状态的变化而变化的。在自然过程中,系统的 熵是增加的。 在绝热过程或孤立系统中,熵是增加的,叫做熵增加原理。对于其它 情况,系统的熵可能增加,也可能减小。
2.一个物体在粗糙的平面上滑动,最后停止。系统的熵如何变化?
解析:因为物体由于受到摩擦力而停止运动,其动能变为系统的内能,增 加了系统分子无规则运动的程度,使得无规则运动加强,也就是系统的无 序程度增加了,所以系统的熵增加。
3.下面关于熵的说法错误的是 B A.熵是物体内分子运动无序程度的量度 B.在孤立系统中,一个自发的过程总是向熵减少的方向进行 C.热力学第二定律的微观实质是熵是增加的,因此热力学第二定律又叫熵 增加原理 D.熵值越大,代表系统分子运动越无序 [精与解] 热力学第二定律提示:一切自然过程总是沿着分子热运动无序 性增大的方向进行的。例如,功转变为热是机械能或电能转变为内能的过 程是大量分子的有序运动向无序运动转化,气缸内燃气推动活塞做功燃气 分子作有序运动,排出气缸后作越来越无序的运动。 物理学中用熵来描述系统大量分子运动的无序性程度。热力学第二定 律用熵可表述为:在任何自然过程中,一个孤立系统的总熵不会减小,也 就是说,一个孤立系统的熵总是从熵小的状态向熵大的状态发展。反映了 一个孤立系统的自然过程会沿着分子热运动的无序性增大的方向进行。
