硅的知识点概述
有关硅的知识点总结

有关硅的知识点总结硅的物理性质硅是一种灰白色、具有金属光泽的固体。
其熔点为1414°C,沸点为3265°C,在常温下为半导体,具有高的电阻率。
硅具有良好的热导电性能,对许多化学物质具有良好的耐腐蚀性。
硅的化学性质硅是一种化学性质稳定的元素,不易与多种物质发生反应。
但在高温下,硅可以与氧、氮、氢等元素发生化学反应,生成硅氧化物、氮化硅、氢化硅等化合物。
这些化合物在工业生产中具有广泛的应用。
硅的应用1. 半导体材料硅是最重要的半导体材料之一,被广泛应用于电子器件制造中。
硅芯片是计算机、手机、电视等电子设备的关键组成部分,其微小的电路结构使得信息处理速度大大提高。
2. 太阳能电池硅材料是太阳能电池的主要材料之一,通过将硅材料掺杂成P型和N型半导体,制成硅太阳能电池板,能够将太阳能转化为电能,具有环保和可再生的特点。
3. 硅酮制品硅酮是一种广泛用于建筑材料、陶瓷制品和耐火材料的材料,因其耐高温、耐腐蚀的特性,在工业上有重要应用。
4. 硅橡胶硅橡胶是一种具有优异性能的橡胶制品,具有耐高温、耐老化、优异的电绝缘性能,被广泛用于制造密封件、电线电缆绝缘层等。
5. 医疗器械由于硅材料具有生物相容性,被广泛用于医疗器械制造,例如心脏起搏器、人工关节等。
6. 化妆品硅材料被广泛应用于化妆品中,起到吸油、增稠、保湿等作用,提高了化妆品的质感和保湿效果。
硅的生产硅的生产主要通过硅石焙烧法和金属硅熔炼法两种方法进行。
硅石焙烧法是利用石英石和碳粉在高温下反应生成二氧化碳和二氧化硅,再通过还原反应将二氧化硅还原为金属硅。
金属硅熔炼法是利用金属硅的氧化物与还原剂在高温下进行反应生成金属硅的方法。
这两种方法均需要高温高压条件,并产生大量的二氧化碳排放,造成对环境的污染。
未来发展随着科学技术的不断发展,对新型材料的需求也日益增加。
硅作为一种重要的半导体材料,其在电子器件、光伏发电、新能源领域的应用前景十分广阔。
硅知识点总结

硅知识点总结关键信息项1、硅的物理性质名称:____________________外观:____________________硬度:____________________熔点:____________________沸点:____________________导电性:____________________2、硅的化学性质与氧气反应:____________________与氯气反应:____________________与氢氟酸反应:____________________与强碱溶液反应:____________________ 3、硅的用途半导体材料:____________________太阳能电池:____________________计算机芯片:____________________4、硅的制备方法工业制备:____________________实验室制备:____________________11 硅的物理性质硅是一种具有灰色金属光泽的固体,具有硬而脆的特点。
其晶体结构属于金刚石型,原子之间以共价键相结合,形成空间网状结构。
硅的硬度较大,莫氏硬度约为 7。
硅的熔点较高,约为 1414℃,沸点约为 2355℃。
在常温下,硅的导电性较差,属于半导体材料,但在高温下其导电性会增强。
111 硅的外观硅通常呈现出银灰色的外观,具有一定的金属光泽。
112 硅的导电性硅的导电性介于导体和绝缘体之间,其导电性可以通过掺入杂质来进行调节。
例如,掺入少量的磷或硼等杂质可以显著改变硅的导电性,使其分别成为 N 型半导体和 P 型半导体。
12 硅的化学性质硅在常温下化学性质相对稳定,但在一定条件下可以与多种物质发生化学反应。
硅在加热或点燃的条件下可以与氧气发生反应,生成二氧化硅(SiO₂)。
反应方程式为:Si + O₂= SiO₂。
硅可以与氯气在加热条件下反应,生成四氯化硅(SiCl₄)。
第五讲 硅—无机非金属材料

知识点一.硅1.硅的化学性质。
在常温下,硅的化学性质不活泼,不与O 2、Cl 2、H 2SO 4、HNO 3等反应,但可与氟气、氢氟酸和强碱反应。
①硅和氟气反应:Si+2F 2==SiF 4。
②硅和氢氟酸反应:Si+4HF==SiF 4↑+2H 2↑。
③硅和氢氧化钠溶液反应:Si+2NaOH+H 2O==Na 2SiO 3+2H 2↑。
④硅在氧气中加热:Si+O 2SiO 2。
2. 硅的工业制法。
SiO 2+2C Si(粗硅)+2CO ↑(注意产物)提纯:Si+2Cl 2SiCl 4 ;SiCl 4+2H 2Si+4HCl ↑3.晶体硅的用途。
用来制造半导体器件,制成太阳能电池、芯片和耐酸设备等。
知识点二. 二氧化硅1.物理性质:硬度大、熔点高,难溶于水。
2.化学性质:①酸性氧化物的通性:SiO 2是酸性氧化物,是H 2SiO 3的酸酐,但不溶于水:△无机非金属材料的主角-硅SiO2+CaO CaSiO3SiO2+2NaOH=Na2SiO3+H2O (Na2SiO3是强的粘合剂)②弱氧化性:SiO2+2C Si+2CO↑③特性:SiO2+4HF=SiF4↑+2H2O要点解释:(A)由于玻璃的成分中含有SiO2,故实验室盛放碱液的试剂瓶用橡皮塞而不用玻璃塞。
(B)未进行磨砂处理的玻璃,在常温下是不易被强碱腐蚀的,故盛放碱液可以用玻璃瓶(不能用玻璃塞)。
(C)因为氢氟酸腐蚀玻璃,与玻璃中的SiO2反应,所以氢氟酸既不能用玻璃塞、也不能用玻璃瓶保存,而应保存在塑料瓶或铅皿中。
3.用途:①SiO2是制造光导纤维的主要原料。
②石英制作石英玻璃、石英电子表、石英钟等。
③水晶常用来制造电子工业的重要部件、光学仪器、工艺品等。
④石英砂常用作制玻璃和建筑材料。
4.SiO2与CO2化学性质的比较CO2+H2O H2CO3SiO2+CaO CaSiO3SiO2+2C Si+2CO↑知识点三.硅酸(H4SiO4、H2SiO3)△1.不稳定性:H2SiO3SiO2 +H2O2.极弱酸性:不能使酸碱指示剂变色:H2SiO3+2NaOH=Na2SiO3+2H2O制备:Na2SiO3+CO2+H2O=H4SiO4↓(白色胶状)+Na2CO3或Na2SiO3+2HCl==H2SiO3↓+2NaCl,H4SiO4=H2SiO3+H2O(不稳定、易分解)知识点四. 硅酸盐1.常用的硅酸盐是Na2SiO3,俗称“泡花碱”,易溶于水,其水溶液称为水玻璃,是一种矿物胶,密封保存。
高中硅知识点总结

高中硅知识点总结1. 硅的性质硅是一种非金属元素,化学性质和碳相似,常温下处于固态。
硅不溶于水,但可溶于浓盐酸和氢氟酸。
硅具有良好的导热性和导电性,因此被广泛应用于半导体行业。
2. 硅的存在形式硅是地壳中最丰富的元素之一,主要以二氧化硅(SiO2)的形式存在于矿物中。
硅也广泛存在于许多天然物质中,如玻璃、水晶、水泥等。
3. 硅的化合物硅主要形成了许多氧化物和硅酸盐。
常见的硅化合物包括二氧化硅、三氧化二硅、硅酸镁、硅酸铝等。
4. 硅的制备硅的制备主要通过还原二氧化硅来实现。
传统的方法是用碳还原法,即在高温下通过碳还原二氧化硅。
近年来,高纯度硅的制备也采用了其他先进的制备方法,如氢气还原法、熔融盐电解法等。
5. 硅的物理性质硅是典型的半导体材料,具有一些特殊的物理性质。
硅的晶体结构属于钻石型结构,具有稳定的晶格和特定的电子能带结构。
此外,硅对光的透射性和折射性也具有特殊的表现,广泛应用于光电子器件中。
6. 硅的化学性质硅在化学反应中表现出一定的反应性,但相对于其他金属元素来说,它的反应性较低。
硅能与氢气、氯气等发生置换和加成反应,产生氢化硅、氯化硅等化合物。
7. 硅的应用硅是现代技术中的重要材料之一,在电子、通讯、光电子、太阳能等领域都有广泛的应用。
硅材料主要应用于半导体器件、太阳能电池、集成电路板等高科技领域。
8. 硅的环境影响硅在环境中的排放和使用会对环境造成一定的影响。
硅的制备和应用过程中会产生高温排放和石棉尘等有害物质,对环境造成污染。
因此,在硅的生产和应用过程中,需要采取有效的环保措施,减少对环境的影响。
综上所述,硅是一种重要的非金属元素,具有广泛的应用价值和发展潜力。
随着技术的不断进步,硅材料在现代科技领域的应用将会越来越广泛,对经济和社会发展都将产生重要的影响。
同时,也需要持续关注硅材料在生产和应用过程中对环境和生态系统的影响,并采取有效的措施加以控制。
si元素知识点总结

si元素知识点总结一、硅元素的基本知识1.1 硅元素的发现硅元素最早被认识到并得到应用是在古代希腊化学家提亚哥尼当时。
在18世纪早期,瑞典化学家狄卡曼曾经从植物灰得到了明显有硅的白色物质,这被认为是硅的初次发现。
1808年,英国化学家戈比伦从硅酸盐中提取出了纯度较高的硅。
1831年,斯塔克将硅当作是一种新元素,起初被叫做硅素(silicium)。
后在1867年,进一步研究发现确凿无误地证明了硅是一种单质。
1.2 硅元素的结构硅元素的原子序数为14,原子量为28.09。
在元素周期表中位于第14族,第3周期。
硅元素的化学性质与其结构密切相关。
硅元素是有七个电子壳的元素,有4个价电子,硅在化学反应中得失电子以达到稳定的电子构型。
硅的原子结构为1s2 2s22p6 3s23p2,在固态中以硅原子中心为顶点的四面体结构成为共价化合物。
硅的晶体结构可以是钻石型或闪锌矿型。
1.3 硅元素的同位素硅元素有多种同位素,其中自然界存在的有3种同位素,分别是硅-28(92.23%)、硅-29(4.67%)、硅-30(3.10%)。
此外,人工合成了多种放射性同位素,可用于放射性示踪、医学诊断等领域。
二、硅元素的性质2.1 物理性质硅元素是一种具有金属和非金属性质的典型准金属元素。
在常温常压下呈现为灰白色固体,有金属光泽,质地脆硬。
硅元素的结构稳定性较高,熔点为1414°C,沸点为3265°C。
硅元素是热传导性能极好的材料,同时也是半导体材料。
2.2 化学性质硅元素的化学性质活泼,容易与氧、氮等元素发生反应。
硅元素在常温下不溶于多种酸、碱溶液中,但遇到浓硝酸和氢氟酸时会发生剧烈反应。
硅元素与氧发生化学反应时,形成二氧化硅(SiO2),通常被称为石英,也是硅元素广泛存在的一种化合物。
2.3 其他性质硅元素的结构稳定性较高,同时还具有良好的光学性能、导电性能。
此外,硅元素还具有辐射抗性、耐高温等优良性质。
高中化学硅的知识点

高中化学硅的知识点硅是一种重要的元素,化学符号为Si,位于元素周期表的第14位。
它是地壳中最常见的元素之一,约占地壳质量的27.7%。
硅在自然界中以氧化硅(SiO2)的形式存在,主要以石英、石英砂、硅灰石等矿物的形式存在。
以下是关于高中化学中硅的一些重要知识点:1.硅的性质:硅是一种灰色晶体,与大多数金属不发生化学反应,但在高温下可以与氧、氮、卤素等元素反应。
硅具有高的熔点(1414℃)和沸点(3265℃),是一种良好的导热材料和半导体。
2.硅的制备:硅的主要制备方法是通过冶炼石英矿或其他含硅矿石,通过高温还原的方法得到纯度较高的硅。
3.硅的重要化合物:硅在化合物中形成了许多重要的化合物,如二氧化硅(SiO2),也称为二氧化硅,是最常见的硅化合物。
它是一种无机非金属固体,具有很强的硬度和热稳定性。
另一个重要的硅化合物是硅酸盐,如硅酸钠(Na2SiO3)和硅酸铝(Al2(SiO3)3)等。
4.硅的应用:硅在工业上有广泛的应用。
硅通过加工和改性可以制成硅半导体材料,用于制造电子器件和计算机芯片等高科技领域。
硅也可以制成硅橡胶,用于制造密封件、电线绝缘等。
硅还可以作为合金添加剂,用于改善金属的硬度和耐腐蚀性。
此外,硅还用于生产玻璃、陶瓷、光纤等。
5.硅在生物体中的作用:硅在生物体中也起着重要的作用。
一些植物组织中富含硅,如稻谷的秆和叶片。
硅可以提高植物的机械强度,增加其抗病性和逆境适应能力。
此外,硅还被认为是一种人体所需的微量元素,对于维持骨骼、血管的健康以及预防骨质疏松症等方面有重要作用。
6.硅的环境影响:尽管硅是一种天然存在的元素,但大量的硅可以造成环境问题。
例如,硅在自然界中的含量很高,会导致土壤盐碱化,影响农作物的生长。
此外,硅的粉尘会对人体呼吸系统造成刺激,引发肺部疾病。
7.硅在化学反应中的应用:硅可以用作还原剂,与很多氧化物反应生成相应的金属。
例如,将二氧化硅与铝粉或铁粉加热可以得到相应的金属硅。
硅知识点总结

硅及其化合物_________ 年一月一日硅元素在地壳中的含量排第二,在自然界中没有游离态的硅,只有以化合态存在的硅,常见的是二氧化硅、硅酸盐等。
硅的原子结构示意图为,硅元素位于元素周期表第三周期第W A族,硅原子最外层有4个电子,既不易失去电子又不易得到电子,主要形成四价的化合物。
1、单质硅(Si):(1)物理性质:有金属光泽的灰黑色固体,熔点高,硬度大。
(2)化学性质:①常温下化学性质不活泼,只能跟 F2、HF和NaOH溶液反应。
Si + 2F2 = SiF4 Si + 4HF = SiF4 T+ 2H2 T Si + 2NaOH+ H20= Na2SiO3+ 2H2 T②在高温条件下,单质硅能与 02和CI2等非金属单质反应。
高温高温Si + 02 Si02 Si + 2CI2 SiCl4(3)用途:太阳能电池、计算机芯片以及半导体材料等。
(4)硅的制备:工业上,用 C在高温下还原Si02可制得粗硅。
Si02+ 2C= Si(粗)+2C0 T Si(粗)+ 2CI2= SiCl4 SiCl4 + 2H2= Si (纯)+ 4HCI2、二氧化硅(Si02):(1)Si02的空间结构:立体网状结构, Si02直接由原子构成,不存在单个 Si02分子。
(2)物理性质:熔点高,硬度大,不溶于水。
(3)化学性质:Si02常温下化学性质很不活泼,不与水、酸反应(氢氟酸除外) ,能与强碱溶液、氢氟酸反应,高温条件下可以与碱性氧化物反应:①与强碱反应:Si02 + 2Na0H= Na2Si03+ H20 (生成的硅酸钠具有粘性;所以不能用带磨口玻璃塞试剂瓶存放Na0H溶液和NazS03溶液,避免Na2Si03将瓶塞和试剂瓶粘住,打不开,应用橡皮塞)。
②与氢氟酸反应[Si02的特性]:SQ2 + 4HF= SiF4 T +2出0 (利用此反应,氢氟酸能雕刻玻璃;氢氟酸不能用玻璃试剂瓶存放,应用塑料瓶)。
高温③高温下与碱性氧化物反应:Si02+ CaQ^= CaSi03(4)用途:光导纤维、玛瑙饰物、石英坩埚、水晶镜片、石英钟、仪器轴承、玻璃和建筑材料等。
硅的知识点总结

硅的知识点总结硅的性质:硅是一种灰白色半金属,具有金属性和非金属性的特性。
它在高温下呈现金属性,能够导电、导热和反射光线。
但在常温下,硅呈现非金属性,是一种典型的非金属元素,具有高熔点和硬度。
硅的化合物:硅的化合物非常广泛,其中最重要的化合物就是二氧化硅(SiO2),又称为石英。
石英是地壳中非常常见的矿物,它在玻璃、陶瓷、水泥等制品中具有重要的应用。
此外,硅还可以形成硅酸盐矿物,如长石、云母等。
硅的用途:1. 半导体材料:硅是半导体材料中最重要的一种,它在电子、光电子等领域有广泛的应用。
硅晶体可以制成大规模集成电路、太阳能电池等器件,被广泛应用于电子产品和光伏产业。
2. 硅橡胶:硅橡胶是一种优质的弹性材料,具有耐高温、耐低温、耐腐蚀等特性,被广泛用于汽车、电子、医疗器械等领域。
3. 硅钢:硅钢是一种制造变压器、发电机等电工设备的重要材料,硅能够提高钢的磁导率,降低磁能损耗,因此被广泛用于电力行业。
4. 硅酸盐制品:硅的化合物在建筑、玻璃、陶瓷等行业有广泛应用,石英玻璃、瓷砖、陶瓷等制品都是硅的重要应用领域。
硅的加工:硅的加工主要包括两个领域,一是硅单晶的制备,二是硅化合物的制备和加工。
1. 硅单晶的制备:硅单晶是制造集成电路和太阳能电池的重要原材料,它主要靠克拉法无机熔融法和气相淀积法来制备。
在克拉法无机熔融法中,硅锭通过高温熔化后逐渐冷凝成单晶,最终可以切割成晶圆用于制造集成电路。
而气相淀积法是通过化学气相沉积技术制备薄膜太阳能电池的重要工艺。
2. 硅化合物的制备和加工:硅化合物的制备和加工通常是通过硅矿石提炼出纯净的硅,然后再通过氧化或还原等反应制备出所需的化合物,如二氧化硅、硅酸盐等。
硅化合物在高温条件下可以制备成各种硅陶瓷、硅橡胶、硅玻璃等制品。
硅的环境问题:由于硅的加工和利用过程中会产生大量工业废水和废气,因此对环境造成一定的影响。
特别是在硅单晶的生产过程中,会产生有害气体和固体废弃物,对周围环境和人体健康造成潜在危害。
硅知识点总结120919

硅知识点总结120919硅(Ge)是一种常见的半导体材料,它广泛应用于电子器件和集成电路中。
在学习硅的知识点时,我们需要了解硅的物理和化学性质、硅晶体的结构和生长方法、硅的掺杂和掺杂技术、硅的杂质和缺陷等。
下面我将为您总结一些关键的知识点。
1.硅的基本信息硅是地壳中含量最高的元素之一,化学符号为Ge,原子序数为32、它是一种灰白色的硬质金属,熔点为937.4℃,沸点为2830℃。
硅的密度为5.323克/立方厘米,具有良好的热导性和电导性。
2.硅的结构硅的结构类似于碳,它具有钻石型晶体结构。
硅原子通过共价键连接在一起,形成一个三维网格结构。
硅晶体可以分为两种结构:多晶硅和单晶硅。
多晶硅由许多晶粒组成,晶粒之间存在晶界;单晶硅由一个连续的晶体结构组成,没有晶界。
3.硅的生长方法硅晶体可以通过多种方法生长,包括Czochralski法、区域熔凝法、气相外延法等。
其中,Czochralski法是最常用的方法。
该方法通过在熔融硅中放入一个种子晶体,然后缓慢提拉并旋转晶体,使其逐渐生长为一个完整的单晶体。
4.硅的掺杂硅可以通过掺杂来调节其导电性能。
掺杂是指将少量杂质原子引入硅晶体中,以改变硅的电子能带结构。
通常使用磷(P)、硼(B)、砷(As)等元素进行掺杂。
磷掺杂的硅是N型硅,硼掺杂的硅是P型硅。
N型硅中的电子浓度高于空穴浓度,P型硅中的空穴浓度高于电子浓度。
5.硅的掺杂技术硅的掺杂技术主要有扩散法、离子注入法和外延法。
扩散法是将掺杂材料的薄层放在硅晶体表面,并在高温下使其扩散到晶体内部。
离子注入法是将掺杂材料的离子注入到硅晶体中,然后通过热退火来修复晶格损伤。
外延法是在硅晶体表面上沉积一层掺杂材料,使其在晶体生长过程中被夹在两个硅层之间。
6.硅的杂质和缺陷硅晶体中可能存在一些杂质和缺陷,它们会对硅的性能产生影响。
常见的杂质有氧气、碳、金属杂质等。
氧气和碳是硅晶体的主要杂质,会影响硅的电子迁移率和载流子浓度。
高一化学硅的相关知识点总结

高一化学硅的相关知识点总结硅是一种非金属元素,化学符号为Si,位于周期表的第14组。
它在地壳中广泛存在,是地壳中第二丰富的元素,仅次于氧气。
硅在日常生活和工业生产中具有广泛的应用,因此对硅的相关知识点进行总结很有必要。
1. 硅的性质硅的外层电子层结构为2-8-4,具有4个价电子,属于典型的非金属。
硅是一种固体,常温下为灰色晶体,呈金属光泽。
它具有热稳定性和化学稳定性,在大多数常见的酸和碱中不溶解。
2. 硅的同素异形体硅存在多种同素异形体,其中最常见的是晶态硅和非晶态硅。
晶态硅由于具有规则的晶格结构,具有良好的导电性,在电子器件制造中得到广泛应用;非晶态硅由于没有规则的晶格结构,导电性较差,常用于太阳能电池等领域。
3. 硅的化合物硅与氧结合形成了许多重要的化合物,其中最常见的是二氧化硅(化学式SiO2)。
二氧化硅是一种无机化合物,常见于矿物和土壤中。
它具有良好的绝缘性能和耐高温性,广泛用于玻璃制造、陶瓷制造和电子工业等领域。
4. 硅的应用硅具有许多重要的应用,以下是其中几个常见的应用领域:4.1 电子工业:硅是制造半导体器件的关键材料,例如晶体管和集成电路。
晶体管的发明对现代电子技术的发展产生了重大影响,而集成电路的发展使得电子设备越来越小型化和高效化。
4.2 太阳能电池:非晶态硅在太阳能电池中作为光吸收材料使用。
光照射到硅上时,硅中的电子被激发形成电流,从而将光能转化为电能。
4.3 玻璃制造:二氧化硅是玻璃的主要成分之一,它赋予玻璃良好的透明性和硬度。
不同的掺杂剂和添加剂可以使玻璃具有不同的功能和特性,如透光玻璃、耐高温玻璃等。
4.4 化妆品:硅在化妆品中被广泛使用,例如硅油(聚二甲基硅氧烷)。
硅油具有良好的润滑性和滑润感,可以改善产品的质感和延展性。
4.5 医疗器械:硅材料在医疗器械上有着广泛的应用,如人工关节、心脏起搏器等。
硅材料具有优良的生物相容性和耐腐蚀性能,对人体无毒副作用。
综上所述,硅作为一种重要的非金属元素,在现代工业和科学技术中具有广泛的应用。
关于硅的知识点总结

关于硅的知识点总结如下:
1. 物理性质:硅是半导体材料,具有灰黑色、硬脆的固体性质,且熔点较高,为2303K。
2. 化学性质:硅在常温下不与非氧化性酸反应,但能与氢氟酸反应生成四氟化硅气体。
此外,硅也能与强碱
溶液反应生成硅酸盐和氢气。
3. 用途:硅是现代信息技术的关键元素,被广泛应用于电子工业和半导体制造业等领域。
此外,硅还用于制
造陶瓷、玻璃、耐火材料等。
4. 制备方法:工业上通常采用碳在高温下还原二氧化硅的方法制取硅,即用焦炭还原石英砂或用氢气还原四
氯化硅来制备高纯度硅。
5. 硅酸盐:硅酸盐是由硅、氧和金属元素组成的化合物的总称,是地壳中含量最丰富的矿物之一。
常见的硅
酸盐包括长石、云母、黏土等。
6. 硅酸盐工业:硅酸盐工业是以含硅元素物质为原料通过高温加热制取技术制成陶瓷、玻璃、水泥等硅酸盐
产品的工业。
综上所述,硅作为一种重要的半导体材料,在电子工业、半导体制造业等领域具有广泛应用。
了解硅的性质、用途、制备方法和硅酸盐工业等方面的知识有助于更好地认识和应用硅材料。
高考化学硅知识点总结

高考化学硅知识点总结化学是高考科目之一,其中硅是重要的知识点之一、硅是地壳中含量最多的化学元素之一,其具有多种重要的化学性质和广泛的应用价值。
下面是关于硅的知识点总结。
1.硅的性质:(1)硅是一种非金属元素,原子序数为14,位于元素周期表的第3周期第14族,属于主族元素。
(2)硅的原子结构:硅原子有14个电子,电子排布为1s²2s²2p⁶3s²3p²,即外层电子排布为2s²2p⁶。
硅原子具有4个价电子,可形成4个共价键。
(3)硅是一种灰黄色固体,具有金属光泽,呈现半导体性质。
2.硅的化合物:(1)硅的氧化物:硅的氧化物有硅的氧化物(SiO₂)和二氧化硅(SiO₂)。
二氧化硅是自然界中普遍存在的矿物,常见的有石英、水晶等。
硅的氧化物是硅的最重要的化合物之一,具有重要的物理和化学性质。
(2)硅的氢化物:硅的氢化物有硅烷(SiH₄)、二硅烷(Si₂H₆)等。
硅烷是一种无色气体,是硅的最简单的有机化合物,常用于半导体材料制备和化学气相沉积中。
(3)硅的卤化物:硅的卤化物包括四氯化硅(SiCl₄)、三氯化硅(SiCl₃)、三溴化硅(SiBr₃)等。
四氯化硅是一种无色液体,常用于有机合成、涂料等工业上的应用。
(4)硅的硫化物:硅的硫化物包括硫化硅(SiS₂)等。
硫化硅是一种黄色固体,常用于化学实验室中的试剂。
3.硅的应用:(1)半导体材料:硅是最重要的半导体材料之一,用于制造集成电路、电子元件等。
硅片是半导体电子元器件的基础材料,是计算机、手机等现代电子产品的核心元件。
(2)玻璃制造:硅是制造玻璃的重要原料之一、二氧化硅可以与其他金属氧化物形成玻璃,常见的玻璃材料有石英玻璃、硼硅酸玻璃等。
(3)建筑材料:硅材料常用于建筑领域,如硅酸盐水泥、硅藻土等。
硅酸盐水泥是一种优质的建筑材料,具有强度高、耐久性好、硬化速度快等优点。
(4)化学试剂:硅化合物常用于化学实验室中的试剂,如硅烷、四氯化硅等。
硅元素及其化合物知识点总结

硅元素及其化合物知识点总结
一、什么是硅
硅(Silicon)是一种无色、无臭、有较高熔点的纯净固体,是最常见的金属元素之一、它有高导电性、热电性和冶金特性,是最重要的半导体材料,可用于微电子制造、电力装置、火灾报警器、航空航天制品等。
二、硅元素的结构
硅元素是由28个阳离子和14个阴离子组成的类铁结构,由四个Si 原子构成四个一组,其中两个硅原子存在正方形的相互结合,其余两个Si原子的配对紧密相互关联,被称为类铁结构。
硅元素内部的化学性能和外部的物理性能都会受到这类铁结构的影响。
三、硅元素的物理性质
1、硅元素的密度是2.33 g/cm3,比重是大约2.4
2、硅元素的沸点是2355℃,熔点是1414℃。
3、硅元素的导热系数是159W/(m·K),具有较高的导热性,可用于制作电子器件。
4、硅元素具有高韧性,其弹性模量是约73GPa,抗拉强度约是
211MPa,抗压强度约是8.2MPa。
5、硅元素的折射率在0.5~3.6微米之间,可用作反射镜。
6、硅元素的电导率是0.6×10-(Ω·m),可用作热电力元件。
四、硅元素的化学性质
1、硅元素是一种非金属元素,属于第四周期,在元素周期表中排在14位,原子序数为14,其电子配置与硅杂质的构成相同,即[Ne]3s23p2
2、硅元素是半金属元素。
化学硅的知识点

化学硅的知识点
1. 硅元素:硅是一种非金属元素,位于第14族,原子序数为14,化学符号为Si。
2. 硅的性质:硅是一种灰色的坚硬晶体,可以通过三种不同的形态(晶体硅,非晶硅和纳米晶硅)存在。
它是不可溶于水的,但可以溶解于大多数互不相容的溶剂中,如氢氟酸和密度大约为2.33 g/cm³的苛性钠。
3. 硅的用途:硅是一种广泛应用于电子和半导体领域的材料,其重要性体现在各种电子设备和计算机上。
硅在制造晶体管、半导体、太阳能电池板等方面应用广泛,它还用于制造玻璃、沙鼠、硅橡胶、硅油等。
4. 硅化合物:硅能形成许多不同的化合物,如SiO2,SiC,SiH4等。
SiO2也被称为二氧化硅,是地球上最常见的化合物之一。
SiC是一种具有高度耐腐蚀性和强度的陶瓷材料。
SiH4是一种高度易爆的气体,常用于制造半导体材料。
5. 硅的制备方法:硅可以通过多种方法制备,其中最常见的是从硅矿石中提取。
硅矿石通常是以SiO2的形式存在,通过熔融还原法或化学还原法可以得到纯硅。
在实验室中,还可以通过电化学方法或热分解的方法进行制备。
6. 硅烷:硅烷是最简单的硅化合物之一,其分子式为SiH4,属于非极性分子。
硅烷是一种高度易爆的气体,可以通过化学还原法制备。
它在半导体加工和纳米
技术等领域有广泛应用。
高中化学硅的知识点

高中化学硅的知识点
高中化学中,关于硅的主要知识点包括:
1. 硅的性质:硅是一个非金属元素,具有银白色,半金属性质。
它的原子序数为14,原子量为28.086。
硅的密度较低,熔点高,熔点为1414℃,沸点为3265℃。
硅具有
很好的化学稳定性,不与大多数酸和碱反应。
2. 硅的电子结构:硅的电子结构为1s2 2s2 2p6 3s2 3p2。
它具有4个价电子,即能形成4个共价键。
硅原子通过与其他硅原子形成共价键,形成硅晶体或硅化合物。
3. 硅的化合物:硅常见的化合物有硅氧化合物和硅碳化合物。
硅氧化合物包括二氧化
硅(SiO2)、硅酸(SiO4^4-)等,它们是玻璃、石英和许多岩石的主要成分。
硅碳化合物
如硅烷(SiH4)、二甲基硅烷((CH3)2SiH2)等,在化学和材料工业中有广泛的应用。
4. 硅的化学反应:硅可以与氧气反应生成二氧化硅。
例如,硅晶体在加热的条件下与
氧气反应可以生成二氧化硅。
硅还可以与卤素、硫等元素反应生成相应的化合物,如
氯化硅(SiCl4)、硫化硅(SiS2)等。
5. 硅的应用:硅是现代高科技产业的重要原材料,广泛应用于电子、光电子、半导体、太阳能等领域。
硅晶体是半导体材料的主要组成部分,是集成电路和太阳能电池的关
键原料。
这些是高中化学中关于硅的基本知识点,希望对你有帮助!。
硅知识点总结

硅知识点总结硅是一种重要的非金属元素,也是半导体材料的主要组成部分。
在现代科技发展中,硅的应用越来越广泛,涉及到电子、信息、能源等众多领域。
深入了解硅的性质和应用,对于我们更好地理解现代科技的发展具有重要的意义。
本文将对硅的知识点进行总结,以便读者更好地了解这个重要的元素。
一、硅的基本性质1.1物理性质硅的原子半径为0.118 nm,原子序数为14,相对原子质量为28.09,密度为2.33 g/cm3。
硅的晶体结构为面心立方晶系,共有三种常见结构:金刚石型结构、锗型结构和立方晶型结构。
硅的熔点为1415℃,沸点为2355℃,比熔对为-168℃,是一种典型的半导体材料。
硅的热导率、电导率、热膨胀系数和硬度都比较高,可以用于制造高温、高压的电子元件。
1.2化学性质硅在常温下不与大多数化学物质反应,但是会与强氧化剂如氧气、水等反应。
硅和氧气反应可以生成二氧化硅,化学式为SiO2。
二氧化硅是一种重要的无机化合物,在材料科学、环保和净水等领域都有广泛的应用。
二、硅的制备方法2.1物理制备硅的物理制备主要有两种方法:热分解和顶硼热还原法。
其中热分解法是将硅化物在高温下进行分解,生成纯度较高的硅;顶硼热还原法是将硅化铝和贫硅化物在高温下反应生成硅。
2.2化学制备化学制备硅的方法主要有两种:氢氧化钠法和三氯硅烷法。
其中氢氧化钠法是将高纯度的二氧化硅与氢氧化钠进行反应,生成硅酸钠,并经过还原反应得到硅质量;三氯硅烷法是将三氯硅烷和氢气在催化剂作用下反应生成硅,适用于大规模生产。
三、硅的应用领域3.1电子领域硅是电子工业中半导体材料的主要成分之一,广泛应用于半导体器件、集成电路、太阳能电池等领域。
其中硅晶体管是电子工业中的重要发明,可以放大电信号,是电子通信领域的核心元件。
3.2信息领域硅还广泛应用于计算机、手机等信息产品中,硅片是制造集成电路的重要材料。
除此之外,硅还可以用于制造LCD显示器等多种信息产品。
3.3能源领域硅在能源领域的应用主要是太阳能电池。
高三有关硅的化学知识点

高三有关硅的化学知识点硅是一种非金属元素,化学符号为Si,原子序数为14,属于周期表中的第14组。
硅是地壳中含量第二多的元素,仅次于氧气。
硅在自然界中以二氧化硅(SiO2)的形式广泛存在于沙、岩石和土壤中。
硅的性质:1. 物理性质:硅是一种灰色晶体,具有金属光泽。
硅的熔点高达1414℃,沸点达到3265℃,使其具有较高的熔融温度。
硅具有较低的电导率,属于半导体材料。
2. 化学性质:硅在常温下与氧气反应生成二氧化硅。
它对酸和碱的腐蚀性较小,但在浓碱和盐酸中会发生反应。
硅与磷、氧和卤素等元素反应形成相应的化合物。
硅的应用:1. 光伏产业:硅在光伏产业中被广泛应用,用于制造太阳能电池板。
硅作为一种半导体材料,能够将太阳光转化为电能。
2. 半导体产业:硅是半导体材料的主要成分,被广泛用于电子器件中,如集成电路、晶体管和二极管等。
硅的高熔点和化学稳定性使得它成为电子器件的重要基础材料。
3. 玻璃工业:硅是玻璃和陶瓷制品的主要原料之一。
二氧化硅可制成不同种类的玻璃,如平板玻璃、光纤和光学仪器等。
4. 化妆品和医药产业:硅在化妆品和医药领域表现出特殊的物理和化学性质。
硅可以用于制造化妆品中的防晒霜和美容产品,同时也被广泛应用于医药行业中的药物制剂。
硅的化合物:1. 二氧化硅(SiO2):也被称为石英,是硅最常见的化合物。
它具有高熔点、高硬度、抗化学腐蚀等特性,被广泛用于光学设备、玻璃工业和陶瓷制造等领域。
2. 氢氧化硅(Si(OH)4):是一种无机酸,可溶于水形成硅酸。
氢氧化硅在医药和化妆品行业中作为一种稳定剂使用。
3. 硅酸盐:硅酸盐是由硅酸和金属离子组成的化合物,包括硅酸镁、硅酸钙、硅酸铝等。
硅酸盐在土壤中起到了重要的结构和化学作用。
总结:硅是一种重要的非金属元素,具有广泛的应用价值。
它在光伏、半导体、玻璃工业、化妆品和医药领域发挥着重要作用。
认识硅的性质和化合物对于理解其在不同领域中的应用至关重要。
硅元素的知识点总结

硅元素的知识点总结硅元素的物理性质硅的外层电子排布为2, 8, 4,属于第4主族元素。
硅元素是一种具有金属性和非金属性的半金属元素,它在固态状态下是一种闪亮的灰白色晶体,熔点为1414℃,沸点为3265℃。
硅是一种较为脆弱的半导体材料,它的导电性能随温度的升高而增加,并且在25℃时,硅的电阻率约为3000Ω·cm。
硅元素的化学性质硅元素具有明显的非金属性,它与氧化物能形成硅酸盐,与非金属元素形成硅的硅化物(如硅化氢、硅化碳)等。
硅在常温下能与氧气和水反应,生成二氧化硅和水合硅酸。
此外,硅元素还具有较好的抗腐蚀性能,能够抵御大部分酸和碱的侵蚀。
硅元素在工业和生活中的应用硅元素是一种广泛应用的材料,它在各种工业和科技领域中都具有重要的作用。
硅元素主要应用于以下几个方面:1. 半导体材料:硅元素是现代电子工业中最重要的材料之一,它被广泛应用于电子元件、光伏电池、集成电路等领域。
2. 材料增强剂:硅元素是一种重要的合金添加剂,能够改善其他金属的力学性能和耐腐蚀性能,同时还能提高合金的热稳定性和机械性能。
3. 硅橡胶:硅元素是橡胶产品中的一种关键添加剂,硅橡胶具有优异的耐高温性能和化学稳定性,被广泛应用于各种高温、耐磨的工业领域。
4. 制备玻璃:硅元素是玻璃制造工业中必不可少的原料,硅元素能够使玻璃具有硬度高、抗冲击性能好、耐高温、耐酸碱等优点。
5. 医疗保健:硅元素被广泛应用于制备医疗保健产品,如医用玻璃器皿、医用硅橡胶制品和生物材料等。
硅元素的环境影响及防护措施硅元素在工业生产过程中会产生硅尘、二氧化硅等有害物质,对环境和人体健康造成危害。
因此,需要采取相关的防护措施来减少硅元素对环境和人体的影响。
1. 在生产过程中应采取有效的通风设备和防护设施,避免硅尘对工人的侵害。
2. 对硅元素的使用和处理应按照相关法规和标准进行,做好废弃物的收集、处理和处置工作。
3. 在生产过程中应加强对二氧化硅的监测,确保工作场所的空气质量符合相关标准。
硅的知识点概述
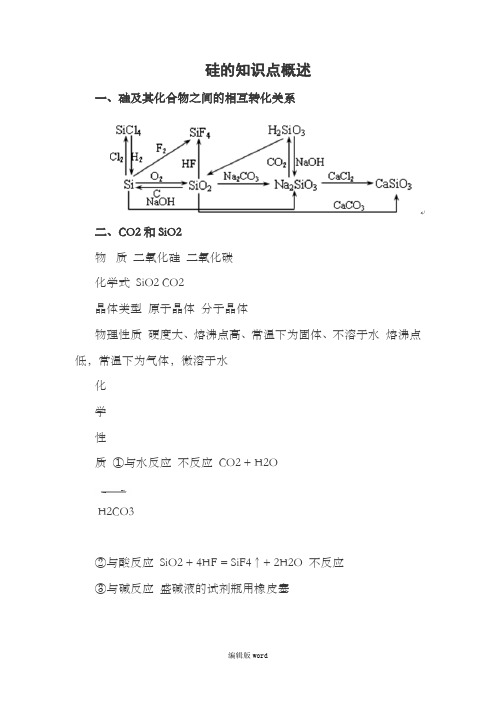
硅的知识点概述一、硅及其化合物之间的相互转化关系二、CO2和SiO2物质二氧化硅二氧化碳化学式SiO2 CO2晶体类型原子晶体分子晶体物理性质硬度大、熔沸点高、常温下为固体、不溶于水熔沸点低,常温下为气体,微溶于水化学性质①与水反应不反应CO2 + H2OH2CO3②与酸反应SiO2 + 4HF = SiF4↑+ 2H2O 不反应③与碱反应盛碱液的试剂瓶用橡皮塞SiO2 + 2NaOH = Na2SiO3 + H2O(反应条件:高温) CO2(少量)+ 2NaOH = Na2CO3 + H2OCO2(过量)+ NaOH = 2NaHCO3④与盐反应SiO2 + Na2CO3 =Na2SiO3 + CO2↑(反应条件:高温)SiO2 + CaCO3 = CaSiO3 + CO2↑(反应条件:高温) Ca(ClO)2 + CO2 + H2O = CaCO3↓ + 2HClOCO2 + Na2CO3 + H2O = 2NaHCO3⑤与碱性氧化物反应SiO2 + CaO = CaSiO3(反应条件:高温) CO2 + Na2O = Na2CO3三、硅、硅酸及硅酸盐:1.硅:单质硅有晶体硅和无定形硅两种。
晶体硅为原子晶体,灰黑色、有金属光泽、硬度大而脆、熔沸点高。
导电性介于导体和绝缘体之间,是常用的半导体材料。
化学性质:①常温Si + 2F2 = SiF4 ;Si + 4HF = SiF4 + 2H2 ;Si + 2NaOH + H2O = Na2SiO3 + 2H2↑的硅,工业上用焦炭在电炉中还原二氧化硅制取粗硅:SiO2 + 2C = Si + 2CO↑2.硅酸(H2SiO3或原硅酸H4SiO4):难溶于水的弱酸,酸性比碳酸还弱。
3.硅酸钠:溶于水,其水溶液俗称“水玻璃”,是一种矿物胶。
盛水玻璃的试剂瓶要使用橡胶塞。
能与酸性较强的酸反应:Na2SiO3 + 2HCl = H2SiO3↓(白)+ 2NaCl;Na2SiO3 + CO2 + H2O =H2SiO3↓+ Na2CO3四、水泥、玻璃和陶瓷等硅酸盐产品的主要化学成分、生产原料及其用途硅酸盐材料是传统的无机非金属材料:玻璃、水泥、各种陶瓷等都是以黏土、石英和长石等为原料生产的硅酸盐制品,比较如下(表18—6)硅酸盐产品水泥玻璃原料石灰石、黏土纯碱、石灰石、石英反应原理发生复杂的物理化学变化(不作要求)SiO2 + Na2CO3Na2SiO3 + CO2↑SiO2 + CaCO3CaSiO3 + CO2↑主要设备水泥回转窑玻璃窑主要成分3CaO·SiO2、2CaO·SiO2、3CaO·Al2O3 Na2SiO3、CaSiO3、SiO2反应条件高温高温陶瓷生产的一般过程:混合→成型→干燥→烧结→冷却→陶瓷,随着现代科学技术的发展,一些具有特殊结构、特殊功能的新型无机非金属材料如高温结构陶瓷、生物陶瓷、压电陶瓷等相继被生产出来。
硅知识点总结框架

硅知识点总结框架一、硅的含量与存在1. 硅的含量:地壳中硅的含量居第二位(质量分数为26.3%),仅次于氧。
2. 存在形态:硅的化合物几乎全部是二氧化硅和硅酸盐,广泛存在于地壳的各种矿物和岩石中。
二、硅单质1. 分类:硅单质主要有晶体和无定形两大类。
2. 物理性质:带有金属光泽的灰黑色固体,熔点高,硬度大,有脆性。
晶体硅的结构与金刚石相似。
3. 化学性质:* 常温下不活泼,一般不与其他物质反应,但可以与氟、氢氟酸、碱反应。
* 在加热或点燃的条件下可以与氢气、氧气、氯气等反应。
4. 主要应用:半导体材料(如硅芯片)、硅太阳能电池。
5. 高纯硅的制备:涉及的主要化学反应为二氧化硅与碳在高温下的反应。
三、二氧化硅1. 存在:自然界中,碳元素既有游离态,又有化合态,而硅元素仅有化合态,主要以氧化物和硅酸盐的形式存在。
天然SiO2有晶体和无定形两种,统称硅石。
2. 物理性质:熔点高,硬度大,难溶于水。
3. 结构:SiO2晶体有多种晶型,其基本结构单元为硅氧四面体,通过氧原子相互连接为空间的网状结构。
每个硅原子与4个氧原子相连,而每个氧原子与2个硅原子相连,故SiO2晶体中Si和O的比例为1∶2。
4. 化学性质:* SiO2为酸性氧化物,是硅酸的酸酐。
* 可以与碱反应生成硅酸盐。
* 在高温条件下可以与碳酸盐、碱性氧化物反应。
* 常温下与氢氟酸反应。
5. 主要应用:光导纤维。
四、硅酸、硅酸盐1. 硅酸(H2SiO3)。
2. 硅酸盐:由硅、氧和金属元素组成的化合物,是构成地壳岩石的重要成分。
硅酸盐组成的表示方法通常用二氧化硅和金属氧化物的组合形式表示。
如硅酸钠(Na2SiO3)可表示为Na2O·SiO2。
用途:黏合剂(矿物胶),耐火阻燃材料。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
硅的知识点概述
一、硅及其化合物之间的相互转化关系
二、CO2和SiO2
物质二氧化硅二氧化碳
化学式 SiO2 CO2
晶体类型原子晶体分子晶体
物理性质硬度大、熔沸点高、常温下为固体、不溶于水熔沸点低,常温下为气体,微溶于水
化
学
性
质①与水反应不反应 CO2+ H2O
H2CO3
②与酸反应 SiO2+ 4HF = SiF4↑+2H2O 不反应
③与碱反应盛碱液的试剂瓶用橡皮塞
SiO2+ 2NaOH = Na2SiO3+H2O(反应条件:高温) CO2(少量)+ 2NaOH= Na2CO3 + H2O
CO2(过量)+NaOH = 2NaHCO3
④与盐反应 SiO2 + Na2CO3 =Na2SiO3+ CO2↑(反应条件:高温)
SiO2+ CaCO3 = CaSiO3 +CO2↑(反应条件:高温) Ca(ClO)2+ CO2+ H2O=CaCO3↓ + 2HClO CO2 + Na2CO3 + H2O = 2NaHCO3
⑤与碱性氧化物反应 SiO2 + CaO = CaSiO3
(反应条件:高温) CO2 + Na2O =Na2CO3
三、硅、硅酸及硅酸盐:
1.硅:单质硅有晶体硅和无定形硅两种。
晶体硅为原子晶体,灰黑色、有金属光泽、硬度大而脆、熔沸点高。
导电性介于导体和绝缘体之间,是常用的半导体材料。
化学性质:
①常温Si + 2F2= SiF4 ;
Si + 4HF= SiF4 +2H2 ;
Si + 2NaOH + H2O = Na2SiO3 + 2H2↑
的硅,工业上用焦炭在电炉中还原二氧化硅制取粗硅:SiO 2+ 2C = Si + 2CO↑
2.硅酸(H2SiO3或原硅酸H4SiO4):难溶于水的弱酸,酸性比碳酸还弱。
3.硅酸钠:溶于水,其水溶液俗称“水玻璃”,是一种矿物胶。
盛水玻璃的试剂瓶要使用橡胶塞。
能与酸性较强的酸反应:Na2SiO3 +2HCl = H2SiO3↓(白)+ 2NaCl;Na2SiO3+ CO2 + H2O =H2SiO3↓+ Na2CO3
四、水泥、玻璃和陶瓷等硅酸盐产品的主要化学成分、生产原料及其用途
硅酸盐材料是传统的无机非金属材料:玻璃、水泥、各种陶瓷等都是以黏土、石英和长石等为原料生产的硅酸盐制品,比较如下(表18—6)
硅酸盐产品水泥玻璃
原料石灰石、黏土
纯碱、石灰石、石英
反应原理发生复杂的物理化学变化(不作要求)
SiO2 +Na2CO3
Na2SiO3+ CO2↑
SiO2 + CaCO3
CaSiO3 + CO2↑
主要设备水泥回转窑玻璃窑
主要成分 3CaO·SiO2、2CaO·SiO2、3CaO·Al2O3 Na2SiO3、CaSiO3、SiO2
反应条件高温高温
陶瓷生产的一般过程:混合→成型→干燥→烧结→冷却→陶瓷,随着现代科学技术的发展,一些具有特殊结构、特殊功能的新型无机非金属材料如高温结构陶瓷、生物陶瓷、压电陶瓷等相继被生产出来。
常见考点考法
1.可以用来制取半导体材料(如大规模集成电路)的是( )
A.二氧化硅B.粗硅C.高纯硅 D.硅酸盐
2.构成地壳基本骨架的非金属元素的是()
A.Al
B.O C. Si
D.C
3.下列物质中主要成分不是二氧化硅的是 ( )
A.硅胶B.水晶 C.玛瑙 D.硅石
4.NaOH、KOH等碱性溶液可以贮存在下列哪种试剂瓶中( )
A.具有玻璃塞的细口瓶
B.具有玻璃塞的广口瓶
C.带滴管的滴瓶 D.具有橡胶塞的细口瓶
5.二氧化硅的化学性质很不活泼,几乎所有的酸都不与其反应,但有一种酸能够和二氧化硅发生反应,这种酸是( ) A.浓盐酸 B.硫酸 C.硝酸 D.氢氟酸
6.二氧化硅属于酸性氧化物,理由是 ( )
A.Si是非金属元素
B.SiO2对应的水化物是可溶性弱酸
C.SiO2与强碱反应生成盐和水D.SiO2不能与酸反应
7.下列物质中,能够与NaOH溶液反应的是( )
A.碳酸钠B.硅酸钠C.二氧化硅D.氢氧化铝
8.下列不是水玻璃用途的是()
A.肥皂填料 B.木材防火剂
C.纸板黏胶剂
D.建筑装饰材料
9.下列不属于传统硅酸盐产品的是( )
A.玻璃B.水泥 C.光导纤维D.陶瓷
10.能证明硅酸的酸性弱于碳酸酸性的实验事实是( )
A.CO2溶于水形成碳酸,SiO2难溶于水
B.CO2通入可溶性硅酸盐中析出硅酸沉淀
C.高温下SiO2与碳酸盐反应生成CO2
D.氯化氢通入可溶性碳酸盐溶液中放出气体,通入可溶性硅酸盐溶液中生成沉淀
11.下列物质的变化,不能通过一步化学反应完成的是( )
A.CO2→H2CO3
B.SiO2→Na2SiO3
C.Na2O2→Na2CO3
D.SiO2→H2SiO3
12.下列离子方程式,正确的是( )
A.澄清石灰水中通入过量二氧化碳:Ca2++2OH- +CO2 ===CaCO3↓+H2O
B.碳酸钠溶液中加入二氧化硅:CO32- +SiO2==SiO32- +CO2↑
C.二氧化硅与烧碱溶液反应:SiO2 +2OH- ===SiO32-+H2O↑
D.硅酸与烧碱溶液中和:H2SiO 3 +2OH- ===SiO32-+2H2O
13.在SiO2+3C
SiC+2CO↑反应中,氧化剂和还原剂的质量比为( )
A.36∶30
B.60∶36
C.2∶
1 D.1∶2
14.下面关于硅的叙述中,正确的是()
A.硅的非金属性比碳强,只有在高温下才能跟氢气起化合反应
B.硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位
C.硅的化学性质不活泼,在自然界中可以以游离态存在
D.硅在电子工业中,是重要的半导体材料
15.钢筋混凝土强度大,常常用来建造高楼大厦、桥梁涵洞、高速公路等,在现代社会中发挥着举足轻重的作用,下面是钢筋混凝土的主要成分的是 ( )
A.水泥、沙子和钢筋B.水泥、沙子、碎石和钢筋
C.水泥、碎石和钢筋D.水泥、沙子和碎石
16.某无色溶液中加入过量盐酸有沉淀产生,过滤后向滤液中加入过量氨水又有沉淀产生,下列溶液中符合此条件的是 ( )
A. Ag+、Al3+、K+ B. SiO32-、AlO2-、K+
C. Ag+、Cu2+、Na+
D. Ag+、Ba2+、 Na+
17.下列说法正确的是()
A.SiO2溶于水显酸性
B.CO2通入水玻璃可得硅酸
C.SiO2是酸性氧化物,它不溶于任何酸
D.SiO2晶体中不存在单个SiO2分子
18.10g含有杂质的CaCO3和足量的盐酸反应,产生CO20.1mol,则此样品中可能含有的杂质是( )
A.KHCO3和MgCO3 B.MgCO3和SiO2
C.K2CO3和SiO2 D.无法确定
19.下列关于二氧化硅的说法中,错误的是()
A.二氧化硅也叫硅酐
B.二氧化硅分子由一个硅原子和两个氧原子构成
C.不能用二氧化硅跟水直接作用制取硅酸
D.二氧化硅既能与氢氟酸反应,又能与烧碱反应,所以它是两性氧化物
参考答案
1 2 3 4 5 6 7 8 9 10
C C A
D D C CD D C B
11 12 13 14 15 16 17 18 19
D C D D B AB BD B BD。
