polyjet转染技术讲解
转染步骤及经验(精华)

转染步骤及经验(精华)一、基础理论转染是将外源性基因导入细胞内的一种专门技术。
分类:物理介导方法:电穿孔法、显微注射和基因枪;化学介导方法:如经典的磷酸钙共沉淀法、脂质体转染方法、和多种阳离子物质介导的技术;生物介导方法:有较为原始的原生质体转染,和现在比较多见的各种病毒介导的转染技术。
理想细胞转染方法,应该具有转染效率高、细胞毒性小等优点。
病毒介导的转染技术,是目前转染效率最高的方法,同时具有细胞毒性很低的优势。
但是,病毒转染方法的准备程序复杂,常常对细胞类型有很强的选择性,在一般实验室中很难普及。
其它物理和化学介导的转染方法,则各有其特点。
需要指出的一点,无论采用哪种转染技术,要获得最优的转染结果,可能都需要对转染条件进行优化。
影响转染效率的因素很多,从细胞类型、细胞培养条件和细胞生长状态到转染方法的操作细节(见后文)。
二、转染操作流程(以常用的6孔板为例)(1) 细胞培养:取6孔培养板,以3x104/cm2密度铺板,37℃5%CO2培养箱中培养至70%~90%汇合。
(不同细胞略有不同,根据实验室优化的条件进行,汇合过分,转染后不利筛选细胞)。
(2) 转染液制备:在EP管中制备以下两液(为转染每一个孔细胞所用的量)A液:用不含血清培养基稀释1-10μg DNA,终量100μL,B液:用不含血清培养基稀释对应量的转染试剂,终量100μL;轻轻混合A、B液(1:1混匀),室温中置15分钟,稍后会出现微浊现象,但并不妨碍转染。
(3) 转染准备:用2mL不含血清培养液漂洗两次,再加入2mL不含血清及PS的培养液。
(4) 转染:把A/B复合物缓缓加入培养液中(缓慢滴加),轻轻摇匀,37℃温箱置6~8小时,吸除无血清转染液,换入正常培养液继续培养。
三、转染注意事项1. 血清A. DNA-阳离子脂质体复合物形成时不能含血清,因为血清会影响复合物的形成。
B.一般细胞对无血清培养可以耐受几个小时没问题,转染用的培养液可以含血清也可以不加,但血清一度曾被认为会降低转染效率,转染培养基中加入血清需要对条件进行优化。
Lipofectamine-2000转染说明

Lipofectamine TM 2000CAT. NO. 11668-027 Size: 0.75mlCAT. NO. 11668-019 Size: 1.5 ml4℃储存(不要冻存)说明:Lipofectamin TM 2000是核酸(DNA或RNA)转染真核细胞的一个专用的试剂盒,其有如下优点:●对各种细胞及细胞板(如96孔板)都有高的转染效率,在的细胞系数据库中有各种细胞转染成功的实例。
●在含有或是不含有血清的培养基中,DNA- Lipofectamin TM 2000复合物能够直接加给细胞。
●在转染之后不需要除去复合物以及添加或是更换培养液,但在培养4-6小时后需要除去复合物。
关于转染的一些重要建议:1.不要用即将要介绍的转染程序进行RNAi的转染实验。
在上有转染步骤,登陆后点击说明。
2.对于大多数细胞系,转染复合物中DNA(μg)与Lipofectamine TM2000(μl)的比例在1:2到1:3之间,最好达到最优化的比例。
注意:在混合之前,我们建议用Opti-MEM I 低血清培养基(Cat: NO.31985-062)(reduced serum medium)稀释Lipofectamine TM 2000和DNA.3.为了实现高的转染效率、高的目的基因表达水平以及低水平细胞毒效应,受体细胞最好达到高的浓度:在转染时,细胞的培养液的混浊度建议为90%-95%并最优化混浊度。
此外,在实验过程中保证相同的接种条件。
4.为避免细胞死亡,在培养基中不要加抗生素。
5.由于一些无血清复合物(如CD239、SFM II、VP-SFM)会抑制阳离子脂质体介导的转染,因此有必要检测一下无血清培养基和Lipofectamine TM 2000的相容性。
转染步骤(用于DNA):按照如下步骤在24孔板中转染哺乳动物细胞。
对于其它种类细胞板请参照转染量度标准。
步骤中均按照一个细胞孔的量给出质量和体积。
(完整版)LIPOFECTAMINE 2000转染试剂转染步骤

LIPOFECTAMINE 2000转染试剂转染步骤24孔板贴壁细胞的瞬时或稳定转染实验步骤:(在生长培养基中直接加入复合物)1。
转染前一天,胰酶消化细胞并计数,将细胞转至24孔板,控制密度使其在转染日密度接近90%.细胞铺板在0。
5ml含血清,不含抗生素的正常生长的培养基中。
2.对于每孔细胞,使用50μl OPTI—MEMⅠ培养基稀释1μl-3μl LIPOFECTAMINE 2000试剂。
温柔混匀LIPOFECTAMINE 2000,室温温浴5分钟(在5-25分钟内同稀释的DNA混合.保温时间过长会降低活性。
可以批量制备。
)注意:即使LIPOFECTAMINE 2000使用OPTI—MEMⅠ稀释,细胞也可以使用D-MEM培养. 3。
对于每孔细胞,使用50μl无血清培养基(如OPTI—MEMⅠ培养基)稀释0。
8μg-1.0μg DNA。
多孔操作可以批量制备。
4。
混合稀释的DNA(由第3步)和稀释的LIPOFECTAMINE 2000(由第2步).在室温保温20分钟。
注意:溶液可能会混浊,但不会影响转染。
复合物可以在室温保持6小时稳定.5。
直接将复合物(100μl)加入到每孔中,前后(或左右)摇动培养板,轻轻混匀.注意:如果在无血清条件下转染,使用含血清的正常生长培养基进行细胞铺板。
在加入复合物前移去生长培养基,替换为0.2ml无血清培养基。
6.在37℃,5%的CO2中保温18—48小时,无须去掉复合物或更换培养基或者在4—5小时后更换生长培养基也不会降低转染活性。
7.在细胞中加入复合物18—72小时后,分析细胞抽提物或进行原位细胞染色,检测报告基因活性。
这依赖于细胞类型和启动子活性.对稳定表达,在开始转染一天后将细胞传代至新鲜培养基中(1:10),两天后加入筛选抗生素。
进行稳定表达需要数天或数周.。
多聚乙烯亚胺介导基因转染的体外研究试验

多聚乙烯亚胺介导基因转染的体外研究试验赵梦丹1,杨峰亮1,陈坚2,虞和永1*(1. 浙江大学医学院附属妇产科医院,浙江杭州 310006;2. 浙江医药高等专科学校,浙江宁波 315100)摘要:目的考察并确定多聚乙烯亚胺(PEI)最佳的体外细胞转染条件,评价PEI作为基因转染试剂的可行性。
方法以MTT法检测不同分子量PEI的细胞毒性。
以PEI为载体,在不同的N/P 比值的条件下,将绿色荧光蛋白基因导入人Ⅱ型肺上皮A549细胞,以荧光显微镜及荧光分光光计系统检测其转染效率。
结果分子量为25Kda的PEI,当N/P比值为7.5时,其转染效率最高。
结论PEI是一种价格低廉、低毒性、高效率的基因转染载体,可应用于体内外基因治疗。
关键词:基因递送;多聚乙烯亚胺;基因转染;pEGFP-C3;人Ⅱ型肺上皮A549细胞Polyethylenimine as a Nonviral Vector for Gene TransferZHAO Meng-Dan1,YANG Feng-Liang1,CHEN Jian2,YU He-Yong1*(1.Women's Hospital School Of Medicine Zhejiang University,Hangzhou 310006;2.Zhejiang Pharmaceutical College,Ningbo 315100 )Abstract:Objective To investigate the best condition of polyethylenimine(PEI)for gene transfer to A549 cells.Methods Evaluate the cytotoxicity of PEI by Mononuclear cell direc cytotoxicity assay(MTT).In different conditions,using PEI as the vector,A549 cells were transfected with fluorescent protein(pEGFP-C1)gene and 1ueiferase gene.Expression efficiency of the transduced gene was monitored by fluorescence miceoscopy and fluorescence assay system.Results PEI had low cytotoxicity.when N/P ratio equaled to 7.5,the transfection efficiency of PEI was highest.Conclusion PEI is an inexpensive,low cytotoxicity and high efficiency vector.It can be widely used in the area of gene therapy.Key words:Non-viral vector;PEI; Transfection efficiency; pEGFP-C3;A549基因治疗是以基因转移为基础,将外源基因导入人体,达到治疗目的的一种治疗方法。
转染技术原理及应用

常规转染技术分为两大类,一类是瞬时转染,一类是稳定转染永久转染;前者外源DNA/RNA不整合到宿主染色体中,因此一个宿主细胞中可存在多个拷贝数,产生高水平的表达,但通常只持续几天,多用于启动子和其它调控元件的分析;一般来说,超螺旋质粒DNA转染效率较高,在转染后24-72小时内依赖于各种不同的构建分析结果,常常用到一些报告系统如荧光蛋白,β半乳糖苷酶等来帮助检测;后者也称稳定转染,外源DNA既可以整合到宿主染色体中,也可能作为一种游离体episome存在;尽管线性DNA比超螺旋DNA转入量低但整合率高;外源DNA整合到染色体中概率很小,大约1/104转染细胞能整合,通常需要通过一些选择性标记,如来氨丙基转移酶APH;新霉素抗性基因,潮霉素B 磷酸转移酶HPH,胸苷激酶TK等反复筛选,得到稳定转染的同源细胞系;转染技术的选择对转染结果影响也很大,许多转染方法需要优化DNA与转染试剂比例,细胞数量,培养及检测时间等;一些传统的转染技术,如DEAE右旋糖苷法,磷酸钙法,电穿孔法,脂质体法各有利弊,其主要原理及应用特点见下表:转染方法原理应用特点磷酸钙法磷酸钙DNA复合物吸附细胞膜被细胞内吞稳定转染瞬时性转染不适用于原代细胞操作简便但重复性差有些细胞不适用DEAE-右旋糖苷法带正电的DEAE-右旋糖苷与核酸带负电的磷酸骨架相互作用形成的复合物被细胞内吞瞬时性转染相对简便、结果可重复但对细胞有一定的毒副作用转染时需除血清电穿孔法高脉冲电压破坏细胞膜电位,DNA通过膜上形成的小孔导入稳定转染瞬时性转染所有细胞适用性广但细胞致死率高,DNA和细胞用量大, 需根据不同细胞类型优化电穿孔实验条件病毒介导法通过侵染宿主细胞将外源基因整合到染色体中稳定转染可用于难转染的细胞、原代细胞,体内细胞等逆转录病毒特定宿主细胞但携带基因不能太大细胞需处分裂期需考虑安全因素腺病毒通过侵染宿主细胞将外源基因整合到染色体中瞬时转染特定宿主细胞可用于难转染的细胞需考虑安全因素阳离子脂质体法带正电的脂质体与核酸带负电的磷酸基团形成复合物被细胞内吞稳定转染瞬时性转染所有细胞适用性广,转染效率高,重复性好,但转染时需除血清;转染效果随细胞类型变化大Biolistic颗粒传递法将DNA用显微重金属颗粒沉淀,再将包被好的颗粒用弹道装置投射入细胞,DNA在胞内逐步释放,表达瞬时性转染可用于:人的表皮细胞,纤维原细胞,淋巴细胞系以及原代细胞显微注射法用显微操作将DNA直接注入靶细胞核稳定转染瞬时性转染转染细胞数有限,多用于工程改造或转基因动物的胚胎细胞各种转染方法的比较除上述传统方法外,近年来国际上推出了一些阳离子聚合物基因转染技术,以其适用宿主范围广,操作简便,对细胞毒性小,转染效率高受到研究者们的青睐;其中树枝状聚合物Dendrimers和聚乙烯亚胺Polyethylenimine,PEI的转染性能最佳,但树枝状聚合物的结构不易于进一步改性,且其合成工艺复杂;聚乙烯亚胺是一种具有较高的阳离子电荷密度的有机大分子,每相隔二个碳个原子,即每“第三个原子都是质子化的氨基氮原子,使得聚合物网络在任何pH下都能充当有效的“质子海绵”proton sponge体;这种聚阳离子能将各种报告基因转入各种种属细胞,其效果好于脂质聚酰胺,经进一步的改性后,其转染性能好于树枝状聚合物,而且它的细胞毒性低;大量实验证明,PEI是非常有希望的基因治疗载体;目前在设计更复杂的基因载体时,PEI经常做为核心组成成分;线型PEILine PEI,LPEI与其衍生物用作基因转染载体的研究比分枝状PEIBranched PEI,BPEI要早一些,过去的研究认为在不考虑具体条件,LPEI/DNA转染复合物的细胞毒性较低,有利于细胞定位,因此与BPEI相比应该转染效率高一些;但最近研究表明BPEI 的分枝度高有利于形成小的转染复合物,从而提高转染效率,但同时细胞毒性也增大;超高分枝的、较柔性的PEI衍生物含有额外的仲胺基和叔胺基,在染实验中发现这种PEI 的毒性低,但转染效率却较高;GenEscort是采用各种分枝状和超高分枝状的小分子PEI与各种含有生理条件下可降解键的交联剂交联,合成出的一系列高分枝的可降解的PEI衍生物;聚合物的分枝结构使得其具有较高的正电性,因此易于高效地包裹各种DNA、RNA分子及质粒形成小的纳米颗粒,从而提高转染效率,当所形成复合物进入细胞以后,其中所含的生理条件下可降解的化学键在细胞内水解,使交联聚合物分解为无细胞毒性的小分子PEI,这样结构的转染试剂在体外应用可以获得高的转染效率和低的细胞毒性,其可降解性对体内应用也具有重要的意义;影响转染实验的因素转染技术是指将外源分子如DNA,RNA等导入真核细胞的技术;随着分子生物学和细胞生物学研究的不断发展,转染已经成为研究和控制真核细胞基因功能的常规工具;在研究基因功能、调控基因表达、突变分析和蛋白质生产等生物学试验中,其应用越来越广泛;影响转染效率的因素有很多,细胞株本身的特性和活性,细胞培养条件,转染的DNA或RNA的质量,转染方法,转染试剂的选择等;常规转染技术可分为两大类,一类是瞬时转染,一类是稳定转染永久转染;前者外源DNA/RNA不整合到宿主染色体中,因此一个宿主细胞中可存在多个拷贝数,产生高水平的表达,但通常只持续几天,多用于启动子和其它调控元件的分析;一般来说,超螺旋质粒DNA转染效率较高,在转染后24-72小时内依赖于各种不同的构建分析结果,常常用到一些报告系统如荧光蛋白,β - 半乳糖苷酶等来帮助检测;后者也称稳定转染,外源DNA既可以整合到宿主染色体中,也可能作为一种游离体episome存在;尽管线性DNA比超螺旋DNA转入量低但整合率高;外源DNA整合到染色体中概率很小,大约1/104转染细胞能整合,通常需要通过一些选择性标记,如来氨丙基转移酶APH;新霉素抗性基因,潮霉素B磷酸转移酶HPH,胸苷激酶TK等反复筛选,得到稳定转染的同源细胞系;转染效率受多种因素影响,主要因素有下面几个:1.转染试剂不同细胞系转染效率通常不同,但细胞系的选择通常是根据实验的需要,因此在转染实验前应根据实验要求和细胞特性选择适合的转染试剂;每种转染试剂都会提供一些已经成功转染的细胞株列表和文献,通过这些资料可选择最适合实验设计的转染试剂;当然,最适合的是高效、低毒、方便、廉价的转染试剂;2.细胞状态一般低的细胞代数<50能确保基因型不变;最适合转染的细胞是经过几次传代后达到指数生长期的细胞,细胞生长旺盛,最容易转染;细胞培养在实验室中保存数月和数年后会经历突变,总染色体重组或基因调控变化等而演化;这会导致和转染相关的细胞行为的变化;也就是说同一种系的细胞株,在各实验室不同培养条件下,其生物学性状发生不同程度的改变,导致其转染特性也发生变化;因此,如果发现转染效率降低,可以试着转染新鲜培养的细胞以恢复最佳结果;3.转染方法不同转染试剂有不同的转染方法,但大多大同小异;转染时应跟据具体转染试剂推荐的方法,但也要注意,因不同实验室培养的细胞性质不同,质粒定量差异,操作手法上的差异等,其转染效果可能不同,应根据实验室的具体条件来确定最佳转染条件;1细胞培养物健康的细胞培养物是成功转染的基础;不同细胞有不同的培养基,血清和添加物;高的转染效率需要一定的细胞密度,一般的转染试剂都会有专门的说明;推荐在转染前24小时分细胞,这将提供正常细胞代谢,增加对外源DNA摄入的可能;一定要避免细菌,支原体或真菌的污染;2细胞密度细胞密度对转染效率有一定的影响;不同的转染试剂,要求转染时的最适细胞密度各不相同,即使同一种试剂,也会因不同的细胞类型或应用而异;转染时过高或者过低的细胞密度会导致转染效率降低,乃至表达水平偏低;因此如果选用新的细胞系或者新的转染试剂,最好能够进行优化实验并为以后的实验建立一个稳定方法,包括适当的接种量和培养时间等等;阳离子脂质体具有微量的细胞毒性而往往需要更高的铺板密度或者更多的悬浮细胞数,有的要求细胞90%汇片;而有些多胺或者非脂质体的配方则要求在40%-80%之间,总之是尽量在细胞最适的生理状态下转染,以求最佳的转染效果;不同的实验目的也会影响转染时的铺板密度,比如研究细胞周期相关基因等表达周期长的基因,就需要较低的铺板密度,所以需要选择能够在较低铺板密度下进行转染的试剂;一般转染时贴壁细胞密度为50%-90%,但这个需要参考所选转染试剂的说明书;3血清血清一度曾被认为会降低转染效率,老一代的转染方法往往要求转染前后洗细胞或者在无血清培养基条件下转染,但有些对此敏感的细胞如原代细胞会受到损伤,甚至死亡导致转染效率极低;不过转染产品配方几经革新后的今天,对于主流的转染试剂来说,血清的存在已经不会影响转染效率,甚至还有助于提高转染效率,如阳离子聚合物等,血清的存在会影响DNA—转染复合物的形成,但只要在DNA-转染复合物形成时用无血清培养基或PBS来稀释DNA和转染试剂就可以了,在转染过程中是可以使用血清的;不过要特别注意:对于RNA转染,如何消除血清中潜在的RNase污染是值得关注的;胎牛血清FCS经常用到,便宜一点的有马或牛血清;通常的,血清是一种包含生长因子及其它辅助因子的不确切成分的添加物,对不同细胞的生长作用有很大的差别;血清质量的变化直接影响细胞生长,因此也会影响转染效率;新加培养基的预热对细胞转染很有帮助;4抗生素细胞培养过程中往往会添加抗生素来防止污染,但是这些添加剂可能对转染造成麻烦;比如青霉素和链霉素,就是影响转染的培养基添加物;这些抗生素一般对于真核细胞无毒,但有些转染试剂增加了细胞的通透性,使抗生素可以进入细胞;这可能间接导致细胞死亡,造成转染效率低;目前转染试剂因为全程都可以用有血清和抗生素等添加剂的完全培养基来操作,非常方便,省去了污染等麻烦;5氮磷N/P比N/P比是转染效率的关键为了换算方便,一般以DNA/转染试剂质量比表示,在一定比例范围内转染效率随N/P比成比例增高,之后达到平值,但毒性也随之而增加,因此在实验之前应根据推荐比例,确定本实验的最佳转染比例;6DNA质量DNA质量对转染效率影响非常大;一般的转染技术如脂质体等基于电荷吸引原理,如果DNA不纯,如带少量的盐离子,蛋白,代谢物污染都会显著影响转染复合物的有效形成及转染的进行,但对GenEscort系列转染试剂影响不大;核酸纯化世界第一品牌德国QIAGEN公司提供的超纯质粒抽提试剂盒,能达到两倍2×CsCl梯度离心以上的纯度效果,使您不必为DNA质量操心;此外,对一些内毒素敏感的细胞如原代细胞,悬浮细胞和造血细胞,QIAGEN还提供可去除内毒素污染的质粒抽提试剂盒,在质粒抽提过程中有效去除脂多糖分子,保证理想的转染效果;但如果使用GenEscort转染试剂,一般不需要这么高的DNA质量要求;当使用GenEscort转染试剂时,即使采用传统的酚-氯仿沉淀方法纯化质粒,仍然可达到非常好的转染效果,但所用的质粒量比试剂盒纯化方法的DNA用量大一些;4.载体构建转染载体的构建病毒载体,质粒DNA,RNA,PCR产物,寡核苷酸等也影响转染结果;病毒载体对特定宿主细胞感染效率较高,但不同病毒载体有其特定的宿主,有的还要求特定的细胞周期,如逆转录病毒需侵染分裂期的宿主细胞,此外还需考虑一些安全问题如基因污染;除载体构建外,载体的形态及大小对转染效率也有不同的影响,如前面提到的超螺旋及线性DNA对瞬时和稳定转染的影响;如果基因产物对细胞有毒性作用,转染也很难进行,因此选择组成或可调控,强度合适的启动子也很重要,同时做空载体及其它基因的相同载体构建的转染正对照可排除毒性影响的干扰;转染技术的要点及转染试剂正确选择转染技术的要点及转染试剂正确选择转染技术是指将外源分子如DNA,RNA等导入真核细胞的技术,它是研究基因表达调控,突变分析等的常规工具;随着功能研究的兴起,其应用越来越广泛;以下就向大家介绍一些转染的技术要点及市面上主要的转染试剂类型的选择;常规转染技术可分为两大类,一类是瞬时转染,一类是稳定转染永久转染;前者外源DNA/RNA不整合到宿主染色体中,因此一个宿主细胞中可存在多个拷贝数,产生高水平的表达,但通常只持续几天,多用于启动子和其它调控元件的分析;一般来说,超螺旋质粒DNA转染效率较高,在转染后24-96小时内依赖于各种不同的构建分析结果,常常用到一些报告系统如荧光蛋白,β半乳糖苷酶等来帮助检测;后者也称稳定转染,外源DNA既可以整合到宿主染色体中,也可能作为一种游离体episome存在;尽管线性DNA比超螺旋DNA转入量低但整合率高;外源DNA整合到染色体中概率很小,大约1/104转染细胞能整合,通常需要通过一些选择性标记,如来氨丙基转移酶APH;新霉素抗性基因,潮霉素B磷酸转移酶HPH,胸苷激酶TK等反复筛选,得到稳定转染的同源细胞系;转染效率收多种因素影响,主要因素有下面几个:1. 细胞培养物健康的细胞培养物是成功转染的基础;不同细胞有不同的培养基,血清和添加物;低的细胞代数<50能确保基因型不变;高的转染效率需要一定的细胞密度,一般的转染试剂都会有专门的说明;推荐在转染前24小时分细胞,这将提供正常细胞代谢,增加对外源DNA摄入的可能;一定要避免细菌,支原体或真菌的污染;2. 血清大多数培养基在使用前需要加血清;胎牛血清FCS经常用到,便宜一点的有马或牛血清;通常的,血清是一种包含生长因子及其它辅助因子的不确切成分的添加物,对不同细胞的生长作用有很大的差别;血清质量的变化直接影响转染效率;因此在转染前建议先测转右试出对细胞生长良好的血清批号,转染时用同一批号的血清,并同时做负对照不加转染试剂及外源DNA以测试细胞生长是否正常;有些转染技术如脂质体转染在有血清存在情况下效率很低,因此在转染前要除血清;但有些对此敏感的细胞如原代细胞会受到损伤,甚至死亡导致转染效率极低; 3. 载体构建转染载体的构建病毒载体,质粒DNA,RNA,PCR产物,寡核苷酸等也影响转染结果;病毒载体对特定宿主细胞感染效率较高,但不同病毒载体有其特定的宿主,有的还要求特定的细胞周期,如逆转录病毒需侵染分裂期的宿主细胞,此外还需考虑一些安全问题如基因污染;除载体构建外,载体的形态及大小对转染效率也有不同的影响,如前面提到的超螺旋及线性DNA对瞬时和稳定转染的影响;如果基因产物对细胞有毒性作用,转染也很难进行,因此选择组成或可调控,强度合适的启动子也很重要,同时做空载体及其它基因的相同载体构建的转染正对照可排除毒性影响的干扰;4. DNA质量DNA质量对转染效率影响非常大;一般的转染技术如脂质体等基于电荷吸引原理,如果DNA不纯,如带少量的盐离子,蛋白,代谢物污染都会显著影响转染复合物的有效形成及转染的进行;核酸纯化世界第一品牌德国QIAGEN公司提供的超纯质粒抽提试剂盒,能达到两倍2x CsCl梯度离心以上的纯度效果,使您不必为DNA质量操心;此外,对一些内毒素敏感的细胞如原代细胞,悬浮细胞和造血细胞,QIAGEN还提供可去除内毒素污染的质粒抽提试剂盒,在质粒抽提过程中有效去除脂多糖分子,保证理想的转染效果;5.转染技术转染技术的选择对转染结果影响也很大,许多转染方法需要优化DNA与转染试剂比例,细胞数量,培养及检测时间等;一些传统的转染技术,如DEAE右旋糖苷法,磷酸钙法,电穿孔法,脂质体法各有利弊,其主要原理及应用特点见下:转染方法原理应用特点DEAE-右旋糖苷法带正电的DEAE-右旋糖苷与核酸带负电的磷酸骨架相互作用形成的复合物被细胞内吞瞬时性转染相对简便、结果可重复但对细胞有一定的毒副作用,转染时需除血清磷酸钙法磷酸钙DNA复合物吸附细胞膜被细胞内吞稳定转染,瞬时性转染不适用于原代细胞,操作简便但重复性差,有些细胞不适用;电穿孔法高脉冲电压破坏细胞膜电位,DNA通过膜上形成的小孔导入稳定转染,瞬时性转染,所有细胞适用性广但细胞致死率高,DNA和细胞用量大,需根据不同细胞类型优化电穿孔实验条件阳离子性的脂质体法带正电的脂质体与核酸带负电的磷酸基团形成复合物被细胞内吞稳定转染瞬时性转染,所有细胞适用性广,转染效率高,重复性好但转染时需除血清转染效果随细胞类型变化大病毒介导法逆转录病毒通过侵染宿主细胞将外源基因整合到染色体中稳定转染,特定宿主细胞可用于难转染的细胞、原代细胞,体内细胞等,但携带基因不能太大细胞需处分裂期,需考虑安全因素 ,腺病毒瞬时转染,特定宿主细胞可用于难转染的细胞,需考虑安全因素;Biolistic 颗粒传递法将DNA用显微重金属颗粒沉淀,再将包被好的颗粒用弹道装置投射入细胞,DNA在胞内逐步释放,表达瞬时性转染可用于:人的表皮细胞,纤维原细胞,淋巴细胞系以及原代细胞显微注射法用显微操作将DNA直接注入靶细胞核稳定转染,瞬时性转染转染细胞数有限,多用于工程改造或转基因动物的胚胎细胞。
常用转染方法原理及应用

常用转染方法原理及应用常用的转染方法有物理转染和化学转染两种。
物理转染是利用物理力学方法将外源DNA导入细胞内。
常用的物理转染方法有离心转染、电穿孔转染和基因枪转染。
离心转染是利用离心力将外源DNA加速转移到细胞内。
利用离心力可将DNA迅速穿透细胞膜,使其进入细胞质。
离心转染操作简单快捷,对细胞毒性较小,适用于大部分细胞的转染。
但由于仅靠离心力进行转染,对一些细胞类型转染效率较低。
电穿孔转染是利用电场将细胞膜瞬间打开,使外源DNA得以进入细胞内。
通过施加电场,使细胞膜上形成小孔,从而增加外源DNA进入细胞的机会。
电穿孔转染方法具有转染效率高、对细胞毒性较小等优点,适用于多种细胞类型的转染。
但操作过程较复杂,需要专用电转仪,且对细胞穿孔条件的控制较为严格。
基因枪转染是利用高压气泡冲击将外源DNA直接注射到细胞内。
将外源DNA包裹在微小金粒表面,再利用高压气泡将微小金粒射入细胞内,使外源DNA进入细胞质。
基因枪转染方法可以对不易转染的细胞类型进行转染,如植物细胞等。
但操作相对繁琐,对转染条件的控制较为困难。
化学转染是通过化学方法将外源DNA导入细胞内。
常用的化学转染方法有磷脂体转染、阳离子转染和电转的转染。
磷脂体转染是利用磷脂体包裹外源DNA,形成DNA磷脂体复合物,使其与细胞膜相互作用,从而实现外源DNA进入细胞质。
磷脂体转染方法适用于多种细胞类型,转染效率较高。
但磷脂体转染对细胞毒性较大,而且操作步骤较繁琐。
阳离子转染是利用阳离子聚合物与DNA形成复合物,使其与细胞膜发生相互作用,促进DNA进入细胞质。
阳离子转染适用于多种细胞类型,转染效率较高,但对细胞毒性较大,操作过程较为复杂。
电转是利用电场作用使负带电的外源DNA进入细胞内。
将细胞与含有外源DNA的转染缓冲液一起放在电转仪中,通过施加电压使DNA进入细胞质。
电转适用于多种细胞类型,具有转染效率高和操作简单等优点。
转染方法在生物研究和生物技术应用中具有重要作用。
慢病毒转染PROTOCOL

慢病毒转染PROTOCOL第一天病毒感染前24 小时将细胞置于12 孔板。
加入 1 ml 适当的完全培养基(含有血清和抗生素)孵育过夜。
在传染当天细胞应该达到约50%平铺(Day 2)。
注意:也可用其它型号培养板转导。
这样需要根据孔径或培养板调节细胞量。
第二天准备完全培养基和Polybrene? (sc-134220) 混合物,Polybrene 终浓度为:5 μg/ml。
移去培养基并添加1 ml Polybrene/培养基混合物于每孔中(适用于12 孔板)。
注意:Polybrene 是一种聚阳离子,可以中和电荷以促进假病毒外壳与细胞膜的作用。
Polybrene 最佳浓度因不同细胞株而异并应根据经验而定(通常范围为2-10 μg/ml)。
过长时间暴露于Polybrene (> 12 小时)可对某些细胞产生毒性作用。
在室温下溶化慢病毒颗粒,使用前轻轻混匀。
培养液中加入shRNA 慢病毒颗粒以感染细胞。
轻轻振动培养板使其混匀并孵育过夜。
病毒颗粒使用量因细胞株的特点而有较大不同。
注意:溶化的shRNA 慢病毒颗粒置于冰上。
反复冻溶或长时间将病毒颗粒暴露于常温可使病毒效价降低。
注意:当你是第一次转导shRNA 慢病毒结构进入细胞,我们建议你用几个不同剂量的shRNA 慢病毒颗粒。
此外,我们建议你用一孔shRNA 慢病毒颗粒转导的细胞作对照(sc-108080)。
注意:用copGFP 对照慢病毒颗粒:sc-108084 观察转导效率。
第三天移去培养液并添加1 ml 完全培养基(不含Polybrene)。
孵育细胞过夜。
第四天欲选择稳定表达shRNA 的克隆,根据细胞类型不同将其分成1:3 到1:5 并继续在完全培养基中孵育24-48 小时。
第五-六天及以后用Puromycin dihydrochloriede (sc-108071) 筛选稳定表达shRNA 的克隆。
Puromycin 筛选法:用足够剂量的Puromycin 杀死非转导的细胞。
转染中常见小问题及解决方法

在DNA转染和DNA-siRNA共转染过程中,细胞密度控制在60~70%之间;在siRNA转染过程中,细胞密度控制在50%左右。
使用了次优化的反应条件,如转染试剂的用量,DNA的用量以及DNA-转染试剂复合物形成时间等参数未优化。
如果您不清楚最优化的反应条件或者不知道如何针对待转染细胞进行条件优化,请致电或发邮件至info@寻求技术支持。
严格控制细胞生成条件,务必使每一次转染时细胞的密度较为均一。如果细胞传代太多,建议重新复苏一批新鲜细胞进行培养。
转染试剂
有时呈云
雾状浑浊
转染试剂储存温度太低
请务必不要低温保存转染试剂,+4℃环境即可;如果将转染试剂误放在-20℃以下环境,建议将冰冻的转染试剂(LipoD293™和LipoJet™转染试剂除外)温浴10分钟后,待完全融化后,再进行转染操作。一般情况下不会导致转染效率降低。
转染复合物的最佳放置时间和温度是室温条件下10~20分钟,长时间放置会显著地降低转染效率,请务必控制放置时间在20分钟之内。
使用LipoD293™和PolyJet™转染试剂时,细胞的密度太低
使用LipoD293™和PolyJet™转染试剂时,细胞的密度控制在~70%为宜
高转速离心转染复合物
在形成转染复合物时,标准操作步骤推荐数秒内涡旋混合转染试剂和DNA或siRNA以生成高效转染复合物。如果想将粘附于管壁的复合物离心到管底,请务必使用极低转速离心,如80g离心5秒钟足够,离心转速太高将显著降低转染复合物的转染效率。
确定转染效率的方法学问题
建议每次转染时,设定一个阳性对照,如绿色荧光蛋白(GFP)。
所使用DNA的启动子不能被待转染细胞所识别
在转染实验前,请确认所转染DNA确实能在待转染细胞内表达。
优宁维转染全攻略
转染——是指将外源基因如DNA、RNA等导入真核细胞的技术。随着分子生物学和细胞生物学研究的不断发展,转染已经成为研究和控制真核细胞基因功能的常规工具。在研究基因功能、调控基因表达、突变分析和蛋白质生产等生物学试验中,其应用越来越广泛。
目前常见的细胞转染方法有以下几种:
1、化学介导法:
3、生物介导法:
病毒介导法:对于上述几种方式都不能实现转染的细胞,可采用病毒转染。病毒介导法转染效率特别高,尤其是针对难以转染的原代细胞、活体细胞。病毒转染主要包括以下几个步骤:构建载体、包装提纯病毒以及感染靶细胞
慢病毒包装、转染过程
目前,腺病毒、逆转录病毒和慢病毒载体已广泛用于哺乳动物细胞体内外的转染实验中。以慢病毒为例,其包装系统由两部分组成,即包装成分和载体成分。将包装成分与载体成分的多个质粒共转染包装细胞,即可在细胞上清中收获携带目的基因的复制缺陷型慢病毒载体颗粒。包装好的假病毒颗粒可以直接用于宿主细胞的感染,目的基因进入到宿主细胞之后,经过反转录,整合到基因组,从而高水平的表达效应分子。
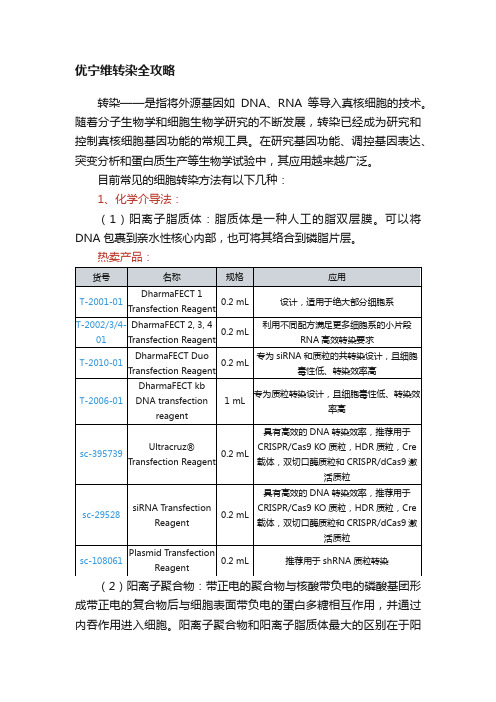
0.2 mL
具有高效的DNA转染效率,推荐用于CRISPR/Cas9 KO质粒,HDR质粒,Cre 载体,双切口酶质粒和CRISPR/dCas9激活质粒
sc-108061
Plasmid Transfection Reagent
0.2 mL
推荐用于shRNA质粒转染
(2)阳离子聚合物:带正电的聚合物与核酸带负电的磷酸基团形成带正电的复合物后与细胞表面带负电的蛋白多糖相互作用,并通过内吞作用进入细胞。阳离子聚合物和阳离子脂质体最大的区别在于阳离子聚合物不含疏水部分而完全溶于水,可以方便地进行化学修饰,且不会像脂质体一样破坏细胞结构,所以相对毒性较低。
Polyplus公司转染试剂FAQ(常见问题解答)中文版-朱艳梅2012.8

请 浏 览 Polyplus 网 站 的 细 胞 转 染 数 据 库 , 在 这 里 可 以 找 到 许 多 细 胞 的 具 体 转 染 条 件 (/technical-resources/cell-line-database/) 。 悬浮细胞 jetPRIME®推荐用于悬浮细胞的 DNA 转染吗?
悬浮细胞,例如 T 和 B 淋巴细胞是众所周知的难转染 DNA 的细胞,无论使用哪种化学方法的试剂。 因此,我们通常推荐电转或病毒转染核酸到悬浮细胞。 植物细胞 jetPRIME®是否测试过可以用于植物细胞的转染?
植物细胞富含纤维素的膜阻止了 jetPRIME®/DNA 复合物进入细胞。甚至在脱去纤维素的原生质体阶段, 复合物也无法穿透进入细胞质。 HUVEC(人脐静脉内皮细胞) jetPRIME®对 HUVEC 的 DNA 转染是否有效?
INTERFERin® 仅用于体外转染。对于动物的 siRNA 转染,我们推荐使用 in vivo-jetPEI®,其已成功
用于多种动物的 siRNA 和寡核苷酸的转染。更多信息,请参见 in vivo-jetPEI® web page。
保存 INTERFERin®如何保存? INTERFERin®应该盖紧盖子放在 4°C。 冷冻 我不小心将 INTERFERin®试剂冻存在-20°C。它是否仍有效,可否继续使用?
jetPRIME®可以耐受偶尔的冻融,而不影响转染效率。然而,对于长期保存来说,我们建议分装并储 存在 4°C,以确保试剂长时间有效。 有效期 jetPRIME®试剂可以使用多长时间?
保存适当时,jetPRIME® cat#114-01 (0.1 ml)可以保存 6 个月。其他规格的 jetPRIME®至少可以保存 一年。
转染实验技巧DNA体外转染试剂如何准备转染所需的质粒DNA转染

转染实验技巧DNA体外转染试剂如何准备转染所需的质粒DNA转染效率受到诸多因素的影响,除了细胞、培养基和载体等影响因素外,另外一项非常重要的因素便是DNA的质量。
为了比较不同厂家的转染效率,我们分别从三家不同的供应商购买了质粒制备试剂盒来制备pEGFP-N3质粒DNA,并通过不同的方法将制备的pEGFP-N3质粒转运至NIH-3T3细胞。
pEGFP-N3质粒分别通过Endofree Maxi Piasmid Kit(Qiagen),PerfectPrep Endofree Piasmid Maxi Kit(5 PRIME,inc)及NucleoBond DNA Maxi Kit(MACHEREY-NAGEL GmbH&Co.KG)制备,我们测定了230,260,280及320nm的吸光值检测DNA的质量。
通过上述三种方法制备的DNA质量如下:MACHEREY-NAGEL >5Prime>Qiagen。
pEGFP-N3由PolyJetDNA转染试剂运至NIH-3T3细胞。
转染效率的高低与DNA的质量相符,由MACHEREY-NAGEL纯化DNA对应的转染效率最高,而由Qiagen纯化DNA对应的转染效率最低。
因此,MACHEREY-NAGEL GmbH & Co.KG的质粒制备试剂盒被认为是制备转染级别DNA的最佳选择。
How to prepare transfection grade plasmid DNATransfection efficiencies are affected by a variety of different parameters. Besides factor such as cell culture, medium and vectors, one of most critical parameters is DNA quality. We prepared pEGF-N3 plasmid DNA by large plasmid preparation kits from three different vendors and tested transfection efficiencies by delivering pEGFP-N3 DNAs prepared by different methods to NIH-3T3 cells.We prepared pEGFP-N3 plasmid with Endofree Maxi Plasmid Kit (Qiagen), PerfectPrep Endofree Plasmid Maxi Kit (5 PRIME, Inc.) and NucleoBond DNA Maxi Kit (MACHEREY-NAGEL GmbH & Co. KG). The DNA quality was determined by measuring absorbance at 230, 260, 280 and 320 nm by spectrometry.The purity of DNA prepared by the three methods is as follows: MACHEREY-NAGEL > 5 Prime > Qiagen.Then pEGFP DNA was delivered with PolyJet™ (Cat # SL100688) DNA transfection reagent to NIH-3T3 cells per manufacturer’s protocol. In accordance with DNA purity results, we found that DNA from MACHEREY-NAGEL gave the best transfection efficiency while Qiagen DNA gave the worst efficiency. Therefore plasmid preparation kit from MACHEREY-NAGEL GmbH & Co. KG is confirmed to be the best choice to prepare tansfection grade DNA.表皮细胞的转染表皮细胞广泛遍布于身体,正常的表皮细胞较难转染,尤其是使用基于脂质体技术的转染试剂。
非脂质体转染原理

非脂质体转染原理
非脂质体转染是一种基因转移技术,它是通过将外源DNA导入到细胞内,从而实现基因转移的过程。
与传统的脂质体转染技术相比,非脂质体转染具有更高的转染效率和更低的细胞毒性,因此在基因治疗和基因工程领域得到了广泛的应用。
非脂质体转染的原理是利用一些特殊的载体将外源DNA导入到细胞内。
这些载体可以是病毒、细胞外囊泡、聚合物、蛋白质等。
其中,病毒是最常用的载体之一,因为它们具有高度的特异性和高效的转染能力。
但是,病毒载体也存在一些缺点,如易感染人体、难以控制等。
相比之下,非病毒载体具有更好的安全性和可控性。
例如,聚合物载体可以通过改变其化学结构和分子量来调节其转染效率和细胞毒性。
蛋白质载体则可以通过改变其结构和功能来实现基因转移。
此外,细胞外囊泡也是一种常用的非病毒载体,它们可以通过改变其大小、形状和表面性质来实现基因转移。
非脂质体转染的过程可以分为三个步骤:载体与DNA的结合、载体-DNA复合物的形成和复合物与细胞膜的相互作用。
在第一步中,载体与DNA通过静电相互作用、氢键和范德华力等力学相互作用结合在一起。
在第二步中,载体-DNA复合物会形成一种球形结构,称为纳米粒子。
在第三步中,纳米粒子与细胞膜相互作用,通过内吞
作用将DNA导入到细胞内。
非脂质体转染是一种高效、安全、可控的基因转移技术,它可以通过改变载体的结构和性质来实现基因转移。
随着基因治疗和基因工程领域的不断发展,非脂质体转染技术将会得到更广泛的应用。
瞬时转染实验步骤-概述说明以及解释

瞬时转染实验步骤-概述说明以及解释1.引言1.1 概述瞬时转染实验是一种广泛应用于分子生物学研究的技术手段。
通过该实验,研究人员能够将外源基因材料有效地传递到细胞内,从而实现对基因功能和细胞过程的研究。
瞬时转染实验的步骤相对简单,同时能够快速地获得实验结果,因此在许多研究领域被广泛应用。
本文旨在介绍瞬时转染实验的具体步骤,并讨论其研究结果的分析方法。
首先,我们将详细介绍实验前的准备工作,包括培养细胞、制备转染试剂以及优化实验条件等。
其次,我们将重点介绍瞬时转染的步骤,包括选择适当的转染方法、判断转染效率以及确定最佳转染时间等方面的内容。
最后,我们将展示如何对实验结果进行分析,包括利用荧光染料观察转染效果、使用定量PCR或Western blot等方法检测目标基因的表达水平。
通过本文的研究,我们旨在总结瞬时转染实验的操作步骤,为其他研究人员提供一种快速、高效的细胞转染方法,并探讨转染结果的研究意义。
此外,我们还将展望未来研究方向,包括进一步优化转染方法、完善转染效果评价体系以及探索转染技术在临床治疗中的应用前景等。
通过本文的阅读,读者将能够全面了解瞬时转染实验的实施步骤和结果分析方法,为自己的研究工作提供有价值的参考。
同时,我们也期望读者通过本文的阅读,进一步深入探索转染技术的应用领域,并为未来的基础研究和临床应用做出更多的贡献。
1.2文章结构文章结构:本文主要包括引言、正文和结论三个部分。
引言部分分为概述、文章结构和目的三个小节。
概述部分主要介绍瞬时转染实验的背景及其在生命科学研究中的重要作用,以及当前已有的研究进展和存在的问题。
文章结构部分主要说明整篇文章的组织结构,从而使读者对后续内容有一个整体的了解。
该部分提供了文章的目录,方便读者查阅。
目的部分则明确了本文研究的目标,即通过瞬时转染实验步骤的介绍和实验结果的分析,探索某一具体问题或验证某一假设,为相关研究提供依据。
正文部分主要包括实验准备、瞬时转染步骤和实验结果分析三个小节。
转染步骤及经验

转染步骤及经验
1.根据要进行体细胞转染的实验的特殊要求,选择适当的载体质粒,以及目标细胞。
2.制备转染的DNA样本:根据质粒的大小和实验的要求,严格控制样本的DNA浓度,并确保其质量良好,无杂质;
3.准备转染液:将转染的DNA样本和必要的添加剂放入适量的
PBS/DMEM中混合,形成转染液;
4.细胞放入转染液中:把细胞放入适量转染液中,使细胞与转染液充分混合;
5.细胞转染:细胞转染的方法有优化的转染技术(如脉冲转染)和非优化转染技术(如胞浆转染),根据实验对转染效果的要求,选择合适的转染技术;
6.细胞休眠:细胞休眠后,为后续实验提供了理想的条件,简化接下来的操作。
7.细胞筛选:有些载体质粒将特定的标记物(如GFP)植入细胞内,接着,使用不同颜色的染料或者发光技术,筛选出转染后的细胞,这将有助于后续的实验。
8.检测转染效率:使用细胞膜染色,PCR,蛋白表达分析来检测转染效率,以证实转染是否成功。
9.细胞接种:转染细胞分离后,接种到HMVEC或其他细胞上,以复制体系,以便进一步的研究。
细胞转染是一个复杂的过程,需要仔细地操作。
聚乙烯亚胺介导基因转染的影响因素研究

聚乙烯亚胺介导基因转染的影响因素研究周鹏;张瑜【摘要】目的研究非病毒基因载体聚乙烯亚胺(PEI)介导基因转染的影响因紊.方法采用透射电镜观察PEI与DNA形成复合物的形态,分别考察质粒量、复合物形成时间、复合物在细胞上作用时间和氮磷比(N/P)对转染效率的影响,以筛选较优的转染条件.结果 PEI可有效地与DNA形成复合物,当质粒量为每孔2 μg、复合物形成时间为30 min、复合物在细胞上的作用时间为4 h且N/P为20时转染效率最高.结论 PEI可作为合成新型非病毒栽体的骨架,但必须控制有关因素才能得到最佳的和可重复的转染结果.【期刊名称】《中国药业》【年(卷),期】2010(019)013【总页数】2页(P25-26)【关键词】聚乙烯亚胺;非病毒基因载体;转染【作者】周鹏;张瑜【作者单位】广东省深圳龙珠医院,广东,深圳,518055;新疆维吾尔自治区人民医院高血压科,新疆,乌鲁木齐,830001【正文语种】中文【中图分类】Q782基因转染是指利用基因载体携带目的基因运送到细胞内的方法。
目前在基因治疗中,由于病毒载体存在着诸多缺陷[1],非病毒载体如阳离子脂质体和阳离子共聚物越来越受到重视[2-3]。
其中聚乙烯亚胺(polyethylenimine,PEI)是目前研究较多的聚阳离子型基因载体[4],富含氨基,可与DNA链上负电性的磷酸根通过静电作用缔合成复合物。
在此过程中,DNA会被高度压缩成50~200 nm大小的纳米球[5],大大增强了对细胞膜的穿透作用,因此具有较高的转染效率[6]。
但PEI作为非病毒基因载体,其转染效率的影响因素较多,重复性不好。
笔者考察了影响其转染效率的因素,从而筛选出较优的转染条件,为进一步的研究打下基础。
1 实验材料PEI(相对分子质量为25 000,支链型,无水,Aldrich-Sigma公司)。
人宫颈癌细胞系Hela细胞(L-2.1),在100 mL/L胎牛血清的RPMI 1640培养基中培养,血清56℃灭活30 min。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
11). 24,48小时后检测转染效率。
转染效率对比(摘于SignaGeet™ (µL):DNA (µg) is=3:1,也可以自己摸索调整。六孔板一个 孔加质粒1ug。
5).1ugDNA用50ul的高糖无血清培养基稀释, 轻轻地涡旋震荡(涡旋振荡器),简短的 离心(掌心宝离心机)。(标记为试剂1) 6).3ul PolyJet™ 试剂用用50ul的高糖无血清 培养基稀释,轻轻地涡旋震荡,简短的离 心。(标记为试剂2) 7).立刻将试剂2加到试剂1中。(注意:千万 不要将顺序弄反!!!!!)
8).将混合后的试剂轻轻地涡旋震荡,简短的 离心,室温孵育约15分钟,以形成 PolyJet™/DNA 复合物。(孵育时间不要超 过20分钟) 9).孵育完毕后,将试剂加到六孔板中,轻轻 地摇动六孔板,混匀。 10).转染12-18小时后更换新的培养基。对于 比较敏感的细胞,为减少细胞毒性,转染68小时后更换培养基。
以六孔板为例) 转染步骤(以六孔板为例) 1).转染之前铺板,待细胞密度达到90%-95% 进行转染(与转染小干扰时的细胞密度有 区别)。 2).转染之前30-60分钟换液,六孔板中每个孔 中加1ml的有血清培养基。 3).用高糖无血清培养基 serum-free DMEM with 高糖无血清培养基( 高糖无血清培养基 High Glucose)来稀释DNA和PolyJet™试剂。 (绝对避免用Opti-MEM来稀释PolyJet™试 剂和DNA, 它会破坏转染复合体)
技术讲解
质粒转染
1.质粒转染概念: 将外源质粒导入真核细胞的过程 。 2.质粒转染常见几种方法: (1)磷酸钙转染技术 (2)电穿孔DNA转移技术 (3)脂质体载体法 (4)基因显微注射技术
新的转染试剂
SignaGen体外 体外DNA转染试剂 转染试剂-PolyJet™ 体外 转染试剂 (只用来转染质粒DNA!!!!!!!)
