脂质体转染实验原理与操作步骤总(精)
转染详细步骤大攻略

转染详细步骤大攻略范例----真核重组表达质粒pDsRed-N1-NS1在A549细胞中表达按上海索莱宝生物科技有限公司去内毒素质粒小提试剂盒说明书方法进行质粒抽提,测得质粒浓度为410.32ng/µl。
将培养的A549细胞铺板,待细胞密度长到90%左右时,按lipo2000说明书转染A549细胞,36h后于荧光显微镜下观察DsRed-NS1融合蛋白的表达情况。
具体操作步骤如下:1)质粒准备按上海索莱宝生物科技有限公司去内毒素质粒小提试剂盒说明书方法进行质粒抽提,具体步骤如下:(1) 取1-5ml细菌培养物,12000rpm离心1 min,尽量吸除上清(菌液较多时可以通过多次离心将菌体沉淀收集到一个离心管中)。
(2) 向留有菌体沉淀的离心管中加入200µl溶液P1(请先检查是否已加入RNaseA),使用移液器或涡旋振荡器彻底悬浮细菌细胞沉淀。
(注:如果菌块未彻底混匀,会影响裂解导致质粒提取量和纯度偏低)(3)向离心管中加入200µl溶液P2,温和地上下翻转6-8次使菌体充分裂解。
(注:混匀一定要温和,以免污染基因组DNA,此时菌液应变得清亮粘稠,所用时间不应超过5min,以免质粒受到破坏)(4)向离心管中加入250µl溶液P3,立即温和地上下翻转6-8次,充分混匀,此时会出现白色絮状沉淀。
12000rpm 离心10min,用移液器小心地将上清转移到另一个干净的离心管中,尽量不要吸出沉淀。
(注:溶液P3加入后应立即混合,避免产生局部沉淀。
如果上清中还有微小白色沉淀,可再次离心后取上清)(5)加入1/5体积冰预冷的去内毒素清除剂,振荡混匀,溶液变浑浊,冰浴2min 至溶液变清亮。
(6)37℃水浴5 min,不时振荡,溶液又变浑浊。
12000rpm室温离心5min,溶液应分为两相,上层水相含质粒DNA,下层油状相含内毒素。
(7)将质粒DNA上层水相转移至新管,弃下层油状相,注意不要吸入油状相,重复抽提三次,即重复步骤5-7三次。
脂质体介导转染方法

脂质介导的短暂表达
实验材料
哺乳动物细胞
试剂、试剂
质粒DNA完全培养基氯化铯DMEM
盒
仪器、耗材
培养皿培养箱聚苯乙烯管
实验步骤
1. 按5×105细胞/孔的量在六孔板中接种指数期生长的细胞,在37℃ 5%CO2培养箱中
培养过夜,直至细胞80%汇片。
(如果用100 mm 培养皿代替六孔扳,则培养细胞至80%
汇片,将所有数量扩大8倍)
2. 在聚苯乙烯管中配制DNA/脂质体复合物如下:稀释质粒DNA至1 ml DMEM-SF中,
在旋涡混合器上振荡1 s 然后加入脂质体悬液、再次旋起混匀。
在室温下温育5~ 10 min,
使DNA与阳离子脂质体结合。
3. 吸去DMEM-SF培养液,用1 ml 的完全DMEM-SF洗1次,吸去DMEM-SF。
对毎
个35 mm 孔中,直接在细胞上加1 ml DNA/脂质体复合物。
在37℃培养箱中温育3~5 h。
4. 往每孔细抱中加入1 ml 的DMEM-20完全培养液,在37℃培养箱中继续温育24~48
h。
5. 吸去完全DMEM/DNA/脂质体复合物,毎孔加入2 ml 新的DMEM-10完全培养液,
继续搵育24~48 h。
6. 收集细胞:用细胞刮于刮下细胞,或胰蛋白酶消化或冻融裂解细胞。
进行适当的表
达分析。
脂质体进行稳定表达。
脂质体转染mrna细胞原理

脂质体转染mrna细胞原理
脂质体转染mRNA细胞的原理是利用脂质体作为载体,将目的mRNA包裹在其内部,然后通过与细胞膜融合让mRNA进入细胞质,最终达到将目的mRNA表达出来的目的。
脂质体是由磷脂和胆固醇等组成的微小囊泡结构,与细胞膜结构相似。
其内部的疏水层可以容纳水溶性的物质,包括mRNA分子。
脂质体转染mRNA的步骤如下:
1. 准备目的mRNA:目的mRNA是指需要转染到细胞内进行表达的mRNA,可以是外源的mRNA,也可以是经过In vitro 转录合成的人工合成mRNA。
这些mRNA一般会在实验室中事先准备好。
2. 制备脂质体:将脂质体粉末或液体悬浮液溶解在适当的缓冲液中,形成脂质体溶液。
脂质体通过磷脂的双层结构来包裹mRNA,形成稳定的脂质体-mRNA复合物。
3. 混合脂质体与mRNA:将目的mRNA与脂质体溶液混合,并进行充分的混合和搅拌。
这样就可以使mRNA和脂质体发生相互作用,形成脂质体-mRNA复合物。
4. 转染细胞:将脂质体-mRNA复合物加入到需要转染的细胞培养液中,使其与细胞接触。
脂质体复合物会与细胞膜融合,从而使脂质体内的mRNA进入细胞质。
5. mRAN转录和表达:在细胞质中,脂质体释放的mRNA会
被细胞的核糖体识别,进而进行mRNA转录和翻译,最终使
该mRNA编码的蛋白质在细胞内得到表达。
脂质体作为转染载体具有一定的优势,如制备简单、生物相容性好等。
但是,脂质体转染也存在一些问题,如转染效率较低、引起细胞毒性等。
因此,在实际应用中需对转染条件进行优化,以提高转染效率和减少毒性。
脂质体转染原理及操作步骤

脂质体转染原理及操作步骤脂质体转染是一种常用的基因传递技术,用于将外源的核酸(例如DNA、RNA)转入细胞内。
脂质体是由人工合成的类似于细胞膜的双层脂质膜组成,具有较好的生物相容性和可降解性,因此可以用来包裹并传递外源核酸进入目标细胞内。
本文将详细介绍脂质体转染的原理和操作步骤。
脂质体由两个疏水性脂质尾部和一个亲水性脂质头部组成,形成类似生物细胞膜的双层结构。
这种双层结构使得脂质体可以包裹水溶性的外源核酸,并形成脂质体-核酸复合物。
当复合物与细胞膜接触时,由于脂质体的类似性,这些复合物可以与细胞膜融合,并释放外源核酸进入细胞。
然而,简单地将脂质体-核酸复合物添加到细胞培养基中并不能有效地将外源核酸转入细胞内。
为了提高转染效率,常常需要使用电穿孔或钙磷共沉淀等方法,以增加细胞膜的通透性。
操作步骤:1.准备工作:-完整的脂质体转染试剂盒。
-DNA或RNA溶液。
-靶细胞。
-无菌操作条件下的实验室。
2.重组脂质体的合成:-按照试剂盒说明将脂质体复合物合成。
-使用无菌的工具和试剂。
3.核酸引物的制备:-将外源DNA或RNA与引物混合,使其形成核酸复合物。
4.细胞处理:-将培养皿中的细胞进行冲洗,去除培养基。
-将适量的细胞培养基添加到培养皿中,以保证细胞的正常生长。
5.导入核酸:-将所制备的核酸复合物滴加到细胞培养基中。
-将细胞培养皿置于无菌环境中,以便细胞吸收和利用核酸。
6.细胞培养:-按照细胞类型和所使用的培养基,将细胞置于恰当的培养条件下,并进行培养。
-根据需求添加所需要的生长因子和抗生素。
7.观察和分析:-在一定的培养时间后,观察细胞是否发生了显著的变化。
- 使用适当的实验方法(如PCR、Western blot等)检测外源基因的表达。
-观察并记录实验结果。
以上是脂质体转染的原理和操作步骤。
脂质体转染是目前常用的基因传递技术之一,可以用于研究基因功能、疾病治疗等领域。
随着技术的不断发展,转染效率和特异性将逐渐提高,为研究和治疗带来更多的机会和挑战。
脂质体转染原理及操作步骤

脂质体转染原理及操作步骤
脂质体转染是一种常用的基因传递方法,通过将目标基因以及负载该基因的脂质体添加到细胞培养物中,使其与细胞膜融合,并将基因导入到细胞内。
脂质体转染的操作步骤如下:
1. 提取脂质体:首先,从脱脂牛奶或其它来源中提取脂质体。
可以通过超声处理、离心等方法将脂质体分离出来。
2. 混合目标基因与脂质体:将目标基因与脂质体混合,目标基因可以是质粒DNA、RNA等。
将基因加入脂质体溶液中,进
行充分混合。
3. 孵育:将脂质体-基因混合物在室温下孵育一段时间,通常
为15-30分钟。
这一步主要是让脂质体与基因充分结合。
4. 加入细胞:将孵育好的脂质体-基因混合物加入需要转染的
细胞培养物中。
细胞种类可以是哺乳动物细胞、脊椎动物细胞、细菌等。
5. 孵育细胞:将细胞培养物保持在适宜的培养条件下,孵育一定时间,让细胞充分吸收脂质体-基因复合物。
6. 收获转染细胞:经过一定时间的孵育后,可从培养物中收获转染细胞。
可以根据实验需要进行后续分析。
需要注意的是,脂质体转染的效率与脂质体组分、浓度、孵育时间、细胞类型等因素密切相关,需要进行参数优化才能达到较高的转染效果。
细胞的脂质体转染法和电穿孔法

细胞的脂质体转染法和电穿孔转染法(一)脂质体转染一、实验试剂及器材Lipofectamine® 3000 Transfection Reagent,质粒DNA(0.5-5 μg/μL储液),Opti-MEM®减血清培养基,培养板,酒精灯,离心机,微量移液器,离心管等。
二、实验步骤1. 接种细胞至70-90%汇合度时转染;2. 使用Opti-MEM®减血清培养基稀释Lipofectamine® 3000试剂(2管),充分混匀(6孔板Opti-MEM®培养基为125 μL× 2,Lipofectamine® 3000为3.75和7.5 μL);3. 在每管已稀释的Lipofectamine® 3000试剂中加入稀释的DNA(用P3000TM试剂稀释)(1:1比例);4. 室温孵育5分钟;5. 加入DNA-脂质体复合物至细胞中;6. 37°C(PK-15在39°C下培养)孵育细胞2–4天,然后分析转染细胞。
三、注意事项1. 在无血清培养基(如Opti-MEM®减血清培养基)中制备DNA-Lipofectamine® 3000脂质体复合物,直接将其加入含细胞培养基的细胞中(在血清/抗生素存在或不存在时均可);2. 转染后无需去除转染复合物或者更换/添加培养基;3. Lipofectamine® 3000试剂用量各有不同,测试推荐的两种浓度的Lipofectamine® 3000试剂,以确定最佳用量,开始新的转染;4. Lipofectamine® 3000试剂应放在4℃储存(切勿冷冻)。
附上Lipofectamine 3000 REagent Protocol:(二)电穿孔转染法一、实验试剂及器材BTX ECM2001®2001细胞电融合仪,细胞,胰蛋白酶,电转液,DMEM,培养板,离心机等。
脂质体介导转染法的原理与应用

68 7
4
Be sD a T d  ̄ u o. 0 1 2 8 47 l0 A t  ̄ns l n 120 .2( ):5 。
4 63
1 脂 质 体 的 组 成 和 制 备 . 1 1 组 成 脂 质 体 的 脂 类 . 现 有 的商 业 化
脂质 体 均 为 阳离 子脂 类 与 中性 脂 类 的 复 合 体 , Lp fcA N Lpfci 等 , 性 脂 如 ioetMIE、 ioet n 中 粪 多 为 二 油 酰 磷 脂 酰 乙 醇 胺 ( P 其 DO E) 中, 阳离子脂类 起 主要 作用 , 过静 电作用 与 通 D A形成 D A 脂 复 合 体 并 引 导 D A 进 入 N N 一 N 细胞 ; P DO E起 辅 助 作 用 . 定 脂 质 和 胞 内促 稳 D NA释 放 , 为 辅 助 脂 类 称 阳离子脂质 体 主要 分 3类 : 1 ( )人 工 合
关 键 词 : 质 体 ; 离 子 脂 质 体 ; 染 脂 阳 转 中 图分 类 号 : 8 3 Q 1
脂 胺 S 为 已知 的 唯 一 纯 天 然 的 脂 类 阳离 A,
子 脂 粪 根 据 所 转 的 细 胞 种 类 不 同 , 在 细 胞 存 选 择 问 题 , 可 能 与 细 胞 表 面差 异 有 关 这 12 脂 质 体 的 制 备 方 法 . 磷 脂 在 水 中 能 与 水 相 互 作 用 自发 形 成 脂 膜 , 此 制 备 脂 质 因 体 的 关 键 在 于 如 何 形 成 大 小 适 当 、 封 率 高 包 的 囊 泡 根 据 分 散 方 法 的 不 同 , 备 方 法 分 制 为 机 械 分 散 法 ( 手 摇 法 、 声 波 法 等 ) 钙 如 超 、 融 合 法 、 机 溶 液 分 散 法 、 相 蒸 发 法 、 污 有 反 去 剂法等 。制备 的主要 步骤 为 : 1 ( )将 脂 质 材 料溶于有 机相 中 , 一 定条件下 去除溶剂 , 在 使 脂 质 干 燥 形 成 薄 膜 : 2)使 脂 质 分 散 形 成 所 ( 需 大 小 的 囊 泡 ; 3)包 裹 D A; 4) 纯 化 脂 ( N ( 质 体 ;5 ( )转 染 : 为 了 获 得 满 意 的 脂 质 体 , 需 要 综 合 利 用 上 述 方 法 手 摇 法 形 成 的 脂 质 体 是 多 层 囊 泡 ML V ( llm l rvs l) 但 大 小 不 均 一 且 不 能 muta el ei e , i a c 保 护 D A免受核 酸酶 的降解 。 M V经 超 声 N L 波 处 理 则 变 为 小 的 单 层 囊 泡 (mal nlme— s lu i l a lrvs lsS V) U a ei e ,U 。S V体 积 小 , 裹 效 率 低 c 包 且 不 能 包 裹 较 大 分 子 量 的 核 酸 如 今 , 用 运
细胞的脂质体转染法和电穿孔法

细胞的脂质体转染法和电穿孔转染法(一)脂质体转染一、实验试剂及器材Lipofectamine® 3000 Transfection Reagent,质粒DNA(0.5-5 μg/μL储液),Opti-MEM®减血清培养基,培养板,酒精灯,离心机,微量移液器,离心管等。
二、实验步骤1. 接种细胞至70-90%汇合度时转染;2. 使用Opti-MEM®减血清培养基稀释Lipofectamine® 3000试剂(2管),充分混匀(6孔板Opti-MEM®培养基为125 μL× 2,Lipofectamine® 3000为3.75和7.5 μL);3. 在每管已稀释的Lipofectamine® 3000试剂中加入稀释的DNA(用P3000TM试剂稀释)(1:1比例);4. 室温孵育5分钟;5. 加入DNA-脂质体复合物至细胞中;6. 37°C(PK-15在39°C下培养)孵育细胞2–4天,然后分析转染细胞。
三、注意事项1. 在无血清培养基(如Opti-MEM®减血清培养基)中制备DNA-Lipofectamine® 3000脂质体复合物,直接将其加入含细胞培养基的细胞中(在血清/抗生素存在或不存在时均可);2. 转染后无需去除转染复合物或者更换/添加培养基;3. Lipofectamine® 3000试剂用量各有不同,测试推荐的两种浓度的Lipofectamine® 3000试剂,以确定最佳用量,开始新的转染;4. Lipofectamine® 3000试剂应放在4℃储存(切勿冷冻)。
附上Lipofectamine 3000 REagent Protocol:(二)电穿孔转染法一、实验试剂及器材BTX ECM2001®2001细胞电融合仪,细胞,胰蛋白酶,电转液,DMEM,培养板,离心机等。
细胞转染

1、转染前一天,3.0×105-8.0×105 个/ml细胞接种于 35mm底部含有盖玻片的培养皿培养,加入1mlRPMI 1640 含血清,使其在24小时内使细胞汇合达到40-70%(汇合过 分,转染后不利筛选细胞); 2、转染液制备:在1.5mlEP管中制备以下两液:A液:用无 血清培养基稀释4μg DNA,终量250μL;B液:用250μL无 血清培养基稀释10μl脂质体试剂,轻轻混匀,室温放置5 分钟(注意:无血清中不含双抗,因为抗生素会在穿透的 细胞中积累毒素); 3、混合A、B液,轻轻混匀,室温放置30分钟,以便形成 DNA / 脂质体复合物;
【实验用品】
1、仪器和用品:37℃、5%CO2的加湿培养箱、35mm的 细胞培养皿、 载玻片、盖玻片、弯头镊子。 2、材料:呈指数生长的真核细胞HO-8910PM(贴壁细胞)。 3、试剂 1)RPMI 1640含血清培养基 2)质粒载体DNA带GFP(绿色荧光蛋白)基因。 3)转染试剂:阳离子试剂脂质体2000。 4)RPMI 1640无血清培养基不含青霉素、链霉素。
4.转染准备:用2mL无血清培养液漂洗两次细胞,再加 入1mL无血清培养液(注意:转染时切勿加血清,血清对 转染效率有很大影响); 5.将500μl DNA / 脂质体 复合物加到含有细胞和培养基的 培养皿中,来回轻柔摇晃细胞培养板,37℃温箱温育6~ 24小时,吸除无血清转染液,换入正常培养液继续培养; 6.转染24h后,取出盖玻片盖在载玻片上,使用荧光显微 镜观察计数表达绿色荧光蛋白的细胞,在明场中观察计数 同一视野中的总细胞数,计算转染效率。 转染细胞率=荧光蛋白表达细胞数/总细胞数×100%
实验八
脂质体介导转染实验
转染实验报告原理

一、引言转染实验是分子生物学和细胞生物学领域常用的技术之一,主要用于将外源DNA或RNA分子导入细胞内,使其在细胞内表达,从而研究基因功能、基因调控等生物学问题。
本文将详细阐述转染实验的原理,并探讨其在生物学研究中的应用。
二、转染实验原理1. 转染过程转染过程主要包括以下几个步骤:(1)外源DNA或RNA分子的制备:通过PCR、化学合成或克隆等方法获得目的基因,并将其克隆到表达载体或报告基因载体上。
(2)转染试剂的选择:根据细胞类型和实验需求,选择合适的转染试剂,如脂质体、聚合物、电穿孔等。
(3)转染操作:将外源DNA或RNA分子与转染试剂混合,加入细胞培养液中,在一定条件下使转染试剂与细胞膜接触,使外源DNA或RNA分子进入细胞内。
(4)基因表达:外源DNA或RNA分子进入细胞后,通过转录和翻译过程,使目的基因在细胞内表达。
2. 转染原理转染实验的原理主要包括以下几种:(1)脂质体介导的转染:脂质体是一种由磷脂分子组成的微小囊泡,具有生物相容性和靶向性。
将外源DNA或RNA分子与脂质体混合,通过脂质体与细胞膜的相互作用,使外源DNA或RNA分子进入细胞内。
(2)聚合物介导的转染:聚合物介导的转染是通过聚合物与细胞膜相互作用,使外源DNA或RNA分子进入细胞内。
常用的聚合物有聚乙二醇(PEG)、聚赖氨酸等。
(3)电穿孔转染:电穿孔转染是通过高电压脉冲使细胞膜产生短暂孔洞,使外源DNA或RNA分子进入细胞内。
三、转染实验应用1. 基因功能研究转染实验可用于研究基因功能,如:(1)基因敲除:通过转染短发夹RNA(shRNA)或siRNA,使目的基因表达沉默,研究基因在细胞功能中的作用。
(2)基因过表达:通过转染表达载体,使目的基因在细胞内过表达,研究基因在细胞功能中的作用。
2. 基因调控研究转染实验可用于研究基因调控,如:(1)启动子分析:通过转染报告基因载体,检测启动子活性,研究基因调控元件。
(2)转录因子功能研究:通过转染转录因子表达载体,研究转录因子对基因表达的影响。
脂质体的转染原理

脂质体的转染原理
脂质体是一种由脂质和溶剂组成的胶束结构,可以用于体外和体内的基因转染。
转染是指将外源基因导入目标细胞内的过程。
脂质体的转染原理基于脂质体与细胞膜之间的相互作用和脂质体内基因的释放。
转染过程中,首先将目标基因(如DNA或RNA)与脂质体包裹在一起,形成脂质体-基因复合物。
这些复合物通过静电相互作用、疏水相互作用和膜融合等方式与细胞膜结合。
一旦脂质体-基因复合物结合到细胞膜上,脂质体与细胞膜之间的相互作用促使脂质体通过了细胞膜。
一种可能的机制是脂质体与细胞膜之间形成一个小的膜破裂,从而使基因从脂质体中释放出来。
经过释放,目标基因便能进入到细胞质中,通过细胞内的各种机制被转录成RNA 或翻译成蛋白质。
总的来说,脂质体转染的原理是通过脂质体与细胞膜的相互作用、基因释放和细胞内过程,将外源基因导入到目标细胞中。
脂质体转染实验步骤和细胞转染技术总述

脂质体转染实验步骤和细胞转染技术总述
一、脂质体转染实验步骤
1)细胞处理:细胞培养,细胞脱落,细胞悬液浓缩;
2)添加脂质体:将DNA与相应脂质体混合,可以将DNA结合到脂质体上;
3)细胞接种:将脂质体/DNA混合物接种到细胞悬液中,使DNA能够被细胞吞噬;
4)转染放置:将接种混合物保持在室温静置一定的时间,从而使DNA能够被细胞吞噬;
5)细胞活化:在静置期间,DNA会被细胞内吞噬,当添加激活剂和营养培养基时,细胞会活化;
6)细胞培养:在细胞活化后,细胞会被培养,并进行观察,以评估DNA转染的效果;
7)细胞收集:在培养过程中,可以通过浓缩细胞悬液,将转染后的细胞收集起来,以便进行其他分析。
细胞转染是将外源DNA片段转染到细胞中,从而改变其基因表达的技术。
目前常用的细胞转染技术有电转染、磁珠转染、质粒转染、脂质体转染等。
1)电转染
电染是一种最常用的染技术,即通过将DNA片段置于细胞悬液中,然后用微电流刺激,使DNA片段直接进入细胞。
转染步骤及经验(精华)

转染步骤及经验(精华)一、基础理论转染是将外源性基因导入细胞内的一种专门技术。
分类:物理介导方法:电穿孔法、显微注射和基因枪;化学介导方法:如经典的磷酸钙共沉淀法、脂质体转染方法、和多种阳离子物质介导的技术;生物介导方法:有较为原始的原生质体转染,和现在比较多见的各种病毒介导的转染技术。
理想细胞转染方法,应该具有转染效率高、细胞毒性小等优点。
病毒介导的转染技术,是目前转染效率最高的方法,同时具有细胞毒性很低的优势。
但是,病毒转染方法的准备程序复杂,常常对细胞类型有很强的选择性,在一般实验室中很难普及。
其它物理和化学介导的转染方法,则各有其特点。
需要指出的一点,无论采用哪种转染技术,要获得最优的转染结果,可能都需要对转染条件进行优化。
影响转染效率的因素很多,从细胞类型、细胞培养条件和细胞生长状态到转染方法的操作细节(见后文)。
二、转染操作流程(以常用的6孔板为例)(1) 细胞培养:取6孔培养板,以3x104/cm2密度铺板,37℃5%CO2培养箱中培养至70%~90%汇合。
(不同细胞略有不同,根据实验室优化的条件进行,汇合过分,转染后不利筛选细胞)。
(2) 转染液制备:在EP管中制备以下两液(为转染每一个孔细胞所用的量)A液:用不含血清培养基稀释1-10μg DNA,终量100μL,B液:用不含血清培养基稀释对应量的转染试剂,终量100μL;轻轻混合A、B液(1:1混匀),室温中置15分钟,稍后会出现微浊现象,但并不妨碍转染。
(3) 转染准备:用2mL不含血清培养液漂洗两次,再加入2mL不含血清及PS的培养液。
(4) 转染:把A/B复合物缓缓加入培养液中(缓慢滴加),轻轻摇匀,37℃温箱置6~8小时,吸除无血清转染液,换入正常培养液继续培养。
三、转染注意事项1. 血清A. DNA-阳离子脂质体复合物形成时不能含血清,因为血清会影响复合物的形成。
B.一般细胞对无血清培养可以耐受几个小时没问题,转染用的培养液可以含血清也可以不加,但血清一度曾被认为会降低转染效率,转染培养基中加入血清需要对条件进行优化。
脂质体转染原理

脂质体是磷脂分散在水中时形成的脂质双分子层,又称为人工生物膜。
最初,人们只是运用脂质体模拟生物膜,研究膜的构造及功能,从而发现了膜的融合及内吞作用,因而可用作外源物质进入细胞的载体
阳离子脂质体表面带正电荷,能与核酸的磷酸根通过静电作用将DNA分子包裹人内,形成DNA一脂复合体,也能被表面带负电荷的细胞膜吸附,再通过膜的融合或细胞的内吞作用,偶尔也通过直接渗透作用,将DNA传递进入细胞,形成包涵体或进入溶酶体其中一小部分DNA能从包涵体内释放,并进入细胞质中,再进一步进入核内转录、表达。
可以不换无血清的培养基,只要用无血清的培养基配质粒DNA稀释液和脂质体稀释液即可,一定混匀并注意孵育时间,然后再加到含血清的细胞培养基中混匀就行了。
这是先铺板待细胞贴壁并汇合到一定程度的转染方式。
另外,对于有些细胞,也可以同时转染,即将孵育好的DNA和脂质体混合液(用无血清培养基稀释)加入消化下的细胞悬液,混匀再铺板即可。
通常来讲,后者的转染效率不如前者高,但对于一些应用此方法转染效率比较高的细胞而言,能节省些时间。
还有一点需要注意的是,无论上述那种转染方法,都要注意一个脂质体毒性的问题,说明书中建议在转染4-6 h换去转染培养基并不会影响转染效率,这点因细胞而异。
说明书建议用无血清培养基的原因主要是因为血清中会有DNase和RNase. 尤其对于RNA 的转染,更加要注意降解问题. 所以我觉得对于一般的DNA质粒转染, 但是我觉得如果要是担心降解尤其是RNA降解的话,还是用无血清培养基要安全些.。
贴壁细胞的脂质体转染protocol

一、实验材料1、宿主细胞CHO(贴壁细胞)2、脂质体LIPOFECTAMINE 2000(invitrogen公司)3、6孔细胞培养版4、无血清培养基OPTI-MEM(GIBICO)5、转染级质粒二、实验步骤invitrogen的LIPOFECTAMINE 2000说明书上列举了24孔、12孔、6孔......板的实验体系,因为需要转染的细胞量大,所以一直采用的是6孔版做的转染。
以下是以6孔板为例说明一下我的体系和方法吧!1、转染前一天,以合适的细胞密度接种到6孔培养板上。
(我的接种密度是3~4*105/ml.)转染时,细胞要达到90~95%的融合。
2、溶液1:240ul 无血清培养基+ 10 ul lipofectamine 2000 per well (总体积250 ul)(温育5min)3、溶液2:X ul 无血清培养基+ 4 ug 质粒per well(总体积250 ul)4、将溶液1与溶液2混合,室温下置20min。
5、与此同时,将6孔板中的细胞用无血清培养基冲洗细胞两遍后,加入2ml 无血清培养基。
6、将溶液1与溶液2的混合液逐滴加入孔中,摇动培养板,轻轻混匀。
在37℃,5%的CO2中保温5~6小时。
7、6小时后,更换含有血清的全培养基,在37℃,5%的CO2中48~72h检测转染水平。
8、如果做稳定转染,换全培养基培养后24h,即可以1:10或更高的稀释比例(根据细胞的生长情况)接种到新的培养板,加抗生素进行筛选。
三、个人经验:我觉得贴壁细胞的脂质体转染还是很容易的,有了经验之后,现在做转染得心应手,转染前后细胞的形态几乎不发生变化,几乎没有细胞死亡。
转染率很高。
以下是个人经验,与大家分享。
1.细胞的状态。
这点非常重要,不要急于求成,一定要让细胞处于最佳的生长状态再做。
有文献说传代不要超过17代。
我总是在细胞复苏后的3代左右做,那时细胞状态最好,不要用传了很多代的细胞去做,细胞的形态都会发生变化了。
转染技术2

pcDNA3.1-GFP转染细胞实验2009年08月07日09时21分55秒来源:未知浏览:286次【原理】外源基因进入细胞主要有三种方法:电击法、磷酸钙法和脂质体介导法,实际上其基本原理都是利用不同的方法在细胞上短时间暂时性的穿孔让外源质粒进入,但是由于前两者的效率低且伤害较大,所以现在除了对于一些特殊细胞系,一般的转染方法都利用脂质体。
利用脂质体转染和其他方法一样,最重要的就是防治其毒性,因此脂质体与治理的比例,细胞密度以及转染的时间长短和培养基中血清的含量都是影响转染效率的重要问题,通过实验摸索的合适转染条件对于效率的提高有巨大的作用。
图所示是脂质体介导转染的示意图,它显示了外源质粒进入细胞的一般过程。
本实验学习和掌握外源基因导入真核细胞的主要方法—脂质体介导的转染。
了解外源基因进入的一般性方法,观测外源蛋白的表达(绿色荧光蛋白)。
【试剂与仪器】1 .小牛血清。
2 .双抗溶液(链霉素100μg+ 青霉素100 单位)。
3 .DMEM 培养基。
4 .转染试剂(LIPOFECTAMINE 2000 )。
5 .细胞培养基(DMEM+10%NCS )。
6 .PBS 。
7 .无血清培养基。
8 .胰酶(Trypsin )。
9 .培养皿,移液管,量筒,恒温水浴箱,离心机,15ml 离心管,微量移液器,荧光显微镜和CCD 。
【操作步骤】1 .转染前一天,胰酶消化细胞并计数,细胞铺板,使其在转染日密度为90% 。
细胞铺板在0.5ml 含血清,不含抗生素的正常生长的培养基中(参见表6 了解建议的细胞密度)。
2. 对于每孔细胞,使用50μl 无血清DMEM 培养基稀释0.8μg-1.0μg DNA 。
多孔操作可以批量制备。
3. 对于每孔细胞,使用50μl DMEM 培养基稀释1μl-3μl LIPOFECTAMINE 2000 试剂。
LIPOFECTAMINE 2000 稀释后,在5 分钟内同稀释的DNA 混合。
脂质体转染操作步骤

脂质体转染操作步骤
(一)准备材料
1.质粒:一般是由受体细胞胞浆抽提的质粒,其中含有DNA操纵因子、胞质蛋白等;
2.抗体:主要由混合物或单一蛋白质组成,用于鉴定质粒抗原性以及
抑制免疫反应;
3.细胞培养液:一般为包含细胞培养基和生长因子的混合物;
4.转染试剂:也称转染缓冲液,主要由多种物质,如阿拉伯胞浆清酯、卡夫培糖、酚红、多数体核酸等组成,用于载体细胞的传感和质粒的迁移。
(二)脂质体转染操作
1.取出细胞培养液,将受体细胞倒入培养管中,用浓度为0.25%(体
积比)的牛血清添加至8-10%,以细胞膜生长抗性抑制剂(如抗生素或吲
哚美辛)等抑制细胞膜的分裂,加以培养;
2.将培养液中的受体细胞的数量控制在2×105/ml以上,用酚酞红法
检测,检测结果达到要求后,把受体细胞从培养管中放入6 ml的离心管中,进行6000 g的离心;
3.将离心液放入新的容器中,把细胞抽出,再加入细胞稀释缓冲液
(以PBS或缓冲液为主,加入百维素或多数体核酸)至1×106/ml,离心5000 g;
4.将离心液抽出,用转染试剂缓冲液把细胞洗涤,再分别加入DNase I, 抗体和质粒,放入摇床中。
脂质体转染大鼠肝星状细胞的实验研究

脂质体转染大鼠肝星状细胞的实验研究脂质体转染是一种将外源DNA载体转移至细胞内的有效方法。
其中,脂质体是由生物学脂质制成的小泡,具有高度结构特异性和稳定性。
通过脂质体转染,可以将外源DNA导入到目标细胞中,从而实现基因编辑和基因治疗等一系列研究和应用。
肝星状细胞是肝脏中的一类非常重要的细胞。
它们发挥着肝脏的清除、免疫和代谢功能。
因此,研究肝星状细胞的生物学特性和功能,对于深入了解肝脏病理生理以及开发肝脏相关药物具有重要意义。
而脂质体转染在肝星状细胞研究中应用广泛,被认为是一种较为有效的基因传递技术。
一般情况下,脂质体转染是采用包涵或表达目的基因的质粒载体作为DNA源,经过和脂质体混合后,形成复合材料。
这些复合材料可以在一定条件下穿越细胞膜,进入到内部细胞器中,从而实现对外源基因的转染。
而对于肝星状细胞而言,脂质体转染更多地是应用于RNAi技术及基因敲除的研究中。
例如,研究人员利用脂质体转染技术,针对肝星状细胞中TGF-β的表达,通过RNAi技术敲除TGF-β,从而实现降低炎症水平、增加肝星状细胞凋亡等多种效应。
又如,使用脂质体转染载体对肝星状细胞PI3K基因进行敲除,发现可以降低细胞的增殖活性和生长抑制因子的表达。
此外,还有一些研究运用脂质体转染技术对肝星状细胞进行基因治疗方面的探索。
例如,通过CRISPR/Cas9技术对肝星状细胞进行PGC-1α基因编辑,从而发现可以降低肝脏脂肪生成等多种生理指标,并有望应用于肝脏疾病的治疗。
总的来说,脂质体转染技术在肝星状细胞研究中具有很高的应用价值。
它可以用于基因编辑和基因治疗等多种方面的探究,并有望为相关肝脏疾病的治疗带来革命性进展。
分子生物学实验课:8脂质体转染
ß-半乳糖苷酶(ß-gal)表达比较
转染试
LIPOFECTAMINE2000
剂家族
•提供对大多数细胞最高的转染活性
•在含血清时的效果无可匹敌
•对常用于蛋白表达的细胞系非常适合
•建议使用96孔板进行高通量应用
LIPOFECTAMINE PLUS
•对于多数贴壁细胞的转染效率较高
•使用方便,不需要对DNA和阳离子脂质体试剂的量进行优化
LIPOFECTIN •对内皮细胞的转染效率较高 •用于寡聚核苷酸的转染效果已证实
293FECTIN •专门针对293细胞的转染 •对293细胞的转染表现出最佳效果
图1. 使用LIPOFECTAMINE 2000获得高转染效率 细胞在含有血清的生长培养基中铺板,第2天使用LIPOFECTAMINE 2000在24孔板中 转染(BE(2)C细胞不使用血清)pCMV·SPORT-βgal。加入复合物后24小时使用X-gal 对细胞染色。根据LIPOFECTAMINE 2000剂量-反应曲线确定最佳点。
脂质体转染步骤
• 1.培养好的细胞接种24孔细胞孔板,37ቤተ መጻሕፍቲ ባይዱ的CO2培养箱培养,待细胞 密度为80~90%,约24h。
• 2. 待转染质粒与脂质体混合物制备: • A液:转染质粒0.8ug稀释至无血清F12培养基中50ul,混匀,室温放置
5min; • B液:脂质体2ul稀释至50ul无血清F12培养基中,混匀,室温放置5min; • A、B液混匀,室温放置30min,该混合液在30min~6h内稳定。 • 3. 取出细胞孔板,弃培养液,用hanks液洗涤2次,待用。 • 4. 到时间后,将混合物导入细胞中,加入0.4ml无血清DMEM培养基,
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
脂质体转染的实验原理与操作步骤大全
日期:2012-06-25 来源:互联网作者:青岚点击:3644次
摘要:
细胞转染的方法主要包括:电穿孔法、显微注射、基因枪、磷酸钙共沉淀法、脂质体转染法、多种阳离子物质介导、病毒介导的转染等, 理想的细胞转染方法是具有高转染效率、对细胞的毒性作用小等, 本文主要介绍细胞转染常用的方法 -脂质体转染的原理和操作步骤等。
找产品,上生物帮 >> >>
细胞转染的方法主要包括:电穿孔法、显微注射、基因枪、磷酸钙共沉淀法、脂质体转染法、多种阳离子物质介导、病毒介导的转染等, 理想的细胞转染方法是具有高转染效率、对细胞的毒性作用小等,本文主要介绍细胞转染常用的方法 -脂质体转染的原理和操作步骤等。
脂质体 (lipofectin regeant, LR 试剂是阳离子脂质体 N-[1-2, 3-Dioleyoxy , Propyl]-n, n , n-Trimethylammonium Chloride(DOTMA和 Dioleoyl photidye-thanolamine(DOPE的混合物 [1:1(w/w]。
它适用于把 DNA 转染入悬浮或贴壁培养细胞中 ,是目前条件下最方便的转染方法之一。
转染率高,优于磷酸钙法,比它高
5~100倍,能把 DNA 和 RNA 转染到各种细胞。
用 LR 进行转染时, 首先需优化转染条件, 应找出该批 LR 对转染某一特定细胞适合的用量、作用时间等,对每批 LR 都要做:第一,先要固定一个 DNA 的量和DNA/LR混合物与细胞相互作用的时间, DNA 可从1~5μg和孵育时间 6小时开始,按这两个参数绘出相应 LR 需用量的曲线,再选用 LR 和 DNA 两者最佳的剂量,确定出转染时间 (2~24小时。
因 LR 对细胞有一定的毒性,转染时间以不超过 24小时为宜。
细胞种类:COS-7、 BHK 、 NIH3T3、 Hela 和 Jurkat 等任何一种细胞均可作为受体细胞。
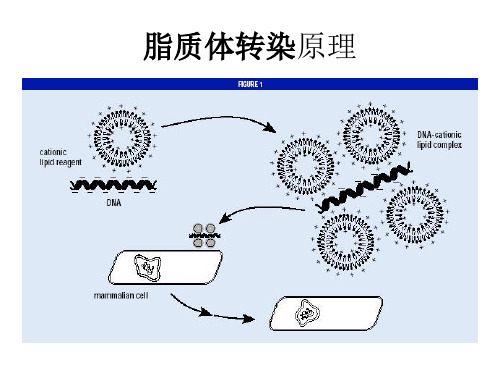
一、脂质体 (liposome转染方法原理
脂质体 (liposome转染方法原理:脂质体 ((Iiposome作为体内和体外输送载体的工具, 已经研究的十分广泛,用合成的阳离子脂类包裹 DNA ,同样可以通过融合而进人细胞。
使用脂质体将 DNA 带人不同类型的真核细胞 ,与其它方法相比,有较高的效率和较好的重复性。
中性脂质体是利用脂质膜包裹 DNA ,借助脂质膜将 DNA 导入细胞膜内。
带正电的阳离子脂质体, DNA 并没有预先包埋在脂质体中,而是带负电的 DNA 自动结合到带正电的脂质体上,形成 DNA-阳离子脂质体复合物,从而吸附到带负电的细胞膜表面,经过内吞被导入细胞。
二、脂质体转染操作步骤
1、操作步骤 [方法一 ]:
(1细胞培养:取 6孔培养板 (或用 35mm 培养皿 ,向每孔中加入 2mL 含 1~2×105个细胞培养液, 37℃ CO2培养至 40%~60%汇合时 (汇合过分,转染后不利筛选细胞。
(2 转染液制备:在聚苯乙稀管中制备以下两液 (为转染每一个孔细胞所用的量 A 液:用不含血清培养基稀释 1-10μg DNA, 终量100μL, B 液:用不含血清培养基稀释 2-50μgLR, 终量100μL,轻轻混合 A 、 B 液,室温中置 10-15分钟 ,稍后会出现微浊现象,但并不妨碍转染 (如出现沉淀可能因 LR 或 DNA 浓度过高所致,应酌情减量。
(3转染准备:用 2mL 不含血清培养液漂洗两次,再加入 1mL 不含血清培养液。
(4转染:把 A/B复合物缓缓加入培养液中,摇匀, 37℃温箱置 6~24小时,吸除无血清转染液,换入正常培养液继续培养。
(5其余处理如观察、筛选、检测等与其它转染法相同。
注意:转染时切勿加血清,血清对转染效率有很大影响。
2、快速脂质体转染法操作步骤如下 [方法二 ]:
(1以 5×105细胞 /孔接种 6孔板 (或 35mm 培养皿培养 24小时,使其达到
50~60%板底面积。
(2在试管中配制 DNA/脂质体复合物方法如下:
①在 1mL 无血清 DMEM 中稀释 PSV2-neo 质粒 DNA 或供体 DNA 。
②旋转 1秒钟,再加入脂质体悬液,旋转。
③室温下放置 5~10分钟,使 DNA 结合在脂质体上。
(3弃去细胞中的旧液, 用 1mL 无血清 DMEM 洗细胞一次后弃去 ,向每孔中直接加入 1mL DNA/脂质体复合物, 37℃培养 3~5小时。
(4再于每孔中加入 20%FCS的 DMEM ,继续培养 14~24小时 ,
(5吸出 DMEM/DNA/脂质体混合物加入新鲜 10%FCS的 DMEM , 2mL/孔,再培养 24~48小时。
(6用细胞刮或消化法收集细胞,以备分析鉴定。
3、稳定的脂质体转染方法如下:
(1接种细胞同前,细胞长至 50%板底面积可用于转染。
(2DNA/脂质体复合物制备转染细胞同前 (2、 (3步骤。
(3在每孔中加入 1mL 、 20%FCS的 DMEM , 37℃培养 48小时。
(4吸出 DMEM , 用 G418选择培养液稀释细胞, 使细胞生长一定时间, 筛选转染克隆, 方法参照细胞克隆筛选法进行。
三、个人经验:
本人用的是 Invitrogen 公司的 Lipofectamine2000在 24孔板转染单层贴壁细
胞。
(别的方法可以参考生产商提供的 protocol
1、转染前 1天将 0.5~2×105细胞接种于 24孔培养板, 并加入 500ul 不含抗生
素的完全培养基,以保证转染时细胞汇合达 90~95%。
2、准备复合物
(1 将 0.8ug DNA稀释于 50ul 无血清无抗生素的培养液中轻轻浑匀。
(2 将 2ul Lipofectamine2000稀释于 50ul 无血清无抗生素的培养液中, 轻轻浑匀, 室温孵育 5分。
注意:必须在 25分内进行。
(3 5分后将它们混合,并轻轻浑匀,室温孵育 20分。
3、吸去培养板的培养基,用 PBS 或无血清培养基 (最好清洗细胞 2次。
4、将复合物 (总体积 100ul 加入培养孔,前后摇动培养板使其分布均匀。
5、将细胞放入培养箱孵育 4~6h 后,可以更换含血清培养液去除复合物 (也可不用。
6、 24~48h 后可以观察转入基因表达情况。
7、稳定转染:换含血清培养基 24h 后将细胞以 1:10(或更高比例传代, 1天后更换筛选培养基筛选。
8、优化:要保证细胞汇合率达 90~95%(比较高 ;DNA/ Lipofectamine2000比率 1: 0.5~1:5,一般细胞 1:2~3.
脂质体转染法的主要优点是可用将 DNA 转染至悬浮或者铁壁细胞培养、转染效率相对较高、对基因片段大小的限制较小等,但是
阳离子脂质体对细胞的毒性相对较高,为了防止其毒性,要摸索好如下实验条件:脂质体与质粒的比例、细胞转染时间等。
脂质体是由脂双分子层组成的颗粒, 可介导基因穿过细胞膜。
通过脂质体介导比利用病毒转导进行基因转移具有以下明显的优势:①脂质体与基因的复合过程
比较容易; ②易于大量生产; ③脂质体是非病毒性载体, 与细胞膜融合将目的基因导入细胞后, 脂质即被降解, 无毒, 无免疫原性; ④DNA 或 RNA 可得到保护, 不被灭活或被核酸酶降解; ⑤脂质体携带的基因可能转运至特定部位; ⑥体外和体内试验都表明,接近染色体大小的 DNA 片段也能被转运至宿主基因组中并增
长;⑦转染过程方便易行,重现性好。
脂质体是具有双层膜的封闭式粒子,自身聚集性脂类分子包封内水相介质, 可分为大、小多层, 寡多层和单室脂质体,医学应用较多为小单室脂质体。
基于脂质体作为药物载体系统的经验,理想的用于转运基因的脂质体,对于质粒 DNA 具有高包封率 , 保护 DNA 不被血浆核酶降解的特点, 它们粒径分布范围窄, 粒径平均为 100 nm或者更小。
为使脂质体接近血管外区域,故采用具有广泛的结合潜力脂类,这种特殊脂类可促进与细胞膜融合和 /或提高脂质体在循环系统中的
稳定性。
第 1种为传统上的脂质体, 人们可控制其体外行为, 但不能控制其体内行为,它们很快被灭活或被固定;第 2种为无活性脂质体(即不与外界作用, 由于聚合物包封于表面的立体稳定性而抑制其相互作用; 第 3种脂质体表面结合抗原、凝集素或其他基团,由于表面结合的特定配基,也可特定地相互作用;第 4种为反应活性脂质体,如离子型、靶敏感型和融合性脂质体,这种脂质体有时指相转变的多孔脂质体, 脂质体内有离子敏感亚基, Ca2+ 其他金属离子敏感性脂质体, 也包括阳离子脂质体, 阴离子脂质体。
阴离子脂质体不属于有反应活性类,但特殊的试验如试管内与相反电荷(多离子相互作用例子除外。
常规脂质体进入细胞转运 DNA 实验, 其原理是脂质体增强细胞体的聚集, 即加速大分子、荷电多的分子透过膜,该过程相当复杂,尤其在包封较大片段时, 在实践中这种技术只在体外使用且要用融合剂,荷电越多用途越少。
脂质体可用于转基因, 或制备的药物, 利用脂质体可以和细胞膜融合的特点, 将药物送入细胞内部。
