高中化学从自然界中获取铁和铜4 苏教版
2017-2018学年高中化学三维设计江苏专版必修一讲义:专题3 第二单元 第一课时 从自然界获取铁和铜

铁、铜的冶炼1.铁、铜的存在铁、铜在自然界中主要以化合态的形式存在。
(1)铁矿有磁铁矿(主要成分为Fe 3O 4)、赤铁矿(主要成分为Fe 2O 3)等。
(2)铜矿有黄铜矿(主要成分为CuFeS 2)、孔雀石[主要成分为CuCO 3·Cu(OH)2]等。
2.铁、铜的早期获取人们最早利用的单质铁和单质铜均直接来自于自然界。
所不同的是铁单质只存在于从天而降的陨铁中,所以古代人称铁为“天石”,而铜则来自于地球上自然存在的少量单质铜。
3.铁的冶炼 (1)设备:炼铁高炉。
(2)原料:铁矿石、焦炭、空气、石灰石等。
(3)主要反应①还原剂的生成。
a.生成CO 2:C +O 2高温,CO 2, b 生成CO :CO 2+C 高温,2CO 。
②铁的生成:Fe 2O 3+3CO 高温,2Fe +3CO 2。
③炉渣的形成:a.CaCO 3高温,CaO +CO 2, b .CaO +SiO 2高温,CaSiO 3。
[特别提醒]使用炼铁高炉得到的是含碳2%~4.5%的生铁,生铁经过进一步冶炼,包括降碳,调硅锰,除硫、磷,得到含碳量0.03%~2%的钢。
4.炼铜(1)工业炼铜:工业上采用高温冶炼黄铜矿(主要成分为CuFeS 2)的方法得到铜。
黄铜矿――→还原剂高温冰铜―→粗铜(含Ag 、Au 、Fe 、Zn 等杂质)――→电解精炼精铜 (2)生物炼铜(矿堆浸铜法)①原理:CuS ――→细菌O2CuSO 4――→FeCu 。
②特点:成本低、污染小、反应条件简单等。
1.高炉炼铁的生产中,下列说法正确的是( ) A .焦炭和一氧化碳都是还原剂 B .采用富氧空气可以得到纯铁C.加石灰石的目的主要是为了得到CO2D.用于冶炼生铁的矿石主要有磁铁矿、赤铁矿和黄铁矿2.回答下列关于高炉炼铁的问题:(1)炼铁的原料有______________________________________________________。
苏教版高中化学必修一课件专题3第二单元铁、铜的获取及应用课件第一课时(40张)

专题3 从矿物到基础材料
(2)第二步:金属的冶炼。利用氧化还原反 应的原理,在一定条件下,用还原剂把金属 矿物中的金属离子还原为金属单质的过程。 主要的方法有电解法、热还原法、热分解法 等。 (3)第三步:金属的精炼。采用适当的方法 提炼出纯金属。我们可用电解的方法提炼金 属铜等。
栏目 导引
0.2 mol FeO→14.4 g
0.2 3
mol Fe2O3→10.67 g
0.2
4
mol Fe3O4→11.6 g
该氧化物可能是 Fe3O4,也可能是由 Fe2O3 和 FeO 组成的混合物。栏目 Βιβλιοθήκη 引专题3 从矿物到基础材料
金属的冶炼
探究导引 欲从金属化合物中获取金属单质,需采取什 么措施? 提示:金属化合物(MXn)中金属元素(M)一 定显正价,欲将其转化成单质必须利用比该 金属还原性强的还原剂将其还原出来或利用 电解(最强的氧化还原手段)的方法获得。
―高―温→
灼烧
粗铜含Ag、 Au、Fe、Zn等
―电―解→
精炼
精铜纯度 99.95%~99.98%
栏目 导引
专题3 从矿物到基础材料
(2)生物炼铜(矿堆浸铜法) ①原理:CuS―细―O菌2→___C__u_S_O__4 ___ ――Fe→Cu ②特点:成本低、污染小、反应条件简单等。 (3)湿法炼铜:_F__e_+__C_u_S__O_4_=_=_=_F__e_S_O_4_+__C__u_。
栏目 导引
专题3 从矿物到基础材料
存在 金属
铁
自然界中的存在状 常见矿石及主要成
态
分
①主要以_化__合__态__形 式存在②铁单质只
存在于陨铁中
苏教版高中化学电子课本下载

苏教版高中化学电子课本下载篇一:高中化学教材目录--苏教版高中化学--苏教版目录? 必修1专题一化学家眼中的物质世界第一单元丰富多彩的化学物质第二单元研究物质的实验方法第三单元人类对原子结构的认识专题二从海水中获得的化学物质第一单元氯、溴、碘及其化合物第二单元钠、镁及其化合物专题三从矿物到基础材料第一单元从铝土矿到铝合金第二单元铁、铜的获取及应用第三单元含硅矿物与信息材料专题四硫、氮和可持续发展第一单元含硫化合物的性质和应用第二单元生产生活中的含氮化合物附录一相对原子质量表附录二常见酸、碱和盐的溶解性表(20?) 附录三中英文名词对照表元素周期表高中化学--苏教版目录? 必修21专题一微观结构与物质多样性第一单元原子核外电子排布与元素周期律第二单元微粒之间的相互作用力第三单元从微观结构看物质多样性专题二化学反应与能量转化第一单元化学反应速率与反应限度第二单元化学反应中的热量第三单元化学能与电能的转化第四单元太阳能、生物质能和氢能的利用专题三有机化合物的获得与应用第一单元化石燃料与有机化合物第二单元食品中的有机化合物第三单元人工合成有机化合物专题四化学科学与人类文明第一单元化学是认识和创造物质的科学第二单元化学是社会可持续发展的基础附录一相对原子质量表附录二中英文名词对照表元素周期表高中化学--苏教版目录? 选修1 化学与生活专题一洁净安全的生存环境第一单元空气质量的改善第二单元水资源的合理利用第三单元生活垃圾的分类处理第四单元化学品的安全使用专题二营养均衡与人体健康第一单元提取人体必需的化学元素第二单元提供能量与营养的食物第三单元优化食物品质的添加剂第四单元造福人类的化学药物专题三丰富多彩的生活材料2第一单元应用广泛的金属材料第二单元功能各异的无机非金属材料第三单元高分子材料和复合材料附录中英文名词对照表附录一相对原子质量表附录二常见酸、碱和盐的溶解性表(20?)附录三生活饮用水水质标准附录四人体内常量元素和微量元素的含量附录五一些食物中的营养素含量附录六常见的食品添加剂附录七一些合成纤维的组成及特点元素周期表高中化学--苏教版目录? 选修2化学与技术专题一多样化的水处理技术第一单元水的净化与污水处理第二单元硬水软化第三单元海水淡化专题二从自然资源到化学品第一单元氨的合成第二单元氯碱生产第三单元硫酸工业第四单元镁和铝的冶炼专题三让有机反应为人类造福第一单元有机药物制备第二单元合成洗涤剂的生产第三单元纤维素的化学加工第四单元有机高分子合成专题四材料加工与性能优化专题五为现代农业技术添翼专题六从污染防治到绿色化学附录一中英文名词对照表元素周期表3高中化学--苏教版目录? 选修3物质结构与性质专题一揭示物质结构的奥秘专题二原子结构与元素的性质第一单元原子核外电子的运动第二单元元素性质的递变规律专题三微粒间作用力与物质性质第一单元金属键金属晶体第二单元离子键离子晶体第三单元共价键原子晶体第四单元分子间作用力分子晶体专题四分子空间结构与物质性质第一单元分子结构与物质的性质第二单元配合物的形成和应用专题五物质结构的探索无止境附录一中英文名词对照表元素周期表高中化学--苏教版目录? 选修4化学反应原理专题一化学反应与能量变化第一单元化学反应中的热效应第二单元化学能与电能的转化第三单元金属的腐蚀与防护专题二化学反应速率与化学平衡第一单元化学反应速率第二单元化学反应的方向和限度第三单元化学平衡的移动专题三溶液中的离子反应4第一单元弱电解质的电离平衡第二单元溶液的酸碱性第三单元盐类的水解第四单元难溶电解质的沉淀溶解平衡附录一中英文名词对照表附录二常见酸、碱和盐的溶解性表(20?) 附录三难溶电解质的溶度积常数(25?)附录四弱电解质在水中的电离平衡常数(25?) 元素周期表高中化学--苏教版目录? 选修5有机化学基础专题一认识有机化合物第一单元有机化学的发展与应用第二单元科学家怎样研究有机物专题二有机物的结构与分类第一单元有机化合物的结构第二单元有机化合物的分类与命名专题三常见的烃第一单元脂肪烃第二单元芳香烃专题四烃的衍生物第一单元卤代烃第二单元醇酚第三单元醛羧酸专题五生命活动的物质基础第一单元糖类油脂第二单元氨基酸蛋白质核酸附录一中英文名词对5照表元素周期表高中化学--苏教版目录? 选修6实验化学专题一物质的分离与提纯课题1 海带中碘元素的分离及检验拓展课题1-1 茶叶中某些元素的鉴定课题2 用纸层析法分离铁离子和铜离子拓展课题1-2 菠菜的叶绿体中色素的提取和分离拓展课题1-3 用粉笔进行层析分离课题3 硝酸钾晶体的制备拓展课题1-4 粗盐的提纯专题二物质性质的研究课题1 铝及其化合物的性质拓展课题2-1 铝热反应课题2 乙醇和苯酚的性质拓展课题2-2 苯酚与甲醛的反应专题三物质的检验与鉴别课题1 牙膏和火柴头中某些成分的检验拓展课题3-1 新装修居室内空气中甲醛浓度的检测拓展课题3-2 汽车尾气成分的检验课题2 亚硝酸钠和食盐的鉴别拓展课题3-3 真假碘盐的鉴别专题四化学反应条件的控制课题1 硫代硫酸钠与酸反应速率的影响因素拓展课题4-1 “蓝瓶子”实验课题2 催化剂对过氧化氢分解反应速率的影响拓展课6题4-2 过氧化氢酶的催化作用拓展课题4-3 蔗糖的燃烧课题3 反应条件对化学平衡的影响拓展课题4-4 淀粉与碘显色现象的探究拓展课题4-5 压强对化学平衡的影响专题五电化学问题研究课题1 原电池拓展课题5-1 干电池模拟实验课题2 电解与电镀拓展课题5-2 阿佛伽德罗常数的测定拓展课题5-3 用铜电极电解饱和食盐水专题六物质的定量分析课题1 食醋总酸含量的测定拓展课题6-1 配制并标定氢氧化钠溶液课题2 镀锌铁皮镀锌层厚度的测定拓展课题6-2 水果中维生素C含量的测定专题七物质的制备与合成课题1 硫酸亚铁铵的制备拓展课题7-1 用制氢废液制备硫酸锌晶体课题2 阿司匹林的合成拓展课题7-2 对氨基苯磺酸的合成附录一实验规则附录二实验室安全守则附录三实验室事故的处理附录四常见酸、碱和盐的溶解性表(20?) 附录五常见指示剂附录六基本操作和气体发生装置图附录七误差和有效数字运算规则附录八元素的相对原子质量表附录九7中英文名词对照表元素周期表篇二:苏教版语文电子课本目录费下载苏教版语文电子课本目录一年级上目录识字(一)1 一去二三里2 口耳目3 在家里4 操场上语文园地一有趣的游戏课文1 画2 四季3 小小竹排画中游4 哪座房子最漂亮5 爷爷和小树语文园地二我们的画6 静夜思7 小小的船8 阳光9 影子10 比尾巴语文园地三这样做不好识字(二)1 比一比2 自选商场3 菜园里84 日月明语文园地四我会拼图课文11 我多想去看看12 雨点儿13 平平搭积木14 自己去吧15 一次比一次有进步语文园地五该怎么办 16 小松鼠找花生17 雪地里的小画家18 借生日19 雪孩子20 小熊住山洞语文园地六小兔运南瓜生字表(一)生字表(二) 一.培养良好的学习习惯二.汉语拼音三.识字四.课文1 人有两个宝2 升国旗3 江南4 我叫神舟号5 家6 东方明珠97 秋姑娘的信8 看菊花五.识字六.课文9 大海睡了10 冰花11 北风和小鱼12 怀素写字13 小河与青草生字表一年级语文下目录一.培养良好的学习习惯二.识字三.课文1 春笋2 雨点3 小池塘4 春到梅花山5 草原的早晨6 蘑菇该奖给谁7 骑牛比赛108 小松树和大松树9 吃水不忘挖井人10 他得的红圈圈最多 11 奶奶的白发12 陈毅探母13 好学的爸爸四.识字五.课文14 鲜花和星星15 放小鸟16 这儿真好17 世界多美呀18 我叫足球19 三个小伙伴20 蚂蚁和蝈蝈21 古诗两首22 司马光23 鲁班和橹板24 乌鸦喝水25 咏华山26 小松鼠找花生果生字表苏教版二年级语文上册电子课本目录一.培养良好的学习习惯11二.识字三.课文1 秋游2 2008,北京~3 英英学古诗4 乡下孩子5 送给盲婆婆的婚姻6 一抹紫丁香7 有趣的发现8 小鹰学飞9 青蛙看海10 狼和小羊11 狐狸和乌鸦四.识字五.课文12 要好好学字13 来德扁担14 梅兰芳学艺15 大禹治水16 孔繁森17 登鹳雀楼18 青松19 小动物过冬1220 美丽的丹顶鹤21 水乡歌22 云房子23 夕阳真美生字表苏教版二年级语文下册电子课本目录一.培养良好的学习习惯二.识字三.课文1 古诗两首2 蚕姑娘3 月亮湾4 快乐的节目5 雨后6 谁的本领大7 蜗牛的奖杯8 狐假虎威9 母亲的恩情10 沉香救母(一) 11 沉香救母(二) 12 木兰从军四.识字五.课文13 学棋1314 黑板跑了15 晚上的太阳16 闪光的金子17 歌唱二小放牛郎 18 鸟岛19 台湾的蝴蝶谷20 欢乐的泼水节21 真想变成大大的荷叶 22 猴子种果树23 会走路的树24 问银河生字表苏教版三年级语文上册电子课本目录一.培养良好的学习习惯二.课文1 让我们荡起双桨2 学会查无字词典3 古诗两首4 做一片美的叶子三.课文5 北大荒的秋天6 西湖7 拉萨的天空四.课文8 蒲公英149 三袋麦子10 哪吒闹海五.课文11 第八次12 卧薪尝胆13 世界上第一个听诊器六.课文14 东方之珠15 小露珠16 石榴七.课文17 石头书18 小稻秧脱险记19 航天飞机八.课文20 军神21 掌声22 奎子九.课文23 每逢佳节倍思亲 24 孙中山破陋习生字表15苏教版三年级语文下册电子课本目录一.培养良好的学习习惯二.课文1 长城和运河2 美丽的南沙群岛3 庐山的云雾三.课文4 微笑着承受一切5 雪儿6 花瓣飘香四.课文8 蒲公英9 三袋麦子10 哪吒闹海五.课文11 赶海12 荷花13 古诗两首六.课文篇三:苏教版高一化学必修一教材整合苏教版高一化学必修一教材整合(共4个专题10个单元31节)16专题1 化学家眼中的物质世界一、教材整合的整体思路是:由于第一单元丰富多彩的化学物质一、物质的分类及转化(移去“氧化还原反应的判断”) 学生基础底,知识薄,教学中特别注重二、物质的量初中知识的复习与高中知识的衔接。
高中化学必修一 专题三 第二单元 铁铜的获取及应用

第二单元 铁、铜的获取及应用第一课时 从自然界中获取铁和铜一、铁和铜在自然界中的存在铁和铜在自然界主要以 化合态 的形式存在。
常见的铁矿 磁铁矿 (主要成分为Fe 3O 4)、 赤铁矿 (主要成分为Fe 2O 3)等;常见的铜矿有 黄铜矿 (主要成分为CuFeS 2)、 孔雀石 [主要成分为CuCO 3·Cu(OH)2]等。
此外铁在自然界中还以 游离态 的形式存在于陨铁中。
二、工业炼铁工业炼铁的原理是利用 氧化还原 反应,用 还原剂 将铁从铁矿石中还原出来。
1.原料铁矿石 、焦炭 、空气 、石灰石 等。
2.设备 炼铁高炉。
3.反应原理用还原剂将铁从其化合物中还原出来。
4.工艺流程从高炉下方鼓入空气与焦炭反应产生 二氧化碳 ,并放出大量的热量;二氧化碳 再与灼热的 焦炭 反应,生成 一氧化碳 ;一氧化碳 在高温下将氧化铁还原为铁。
有关反应的化学方程式:C +O 2 CO 2 ; CO 2+C 2CO ; Fe 2O 3+3CO 2Fe +3CO 2 。
5.除去铁矿石中含有的SiO2石灰石在高温下分解生成氧化钙和二氧化碳,氧化钙与铁矿石中的二氧化硅等反应生成炉渣,有关反应的化学方程式:CaCO 3 CaO +CO 2↑ ;CaO +SiO 2 CaSiO 3 。
炉渣的密度比铁水小,故浮在铁水上面,分离可得铁水。
三、工业炼铜1.用黄铜矿炼铜工业上用高温分解黄铜矿的方法获得铜。
粗铜中铜的含量为 99.5%~99.7% 。
含有 Ag 、=====点燃 =====高温 =====高温 =====高温 工业炼铁中碳的作用是什么? 作用主要有:①与氧气经过一系列反应提供还原剂; ②反应放热维持高温。
Au 、Fe 、Zn 等杂质。
2.粗铜的精炼电解精炼铜的原理是让 粗铜 作阳极,失电子变为Cu2+,在阴极上用 纯铜 作阴极即可得 精铜 。
电解精炼得到的铜,其含量高达 99.95%~99.98% 。
最新苏教版高中化学必修一课时同步测试题(全册 共193页 附答案)

最新苏教版高中化学必修一课时同步测试题(全册共193页附答案)目录课时1 物质的分类与转化课时2 物质的量课时3 物质的聚集状态第4课时物质的分散系课时5 物质的分离与提纯课时5常见离子的检验专题2课时1 氯气的生产原理课时2 氯气的性质课时3 氧化还原反应课时4 溴、碘的提取课时5 金属钠的性质与应用课时6 碳酸钠的性质与应用课时7 离子反应课时8 镁的提取及应用专题1 化学家眼中的物质世界课时1 物质的分类与转化【基础梳理】1.下列说法正确的是()A.无氧酸是指分子组成中不含氧元素的酸,如HCl、CH4等B.根据溶解性的不同,可将碱分为难溶性碱和可溶性碱C.和酸反应生成盐和水的物质一定是碱性氧化物D.有的酸性氧化物都可以与水化合得到相应的酸2.某学生发现实验室中的一瓶无色气体,他想知道是何种气体,经实验测定此瓶气体中只含有C、H两种元素,常温常压下这瓶气体不可能是()A.一种化合物B.一种单质和一种化合物的混合物C.两种化合物D.两种单质3.将下列各组物质按单质、氧化物、酸、碱、盐分类顺序排列,其中正确的是() A.银、干冰、硫酸、烧碱、食盐B.碘酒、冰、盐酸、烧碱、食盐C.氢气、二氧化硫、硝酸、纯碱、硝酸钾D.铜、氧化铜、醋酸、石灰水、氯化铜4.如图表示的是纯净物、单质、化合物、含氧化合物、氧化物之间的包含与不包含关系,若整个大圆代表纯净物,则①③所属的类别是()A.①单质、③氧化物B.①单质、③含氧化合物C.①化合物、③氧化物D.①化合物、③含氧化合物5.以下表示的是碳及其化合物的相互转化关系:其中涉及的基本反应类型依次为()A.置换、化合、分解、复分解B.置换、化合、复分解、分解C.化合、置换、分解、复分解D.化合、置换、复分解、分解6.下列说法中正确的是()A.凡没有单质参加的化合反应一定是非氧化还原反应B.有单质参加的反应一定是氧化还原反应C.凡有盐参加的反应,都是复分解反应D.置换反应一定是氧化还原反应7.对于下列反应类型的判断,不正确的是()A.2FeCl2+Cl2==2FeCl3(化合反应) B.3CO+Fe2O32Fe+3CO2(置换反应) C.2KClO32KCl+3O2↑(氧化还原反应) D.H2CO3CO2↑+H2O(分解反应)8.按不同的分类方法,下列每组中都有一种物质与其他物质不同,试分析每组中物质的组成规律,将其中不同于其他物质的物质找出来。
高中化学必修一教案-3.2 铁、铜的获取及应用3-苏教版

《铁元素与人体健康》教学设计——补血剂中的活性成分的检验高中化学学科核心素养是学生发展核心素养的重要组成部分,包括“宏观辨识与微观探析”、“变化观念和平衡思想”、“证据推理和模型认知”、“科学探究与创新意识”和“科学精神与社会责任”5个维度,全面展现了学生通过化学课程学习形成的关键能力和必备品格。
本文认为,基于化学核心素养的教学是指教学目标的确定、教学内容的组织、教学过程的实施、教学结果的改进、教学评价的设计等一系列教学环节均以化学核心素养的发展作为衡量准则,培养学生的关键能力和必备品格。
具体来说,教学目标源于化学学科核心素养、教学内容基于真实情境、教学过程的实施(教学方法)有利于素养的内化,积极实施“教、学、评”一致性,有效开展化学日常学习评价,促进学生化学学科核心素养的提升。
一、教材分析本节课内容选自苏教版化学1专题3第二单元。
铁是生产、生活中应用量最大、应用最广泛的金属,在人类文明发展进程中起着十分重要的作用。
教材选取铁这种金属是为了让学生认识金属元素及其化合物的相关性质,了解化学与人类生活的密切关系,进一步掌握元素化合物知识的一般研究方法。
本节课教材知识体系从人们熟悉的铁及其化合物在生产生活中的应用实例着手,引导学生复习铁离子及亚铁离子的检验及转化,并学会用其解决实际问题。
二、教学目标1.宏观辨识与微观探析:掌握Fe2+与Fe3+的检验及鉴别方法;掌握Fe2+与Fe3+的相互转化2.变化观念与平衡思想:运用氧化还原理论分析Fe2+与Fe3+的相互转化;3.证据推理与模型认知:学会从信息提示与资料卡中,提取有用信息,并能合理利用解释化学问题;能根据实验证据推出合理结论;构建Fe2+与Fe3+的转化模型,运用模型解释化学问题;4.科学探究与创新意识:学习设计鉴别补血剂中的亚铁离子的实验方案,小组合作完成实验设计;5.科学精神与社会责任:了解铁元素与人体的紧密联系,体会化学与生活息息相关;三、教学重难点:补血剂中活性成分的检验实验设计、Fe2+与Fe3+的相互转化;四、设计思路素养是人在特定情境中综合运用知识、技能和态度解决问题的高级能力与人性能力。
高中化学苏教版必修1教学案专题3第二单元第二课时铁、铜及其化合物的应用Word版含解析
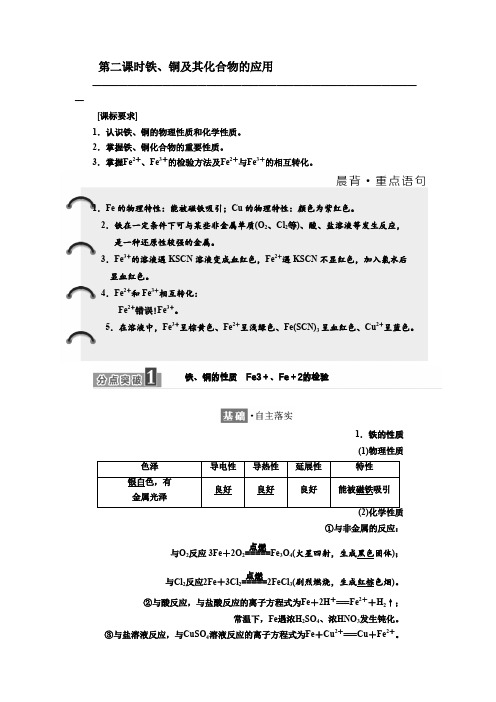
第二课时铁、铜及其化合物的应用——————————————————————————————————————[课标要求]1.认识铁、铜的物理性质和化学性质。
2.掌握铁、铜化合物的重要性质。
3.掌握Fe 2+、Fe 3+的检验方法及Fe 2+与Fe 3+的相互转化。
1.Fe 的物理特性:能被磁铁吸引;Cu 的物理特性:颜色为紫红色。
2.铁在一定条件下可与某些非金属单质(O 2、Cl 2等)、酸、盐溶液等发生反应, 是一种还原性较强的金属。
3.Fe 3+的溶液遇KSCN 溶液变成血红色,Fe 2+遇KSCN 不显红色,加入氯水后显血红色。
4.Fe 2+和Fe 3+相互转化:Fe 2+错误!Fe 3+。
5.在溶液中,Fe 3+呈棕黄色、Fe 2+呈浅绿色、Fe(SCN)3呈血红色、Cu 2+呈蓝色。
铁、铜的性质 Fe3+、Fe +2的检验1.铁的性质 (1)物理性质①与非金属的反应:);固体黑色火星四射,生成(4O 3Fe =====点燃2反应 3Fe +2O 2与O )。
色烟红棕剧烈燃烧,生成(32FeCl =====点燃2反应2Fe +3Cl 2与Cl ②与酸反应,与盐酸反应的离子方程式为Fe +2H +===Fe 2++H 2↑;常温下,Fe 遇浓H 2SO 4、浓HNO 3发生钝化。
③与盐溶液反应,与CuSO 4溶液反应的离子方程式为Fe +Cu 2+===Cu +Fe 2+。
2.铜的性质(1)物理性质紫红颜色:良好。
色;导电性、导热性和延展性:(2)化学性质①与非金属反应:与O2反应:2Cu+O2高温,2CuO;与Cl2反应:Cu+Cl2点燃,CuCl2。
(剧烈燃烧,生成棕黄色烟)②与盐溶液反应:与AgNO3溶液反应的离子方程式为Cu+2Ag+===Cu2++2Ag。
3.Fe3+、Fe2+的检验(1)检验方法(2)Fe3+与KSCN反应的离子方程式为Fe3++3SCN-===Fe(SCN)3。
基于核心素养的“从自然界获取铁和铜”教学设计

要求学生以小组为单位ꎬ进行原电池产生条件的探究.当探究任务完成之后ꎬ教师与学生共同就知识点加以总结ꎬ并安排课后作业ꎬ使学生对于超市中所售卖的 热敷袋 工作原理进行分析ꎬ课后时间ꎬ学生把热敷袋打开ꎬ发现里面的材料是铁屑㊁木屑㊁食盐等物质ꎬ学生意识到只要在轻轻揉搓之后ꎬ袋子便会放散出热量ꎬ而在此过程中铁粉变为铁锈.类似的实验探究性较强ꎬ对于化学基本原理的认知效果却非常好ꎬ于核心素养培养的目标也非常接近.3.对分析总结的重视高中化学生态课堂能够很好地指向于学生核心素养的培养这固然不假ꎬ但是在此过程中ꎬ教师一定不能忽略课堂的整体性ꎬ这就像在自然生态环境中ꎬ各生态参与者处在相对密闭的环境中一样ꎬ课堂也是一个独立的单元ꎬ当这个单元完成之后ꎬ教师所做的分析总结ꎬ也应当成为教学内容的组成部分ꎬ也就是生态课堂的组成部分ꎬ以便最终对核心素养的完善保驾护航.比如在教学完成烃及烃的衍生物等项知识内容以后ꎬ教师可以利用生活中的一些药品说明书中的分子结构ꎬ以分析总结的方式启迪学生进行积极的思考ꎬ像阿莫西林的分子结构式是什么样的?学生能够在分析之后了解到其分子中包括了苯环ꎬ同时苯环之上还连有羟基ꎬ所以能够大致推测出其可能拥有酚的基本化学性质ꎬ在此基础上用实验对推测进行验证.这种从现实生活中来的总结方式ꎬ可以让学生的思维得到进一步激活ꎬ由此满足核心素养各项能力尤其是创新能力的培养.另外ꎬ在教学之后教师还可以用化学科学前沿发展成果做总结ꎬ比如在介绍到化学环境污染及保护内容时ꎬ适时插入一些居室污染和防护的议题ꎬ以便吸引大家对于社会问题的关注.如上面所讲ꎬ因为核心素养培养的日益受到重视ꎬ高中化学生态课堂构建显然极有必要ꎬ所以高中化学教育工作者只有进行更加积极的探索ꎬ才能对生态课程加以不断完善ꎬ让化学课堂更具吸引力.㊀㊀参考文献:[1]田晓梅ꎬ康宁.加强高中化学学科核心素养培养ꎬ提高学生科学思维能力 2016年高考化学探究性试题的分析与启示[J].考试研究ꎬ2017(3):28-30.[2]任超文.构建高中化学生态课堂之刍议[J].中国校外教育ꎬ2016(4):41-43.[3]王和.基于发展学科核心素养的高中化学实验教学实践与思考[J].西部素质教育ꎬ2016(10):23-25.[责任编辑:季春阳]基于核心素养的 从自然界获取铁和铜 教学设计王㊀健1㊀倪娇蓉2(1.浙江省台州市仙居县城峰中学㊀317300㊀2.浙江省台州市仙居县官路镇初中㊀317309)摘㊀要:基于核心素养的角度对 从自然界获取铁和铜 教学设计进行简析.让学生在学习中树立正确的价值观ꎬ体会化学的精神内涵.关键词:核心素养ꎻ铁ꎻ铜ꎻ教学设计中图分类号:G632㊀㊀㊀㊀㊀㊀文献标识码:A㊀㊀㊀㊀㊀㊀文章编号:1008-0333(2018)30-0092-02收稿日期:2018-04-15作者简介:王健(1975.1-)ꎬ男ꎬ浙江省台州人ꎬ本科ꎬ中学高级教师ꎬ从事高中化学课堂教学ꎬ高中生学习心理等研究.㊀㊀一㊁教学目标1.知识与技能:了解自然界铁㊁铜的存在形式和冶炼方法.体会铁㊁铜的冶炼对人类文明的影响.2.过程与方法:通过对比分析铜㊁铁的存在㊁发现和获取ꎬ提高学生比较解决和分析问题的能力.3.情感㊁态度和价值观:通过介绍及探究铁铜的获取ꎬ学会利用身边的化学资源ꎬ合理地开发和利用资源.㊀㊀二㊁教学重点与难点1.重点铁㊁铜在自然界的存在形式及人们的获取方式ꎻ冶炼铁㊁铜的方法和基本原理.2.难点高炉炼铁的基本原理及除杂反应原理.㊀㊀三㊁教学过程本小节以历史发展各阶段时期铁㊁铜的冶炼为线索ꎬ分析和探究铁㊁铜的价值和用途ꎬ让学生充分认识到化合物在历史发展中有重要的地位ꎬ虽然就教学内容来看本节对学生要求掌握的知识含量要求不高ꎬ但是可以让学生体会到化学学科对人类文明的重要意义.1.教师活动:通过一段简短的视频向同学们阐述铁㊁铜在自然界中是如何被人类发现的.调动课堂气氛ꎬ提高29学生学习这一节的兴趣.2.学生活动:让学生相互交流看完短片后对铁㊁铜在自然界的存在形式有何认识ꎬ生活中常见的铁㊁铜有哪些.教学设想:使学生感受到化学与生活的紧密联系提出问题:自然界中ꎬ天然存在的铁单质和铜单质多吗?铁和铜在自然界中主要以什么形式存在呢?我国的铁矿和铜矿资源如何ꎬ主要分布在哪些地方?3.教师活动:通过PPT展示石器时代㊁青铜器时代㊁铁器时代这三个历史时期ꎬ铁和铜是以怎样的形式存在于人们生活里.教学设想:感受古今中国的强盛ꎬ从国家的强盛引出课时中涉及的化学知识ꎬ使学生感受化学在不同阶段对于社会进步与生产力提高有着划时代的意义.提出问题:人类社会在4000多年前已进入铜器时代ꎬ在2000多年前已进入铁器时代.这说明了什么问题?你了解古代是怎样冶炼铁和钢的吗?4.学生活动:学生交流讨论铁㊁铜在古代的应用为人们提供了哪些方便.教学设想:引发学生对生活中化学问题的思考和关注ꎬ体会到化学在生活中的重要地位.5.教师活动:PPT上投影出古代冶炼铁㊁铜的方法ꎬ引出现代铁㊁铜冶炼的基本原理.教学设想:让学生了解我国铜铁的冶炼史ꎬ知道铜铁冶炼的基本原理.掌握基本化学方程式.过渡语:同学们ꎬ请你们回忆以前所学的知识ꎬ如何将化合态的铜和铁转化为游离态的铜和铁呢?6.学生活动:让同学们2~4人为一小组讨论古人冶炼铁㊁铜的方法ꎬ如何使铜㊁铁从化合态转化为游离态ꎬ所需的还原剂是什么并写出化学方程式.学生讨论:生成铁的化学方程式:Fe2O3+3H2 2Fe+3H2OꎻFe2O3+3CO 2Fe+3CO2ꎻFe3O4+4H2 3Fe+4H2OꎻFe3O4+4CO 3Fe+4CO2.生成铜的化学方程式:CuO+H2 Cu+H2OꎻCuO+C Cu+COꎻCuO+C Cu+CO2ꎻZn+CuSO4 Cu+ZnSO4.教学设想:提高学生的团结合作能力和探索问题的精神.7.教师活动:PPT讲解高炉炼铁的原理和设备ꎬ如何才能选择合适的还原剂.在工业上我们选取的原料是铁矿石ꎬ我们都知道氧化铁和四氧化三铁都是熔点很高的物质ꎬ他们在电解的情况下可以分解吗?教学设想:课本与实际结合ꎬ让学生了解高炉炼铁的原理ꎬ感受到科技的不断创新.8.学生回答:不可以9.教师活动:常见的还原剂是哪些?有些同学用氢气做还原剂ꎬ是否合适?10.学生思考回答:活泼的金属单质.不合适ꎬ氢气的制取成本太高了.11.教师活动:一氧化碳可以用来做还原剂?怎么制取呢?12.学生回答:高温条件下和二氧化碳反应.13.教师活动:讲解高炉炼铁的化学方程式并介绍钢与铁的有关常识14.学生活动:了解高炉炼铁的主要原理ꎬ联系生活知道钢和铁的区别.15.教师活动:播放一段我国金属矿石介绍的短片ꎬ告诉同学们大自然资源有限ꎬ我们应该为保护金属矿石做哪些力所能及的事?16.学生活动:小组讨论通过这节课学到了什么ꎬ有什么感想.教学设想:回顾本节知识ꎬ让学生形成解决问题的思路ꎬ体会到化学科学的魅力所在ꎬ认识到化学科学对社会发展的重要性.㊀㊀四㊁教学反思1.学习来源于生活教学内容应该尽可能贴近学生的生活经验ꎬ这样能更好的引起学生的兴趣ꎬ不会让学生觉得枯燥ꎬ教学素材从生活中获取ꎬ能让学生全面客观地认识化学学科跟现实生活的紧密相关程度ꎬ用视频㊁图片等让课堂变得生动.2.知识是一个体系许多教师在化学学科上有很深的造诣ꎬ但学生的知识储备远达不到教师的程度ꎬ化学学习中环环相扣ꎬ在初中学生已经接触了一些相关的原理ꎬ教师应该对这些知识进行回顾ꎬ让学生对知识点加深记忆ꎬ这就要求教师不仅要对高中化学教学体系了如指掌ꎬ也应对初中化学体系有充分的了解.这种衔接教学更有利于学生掌握上课内容ꎬ让化学知识形成一个体系.3.培养学生合作参与能力课堂中有多次让同学小组讨论的环节ꎬ不仅可以加强同学们相互交流合作ꎬ遇到不同意见和想法时小组内自己解决和探讨ꎬ锻炼学生独立思考能力和实际解决问题的能力.让学生感受到合作的乐趣ꎬ相互交流中增长知识.4.培养学生社会责任感本节从生活中的化学作为切入点ꎬ让学生切身感受到化学就在身边ꎬ以为社会服务ꎬ推动社会发展为最终目的ꎬ让学生感受到化学科学的科学精神内涵所在ꎬ对学生进行爱国教育ꎬ提升他们的社会责任感.㊀㊀参考文献:[1]赵喜平.从 铁和铜的发展史 中领悟化学 从自然界获取铁和铜 的教学设计[J].中学化学教学参考ꎬ2012(5):36-38.[2]梁瑜ꎬ孙清亚ꎬ莘赞梅.应用新技术研究 一氧化碳还原氧化铁 的产物[J].化学教育ꎬ2014(23):37-39.[责任编辑:季春阳]39。
苏教版高一化学必修一3.2铁、铜的获取及应用 Fe2+、Fe3+的检验及转化 教案设计与反思

教学设计名称:《F e2+和Fe3+的相互转化》所属课程:苏教版必修一所属专业:化学《F e2+和Fe3+的相互转化》教学设计案例一、教学内容分析:“Fe2+、Fe3+的转化”是新课标苏教版高中化学必修一专题三第二单元《铁、铜的获取及应用》的重点之一。
本节课首先让学生通过了解铁在人体中的重要作用,提出“为什么补铁的时候需要同时服用维C效果会更好”。
然后结合专题一和专题二的氧化还原的有关知识,推测Fe3+和Fe2+之间是否能发生转化?再通过实验进行探究,最后总结出Fe3+和Fe2+之间转化的条件,从而解决一开始提出的补铁问题。
实现了从生活走向化学,又从化学回归生活。
在教学过程中,力图使学生将“铁离子的检验”与“氧化还原反应”、“铁盐转化”等知识有机结合来解决实际问题,从而提高学生的思维能力和动手能力。
二、教学目标:知识与技能:1.掌握Fe2+和Fe3+的还原性和氧化性。
2.通过探究实验进一步理解氧化还原反应的相关知识,同时培养学生的探究能力。
过程与方法:1.通过Fe2+和Fe3+的相互转化探究实验,学生学会氧化还原反应原理。
2.预测和验证未知物性质的科学方法。
情感态度与价值观:1.体会氧化还原反应的普遍存在,并能举例说明生活、生产中常见的氧化还原反应。
2.通过了解铁与人体健康的内容,知道化学无处不在,真正感悟到生命健康与化学的紧密关系。
三、教学重点难点:1.学生掌握Fe3+和Fe2+的相互转化关系,进一步巩固氧化还原反应的知识。
2.实验探究方案的设计。
3.用氧化还原反应原理预测和验证物质性质的科学方法。
四、学生情况分析本节课是在学生学习氧化还原反应原理以及离子反应之后一次非常重要的综合升华,由于课时的限制学生对上述知识的掌握不太到位,给本节课的教学带来了不小的困难,同时这节课本身也属于高中知识的难点,学生的表达能力以及设计实验的能力还没有达到要求,所以,想要更好的实现教学目标,在课堂的设计和组织上要多花点心思。
《铁、铜的获取》教案设计

《铁、铜的获取》教案设计一、教案背景1、面向学生:□√中学□小学2、学科:化学2、课时:13、学生课前准备:课前利用各种途径搜集有关炼铁、炼铜的相关资料。
4、教师课准备:①准备有关铁、铜用途的图片。
②制作教学多媒体课件。
二、教学课题Ⅰ、知识与技能:1、了解自然界中铁铜的存在形式,掌握炼铁过程中发生的化学变化和相应的反应方程式。
2、知道工业炼铜的原理和方法。
Ⅱ、过程与方法:通过探讨铁铜的冶炼的制取原理及方法及对方法的评价,提高从化学原理分析并解决实际问题的能力。
Ⅲ、情感、态度、价值观:1、介绍我国悠久的铁铜冶炼史,增强爱国主义意识,体会铁铜的冶炼对人类文明的影响。
2、介绍铁和铜使用情况,认识到化学认识到化学与生活的紧密联系,增强社会责任感。
三、教材分析《铁、铜的获取及应用》这一课是苏教版高中化学必修Ⅰ专题三第二单元的内容。
经过前面的学习,学生已经了解了从自然界获取钠、镁、铝等活泼金属的方法,为铁铜获取的学习打下了基础,本章知识的学习是进一步完善元素及其化合物知识体系,同时为下一课时——铁、铜及其化合物的应用奠定了基础,因此起到承上启下的作用。
同时可以帮助学生逐步掌握学习化学的一些基本方法,认识到化学在促进社会发展、改善人类生活条件等方面所起到的重要作用。
四、教学方法本课的教学借助计算机多媒体提供的教学资源优势来突破重点、难点。
让学生主动参与课堂,体现了学生的主体性。
在教学设计中充分联系生产生活实际,激起学生学习的兴趣,再以问题创设教学情境,激发学生的求知欲。
让学生事先搜索我国古代炼铁术,激发学生的爱国精神。
再搜索现代的炼铁技术,相互交流讨论高炉炼铁的知识,从而掌握这节课的重点。
【展示】日常生活中接触到的铁铜【交流讨论】1、日常生活中使用的是什么形态的铁、铜?2、铁、铜在自然界以何种形态存在?我国纪念1996年钢铁产量超亿吨而发行的邮票【交流讨论】你知道哪些炼铜的方法? 【展示】火法炼铜,湿法炼铜,生物炼铜法。
苏教版高中化学高三第一轮复习—铁及其化合物教案设计

课题名称铁三角及其化合物的应用教材内容剖析:铁、铜及其化合物的应用”知识是本专题的重点之一,经过这部分内容的学习能够加深稳固“从自然界获得铁和铜”的知识,并为下一节“钢铁的腐化”的学习确定基础故本节教材拥有承前启后的作用;本部分知识系统打破了过去元素化合物知识学习中的“构造—性质—制备—用途”的模式,而是从熟习的这些元素及其化合物在生产生活中的应用案例着手,引起学生对“他们在自然界怎样存在?人类怎样获得这些物质”的思虑,从而产生研究的欲念。
这样安排的目的,是为了使学生在更广阔的视线下,认识在生产生活中有宽泛应用的元素及其化合物的有关知识,认识化学在资源的利用和保护中的意义和作用,认识化学与人类生活的亲密关系,培育学生运用化学知识解说与解决与化学有关的社会问题的能力,形成正确的感情态度和价值观,加强社会责任感。
而且经过“铁三角”的学习还可以进一步稳固氧化复原反响的知识学习者特色剖析学生已经学习了铁,铜的物理性质和基本的化学性质,也对铁、铜等金属资料的冶炼:高炉炼铁、湿法炼铜有了简单认识,均为本课时的学习起了很好的铺垫作用,可是在总复习阶段,学生对铁三角的应用仍旧属于不太好掌握的,所以在安排课不时仍旧需要花更多的时间去复习基础知识。
教课目的及确定依照依照新课程理念,本着对教材构造和内容的理解,联合学生的学习基础和认知特色,确定学习目标以下:知识与技术1、认识铁、铜的物理性质,掌握铁、铜的化学性质;2、掌握Fe2+、Fe3+的性质及互相转变,学会用化学方法鉴识Fe2+、Fe3+。
过程与方法1、经过演示实验,锻炼察看的能力,学会剖析问题的方法。
2、经过列表比较和图示联系的方法,在掌握Fe2+、Fe3+的性质的同时学习科学的思想方法和学习方式。
感情、态度、价值观经过本节铁铜这些常有元素及其化合物在生活中的应用的学习,进一步深切认识到化学与生活的亲密关系,学会用化学知识解说或解决身旁与化学有关的问题。
教课重难点剖析及确定依照:鉴于我对本节教材价值的认识和学生的实质学习能力,将教课重点:铁、铜及其化合物的性质;Fe2+、Fe3+的性质及其互相转变。
苏教版高中化学电子课本

苏教版高中化学电子课本下载篇一:高中化学教材目录--苏教版高中化学--苏教版目录·必修1专题一化学家眼中的物质世界第一单元丰富多彩的化学物质第二单元研究物质的实验方法第三单元人类对原子结构的认识专题二从海水中获得的化学物质第一单元氯、溴、碘及其化合物第二单元钠、镁及其化合物专题三从矿物到基础材料第一单元从铝土矿到铝合金第二单元铁、铜的获取及应用第三单元含硅矿物与信息材料专题四硫、氮和可持续发展第一单元含硫化合物的性质和应用第二单元生产生活中的含氮化合物附录一相对原子质量表附录二常见酸、碱和盐的溶解性表(20℃)附录三中英文名词对照表元素周期表高中化学--苏教版目录·必修2专题一微观结构与物质多样性第一单元原子核外电子排布与元素周期律第二单元微粒之间的相互作用力第三单元从微观结构看物质多样性专题二化学反应与能量转化第一单元化学反应速率与反应限度第二单元化学反应中的热量第三单元化学能与电能的转化第四单元太阳能、生物质能和氢能的利用专题三有机化合物的获得与应用第一单元化石燃料与有机化合物第二单元食品中的有机化合物第三单元人工合成有机化合物专题四化学科学与人类文明第一单元化学是认识和创造物质的科学第二单元化学是社会可持续发展的基础附录一相对原子质量表附录二中英文名词对照表元素周期表高中化学--苏教版目录·选修1 化学与生活专题一洁净安全的生存环境第一单元空气质量的改善第二单元水资源的合理利用第三单元生活垃圾的分类处理第四单元化学品的安全使用专题二营养均衡与人体健康第一单元提取人体必需的化学元素第二单元提供能量与营养的食物第三单元优化食物品质的添加剂第四单元造福人类的化学药物专题三丰富多彩的生活材料第一单元应用广泛的金属材料第二单元功能各异的无机非金属材料第三单元高分子材料和复合材料附录中英文名词对照表附录一相对原子质量表附录二常见酸、碱和盐的溶解性表(20℃)附录三生活饮用水水质标准附录四人体内常量元素和微量元素的含量附录五一些食物中的营养素含量附录六常见的食品添加剂附录七一些合成纤维的组成及特点元素周期表高中化学--苏教版目录·选修2化学与技术专题一多样化的水处理技术第一单元水的净化与污水处理第二单元硬水软化第三单元海水淡化专题二从自然资源到化学品第一单元氨的合成第二单元氯碱生产第三单元硫酸工业第四单元镁和铝的冶炼专题三让有机反应为人类造福第一单元有机药物制备第二单元合成洗涤剂的生产第三单元纤维素的化学加工第四单元有机高分子合成专题四材料加工与性能优化专题五为现代农业技术添翼专题六从污染防治到绿色化学附录一中英文名词对照表元素周期表高中化学--苏教版目录·选修3物质结构与性质专题一揭示物质结构的奥秘专题二原子结构与元素的性质第一单元原子核外电子的运动第二单元元素性质的递变规律专题三微粒间作用力与物质性质第一单元金属键金属晶体第二单元离子键离子晶体第三单元共价键原子晶体第四单元分子间作用力分子晶体专题四分子空间结构与物质性质第一单元分子结构与物质的性质第二单元配合物的形成和应用专题五物质结构的探索无止境附录一中英文名词对照表元素周期表高中化学--苏教版目录·选修4化学反应原理专题一化学反应与能量变化第一单元化学反应中的热效应第二单元化学能与电能的转化第三单元金属的腐蚀与防护专题二化学反应速率与化学平衡第一单元化学反应速率第二单元化学反应的方向和限度第三单元化学平衡的移动专题三溶液中的离子反应第一单元弱电解质的电离平衡第二单元溶液的酸碱性第三单元盐类的水解第四单元难溶电解质的沉淀溶解平衡附录一中英文名词对照表附录二常见酸、碱和盐的溶解性表(20℃)附录三难溶电解质的溶度积常数(25℃)附录四弱电解质在水中的电离平衡常数(25℃)元素周期表高中化学--苏教版目录·选修5有机化学基础专题一认识有机化合物第一单元有机化学的发展与应用第二单元科学家怎样研究有机物专题二有机物的结构与分类第一单元有机化合物的结构第二单元有机化合物的分类与命名专题三常见的烃第一单元脂肪烃第二单元芳香烃专题四烃的衍生物第一单元卤代烃第二单元醇酚第三单元醛羧酸专题五生命活动的物质基础第一单元糖类油脂第二单元氨基酸蛋白质核酸附录一中英文名词对照表元素周期表高中化学--苏教版目录·选修6实验化学专题一物质的分离与提纯课题1 海带中碘元素的分离及检验拓展课题1-1 茶叶中某些元素的鉴定课题 2 用纸层析法分离铁离子和铜离子拓展课题1-2 菠菜的叶绿体中色素的提取和分离拓展课题1-3 用粉笔进行层析分离课题 3 硝酸钾晶体的制备拓展课题1-4 粗盐的提纯专题二物质性质的研究课题1 铝及其化合物的性质拓展课题2-1 铝热反应课题2 乙醇和苯酚的性质拓展课题2-2 苯酚与甲醛的反应专题三物质的检验与鉴别课题1 牙膏和火柴头中某些成分的检验拓展课题3-1 新装修居室内空气中甲醛浓度的检测拓展课题3-2 汽车尾气成分的检验课题2 亚硝酸钠和食盐的鉴别拓展课题3-3 真假碘盐的鉴别专题四化学反应条件的控制课题 1 硫代硫酸钠与酸反应速率的影响因素拓展课题4-1 “蓝瓶子”实验课题2 催化剂对过氧化氢分解反应速率的影响拓展课题4-2 过氧化氢酶的催化作用拓展课题4-3 蔗糖的燃烧课题3 反应条件对化学平衡的影响拓展课题4-4 淀粉与碘显色现象的探究拓展课题4-5 压强对化学平衡的影响专题五电化学问题研究课题1 原电池拓展课题5-1 干电池模拟实验课题2 电解与电镀拓展课题5-2 阿佛伽德罗常数的测定拓展课题5-3 用铜电极电解饱和食盐水专题六物质的定量分析课题1 食醋总酸含量的测定拓展课题6-1 配制并标定氢氧化钠溶液课题2 镀锌铁皮镀锌层厚度的测定拓展课题6-2 水果中维生素C含量的测定专题七物质的制备与合成课题1 硫酸亚铁铵的制备拓展课题7-1 用制氢废液制备硫酸锌晶体课题2 阿司匹林的合成拓展课题7-2 对氨基苯磺酸的合成附录一实验规则附录二实验室安全守则附录三实验室事故的处理附录四常见酸、碱和盐的溶解性表(20℃)附录五常见指示剂附录六基本操作和气体发生装置图附录七误差和有效数字运算规则附录八元素的相对原子质量表附录九中英文名词对照表元素周期表篇二:苏教版语文电子课本目录费下载苏教版语文电子课本目录一年级上目录识字(一)1 一去二三里2 口耳目3 在家里4 操场上语文园地一有趣的游戏课文1 画2 四季3 小小竹排画中游4 哪座房子最漂亮5 爷爷和小树语文园地二我们的画6 静夜思7 小小的船8 阳光9 影子10 比尾巴语文园地三这样做不好识字(二)1 比一比2 自选商场3 菜园里4 日月明语文园地四我会拼图课文11 我多想去看看12 雨点儿13 平平搭积木14 自己去吧15 一次比一次有进步语文园地五该怎么办16 小松鼠找花生17 雪地里的小画家18 借生日19 雪孩子20 小熊住山洞语文园地六小兔运南瓜生字表(一)生字表(二)一.培养良好的学习习惯二.汉语拼音三.识字四.课文1 人有两个宝2 升国旗3 江南4 我叫神舟号5 家6 东方明珠7 秋姑娘的信8 看菊花五.识字六.课文9 大海睡了10 冰花11 北风和小鱼12 怀素写字13 小河与青草生字表一年级语文下目录一.培养良好的学习习惯二.识字三.课文1 春笋2 雨点3 小池塘4 春到梅花山5 草原的早晨6 蘑菇该奖给谁7 骑牛比赛8 小松树和大松树9 吃水不忘挖井人10 他得的红圈圈最多11 奶奶的白发12 陈毅探母13 好学的爸爸四.识字五.课文14 鲜花和星星15 放小鸟16 这儿真好17 世界多美呀18 我叫足球19 三个小伙伴20 蚂蚁和蝈蝈21 古诗两首22 司马光23 鲁班和橹板24 乌鸦喝水25 咏华山26 小松鼠找花生果生字表苏教版二年级语文上册电子课本目录一.培养良好的学习习惯二.识字三.课文1 秋游2 2008,北京!3 英英学古诗4 乡下孩子5 送给盲婆婆的婚姻6 一抹紫丁香7 有趣的发现8 小鹰学飞9 青蛙看海10 狼和小羊11 狐狸和乌鸦四.识字五.课文12 要好好学字13 来德扁担14 梅兰芳学艺15 大禹治水16 孔繁森17 登鹳雀楼18 青松19 小动物过冬20 美丽的丹顶鹤21 水乡歌22 云房子23 夕阳真美生字表苏教版二年级语文下册电子课本目录一.培养良好的学习习惯二.识字三.课文1 古诗两首2 蚕姑娘3 月亮湾4 快乐的节目5 雨后6 谁的本领大7 蜗牛的奖杯8 狐假虎威9 母亲的恩情10 沉香救母(一)11 沉香救母(二)12 木兰从军四.识字五.课文13 学棋14 黑板跑了15 晚上的太阳16 闪光的金子17 歌唱二小放牛郎18 鸟岛19 台湾的蝴蝶谷20 欢乐的泼水节21 真想变成大大的荷叶22 猴子种果树23 会走路的树24 问银河生字表苏教版三年级语文上册电子课本目录一.培养良好的学习习惯二.课文1 让我们荡起双桨2 学会查无字词典3 古诗两首4 做一片美的叶子三.课文5 北大荒的秋天6 西湖7 拉萨的天空四.课文8 蒲公英9 三袋麦子10 哪吒闹海11 第八次12 卧薪尝胆13 世界上第一个听诊器六.课文14 东方之珠15 小露珠16 石榴七.课文17 石头书18 小稻秧脱险记19 航天飞机八.课文20 军神21 掌声22 奎子九.课文23 每逢佳节倍思亲24 孙中山破陋习生字表苏教版三年级语文下册电子课本目录一.培养良好的学习习惯1 长城和运河2 美丽的南沙群岛3 庐山的云雾三.课文4 微笑着承受一切5 雪儿6 花瓣飘香四.课文8 蒲公英9 三袋麦子10 哪吒闹海五.课文11 赶海12 荷花13 古诗两首六.课文篇三:苏教版高一化学必修一教材整合苏教版高一化学必修一教材整合(共4个专题10个单元31节)专题1 化学家眼中的物质世界一、教材整合的整体思路是:由于第一单元丰富多彩的化学物质一、物质的分类及转化(移去“氧化还原反应的判断”)学生基础底,知识薄,教学中特别注重二、物质的量初中知识的复习与高中知识的衔接。
(完整版)苏教版高中化学目录全

(完整版)苏教版高中化学目录全必修1专题1化学家眼中的物质世界第一单元丰富多彩的化学物质●物质的分类与转化●物质的量●物质的聚集状态●物质的分散系第二单元研究物质的实验方法●物质的分离与提纯●常见物质的检验●溶液的配制及分析第三单元人类对原子结构的认识●原子结构模型的演变●原子核外电子排布●原子核的组成专题2从海水中获得的化学物质第一单元氯、溴、碘及其化合物●氯气的生产原理●氯气的性质●氧化还原反应●溴,碘的提取第二单元钠、镁及其化合物●金属钠的性质与应用●碳酸钠的性质与应用●离子反应●镁的提取与应用专题3从矿物到基础材料第一单元从铝土矿到铝合金●从铝土矿中提取铝●铝的氧化物与氢氧化物●铝及铝合金第二单元铁、铜的获取及应用●从自然界获取铁和铜●铁,铜及其化合物的应用第三单元含硅矿物与信息材料●硅酸盐矿物与硅酸盐产品●二氧化硅与信息材料专题4硫、氮和可持续发展第一单元含硫化合物的性质和应用●二氧化硫的性质和作用●硫酸的制备和性质●硫和含硫化合物的相互转化第二单元生产生活中的含氮化合物必修2专题1微观结构与物质的多样性第一单元原子核外电子排布与元素周期律第二单元微粒之间的相互作用力第三单元从微观结构看物质的多样性专题2 化学反应与能量转化第一单元化学反应速率与反应限度第二单元化学反应中的热量第三单元化学能与电能的转化第四单元太阳能、生物质能和氢能的利用专题3 有机化合物的获得与应用第一单元化石燃料与有机化合物第二单元食品中的有机化合物第三单元人工合成有机化合物专题4 化学科学与人类文明第一单元化学是认识和创造物质的科学第二单元化学是社会可持续发展的基础选修1 化学与生活专题1 洁净安全的生存环境第一单元空气质量的改善第二单元水资源的合理利用第三单元生活垃圾的分类处理第四单元化学品的安全使用专题2 营养均衡与人体健康第一单元摄取人体必需的化学元素第二单元提供能量与营养的食物第三单元优化食物品质的添加剂第四单元造福人类健康的化学药物专题3 丰富多彩的生活材料第一单元应用广泛的金属材料第二单元功能各异的无机非金属材料第三单元高分子材料和复合材料选修2 化学与技术专题1 多样化水处理技术第一单元水的净化与污水处理(完整版)苏教版高中化学目录全第二单元硬水软化第三单元海水淡化专题2 从自然资源到化学品第一单元氨的合成第二单元氯碱生产第三单元硫酸工业第四单元镁和铝的冶炼专题3 让有机反应为人类造福第一单元有机药物制备第二单元合成洗涤剂的生产第三单元纤维素的化学加工第四单元有机高分子合成专题4 材料加工与性能优化第一单元材料的加工处理第二单元材料组成的优化第三单元复合材料的制造专题5 为现代农业技术添翼第一单元土壤酸碱性的改良第二单元化肥的生产与合理使用第三单元无土栽培技术第四单元化学农药的发展专题6 从污染防治到绿色化学第一单元环境污染的化学防治第二单元绿色化学与可持续发展选修3 物质结构与性质专题1 揭示物质结构的奥秘专题2 原子结构与元素第一单元原子核外电子的运动第二单元元素性质的递变规律专题3 微粒间作用力与物质性质第一单元金属键金属晶体第二单元离子键离子晶体第三单元共价键原子晶体第四单元分子间作用力分子晶体专题4 分子空房间结构与物质性质第一单元分子构型与物质的性质第二单元配合物是如何形成的专题5 物质结构的探索无止境选修4 化学反应原理专题1 化学反应与能量变化第一单元化学反应中的热效应第二单元化学能与电能的转化第三单元金属的腐蚀与防护专题2 化学反应速率与化学平衡第一单元化学反应速率第二单元化学反应的方向和限度第三单元化学平衡的移动专题3 溶液中的离子反应第一单元弱电解质的电离平衡第二单元溶液的酸碱性第三单元眼泪的水解第四单元沉淀溶解平衡选修5 有机化学基础专题1 认识有机化合物第一单元有机化学的发展与应用第二单元科学家怎样研究有机物专题2 有机物的结构与分类第一单元有机化合物的结构第二单元有机化合物的分类和命名专题3 常见的烃第一单元脂肪烃第二单元芳香烃专题4 烃的衍生物第一单元卤代烃第二单元醇酚第三单元醛羧酸专题5 生命活动的物质基础第一单元糖类油脂第二单元氨基酸蛋白质核酸选修6 实验化学专题1 物质的分类与提纯课题1 海带中碘元素的分离及检验课题2 用纸层析法分离铁离子和铜离子课题3 硝酸钾晶体的制备专题2 物质性质的探究(完整版)苏教版高中化学目录全课题1 铝及其化合物的性质课题2 乙醇和苯酚的性质专题3 物质的检验与鉴别课题1 牙膏和火柴中某些成分的检验课题2 亚硝酸钠和食盐的鉴别专题4 化学反应条件的控制课题1 硫代硫酸钠与酸反应速率的影响因素课题2 催化剂对过氧化氢分解反应速率的影响课题3 反应条件对化学平衡的影响专题5 电化学问题研究课题1 原电池课题2 电解与电镀专题6 物质的定量分析课题1 食醋总酸含量的测定课题2 镀锌铁皮锌镀层厚度的测定高中化学:必修1必修2选修1化学与生活选修2化学与技术选修3物质结构与性质选修4化学反应原理选修5有机化学基础选修6实验化学。
高中化学专题3从矿物到基础材料第二单元铁、铜的获取及应用第1课时从自然界中获取铁和铜学案苏教版必修

2018版高中化学专题3 从矿物到基础材料第二单元铁、铜的获取及应用第1课时从自然界中获取铁和铜学案苏教版必修1编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2018版高中化学专题3 从矿物到基础材料第二单元铁、铜的获取及应用第1课时从自然界中获取铁和铜学案苏教版必修1)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2018版高中化学专题3 从矿物到基础材料第二单元铁、铜的获取及应用第1课时从自然界中获取铁和铜学案苏教版必修1的全部内容。
第1课时从自然界中获取铁和铜[学习目标定位] 1.熟知铁、铜的冶炼原理和方法,会写有关的化学方程式。
2.初步了解金属冶炼的一般方法和原理。
一、铁、铜的存在形式1.铁和铜在自然界中主要以化合态的形式存在。
(1)常见的铁矿有磁铁矿(主要成分为Fe3O4)、赤铁矿(主要成分为Fe2O3)、黄铁矿(主要成分为FeS2)、菱铁矿(主要成分为FeCO3)等。
(2)常见的铜矿有孔雀石[主要成分为CuCO3·Cu(OH)2]、黄铜矿(主要成分为CuFeS2)等。
2.人们最早利用的单质铁和单质铜均直接来自于自然界。
所不同的是铁单质只存在于从天而降的陨铁中,所以古代人称铁为“天石”,而铜则来自于地球上自然存在的少量单质铜。
1.铁、铜元素在自然界中的存在形式既有游离态也有化合态。
2.铁在地壳中的含量仅次于氧、硅、铝,居第四位.1.铜在自然界存在于多种矿石中。
下列矿石的主要成分中铜元素的质量分数最高的是()A.黄铜矿CuFeS2B.斑铜矿Cu5FeS4C.辉铜矿Cu2SD.孔雀石CuCO3·Cu(OH)2答案C解析设均含有2个Cu原子,比较“Fe2S4"“Fe错误!S错误!”“S”“H2CO5"的式量可知,Cu2S 中铜的质量分数最高,CuFeS2中的Cu的质量分数最低。
苏教版高中化学必修一课件第1课时铁、铜的获取及其性质.pptx

A.24(mn-n)
B.m2-4nn
(B)
2(m-n) C. 3n
m-n D. 8n
解析 可以利用方程计算,也可以利用元素的质量分数计
算,Fe2O3 中含铁元素的质量分数为 w(Fe),设铁的相对原 子质量为 x。w(Fe)=2x2+x48×100%=mn ×100%,2x2+x48= mn ,x=m2-4nn。
解析 用 H2、C、CO 还原等质量 Fe2O3 且产物为 H2O、CO、 CO2 时,耗三者物质的量比为 1∶1∶1,质量比为 1∶6∶14; 当产物为 H2O、CO2 时,三者物质的量之比为 2∶1∶2,质 量比为 1∶3∶14。
8.在实验室中,用锌、氧化铜、稀硫酸为原料制取铜,有
下列两种途径: ①Zn—稀—硫 ——酸→H2—氧—化 ——铜→Cu ②CuO—稀—— 硫—酸→CuSO4―Z―n→Cu
(2)化学性质 ①与非金属单质的反应
与 Cl2、O2 反应的化学反应方程式分别为: 2Fe+3Cl2=点==燃==2FeCl3、 3Fe+2O2=点==燃==Fe3O4 。
②与非氧化性酸的反应
常温下,铁与盐酸、稀硫酸反应的离子方程式为: Fe+2H+===Fe2++H2↑ 。
③与一些盐的反应
铁与 CuSO4 反应的化学方程式: Fe+CuS炉实际月产纯铁为 40万吨1-×2(.10-%4.0%)=39 万吨 设每月需赤铁矿 x 万吨
Fe2O3+3CO===2Fe+3CO2
160
112
86%x 万吨 39 万吨 则8166%0x=13192,x≈65。
答:每月需含 Fe2O3 86%的赤铁矿约 65 万吨。
解法二 设每月需赤铁矿 x 万吨,依铁元素守恒得: 86%x×111620=40×1-(1-2.04%.0%),x=65。
苏教版高中化学必修一专题三第二单元《铁、铜的获取及应用》单元练习(答案解析版)

高中化学学习材料金戈铁骑整理制作铁、铜的获取及应用时间:45分钟满分:100分一、选择题(每小题4分,共48分)1.将铁屑溶于过量盐酸后,再加入下列物质,不会有三价铁生成的是()A.硫酸B.氯水C.硝酸锌D.溴水答案:A2.下列关于铁的叙述正确的是()①铁能被磁铁吸引,但纯铁易锈蚀。
②在人体的血红蛋白中含有铁元素。
③铁位于周期表中的第四周期第ⅧB族。
④铁能在氧气中剧烈燃烧,但不能在水蒸气中燃烧。
⑤铁与硝酸反应的产物仅是Fe(NO3)3。
⑥不能通过化合反应生成FeCl2和Fe(OH)3。
A.①③B.②④C.②⑤D.④⑥答案:B3.将Cu片放入0.1 mol·L-1FeCl3溶液中,反应一段时间后取出Cu片,溶液中c(Fe3+) ∶c(Fe2+)=2 ∶3,则溶液中Cu2+和Fe3+的物质的量之比为(不考虑溶液体积变化)() A.3 ∶2 B.3 ∶5C.4 ∶3 D.3 ∶4答案:D4.将22.4 g铁粉逐渐加入含HNO3 0.8 mol的稀硝酸中,反应生成的气体的物质的量(x)随消耗铁粉的物质的量(y)的变化关系中,正确的是()解析:最初Fe 是不足的,主要反应为Fe +4HNO 3(稀)===Fe(NO 3)3+NO ↑+2H 2O ,当加0.2 mol Fe 时恰好完成上述反应,再加0.1 mol Fe ,发生的反应是:2Fe 3++Fe===3Fe 2+,最终剩余0.1 mol Fe 。
答案:C5.向一定量的Fe 、FeO 、Fe 2O 3的混合物中,加入100 mL 1 mol/L 的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)气体,所得溶液加KSCN 溶液无血红色出现,那么若用足量的CO 在高温下还原相同质量的混合物,能得到铁( )A .11.2 gB .2.8 gC .5.6 gD .无法计算答案:B6.(2011·临沂模拟)把7.2 g 铁粉投入某硝酸溶液中,充分反应剩余固体1.6 g ,产生NO 2和NO 的混合气体0.08 mol 。
(完整版)苏教版高中化学目录全

必修1专题1化学家眼中的物质世界第一单元丰富多彩的化学物质●物质的分类与转化●物质的量●物质的聚集状态●物质的分散系第二单元研究物质的实验方法●物质的分离与提纯●常见物质的检验●溶液的配制及分析第三单元人类对原子结构的认识●原子结构模型的演变●原子核外电子排布●原子核的组成专题2从海水中获得的化学物质第一单元氯、溴、碘及其化合物●氯气的生产原理●氯气的性质●氧化还原反应●溴,碘的提取第二单元钠、镁及其化合物●金属钠的性质与应用●碳酸钠的性质与应用●离子反应●镁的提取与应用专题3从矿物到基础材料第一单元从铝土矿到铝合金●从铝土矿中提取铝●铝的氧化物与氢氧化物●铝及铝合金第二单元铁、铜的获取及应用●从自然界获取铁和铜●铁,铜及其化合物的应用第三单元含硅矿物与信息材料●硅酸盐矿物与硅酸盐产品●二氧化硅与信息材料专题4硫、氮和可持续发展第一单元含硫化合物的性质和应用●二氧化硫的性质和作用●硫酸的制备和性质●硫和含硫化合物的相互转化第二单元生产生活中的含氮化合物必修2专题1微观结构与物质的多样性第一单元原子核外电子排布与元素周期律第二单元微粒之间的相互作用力第三单元从微观结构看物质的多样性专题2 化学反应与能量转化第一单元化学反应速率与反应限度第二单元化学反应中的热量第三单元化学能与电能的转化第四单元太阳能、生物质能和氢能的利用专题3 有机化合物的获得与应用第一单元化石燃料与有机化合物第二单元食品中的有机化合物第三单元人工合成有机化合物专题4 化学科学与人类文明第一单元化学是认识和创造物质的科学第二单元化学是社会可持续发展的基础选修1 化学与生活专题1 洁净安全的生存环境第一单元空气质量的改善第二单元水资源的合理利用第三单元生活垃圾的分类处理第四单元化学品的安全使用专题2 营养均衡与人体健康第一单元摄取人体必需的化学元素第二单元提供能量与营养的食物第三单元优化食物品质的添加剂第四单元造福人类健康的化学药物专题3 丰富多彩的生活材料第一单元应用广泛的金属材料第二单元功能各异的无机非金属材料第三单元高分子材料和复合材料选修2 化学与技术专题1 多样化水处理技术第一单元水的净化与污水处理第二单元硬水软化第三单元海水淡化专题2 从自然资源到化学品第一单元氨的合成第二单元氯碱生产第三单元硫酸工业第四单元镁和铝的冶炼专题3 让有机反应为人类造福第一单元有机药物制备第二单元合成洗涤剂的生产第三单元纤维素的化学加工第四单元有机高分子合成专题4 材料加工与性能优化第一单元材料的加工处理第二单元材料组成的优化第三单元复合材料的制造专题5 为现代农业技术添翼第一单元土壤酸碱性的改良第二单元化肥的生产与合理使用第三单元无土栽培技术第四单元化学农药的发展专题6 从污染防治到绿色化学第一单元环境污染的化学防治第二单元绿色化学与可持续发展选修3 物质结构与性质专题1 揭示物质结构的奥秘专题2 原子结构与元素第一单元原子核外电子的运动第二单元元素性质的递变规律专题3 微粒间作用力与物质性质第一单元金属键金属晶体第二单元离子键离子晶体第三单元共价键原子晶体第四单元分子间作用力分子晶体专题4 分子空房间结构与物质性质第一单元分子构型与物质的性质第二单元配合物是如何形成的专题5 物质结构的探索无止境选修4 化学反应原理专题1 化学反应与能量变化第一单元化学反应中的热效应第二单元化学能与电能的转化第三单元金属的腐蚀与防护专题2 化学反应速率与化学平衡第一单元化学反应速率第二单元化学反应的方向和限度第三单元化学平衡的移动专题3 溶液中的离子反应第一单元弱电解质的电离平衡第二单元溶液的酸碱性第三单元眼泪的水解第四单元沉淀溶解平衡选修5 有机化学基础专题1 认识有机化合物第一单元有机化学的发展与应用第二单元科学家怎样研究有机物专题2 有机物的结构与分类第一单元有机化合物的结构第二单元有机化合物的分类和命名专题3 常见的烃第一单元脂肪烃第二单元芳香烃专题4 烃的衍生物第一单元卤代烃第二单元醇酚第三单元醛羧酸专题5 生命活动的物质基础第一单元糖类油脂第二单元氨基酸蛋白质核酸选修6 实验化学专题1 物质的分类与提纯课题1 海带中碘元素的分离及检验课题2 用纸层析法分离铁离子和铜离子课题3 硝酸钾晶体的制备专题2 物质性质的探究课题1 铝及其化合物的性质课题2 乙醇和苯酚的性质专题3 物质的检验与鉴别课题1 牙膏和火柴中某些成分的检验课题2 亚硝酸钠和食盐的鉴别专题4 化学反应条件的控制课题 1 硫代硫酸钠与酸反应速率的影响因素课题 2 催化剂对过氧化氢分解反应速率的影响课题3 反应条件对化学平衡的影响专题5 电化学问题研究课题1 原电池课题2 电解与电镀专题6 物质的定量分析课题1 食醋总酸含量的测定课题2 镀锌铁皮锌镀层厚度的测定高中化学:必修1必修2选修1化学与生活选修2化学与技术选修3物质结构与性质选修4化学反应原理选修5有机化学基础选修6实验化学。
高中化学 3.2.2铁、铜及其化合物的应用教案 苏教版必修1-苏教版高一必修1化学教案

1、使学生体会科学探究的过程及方法,强化科学探究意识,培养科学素养2、通过以化学实验为主的多种探究活动,认识化学实验在学习和研究化学中的重要作用,激发学生学习化学的兴趣,培养学生的创新意识和实践能力。
教学重点
Fe2+、Fe3+的性质;铁盐和亚铁盐的转变;Fe3+的检验
教学难点
二价铁和三价铁的相互转化
思考、讨论
学会思考
过渡
阅读课本,总结铁、铜及其化合物的应用
阅读教材P76相关内容:
培养学生的自学能力 ,归纳总结能力
板书
五、铁、铜及其化合物的广泛应用
1、不同价态的铁元素之间的转化的应用
⑴ 配制Fe2+的溶液 ⑵ 废水的处理
活动
探究
用毛笔蘸取少量30﹪的FeCl3溶液,在铜片上画一个“+”,放置片刻后,用少量水将铜片上的溶液冲到小烧杯中。观察其变化。
3.与盐溶液的反应 Fe+CuSO4= Cu + FeSO4Cu+AgNO3= Ag + Cu﹙NO3﹚2
讲解总结
Fe ----------- Fe2+
Fe ----------- Fe3+
倾听,思考、做笔记
培养学生的理解、总结归纳的能力
过渡
铁与不同的氧化剂反应,会转化为不同价态的铁的化合物,那么,我们如何进行鉴别?
思考、阅读信息提示并设计鉴别方案
培养学生的实验设计能力
板书
三、Fe2+、Fe3+的检验
实验设计
⑴在2支试管中分别加入10mlFeCl2溶液和FeCl3溶液直接观察颜色
⑵各滴加几滴KSCN溶液,观察现象
⑶再取2支试管,分别加入10mlFeCl2溶液和FeCl3溶液,然后,各滴加几滴加NaOH溶液
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
从 自 然 界 获 取仙
居 中
铁学 和尹
沧
铜浪
陈列于新疆地质矿产博物馆重达30吨、 世界排行第三(按重量)的大陨铁。
常见的铁矿石
陨铁
赤铁矿(Fe2O3)
磁铁矿(Fe3O4)
褐铁矿
(Fe2O3·nH2O )
黄铁矿(FeS2 )
常见的铜矿石
黄铜矿(CuFeS2)
孔雀石(Cu2(OH)2CO3 )
大自然给予了我们很多美好的东西,只是我们自己却不知道去好好珍惜,只有当我们在失去后或者犯错了,我们才会去说后悔没有珍惜,希望能给一次机会重新来过,只是这样的重来真的还能重来吗?我们谁都不能去肯定,路,自己选择,自己走下去,也许有人给你使绊,也许有人会拉你一把,但终归还是需要自己去选择,自己亲自去走。人生经历太多,失败了、跌倒了,可以站起来继续走,如果走错了,可以选择正确的路,但我们如果放弃了,就有可能一直停留在那,多年以后,或许你已经被遗忘。
回忆的老墙,偶尔依靠,黄花总开不败,所有囤积下来的风声雨声,天晴天阴,都是慈悲。时光不管走多远,不管有多老旧,含着眼泪,伴着迷茫,读了一页又一页,一直都在,轻轻一碰,就让内心温软。旧的时光被揉进了岁月的折皱里,藏在心灵的沟壑,直至韶华已远,才知道走过的路不能回头,错过的已不可挽留,与岁月反复交手,沧桑中变得更加坚强。
2CuFeS2+O2=Cu2S+2FeS+SO2↑ 2Cu2S+3O2=2Cu2O+2SO2↑ 2Cu2O+Cu2S=6Cu+SO2↑
(了解内容,不必掌握)
三. 铜的冶炼
1.湿法炼铜:(古代)
Fe+CuSO4=FeSO4+Cu 氧化还原反应
氧化剂: CuSO4 还原剂: Fe 2.火法炼铜:
原料: 黄铜矿
老李一般在家休息,负伤的地方经常疼痛难忍。家里有老婆姓元,大儿子当时工作了,还有两个孩子在读书。老石呢,由于是个工程师专门修理无线电的,厂里人的电器坏了一般都让老石修理,所以一下班吃完饭他就忙着给别人修理电器。老赵由于是个采购员,一天就是给食堂买粮食和各种蔬菜。老吴是个教师一般都是上课,但是还有两个寒暑假期。老吴的家里人口最多,五个儿子一个女儿,加上老两口,一共八口人。 物质缺乏的年代,大家过得都是差不多的日子,这四家就属老干部老李条件最好,一般买东西都是要用粮票、布票、肉票。要是没有这些票证的话,就算你有钱出去也会饿死的。老干部的待遇好一点,经常用不了那些票证,于是老李就常常把用不完的票证分给了这些邻居。
风景在路上,我们需要去寻找,才能找到真正的自己,谁都有无奈,谁都有生活的压力,只是你们的选择不一样,当你走上自己的路,或许你会觉得轻松,或许你会觉得很难,但那终归是属于自己的路,因为生活,始终在你手中。是在医院渡过,然而和母亲在一起的毎一刻都是温暖美好的。四年前,母亲还是离开了这个世界,离开了我。生命就是如此脆弱,逝去和別离,陈旧的情绪某年某月的那一刻如水泻闸。水在流,云在走,聚散终有时,不贪恋一生,有你的这一程就是幸运。那是地久天长的在我的血液中渗透,永远在我的心中,在我的生命里。
毛赤铜矿(Cu2O )
蓝铜矿(Cu3(CO3)2(OH)2 )
一.铁、铜在自然界中的存在形式:
1、铁以化合态形式存在于自然界,游离态的铁来 自陨石。 铁的存在:磁铁矿(Fe3O4)、赤铁矿(Fe2O3 )等
2、铜主要以化合态存在于自然界, 铜的存在:黄铜矿(CuFeS2) 、 孔雀石(CuCO3· Cu(OH)2) 铜有少量的以游离态形式存在自然界
探究一:
如何将铁、铜从化合态价)
原理:用还原剂把铁、铜从化合态
还原到游离态.
常见的还原剂:H2、C、CO、金属
写一写:
请完成P72交流与讨论表3-3.
查漏补缺:
生成铁的化学方程式 生成铜的化学方程式
3H2+Fe2O3 2Fe+3H2O
H2+CuO Cu+H2O
3CO+Fe2O3 2Fe+3CO2
CO+CuO Cu+CO2
3C+2Fe2O3 4Fe+3CO2 2Al+Fe2O3 Al2O3+2Fe
C+2CuO 2Cu+CO2 Fe+CuCl2 Cu+FeCl2
想一想:
人类如何从自然界获取铁?
古代炼铁
古代炼铁, 设备是极其简 单的土窑;原 料为铁矿石和 木炭。
时光就是这么不经用,很快自己做了母亲,我才深深的知道,这样的爱,不带任何附加条件,不因万物毁灭而更改。只想守护血浓于水的旧时光,即便峥嵘岁月将容颜划伤,相信一切都是最好的安排。那时的时光无限温柔,当清水载着陈旧的往事,站在时光这头,看时光那头,一切变得分明。执笔书写,旧时光的春去秋来,欢喜也好,忧伤也好,时间窖藏,流光曼卷里所有的宠爱,疼惜,活色生香的脑海存在。
窑里边堆 上木炭,上面 放上铁矿石, 炼出的铁水顺 炉内通道汇聚 于炉底,再从 一小口流出, 便可以作为生 铁使用了。
C+O2点==燃CO2
高温
CO2+C==2CO
3CO+ Fe2O3 高温 2Fe+3CO2
交流与讨论:
想一想:
即使科技水平发展到现在,目前所用的炼铁方法基本还
是此法在。只古不代过炼设备铁和中工的艺已主先要进还了许原多剂。是请你不从是生木产的碳? 连响如续等果性方,面不原对是料古,的代利炼那用铁是率设什(备反和么应工物是艺质否进充行?分评涉)价及以,及并的对提主环出要境改的进化影意 见学。反应有哪些?
是的,折枝的命运阻挡不了。人世一生,不堪论,年华将晚易失去,听几首歌,描几次眉,便老去。无论天空怎样阴霾,总会有几缕阳光,总会有几丝暗香,温暖着身心,滋养着心灵。就让旧年花落深掩岁月,把心事写就在素笺,红尘一梦云烟过,把眉间清愁交付给流年散去的烟山寒色,当冰雪消融,自然春暖花开,拈一朵花浅笑嫣然。
听这位老友,絮絮叨叨地讲述老旧的故事,试图找回曾经的踪迹,却渐渐明白了流年,懂得了时光。过去的沟沟坎坎,风风雨雨,也装饰了我的梦,也算是一段好词,一幅美卷,我愿意去追忆一些旧的时光,有清风,有流云,有朝露晚霞,我确定明亮的东西始终在。静静感念,不着一言,百转千回后心灵又被唤醒,于一寸笑意中悄然绽放。
人,活着其实很累,在公司,上有可能需要讨好领导,下还需要和同事打好关系,回家需要处理好家庭的关系,交际需要维护好朋友自己的友谊,一不小心就有可能会各种质疑的话语,让我们心里、身体上背负着更重的压力。
也许经常有这样的场景,喧嚣的闹市,聚会上,热闹非凡,尽情的喝着酒,各种嘈杂,殊不知在心里巴不得这聚会早点结束就好,想着明天还要早起上班,想着家里的妻儿还在幽幽的盼着,而你自己也根本就不喜欢这样的场合,偶尔还可以,时间长了,你已经不知该怎样去选择。年纪越大,时间越来越少,身体越来越没以前那么能抗,而自己明白的事情却越来越迷茫,入夜时分,站在这个城市的中央,越来越觉得生活的选择已经不由的我们自己来做主,只剩下了莫名的伤感。
系?炼钢原理?
生铁含碳2% ~ 4.5%,将生铁进一 步炼制,就可以得到用途更广泛的钢 (含碳0.03% ~ 2%).
炼钢就是对生铁降碳、去硫磷、调硅锰 含量的过程.
那么人类又是如何从自然界获取铜? “古代”人类是怎样炼铜的? 现在的冶炼方法?
火法炼铜
把精矿砂、熔剂(石灰石)和燃料混合, 投入“密闭”鼓风炉中,在1000℃左右进行熔炼。
唯用一枝瘦笔,剪一段旧时光,剪掉喧嚣尘世的纷纷扰扰,剪掉终日的忙忙碌碌。情也好,事也罢,细品红尘,文字相随,把寻常的日子,过得如春光般明媚。光阴珍贵,指尖徘徊的时光唯有珍惜,朝圣的路上做一个谦卑的信徒,听雨落,嗅花香,心上植花田,蝴蝶自会来,心深处自有广阔的天地。旧时光难忘,好的坏的一一纳藏,不辜负每一寸光阴,自会花香满径,盈暗香满袖。每个人都有自己的精神家园,而对于记忆中的几户人家,我更有着刻骨铭心的情感。 上个世纪六七十年代,在陕西的某城市的郊区一个大院子里住了四家人。一家人姓赵四十岁左右,是一个食堂的采购员;姓李的一家人是个老离休干部,也是一个军人。曾经在解放战争时期受过伤,当时他的腿上留有敌人手榴弹炸的弹片在里头呢;东面的一家姓石,是一个搞电子的工程师;西面一家姓吴,老吴是一个中学教师。
是 CO ,由于矿石中有杂质,需除去,所 加造渣剂为 石灰石.
用这种方法炼出的铁是含碳2%~4.5% 的 生铁 ,将生铁进一步冶炼,就可以得到
用途广泛的钢。
2.关于炼铁原理下列叙述正确的是( D ) A.铁矿石在高温下被氧化成铁 B.生铁中杂质被氧化 C.铁矿石在高温下被焦炭还原成铁 D.铁矿石在高温下被CO还原成铁
3 .生物炼铜(自学P73)
高 温 冶 炼
(粗铜
电解
精铜)
不同金属冶炼方法的选择
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag
电解法
热还原法 热分解法
练习: 1.铁的冶炼:
工业上铁的冶炼是在 高炉 中进行的。 原料有铁矿石、 焦炭 、 空气 和石灰石等。
在冶炼过程中,铁元素被还原,还原剂
时光在飞逝,父母容颜渐渐沧桑,望着父母佝偻的背影,心里一阵阵莫名的心酸。年轻时不努力拼搏,老了就自己受苦,这是现在年轻人经常激励自己的话,为了所谓的以后,我们牺牲了自己最美好的年华,却没有谁知道以后的样子又会是如何,也许这就是所谓的选择。
