山东省泰安市宁阳一中2017-2018学年高二上学期阶段性考试一化学试题 Word版含答案
山东省泰安市宁阳县2017-2018学年高一第一学期阶段性考试化学试卷一

山东省泰安市宁阳县2017-2018学年高一化学上学期阶段性考试试题一本试卷分选择题和非选择题两部分,时间 90分钟满分 100分常用相对原子质量:H:1 C:12 N:14 O:16 Na:23 Cl:35.5 S:32 K:39 Fe:56第Ⅰ卷(选择题,共60分)一、选择题(每题只有一个选项符合题意,每题2分,共60分。
)1、将一小块金属钠长期露置于空气中发生一系列变化,最终产物是:()A.NaOH B.Na2O C.Na2O2 D.Na2CO32、漂白粉的有效成分是()A.Ca(OH)2 B.Ca(ClO)2 C.CaCl2 D.CaCO33、下列有关实验现象的叙述,不正确的是()A.氢气在氯气中燃烧,发出苍白色火焰 B.铁丝在氯气中燃烧,生成红棕色烟C.钠在氯气中燃烧,生成白色的烟 D.铜丝在氯气中燃烧,生成蓝色的烟4、下列关于氯水的叙述,正确的是()A.新制的氯水中只含Cl2和H2OB.新制的氯水可使蓝色的石蕊试纸先变红后褪色C.光照氯水有气泡逸出,该气体是Cl2D.氯水放置数天后酸性将减弱5、下列有关阿佛加德罗常数(N A)的说法错误的是()A.22.4L O2所含的原子数目为N AB.0.5mol H2O含有的原子数目为1.5N AC.1mol H2O含有的H2O分子数目为N AD.0 5 N A个氯气分子的物质的量是0.5mol6、下列说法正确的是()A.标准状况下,11.2L酒精所含分子数为0.5NAB.实验测得1mol某气体体积为22.4L,测定条件不一定是标准状况C.摩尔是七个基本物理量之一D.将40gNaOH溶解在1L水中所得溶质的物质的量浓度为1mol/L7、研究物质性质的基本程序有:①预测物质的性质;②观察物质的外观;③解释和结论;④实验和观察。
其中,正确的顺序为()A.②①④③B.①②③④ C.③①②④D.④③②①8、下列物质中,不能由两种单质直接化合得到的是()A.HCl B.CuCl2C.FeCl2D.H2O9、下列溶液与20mL 1 mol·L—1 NaNO3溶液中NO3—物质的量浓度相等的是()A.10 mL 1 mol·L—1 Mg(NO3)2溶液 B.5 mL 0.8 mol·L—1 Al(NO3)3溶液C.10 mL 2 mol·L—1 AgNO3溶液 D.10 mL 0.5 mol·L—1 Cu(NO3)2溶液10、实验室的尾气中含有较多的氯气,要吸收这些尾气,下列试剂最适合的是()A.饱和的石灰水 B.饱和的食盐水 C.自来水 D.烧碱溶液11、实验室里做钠跟水反应的实验时,用到的仪器和药品是()①试管夹②镊子③小刀④滤纸⑤研钵⑥烧杯⑦坩埚⑧石棉网⑨玻璃片⑩药匙A.①②③④ B.②③④⑥⑨ C.③④⑧⑨⑩ D.②⑤⑦⑨⑩12、实验室要用固体氯化钠试剂准确配制0.5 L 0.2 mol·L-1的NaCl溶液,下列哪种仪器不是必须使用的()A.500 mL容量瓶 B.胶头滴管 C.试管 D.托盘天平13、现有CO、CO2、O3(臭氧)三种气体,它们分别都含有1mol氧原子,则三种气体的物质的量之比为()A.1∶1∶1 B.1∶2∶3 C.3∶2∶1 D.6∶3∶214、将30 mL 0.5mol/L的NaOH溶液加水稀释到500 mL,稀释后NaOH的物质的量浓度为()A.0.3 mol/L B.0.03 mol/L C.0.05 mol/L D.0.04 mol/L15、设N A为阿佛加德罗常数,下列说法正确的是()①标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为N A②同温同压下,体积相同的氢气和氩气所含的分子数相等③1L 2mol/L的氯化镁溶液中含氯离子为4N A④标准状况下22.4LH2O中分子数为N A⑤在过氧化钠中,阴阳离子个数比为1:2A.①②③④ B.③④ C.①③④ D.①②③⑤16、下列叙述正确的是()A.1 mol H2O的质量为18g/molB.CH4的摩尔质量为16gC.3.01×1023个SO2分子的质量为32gD.标准状况下,1 mol任何物质体积均为22.4L17、在0.5 L某浓度的NaCl溶液中含有0.5 mol Na+,下列对该溶液的说法中,不正确的是()A.该溶液的物质的量浓度为1 mol·L-1B.该溶液中含有58.5 g NaClC.配制100 mL该溶液需用5.85 g NaClD.量取100 mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.1 mol18、同温同压下,同体积的甲乙两种气体的质量比是17:14。
20182019高二化学10月月考试题带答案山东泰安宁阳一中
-1
20仃级高1
年-
1级上学
1期阶段性:
-fz.考
试一
化学「试J题本试卷分
彷第I
卷
F(选
择题)和第一
卷
'(非选择题)
两部分。考试E
结
1■
束后,将答
$题
1纸
利答题卡-
、人 并
'交回。[试卷-
满
分
1(
)0分,
考试
吉时
间90分钟
。
第I卷
(选
择
共60分)
可能
电用到
刃的相
寸对
亠原子质量:
H1
C
120「16
每
生'
成
2
分
子
AE
放
出
bkJ
热量.C.该反应中反应物的I总能量低于生成物
的总能量oT断裂ihclA-A键吸收akJ能量
3
.已
已知热
/学
方程式:
2A(g
)+B(g
J) 2C(c
J
A
H=
QkJ?
m(
)I-1(Q?0
')。下厶
列说法
F正确*
的是
()
A.
相同7
条件
:、
,2m(
)iA(g)
和1巾。B(g
)所具
组
同
学
设
想
如
果
模
拟
工
业
上
离
子
交
换
膜
法
制
烧
碱
的
方
法
用
电
源
山东省泰安市宁阳县2017-2018学年高二化学上学期阶段性考试试题一

山东省泰安市宁阳县2017-2018学年高二化学上学期阶段性考试试题一本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷1-5页和第Ⅱ卷6-8页。
满分100分,考试时间90分钟相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 K 39 Fe 56 Zn 65 Cu 64第Ⅰ卷 (共50分)选择题(每题2分,共50分)1.下列能源组合中,均属于新能源的一组是( )①天然气;②煤;③核能;④石油;⑤太阳能;⑥生物质能;⑦风能;⑧氢能.A .①②③④B .①⑤⑥⑦⑧C .③④⑤⑥⑦⑧D .③⑤⑥⑦⑧2.下列关于盖斯定律的说法不正确的是( )A .不管反应是一步完成还是分几步完成,其反应热相同B .反应热只与反应体系的始态和终态有关,而与反应的途径无关C .有些反应的反应热不能直接测得,可通过盖斯定律间接计算得到D .根据盖斯定律,热化学方程式中△H 直接相加即可得总反应热3.已知化学反应A 2(g )+B 2(g )═2AB(g )△H=Q kJ•mol ﹣1,其能量变化如图所示,则Q的值正确的是( )A .a ﹣bB .aC .﹣bD .b ﹣a4.已知在298K 时下述反应的有关数据如下:C (s )+21O 2(g )═CO(g )△H 1=﹣110.5kJ•mol ﹣1 C (s )+O 2(g )═CO 2(g )△H 2=﹣393.5kJ•mol ﹣1则C (s )+CO 2(g )═2CO (g )的△H 为( )A .+283.5 kJ•mol ﹣1B .﹣172.5 kJ•mol ﹣1C .+172.5 kJ•mol ﹣1D .﹣504 kJ•mol ﹣15.已知1g 氢气完全燃烧生成水蒸气时放出热量121kJ ,且氧气中1mol O=O 键完全断裂时吸收热量496kJ ,水蒸气中1mol H ﹣O 键形成时放出热量463kJ ,则氢气中1mol H ﹣H 键断裂时吸收热量为( )A .920kJB .557kJC .436kJD .188kJ6.以下几个热化学方程式,能表示燃烧热的热化学方程式是( )A .C (s )+21O 2(g )═CO(g )△H=110.5 kJ•mol ﹣1 B .C (s )+O 2(g )═CO 2(g )△H=﹣393.5 kJ•mol ﹣1C .2H 2(g )+O 2(g )═2H 2O (l )△H=﹣571.6 kJ•mol ﹣1D .H 2(g )+21O 2(g )═H 2O (g )△H=﹣241.8 kJ•mol ﹣1 7.实验室用4mol SO 2与2mol O 2进行下列反应:2SO 2(g )+O 2(g )2SO 3(g );△H=﹣196.64kJ/mol ,当放出314.624kJ 热量时,SO 2的转化率为( )A .40%B .50%C .80%D .90%8.已知:H 2(g )+F 2(g )═2HF(g )△H=﹣270kJ/mol ,下列说法正确的是( )A .2L 氟化氢气体分解成1L 的氢气和1L 的氟气吸收270kJ 热量B .1mol 氢气与1mol 氟气反应生成2mol 液态氟化氢放出的热量小于270kJC .在相同条件下,1mol 氢气与1mol 氟气的能量总和大于2mol 氟化氢气体的能量D .1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ 热量9.已知反应:①101kPa 时,C (s )+21O 2(g )═CO(g )△H 1=﹣110.5kJ/mol ②稀溶液中,H +(aq )+OH ﹣(aq )═H 2O (l )△H 2=﹣57.3kJ/mol .下列结论正确的是( )A .若碳的燃烧热用△H 3来表示,则△H 3<△H 1B .若碳的燃烧热用△H 3来表示,则△H 3>△H 1C .浓硫酸与稀NaOH 溶液反应的中和热为57.3kJ/molD .稀醋酸与稀NaOH 溶液反应生成1mol 水,放出57.3kJ 热量10.已知充分燃烧a g 乙炔气体时生成1mol 二氧化碳气体和液态水,并放出热量b kJ ,则乙炔燃烧的热化学方程式正确的是( )A .2C 2H 2(g )+5O 2(g )═4CO 2(g )+2H 2O (l );△H=﹣4b kJ/molB .C 2H 2(g )+25O 2(g )═2CO 2(g )+H 2O (l );△H=2b kJ/mol C .2C 2H 2(g )+5O 2(g )═4CO 2(g )+2H 2O (l );△H=2b kJ/molD .2C 2H 2(g )+5O 2(g )═4CO 2(g )+2H 2O (l );△H=b kJ/mol11.室温下将1mol 的CuSO 4•5H 2O (s )溶于水会使溶液温度降低,热效应为△H1,将1mol 的CuSO 4(s )溶于水会使溶液温度升高,热效应为△H 2;CuSO 4•5H 2O 受热分解的化学方程式为:CuSO 4•5H 2O (s )═CuSO 4(s )+5H 2O (l ),热效应为△H 3.则下列判断正确的是( )A .△H 2>△H 3B .△H 1>△H 3C .△H 1=△H 2+△H 3D .△H 1+△H 2>△H 312.化学能与热能、电能等能相互转化.关于化学能与其他能量相互转化的说法正确的是( )图I 图IIA .化学反应中能量变化的主要原因是化学键的断裂与生成B .铝热反应中,反应物的总能量比生成物的总能量低C .图I 所示的装置能将化学能转变为电能D .图II 所示的反应为吸热反应13.某原电池总反应的离子方程式为:2Fe 3++Fe═3Fe 2+,能实现该反应的原电池是( )A .正极为Cu ,负极为Fe ,电解质溶液为FeCl 3溶液B .正极为C ,负极为Fe ,电解质溶液为FeSO 4溶液C .正极为Fe ,负极为Zn ,电解质溶液为Fe 2(SO 4)3溶液D .正极为Ag ,负极为Cu ,电解质溶液为CuSO 4溶液14.如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
山东省泰安市宁阳一中2017-2018学年高二上学期阶段性考试二(文)

山东省泰安市宁阳一中2017-2018学年高二上学期阶段性考试二(文)一、选择题(每题5分共60分)1.命题“”的否命题...是 ( ) A. B.C. D.2.{n a }是公差为1的等差数列,n s 是其前n 项和,若484s s =,则10a =( ) A .219 B .217 C .10 D .123. 已知数列,,29,23,17,11,5 则55是它的第( )项A .19B .20C .21D .224.已知椭圆方程221259x y +=,椭圆上点M 到该椭圆一个焦点1F 的距离为2,N 是1MF 的中点,O 是椭圆的中心,那么线段ON 的长度为( )A.2 B.4 C.8 D.325.已知数列{}n a 为等比数列,其前n 项和13n n S t -=+,则t 的值为( )A .1-B . 3- C. 13- D .16.设{}n a 是公比为q 的等比数列,则“1q >”是“{}n a 为递增数列”的( )A.充分不必要条件B.必要不充分条件C.充要条件D.既不充分也不必要条件7.对2,10x R kx kx ∀∈--<是真命题,则k 的取值范围是( )A.-4≤k ≤0B. -4<k ≤0C. -4≤k <0D.-4<k <0 8. 已知椭圆141622=+y x ,过点P(2,1)且被点P 平分的椭圆的弦所在的直线方程是( ) A.0178=-+y x B.042=-+y x C.02=-y x D. 0158=--y x,11a b a b >->-若则,11a b a b >-≤-若则,11a b a b >-<-若则,11a b a b ≤-≤-若则,11a b a b <-<-若则9.已知椭圆C :x 2a 2+y 2b 2=1(a>b>0)的左、右顶点分别为A 1,A 2,且以线段A 1A 2为直径的圆与直线bx -ay +2ab =0相切,则C 的离心率为( ) A.63 B.33 C.23 D.1310.直线l 经过椭圆的一个顶点和一个焦点,且椭圆的中心到l 的距离为其短轴长的41, 则该椭圆的离心率为( )A. 31B. 21C. 32D. 43 11.△ABC 中角A,B,C 所对边分别为a,b,c,且sinB+sinA(sinC -cosC)=0,a=2,c=2,则C=( ) A. 12π B. 3π C. 4π D. 6π 12.A,B 是椭圆C: 1322=+my x 的长轴顶点,在C 上存在点M 使得묝︒=∠120AMB ,则m 的取值范围是( ) A ),4[]3,0(+∞⋃ B ),9[]3,0(+∞⋃ C .),4[]1,0(+∞⋃ D .),9[]1,0(+∞⋃二、填空题(每题5分共20分)13. 在约束条件2203603230x y x y x y +-≥⎧⎪-+≥⎨⎪--≤⎩下,目标函数y x z +=的最小值为 .14.已知P 为平面内的一个动点,12(10)(10)F F -,,,,且12F F 是1PF 和2PF 的等差中 项.求动点P 的轨迹方程 ; 15.若直线)0,0(1>>=+b a by a x 过点(1,2),则2a+b 的最小值为____________. 16.关于x 的方程012)1(22=-+-mx x m 的一个根小于0,另一个根大于1,则m 的取值范围是___________________.三、解答题(17题10分,18-22题各12分,共70分)17. (10分)已知{}n a 为等差数列,且0,663=-=a a(1)求{}n a 的通项公式;(2)等比数列{}n b 满足32121,8a a a b b ++=-=,求n b(3) 求{}n n a b +的前n 项和n S .18.(12分)已知c bx x x f ++=22)(,不等式0)(<x f 的解集是()5,0.(1)求)(x f 的解析式;(2)若对任意[]1,1-∈x ,不等式2)(≤+t x f 恒成立,求t 的取值范围.19. (12分)已知命题p :不等式2x -x 2<m 对一切实数x 恒成立,命题q :m 2-2m -3≥0,如果“p ⌝”与“p q ∧”同时为假命题,求实数m 的取值范围.20.(12分)在ABC ∆中,a 、b 、c 分别是三内角A 、B 、C 的对应的三边,已知C a A c cos sin -= (1)求角C 的大小;(2)满足2)43cos(sin 3=+-πB A 的ABC ∆是否存在?若存在,求角A 的大小.21.已知椭圆E :x 2a 2+y 2b 2=1(a>b>0)的离心率为22,右焦点为F (1,0). (1)求椭圆E 的标准方程;(2)设点O 为坐标原点,过点F 作直线l 与椭圆E 交于M ,N 两点,若OM ⊥ON ,求直线l 的方程.22.已知椭圆C :x 2a 2+y 2b 2=1(a >b≥1)过点P(2,1),且离心率e =32. 1)求椭圆C 的方程;(2)直线l 的斜率为12,直线l 与椭圆C 交于A ,B 两点,求△P AB 面积的最大值.参考答案 1-6.CACBCD7-12.BBABDD13.1 14. 22143x y += 15. 8 16. (0,1) 17.解:(1)2336=-=a a d ,所以122-=n a n ………………………………4分 (2) 24,821-=-=b b ,所以3=q ,138-•-=n n b ……………………8分(3) 411342+-+•-=n n s n n ………………………………………12分18. 解:(Ⅰ)由题意知5,0==x x 是方程022=++c bx x 的两个根所以得0,10=-=c a 所以x x x f 102)(2-=………………………………6分 (Ⅱ) 原不等式等价于21022++-≤x x t 在[]1,1-∈x 上恒成立令)11(2102)(2≤≤-++-=x x x x g ,则m in )(x g t ≤ ………8分229)25(2)(2+--=x x g Q ,)(x g ∴在上单增………10分 10)1()(min -=-=∴g x g ………………………………………………11分 得10-≤t ………………………………………………12分19. 解:2x -2x =2)1(--x +1≤1所以p 为真时,m>1 …………………………………………3分由322--m m ≥0得m≤-1或m≥3,所以q 为真时,m≤-1或m≥3. …6分 因为“﹁p”与“p ∧q”同时为假命题,所以p 为真命题,q 为假命题, …… 8分 所以得m>1,-1<m<3,解得1<m<3, …………………………11分 故m 的取值范围为(1,3). …………………………………12分20. 解:(1)由正弦定理,得 C A A C cos sin sin sin -=化简得1tan -=C 所以43π=C ………………………………………………4分(2) 由(1) 知2)43cos(sin 3=+---ππA C A , 即2cos sin 3=+A A 化简得1)6sin(=+πA ………………………………8分 所以得3π=A , ……………………………………………………10分因为ππ>=+1213C A 所以这样的三角形不存在。
山东省泰安市2017-2018学年高二上学期期末考试化学试题(解析版)

山东省泰安市2017-2018学年高二上学期期末考试化学试题相对原子质量:H 1 C 12 O 16 Na 23 Al 27 S 32 Zn 65 Ag 108第Ⅰ卷(选择题共50分)一、选择题(本题包括10小题,每小题2分,共20分。
每小题只有一个选项符合题意。
)1. 化学与生产、生活密切相关。
下列叙述正确的是A. 明矾和漂白粉用于自来水的净化和杀菌消毒,两者的作用原理相同B. 将AlCl3、FeCl3、CuCl2溶液直接蒸干均不能得到原溶质C. 铵态氮肥和草木灰(含K2CO3)可以混合施用D. 泡沫灭火器内的玻璃筒里盛碳酸氢钠溶液,铁筒里盛硫酸铝溶液【答案】B..................点睛:盐溶液蒸干灼烧时所得产物的几种判断类型:(1)盐溶液水解生成难挥发性酸时,蒸干后一般得到原物质;盐溶液水解生成易挥发性酸时,蒸干灼烧后一般得对应的氧化物;(2)酸根阴离子易水解的强碱盐,蒸干后得到原物质;(3)考虑盐受热时是否分解;(4)还原性盐在蒸干时被氧气氧化。
2. 在一定温度下发生反应2NO2(g)N2O4(g) ΔH<0,达平衡后,改变下列条件可使混合气体颜色加深的是A. 缩小容器的容积B. 使用催化剂C. 降低体系温度D. 体积不变充入氮气【答案】A【解析】A、缩小容器的容积,组分浓度增大,气体颜色加深,故A正确;B、使用催化剂,平衡不移动,气体颜色不变,故B错误;C、正反应是放热反应,降低温度,平衡向正反应方向移动,气体颜色变浅,故C错误;D、恒容状态下,充入非反应气体,组分浓度不变,气体颜色不变,恒压状态下,充入非反应气体,体积增大,组分浓度降低,气体颜色变浅,故D错误。
3. 下列有关电化学装置图能实现目的的是A. AB. BC. CD. D【答案】C【解析】A、精炼铜时,粗铜作阳极,纯铜作阴极,故A错误;B、电镀时,待镀金属作阴极,镀层金属作阳极,即Ag作阳极,铁作阴极,故B错误;C、铁作阴极,因此可以防止Fe被腐蚀,这叫外加电流阴极保护法,故C正确;D、锌电极应插入到盛有ZnSO4溶液的烧杯中,Cu电极应插入到盛有CuSO4溶液的烧杯中,故D错误。
山东省泰安宁阳一中2018-2019学年高二3月月考化学试卷

宁阳一中2017级高二下学期阶段性考试一化学试题时间:90分钟满分:100分可能用到的相对原子量:H-1 O-16 C-12 N-14 S-32 Cu-64 Mg-24 Ca-40 Na-23Fe-56 Al-27 Cl-35.5一、选择题(本题包括25小题,1--15每小题2分,16--25每小题3分,共60分)1.在分子中,羰基碳原子与甲基碳原子成键时所采取的杂化方式分别为( )A.sp2杂化;sp2杂化B.sp2杂化;sp3杂化C.sp3杂化;sp3杂化D.sp杂化;sp3杂化2.当镁原子由1s22s22p63s2→1s22s22p63p2时,以下认识正确的是( )A.转化后位于p能级上的两个电子处于同一轨道,且自旋方向相同B.镁原子由激发态转化成基态,这一过程中释放能量C.镁原子由基态转化成激发态,这一过程中吸收能量D.转化后镁原子与硅原子电子层结构相同,化学性质相似3.下列说法或有关化学用语的表达正确的是( )A.在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量B.根据原子核外电子排布的特点,Cu在周期表中属于s区元素C.因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大D.基态Fe原子的价电子轨道表示式:4.下列每组物质中化学键类型和分子的极性都相同的是( )A.H2O和CH4 B.NaCl和HCl C.CO2和CS2 D.O2和HBr5.下列说法中正确的是( )A.任何一个能层最多只有s、p、d、f四个能级B.同一原子中,2p、3p、4p能级的轨道数依次增多C.在一个多电子原子中,不可能有两个运动状态完全相同的电子D.在一个多电子原子中,N层上的电子能量肯定比M层上的电子能量高6. 下列各组物质的沸点按由低到高的顺序排列的是( )A.NH3、CH4、NaCl、Na B.H2O、H2S、MgSO4、SO2C.CH4、H2O、NaCl、SiO2 D.Li、Na、K、Rb、Cs7.共价键、离子键和范德华力是粒子之间的三种作用力。
山东省泰安市宁阳县2017_2018学年高一化学上学期阶段性考试试题一2017101801135

山东省泰安市宁阳县2017-2018学年高一化学上学期阶段性考试试题一本试卷分选择题和非选择题两部分,时间90分钟满分100分常用相对原子质量:H:1 C:12 N:14 O:16 Na:23 Cl:35.5 S:32 K:39 Fe:56第Ⅰ卷(选择题,共60分)一、选择题(每题只有一个选项符合题意,每题2分,共60分。
)1、将一小块金属钠长期露置于空气中发生一系列变化,最终产物是:()A.NaOH B.Na2O C.Na2O2 D.Na2CO32、漂白粉的有效成分是()A.Ca(OH)2 B.Ca(ClO)2 C.CaCl2 D.CaCO33、下列有关实验现象的叙述,不正确的是()A.氢气在氯气中燃烧,发出苍白色火焰B.铁丝在氯气中燃烧,生成红棕色烟C.钠在氯气中燃烧,生成白色的烟D.铜丝在氯气中燃烧,生成蓝色的烟4、下列关于氯水的叙述,正确的是()A.新制的氯水中只含Cl2和H2OB.新制的氯水可使蓝色的石蕊试纸先变红后褪色C.光照氯水有气泡逸出,该气体是Cl2D.氯水放置数天后酸性将减弱5、下列有关阿佛加德罗常数(N A)的说法错误的是()A.22.4L O2所含的原子数目为N AB.0.5mol H2O含有的原子数目为1.5N AC.1mol H2O含有的H2O分子数目为N AD.0 5 N A个氯气分子的物质的量是0.5mol6、下列说法正确的是()A.标准状况下,11.2L酒精所含分子数为0.5NAB.实验测得1mol某气体体积为22.4L,测定条件不一定是标准状况C.摩尔是七个基本物理量之一D.将40gNaOH溶解在1L水中所得溶质的物质的量浓度为1mol/L7、研究物质性质的基本程序有:①预测物质的性质;②观察物质的外观;③解释和结论;④实验和观察。
其中,正确的顺序为()A.②①④③B.①②③④C.③①②④D.④③②①8、下列物质中,不能由两种单质直接化合得到的是()A.HCl B.CuCl2 C.FeCl2 D.H2O9、下列溶液与20mL 1 mol·L—1 NaNO3溶液中NO3—物质的量浓度相等的是()A.10 mL 1 mol·L—1 Mg(NO3)2溶液B.5 mL 0.8 mol·L—1 Al(NO3)3溶液C.10 mL 2 mol·L—1 AgNO3溶液D.10 mL 0.5 mol·L—1 Cu(NO3)2溶液10、实验室的尾气中含有较多的氯气,要吸收这些尾气,下列试剂最适合的是()A.饱和的石灰水B.饱和的食盐水C.自来水D.烧碱溶液11、实验室里做钠跟水反应的实验时,用到的仪器和药品是()①试管夹②镊子③小刀④滤纸⑤研钵⑥烧杯⑦坩埚⑧石棉网⑨玻璃片⑩药匙A.①②③④B.②③④⑥⑨C.③④⑧⑨⑩D.②⑤⑦⑨⑩12、实验室要用固体氯化钠试剂准确配制0.5 L 0.2 mol·L-1的NaCl溶液,下列哪种仪器不是必须使用的()A.500 mL容量瓶B.胶头滴管C.试管D.托盘天平13、现有CO、CO2、O3(臭氧)三种气体,它们分别都含有1mol氧原子,则三种气体的物质的量之比为()A.1∶1∶1 B.1∶2∶3 C.3∶2∶1 D.6∶3∶214、将30 mL 0.5mol/L的NaOH溶液加水稀释到500 mL,稀释后NaOH的物质的量浓度为()A.0.3 mol/L B.0.03 mol/L C.0.05 mol/L D.0.04 mol/L15、设N A为阿佛加德罗常数,下列说法正确的是()①标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为N A②同温同压下,体积相同的氢气和氩气所含的分子数相等③1L 2mol/L的氯化镁溶液中含氯离子为4N A④标准状况下22.4LH2O中分子数为N A⑤在过氧化钠中,阴阳离子个数比为1:2A.①②③④B.③④C.①③④D.①②③⑤16、下列叙述正确的是()A.1 mol H2O的质量为18g/molB.CH4的摩尔质量为16gC.3.01×1023个SO2分子的质量为32gD.标准状况下,1 mol任何物质体积均为22.4L17、在0.5 L某浓度的NaCl溶液中含有0.5 mol Na+,下列对该溶液的说法中,不正确的是()A.该溶液的物质的量浓度为1 mol·L-1B.该溶液中含有58.5 g NaClC.配制100 mL该溶液需用5.85 g NaClD.量取100 mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.1 mol18、同温同压下,同体积的甲乙两种气体的质量比是17:14。
山东省泰安市宁阳一中2018-2019学年高二上学期10月月考化学试题(含答案)

宁阳一中2017级高二年级上学期阶段性考试一化学试题本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
考试结束后,将答题纸和答题卡一并交回。
试卷满分100分,考试时间90分钟。
第Ⅰ卷(选择题共60分)可能用到的相对原子质量:H 1 C 12 O 16 S 32 Cl 35.5 Ca 40 Al 27 Cl35.5Cu 64 Fe 56 Mg 24 Zn 65一、选择题:本题共25小题,1--15每小题2分。
16--25每小题3分满分60分,每题只有一个选项是最符合题意的。
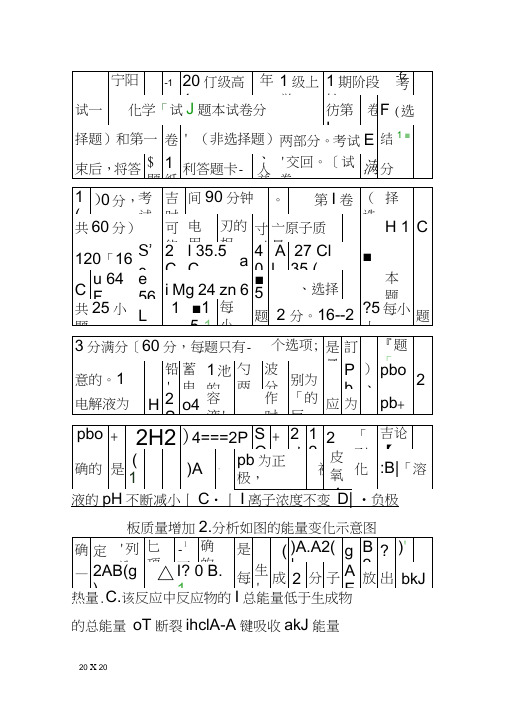
1.铅蓄电池的两极分别为Pb、PbO2,电解液为H2SO4溶液,工作时的反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O,下列结论正确的是()A.Pb为正极,被氧化B.溶液的pH不断减小SO 离子浓度不变D.负极板质量增加C.242.分析如图的能量变化示意图,确定下列选项中正确的是 ( )A.A2(g)+B2(g)=2AB(g) △H﹤0B.每生成2分子AB放出bkJ热量C.该反应中反应物的总能量低于生成物的总能量D.断裂1molA-A键吸收akJ能量3.已知热化学方程式:2A(g)+B(g)2C(g) ΔH=-QkJ·mol-1(Q﹥0)。
下列说法正确的是( )A.相同条件下,2molA(g)和1molB(g)所具有的总能量小于2mol C(g)所具有的能量B.增大压强或升高温度,该平衡都向逆反应方向移动C.将2molA(g)和1molB(g)置于一密闭容器中充分反应后,放出热量为QkJD.如将一定量A(g)和B(g)置于某密闭容器中充分反应放热Q kJ,则此过程中有2molA(g)被消耗4. 高温下,某反应达到平衡,平衡常数)H (c )CO (c )O H (c )CO (c k 222⋅⋅=,恒容时,温度升高,H 2浓度减小,下列说法正确的是( )A .该反应的焓变为正值B .恒温恒容下,增大压强,H 2浓度一定减小C .升高温度,逆反应速率减小D .该反应化学方程式为CO +H 2O CO 2+H 25.A 、B 、C 是三种金属,根据下列①、②两个实验:①将A 与B 浸在稀硫酸中用导线相连,A 上有气泡逸出,B 逐渐溶解;②电解物质的量浓度相同的A 、C 盐溶液时,阴极上先析出C (使用惰性电极)。
山东省泰安市2017-2018学年高二上学期期末考试化学试题扫描版缺答案

试卷类型:A高二年级考试化学试题2OIX.2本试卷分第I卷(选择题)和第U卷(非选择题)两部分,第I卷1至4页•第U卷5 至8页。
满分100分•考试时间90分钟。
相对原子质M::H 1 C 12 0 16 Na 23 Al 27 S 32 Zn 65 Ag 108第I卷(选择题共50分)注意事项:1. 存第I卷前,与生务必将白己的姓名、考号、试卷类型、考试科目用铅笔涂写在答时上。
*2. 毎小题选出答案后•用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦F净肩,山选涂其他答案,不能答在试卷上。
3. 乌试结柬斤监歩人从将本试卷和答题卡一并收【眼一、选择題(本题包括10小題,每小题2分,共20分。
每小题只有一个选项符合題意。
)• • • •1. 化学9生产、生活密切相关。
F列叙述正确的是A.明矶和漂白粉用r n来水的净化和杀菌消"者的作用尿理相同B. 将AICh、FeCh、CuC12涪液ff接蒸干均不能得到1O质C. 戦念氮肥和箪木灰(含K丄0J 4以混合施用I).泡诛火火器内的玻增简必碳战魚钠游液,铁簡恫盛硫酿铝帑液2・在一定温度卜发4:•反应2N()3 ; ±N.()4(K) A/Z<0,达平衡后,改变下列条件可便混令气体骸色加深的是A. 缩小容器的容积B. 化剂C.降低体系温度D.体枳不变允人飙气岛二化学试题第1页(共X页)A B C Drl'ln F w A8 AgNOa 溶液 Zn 、 ■一粗铜 石叩 ■ 一严桥 jj-4?Cu OM M BCuSO <溶液 NaCl 溶液 CuSO <溶液ZnSO <溶液 铜的粘炼 铁上镀银 防止Fe 被腐烛 构成铜锌原电池3.下列右关电化学冥牡图能实现11的的址4. 对0.1 moM.-'醋酸溶液住25弋下的稀释过程•不正确的是 A. 醋赧的电离平衡常数不变B. 溶液中[H ・]截小C. r(H )/(((;lhCOOH)增大 【).卿酸溶液中所冇离子的浓度均减少 5. 埋任地下的钢借道可以用如图所示方法进行保护。
山东省宁阳县2017-2018学年高二第一学期期中化学试卷

2017----2018学年度高二化学期中测试题 说明:本试卷包括第I 卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分。
考试时间90分钟。
2017.11第I 卷(选择题,共50分)一、选择题(包括20小题,1-10每小题2分,11-20每小题3分,共50分。
每小题只有一个选项符合题意)1.室温下,水的电离达到平衡:H 2O H ++OH -。
下列叙述正确的是( )A .将水加热,平衡向正反应方向移动,K W 不变B .向水中加入少量盐酸,平衡向逆反应方向移动,c (H +)增大C .向水中加入少量NaOH 固体,平衡向逆反应方向移动,c (OH -)降低D .向水中加入少量CH 3COONa 固体,平衡向正反应方向移动,c (OH -)=c (H +)2.醋酸溶液中存在电离平衡:CH 3COOH H ++CH 3COO -,下列叙述不正确的是( )A .CH 3COOH 溶液中离子浓度的关系满足:c (H +)=c (OH -)+c (CH 3COO -)B .CH 3COOH 溶液中加入少量CH 3COONa 固体,平衡逆向移动C .0.1 mol/L 的CH 3COOH 溶液加水稀释,溶液中c (OH -)减小D .常温下,pH =2的CH 3COOH 溶液与pH =12的NaOH 溶液等体积混合后,溶液的pH <73.用水稀释0.1mol·L -1氨水时,溶液中随着水量的增加而减小的是 ( )A.c(OH -)/c(NH 3·H 2O)B.c(NH 3·H 2O)/c(OH -)C.n (OH -)D. c (H +)4. 物质的量浓度相同的下列溶液中,NH 4+浓度最大的是( )A. NH 4ClB. NH 4HCO 3C. CH 3COONH 4D. NH 4HSO 45、下列事实可证明氨水是弱碱的是( )A 、氨水能跟氯化铁溶液反应生成氢氧化铁 B. 铵盐受热易分解C . 0.1mol •L -1氨水可以使酚酞试液变红D .0.1mol •L -1氯化铵溶液的pH 约为56. 把0.01mol 纯净的烧碱固体分别投入下列100mL 的溶液中,溶液的导电能力有明显变化的是( )A 0.5 mol •L -1的硫酸B 0.5 mol •L -1的醋酸溶液C 0.25 mol •L -1的盐酸D 0.25 mol •L -1的硫酸铜溶液7.下列各组物质分别溶于水后蒸干灼烧,最后得到同一种固体的是( )A. 311A C 和氯化铵B. 3211FeC FeC 和C .24331()11A SO A C 和 D. 1KC KOH 和8.下列物质的稀溶液中,溶质的阴、阳离子个数之比为1∶2的是( )A .K 2SO 4B .Na 2CO 3C .(NH 4)2SO 4D .NH 4HCO 39.某酸式盐NaHY 的水溶液显碱性,下列叙述正确的是( )A .H 2Y 的电离方程式:H 2Y2H ++Y 2- B .HY -的水解方程式:HY -+H 2OH 3O ++Y 2- C .该酸式盐溶液中离子浓度关系:[Na +]>[HY -]>[OH -]>[H +]D .该酸式盐溶液中离子浓度关系:[Na +]>[Y 2-]>[HY -]>[OH -]>[H +]10. 欲使0.1mol/L K 2CO 3溶液中[K +]==2[CO 32-],应采取的措施是( )A.加少量盐酸B.加适量KOHC.加适量水D.加适量NaOH11. 下面提到的问题中,与盐的水解无关的正确说法是 ( )①明矾和FeCl 3可作净水剂.②为保存FeCl 3溶液,要在溶液中加少量盐酸.③实验室配制AlCl 3溶液时,应先把它溶在盐酸中,而后加水稀释.④NH 4Cl 与ZnCl 2溶液可作焊接中的除锈剂.⑤实验室盛放Na 2CO 3、Na 2SiO 3等溶液的试剂瓶应用橡皮塞,而不能用玻璃塞. ⑥用NaHCO 3与Al 2(SO 4)3两种溶液可作泡沫灭火剂.⑦在NH 4Cl 或AlCl 3溶液中加入金属镁会产生氢气.⑧长期使用硫铵,土壤酸性增强;草木灰与铵态氮肥不能混合施用.⑨比较NH 4Cl 和Na 2S 等溶液中离子浓度的大小或某些盐溶液的酸碱性.A .①④⑦ B.②⑤⑧ C.③⑥⑨ D.全有关.12. 在PH 都等于9的NaOH 和CH 3COONa 两种溶液中,设由水电离产生的OH-浓度分别为amol/L与bmol/L ,则a 和b 的关系为( )A.a >bB. a=10-4bC. b=10-4aD. a=b13.t ℃时,水的离子积为K W ,该温度下混合可溶性一元酸HA 与一元碱BOH 溶液。
宁阳县第一中学2018-2019学年高二上学期第一次月考模拟试卷化学

宁阳县第一中学2018-2019学年高二上学期第一次月考试卷化学班级__________ 座号_____ 姓名__________ 分数__________一、选择题1.下列说法中有明显错误的是A.对有气体参加的化学反应,增大压强,体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大B.升高温度,一般可使活化分子的百分数增大,因而反应速率增大C.活化分子之间发生的碰撞一定为有效碰撞D.加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增大化学反应的速率2.25 ℃时,体积均为20 mL、浓度均为0.1mol·L-1的两种酸HX、HY 分别与0.1mol·L-1的NaOH溶液反应,所加NaOH溶液体积与反应后溶液的pH的关系如图所示。
下列叙述正确的是()A.K a(HY)的数量级约为10-3 B.a点c(X-)>b点c(Y-)C.HX发生反应的离子方程式为HX +OH-=X-+H2O D.pH=7时,两种反应后的溶液中c(Y- )>c(X-)3.25℃时,用0.1000mol/L的AgNO3溶液分别滴定体积均为V0mL的且浓度均为0.1000molL的KCl、KBr 及KI溶液,其滴定曲线入下图,(已知25℃时,AgCl、AgBr及AgI溶度积常数依次为l.8×10-10、5.0×10-13、8.3×10-17),下列说法正确的是A.V0= 45.00B.滴定曲线①表示KCl的滴定曲线C.滴定KCl时,可加入少量的KI作指示剂D.当AgNO3溶液滴定至60.00mL 时,溶液中c(I-)-)-)4.某一有机物A可发生下列变化:已知C为羧酸,且C、E不发生银镜反应,则A的可能结构有(不考虑立体异构)A.4种B.3种C.2种D.1种5.分子式为C5H10O3的有机物与NaHCO3溶液反应时,生成C5H9O3Na;而与金属钠反应时生成C5H8O3Na2,则该有机物的同分异构体有()种(不考虑立体异构)A.10 B.11 C.12 D.136.将一定质量的Mg和Al的混合物投入200 ml稀盐酸中,固体全部溶解并产生气体。
山东省泰安市宁阳一中2017-2018学年高二上学期阶段性考试二化学试卷.pdf

宁阳一中高二年级上学期阶段性考试二 化 学 试 题 2017年12月 本试卷分第Ⅰ卷(选择题)和第Ⅱ卷Ⅰ卷1-5页和第Ⅱ卷第Ⅰ卷 (共分) 选择题(本题包括小题,每小题只有一个答案符合题意,每小题2分共5分) .下列说法正确的是 A.常温下的一元酸溶液与的一元碱溶液等体积混合所得溶液的一定等于 B.在相同温度下浓度均为的和溶液中相同 在的和的混合液中 D.将CH3COOH和NaOH混合3.水的电离平衡曲线如图所示,下列说法正确的是( ) A.图中五点KW间的关系:B=C=A=D=E B.若从A点到D点,可采用:温度不变在水中加入少量的酸 C.若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl固体 D.若处在B点时,将pH=2的硫酸与pH=10的KOH溶液等体积混合,溶液显酸性.下列叙述正确的是 ( ) A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO)>c(NH) B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 D.向0.1 mol/L的氨水中加入少量硫酸铵固体,溶液增大.已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOHCH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( ) A.加少量烧碱溶液 B.温度C.加少量冰醋酸 D.加水6.已知①氢硫酸是二元弱酸,②CuSO4+H2S===CuS↓+H2SO4。
在氢硫酸溶液中,通入或加入少量的下列物质:①O2;②Cl2;③SO2;④CuSO4。
能使溶液中的c(H+)增大的是( ) A.①② B.②④C.②③④ D.①.MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示。
下列叙述中正确的是 ( )A.在x点时,ROH完全电离 B.在x点时,c(M+)>c(R+) C.MOH是一种强碱 D.稀释前,c(ROH)=10c(MOH).℃下,0.1 mol·L-1 NaHCO3溶液pH=10,下列判断正确的是 ( )。
山东省新泰二中、泰安三中、宁阳二中2017-2018学年高二化学上学期期中联考试题

2017年高二上学期期中考试化学试题2017.11本试卷分第I卷(选择题)和第II卷(非选择题)两部分,满分100分.考试时间90分钟。
注意事项:1.答第I卷前,考生务必将自己的姓名、准考证号、考试科目涂写在答题卡上.2.每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案,不能答在试卷上.可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cu 64 Ag 108第I卷(选择题共54分)一、选择题(本大题共18小题,每小题只有一个选项符合题意,每小题3分,共54分.)1.下列说法正确的是()A.反应焓变是指1 g物质参加反应时的能量变化B.当反应放热时,△H>0,反应吸热时,△H<0C.在加热条件下发生的反应均为吸热反应D.一个化学反应中,当反应物总能量大于反应产物总能量时,反应放热,△H为“﹣”2.在密闭容器中进行反应N2+O22NO,下列条件能加快反应速率的是A.增大体积使压强减小B.体积不变,充入N2使压强增大C.体积不变,充入He使压强增大D.压强不变,充入气体Ne3.下列说法正确的是A.放热反应不需要加热就能发生B.升高温度或加入催化剂,均可以改变化学反应的反应热C.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同D.一定条件下某吸热反应能自发进行,说明该反应是熵增大的反应4.反应CO(g) +H2O(g) H2(g) +CO2(g) ΔH<0,改变其中一种条件,能加快反应速率且反应放出的热量不变的是A.升高温度B.减小压强C.加入COD.加入催化剂5.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是A.钢铁发生吸氧腐蚀的正极反应式:Fe-2e- = Fe2+B.氢氧燃料电池的负极反应式:O2 + 2H2O+ 4e- = 4OH-C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e - = Cu 2+D.惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl -- 2e -= Cl 2 ↑ 6.下图为某化学反应的速率与时间的关系示意图.在t 1时刻升高温度或者增大压强,速率的变化都符合示意图的反应是A.2SO 2(g)+O 2(g) 2SO 3(g) △H <0B.4NH 3(g)+5O 2(g) 4NO(g)+6H 2O(g) △H <0C.H 2(g)+I 2(g) 2HI(g) △H >0 D.N 2(g) +3H 2(g)2 NH 3(g) △H <07.根据反应Br +H 2HBr +H 的能量对反应历程的示意图甲进行判断,下列叙述中不正确的是A.正反应吸热B.加入催化剂,该化学反应的反应热不变C.加入催化剂后,该反应的能量对反应历程的示意图可用图乙表示D.加入催化剂可增大正反应速率,降低逆反应速率8.如图电解池中装有硫酸铜溶液,选用不同材料的电极进行电解。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2017-2018学年上学期高二阶段性考试一化 学 试 题 2017年9月本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷1-5页和第Ⅱ卷6-8页。
满分100分,考试时间90分钟相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 K 39 Fe 56 Zn 65 Cu 64第Ⅰ卷 (共50分)选择题(每题2分,共50分)1.下列能源组合中,均属于新能源的一组是( )①天然气;②煤;③核能;④石油;⑤太阳能;⑥生物质能;⑦风能;⑧氢能. A .①②③④ B .①⑤⑥⑦⑧ C .③④⑤⑥⑦⑧ D .③⑤⑥⑦⑧ 2.下列关于盖斯定律的说法不正确的是( )A .不管反应是一步完成还是分几步完成,其反应热相同B .反应热只与反应体系的始态和终态有关,而与反应的途径无关C .有些反应的反应热不能直接测得,可通过盖斯定律间接计算得到D .根据盖斯定律,热化学方程式中△H 直接相加即可得总反应热3.已知化学反应A 2(g )+B 2(g )═2AB (g )△H=Q kJ•mol ﹣1,其能量变化如图所示,则Q 的值正确的是( )A .a ﹣bB .aC .﹣bD .b ﹣a4.已知在298K 时下述反应的有关数据如下: C (s )+21O 2(g )═CO (g )△H 1=﹣110.5kJ•mol ﹣1C (s )+O 2(g )═CO 2(g )△H 2=﹣393.5kJ•mol ﹣1则C (s )+CO 2(g )═2CO (g )的△H 为( )A .+283.5 kJ•mol ﹣1B .﹣172.5 kJ•mol ﹣1C .+172.5 kJ•mol ﹣1D .﹣504 kJ•mol ﹣15.已知1g 氢气完全燃烧生成水蒸气时放出热量121kJ ,且氧气中1mol O=O 键完全断裂时吸收热量496kJ ,水蒸气中1mol H ﹣O 键形成时放出热量463kJ ,则氢气中1mol H ﹣H 键断裂时吸收热量为( )A .920kJB .557kJC .436kJD .188kJ6.以下几个热化学方程式,能表示燃烧热的热化学方程式是( ) A .C (s )+21O 2(g )═CO (g )△H=110.5 kJ•mol ﹣1 B .C (s )+O 2(g )═CO 2(g )△H=﹣393.5 kJ•mol ﹣1 C .2H 2(g )+O 2(g )═2H 2O (l )△H=﹣571.6 kJ•mol ﹣1D .H 2(g )+21O 2(g )═H 2O (g )△H=﹣241.8 kJ•mol ﹣17.实验室用4mol SO 2与2mol O 2进行下列反应:2SO 2(g )+O 2(g )2SO 3(g );△H=﹣196.64kJ/mol ,当放出314.624kJ 热量时,SO 2的转化率为( ) A .40% B .50% C .80% D .90%8.已知:H 2(g )+F 2(g )═2H F (g )△H=﹣270kJ/mol ,下列说法正确的是( ) A .2L 氟化氢气体分解成1L 的氢气和1L 的氟气吸收270kJ 热量B .1mol 氢气与1mol 氟气反应生成2mol 液态氟化氢放出的热量小于270kJC .在相同条件下,1mol 氢气与1mol 氟气的能量总和大于2mol 氟化氢气体的能量D .1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ 热量 9.已知反应:①101kPa 时,C (s )+21O 2(g )═CO (g )△H 1=﹣110.5kJ/mol②稀溶液中,H +(aq )+OH ﹣(aq )═H 2O (l )△H 2=﹣57.3kJ/mol . 下列结论正确的是( )A .若碳的燃烧热用△H 3来表示,则△H 3<△H 1B .若碳的燃烧热用△H 3来表示,则△H 3>△H 1C .浓硫酸与稀NaOH 溶液反应的中和热为57.3kJ/molD .稀醋酸与稀NaOH 溶液反应生成1mol 水,放出57.3kJ 热量10.已知充分燃烧a g 乙炔气体时生成1mol 二氧化碳气体和液态水,并放出热量b kJ ,则乙炔燃烧的热化学方程式正确的是( )A .2C 2H 2(g )+5O 2(g )═4C O 2(g )+2H 2O (l );△H=﹣4b kJ/molB .C 2H 2(g )+25O 2(g )═2CO 2(g )+H 2O (l );△H=2b kJ/molC .2C 2H 2(g )+5O 2(g )═4CO 2(g )+2H 2O (l );△H=2b kJ/molD .2C 2H 2(g )+5O 2(g )═4CO 2(g )+2H 2O (l );△H=b kJ/mol11.室温下将1mol 的CuSO 4•5H 2O (s )溶于水会使溶液温度降低,热效应为△H1,将1mol 的CuSO 4(s )溶于水会使溶液温度升高,热效应为△H 2;CuSO 4•5H 2O 受热分解的化学方程式为:CuSO 4•5H 2O (s )═CuSO 4(s )+5H 2O (l ),热效应为△H 3.则下列判断正确的是( ) A .△H 2>△H 3 B .△H 1>△H 3C .△H 1=△H 2+△H 3D .△H 1+△H 2>△H 3 12.化学能与热能、电能等能相互转化.关于化学能与其他能量相互转化的说法正确的是( )图I 图IIA .化学反应中能量变化的主要原因是化学键的断裂与生成B .铝热反应中,反应物的总能量比生成物的总能量低C .图I 所示的装置能将化学能转变为电能D .图II 所示的反应为吸热反应13.某原电池总反应的离子方程式为:2Fe 3++Fe═3Fe 2+,能实现该反应的原电池是( ) A .正极为Cu ,负极为Fe ,电解质溶液为FeCl 3溶液B.正极为C,负极为Fe,电解质溶液为FeSO4溶液C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液D.正极为Ag,负极为Cu,电解质溶液为CuSO4溶液14.如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
下列有关说法正确的是 ()A. 反应一段时间后,乙装置中生成的氢氧化钠在铁极区B. 乙装置中铁电极为阴极,电极反应式为Fe-2e-Fe2+C. 通入氧气的一极为正极,发生的电极反应为O 2-4e-+2H2O4OH-D. 反应一段时间后,丙装置中硫酸铜溶液浓度保持不变15.已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,判断下列叙述中正确的是()A.该反应热△H=+(a﹣b)kJ•mol﹣1B.每生成2mol AB(g)吸收b kJC.该反应中反应物的总能量高于生成物的总能量D.断裂1mol A﹣A和1mol B﹣B键,放出a kJ能量16.利用人工光合作用合成甲酸的原理为2CO 2+2H2O2HCOOH+O2,装置如图所示,下列说法不正确的是()A.该装置将太阳能转化为化学能和电能B.电极1周围pH减小C.电极2上发生的反应为CO2+2H++2e﹣═HCOOHD.H+由电极2室经过质子膜流向电极1室17.锌、铜和稀硫酸组成的原电池,下列有关说法正确的是()①锌极有气泡产生②电子由Zn经外电路流向Cu③负极:Zn+2e﹣=Zn2+④Cu2+在溶液中由Cu棒向Zn棒迁移.A.①②④B.①②③C.②D.②④18.如图所示装置中,观察到电流计指针偏转;M棒变粗;N棒变细,由此判断表中所列M、N P19.如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是()A.外电路的电流方向为:X→外电路→YB.若两电极分别为Fe和碳棒,则X为碳棒,Y为FeC.X极上发生的是还原反应,Y极上发生的是氧化反应D.若两电极都是金属,则它们的活动性顺序为X>Y20.X、Y、Z、W四块金属分别用导线两两相连浸入稀硫酸中组成原电池.X、Y相连时,X 为负极;Z、W相连时,电流方向是W→Z;X、Z相连时,Z极上产生大量气泡;W、Y相连时,W极发生氧化反应.据此判断四种金属的活动性顺序是()A.X>Z>W>Y B.Z>X>Y>WC.X>Y>Z>W D.Y>W>Z>X21.某锂离子电池用含有Li+的导电固体作为电解质.充电时,Li+还原为Li,并以原子形式嵌入电极材料碳C6中,以LiC6表示,电池反应为CoO2+Li C6LiCoO2+C6.右图表示该装置工作时电子和离子的移动方向,此时C6电极是作为()A.阴极B.阳极C.负极D.正极22.铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如图.下列说法不正确的是( )A .因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀B .若水膜中溶解了SO 2,则铁铆钉腐蚀的速率变小C .铜极上的反应是2H ++2e ﹣═H 2↑,O 2+4e ﹣+4H +═2H 2OD .在金属表面涂一层油脂,能防止铁铆钉被腐蚀23.铁镍蓄电池又称爱迪生电池.放电时的总反应为:Fe+Ni 2O 3+3H 2O═Fe (OH )2+2Ni (OH )2.下列有关该电池的说法错误的是( ) A .电池的电解液为碱性溶液,负极为FeB .电池放电时,负极反应为Fe+2OH ﹣﹣2e ﹣═Fe (OH )2C .电池充电过程中,阴极附近溶液的pH 减小D .电池充电时,OH ﹣向阳极迁移 24.如图所示,甲池的总反应式为:CH 4+2O 2+2KOH=K 2CO 3+3H 2O ,下列说法正确的是( )A .甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置B .甲池中正极的电极反应式是O 2+4e ﹣+4H +=2H 2OC .反应过程中,乙池的pH 逐渐减小D .甲池中消耗O 2的体积与丙池生成气体的总体积在相同条件下的比值为1:225.用惰性电极电解M(NO 3)x 的水溶液,当阴极上增重a g 时,在阳极上同时产生b L(标准状况)氧气,从而可知M 的相对原子质量是( )A.bax 4.22 B.b ax 4.22 C.bax6.5 D.b ax 5.2第II 卷本卷共4题,共50分26. (共14分)50mL 0.50mol•L ﹣1盐酸与50mL 0.55mol•L ﹣1 NaOH 溶液在图示的装置中进行中和反应.通过测定反应过程中的热量可计算中和热.回答下列问题: (1)从实验装置上看,图中尚缺少的一种玻璃用品是 . (2)烧杯间填满碎纸条的作用是 .(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”、“偏小”或“无影响”).(4)实验中改用60mL 0.50mol•L﹣1盐酸跟50 mL 0.55mol•L﹣1 NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”),所求中和热(填“相等”或“不相等”),简述理由:.(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会.27.(共10分)A、B、C、D是元素周期表中的短周期元素,且原子序数依次增大.A元素原子中无中子,B元素的一种同位素常用于文物考古,且该元素形成的化合物种类最多,D元素的原子核外最外层电子数是次外层电子数的三倍.回答下列问题:(1)D元素的符号是,C元素组成的单质C2的电子式是.(2)C2A4可作为火箭发动机的燃料,与氧化剂C2D4反应生成C2和A2D.已知:①C2(g)+2D2(g)═C2D4(l)△H1═﹣19.5kJ/mol②C2A4(l)+D2(g)═C2(g)+2A2D(g)△H2═﹣534.2kJ/mol写出液体燃料C2A4与液态C2D4反应的热化学方程式:.(3)在230℃和催化剂存在的条件下,将BD2与A2转化为BA3DA(g)和A2D(g).如图为生产1mol BA3DA(g)的能量变化示意图:已知破坏1mol不同共价键的能量(kJ)分别是:2232②已知E1=8.2kJ•mol﹣1,则E2= 。
