@第一章 物质存在状态
八年级上册物理第一章知识点归纳总结精彩3篇

八年级上册物理第一章知识点归纳总结精彩3篇八年级上册物理第一章知识点篇一第一章物态及其变化一、物态1、物质存在的状态:固态、液态和气态。
2、物态变化:物质由一种状态变为另一种状态的过程。
物态变化跟温度有关:物质是由分子组成的,分子之间存在着相互作用的引力和斥力,同时分子之间有一定的空隙。
当物质处于固态时,引力作用较强,分子排列紧密,分子之间空隙很小,每个分子只能在原位置附近振动,所以固态物质有一定的体积和形状。
固体的温度升高,分子的运动加剧,当温度升高到一定程度时,分子的运动足以使它们离开原来的位置,而在其他分子之间运动,这时物质便以液态的形式存在。
如果温度再升高,分子运动更加剧烈,当温度升高到一定程度时,分子会摆脱其他分子的作用而自由地运动,这时物质便以气态的形式存在。
二、温度的测量1、温度:物体的冷热程度用温度表示。
2、温度计的原理:是根据液体的热胀冷缩的性质制成的。
3、摄氏温度的规定:在大气压为1.01×105Pa时,把冰水混合物的温度规定为0度,而把水的沸腾温度规定为100度,把0度到100度之间分成100等份,每一等份称为1摄氏度,用符号℃表示。
4、温度计的使用:(1)让温度计与被测物长时间充分接触,直到温度计液面稳定时再读数。
(2)读数时,不能将温度计拿离被测物体。
(3)读数时,视线应与温度计标尺垂直,与液面相平,不能仰视也不能俯视。
(4)测量液体时,玻璃泡不要碰到容器壁或容器底。
5、体温计:量程一般为35~42℃,分度值为0.1℃。
三、熔化和凝固1、熔化:物质由固态变成液态的过程。
(吸热)凝固:物质由液态变成固态的过程。
(放热)2、固体分为晶体和非晶体。
晶体:有固定熔点。
熔化过程中吸热,但温度不变。
如:金属、食盐、明矾、石英、冰等。
非晶体:没有一定的熔化温度。
变软、变稀变为液体。
如:沥青、松香、玻璃。
四、汽化和液化1、汽化:①物质由液态变成气态的过程。
汽化有两种方式:蒸发和沸腾(吸热)②蒸发是只在液体表面发生的一种缓慢的汽化现象。
第一章-物态及其变化

第一节物态一、物质存在的状态1.自然界中常见的物质有固态、液态和气态。
注意:⑴不同状态的物质具有不同的特征固态物质有一定的形状和体积;液态物质没有固定的形状,但有一定的体积,具有流动性;气态物质既没有固定的形状,也没有一定的体积,且具有很大的流动性。
⑵科学家发现除了常见的固、液、气三种状态外,还有第四态-等离子态(课本P4)二、物态变化在一定条件下,物质存在的状态可以发生变化。
物质由一种变为另一种状态的过程叫做物态变化。
说明:⑴分子:组成物质的,而且具有这种物质物理特性的最小微粒叫做分子。
⑵物质是由分子组成的,分子在永不停息的作无规则的运动,分子间存在着引力和斥力,分子间有间隙。
⑶为什么同种物质会有不同的状态呢?(课本P3)注意:⑴发生物态变化的主要因素是温度,当温度升高时,分子运动加剧。
⑵判断一个变化是否属于物态变化,要紧扣概念,明确三点:①在变化过程中物质的种类不变;②在变化过程中物质是否由一种状态变成另一种状态;③形状的改变与状态变化不是一回事。
第二节温度的测量一、温度(t)1.温度的物理意义:表示物体的冷热程度的物理量。
注意:用感觉来判断物体的冷热程度不可靠;相同温度的物质冷热程度相同。
2.①常用单位:摄氏度(℃),规定:在一个标准大气压(1.01×105Pa)下,把冰水混合物的温度规定为0度,把沸水的温度规定为100度,把0度到100度之间分成100等分,每一等份为1℃。
②国际单位:开尔文,简称开,用字母K表示,它是以-273℃(-273.15℃)为零点的温标。
③关系:T=(t+273)K t=(T-273) ℃△T=△t注意:⑴物理量和单位符号的区分物理量单位摄氏温度t 摄氏度℃(常用单位)热力学温度T 开尔文K(国际单位)⑵在表示温度变化时,每1K的大小与每1℃的大小是相同的,但由于零点不同,而对同一个温度用两种不同的温标表示时,其数值不同。
二、温度计1.测量温度的工具是温度计。
马原-第一章--()PPT课件

荀 子
66
第一节 物质及其存在形式
不可知论 认为物质和意识不具有同一
性,否认思维认识世界或彻底认 识世界的可能性。
休谟
康德
-
77
二、辩证唯物主义的物质观
两种世界观
唯物主义
物质
唯心主义
意识
二、辩证唯物主义的物质观
哲学物质概念的三个基本形态
古代朴素唯物主义物质观
物质=具体物质 形态
近代形而上学唯物主义物质观
时间、空间的有限性和无限性的统一
• 时间和空间的无限性是指整个物质世界 在时间上无始无终,在空间上无边无际。
• 时间和空间的有限性是指每一具体事物 在时间上既有开始又有终结,在空间上 是有边界的。
• 时间和空间的无限性是由无数有限的时 间和空间构成的;无限不在有限之外, 无限就存在于有限之中。
三、社会生活本质上是实践的
运动是宇宙中一切事物和现象 的变 化及其过程
2、运动与物质的关系
• 运动是物质的根本属性和存在方式, 物质和运动是不可分割的。
❖物质是运动着的物质,没有不运动的物质
我们的地球正在 以每秒30公里的速度 绕太阳旋转。
❖物质是运动着的物质,没有不运动的物质
整个生物界和 人类社会都经历着 由低级到高级、由 简单到复杂的发展 过程。
• 时间、空间的相对性:时间、空间的具 体表现形式的多样性
相对论、非欧几何证实了时空的相对性
• 欧氏几何:三角形三内角之和等于180度 • 19世纪30年代俄国数学家罗巴切夫斯基
创立非欧几何: • 三角形三内角之和小于180度(广大的宇
宙空间特性) • 19世纪50年代德国数学家黎曼: • 三角形三内角之和大于180度(微观空间)
八年级物理上册第一章物质的状态及其变化典型例题剖析试题

八年级上北师大版物理第一章第1节物质的状态典型例题剖析【例题1】物质通常存在_______、______和______三种状态,在一定的条件下,物质存在的形态可以发生变化。
答案:固态,液态,气态。
【例题2】物质可以从一种状态变成另一种状态,这种变化叫______。
答案:物态变化。
【例题3】去年冬季我地气温最低达-5℃,正确的读法是A、负5摄氏度B、负摄氏5度C、摄氏负5度D、零下5度答案:-5℃可以读成负5摄氏度和零下5摄氏度。
【例题4】在制作液体温度计时,为了进步温度计的准确程度,下面措施可行的是A、玻璃泡的容积做大一些,玻璃管内径做细一些;B、玻璃泡的容积做小一些,玻璃管内径做粗一些;C、玻璃泡的容积做大一些,玻璃管内径做粗一些;D、玻璃泡的容积做小一些,玻璃管内径做细一些。
分析:液体水银温度计的原理很简单--就是因为水银的热涨冷缩,而且水银的膨胀系数比拟大,变化较明显,适当的将玻璃泡的容积做大一些,玻璃管内径做细一些,可以进步温度计的准确程度,细微的体积变化可以清楚的在刻度上显现。
答案:A【例题5】一只温度计,虽然它的玻璃管的内径和刻度都是均匀的,标度却不准确,它在冰水混合物中的读数是-7℃,在沸水中的读数是103℃。
〔1〕这只温度计的分度值是____℃,〔2〕当它指示气温是5℃时,实际温度是____℃。
分析:因为玻璃管的内径和刻度都是均匀的,这个温度计在-7℃~103℃之间一一共是110格,表示0℃~100℃,列式为:100℃÷110≈℃,那么每个分度的值是℃。
当它度数是5℃时,实际的温度应该是〔5+7〕×℃=℃。
答案:℃/格;℃【例题6】物质从固态变为液态叫做________,这是个______热过程;物质从液态变为固态叫做________,这是个_______热过程。
分析:物质从固态变为液态是熔化,这是一个吸热过程,从液态变为固态,这是凝华,这是一个放热过程,答案:熔化,吸,凝华,放。
无机化学 知识点总结

无机化学(上) 知识点总结第一章 物质存在的状态 一、气体1、气体分子运动论的基本理论①气体由分子组成,分子之间的距离>>分子直径; ②气体分子处于永恒无规则运动状态;③气体分子之间相互作用可忽略,除相互碰撞时; ④气体分子相互碰撞或对器壁的碰撞都是弹性碰撞。
碰撞时总动能保持不变,没有能量损失。
⑤分子的平均动能与热力学温度成正比。
2、理想气体状态方程①假定前提:a 、分子不占体积;b 、分子间作用力忽略 ②表达式:pV=nRT ;R ≈8.314kPa ²L ²mol1-²K1-③适用条件:温度较高、压力较低使得稀薄气体 ④具体应用:a 、已知三个量,可求第四个;b 、测量气体的分子量:pV=M W RT (n=MW ) c 、已知气体的状态求其密度ρ:pV=M W RT →p=MV WRT →ρMVRT=p3、混合气体的分压定律①混合气体的四个概念a 、 分压:相同温度下,某组分气体与混合气体具有相同体积时的压力;b 、 分体积:相同温度下,某组分气体与混合气体具有相同压力时的体积c 、 体积分数:φ=21v v d 、 摩尔分数:xi=总n n i②混合气体的分压定律a 、 定律:混合气体总压力等于组分气体压力之和;某组分气体压力的大小和它在混合气体中体积分数或摩尔数成正比 b 、 适用范围:理想气体及可以看作理想气体的实际气体c 、 应用:已知分压求总压或由总压和体积分数或摩尔分数求分压、 4、气体扩散定律①定律:T 、p 相同时,各种不同气体的扩散速率与气体密度的平方根成反比:21u u =21p p =21M M (p 表示密度) ②用途:a 、测定气体的相对分子质量;b 、同位素分离二、液体 1、液体①蒸发气体与蒸发气压A 、饱和蒸汽压:与液相处于动态平衡的气体叫饱和气,其气压叫做饱和蒸汽压简称饱和气;B、特点:a、温度恒定时为定值;b、气液共存时不受量的变化而变化;c、物质不同,数值不同②沸腾与沸点A、沸腾:当温度升高到蒸汽压与外界压力相等时,液体就沸腾,液体沸腾时的温度叫做沸点;B、特点:a、沸点的大小与外界压力有关;外界压力等于101kPa时的沸点为正常沸点;b、沸腾是液体表面和内部同时气化的现象2、溶液①溶液与蒸汽压a、任何物质都存在饱和蒸汽压;b、纯物质的饱和蒸汽压只与物质本身的性质和温度有关;c、一定温度下饱和蒸汽压为常数;d、溶液蒸汽压的下降:△p=p纯液体-p溶液=K²m②溶液的沸点升高和凝固点的下降a、定量描述:沸点升高△Tb =Kb²m凝固点下降△Tf =Kf²m仅适用于非电解质溶液b、注意:①Tb 、Tf的下降只与溶剂的性质有关②Kb 、Kf的物理意义:1kg溶剂中加入1mol难挥发的非电解质溶质时,沸点的升高或凝固点下降的度数c、应用计算:i、已知稀溶液的浓度,求△Tb 、△Tfii、已知溶液的△Tb 、△Tf求溶液的浓度、溶质的分子量d、实际应用:i、制冷剂:电解质如NaCl、CaCl2ii、实验室常用冰盐浴:NaCl+H2O→22°CCaCl2+H2O→-55°Ciii、防冻剂:非电解质溶液如乙二醇、甘油等③渗透压a、渗透现象及解释:渗透现象的原因:半透膜两侧溶液浓度不同;渗透压:为了阻止渗透作用所需给溶液的额外压力b、定量描述:Vant'Hoff公式:∏V=nRT ∏=VnRT即∏=cRT ∏为溶液的渗透压,c 为溶液的浓度,R 为气体常量,T 为温度。
第一章 物质的状态

中国矿业大学化工学院倪中海第一章物质的状态教学要求:1、了解物质的聚集状态、分散状态;2、掌握气体分压定律、分体积定律、理想气体状态方程;3、掌握溶液的依数性及其应用第一节物质的聚集状态第二节物质的分散状态第一节物质的聚集状态物质有气态、液态和固态三种不同的聚集状态,可用符号g、l、s表示一、气体二、液体三、固体四、等离子态返回一、气体气体的基本性质是一定质量的气态物质在确定的温度和压力下将占有确定的体积。
它的特性无限膨胀性和无限掺混性。
不管容器的大小以及气体量的多少,气体都能充满整个容器,而且不同气体能以任意的比例互相混合从而形成均匀的气体混合物。
气体的体积随体系的温度和压力的改变而改变。
1、气体的基本物理特性气体没有固定的体积和形状气体是最易被压缩的一种聚集状态不同种的气体能以任意比例相互均匀地混合 气体的密度比液体和固体的密度小很多2、理想气体与实际气体理想气体:把气体中的分子看成是几何上的一个点,它只有位置而无体积,同时假定气体中分子间没有相互作用力,那么这样的气体称为理想气体。
理想气体是实际气体的一种极限情况。
2、理想气体与实际气体当实际气体的体积很大(压力很小),分子本身的体积可以忽略不计;当气体分子与分子之间的距离较大时,分子与分子之间的相互吸引力与气体分子本身的能量相比,亦可忽略不计。
这种情况下的实际气体可看成为理想气体。
低压、高温下的实际气体的性质非常接近于理想气体。
3、理想气体定律1)理想气体状态方程式波义尔定律:当n和T一定时,气体的V与p成反比V ∝1/p (1)查理-盖吕萨克定律:n和p一定时,V与T成正比V ∝T (2)阿佛加德罗定律:p与T一定时,V和n成正比V ∝n (3)分压指混合气体中某一种气体在与混合气体处于相同温度下时,单独占有整个容积时所呈现的压力。
混合气体的总压等于各种气体分压的代数和:p 总=p1+p2+p3+…2)理想气体的分压定律与分体积定律分体积是指混合气体中任一气体在与混合气体处于相同温度下,保持与混合气体总压相同时所占有的体积。
第1章物质的状态PPT课件

单位名称 米
千克(公斤) 秒
安[培] 开[尔文] 摩[尔] 坎[德拉]
单位符号 m kg s A K mol cd
2020/12/4
上页
下页
12
第二节 溶 液
表1-2 国际单位制的辅助单位
量的名称 平面角 立体角
单位名称 弧度 球面度
单位符号 rad sr
2020/12/4
上页
下页
13
第二节 溶 液
1、计量及单位
计量: 用一种公认的已知量和一个暂时未知的量进行 比较以 获得一个相对量。
国际单位制(SI制):
SI单位
SI基本单位 SI辅助单位 SI导出单位
表1-1 表1-2 表1-3
2020/12/4
上页
下页
11
第二节 溶 液
表1-1 国际单位制的基本单位
量的名称 长度 质量 时间 电流
热力学温度 物质的量 发光强度
研究表明,蒸气压是温度的函数 p = f (T):
lg p AB T
A V Hm 2.303R
lgp VHm B 2.30R3 T
l
gp2 p1
2.3VH0m R3TT22T1T1
2020/12/4
上页
下页
7
1•1.2 液 体
3. 沸点
当液体的蒸汽压与外界压力相等时,汽化在整个液 体内进行,这一现象称为沸腾; 沸腾时的温度称为沸点.
cB
nB V
mol/L
质量摩尔浓度:
bB
nB mA
mol/kg
物质的量分数:
xi
ni ni
量: 一个数值和单位的乘积。
量(物理量) = 数值×单位
《物质的状态》ppt

水壶中的水慢慢变少
是什么导致物质的状态发生了变化?
温度的变化!
三.物质结构的微观模型
1.物质是有大量分子构成的
了解
2.分子之间存在空隙 3.分子之间有相互作用力 4.分子在不停的做无规则运动
小
结
或弹性)仍ቤተ መጻሕፍቲ ባይዱ具有一定的体积、一定的形状。
固体:比较稳固、不会流动、不论变形或不变形(塑料
液体:具有流动性、没有一定的形状、盛它的容器什么样它
就什么样、不管是大容器盛还是小容器盛它的体积大 小是不变的、是50cm³ 的水盛到哪个容器体积还是 50cm³ 多。 气体:具有流动性、也没有一定的形状、而且没有一定的体
积、它总是充满整个容器的空间。
一试身手
1. 列举身边的物品找出一些固体、液体、气体,将它
们的名称填入表格内
固体 液体 气体
面包、奶酪
3. 物质由被称为“分子”的微粒组成,它们之间
一定空隙 相互作用 存在着______,同时,又有______。
当温度升高时,分子的运动更加_____。 剧烈
4 . 下列说法中不正确的是:( D )。 A . 物质处于固态时,分子排列紧密,分子之 间 空隙很小 B . 当温度升高到一定程度时,分子的运动足以 使它们离开原来的位置,在其他分子之间运 动,这时物质便以液态的形式存在 C. 当温度升高到一定程度时,分子会摆脱其他 分子的作用而自由运动,这时物质便以气态 形式存在 D. 分子之间存在着相互的引力,分子之间没有 空隙
5. 下列现象中,没有发生物态变化的是 (A ) 。
A . 扫地时灰尘到处飞扬
B. 洒在地下的水变干
C. 早上地上的霜
D. 冰雕变小了
4.水具有流动性,水是 液 体,它有一定 的 体积 ,但是没有一定的 形状 。
第一章 物态变化 总结
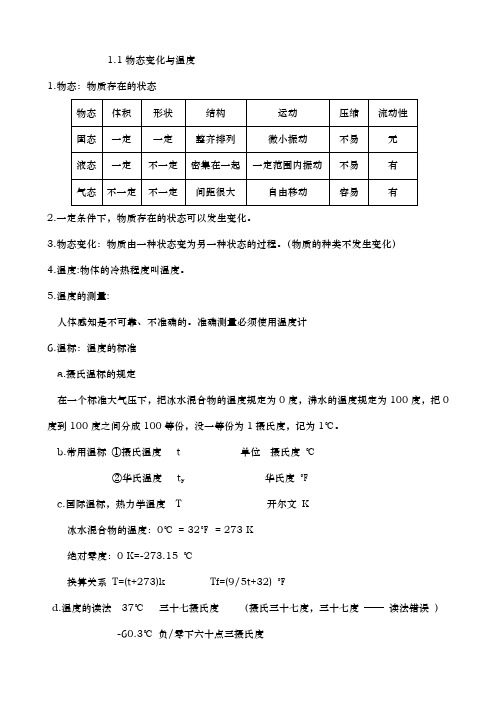
1.1物态变化与温度1.物态:物质存在的状态2.一定条件下,物质存在的状态可以发生变化。
3.物态变化:物质由一种状态变为另一种状态的过程。
(物质的种类不发生变化)4.温度:物体的冷热程度叫温度。
5.温度的测量:人体感知是不可靠、不准确的。
准确测量必须使用温度计6.温标:温度的标准a.摄氏温标的规定在一个标准大气压下,把冰水混合物的温度规定为0度,沸水的温度规定为100度,把0度到100度之间分成100等份,没一等份为1摄氏度,记为1℃。
b.常用温标①摄氏温度t 单位摄氏度℃华氏度℉②华氏温度tFc.国际温标,热力学温度T 开尔文K冰水混合物的温度:0℃= 32℉= 273 K绝对零度:0 K=-273.15 ℃换算关系T=(t+273)k Tf=(9/5t+32) ℉d.温度的读法37℃三十七摄氏度(摄氏三十七度,三十七度——读法错误)-60.3℃负/零下六十点三摄氏度7.实验用温度计(1)原理:液体热胀冷缩的性质常用液体:酒精、水银(汞)、煤油、甲苯(2)结构:玻璃外壳、毛细管、玻璃泡、测温液体、刻度、单位(℃、℉、K)(3)使用方法:测量前:①估:待测物质的温度②选:合适量程的温度计③看:单位、分度值测量时:①拿:温度计上部,不触及玻璃泡②放:玻璃泡/液泡完全浸没在待测物质中(即充分接触),玻璃泡不与容器壁和底接触③读:示数稳定后读数,玻璃泡不能离开被测物质,视线与液柱液面相平(或温度计标尺垂直)“俯大仰小”测量后:①记:温度值,单位8.温度计的分类:9.晶体和非晶体:(1)熔点(凝固点):晶体的确定的熔化(凝固)温度。
(2) 探究海波、蜂蜡熔化特点的实验实验器材:铁架台、酒精灯、石棉网、烧杯、水、试管、温度计、海波、蜂蜡、火柴(打火机)、钟表、搅拌器方法:水浴法【通过加热大容器(烧杯)里的水,间接地给水中要加热的容器加热的方法】优点:使物体受热均匀,减慢熔化过程,便于观察。
部分试验中 不会导致暴沸的现象。
普通化学

*注意:量纲与R数值及其单位的一致性。 即R=8.314J•mol-1•K-1时,式中n、p、V、T等物 理量只能用它们的基本单位mol、Pa、m3和K。
*或R=8314 Pa⋅L⋅mol-1 ⋅K-1 =8.314 kPa⋅L⋅mol-1 ⋅K-1
R=0.08206atm •L • mol-1 • K-1(1atm=101.325KPa) *另外一些形式:
5
溶液的蒸气压下降多少?
——拉乌尔定律(Raoult’s Law)
请学习第二章吧!
6
p(N2)= p- p(NH3) - p(O2) =(133.0-35.5-20.0)kPa =77.5kPa
积。
2)在标准状况下,干燥氧气的体
解:因集气瓶中收集的氧气是该温度下 饱和水蒸气与氧的混合物,它们的总压力 等于大气压→101.3KPa。 查: 298K时,饱和水蒸气压力为3.17kPa 则 Po2=P总 — P水=101.3-3.17=98.1KPa
• 饱和蒸气压与温度密切相关——蒸气压—温度曲线
温度升高, 蒸气压增大
饱和蒸气压:当:气化 = 蒸发 达到平衡,此时的蒸气为饱和 蒸汽,所具有的压力为一定值。称为饱和蒸气压。
2、液体的沸点
• 沸腾:温度升高,液体的蒸气压增大,当温度升 高到某一值时,蒸气压与外界压力相等,此时液 体沸腾。 • 沸点:沸腾时的温度称为液体的沸点。液体的沸 点与外界压力有关。若外界压力增大,液体的沸 点将升高;外界压力减小,液体的沸点则降低。 当外界压力为标准压力101.325 kPa时,液体的 沸点称为正常沸点。 • 应用:利用纯物质沸点不同的特点,可通过蒸馏 来分离液体混合物。
道尔顿(J. Dalton 1766 — 1844)
第1章 物质的状态 第1节 物质的聚集状态

p(O 2 ) n(O 2 ) 0.180 p 35.5kPa 20.0kPa n 0.320
p(N2) = p- p(NH3) - p(O2) =(133.0-35.5-20.0)kPa = 77.5kPa
分压定律的应用实例
4 理想气体的分体积定律
分体积定律:
混合气体的总体积等于组成混合气体的各组分气体的分
体积之和,即 V总= V1+ V2+ V3+ …… = ∑Vi
分体积:在相同温度下,某组分气体单独存在并且与混 合气体总压相同时占有的体积,则 p总 Vi = ni RT 对混合气体则有: p总 V总 = n总RT
OD 是AO的延长线,是过冷水和水蒸气的介稳平衡 线。因为在相同温度下,过冷水的蒸气压大于冰的 蒸气压,所以OD线在OB线之上。过冷水处于不稳定 状态,一旦有凝聚中心出现,就立即全部变成冰。 O点 是三相点,气-液 - 固三相共存。三相点 的温度和压力皆由体 系自定。 H2O的三相点温度 为273.16 K,压力 为610.62 Pa。
金刚石的晶体结构
NaCl的晶体结构 金刚石的晶体结构
三 固体―非晶体
结构特点 组成物质的原子、分子等微粒在三维空间的排列呈 杂乱无序状态 物理特性 组成可变,各向同性,无固定熔点,导热率和热膨 胀性小,可塑性变形性大等
玻璃
橡胶
几种典型的非晶体物质 塑料
三 固体―液晶
晶体是各向异性的,液体则是各向同性的。一般的晶体熔 化后就由各向异性转化为各向同性的液体。但是,有些物 质在由晶体向液体的转变过程中,要经历一种各向异性的 液态,这种状态的物质称液晶。
第1章物质的状态

对任一混合物体系都有 ∑xi=1.
5/26/2020
上页
下页
15
第二节 溶 液
例题:
1、1摩尔(2H)表示什么意义?其基本单元是什么?
2、1摩尔(1/2H2SO4)与0.5摩尔(H2SO4)意义是否相同?为什么? 3、1摩尔 (H2 + 1/2O2 = H2O) 的叫法正确吗?如果正确其意义 为何?
1、计量及单位
计量: 用一种公认的已知量和一个暂时未知的量进行 比较以 获得一个相对量。
国际单位制(SI制):
SI单位
SI基本单位 SI辅助单位 SI导出单位
表1-1 表1-2 表1-3
5/26/2020
上页
下页
11
第二节 溶 液
表1-1 国际单位制的基本单位
量的名称 长度 质量 时间 电流
热力学温度 物质的量 发光强度
p = p* xA
p* : 纯溶剂蒸气压 xA : 溶剂的物质的量分数
p = p* (1 xB)
∴ p = p* xB
→ p*p = p* xB
xB:溶质的物质的量分数 p:溶液蒸气压的下降值
5/26/2020
上页
下页
18
第二节 溶 液
p = p* xB
= p* [nB / (nA + nB)] ≈p* (nB /nA)
Tb=Kb ·bB 0.17 = 0.515(49610–3/M)/(10.0/1000)
M= 1.5102 g/mol C5H7N的式量为81,故:
81n = 1.5102 g/mol
n≈2 尼古丁的分子式为: C10H14N2
5/26/2020
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• §1.1 物质的聚集状态
• 通常认为物质有4种物质聚集状态:气、固、液、等离子 态。而在地球表面,物质只有3种聚集状态:气、固、液。 • §1.1.1气体(无限可膨胀性,掺合性) • 物质的气体状态下,分子间的引力(一个分子对其它分子 的吸引力)非常小,使得各个分子都有快速的和独立的无 规则运动。可以近似认为:气体的物理行为和它们的化学 组成无关,但决定于:体积,压力和物质的摩尔数,温度。
氧气
氮气
氢气
氦
氩
二氧 化碳
氨
22.414 22.413 22.410
22.398 22.401 22.414 22.423
• 分压:就是指在混合气体中,每一种组分气体单独占有 与整个混合气体相同体积时的压力。(P20复思题2、 3) • 道尔顿分压定律: P=P(A)+P(B)+…+P(i) • 如把N2,O2和CO2同放在一容器中, • 混合物的总压力是:P总=PN2+PO2+PCO2 • 根据 P=nRT/V • 可推出:=[n(A)+ n(B)+ n(C)+…n(i)]RT/V • 又:设混合气体某组分i, • PV= nRT…………………(1) • P(i)V= n(i)RT………………(2) • 两式相除: P(i)/P=n(i)/n=x(i) • P(i)=x(i)P………………(3) • 式中x(i)为物理的量分数,此处称为摩尔分数。
• 实际工作中H气,H液无法直接测量, 可ΔHm可以测定。 • 则由式(1-7)可得: • lgP=-ΔrHmθ/2.303RT + B
• lgP1/P2=ΔrHmθ/2.303R[(T2-T1)/T1T2]
Байду номын сангаас
• 可以由一个温度下的蒸气压可求得 另一温度下的蒸气压。
• 二.沸点 • 沸点:指液体的饱和蒸气压与外界压强 相等时的温度。 • 原理:当液体内部产生一个气泡时,原 来占据这里空间的液体被排开,容器中 的液面被迫升高以对抗大气对液面施加 的向下压力,既在气泡内部的蒸气压力 冲击液面使它升高来对抗大气压力,这 只有蒸气压等于大气压才会发生,如果 压力较小,大气压就把气泡压制下去, 不会发生沸腾现象。
• • • 凝聚 液体 气体 蒸发
• 此时,液面上方单位空间里的蒸气分子数目不 再增多,蒸气具有恒定的压力,我们称这时的 蒸气为饱和蒸气,饱和蒸气对器壁的压力称为 饱和蒸气压,简称蒸气压。蒸气压是液体的重 要特性之一,它仅与液体的本质和温度有关, 与液体的量以及液面上方空间的体积无关。
• 相同温度下,若液体分子之间的引力强, 液体分子难以逸出液面,蒸气压就低; 反之,若液体分子之间的引力弱,液体 分子容易逸出液面,蒸气压就高。 • 对同一液体来说,若温度高,则液体中 动能大的分子数目多,逸出液面的分子 数目也相应多些,蒸气压高;反之,若 温度低,则液体中动能大的分子数目少, 逸出液面的分子数目也相应少些,蒸气 压低。具体的例子见书p8,图1-3。
• 液体在沸点时的温度下,气化在整个液体中进 行,称之为液体的沸腾。而在低于此温度下的 气化,则仅限于液体表面上进行,即蒸发。这 就是在沸点以下和达到沸点时液体气化之区别 所在。 • 很明显,液体的沸点同外界气压密切相关。外 界气压升高,则液体的沸点升高;外界气压降 低,则液体的沸点也随之降低。当外界气压为 一个标准大气压即100kpa时,此时液体的沸点 称为正常沸点。见书p8,图1-3,可以找出三 氯甲烷、乙醇、水、醋酸的正常沸点分别为: 61.3℃、78.4℃、100℃、118.5℃。可知这几 种液体挥发性质从易到难分别为:三氯甲烷、 乙醇、水、醋酸。
Pi x i P ; x i
ni n
; ni
m M
;
而 m H 2 m He m N 2 m CO 2 M
CO 2
44 , M M
He
H2
2, M
N2
N2
28 , M
He
4,
即M
H2
M
M
CO 2
n H 2 n He n N 2 n CO 2 , 即 x H 2 x He x N 2 x CO 2 PH 2 PHe PN 2 PCO 2
固体可以想象,当液体的温度降低时,液
体分子的运动的速度必然减慢。一旦温 度降低到分子所具有的平均动能不足以 克服分子间的引力时,将有一些速度小 的分子聚集在一起相对地固定在一定的 位置上。这时液体开始变为固体,这个 过程叫做液体的凝固;相反的过程叫做 固体的熔化。凝固过程是一种放热过程, 体系的能量降低;熔化过程是一种吸热 过程,体系的能量升高。
• 同理根据 V= nRT/P 可得: • V(i)/V=n(i)/n=x(i) • V=V(A)+V(B)+…+V(i) • 分体积定律:混合气体的总体积等于 各组分气体的分体积之和。
• 5.在298K下由相同质量的CO2,H2,N2, He组成的混合气体总压力为P,各组分 气体分压力由大到小的顺序为? • . • 3.在25℃和103.9Kpa下,把1.308g锌与 过量稀盐酸作用,可以得到干燥氢气多 少升?如果上述氢气在相同条件下于水 面上收集,它的体积应为多少升(25℃ 时水的饱和蒸气压为3.17Kpa)?
• a(1657年)波尔定律:在恒定温度下,一定量气体所占 的体积与所受的压力成反比: • V∝1/P或V=常数1/p或pv=常数 • b(1776年)查理定律:在恒压下,一定质量的气体的体 积和绝对温度成正比: • V∝T或v/T=常数 • c(1801年)道尔顿分压定律:气体混合物的总压力等于 混合物中各气体分压的总和: • P总=P1+ P2+ P3+… • d(1818年)盖吕萨克定律:当一定质量的气体的体积保 持恒定时,气体的压力同绝对温度成正比: • P∝T或P/T=常数 • 盖吕萨克定律的重要性后来被亚佛和加德罗所认识,提 出了现在著名德亚佛加德罗原理:在恒温和恒压条件 下,等体积的气体含有相同数目的分子: • V∝n
• • • • • • •
e:理想气体状态方程 讨论过的理想气体三种体积关系: 波儿定律: V∝1/P 查理定律: V∝T 亚佛加德罗定律:V∝n 综上可推出: V∝n(T/P)(T)或V∝nT/p 将上式引入一常数R,则为理想气体状态方程式: PV= nRT • 式中:P:气体压力,Pa(帕),1Kpa(千帕)= 1000Pa;V:气体体积,m3(立方米),1m3= 1000L(升)=1000dm3(立方分米);N:气体物质的 量,mol(摩尔),1kmol(千摩尔)=1000mol;T: 气体的热力学温度,K(开),0℃=273.15K;R: (摩尔)气体常数,为8.314J· -1· -1 。 mol k
• 一.液体的蒸气压 • 一.液体的蒸气压 • 蒸发(气化):液体表面某些运动速度 较大的分子所具有的能量能克服分子间 引力,飞逸出液面变为气体,也就是液 体转变为气体。 • 凝聚(液化):蒸气分子在作无序运动 时与液面撞击时,会被捕获进入液体, 气体转化成液体。
• 蒸发与凝聚过程是互不相干、独立进行的,两 者之间没有直接的定量关系。当蒸发与凝聚的 速度相等时,体系达到一种动态平衡,此时蒸 发与凝聚的过程并没有停止,只是速率相等; 从宏观上看,液体量和气体量不再发生变化。 其过程可以表示如下:
解:1)已知, T = 25 + 273 . 15 = 398 . 15 K , ( P =103 . 9 KP a ,m Zn 1 . 308 g , Z n 与盐酸反应方程式: n Zn n H 2 PV nRT VH2 n H 2 RT P 0 . 02 8 . 314 298 . 15 103 . 9 为 H 2 与水蒸气的混合气体, 0 . 48 L m Zn M
• 实际计算中一定要注意各单位的统一!
• 理想气体状态方程的一些其它形式
n
m M m M
PV nRT V m
RT
m
PV nRT P
m M
RT
P
M RT
1mol理想气体的体积为22.40L。在标准状况下(STP) 一些实际气体的摩尔体积如下表所示:
物质 摩尔体积 L/mol
• 例1:水分子HOH和酒精分子ROH在分 子结构上类似,分子间力的强度很接近 (都是氢键),故二者可以在分子间互 相渗透,能以任何比例互溶。 • 例2:水HOH和四氯化碳CCl4,二者在分 子结构上完全不相似,分子间力也完全 不同(水以氢键为主,沸点mp=100℃, 比重1.00;CCl4的分子间力以范德华力 为主,沸点mp=76.75℃,比重1.594), 两种液体不溶,混合时将分层,上层为 水,下层为四氯化碳。
• 相似相溶原理:性质相近(分子间作用 力和分子结构)则互溶,性质不同则不 溶。(1)分子间力包括范德华力(色散 力,诱导力,取向力)和氢键。(2)由 非极性键构成的分子都为非极性分子 (N2);由极性键构成的分子如结构对 称,正负电荷中心重合的为非极性分子 (CO2),如结构不对称的为极性分子 (H2O)。(3)非极性分子间只存在色 散力;极性分子于非极性分子间存在色 散力、诱导力;极性分子间存在色散力、 诱导力、取向力。
蒸气压曲线: 用蒸气压数据对温度作图,得一条曲线,即蒸气压曲线,见 书p8。若lgP对1/T×10-3作图则得一条直线:
2
lgP
1
0
-1 2.5 2.7 2.9 3.1 3.3 3.5
1/T×10-3
• • • • •
用上图的直线关系可用如下通式表示: lgP=A/T+B…………………(1-7) A为直线斜率,B为截距。 A=-ΔrHmθ/(2.303R)…………(1-8) ΔrHmθ 是摩尔蒸发热:在一定温度(沸点)下, 把一摩尔液体转化成一摩尔蒸气所需得热能, 代表一种物质从液态变道蒸发态时本身热含量 得变化,也就是总热能得变化。 • 热含量简称热焓,有时简称焓, ΔHm 也叫蒸 发焓: • ΔHm=H气-H液
