2017化学表格计算题
化学表格题(基本有答案)
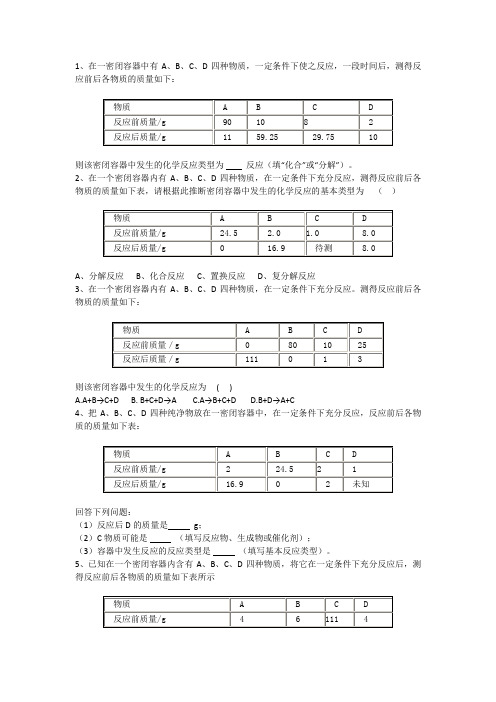
1、在一密闭容器中有A、B、C、D四种物质,一定条件下使之反应,一段时间后,测得反应前后各物质的质量如下:则该密闭容器中发生的化学反应类型为反应(填“化合”或“分解”)。
2、在一个密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表,请根据此推断密闭容器中发生的化学反应的基本类型为()A、分解反应B、化合反应C、置换反应D、复分解反应3、在一个密闭容器内有A、B、C、D四种物质,在一定条件下充分反应。
测得反应前后各物质的质量如下:则该密闭容器中发生的化学反应为( )A.A+B→C+DB. B+C+D→AC.A→B+C+DD.B+D→A+C4、把A、B、C、D四种纯净物放在一密闭容器中,在一定条件下充分反应,反应前后各物质的质量如下表:回答下列问题:(1)反应后D的质量是g;(2)C物质可能是(填写反应物、生成物或催化剂);(3)容器中发生反应的反应类型是(填写基本反应类型)。
5、已知在一个密闭容器内含有A、B、C、D四种物质,将它在一定条件下充分反应后,测得反应前后各物质的质量如下表所示对该表中所给的数据进行分析,你认为:密闭容器内发生的化学变化的基本类型是;密闭容器内参加反应的物质和生成的各物质之间的质量比为。
6、在一个密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:下列说法正确的是A.该反应的反应物为A和C B.容器中发生的化学反应,属于化合反应C.反应后,生成D的质量为84g D.反应后,待测A的质量为26g7、在一个密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:下列说法正确的是( AC )A.该闭容器中发生的化学变化属于分解反应B.密闭容器中发生的化学变化属于化合反应C.该反应中A、B、C、D四种物质(参加反应或生成)的质量比为22∶9∶111∶80D.反应后密闭容器中A的质量为22 g8、在密闭容器中有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:下列说法正确的是( )A.物质C一定是化合物,物质D可能是单质B.反应后密闭容器中A的质量是19.7gC.反应过程中,物质B与物质D变化的质量比为87:36D.若物质A与物质C的相对分子质量之比为197∶158,则反应中A与C的化学计量数之比为1∶2[分析]根据表中数据可以看出,物质C反应后的质量比反应前的质量减少,所以C为反应物,在反应过程中C消耗的质量为31.6g.B、D反应后的质量比反应前的质量增加,所以B、D为生成物,生成B的质量为17.4-8.7=8.7g,生成D的质量为3.6-0.4=3.2g,由于生成的B、D的质量和小于31.6g,故A也是生成物,根据质量守恒定律,生成物A的质量为31.6-8.7-3.2=19.7g,反应后容器中A的总质量为19.7g+19.7g=39.4g,由此可以得出该反应为分解反应,所以A选项的说法正确.B、C选项说法有错误,将生成的A与参加反应的C的质量比换成化学计量数比为19.7/197:31.6/158=1∶2,可知选项D的说法正确,答案为A、D请回答下列问题:A 反应后物质A的物质______B 请根据数据判断该反应的基本类型__________C 反应过程中B和C物质质量之比________D 如已知C和D的物质相对分子之比为158:16,那么C和D的化学计量数之比为____分析:该题是化学化学方程式的综合题,考查的知识点主要有:质量守恒定律、化学方程式的基本类型、化学方程式中物质质量关系、化学反应方程式中化学计量数的确定。
2017年中考化学试题汇编1-物质的构成和变化-考点7-化学计算-1表格

30.(6分)(2017•贺州)小英同学为了测定某地区石灰石样品中碳酸钙的质量分数,取该样品15g,现将75mL的稀盐酸分三次加入石灰石样品中,每次充分反应后测得生成气体的质量,实验数据如下表:实验第一次第二次第三次加入稀盐酸的量/mL 25 25 25生成气体的质量/g 2.2 m 1.1试求:(1)m的值是 2.2g.(2)求该样品中碳酸钙的质量分数(保留一位小数).(2017梅州)17.(12分)某氢氧化钙中韩碳酸钙杂质。
称取研细的该样品12.4g放入锥形瓶中,加入32.6g的水,充分振荡形成悬浊液,再向锥形瓶中逐滴滴加盐酸使其充分反应至无气泡产生。
测得加入盐酸的质量与锥形瓶中的物质的质量关系如下表示。
加入盐酸的质量g 0 25 37.5锥形瓶中物质的质量45 70 80.3(1)加入盐酸的质量在0—25g时,与盐酸发生反应。
(2)反应产生二氧化碳质量为g。
(3)求样品中氢氧化钙的质量分数(写出计算过程,精确到0.1%)。
(2017武汉32.(6分)将4.0gCu –Zn合金粉末放到盛有10g稀硫酸的烧杯中,恰好完全反应。
过滤、称量滤液的质量。
相关实验数据如下:反应前物质的质量/ g 反应后物质的质量/ gCu – Zn合金稀硫酸滤液4.0 10 11.26(1)Cu – Zn合金属于材料(“金属”或“有机合成”)(2)若不考虑该合金中除Cu、Zn以外的其他成分,请计算原Cu – Zn合金中Zn的质量。
写出必要的计算过程。
(2017黔东南州)15.欲测定某锌﹣铜合金中铜的质量分数,进行如下实验:取合金样品10克放入烧杯中,将60克稀硫酸分三次加入,充分反应后,测得生成气体的质量如下:实验次数第一次第二次第三次加入稀硫酸质量/g 20 20 20生成气体质量/g 0.08 m 0.04请回答下列问题并计算:(1)第二次实验时生成气体质量m=_________克;(2)计算该合金样品中铜的质量分数.(2017河北)36.某兴趣小组用图22所示装置制取氧气,试管中固体的质量随时间变化的数据见下表。
10.1 化学计算题 表格型计算(学生)

中考特训10 化学反应的计算10.1 表格型计算重难点集训目录一、表格型计算与解答1、已知反应前与反应后几个物理量,求待测量、反应性质与组成元素等2、固体样品与某溶液反应(金属或大理石样品等)与酸的反应3、求反应中某段的溶质种类与溶液中的溶质质量分数重难点习题集训实验小组在实验室找到一瓶含有铜和铁的均匀混合物。
为测定该混合物中铁的质量分数,分别取一定质量的混合物与稀硫酸进行反应,实验分四组,所得数据如下表所示:请分析数据,回答下列问题:(1)该混合物中铁的质量分数为多少?(2)表中的W=________(填数值)。
(3)第1组实验中所得滤液中的溶质是________(用化学式表示)。
(4)计算第4组实验中所得溶液溶质的质量分数。
(写出计算过程,结果精确到0.1%)在一定量的氢氧化钠稀溶液中逐渐滴加溶质质量分数为 0.73%的稀盐酸,反应过程中不断搅拌并及时测量不同时刻溶液的温度与 pH 值,记录数据如下表:(1)观察上表发现,当反应时间在________s 时,氢氧化钠与盐酸恰好中和。
(2)分析上表数据发现,在逐渐滴加稀盐酸的过程中,溶液的温度先升高后降低,请分析原因_____ 。
(3)结合上表中滴入稀盐酸体积与 pH 值的变化数据,试计算氢氧化钠稀溶液中溶质的质量。
(稀盐酸的密度取 1.0 g/mL ;化学方程式为 NaOH +HCl=NaCl +H 2O )、大理石(主要成分是碳酸钙)是重要的建筑材料。
天安门前的华表、人民大会堂的不少柱子都是用大理石做的。
某大理石厂为了测定一批大理石中碳酸钙的质量分数,取用5g大理石样品,把25g稀盐酸分5次(每次5g)加入到样品中(样品中的杂质与盐酸不反应,也不溶于水),充分反应后,经过滤、洗涤、干燥等操作(无物质损失),最后称量,得到的实验数据如下表:⑴第________次实验中稀盐酸肯定过量。
⑵该大理石中碳酸钙的质量分数为____________。
⑶计算 5g 该大理石样品中的碳酸钙完全反应后生成二氧化碳的质量。
化学图表计算类型专项训练

化学专题训练-------图表计算可能用到原子量:H-1、O-16、Zn-65、S-32、K-39、Cl-35.5、Ag-108、N-14 Ca--40、Na--23、Cu--64、Cl--35.51.化学实验室现有98%的浓硫酸,但在实验中常用到较稀的硫酸。
要把50g 质量分数98%的浓硫酸,稀释为质量分数20%的硫酸。
(1)稀释后硫酸溶液中溶质的质量是多少? (2)稀释时所需水的质量是多少? 2.现有一瓶未开启的浓硫酸,试剂瓶标签上的部分内容如右图所示, 请仔细阅读后计算:(写出计算过程)(1)该瓶浓硫酸中硫元素的质量分数是多少?(计算结果保留一位小数,下同。
)(2)欲配制200 g 溶质质量分数为20%的稀硫酸,需用这种浓硫酸的体积是多少?需加水的质量是多少?3.向10g 氢氧化钠和硫酸钠的混合物中加入100g 溶质的质量分数为9.8%的硫酸溶液,恰好完全反应。
计算:(1)原混合物中氢氧化钠的质量分数;(2)反应后所得溶液中溶质的质量分数。
4.镁条在空气中易被氧化。
有一根在空气中放置一段时间的镁条样品,其质量为2.56g ,将该样品与44g 足量的稀硫酸充分混合,反应过程中测得数据如下:请计算 (写出计算过程) :(1)2.56g 样品中含金属镁的质量是多少? (2)氧化前镁条的质量是多少?5.实验室有一瓶久置的氢氧化钠固体,某同学想了解其变质情况,设计了实验,实验过程如下:实验一:取少量样品于试管中,滴加适量稀盐酸,观察到有气泡产生,说明氢氧化钠已变质,变质的原因是_________________ ______ ____(用化学方程式表示)。
实验二:通过实验二,能进一步推算出氢氧化钠变质的程度。
(1)请计算实验二中参加反应的碳酸钠质量。
(化学方程式:Na 2CO 3+ CaC12=CaCO 3↓+2NaCl )(2)通过实验一的分析和(1)的计算结果,可以进一步计算出样品中已变质的氢氧化钠。
(完整版)初中化学表格计算题(含答案)

nt h初中化学表格计算题答案:75% 1g/4g=75% 14.6%(1)75% 1g/4g=75%(2)解:由表中数据可知第三次加入5 g 稀盐酸后,3 g 碳酸钙与15 g 稀盐酸刚好完全反应。
设稀盐酸中溶质的质量为xCaC03 + 2HCl === CaCl 2 + H 20 + C02↑ 100 733g x73/100 =" x" / 3 x="2.19" g 稀盐酸的溶质质量分数为: 2.19/15×100%=14.6%2、现将石灰石样品15 g 与105.4 g 稀盐酸放入烧杯中充分反应(杂质不与稀盐酸反应),反应时间与反应前后烧杯内物质的质量变化如下表所示:反应时间/s 202020202020质量/g119.52118.64117.76116.88116116(1)样品中碳酸钙的质量分数。
(计算结果保留1位小数)答案:(1)0.96 (2)81.7%试题分析:(1)此题是数据分析、处理题,因为随着反应的进行,氧气不断产生,故剩余固体质量不断减少,直至不再发生变化,说明 结束,故直接根据质量守恒定律,生成氧气的质量=3g-2.04g=0.96g (2)根据化学反应:2KClO 32KCl + 3O 2↑中氧气和氯酸钾的质量关系,即可求出氯酸钾的质量,进an dAn ga re 而计算原混合物中氯酸钾的质量分数解:原混合物中氯酸钾的质量为x 2KClO 32KCl + 3O 2↑ 245 96 x 0.96g答:原混合物中氯酸钾的质量分数为81.7%。
4、某样品为Cu 和CuO 的混合物。
为测定样品中CuO 的含量,甲、乙、丙、丁四位学生用同一样品分别进行实验,测定的数据如下:物 质 质 量学生甲学生乙学生丙学生丁所取固体样品的质量 /g 30252020加入硫酸溶液的质量 /g 100100100120反应后剩余固体的质量 /g22171212分析实验数据,回答下列问题:(1)求混合物中氧化铜的质量分数(2)求硫酸溶液的质量分数(3)反应后所得溶液中溶质的质量分数。
化学表格计算试题及答案

化学表格计算试题及答案一、选择题1. 下列物质中,属于纯净物的是()。
A. 空气B. 矿泉水C. 蒸馏水D. 盐水答案:C2. 根据化学方程式2H2 + O2 → 2H2O,下列说法正确的是()。
A. 每2个氢分子和1个氧分子反应生成2个水分子B. 每4个氢原子和1个氧分子反应生成2个水分子C. 每2个氢分子和1个氧分子反应生成1个水分子D. 每4个氢原子和2个氧原子反应生成2个水分子答案:A二、填空题3. 根据化学方程式C6H12O6 + 6O2 → 6CO2 + 6H2O,葡萄糖(C6H12O6)完全燃烧后生成的二氧化碳(CO2)和水(H2O)的分子个数比是 ________。
答案:1:14. 已知某化合物的化学式为H2SO4,其中硫元素的化合价为+6价,氧元素的化合价为-2价,氢元素的化合价为+1价。
根据化合价规则,该化合物中硫元素的化合价为 ________。
答案:+6三、计算题5. 计算下列化学反应的摩尔比。
反应方程式:2Na + Cl2 → 2NaCl(1)钠(Na)和氯气(Cl2)的摩尔比是 ________。
(2)钠(Na)和氯化钠(NaCl)的摩尔比是 ________。
答案:(1)1:1 (2)1:16. 某溶液中含有0.5摩尔的硫酸(H2SO4),计算该溶液中硫酸根离子(SO4^2-)的摩尔数。
答案:1摩尔四、简答题7. 描述如何通过化学方程式计算反应物和生成物的摩尔数。
答案:首先确定化学方程式中各物质的系数,然后根据系数计算反应物和生成物的摩尔数。
系数表示在完全反应的情况下,各物质的摩尔比。
例如,对于方程式2Na + Cl2 → 2NaCl,钠和氯气的摩尔比为1:1,生成的氯化钠摩尔数与反应的钠摩尔数相等。
8. 解释什么是摩尔质量,并给出一个具体的例子。
答案:摩尔质量是指一摩尔物质的质量,单位为克/摩尔(g/mol)。
例如,水(H2O)的摩尔质量是18克/摩尔,因为它由两个氢原子和一个氧原子组成,氢的原子质量约为1克/摩尔,氧的原子质量约为16克/摩尔,所以水的摩尔质量为2*1 + 16 = 18克/摩尔。
(完整版)初中化学表格计算题(含答案)

初中化学表格计算题一、实验数据的分析(求固体质量分数用总数据,求溶液质量分数用第一次数据)1、石灰厂为了测定一批石灰石样品中碳酸钙的质量分数,取用4 g 石灰石样品,把20 g 稀盐酸分4 次加入样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下表:稀盐酸的用量第一次加入5 g 第二次加入5 g 第三次加入5 g 第四次加入5 g剩余固体的质量 3 g 2 g 1 g 1 g(1)该石灰石样品中碳酸钙的质量分数是(2)计算该稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%)。
(3)100 千克这种纯度的石灰石充分煅烧后,可得到固体多少千克?答案:75%1g/4g=75% 14.6%(1)75%1g/4g=75%(2)解:由表中数据可知第三次加入 5 g 稀盐酸后,3 g 碳酸钙与 15 g 稀盐酸刚好完全反应。
设稀盐酸中溶质的质量为 xCaC03+ 2HCl === CaCl2+ H20 + C02↑100 733g x73/100 =" x" / 3 x="2.19" g稀盐酸的溶质质量分数为: 2.19/15×100%=14.6%2、现将石灰石样品15 g 与105.4 g 稀盐酸放入烧杯中充分反应(杂质不与稀盐酸反应),反应时间与反应前后烧杯内物质的质量变化如下表所示:反应时间/s 20 20 20 20 20 20质量/g 119.52 118.64 117.76 116.88 116 116(1)样品中碳酸钙的质量分数。
(计算结果保留1 位小数)(2)反应后所得溶液中溶质的质量分数。
答案:解:设样品中碳酸钙的质量为X 克。
由表可知,反应完全后,剩余的质量为116 克。
那么生成二氧化碳气体的质量就是15+105.4-116=4.4g2HCl+CaCO3=CaCl2+H2O+CO2 100 111 44 X Y 4.4100/X=44/4.4 111/Y=44/4.4X=10;Y=11.1(1)样品中碳酸钙的质量分数=10 /15*100%=66.7% (2)反应后所得溶液中溶质的质量分数。
中考化学表格类计算问题专题练习卷

中考化学表格类计算问题专题练习卷《表格类计算问题》专题练习卷稀硫酸分三次加⼊,每次⽣成⽓?某同学⽤锌和稀硫酸制取氢⽓?向⽓体发⽣装置中加⼊⼀定量的锌粒,将30g1体的质量如表?第⼀次第⼆次第三次次数10 10 10 加⼊稀硫酸质量/g0.020.040.04⽣成氢⽓质量/g。
g (1)共制得氢⽓____________________ 2 ()所⽤稀硫酸的溶质质量分数。
(填“增⼤”“不变”或“变⼩)。
3 ()反应前后,装置内锌元素的质量_________0.1)(【答案】119.6% (2)稀硫酸的溶质质量分数为 )不变(3 (假稀盐酸分4.0gCaCO2.海边盛产贝壳,其主要成分为?某化学兴趣⼩组称取贝壳样品,把50g5次加⼊样品中3设杂质不反应也不溶解)。
稀盐酸的⽤量得实验数据如下剩余固体的质量3.0g第⼀次加⼊10g2.0g第⼆次加⼊10g1.0g第三次加⼊10g0.8g 10g 第四次加⼊0.8g第五次加⼊10g请计算:。
1 ()贝壳中碳酸钙的质量分数是_______1(2)这些贝壳最多可制得多少克⼆氧化碳?【答案】(1) 80% (2) 1.43?为测定镁和硫酸镁固体混合物中镁元素的质量分数,先称取混合物10g,放⼊⼀⼲净的烧杯中,然后取⼀定溶质质量分数的稀硫酸100g,平均分五次加⼊其中,充分振荡,实验所得数据如下表:第1次第2次第3次第4次第5次20 20 加⼊稀硫酸的质量/g 20 20 20y⽣成⽓体的总质量/gx0.120.40.36、y= 。
)上表中(lx= _______ _________(2)固体混合物中镁元素的质量分数为。
__________________ (3 )所⽤稀硫酸的溶质质量分数为多少?0.24 0.4 )(【答案】158.4% (2) 29.4%3) (20gHCl4 ?某品牌洁厕灵的成分是硫酸与盐酸的混合溶液,某课外活动⼩组想测定该品牌洁厕灵溶液中的质量。
化学表格计算题归纳

1、石灰厂为了测定一批石灰石样品中碳酸钙的质量分数,取用4g石灰石样品,把20g稀盐酸分4次加入样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下表:(1)该石灰石样品中碳酸钙的质量分数是__________;(2)计算该稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%)。
2、某课外小组为了测定铜铁合金中铁的质量分数,现取铜铁合金样品20.0g,将80.0g稀硫酸平均分成4份,分4次逐渐加入到样品中,每次充分反映后测得剩余固体质量见下表:试求:(1)20.0g铜铁合金中,铜的质量为_______g。
(2)铜铁合金中,铁元素的质量分数为________。
(3)20.0g稀硫酸溶液中溶质的质量为_________g。
3、某科学兴趣小组在综合实践活动中,从黄家村石灰厂带来一块石灰石样品,技术员告诉他们此样品中含有的杂质是二氧化硅,二氧化硅难溶于水且不与盐酸反应。
为了测定该石灰石的纯度,兴趣小组的同学取用4g这种石灰石样品,用实验室现有的未知溶液质量分数的稀盐酸40g分4次加入,充分反应后,经过滤、干燥等操作后称量,得到如下数据:(1)表示m的值为_________g。
(2)该石灰石样品的纯度。
(3)所用的稀盐酸中溶质的质量分数。
4、为了测定某铜锌合金的组成,某校化学课外后动小组利用该合金粉末与稀硫酸反应,进行了三次试验,所得相关的试验数据记录如下:(1)试计算该铜锌合金中锌的质量。
(2)从上表数据分析,当取合金与所用稀硫酸的质量比为________时,表明合金中的锌与稀硫酸恰好完全反应。
(3)计算所用合金与稀硫酸恰好完全反应时所得溶液中溶质的质量分数。
5、为了测定黄铜屑(有锌和铜形成的合金)样品组成,甲、乙、丙、丁四位同学分别取样和稀硫酸反应(稀硫酸的密度为1.17g/mL),实验数据记录如下:求:(1)16.0g黄铜屑中锌的质量为多少g ?(2)丁同学所加稀硫酸的体积为多少mL ?6、某石灰厂新到一批石灰,期中含有杂质二氧化硅(二氧化硅不溶于水,不与盐酸反应,高温不分解)为测定石灰石样品的纯度,某化学研究性学习小组的同学分成三组试验测得数据如下表:(1)在空格中填写数据;(2)求出该石灰石样品的纯度7、某校化学研究性学习小组了解到,某石材厂新购进一批石灰石原材料,其所含的杂质既不溶于水,也不溶于盐酸,高温时也不发生反应。
2017人教版九年级化学计算题大全(共65张)

根据氢气在氧气中燃烧的化学(huàxué)方程式,请你标出
各物质的质量比:
2H2
+ O2
点燃2 H2O
(1×2) × 2 : 16×2 : (1×2+16×1)× 2
4 : 32 : 36
若: 4g : ( 3)2 g : ( )36g
若:( 2)g ( 1)6 g : 18 g
通过(tōngguò)今天的学习,你有哪些收获? 1.纯量与不纯量之间的相互换算
2.化学方程式计算的一般步骤
3.含杂质物质的化学方程式计算的方法
第12页,共65页。
第二 课时 (dìèr) 第13页,共65页。
你 还 记 得 吗?
化学方程式的含义
1、表示(biǎoshì)反应物,生成物及反应条件。 2、表示反应物、生成物之间的粒子个数之比。 3、表示反应物、生成物各物质之间的质量比。
Fe2O3+3CO 160
2Fe+3CO2
112
160t
x
160 112 160t x
解得x=112t
答:能冶炼出铁112吨。
第9页,共65页。
2.现有(xiàn yǒu)含Fe2O380%赤铁矿石2000 t,可炼得杂质含 量为5%的生铁多少吨?
解:2000 t赤铁矿中含Fe2O3质量为:
2000t×80%=1600 t
1600t
x
160 112 1600t x
解得x=1120t
答:能冶炼出铁1120吨
第8页,共65页。
练习巩固2
1.现有含杂质20%赤铁矿石(主要成分是Fe2O3)200 t,问能 冶炼(yěliàn)出多少吨铁?
解:200 t赤铁矿中含Fe2O3质量为:
2017化学表格计算题

2017化学表格计算题D1、水污染原因:①工业三废②农药、化肥任意施用③生活污水任意排放。
2、空气污染原因:①粉尘污染②气体污染:有害气体(SO2、NO2、CO),形成酸雨的是SO2、NO2。
3、CO有剧毒,能与血液中的血红蛋白结合。
4、甲醇(CH3OH)有毒,工业酒精中含有甲醇所以不能饮用。
5、甲醛(可作防腐剂)、亚硝酸钠(NaNO2)、硫酸铜(CuSO4)有毒,不能食用。
四、露置在空气中的物质(或溶液)的质量变化:1、质量增重的:①浓H2SO4(有吸水性,可作干燥剂但不能干燥NH3气);②NaOH固体(吸水而潮解并可与CO2反应而变质,可作干燥剂但不能干燥CO2、SO2、SO3、HCl等气体);③生石灰(与H2O与CO2反应,可作干燥剂但不能干燥CO2、SO2、SO3、HCl等气体));④石灰水(与CO2反应)⑤铁粉(与O2和H2O反应而生锈)。
2、质量减轻的:①浓HCl、浓HNO3(易挥发)。
五、化学实验操作中的“先”“后”顺序:1、稀释浓硫酸时,应先在烧杯中加水,后把浓硫酸慢慢加入水中。
2、点燃可燃性的气体(如H2、CO、CH4等)时,应先检验其纯度,后点燃。
3、加热固体时,应先预热,后集中在药品下方加热。
4、实验室用排水法收集氧气后,先要把导气管移出水面,后移开酒精灯(防止水倒流入试管内使试管炸裂)。
5、用氢气还原氧化铜,实验开始时,应先通入氢气1——2分钟,后加热;反应完毕,应先停止加热,待试管冷却后移开导气管。
6、要得到较纯净的气体,一般先除杂,后干燥。
六、有关物质的颜色:1、蓝色液体:铜盐溶液[CuSO4、CuCl2、Cu(NO3)2];蓝色固体:Cu(OH)2、紫色石蕊遇碱。
2、红色:铜Cu、红磷P、铁锈Fe2O3、紫色石蕊遇酸、无色酚酞遇碱。
3、红褐色沉淀:Fe(OH) 3 ;暗紫色:高锰酸钾KMnO44、黄色:硫粉S 、Fe2(SO4)3、FeCl3(即Fe3+的溶液)黄色。
2017年中考化学专题训练 表格型计算题(无答案)
表格型计算题专题练习
1、石灰厂为了测定一批石灰石样品中碳酸钙的质量分数,用了4g石灰石样品,把20g 稀盐酸分4次加入样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶于水),充分
该石灰石样品中碳酸钙的质量分数为。
(2)计算稀盐酸的溶质质量分数(结果精确到0.1%)
2、某课外兴趣小组对一批铁样品(杂质不溶于水也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行实验,其中只有一位同学所取用的稀硫酸与铁样品恰好完全反应。
实验数据如
(1)同学所取用的稀硫酸与铁样品恰好完全反应。
(2)计算样品中铁的质量分数。
(3)计算恰好完全反应后所的溶液中溶质的质量分数。
(烧杯的质量为25.4g,计算结果精确到0.1%)
3、小王、小陈、小杜三位同学分别取废电池外壳(混合物)与稀盐酸反应,所得实验数据如
(2)假设这些金属为锌,则实验所用稀盐酸的溶质质量分数是多少?
(1)
(2)甲制得的硫酸亚铁的质量
(3)该稀硫酸中溶质的质量分数
5、某同学为了测定黄铜屑(由锌和铜形成的合金)样品组成,分四次取样品与稀硫酸反应,
试计算:
(1)黄铜屑中锌的质量分数
(2)所用稀硫酸中溶质的质量分数
(3)。
(版)初中化学计算题之表格图像题

1.5g黄铜样品粉末中,每次充分反响后,测定生成氢气的质量,。
(2)此黄铜样品中锌的质量分数是多少?2.中考专题复习——表格图像题3.我国约在南北朝时就开始冶炼黄铜。
黄铜是铜和锌的合金〔Cu-Zn〕,第一第二第三次次次它可用来制造及其、电器零件及日用mL〕555参加稀盐酸的体积〔品。
为了测定某黄铜样品中锌的质量g〕m生成氢气的质量〔分数〔不考虑黄铜中的其他杂质〕,现将15mL稀盐酸分三次参加到实验数据见下表:试求:2.某化学兴趣小组为了测定镁铜合金中镁的质量分数,取出稀硫酸用量剩余固体质量3g合金样品,将60g稀硫酸分6次参加样品中,充分反响后第一次参加10g mg过滤、洗涤、枯燥、称重,得到的实验数据如下:第二次参加10g(1)从以上数据可知,最后剩余的固体的成分第三次参加10g是;这六次实验中,第次参加稀硫酸时样品中第四次参加10g的镁已经完全反响;表格中,m=。
第五次参加10g(2)计算合金样品中镁的质量分数。
(3)计算所用稀硫酸中第六次参加10gH2SO4的质量分数。
为了对海水中的氯化物〔假设以NaCl计算〕进行成分分析,甲、乙、丙三位同学分别进行实验,他们的实验数据如下,请仔细观察分析,答复以下问题:(1)两溶液恰好完全反响的是甲乙丙_______的实验。
所取海水样品的质量/g1005050 (1)m=(2)请计算海水中氯化物的质量分参加AgNO3溶液的质量/g505075数是多少?反响后所得沉淀的质量/g4.如今市场上出现的假黄金〔铜锌合金〕坑害了许多消费者。
某校化学兴趣小组的同学们为测定假黄金的组成,称取20克假黄金置于烧杯中,用某未知溶质质量分数的稀盐酸50克,分5次参加,每次充分反响后,取出固体,经过滤、枯燥等操作后称重,各次稀盐酸用量和剩余固体质量记录如下:实验次稀盐酸的用量剩余固体的质量数〔g〕〔g〕11018.37521016.75031015.12541013.50051013.500请分析上图表,答复以下问题:〔1〕假黄金中铜、锌的质量之比为。
真题汇编-2017年全国化学中考真题分类专题四、计算应用题

专题四、计算应用题一、选择题15.(2017哈尔滨市,15,2)现有部分被氧化的铜粉固体混合物,为研究铜粉的组成情况,取24g 混合物,先加热完全氧化后,再加入60g9.8%的稀硫酸恰好完全反应,则固体混合物中铜单质的质量分数为( )A .80%B .64%C .16%D .96%【答案】A【解析】本题主要考查根据方程式的计算;设反应的氧化铜质量为,参加反应的硫酸质量=60g ×9.8%=5.88g ,CuO+ H 2SO 4=CuSO 4+ H 2O80 985.88g80=985.88g 解得:=4.8g 所以固体混合物中铜的质量分数为:24g-4.8g 100%=80%24g´;故A 选项正确,符合题意,BCD 错误。
【知识点】根据化学方程式的计算15.(2017江苏盐城,15题,2分)工业上,锻烧石灰石(主要成分是CaCO 3)可制得生石灰(CaO),现有一包CaCO 3和CaO 的固体混合物.己知Ca 元素与C 元素的质量比是5 l ,则此混合物中Ca 元素与O 元素的质量比是( )A, 15 16 B. 15 :14 C. 5 4 D. 15 8【答案】B【解析】,钙元素与碳元素的质量比为51,假设碳元素质量为12g ,则钙元素质量为60g ,含12g 质量的碳酸钙中钙元素质量为40g ,氧元素为48g ,氧化钙中钙元素质量为60g-40g=20g ,氧化钙中氧元素质量为20g ÷40/56-20g=8g,故混合物中氧元素质量为48g+8g=56g ,因此钙与氧的元素质量比为:6056=1514。
故本题答案为B 。
【知识点】化学式计算二、填空题19.(2017河南省,20,3)电解食盐水可得到烧碱、氯气(Cl 2)和一种可燃性气体,反应的化学方程式为_________;配制质量分数为5%的氯化钠溶液,若量取水时俯视量筒刻度读数(其他操作正确),溶液的质量分数______5%(填“大于”、“小于”或“等于”);现有NaCl 和NaBr 的混合物共2.2 g ,溶于水并加入过量的AgNO 3溶液后,生成AgCl 和AgBr 沉淀共4.75g ,则原混合物的含钠元素的质量为________g 。
(2021年整理)2017九年级化学上册计算题专项复习题

(完整)2017九年级化学上册计算题专项复习题(完整)2017九年级化学上册计算题专项复习题编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((完整)2017九年级化学上册计算题专项复习题)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(完整)2017九年级化学上册计算题专项复习题的全部内容。
1九年级化学1--8单元计算题专项复习一:常见题型1、有关化学式的计算:1)关于相对分子质量的计算2)根据化学式计算物质中各元素质量比3)计算物质中某一元素的质量分数4)计算物质中某一元素的质量5)求样品中某物质的纯度或质量分数2、根据化学方程式的计算:(计算步骤:一设二写三标四列五解六答)1)直接根据化学方程式的简单计算2)有关实验室制取氧气或二氧化碳的计算3)有关工业上炼铁的计算二:经典例题及巩固练习有关化学式的计算例1:计算CaCO3、 2H2O 、 CO(NH2)2、CuSO4﹒5H2O的相对分子质量例2:常规题:H2O中各元素的质量比NH4NO3中各元素的质量比Ca(OH)2中各元素的质量比变形题:1)某铁的氧化物常用来作录音磁带和电讯器材的原材料。
实验测得该氧化物中铁元素与氧元素的质量比为21:8,则该氧化物的化学式为()A. FeO B。
Fe2O3C。
Fe3O4 D. Fe(OH)32)[南通市]已知:维生素C的相对分子质量为176,维生素C中C、H、O三种元素的质量比为9∶1∶12。
则维生素C的化学式为。
3)(09重庆)根据化学方程式A+NaOH== B十H20推断,B,A的相对分子质量相差()A. 12 B。
18 C.22 D。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2017化学表格计算题九年级化学部分知识小结一、常见物质的俗称(或主要成分)及化学式:学名俗称化学式学名俗称化学式氢氯酸盐酸HCl 碳酸钙石灰石、大理石CaCO3硫酸H2SO4氯化钠食盐NaCl硝酸HNO3碳酸氢钠小苏打NaHCO3石灰水Ca(OH)2水溶液碳酸钠纯碱、苏打(水溶液呈碱性)Na2CO3氢氧化钠火碱、烧碱、苛性钠NaOH氧化钙生石灰CaO氢氧化钙熟石灰、消石灰Ca(OH)2二氧化碳干冰CO2氯酸钾KClO3甲烷沼气、天然气CH4高锰酸钾KMnO4乙醇酒精C2H5OH 过氧化氢双氧水H2O2乙酸醋酸CH3COOH二、几个之最:1、地壳中含量最多的元素是氧元素,含量最多的金属元素是铝元素,二者组成的物质的化学式为:Al2O3。
2、最轻的气体是:氢气(H2),最理想的能源是氢气(H2)(无污染)。
3、相对分子质量最小的氧化物是水(H2O);天然最硬的物质是金刚石(C);最简单的有机物是甲烷(CH4)。
4、当今世界最重要的三大矿物燃料是煤(工业的粮食)、石油(工业的血液)、天然气(主要成分CH4)。
三、关于污染和物质的毒性:1、水污染原因:①工业三废②农药、化肥任意施用③生活污水任意排放。
2、空气污染原因:①粉尘污染②气体污染:有害气体(SO2、NO2、CO),形成酸雨的是SO2、NO2。
3、CO有剧毒,能与血液中的血红蛋白结合。
4、甲醇(CH3OH)有毒,工业酒精中含有甲醇所以不能饮用。
5、甲醛(可作防腐剂)、亚硝酸钠(NaNO2)、硫酸铜(CuSO4)有毒,不能食用。
四、露置在空气中的物质(或溶液)的质量变化:1、质量增重的:①浓H2SO4(有吸水性,可作干燥剂但不能干燥NH3气);②NaOH固体(吸水而潮解并可与CO2反应而变质,可作干燥剂但不能干燥CO2、SO2、SO3、HCl等气体);③生石灰(与H2O与CO2反应,可作干燥剂但不能干燥CO2、SO2、SO3、HCl等气体));④石灰水(与CO2反应)⑤铁粉(与O2和H2O反应而生锈)。
2、质量减轻的:①浓HCl、浓HNO3(易挥发)。
五、化学实验操作中的“先”“后”顺序:1、稀释浓硫酸时,应先在烧杯中加水,后把浓硫酸慢慢加入水中。
2、点燃可燃性的气体(如H2、CO、CH4等)时,应先检验其纯度,后点燃。
3、加热固体时,应先预热,后集中在药品下方加热。
4、实验室用排水法收集氧气后,先要把导气管移出水面,后移开酒精灯(防止水倒流入试管内使试管炸裂)。
5、用氢气还原氧化铜,实验开始时,应先通入氢气1——2分钟,后加热;反应完毕,应先停止加热,待试管冷却后移开导气管。
6、要得到较纯净的气体,一般先除杂,后干燥。
六、有关物质的颜色:1、蓝色液体:铜盐溶液[CuSO4、CuCl2、Cu(NO3)2];蓝色固体:Cu(OH)2、紫色石蕊遇碱。
2、红色:铜Cu、红磷P、铁锈Fe2O3、紫色石蕊遇酸、无色酚酞遇碱。
3、红褐色沉淀:Fe(OH) 3 ;暗紫色:高锰酸钾KMnO44、黄色:硫粉S 、Fe2(SO4)3、FeCl3(即Fe3+的溶液)黄色。
5、浅绿色:FeSO4、FeCl2 (即Fe2+的溶液)。
6、黑色:氧化铜CuO、二氧化锰MnO2、碳粉C、四氧化三铁Fe3O4。
7、有刺激性气味的物质:SO2(气体)、盐酸(液体)、醋酸(液体)。
七、实验室制备气体的思路:(反应原理、仪器装置、实验步骤、收集、验满、放置及注意事项)1、反应原理:(实验室制O2、CO2等气体的化学方程式见八)。
2、装置的选择:①发生装置:固体+ 固体反应,且需要加热,可用制O2的发生装置。
固体+ 液体反应,且不需加热,可用制CO2的发生装置。
②收集装置:排水法收集(难溶于水的气体)如:O2、H2、CO、CH4等;向上排气法收集(密度比空气大的气体)如:CO2、O2等;向下排气法收集(密度比空气小的气体)如:H2、CH4等。
(注意CO2只能用向上排空法不用排水法,CO只能用排水法不用向下排空法)八、初中化学反应归纳:(一)化合反应:由两种或两种以上物质生成另一种物质的反应。
“多变一”C + O 2(充足) CO22C + O2(不足)2COC + CO 22CO 2CO + O22CO2S + O 2SO2 4P + 5 O2 2 P2O5(产生大量白烟)2H 2 + O2 2 H2O (淡蓝色火焰、放热、生成水)3Fe + 2 O 2Fe3O4(剧烈燃烧、火星四射、生成黑色固体) 2Mg + O 2 2 MgO (耀眼的强光、放热、生成白色固体)CaO + H 2O == Ca(OH)2 (放热) CO 2 + H 2O == H 2CO 3(二)分解反应:由一种物质生成两种或两种以上物质的反应。
“一变多”2KClO 3 2KCl +3O 2↑2H 2O 2 2H 2O + O 2↑ 实验室制取氧气的反应2KMnO 4 K 2MnO 4 +MnO 2 +O 2↑2H 2O 2H 2↑+ O 2↑ CaCO 3 CaO +CO 2↑ (工业制生石灰) H 2CO 3 == CO 2↑+ H 2O (三)置换反应:一种单质..和一种化合物...反应,生成另一种单质..和另一种化合物...的反应。
“一换一” “A +BC AC + B ”1、金属 + 酸盐 + H 2↑Zn + H 2SO 4 == ZnSO 4 +H 2↑(实验室制H 2 ) Zn+2HCl ==ZnCl 2 + H 2↑(实验室制H 2 )Fe +2HCl == FeCl 2 + H 2↑ Mg + H 2SO 4 == MgSO 4 +H 2↑ 2、金属 + 盐(溶液..)新盐 + 新金属Fe + CuSO 4 == Fe SO 4 + Cu (湿法制铜) Cu +2AgNO 3 == Cu(NO 3)2 +2Ag3、(H 2、C )+ 金属氧化物 金属 +(H 2O 、CO 2 )H 2 + CuO Cu +H 2O C + 2CuO 2CuMnO 2△ MnO 2+CO2↑(四)复分解反应:两种化合物互相交换成分生成另两种化合物的反应(两交换,价不变):AB + CD AD + CBNaOH + HCl == NaCl + H2O(酸和碱作用生成盐和水的反应叫中和反应通电....)1、Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑(泡沫灭火器原理)2、CaCO3 + 2HCl = CaCl2 + H2O + CO2↑(实验室制CO2,还可检验生石灰是否变质)3、Al(OH)3 + 3HCl = AlCl3 + 3H2O (用于治疗胃酸过多)4、Fe2O3 + 6HCl = 2FeCl3 + 3H2O Fe2O3 + H2SO4 = Fe2(SO4)3 + 3H2O(除铁锈)5、AgNO3 + HCl = AgC l↓+ HNO3 (检验盐酸或可溶性的盐酸盐)6、BaCl2 + H2SO4 = BaSO4↓+ 2HCl (检验硫酸或可溶性的硫酸盐)7、NH4Cl + NaOH = NaCl + H2O + NH3↑(NH4+的检验)8、Na2CO3 + Ca(OH)2 = 2NaOH + CaCO3 ↓(工业制烧碱)9、Ca(OH)2 + CO2 = CaCO3↓+ H2O (检验CO2气体的存在)10、2NaOH + CO2 = Na2CO3 + H2O (烧碱在空气中变质)(五)不属于四种基本反应类型的反应CO +CuO Cu + CO2(黑色粉末变红,石灰水变浑浊)CH4 +2O 2CO2 + 2H2O(淡蓝色火焰)C2H5OH +3O22CO2 +3 H2O九、常见离子的检验:1、SO42-离子的检验:先加入Ba(NO3)2,产生白色沉淀,再加稀HNO3白色沉淀不消失。
2、Cl-离子的检验:先加入AgNO3,产生白色沉淀,再加稀HNO3白色沉淀不消失。
3、CO32-离子的检验:加入HCl,产生的气体能使澄清的石灰水变浑浊。
十、必记的化学口诀与步骤:1、常见元素和原子团的书写及其化合价口诀。
2、化合物化学式书写口诀。
3、化学方程式书写步骤[三步:写(化学式)、配(平)、注(反应条件与生成物状态)]。
4、根据化学方程式计算步骤(五步)。
5、置换反应的条件(金属活动顺序表)与复分解反应的条件(酸、碱和盐的溶解性口诀)。
化学试题11、某研究性学习小组的同学前往当地的石灰石矿区进行调查,他们取了若干块矿石样品,对样品中的碳酸钙的质量分数进行检测,采用了以下的办法:取用8 g这种石灰石样品,把40 g稀盐酸分四次加入,测量过程所得数据见下表(杂质不溶于水,不与盐酸反应)。
序号第一次第二次第三次第四次加入稀盐10 10 10 10酸质量g剩余固体 5.5 m 1.2 1.2质量g请计算:(1)8 g的石灰石样品中含有杂质多少克?(2)样品中的碳酸钙的质量分数是多少?(3)上表中的m的数值应为多少?(4)要得到280 kg的CaO,需要质量分数为80%的石灰石多少千克?2、某课外兴趣小组对一批铁样品进行分析,甲、乙、丙三位同学分别进行实验,其中只有一位同学所取用的稀硫酸与铁样品恰好完全反应(样品中所含杂质不溶于水,也不与稀硫酸反应)。
实验数据如下表:甲乙丙烧杯+稀硫酸250g 200g 200g加入的铁样品9g 9g 14g充分反应后,烧杯258.7g 208.7g 213.7g+剩余物请你认真分析数据,回答下列问题:(烧杯的质量为75.4g;计算结果精确到0.1%)(1)同学所取用的稀硫酸与铁样品恰好完全反应。
(2)计算样品中铁的质量分数。
3、为了测定某石灰石中碳酸钙的质量分数(假设杂质不参加反应,且不溶于水),某兴趣小组设计如下实验方案:①称取10g石灰石样品,②高温煅烧至质量不再改变,③把剩余固体放在空气中冷却至室温,④称得剩余固体的质量为6.04g。
①在方案中产生二氧化碳的质量为 g,其物质的量为 mol。
②根据方案计算石灰石中碳酸钙的质量分数(根据化学方程式列式计算)。
③指出该实验方案中一处明显的不足并说明原因4、钢铁的生产和使用是人类文明和社会进步的一个重要的标志。
(1)每年钢铁锈蚀都会造成巨大的损失,铁制品锈蚀的主要原因是。
(2)校课外兴趣小组的同学们去潍坊某钢铁长生铁样品进行实验:将四份不同质量的生铁样品(假定其中只含单质铁和单质碳)分别加到100g 质量分数相同的稀硫酸中,充分反应后,测得的实验数据如下表(已知:在标准状况下,22.4LH2的质量为2g)实验序号 1 2 3 4生铁样品的质量 / g 2.88 5.76 9.24 10.28生成H2的体积(标准状况下)/L 1.12 2.24 3.36 m通过计算回答下列问题:①上述表格中m的值为。
