化学热力学基础2
2第二章 化学热力学基础

aA + bB dD + eE
定义:
nB (t ) nB (0)
nA
B
nB
B
(mol )
nE
即
A
nB
B
nD
D
E
15
反应进度 1mol
即nA A a
nB B b
按化学反应进行1mol反应 14
CH4 (g) 2O2 (g) CO2 (g) 2H 2 O(l)
(c) CH4 (g) 3 O 2 (g) CO(g) 2H 2 O(l)
2 3 (d) CH4 (g) O2 (g) CO(g) 2H 2 O(g) 2
25
(2)一个体系从环境得到了160J的功,其内 能增加了200J,则体系与环境交换的热量 为 。 (a)360J (b)-360J (c)40J (d)-40J
U1
Q W 13
பைடு நூலகம்
U2
ΔU= U2 - U1 = Q +W
注:① Q 、W正负号 ② Q 、W、 ΔU单位一致(J、kJ)
例.某一体系在变化过程中从环境吸收了50 kJ的热, 对环境 做功4 kJ , 则热力学能的变化为? ΔU=Q+W =50- 4=46 kJ
14
§2-2 化学反应的焓变
一.反应进度ξ
kJ
= ΔU + ΔnRT J kJ (×10-3)
23
例:使1molH2O(l)在373K, P 下变成1mol H2O(g)需要 提供40.68kJ的热量,求此过程做功W,ΔH及ΔU
解:
化学热力学基础

W = pΔV
第2章 化学热力学基础
§2.1 热力学第一定律
例:圆筒内装有理想气体,其截面积为 A,圆桶 上有活塞,外压为 p,有一热源使气体膨胀,把活塞 推出ΔL,问系统对外作功多少?
解: -WFΔL
因为 p F ,所以 F = pA A
代入上式 -W = pAL= pV= p(V2-V1) W = -pV (求体积功的公式)
第2章 化学热力学基础
§2.1 热力学第一定律
难点:
1、盖斯定律的运用,标准摩尔生成热的含义以及 化学反应热效应的计算;
2、熵的含义、熵值大小的一般规律、标准摩尔熵 的含义及化学反应熵变的计算,熵判断化学反 应进行方向的判断原则及适用条件;
3、吉布斯自由能的含义、标准摩尔吉布斯自由能 的含义以及化学反应吉布斯自由能变的计算, 吉布斯自由能判断化学反应进行方向的判断原 则及适用条件。
§2.2 热化学
反应热的测量: 弹式量热计:
弹式量热计适用于气体以及有机化合物的燃烧 反应。测得的反应热是恒容反应热QV。
杯式量热计: 适用于测量恒压热效应Qp ,如液相反应的反应
热,溶解热,中和热等。
第2章 化学热力学基础
§2.2 热化学
3、反应进度概念
(1) 定义
n B n B 0 ν B ξ
第2章 化学热力学基础
§2.2 热化学
正、逆反应的 H值大小相等,符号相反
H2(g)
+
1 2
O2(g) → H2O(l)
ΔrHm285.m 8 k o 1 Jl
H2O(l)
→
H2(g)
+
1 2
第二章 化学热力学基础

第二章化学热力学基础2.1 热力学概论2.1.11) 高炉炼铁反应Fe2O3 + 3CO = 2Fe + 3CO2 ?2) 汽车尾气污染问题2NO + 2CO = N2 + 2CO2 ?3) 将石墨转化为金刚石C (Graphite) = C (Diamond) ?实现这些化学反应的可能性及反应程度等问题需要化学热力学来解决热力学(themodynamics) :不需要知道物质的内部结构,只从能量观点出发,专门研究能量相互转变过程中所遵循规律的科学。
热力学将宏观物体作为整体看待,直接以宏观实验与观察为基础,从物体表现出的整体宏观现象上总结抽象出共同的规律作为自然法则,然后进行逻辑推演,进而解释和解决各种有关问题。
其理论支柱是四条热力学基本定律,它们是在漫长的岁月中,总结大量正反两方面的实践经验抽象出的宏观法则。
✓热力学研究各种能量之间的转换关系,如电能和机械能、电能和热能等。
✓热力学研究在各种变化过程中发生的各种能量效应。
✓热力学能判断一定条件下的变化能否发生以及进行到什么程度。
所以,尽管热力学是物理学的分支学科,但其应用范围极其广泛,它可以应用于工程学、化学、生物学等学科。
本章从热力学应用于化学的角度,对热力学的基本原理给予初步简介,仅帮助同学们初步地了解如何从宏观角度解释一些化学问题的方法。
化学热力学利用热力学的基本方法、原理来研究化学变化和与化学变化有关的物理变化中能量的转化或传递的学科。
研究化学反应时,常遇到这样一些问题:当几种物质放在一起时,①它们能发生反应吗?②如果发生反应,能量如何变化?③反应是否可进行到底?④反应速率多大?⑤反应是如何进行的(反应机理)?化学热力学的研究范围:①②③属于化学热力学问题,也就是化学反应的方向、限度以及伴随的能量变化。
而④⑤属于化学动力学问题。
化学热力学的作用:☞预测反应发生的可能性及进行的方向(判据)(热力学第二定律)☞判断反应进行的限度(平衡问题)☞确定化学反应的热效应(热力学第一定律)化学热力学的局限性通过化学热力学的研究,能够比较满意地解决①②③这三个问题,但并不能够解决④⑤这两个问题,体现出化学热力学的局限性,因为:✓热力学的研究对象是宏观物体,对于个别原子、分子等微观粒子的性质是无能为力的。
第二章 化学热力学基础2

∆rHmθ = ∑∆fHmθ,(生成物 - ∑∆fHmθ,(反应物 生成物) 反应物) 生成物 反应物 = 4 × ∑∆fHmθ,NaOH(s) 2 × ∑∆fHmθ, 2Na2O2(s) - 2 × ∑∆fHmθ,H2O(l)
= 4 × (-426.73) - 2 × (-513.2) -2 × (-285.83) = - 108.9 kJ·mol-1 12
∆rHϑm = −726.64 − (−563.58) = −163.06 kJ⋅mol-1 − ⋅
10
例 3-7 试利用标准生成热数据计算乙炔的燃烧 热 解:乙炔燃烧反应: 乙炔燃烧反应: C2H2(g) +5/2O2(g) = 2CO2(g) + H2O(l)
∆fHϑm / kJ⋅mol-1 226.8
8
例3-6:已知甲醇和甲醛的燃烧热分别为−726.64 kJ⋅mol-1及−563.58kJ⋅mol-1,求反应 CH3OH(l) + 1/2O2(g) → HCHO(g) + H2O(l) 的反应热。
9
解 CH3OH(l) +1/2O2(g) → HCHO(g) + H2O(l) ??? HCHO(g) + O2 (g) = CO2 (g) + H2O(l) ∆rHϑ1 = −563.58kJ⋅mol-1 ⋅ CH3OH(l) +3/2O2(g) =CO2 (g) +2H2O (l) ∆rHϑ2 = −726.64 kJ⋅mol-1 ⋅ - 得: CH3OH(l) + 1/2O2(g) = HCHO(g) + H2O (l)
(3)
∆rHmθ 3 = ∆rHmθ
- ∆rH θ 1 m 2
第2章 化学热力学基础

n A
n A
A
1.5 0.5 1.0 1.0mol 3 / 2 1/ 2 1
A
3H2 + N2 = 2NH3 t=0 3 1 0 t 时刻 0 0 2
n A
A
3 1 2 1.0mol 3 1 2
3/2 H2 + 1/2N2 = t=0 3 1 t时刻 1.5 0.5 消耗(生成) 1.5 0.5
C
量热计常数,整个量热计升高 1 K 所需要的热量。
(2) 弹式量热计 弹式量热计适用于气体以及有机化合物的燃烧反应。测得的 反应热是恒容反应热Qv 。
P40 图 2-1 弹式量热计
【例】 1mol丙二酸[CH2(COOH)2]晶体 (QV) 中完全燃烧,298K时放出 在弹式量热计 的热量为 866.5kJ ,求 1mol 丙二酸在 298K 时的 等压反应热。 解:
U,p,V 都是状态函数,可见 U + pV 也是一个 状态函数。 令 H ≡ U + pV , H 称焓,是一个新的状态函数。 即 Qp = H 该式说明,在恒压反应中,体系的热效应 Q p 全部 用来改变体系的焓。对化学反应而言热效应等于焓变。
2、定容反应热 QV 与定压反应热 Q p 的关系 Qp = H Qv=U
学习重点
化学热力学的四个状态函数—热力学能、焓、熵、自 由能
学习难点
焓、 自由能
化学热力学的研究对象
热力学是自然科学中的一个重要分支 学科。它研究物质的热现象、热运动的规 律以及热运动和其它运动形式的相互转化 关系; 研究在一定条件下各个物理过程和化 学过程进行的方向和所能达到的限度。
热力学的方法 热力学的方法是一种演绎的方法,它 结合经验所得到的几个基本定律,讨论对 象的宏观性质。 (1)不考虑物质的内部结构。 (2)不涉及化学反应的速率和机理。 (3)只研究大量分子(或原子)表现 的集体行为。
第2章 化学热力学基础

第2章 化学热力学基础2-1. 估计下列过程ΔS 、ΔH 、ΔG 的符号。
(1)硫酸溶于水 (2)室温下冰融化 (3)NaNO 3(s)溶于水解:(1)ΔS >0,ΔH <0,ΔG <0;(2)ΔS >0,ΔH >0,ΔG <0;(3)ΔS >0,ΔH >0,ΔG <0。
2-2. 确定下列各组物质熵值的大小顺序。
(1)H 2O(l)、H 2O(g)、H 2O(s); (3)CH 4(g)、C 2H 6 (g);(2)H 2(g,310K )、H 2(g ,298K) (4)Fe(s)、Fe 2O 3(s)。
解:(1)S (H 2O,g)>S (H 2O,l)>S (H 2O,s) (2)S (H 2,g,80)>℃S (H 2,g,25)℃(3)S (C 2H 6,g) > S (CH 4,g) (4)S (Fe 2O 3,s)>S (Fe,s)2-3. 计算体系热力学能的变化 (1)体系从环境吸热1000J ,并对环境作功540J ;(2)体系向环境放热535J ,环境对体系作功250J 。
解: (1)ΔU =Q +W =(+1000)+(-540)=460(J)(2)ΔU =Q +W =(-250)+(+535)=285(J)2-4. 求下列反应的Δr H m θ。
[Δf H m θ ( Fe 2O 3,s)=-822.2kJ·mol -1,Δf H m θ ( Al 2O 3,s)=-1670kJ·mol -1,其余Δf H m θ值查附录一 ](1)4NH 3(g) + 5O 2(g) = 4NO(g)+ 6H 2O(g) (2)C 2H 4(g)+ H 2O(g)= C 2H 5OH(l)(3)Fe 2O 3(s)+ 2Al(s) = 2Fe(s)+ Al 2O 3(s)解: (1) Δr H m θ =4Δf H m θ(NO,g)+6Δf H m θ(H 2O,g)-[4Δf H m θ( NH 3,g)+5Δf H m θ(O 2,g)]=4×90.25+6×(-241.8)-[4×(-46.11)+5×0]=-905.36(kJ·mol -1)(2) Δr H m θ=Δf H m θ(C 2H 5OH,l)-[Δf H m θ(C 2H 4,g)+Δf H m θ(H 2O,g)]=-277.7-[(52.26+(-241.8)]=-88.16(kJ·mol -1)(3) Δr H m θ=2Δf H m θ(Fe,s)+ Δf H m θ(Al 2O 3,s)- [Δf H m θ(Fe 2O 3,s)+ 2Δf H m θ(Al,s)]=2×0+(-1670)-[(-822.2)+2×0] = -847.8 kJ·mol -12-5. 已知Δc H m θ(C 3H 8,g)=-2220.9kJ·mol -1,Δf H m θ(H 2O,l)=-285.8kJ·mol -1,Δf H m θ(CO 2,g)=-393.5kJ·mol -1,求C 3H 8(g)的Δf H m θ。
第一章 化学热力学基础-2

)T (B,H def)T (H m B m r 相态,定义y y n ?D A C)(m,1r T H D )(m,2r T H D )(m r T H D )B,(def m B m r T H H 相态,n ?D (3)化学反应的标准摩尔焓[变] Hm θ (B, 相态,T )——参与反应的物质B(反应物及生成物)单独存在,各自温度为T 、 压力为p θ下的摩尔焓。
对反应a A +b B →y Y +z Z 则有D r H m θ(T )=yH m θ(Y,相态,T )+zH m θ(Z,相态,T )-aH m θ(A,相态,T )-bH m θ(B,相态,T ) 式(1-46) (1-47)没有实际计算意义,仅是反应的标准摩尔焓[变]的定义式。
⒉等容反应热和等压反应热的关系测定反应热多为在等容条件测定。
即Qv 。
而化学反应又常在等压条件下进行的。
所以找出等压热容和等容热容之间的关系,可进行换算。
因状态函数始,终态均和过程无关:△U=△Uv+△U’=0 △U’ pg:dT=0; △U’=0 Rg:dT=0, 变P V ,△U ’≈0故 △U=△Uv=Qv △H=△U+P △V 因△H=Qp △U=Qv Qp=Qv+P △V (△V <0 Qp <Qv ;△V >0 Qp >Qv ;△V =0 Qp =Qv ) 对于液、固反应:△V ≈0,∴Qp ≈Qv △H ≈△U 对反应物,产物均为理气△V=RT △n/P Qp= Qv+P ×RT △n/P=Qv+RT △ng △ng 产物与反应物摩尔数之差 △n=n 产g -n 反g(4)热化学方程式写法: 注明具体反应条件(如T ,p ,聚集态,焓变)的化学反应方程 式——叫热化学方程式。
如 2C 6H 5COOH (s,p θ ,298.15K)+15O2(g ,p θ , 298.15K)→ 6H 2O (l,p θ , 298.15K )+14CO 2(g,p θ ,298.15K )D r H m θ(298.15K)=-6445.0kJ·mol-1从上式中可以看出,热化学方程式书写时要求:⒈表明温度和压力:△H298,T=298,一般恒压为1atm,对△H影响不大,可不标出⒉注明△H的符号,△H>0表吸热;△H<0,放热例:N2g+3H2g-2NH3g △H298=-92.38KJ ⒊注明反应物及产物的物态,溶液注明浓度,固体注明晶型例:C(石墨1atm)+O2(g,1atm)=CO2(g,1atm) △H=-39305KJ⒋注明各物质的系数,因△H数值与方程式的写法有关,N2g+3H2g-2NH3g ……△H1 1/2N2g+3/2H2g-NH3g ……△H2 △H2=1/2△H1 注意: △H298是指按方程式进行了完全反应即1molN2+3molH2生成2NH3的反应。
第二章 基础化学热力学要点

热力学 解决两个问题
(1)能量如何转化
(2)方向、限度
动力学:反应如何进行及其速率大小
• 第一节 常用名词 • 体系:被研究的对象
• • •
敞开体系 三种体系 封闭体系 • 孤立体系 • 敞开体系:体系与环境之间既有能量交换,又有物质 交换。 • 封闭体系:体系与环境之间只有能量交换,没有物质 交换。
• 关键点:状态函数的改变量“Δ ” 决定于过程的始终态,与途径无 关。
第二节 热力学第一定律
一、热和功 热力学中能量的传递方式:热和功
1、热( Q):是系统与环境间存在温度差而引起的 能量传递。单位:J
正负规定:体系从环境吸热为正,Q 0;
体系向环境放热为负,Q 0 。
2、功(W):在热力学中,除热以外的其他的 能量传递形式称为功。单位:J 正负规定:体系对环境作功为负,W 0; 体系从环境得功为正,W 0 。 体积功:是体系体积变化反抗外力所作的 功。 W体= -p外 V 非体积功:电功、机械功、表面功等。
o m
1
若反应写成2HI(g)= H2(g) + I2(g),则 o • r H m = _________kJ·mol-1。若反应写成 • 1/2H2(g) + 1/2I2(g)= HI(g) , 则 • H o = ___________kJ·mol-1。
r m
热力学依据:由第一定律知:定压时, H= QP ;而H是状态函数,只与反应的始、 终态有关,而与分几步反应的途径无关。
六、生成焓
• 由元素稳定单质生成1 mol某物质时的热效应。
• f H m • 例如: C(石墨)+ O2(g)= CO2 (g)
第二章 化学热力学基础

19
20
5)标准摩尔生成焓 在标准压力下,由最稳定相态的单质为原料,生成 1摩尔 某物质的反应的焓变,称为该物质的标准摩尔生成焓 H o
f m
298.15 K温度下的许多物质的标准摩尔生成焓数据可查附录。
根据标准摩尔生成焓可以推算相关反应的焓变ΔrHo
例如, CO(g) + H2O(g) → CO2(g) + H2(g)
1
第二章 化学热力学基础
从给定的原料出发,能否生成期望的目标产物? 是否可能把原料全部转变成目标产物? 化学热力学的研究目标:
判断化学反应能否发生。(自发过程进行的方向)
判断化学反应的最大限度。(化学反应的平衡原理)
自发过程的概念
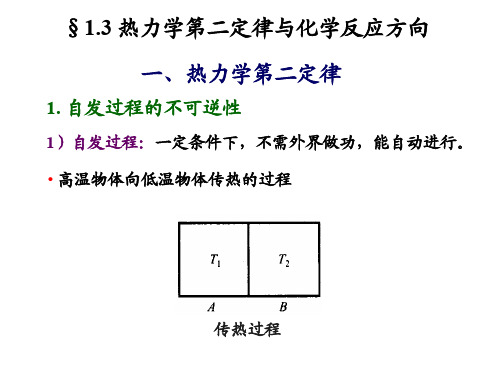
由分子、原子构成的体系,在一定的条件下,听其自然, 不去管它,这个体系会发生一些变化,这样的变化过程 称为自发(变化)过程。
2
传热:高温物体向低温物体传热,直至温度相等 气体做功:高压力向低压力膨胀,直至压力相等 溶液扩散:溶质从浓溶液向稀溶液扩散,直至浓度相等 电流:电子从低电势向高电势流动,直至电势相等 化学反应:锌投入硫酸溶液产生氢气, 直至化学平衡。 自发过程的共同特征: 不去管它就会发生;进行到平衡为止;不会“自动”反向进行。 (化学)热力学 从热和功入手,研究(化学)自发过程进行的方向、限度。
Q r Q ir
所以
Qr T
Q ir T
其中下标r、ir 分别表示可逆(reversible)和不可逆(irreversible)。 所以,热的数值能够反映过程是可逆的(平衡)或不可逆的(自发)。
2. 熵
1) 熵的定义
Entropy,用 S 表示 (可以证明熵是状态函数)
23
化学热力学基础

△U = QV-W = QV
QV :等容热
第二章 化学热力学
⑵ 封闭体系只做膨胀功的等温等压过程,即体系的始 态、终态的压力和环境的压力等于一个恒值(P始=P终= P外)的过程。
△U= QP +P外△V= QP +P外 (V2-V1) 即 QP= △U+P外△V 可见,恒压反应热来自于两方面,一方面是体系内能 的变化,另一方面是体系所作的膨胀功。
例
反应
rHm/kJ·mol-1
2Cu2O(s)+O2(g) → 4CuO(s) CuO(s)+Cu(s) → Cu2O(s)
计算fHm ⊖(CuO,s)。
-292 -11.3
解: (2)式×2=3式 ,2CuO(s)+2Cu(s)→2Cu2O(s) (rHm ⊖)3=2(rHm ⊖)2= -22.6 kJ·mol-1
环境对体系作功为正 (W>0),体系对环境作功为负 (W<0)。
功不是状态函数,其大小与路径有关,所以不能说一个 物质包含多少功。
注意:功和热都不是状态函数,是过程量。
第二章 化学热力学
1.4 热力学能(内能)(thermodynamic energy)
热力学能(U): 体系内所有微观粒子的全部能量之和,旧称 内能。换句话讲,内能即体系作功的总能力(total Capacity)。内能是以动能和势能的形式储存在体系中的能
第一节 热力学第一定律及其应用 第二节 化学反应的方向 第三节 化学反应的限度——化学平衡
第二章 化学热力学
本章学习要求
1 正确理解和掌握系统、环境、状态函数、功、热、 热力学能、焓、焓变、标准摩尔生成焓、自发过程、 熵、熵变、吉布斯自由能、自由能变、标准摩尔生成 自由能等概念。 2 能熟练掌握和运用热力学第一定律解决热力学有关 计算。 3 正确书写热化学方程式,熟练地运用盖斯定律计算 有关化学反应的热效应。 4 能熟练地计算有关过程的Gibbs自由能变,并能运用 热力学有关数据判断过程自发性的方向。
基础化学第二章化学热力学基础
(3)等容过程:系统的体积不发生 变化的过程称为等容过程。 (4)循环过程:如果系统由某一状 态出发,经过一系列变化又回到原 来的状态,这种过程就称为循环过 程。
(四)热和功
▪ 能量,难以下一确切的定义。 ▪ 热力学中,物体间能量交换只有热和功两
种形式。 ▪ 1、热(Q) ➢由于温度不同而在物体间交换的能量。 ➢热的交换是由于大量质点无序运动引起的。
(1) N 2(g )+ 3 H 2(g )= 2 N H 3(g )
(2) 1 /2 N 2 (g )+ 3 /2 H 2 (g )= N H 3 (g )
解:由反应方程式可知,生成4molNH3,消耗2mol N2和6mol H2。N2,H2和NH3的物质的量的变化分 为:
(N2)=n(N2) -n0(N2)=(10-2)mol-10mol=-2mol (H2)=n(H2) -n0(H2)=(20-6)mol-20mol=-6mol (NH3)=n(NH3) -n0(NH3)=4mol-0mol=4mol
是系统内部能量的总和,包括系统内分子 运动的动能、分子间相互作用的势能和分 子内各种粒子(原子、原子核、电子等) 及其相互作用的能量等。
➢物体总能量 E = T + V + U;
➢内能U = 分子动能 + 分子间的势能 + 电子、核的能量。
热力学能是状态函数,其量值取决 于系统的状态。在确定状态下,热力学 能的量值一定,它的改变量由系统的始 态和终态决定,与变化所经历的途径无 关。
4815kJmol18.314103kJmolB 1K1 298.15K(117)
4825kJmol1
三、热化学方程式
➢ 热化学方程式:表示化学反应与反应的 摩尔焓变或摩尔热力学能变关系的化学方 程式。
第二章 化学热力学基础

普通化学第二章化学热力学基础⏹§1.1 热力学基本概念⏹§1.2 热力学第一定律⏹§1.3 焓热力学⏹§1.4 自发过程和熵⏹§1.5 吉布斯自由能与化学反应的方向⏹总结化学热力学研究与解决的主要问题?热力学-------研究各种形式的能量相互转变过程中所遵循规律的科学。
热力学的基础:热力学第一定律和热力学第二定律化学热力学-------将热力学的原理应用于化学变化过程,就称为化学热力学。
化学热力学研究与解决的主要问题:一是在指定的条件下,某一化学反应进行时,与外界交换多少能量?即计算化学反应热。
二是在指定的条件下,某一化学反应能否自发进行,即判断化学反应进行的方向。
三若可能自发进行,反应进行的温度如何?热力学方法的特点:大量质点组成的宏观体系1、热、功、状态函数△U、△H、△G和△S2、热力学第一、二、三定律3、盖斯定律4、自发过程的判定5、吉布斯—亥姆霍兹公式1、功、热、内能、焓、自由能、熵的计算2、自发过程判定AgNO 3与NaCl 的水溶液:如果只研究在水溶液中所进行的反应,则含有这两种物质的水溶液就是体系。
溶液以外的烧杯、溶液上方的空气都是环境。
如果还要研究反应时的能量变化,则水溶液和烧杯为体系,空气为环境。
例如:NaCl+AgNO 3溶液-体系分类敞开体系:体系与环境之间既有能量交换,又有物质交换。
封闭体系:体系与环境之间只有能量交换,没有物质交换。
孤立体系:体系与环境之间既没有能量交换,也没有物质交换。
敞开体系封闭体系绝热箱孤立体系NaOH+H2ONaOH+H2ONaOH+H2O热物质热二、体系的性质1、体系的性质:确定体系状态的各种宏观物理量。
如温度、压力、体积、质量、密度、浓度等2、体系的性质分为广度性质和强度性质两类:广度性质:在数值上与体系中物质的量成正比,即具有加和性。
如体积、质量、内能、焓、熵等。
强度性质:在数值上与体系中物质的量无关,即不具有加和性。
第一章 化学热力学基础-2

水的不同聚集状态的混乱程度
3. 熵增加过程:固体溶解、物质(如水)的 熵增加过程:固体溶解、物质(如水) 汽化、墨水的扩散、气体的扩散等。 汽化、墨水的扩散、气体的扩散等。 反应的熵变( 4. 反应的熵变(△S): 化学反应存在着熵变。反应熵变( △S表示) 化学反应存在着熵变。反应熵变( 表示) 熵变 对于确定的化学反应, 对于确定的化学反应,在一定条件下具有确定 熵变。 的熵变。 S(反应产物) 反应物) △S = S(反应产物)- S(反应物) 5. 熵增加的反应: (△S > 0) 熵增加的反应: ) 产生气体的反应 气体的物质的量增加的反应等
根据下表的数据回答问题: 1.熵增反应一定能自发进行吗? 2.能自发进行的反应一定是熵增加反应吗? 3.熵变对反应方向有什么影响?
事实证明,熵增加有利于反应的自发进行。 事实证明 熵增加有利于反应的自发进行。许 熵增加有利于反应的自发进行 熵增加的反应在常温 常压下可以自发进行, 的反应在常温、 多熵增加的反应在常温、常压下可以自发进行 如: 2H2O2(aq)=2H2O(l)+O2(g) △S=57.16J.mol-1.K-1 有些熵增加的反应在常温、常压下不能自发 有些熵增加的反应在常温、 进行,但在较高温度下可以自发进行, 进行,但在较高温度下可以自发进行,如: CaCO3(s)=CaO(s)+CO2(g) △S=169.6J.mol-1.K-1 C(s,石墨 石墨)+H2O(g)=CO(g)+H2(g) 石墨 △S=133.8J.mol-1.K-1
实验事实 N2O5分解: 2N2O5(g)=4NO2(g)+O2(g) 分解: = △H=+56.7kJ/mol 碳酸铵的分解: 碳酸铵的分解: (NH4 )2CO3(s)=NH4HCO3(s)+NH3(g) = △H=+74.9 kJ/mol 这些反应也能自发进行
第一章 化学热力学基础(2)
• △G的物理意义:等温等压下系统做非体积功的能力。
在恒温恒压下 W′≥(△G)T,P
> 不可逆 = 可逆
经过一个等温等压不可逆过程,一个封闭系统的吉布斯函数的增加 必小于环境对系统所做的非体积功。
2. 吉布斯函数的判据
0;自发过程 ,不可逆过程 G T ,P ,W ' 0;可逆过程或平衡态 0;不可能发生
Δr S m T2 Δr S m T1 ΔC
T2 T1
θ p ,m
dT T
近似处理:ΔrSmθ(TK)≈ΔrSmθ(298.15K)
三、化学反应自发方向的判据
1. 吉布斯函数(J. W. Gibbs)
定义:G = U + PV-TS = H-TS
• G是状态函数;容量性质;单位J ;绝对值无法测知 • 摩尔吉布斯函数:Gm= G/n;单位J· mol-1
= KΘ
r G RT ln K
m
Δ r Gm RT ln K θ RT ln Q
• 平衡常数意义: K 值越大,表示正反应进行得越完全。
• 影响K 的因素:反应的本性;系统的温度。 • 反应商Q与标准平衡常数K 区别: 平衡状态:Q = K,K 是反应达到平衡时的反应商。
ΔrGm = 0,化学平衡是可逆反应的最终状态。
动
υ正 = υ逆 ,并非反应停止进行,只是正逆反应的影响 相互抵消,是一种 动态平衡 。 化学平衡是有条件的、相对的和暂时的。
变
2. 化学反应等温式和标准平衡常数
等温等压下,对任一气相反应: aA(g) + bB(g) = gG(g) + hH(g) 反应商Q
r
级大学化学化学热力学基础II

通式:
0=∑νBB
B——任一反应物质组分
ν B——反应物和产物在方程式中对应的计
量系数,产物取正,反应物取负
反应进度ξ表示化学反应进行的程度。
aA + hH = eE + dD
t=0 nA0 t=t nA
nH0 nH
nE0
nD0
nE
nD
定义:
ξ
=
n
0 A
−
nA
=
nH0
− nH
=
nE − nE0
=
nD − nD0
判断正误:下列两个反应的热效应数值上 应相等:
H 2 ( g) + Br2 ( g) = 2HBr( g) H 2 ( g) + Br2 (l ) = 2HBr( g)
错误
二、 反应进度
设恒温恒压下任一化学反应 aA + hH = eE + dD
可写作: 0 = -aA - hH + eE + dD
各物质都处于标准状态下的摩尔反应 热称为标准摩尔反应焓。用ΔrHmθ表示
标准摩尔反应焓提供了在相同基准 下,不同反应热效应大小比较的可能性。
3. 热化学方程式
定义:表示化学反应与反应热效应关系的方程 式称为热化学方程式。
例: C(石墨) + O2(g) = CO2(g) ΔrHmθ = -393.5 kJ·mol-1
判断正误:
C(石墨)+O2(g) = CO2(g )
√ ΔrHmθ=-393.5kJ·mol-1,这个热效应既是
ΔfHmθ(CO2,g) ,又是C(石墨)的ΔcHmθ 。
× CaO(s) +CO2(g)= CaCO3(s ) 的焓变ΔrHmθ ,
2化学热力学基础

2. 状态与状态函数
材料科学与化学工程学院
状态
系统(宏观体系)物理性质和化学性质(各种性质)的 总和(综合表现)。 状态 = f ( 温度,压力,体积,密度,粘度,折光 度 ...)
状态函数
H2
P = 101.325kPa T = 300K V = 1dm3
用以确定体系状态的物理量。 P, T, V……
过
过程
系统状态发生任何变化
程
与
可
逆
过
程
热力学可逆过程
I状态——II状态,可逆地由II状态——I状态, 对环境产生的影响消失的理想化过程
8/9/2020
Inorganic & Analytical Chemistry 上一页 下一页
材料科学与化学工程学院
5. 热和功
Q
热( Q )
--- 因温度不同而
T1
传递的能量
功( W ) --- 除热以外其它形式传递的能量
T2 T1>T2
功可分为 体积功 Wv(膨胀功 volume work)
和非体积功 W ’(非膨胀功或有用功)
定压下,体积功 Wv = -pDV
固体和液体的体积变化可以忽略不计
8/9/2020
Inorganic & Analytical Chemistry 上一页 下一页
材料科学与化学工程学院
热和功是过程量都不是状态函 数,其数值与变化途径有关 ,按照 热力学的习惯规定,热和功的符号:
“ +”
“ –”
Q 体系吸热
体系放热
W 环境对体系作功 体系对环境作功
8/9/2020
Inorganic & Analytical Chemistry 上一页 下一页
第二章 化学热力学基础.

2.2.3 标准摩尔生成焓
定义:在标准状态下和指定温度下, 由参考状态的单质(最稳定单质)生成1mol 的纯物质时的反应热,称为该物质的标准生成
热或标准摩尔生成焓,
符号 △fHm ,f代表生成(formation)
单位:kJ.mol-1.
热力学规定:参考单质的标准生成热为零。
参考状态的单质(指定单质): 一般是指 298 K 单质较稳定的形态 任意温度下,任何指定单质的标准摩尔生成焓为 0, 如:
2Fe(s)+
3 2
O2(g)=Fe2O3(s)
f Hm (Fe2O3,s,298.15K) f Hm (CO2,g,298.15K) f Hm (CH4,g,298.15K) f Hm (H2SO4,l,298.15K) f Hm (HCl,g,298.15K)
Ө Ө Ө Ө
Ө
C(石墨)+ O2(g)=CO2(g) C(石墨)+ 2H2(g)=CH4(g) S(斜方)+ 2O2(g)+H2(g)=H2SO4 (l)
1 1 Cl2(g)+ H2(g)= HCl(g) 2 2
2.2.4 标准摩尔燃烧焓
定义:在标准状态下和指定温度下,
化1 mol 物质完全燃烧时的热效应叫做该物
质的标准摩尔燃烧焓,简称标准燃烧热.
,符号 C H m ,c代表燃烧(combustion)
单位:kJ.mol-1.
注意:有机化合物完全燃烧的产物分别为CO2(g) 和H2O(l)
第二章 化学热力学基础
写出一个化学反应方程式,要考虑几方面 的问题?
1、理论上该反应能否发生 2、若反应能发生,伴随着反应将发生多少能量变化 3、反应进行的程度有多大,指定产物在体系中占多大比例 4、反应速度快慢 5、新物质的结构怎样
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
说明: ① 不注明温度,指 298 K ,非此温度 需注明。 ② 物质的熵值随温度的升高而增大。 但由于变化不大,可用298K时的标 准熵近似计算。 ③ 最稳定单质的fHmƟ= 0, 但SmƟ≠0 (T > 0 K)。 ④ 规定,水溶液中H+(aq) 的SmƟ = 0。 (新教材P286)
26
G2 = G1
G2 > G1
37
热力学第二定律的一种表述形式:
对于恒温恒压下不做非体积功的封 闭体系,其自发过程总是朝着吉布 斯自由能(G)减小的方向进行。 即:
GT , p ,W非 0 0 自 过 发 程
38
注意:
• rG 只决定于始态和终态。如一反 应可看作两个或更多反应的总和, 则总反应的rG等于各分反应的rG 之总和。
Qr S T
熵的名称来源:可逆过程的热温商。
20
例:已知 373 K, 1.01325105 Pa时, 18 g H2O(l) 变成H2O(g), 吸热44.0 kJ, 求该过程的熵变。 解:由于在相变点的温度和外压下, 物质的相变可视为可逆过程,所以 水在373 K, 1.01325 105 Pa时的汽化 过程的熵变为
Qr S T
[(H2T2S2) (H1T1S1)] W非
33
[(H2T2S2) (H1T1S1)] W非
1876年吉布斯提出了一个把H 和S组合在一起的新热力学函 数G: G = H - TS
G: 吉布斯自由能 是状态函数; 无绝对数值; 其值与n成正比; 是广度性质。 单位: J 或kJ。
2
例:理想气体的恒温可逆膨胀过程
对于一定量的理想气体, T恒定,
始态 p1, V1
膨胀次数 N
终态 p2, V2
可逆过程的特殊性:
理想气体Biblioteka ①驱动力无限小, 体系始 终处于平衡状态; ②过程进行的速度无限慢, 所需时间无限长;
3
可逆过程的特殊性:
③体系对环境所做的功Wr具有最大值, 即可逆过程的效率最高; ④体系和环境的状态可以由原路线还 原,且不留下任何痕迹。 • 可逆过程是实际不存在的理想极限 过程, 但也有实际意义。在相变点温 度和外压下的相变,一般可认为是 可逆过程。例如在373K,100kPa时 水的汽化或液化。
23
24
S=0 T=0 (始态)
S
ST T (终态)
某物质从0 K到温度T时的熵变化称 为该物质的规定熵(也叫绝对熵)。 即 S = ST – S0 = ST – 0 = ST 单位物质的量的某物质在标准状态 下的规定熵称为该物质的标准熵, 用SmƟ 表示,单位:J· –1· –1。 mol K
29
n气
30
•虽然熵增有利于反应的自发进行, 但是与反应焓变一样,不能仅用熵 变作为反应自发性的判据。 如:反应 2SO2(g) + O2(g) = 2SO3(g) 在298K、标准态下是自发过程, 但 其 rSmƟ = 188.0 J .mol–1K–1 < 0。 要正确判断化学反应进行的方向, 就必须综合考虑焓变和熵变以及温度 的影响,即寻找出更好的判据。
例如:热由高温物体传递给低温
物体,直至两物体温度相等(达
到 “ 热平衡 ” )。
9
自发过程的基本特征
③ 自发过程合理设计可以用来做功。
例如:水从高处流向低处,可推动 水轮机做机械功发电:势能 → 机 械能 → 电能)。
10
注意: 自发过程不涉及时间和速度问题。
一个自发过程,不一定是迅速的。
例如: H2(g) + O2(g) = 2H2O(l)
34
吉布斯自由能判据: [(H2T2S2) (H1T1S1)] W非
(G2 G1 ) W非 G W非
G = W非, max
物理意义:封闭体系在恒温恒压可逆过程 中所做的非体积功W非最大(=体系吉布 斯自由能G的减少值)。
35
在恒温恒压下有非体积功的化学反应 进行方向的判据:
31
3-3-4 状态函数 吉布斯自由能
1. 吉布斯自由能判据
某反应在恒温恒压下进行, 且有非体积功, 则热力学第一定律的表示式可写成:
rU = Q + W = Q + (W体+W非) Q = rU (W体+W非)
恒压
Q = H W非
= rU (pV) W非 = rU + (pV) W非
1923年胡刚复为普朗克在南京讲学时做翻译所建议使用的。
18
S = k ln
(lnX = logeX, e = 2.7183)
R 8.314 J mol 1 K 1 k 1.3806 10 23 J K 1 23 1 NA 6.022 10 mol k为 尔 曼 (Boltzmann )常 玻 兹 数
7
2. 自发过程的基本特征
①单向性,不能自动逆转。自发过程 都是单向的,不可逆的。自发过程 的逆过程是非自发的,非自发并不 等于不可能。
例如:电解水, 2H2O(l) = H2(g) + O2(g) 在环境对体系做功的条件下, 反应就能够进行。
8
自发过程的基本特征
② 自发过程有一定的限度,自发过 程的最大限度是系统的平衡状态。
14
2. 吸热的自发反应都有一个共同的特 点:始态终态, 体系混乱度增大。 CuSO4· 2O(s) = CuSO4(s) +5H2O(g) 5H
T > 389 K NH4HCO3(s) = NH3(g) + H2O(g)+ CO2(g) 反应前后对比,不但物质的种类增多, 而且生成物分子的活动范围变大(或者活 动范围大的分子增多), 整个反应体系 的混乱程度增大。这是化学反应自发进 行的又一种趋势。
r G i f G (生) i f G (反)
• rG(正) = rG(逆)
• 如反应物不处于标准状态, rG rGƟ。
39
2. 标准生成吉布斯自由能
某温度下由处于标准状态的各种元 素的指定单质生成1mol某纯物质的 吉布斯自由能改变量,叫做这种温 度下该物质的标准摩尔生成吉布斯 自由能,简称生成自由能。
符号:fGmƟ(T)
单位:kJ.mol–1
⑤物质的聚集状态不同其熵值不同, 同种物质:SmƟ(g) > SmƟ(l) > SmƟ(s)。 ⑥同类物质摩尔质量 M 越大,SmƟ 越 大。(因为原子数、电子数越多, 微观状态数目也就越多。) 如:F2(g) < Cl2(g) < Br2(g) < I2(g)
27
4. 化学反应的标准摩尔熵变
(1) 化学反应熵变的计算 对于化学反应: AA + BB = GG + HH
40
注意: 在任何温度下,各元素指定单质的 标准摩尔生成Gibbs自由能为零。
规定,水溶液中氢离子的标准摩尔 生成Gibbs自由能为零: fGmƟ(H+, aq) = 0。
fHmƟ(H+, aq) = 0
SmƟ(H+, aq) = 0
41
3. 化学反应的标准摩尔吉布斯自由 能变
某一温度下,各物质处于标准态时 化学反应的摩尔吉布斯函数的变化。 符号:rGmƟ(T) 单位:kJ.mol–1
Qr 44.0 1000 J 1 S 118 J K T 373 K
21
熵的性质
• 熵是状态函数,熵的变化只与始 态、终态有关,而与途径无关; • 熵具有加和性,是广度性质; • 熵的绝对数值可以测定(与 U、H 不同)。
22
3. 热力学第三定律和标准熵
假设实现了 0 K, 晶体粒子的热运动 停止, 粒子完全固定在一定位置上, 微 观状态数为 1, 则 S = kln = kln1 = 0 (T = 0 K) 热力学第三定律: 在0 K时,任何纯物质完美晶体的熵 值为零。 S(完美晶体, 0 K) = 0 或称: 绝对零度不可能达到原理。
32
热力学证明:恒温恒压下,体系在可逆过 程中所做的功最大, 且吸热最多, 即Qr最大, 故:
Qr H W非
TS H W非
“=”成立的条件 是可逆途径。
TS H W非 (H TS) W非 [(H2H1) (T2S2 T1S1)] W非
4
3-3-2 自发过程
5
例:(1)水往低处流; (2)热向低温物体传递; (3)电流向低电位点流动 ; (4)气体向低压处扩散。 (5)锌置换硫酸铜溶液反 应自动进行。
6
1. 自发过程的定义: 在一定条件下不需任何外力 便可自动进行的过程。
A spontaneous process is one that proceeds on its own without any outside assistance.
第3章 化学热力学基础
3-3 化学反应的方向
3-3-1 可逆过程 3-3-2 自发过程 3-3-3 影响化学反应方向的因素 3-3-4 状态函数 熵 3-3-5 状态函数 吉布斯自由能
1
3-3-1 可逆过程
• 定义:如果某一体系经过某一过程, 由状态1变到状态2,若能通过原来 过程的反方向变化(原路返回)而使 体系和环境同时复原,不留下任何 痕迹,这样的过程就称为“可逆过 程(reversible process)”。
ABC ABC A BC BC A B AC AC B C AB AB C
微观状态数越大,表明 体系的混乱度越大。
17
2. 状态函数 熵 体系的状态一定, 则体系的微观状 态数一定, 故和微观状态数 相关 联的应有一种宏观的状态函数, 可 以表征体系的混乱度, 这个状态函 数是熵 (S)。
