高二化学上学期第13周周练试题
2020-2021学年高二化学上学期周测试题一

2020-2021学年高二化学上学期周测试题一一、选择题1. 在一定条件下,N 2 与H 2 发生如下反应:N 2 + 3H 2 2NH 3 ,影响该反应速率的最主要因素()A.浓度 B.温度 C.N 2 和H 2 的性质 D.催化剂2. 下列说法正确的是()A.能自发进行的反应一定能迅速发生反应B.非自发进行的反应一定不可能发生反应C.能自发进行的反应实质可能没有发生反应D.常温下,2H 2 O 2 H 2 ↑+O 2 ↑,即常温下水的分解反应是自发反应3. 在一定条件下,当单独改变可逆反应:N 2 (g)+3H 2 (g) 2NH 3 (g) ΔH<0的下列条件后,下列叙述中错误的是( )A.加入催化剂,v 正、v 逆都发生变化,且变化的倍数相等B.增大压强,v 正、v 逆都增大,v 正增大的倍数大于v 逆增大的倍数C.降低温度,v 正、v 逆都减小,且v 正减小的倍数小于v 逆减小的倍数D.加入氩气,v 正、v 逆都增大,且v 正增大的倍数大于v 逆增大的倍数4. 对于温度与反应方向的关系,下列判断不正确的是()A.△H <0,△S>0,所有温度下反应自发进行B.△H >0,△S>0,所有温度下反应自发进行C.△H <0,△S<0,低温下反应自发进行D.△H >0,△S<0,所有温度下反应不能自发进行5. 一定温度下,在一定容的密闭容器中充入NO 2 发生如下反应:2NO 2 N 2 O 4 并达到平衡,此时NO 2 的转化率为P%,再次充入NO 2 ,其转化率将()A.增大 B.减小 C.不变 D.无法确定6. 在一烧瓶中,在25℃时存在着平衡:2NO 2 N 2 O 4 ;ΔH<0。
把烧瓶置于100℃的水中,则下列几项性质①颜色;②平均相对分子质量;③质量;④压强;⑤密度。
不会改变的是 ( )A.①和③ B.②和④ C.④和⑤ D.③和⑤7. 在已处于化学平衡状态的体系中,如果下列量发生变化,其中一定表明平衡发生移动的量是 ( )A.反应混合物的浓度 B.反应物的转化率C.正、逆反应速率 D.体系的压强8. 下列平衡体系中,升温或减压都使平衡向右移动的是 ( )A.N 2 (g)+3H 2 (g)2NH 3 (g);ΔH<0B.N 2 (g)+O 2 (g) 2NO(g);ΔH<0C.C(s)+H 2 O(g) CO(g)+H 2 (g);ΔH>0D.2SO 2 (g)+O 2 (g) 2SO 3 (g);ΔH<09. 一定温度时于密封容器中发生反应:m A (g)+n B (g) p C(g),达到平衡后,若将气体体积压缩到原来的一半,当再达平衡时C的溶液是原来的1.9倍,则下列叙述正确的是 ( )A.平衡向正反应方向移动 B.C气体的质量分数增大C.气体A的转化率降低 D.m+n>p10. 在一定温度下将CO和水蒸气各1 mol放在密闭容器中反应:CO+H 2 O CO 2 +H 2 ,达平衡后测得CO 2 为0.6 mol。
2021-2022年高二化学上学期周练试题(2)

2021-2022年高二化学上学期周练试题(2)一.选择题(每小题只有1个选项符合题意)1.下列说法正确的是A.需要加热的化学反应都是吸热反应 B.中和反应都是放热反应C.原电池是将电能转化为化学能的一种装置 D.水力发电是将化学能转化为电能的过程2. 101kPa时,2g辛烷完全燃烧生成二氧化碳气体和液态水,放出96.81kJ热量,则下列表示辛烷燃烧热的热化学方程式正确的是()A.2 C8H18(l)+25O2(g) 16CO2(g)+18H2O(1)△H=—96.81kJ·mol-1B.C8H18(l)+25/2O2(g) 8CO2(g)+9H2O(1)△H=+5 518kJ·mol-1C.2 C8H18(l)+25O2(g) 16CO2(g)+18H2O(1)△H=—11 036kJ·mol-1D.C8H18(l)+25/2O2(g) 8CO2(g)+9H2O(1)△H=—5 518kJ·mol-13.下列叙述正确的是A.物质燃烧不一定是放热反应B.放热反应不需要从外界吸收任何能量就能发生C.在一个确定的化学反应中,反应物总能量总是高于生成物总能量D.化学反应除了生成新的物质外,还伴随着能量的变化4. 下列变化属于吸热反应的是①液态水汽化②将胆矾加热变为白色粉末③浓硫酸稀释④氯酸钾分解制氧气⑤生石灰跟水反应生成熟石灰A、①④⑤B、①②④C、②③D、②④5.近年来,科学家正在探索利用铝粉作燃料的可能性,以期铝能成为一种石油的替代物。
假如铝作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法,你认为错误的选项是()A.铝质轻,便于运输,且安全B.铝燃烧时放出的热量多,且燃烧后的产物对环境的污染容易得到有效控制C.在地球上,铝矿资源丰富D.现代电冶铝的工业技术已经可以将铝转化为一种廉价的新型能源6.下列关于热化学反应的描述中正确的是A.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1B.CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+(2×283.0)kJ·mol-1C.需要加热才能发生的反应一定是吸热反应D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热7.化学反应N2+3H2= 2NH3的能量变化如图所示,该反应的热化学方程式是A.N2(g)+3H2(g) = 2NH3(l);⊿H = 2(a—b—c)kJ·mol-1B.N2(g)+3H2(g) = 2NH3(g) ;⊿H = 2(b—a)kJ·mol-1C.N2(g)+H2(g) = NH3(l) ;⊿H = (b+c—a)kJ·mol-1D.N2(g)+H2(g) =NH3(g) ;⊿H = (a+b)kJ·mol-18.下列反应中生成物总能量高于反应物总能量的是()A.碳酸钙受热分解 B.乙醇燃烧C.铝粉与氧化铁粉末反应 D.氧化钙溶于水9.下列说法中不正确的是A.所有爆炸反应全是剧烈的放热反应;B.所有的放热反应在一定条件下都可能发生爆炸C.任何化学反应的过程都伴随着能量的吸收或者放出,能量的转化可有不同的形式;D.已知石墨比金刚石稳定,则金刚石向石墨转化是放出能量的化学变化。
2021年高二化学上学期周练(13)(实验班)
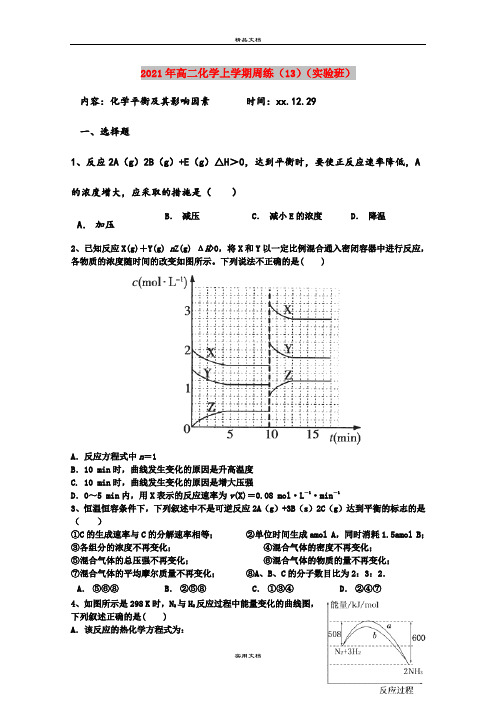
2021年高二化学上学期周练(13)(实验班)内容:化学平衡及其影响因素时间:xx.12.29一、选择题1、反应2A(g)2B(g)+E(g)△H>0,达到平衡时,要使正反应速率降低,A 的浓度增大,应采取的措施是()B.减压C.减小E的浓度D.降温A.加压2、已知反应X(g)+Y(g) n Z(g) ΔH>0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。
下列说法不正确的是( )A.反应方程式中n=1B.10 min时,曲线发生变化的原因是升高温度C. 10 min时,曲线发生变化的原因是增大压强D.0~5 min内,用X表示的反应速率为v(X)=0.08 mol·L-1·min-13、恒温恒容条件下,下列叙述中不是可逆反应2A(g)+3B(s)2C(g)达到平衡的标志的是()①C的生成速率与C的分解速率相等;②单位时间生成amol A,同时消耗1.5amol B;③各组分的浓度不再变化;④混合气体的密度不再变化;⑤混合气体的总压强不再变化;⑥混合气体的物质的量不再变化;⑦混合气体的平均摩尔质量不再变化;⑧A、B、C的分子数目比为2:3:2.A.⑤⑥⑧B.②⑤⑧C.①③④D.②④⑦4、如图所示是298 K时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是( )A.该反应的热化学方程式为:N2+3H22NH3ΔH=-92 kJ/molB.在温度、体积一定的条件下,若通入2 mol N2和6 mol H2反应后放出的热量为Q kJ,则184>QC.加入催化剂,该化学反应的反应热改变D.a曲线是加入催化剂时的能量变化曲线5、在容积不变的密闭容器中,在一定条件下发生反应:2A(?)B (g)+C(s),且达到平衡,当升高温度时,容器内气体的密度变大,则下列判断错误的是A.若正反应为吸热反应,则A为非气态B.若正反应为放热反应,则A为气态C.若在平衡体系中加入少量C,则该平衡不移动D.压强对该平衡的移动无影响6、已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是①生成物的百分含量一定增加②生成物的产量一定增加③反应物的转化率一定增大④反应物浓度一定降低⑤正反应速率一定大于逆反应速率⑥使用了合适催化剂A.①② B.②⑤ C.③⑤D.④⑥7、将相等物质的量的CO和H2O(g)混合,在一定条件下反应:CO(g)+ H2O(g)CO2(g)+ H2(g),达到平衡后CO的转化率为25%,平衡混合气体的密度是相同条件下氢气的倍数是A.46 B.23 C.11.5 D.5.758、一定温度下,向容积恒定的密闭容器中投入2molA和1molB,发生如下可逆反应:2A(g)+B(g) C(g)+D(s)。
高二化学周练试卷—带详细答案

高二化学周练试卷一、单选题(每题2分,共78分)1.根据元素周期表,下列叙述中不正确的是A .透明陶瓷材料硒化锌是由主族元素和副族元素形成的化合物B .半导体材料砷化镓是由主族元素和副族元素形成的化合物C .在非金属元素区域可以寻找制备新型农药材料的元素D .在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素2.美国LawtcceLirermre 国家实验室(LLNL )的V·Lota·C·S·Yoo 和H·Cynn 成功地在高压下将CO 2转化为具有类似SiO 2结构的原子晶体,下列关于CO 2原子晶体的说法正确的是A .CO 2的原子晶体和分子晶体互为同素异形体B .在一定条件下,CO 2原子晶体转化为分子晶体是物理变化C .CO 2的原子晶体和CO 2分子晶体具有相同的物理性质D .在CO 2的原子晶体中,每一个碳原子周围结合四个氧原子,每一个氧原子周围结合两个碳原子3.在通常条件下,下列各组物质的性质排列正确的是A .熔点:22CO KCl SiO >>B .水溶性:22HCl H S SO >>C .沸点:乙烷>戊烷>丁烷D .热稳定性:23HF H O NH >>4.下列说法正确的是( )①氢键是一种化学键 ②由非金属元素组成的化合物可能是离子化合物 ③离子键只是阳离子、阴离子的相互吸引 ④气体单质分子中一定含有共价键 ⑤由不同种元素组成的多原子分子中,一定只存在极性共价键 ⑥离子化合物中可能有共价键 ⑦共价化合物中可能有离子键A .②⑥B .①②③C .②④⑤D .②④⑤⑥5.下列说法正确的是A .分子晶体中一定存在分子间作用力,不一定存在共价键B .分子中含两个氢原子的酸一定是二元酸C .含有金属阳离子的晶体一定是离子晶体D .元素的非金属性越强,其单质的活泼性一定越强6.某元素X的逐级电离能如图所示,下列说法正确的是( )A.X元素可能为+4价B.X可能为非金属C.X为第五周期元素D.X与氯反应时最可能生成的阳离子为X3+7.在NH3和NH4Cl 存在条件下,以活性炭为催化剂,用H2O2氧化CoCl2溶液来制备化工产品[Co(NH3)6]Cl3,下列表述正确的是CoA.中子数为32,质子数为27 的钴原子:3227B.H2O2 的电子式:C.NH3和NH4Cl 化学键类型相同D.[Co(NH3)6]Cl3中Co 的化合价是+38.北大和中科院已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子晶体,具有良好的超导性。
高二化学---2007-2008学年度第一学期13每周一测
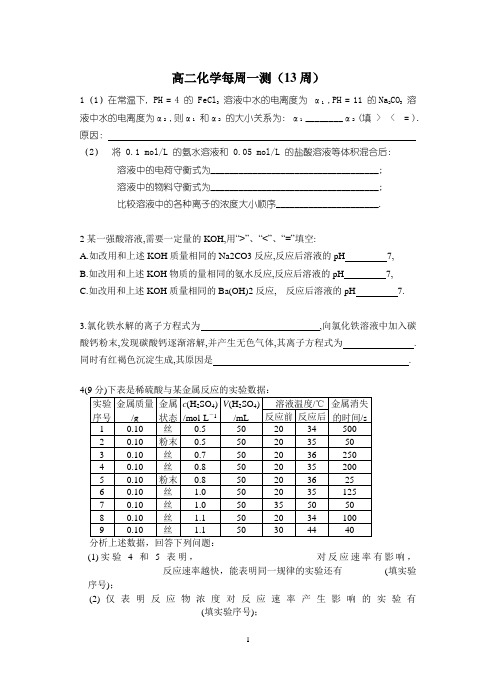
高二化学每周一测(13周)1(1)在常温下, PH = 4 的 FeCl3溶液中水的电离度为α1,PH = 11 的Na2CO3溶液中水的电离度为α2,则α1和α2的大小关系为: α1________α2(填 > < = ).原因:(2)将 0.1 mol/L 的氨水溶液和 0.05 mol/L 的盐酸溶液等体积混合后: 溶液中的电荷守衡式为____________________________________;溶液中的物料守衡式为____________________________________;比较溶液中的各种离子的浓度大小顺序______________________.2某一强酸溶液,需要一定量的KOH,用“>”、“<”、“=”填空:A.如改用和上述KOH质量相同的Na2CO3反应,反应后溶液的pH7,B.如改用和上述KOH物质的量相同的氨水反应,反应后溶液的pH7,C.如改用和上述KOH质量相同的Ba(OH)2反应,反应后溶液的pH7.3.氯化铁水解的离子方程式为,向氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,并产生无色气体,其离子方程式为.同时有红褐色沉淀生成,其原因是.(1)实验4和5表明,________________________ 对反应速率有影响,________________反应速率越快,能表明同一规律的实验还有_________(填实验序号);(2)仅表明反应物浓度对反应速率产生影响的实验有__________________________(填实验序号);(3)本实验中影响反应速率的其他因素还有_____________________,其实验序号是___________。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15 ℃)相近,推测其原因:_____________________________________________________________________。
【配套K12】高二化学上学期周练试题(1-17)(实验班)

电解丰城中学2015-2016学年上学期高二周考试卷6化 学(实验班.零班)一、选择题(每小题3分,共48分)1.2012年12月5日,十八大报告提出“要始终把改革创新精神贯彻到治国理政各个环节”,同时指出“推动能源生产和消费革命,控制能源消费总量,加强节能降耗,支持节能低碳产业和新能源、可再生能源发展,确保国家能源安全”。
下列属于未来新能源的是①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能A .①②③④B .⑤⑥⑦⑧C .①③⑤⑥⑦⑧D .③④⑤⑦⑧ 2、 下列关于“一定”说法正确的句数是 ( ) ①.pH =6的溶液一定是酸性溶液。
②.c(H +)>c (OH -)一定是酸性溶液。
③.强电解质溶液的导电能力一定大于弱电解质溶液的导电能力。
④.25 ℃时,水溶液中水电离出的c(H +)和水电离出的c(OH -)的乘积一定等于10-14。
⑤. 如果Na 2Y 的水溶液显中性,该溶液中一定没有电离平衡 ⑥.0.2mol/L 氢硫酸溶液加水稀释,电离程度增大,c (H +)一定增大 ⑦.温度保持不变,向水中加入钠盐对水的电离一定没有影响⑧. 使用pH 试纸测定溶液pH 时若先润湿,则测得溶液的pH 一定有影响 A .0句B .1句C .2句D .3句3.下列说法正确的是:( )A .如果促进了水的电离,则一定改变了水溶液的酸碱性B .如果抑制了水的电离,则一定向水中加入了酸或者碱C .强电解质的饱和溶液一定是浓溶液D .弱酸弱碱盐的水解一定是吸热的 4.下列反应的离子方程式正确的是 ( ) A .用惰性电极电解MgCl 2溶液:2Cl -+2H 2O====Cl 2↑+H 2↑+2OH -B .硫化钠发生水解:S 2-+H 2O=HS -+OH-C .少量小苏打溶液滴入Ba (OH )2溶液中:HCO -3十Ba 2++OH -= BaCO 3↓+H 2OD .向NH 4HSO 4溶液中加入NaOH 溶液至混合液为中性:H ++OH -= H 2O5、如图所示是298 K 时,N 2与H 2反应过程中能量变化的曲线图,下列叙述正确的是A .该反应的热化学方程式为:N 2+3H 22NH 3 ΔH =-92 kJ/molB .在温度、体积一定的条件下,若通入2 mol N 2和6 mol H 2反应后放出的热量为Q kJ ,则Q ﹤184C .加入催化剂,该化学反应的反应热改变D .a 曲线是加入催化剂时的能量变化曲线6.有8种物质:①乙烷;②乙烯;③乙炔;④苯;⑤甲苯;⑥溴乙烷;⑦聚丙烯;⑧环己烯。
高二化学试题-高二化学上册每周一练检测试题3 最新

高二化学“每周一练”系列试题(19)时间:90分钟 本卷满分:100分一、选择题(本题包括16个小题,每题只有一个选项符合题意,每小题3分,共48分) 1.据人民网报道,有一集团拟将在太空建立巨大的集光装置,把太阳光变成激光用于分解海水制氢,其反应可表示为:激光↑+↑222222O H TiO O H 。
有下列几种说法:① 水分解反应是放热反应;② 氢气是一级能源;③ 使用氢气作燃料有助于控制温室效应;④ 若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件。
其中叙述正确的是 ( )A .①②B .②③C .③④D .①②③④ 2.下列反应中生成物总能量高于反应物总能量的是( )A .碳酸钙受热分解B .乙醇燃烧C .铝粉与氧化铁粉末反应D .氧化钙溶于水3.下列热化学方程式书写正确的是 ( )A .C(s)+O 2(g)==CO 2(g);△H=+393.5kJ/molB .2SO 2+O 2==2SO 3;△H= —196.6kJ/molC .H 2(g )+1/2O 2(g)==H 2O(l);△H=—285.8kJ/molD .2H 2(g )+O 2(g)==2H 2O(l);△H= —571.6KJ4.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。
下列属于未来新能源标准的是( )①天然气 ②煤 ③核能 ④石油⑤太阳能 ⑥生物质能⑦风能⑧氢能A .①②③④B .⑤⑥⑦⑧C .③⑤⑥⑦⑧D .③④⑤⑥⑦⑧5.根据以下3个热化学方程式:2H 2S(g)+3O 2(g)=2SO 2(g)+2H 2O(l) △H =Q 1 kJ/mol 2H 2S(g)+O 2(g)=2S (s)+2H 2O(l) △H =Q 2 kJ/mol 2H 2S(g)+O 2(g)=2S (s)+2H 2O(g) △H =Q 3 kJ/mol判断Q 1、Q 2、Q 3三者关系正确的是( )A . Q 1>Q 2>Q 3B . Q 1>Q 3>Q 2C . Q 3>Q 2>Q 1D . Q 2>Q 1>Q 36.由:①2C(s)+O 2(g)=2CO(g) ΔH =-221 kJ/mol ②H +(aq)+OH -(aq)=H 2O(l) ΔH =-57.3 kJ/mol 可知:( )A .①的反应热为221 kJ/molB .稀硫酸与Ba(OH)2稀溶液反应的中和热为57.3 kJ/molC .碳的燃烧热大于110.5 kJ/molD .稀醋酸与稀NaOH 溶液反应生成1 mol 水,放出57.3 kJ 热量7.在36 g 碳不完全燃烧所得气体中,CO 占1/3体积,CO 2占2/3体积。
2013级高二上化学周考13

2013级高二(上)化学周考13班级姓名成绩第Ⅰ卷选择题(每小题6分,共42分)1.下列有关电解原理的说法不正确的是()A.电解饱和食盐水时,一般用铁作阳极,碳作阴极B.电镀时,通常把待镀的金属制品作阴极,把镀层金属作阳极C.对于冶炼像钠、钙、镁、铝等这样活泼的金属,电解法几乎是唯一可行的工业方法D.电解精炼铜时,用纯铜板作阴极,粗铜板作阳极2.关于电解NaCl水溶液,下列叙述正确的是( )A.电解时在阳极得到氯气,在阴极得到金属钠B.若在阳极附近的溶液中滴入KI淀粉试液,溶液呈蓝色C.若在阴极附近的溶液中滴入酚酞试液,溶液仍无色D.电解一段时间后,将全部电解液转移到烧杯中,加入适量盐酸充分搅拌后溶液可恢复原状况3.用铂电极电解下列溶液时,阴极和阳极上的主要产物分别是H2和O2的是( )A、稀NaOH溶液B、HCl溶液C、酸性CuSO4溶液D、酸性AgNO3溶液4.将两个铂电极插入500mLCuSO4溶液中进行电解,通电一定时间后,某一电极增重0.064g (设电解时该电极无氢气析出,且不考虑水解和溶液体积变化)。
此时溶液中H+浓度约为()A.4×10-3mol/L B.2×10-3 mol/L C.1×10-3 mol/L D.1×10-7 mol/L 5.下列物质中,属于酚类的是 ( )6.某有机化合物的结构简式如下:此有机化合物属于()①烯烃②多官能团有机化合物③芳香烃④烃的衍生物⑤高分子化合物A.①②③④B.②④C.②④⑤D.①③⑤7.下面的原子或原子团不属于官能团的是()A.OH—B.—Br C.—NO2D.第Ⅱ卷非选择题(共58分)8. 现在工业上主要采用离子交换膜法电解饱和食盐水制取H2、Cl2、NaOH。
请回答下列有关问题:(1)在电解过程中,与电源正极相连的电极上所发生的电极反应为________________________。
(2)电解之前食盐水需要精制,目的是除去粗盐中的Ca2+、Mg2+、SO 2等杂质离子,使用的试4剂有:a. Na2CO3溶液、b. Ba(OH)2溶液、c. 稀盐酸。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
江西省横峰中学2016-2017学年高二化学上学期第13周周练试题
时间:45分钟
可能用到的相对原子质量:H-1 O-16 C-12 P-31 S-32 Al-27 Cl-35.5 Ca-40
一、选择题(每小题6分且只有一个正确答案,共10个小题)
1.下列说法正确的是
A.100℃时,某溶液pH=6,则该溶液一定显酸性
B.25℃时,0.1mol/L的NaHSO3溶液pH=4,溶液中c(SO32-)<c(H2SO3)
C.25℃时,pH=3的硫酸溶液与pH=11的氨水等体积混合,所得溶液呈酸性
D.室温下,10mL0.1mol/L CH3COOH溶液与5mL0.1mol/LNaOH溶液混合,所得溶液中有:2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-)
2.用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池。
以下有关该原电池的叙述正确的是( )
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①②B.③④C.②④D.②③
3.已知:K sp(AgCl)=1.8 × 10-10 ,K sp(AgI)=1.5 × 10-16 ,K sp(Ag2CrO4)=2.0 × 10-12,则在相同温度下,下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
A.AgCl>AgI>Ag2CrO4B.AgCl>Ag2CrO4>AgI
C.Ag2CrO4>AgCl>AgI D.Ag2CrO4>AgI>AgCl
4.X、Y、Z、M、N代表五种金属。
有以下化学反应:
①水溶液中:X+Y2+=X2++Y
②Z+2H2O(冷)=Z(OH)2+H2↑
③M、N为电极与N盐溶液组成原电池,发生的电极反应为:M-2e-=M2+
④Y可以溶于稀H2SO4中,M不被稀H2SO4氧化,则这五种金属的活动性由弱到强的顺序是( )
A.M<N<Y<X<Z B.N<M<X<Y<Z
C.N<M<Y<X<Z D.X<Z<N<M<Y
5.有四种混合溶液,分别由等体积0.1mol·L-1的2种溶液混合而成①CH3COONa与HCl;
②CH3COONa与NaOH;③CH3COONa与NaCl;④CH3COONa与NaHCO3。
下列关于该四种混合溶液的各项排序正确的是
A.pH:②>③>④>① B.c(CH3COO-):②>④>③>①
C.c(H+):①>③>②>④ D.c(CH3COOH):①>④>③>②
6.下列有关电解质溶液中粒子浓度关系正确的是
A.pH=1的NaHSO4溶液:c(H+)=c(SO42-)十c(OH-)
B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-)
C.CO2的水溶液:c(H+)>c(HCO3-)=2c(CO32-)
D.含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+ c(C2O42-)+c(H2C2O4)] 7.某合作学习小组的同学利用下列氧化还原反应设计原电池
2KMnO4+10FeSO4+8H2SO4===2MnSO4+5Fe2(SO4)3+K2SO4+8H2O。
盐桥中装有饱和K2SO4溶液,下列叙述中正确的是
A.乙烧杯中发生还原反应
B.甲烧杯中溶液的pH逐渐减小
C.电池工作时,盐桥中的SO42-移向甲烧杯
D.外电路的电流方向是从a到b
8.已知温度T时水的离子积常数为K W,该温度下,将浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
A.a=b B.混合溶液的pH=7
C.混合溶液中,c(H+)= mol/L D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)9.根据右表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是()
A.c(HCO3-)>c(ClO-)>c(OH-)
B.c(ClO-)>c(HCO3-)>c(OH-)
C.c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)
D.c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-)
10.某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。
下列描述正确的是
A.该溶液可能由等物质的量浓度等体积的NaOH溶液和CH3COOH溶液混合而成
B.该溶液可能由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
C.加入适量NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH4+)之和
班级:姓名:得分:
题号12345678910
答案
二、非选择题(本题包括2小题,共40分)
11.按要求填空。
(1)浓度均为0.1 mol/L的①硫酸②醋酸③氢氧化钠④氯化铵四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)。
(2)Fe2(SO4)3溶液显酸性,用离子方程式表示其原因。
(3)AlCl3溶液和NaAlO2溶液混合的化学方程式为。
(4)向饱和FeCl3溶液中加入C aCO3粉末,发现碳酸钙逐渐溶解,同时还产生的现象有。
(5)常温下,将0.2 mol/L CH3COOH和0.1 mol/L NaOH溶液等体积混合,所得溶液的pH<7,该混合溶液中离子浓度由大到小的顺序是。
12.(20分)已知水的电离平衡曲线如图示,试回答下列问题:
(1)图中五点K w间的关系是。
(2)若从A点到D点,可采用的措施是________________。
a.升温b.加入少量的盐酸c.加入少量的NH4Cl
(3)E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为。
(4)B对应温度下,将pH=11的苛性钠溶液V1L与0.05mol/L的稀硫酸V2L混合(设混合后溶液的体积等于原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=___________________。
(5)常温下,将V mL、0.1000mol·L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol·L-1醋酸溶液中充分反应。
请回答下列问题(忽略溶液体积的变化)
如果溶液pH=7,此时V的取值20.00(填“>”“<”或“=”)。
而溶液中c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为。
三、附加题(零班做,20分)
13.NH4Al (SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是
(用必要的方程式和相关文字说明);相同条件下,0.1mol•L﹣1NH4HSO4中c(NH4+)
(填“=”、“>”或“<”)0.1mol•L﹣1 NH4Al(SO4)2中c(NH4+)。
(2)如图1是0.1mol•L﹣1电解质溶液的pH随温度变化的图象.①其中符合0.1mol•L﹣1 NH4Al(SO4)2的pH随温度变化的曲线是(填写字母);
②20℃时,0.1mol•L﹣1 NH4Al(SO4)2中2c(SO42﹣)﹣c(NH4+)﹣3c(Al3+)= mol•L﹣1。
(填精确数值)
(3)室温时,向100mL 0.1mol•L﹣1 NH4HSO4溶液中滴加0.1mol•L﹣1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示.试分析图中a、b、c、d四个点,水的电离程度最大的是;在b点,溶液中各离子浓度由大到小的排列顺序是。
高二年级化学第十三周周练答案
一、选择题(每小题6分且只有一个正确答案,共10个小题)
题号12345678910答案D C C C B A D C A B 二、非选择题(本题包括2小题,共40分)
11.(每空4分)
(1)④>②>③>①
(2)Fe3++3H 2O Fe(OH)3+3H+
(3)AlCl3+ 3NaAlO2+ 6H2O=4Al(OH)3↓+3NaCl
(4)出现红褐色沉淀,同时有无色无味气体产生
(5)c(CH3COO_)>c(Na+)>c(H+)>c(OH_)
12.(1)E=A=D<C<B(4分)
(2)bc(3分)
(3)10:1(3分)
(4)9:11(3分)
(5)①<(3分)
c(Na+)=c(CH3COO-)>c(H+)=c(OH-)(4分)
三、附加题(零班做,20分)
13、(1)Al3++3H 2O Al(OH)3(胶体)+3H+,
Al(OH)3胶体吸附悬浮颗粒使其沉降从而净化水(4分)>(3分)
(2)①A;(3分)②10﹣3-10﹣11(3分)
(3)a;(3分)c(Na+)>c(SO42﹣)>c(NH4+)>c(OH﹣)=c(H+)(4分)。
