植物细胞融合(实验)
植物细胞融合(实验)

准备仪器
准备适当的显微镜、离心 机、摇床、培养皿等实验 仪器。
分离原生质体
表面消毒
将实验材料表面消毒,以避免污染。
酶解
用适当的酶溶液处理实验材料,使细胞壁分解,释放 出原生质体。
分离
将酶解后的组织用离心机或过滤法分离出生质体。鉴定通过形态学观察、分子生 物学技术或免疫学技术等 方法对融合细胞进行鉴定。
培养与繁殖
将筛选和鉴定合格的融合 细胞进行培养和繁殖,以 备后续实验或应用。
03
植物细胞融合实验结果分 析
融合细胞的筛选结果
1 2
筛选方法
采用抗性筛选和荧光激活细胞分选(FACS)等 方法,从融合细胞群体中筛选出具有稳定融合特 征的细胞。
筛选和培育融合细胞
在融合后的细胞中筛选具有双亲遗传 特征的融合细胞,并进行进一步的培 育和筛选。
克隆和繁殖
对筛选出的融合细胞进行克隆和繁殖, 获得具有特定性状的植物个体。
02
植物细胞融合实验步骤
准备实验材料
01
02
03
选择实验材料
选择健康、无病虫害的植 物组织作为实验材料,如 根、茎、叶等。
准备试剂
植物细胞融合(实验)
目录
• 植物细胞融合实验简介 • 植物细胞融合实验步骤 • 植物细胞融合实验结果分析 • 植物细胞融合实验的应用与展望 • 结论
01
植物细胞融合实验简介
植物细胞融合的定义
01
植物细胞融合是指将来自不同植 物的细胞通过物理或化学方法诱 导融合,形成一个具有双亲遗传 特征的融合细胞的过程。
植物细胞融合技术可以用于新品种的培育和遗传改良,未来可以开展 相关研究,为育种工作提供新的工具和方法。
植物细胞融合

结果与分析
活力很低, 活力很低,取 该条件下作为 一个融合亲本
取该条件下作为 一个融合亲本
融合原生质体细胞的分裂
初始培养的1 初始培养的1-2 天, 异核体较易识别。 异核体较易识别。
绿色的霸王原生质体 与红色的草木樨状黄 芪原生质体粘连。 芪原生质体粘连。
UV照射3 UV照射3分钟的霸王原生质体 照射 与经R 6G处理的草木樨状黄 与经R-6G处理的草木樨状黄 芪原生质体融合产物
优点: 优点:可以收集到数量 较大的纯净原生质体, 较大的纯净原生质体, 同时避免收集过程中 原生质体因相互挤压 而破碎。 而破碎。
活力检测
酚藏花红染色法: 酚藏花红染色法: 0.1%酚藏 0.1%酚藏 花红能使有活力的 原生质体染成红色, 原生质体染成红色, 无活力的原生质体 不着色。 不着色。
返回
亲本原生质体的预处理
预 处 理
的 原生质体 的 原生质体
处理
·
处理的
处理
处理
处理的
处理
返回
原生质体诱导融合
融合比例:大约1:1 融合比例:大约1:1 诱导剂:聚乙二醇(polyethyleneglycol诱导剂:聚乙二醇(polyethyleneglycol(polyethyleneglycol PEG)融合诱导液 PEG)融合诱导液 最终状态: 最终状态:形成杂种小愈伤组织
具体步骤
1.亲本原生质体的分离、收集纯化及活力检测 亲本原生质体的分离、 亲本原生质体的分离 2.亲本原生质体的预处理 2.亲本原生质体的预处理 3.原生质体诱导融合 3.原生质体诱导融合 4.杂种融合细胞的鉴别和筛选 4.杂种融合细胞的鉴别和筛选 5.杂种融合细胞的培养和杂种愈伤组织的形成及分化 5.杂种融合细胞的培养和杂种愈伤组织的形成及分化 6.杂种愈伤组织的RAPD分析和线粒体CAPS分析 杂种愈伤组织的RAPD分析和线粒体CAPS 6.杂种愈伤组织的RAPD分析和线粒体CAPS分析 7.杂种愈伤组织对渗透胁迫的抗性分析 7.杂种愈伤组织对渗透胁迫的抗性分析 8.PEG PEG胁迫下杂种愈伤组织的游离脯氨酸含 8.PEG胁迫下杂种愈伤组织的游离脯氨酸含
植物体细胞融合技术

2.1.1植物细胞工程的基本技术--------植物体细胞融合技术学习目标1、简述植物组织培养和植物体细胞杂交技术。
2、尝试进行植物组织培养。
学习重点1、植物组织培养的原理和过程2、植物体细胞杂交的原理一、 植物体细胞杂交技术1.概念:不同种植物的 ,在一定条件下融合成 ,并把杂种细胞培育成新的 的技术。
2.过程 不同的植物体细胞果胶酶纤维素酶−−−→−不同细胞原生质体−−−→−人工诱导原生质体融合 →杂种细胞→杂种植株。
3.植物体细胞杂交步骤:(1)去掉细胞壁,分离出有活力的 ,目前最常用的去细胞壁的方法是酶解法,也就是在温和条件下用 、 去除植物细胞的细胞壁。
(2)不同植物体细胞原生质体融合,必须通过 法和 法来诱导融合。
方法有: 等促使原生质体融合。
化学法是用(PEG)作为诱导剂来诱导融合。
融合后再生出 。
(3)用植物组织培养方法进行培育,可得到杂种植株。
如图在此过程中需要注意的问题有:①植物体细胞杂交过程中,植物体细胞融合所依据的生物学原理是 ;植物组织培养的理论基础是 。
②体细胞融合成功以后,既有AB 型杂种细胞,还能形成AA 型和BB 型两种融合细胞,但只有AB 型细胞是植物体细胞杂交所形成的杂种细胞,因此在杂种细胞形成后还应有一个 过程。
③目前常用的去除细胞壁的方法是 ,保证了原生质体活性。
植物体细胞融合完成的标志是新细胞壁的形成。
④植物体细胞杂交过程仍以植物组织培养为前提,通过植物组织培养完成杂种植株的培育过程。
⑤植物体细胞杂交的最大突破是克服远缘杂交不亲和的障碍,但是目前仍有许多理论和技术问题没有解决,离推广应用仍有一定距离。
【当堂检测】 1.不能..用于人工诱导原生质体融合的方法是 ( ) A .振动 B .电刺激 C .PEG D .重压 2.与传统的有性杂交法相比,植物体细胞杂交的最大优点是 ( ) A .可使两个亲本的优良性状组合到一起 B .可以克服远缘杂交不亲和的障碍 C .可以培育出高产性状明显的新品种 D .可以降低生成成本,提高接济效益3.植物体细胞杂交的过程实质是 ( )A .细胞质融合的过程B .细胞核融合的过程C .细胞膜融合的过程D .细胞原生质体融合的过程 4.原生质体融合后,需诱导产生细胞壁,参与此过程的细胞器是 ( ) A .叶绿体、高尔基体 B .线粒体、高尔基体 C .叶绿体、线粒体 D .线粒体、内质网 5.高度分化的植物细胞、组织和器官进行组织培养可以形成愈伤组织,下列叙述错误..的是 ( )A .该愈伤组织是细胞经过脱分化和分裂形成的B .该愈伤组织的细胞没有全能性C .该愈伤组织是由排列疏松的薄壁细胞D .该愈伤组织可以形成具有生根发芽能力的胚状结构 6.以下不能..说明细胞具有全能性的实验是 ( ) A .胡萝卜韧皮部细胞培育出植株 B .紫色糯性玉米种子培育出植株 C .转入抗虫基因的棉花细胞培育出植株 D .番茄与马铃薯体细胞杂交后培育出植株7.植物组织培养过程中的脱分化是指 ( )A .植物体的分生组织通过细胞分裂产生新细胞B .未成熟的种子经过长期培养,培养出幼苗的过程C .植物的器官、组织或细胞,通过离体培养产生愈伤组织的过程D .取植物的枝芽培育成一株新植物的过程8.在脱分化形成愈伤组织的过程中,下列各项为非.必要条件的是()A.培养基需要消毒灭菌B.给予适宜的温度C.给予充足的光照D.给予适宜的养料和激素9.通过植物体细胞杂交,获得一个杂种植株需要的步骤是()A.分离原生质体→诱导原生质体融合→组织培养→得到杂种植物B.分离原生质体→原生质体直接融合→组织培养→杂种植株C.获取细胞→原生质体融合→组织培养→杂种植株D.获取细胞→原生质体直接融合→组织培养→杂种植株10.胚状体是在植物组织培养的哪一阶段上获得的()A.愈伤组织B.再分化C.形成完整植株D.取离体组织11.利用植物的茎尖、茎段、花药、花粉等,在无菌的条件下,放在玻璃器皿中人工配制的培养基上,使它发育成完整的植株。
植物原生质体的制备及融合

显微镜、低速台式离心机、水浴锅;直式漏斗、离心管;眼科镊等
▪ 试剂
洗涤液 混合酶液 PEG溶液 高钙高pH溶液 20%蔗糖溶液等
原生质体的分离制备
▪ 取新鲜花瓣,以蒸馏水清洗,用吸水纸吸干多余水分。 ▪ 用尖头镊剥取材料的下表皮(带有红色的叶肉细胞),将
下表皮创面朝下浸在酶液中,27℃酶解1hr(振荡)。
▪ 所用小平皿、离心管、漏斗、小镊子等自来水 冲洗并以蒸馏水洗干净后,控干
▪ 托盘及其中的其他物品用自来水冲洗干净
▪ 实验中
植物原生质体的 制备及融合
背景
▪ 原生质体分离 ▪ 细胞融合
▪ 病毒诱导融合(动物细胞) ▪ PEG诱导融合 ▪ 电融合
背景
▪ 融合过程
▪ 细胞的接触 ▪ 细胞质膜的融合 ▪ 细胞质的融合 ▪ 遗传物质的选择(异核体的核融合)
应用
▪ 杂交育种
▪ 单克隆抗体技术
实验器材、试剂等
▪ 材料
剑兰(唐菖蒲)花瓣
原生质体的分离制备
镜检,0 μm
50 μm
原生质体的分离制备
▪ 过滤,以去除大块组织。 ▪ 700rpm离心5分钟,弃上清。 ▪ 加入3mL洗涤液吹打均匀,700rpm离心5分钟,弃上清。 ▪ 加入少量洗涤液(一两百微升即可或由原生质体的量来决
定),悬浮原生质体。 ▪ 镜检,如果碎片较多,可采取蔗糖漂浮方法去除碎片。
▪ 比较分析实验组与对照组之间的差异及 原因
▪ 思考:原生质体制备和融合过程中各种 试剂的渗透压?
提醒
▪ 蔗糖漂浮
▪ 务必留下足够进行融合的细胞悬液 ▪ 使用5ml离心管 ▪ 配平
▪ 35mm dish用于酶解,60mm dish用于融合观察
植物体细胞杂交(完整)

切相关的细胞器是
。高尔基体和线粒体
习题
(2)若番茄细胞内含A条染色体,马铃 薯细胞内含B条染色体,若将番茄和马 铃薯采用有性杂交的育种方法培育(假 设能成功),得到的后代应含(A+B)/条2 染 色体,若采用体细胞杂交技术所得植 株含 A+B条染色体, (3)若番茄是二倍体,马铃薯是四倍体, 则杂种植株为 六倍体。
(4) 在培养杂种苗的过程中,一般在 24~28小时后,大部分原生质体已经 再生出细胞壁。怎样鉴别细胞壁是否 再生?
(5)利用植物体细胞杂交的方法培 育作物新品种过程中,遗传物质的 传递是否遵循孟德尔的遗传规律? 为什么?
知识拓展
自然界中有一种含有叶绿体的原生动物──眼虫,说明植物 的细胞器同样可以在某些动物细胞中存活,请探讨:动物细胞 与植物细胞之间可以实现杂交吗?如果理论上可行,请设计出 具体实验方案。
植物体细胞杂交的过程
材料1:经漫长的进化过程,有性杂交中精子与卵 细胞能够自然发生融合形成受精卵,而体细胞的原 生质体不能自然发生融合,因而需要人工诱导迫使 二者融合。
思考:原生质体如何融合在一起呢?
材料2:聚乙二醇(PEG)分子能改变各类细胞的生物膜 结构,使两细胞接触点处质膜的脂类分子发生疏散和重 组,从而使细胞发生融合,形成杂种细胞。
A.亲本细胞的生殖隔离问题 B.选择具有优良性状的亲本 C.亲本细胞的融合技术 D.杂种细胞愈伤组织的诱导和再分化
2、植物体细胞杂交要先去除细胞壁 的原因是 (C) A.植物体细胞的结构组成中不包括 细胞壁
B.细胞壁使原生质体失去活力 C.细胞壁阻碍了原生质体的融合 D.细胞壁不是原生质体的组成部分
思考:原生质体的融合是哪一部 分的融合?这实现了什么?
植物细胞原生质体的制备与融合

植物细胞原生质体的制备与融合。
1、相关概念:(1)原生质体:是指那些已去除全部细胞壁的细胞。
细胞外仅由细胞膜包裹,呈圆形,要在高渗液中才能维持细胞的相对稳定。
此外,在酶解过程中残存少量细胞壁的原生质体称为原生质球或球状体。
(2)原生质体融合:即体细胞杂交。
用人工的方法,把分离的不同品种或不同种的原生质体诱导成融合细胞,再经离体培养诱导分化和再生完整植株的整个过程。
若取材为体细胞,则成为体细胞杂交。
2、原生质体的制备:在植物组织里,原生质体被坚硬的细胞壁包裹着,而且由于果胶质等使细胞相互紧紧粘连在一起。
在愈伤组织中,这种粘连相对松些;在细胞悬浮培养物中,只有存在细胞团的情况下,有轻度的粘连。
如果破除这种粘连作用,即可使细胞分离开来,进一步去除细胞壁,就能使裸露的原生质体游离出来。
游离效率的高低主要与植物材料和酶混合浓的组成有关。
基本程序如下:取材→除菌→酶解(加酶、渗透压稳定剂)→原生质体的收集与纯化→洗涤→原生质体活力的测定。
(1)取材与除菌:原则上植物任何部位的外植体都可成为制备原生质体的材料。
但人们往往对活跃生长的器官和组织更感兴趣。
因为,由此制得的原生质体一般都生活力较强,再生与分生比例较高。
常用的外植体包括:种子根、子叶、下胚轴、胚细胞、花粉母细胞、悬浮培养细胞和嫩叶。
对外植体的除菌要因材而异,悬浮培养细胞一般无需除菌。
对较脏的外植体往往要先用肥皂水清洗再以清水洗2-3次,然后浸入70%酒精消毒后,再放进3%次氯酸钠处理。
最后用无菌水漂洗数次,并用无菌滤纸吸干。
(2)酶解:现以叶片为例说明如何制备植物原生质体。
①配制酶解反应液:反应液应是一种pH值在5.5-5.8的缓冲液,内含纤维素酶0.3%-3.0%以及渗透压稳定剂,细胞膜保护剂和表面活性剂等。
③酶解:除菌绿。
反应液转绿是酶解成功的一项重要指标,说明已有不少原生质体游离在反应液中。
经镜检确认后应及时终止反应,避免脆弱的原生质体受到更多的损害。
动植物细胞融合(cellfusion)技术

动植物细胞融合(cell fusion)技术红色皇后为什么会有眨着小眼睛的豌豆?还有卖萌傲娇的猫香蒲又是从哪里来的?泳池突然冒出的海藻僵尸三人组,是不是缠绕海藻把僵尸拉到水里的结果?在虚构中寻找现实的人不一定脑子就有问题,因为现实比科幻小说更奇妙。
确实有一些科学家热衷于制造各种各样的动植物合体,细胞融合(cell fusion)技术就是其中最具黑科技风味的一种。
界不同,肿么谈恋爱?细胞融合顾名思义,就是让本来茕茕孑立的细胞合为一体。
有各式各样的工具和手段,鼓励细胞“在一起”。
比如聚乙二醇(polythyleneg-glycol),这种化学物质能让包裹在外的细胞膜分子散开,细胞膜本身就像液体一样会流动,两个细胞就像两滴水般融为一体。
再或者仙台病毒(Sendai virus),它的外壳里的成分,可以促使动物细胞凝集起来,大家像坐公交一样挤到一起,导致“日久生情”。
细胞并不像身体这样排斥异己,科学家可以尽情尝试过各种黑暗的组合。
在上个世纪七十与八十年代,大豆与大麦,人与蚊子,鸡与酵母,中国仓鼠与烟草,植物与变形虫,人与胡萝卜,这些组合都被尝试过。
一项1976年的胡萝卜和人类细胞融合实验尤为猎奇,因为他们用的是海拉细胞系(HeLa cell line)。
海拉细胞系在科学界可谓大名鼎鼎,它们采自一位美国妇女的子宫颈癌组织,“主人”已于1951年死去,癌细胞却一直欣欣向荣地分裂,在需要人类活细胞的各种实验中做出贡献。
王晋康还为它们写过一篇科幻小说《癌人》。
胡萝卜细胞与人类癌细胞的融合,细胞被染成不同的颜色,深黑色的是人类细胞,浅灰色的是胡萝卜细胞D Dudits et al. Fusion of human cells with carrot protoplasts induced by polyethylene glycol. Hereditas(1976) 82:122.在这个实验中,半海拉细胞半胡萝卜细胞的怪物存活了超过72小时,像胡萝卜一样长出了细胞壁(植物细胞裹着坚硬的“墙壁”,无法融合,所以在实验之前,必须用能分解细胞壁的酶把它剥掉),有些分别来自人类和胡萝卜的细胞核融合在一起。
促进植物细胞融合的方法

促进植物细胞融合的方法植物细胞融合是指将两个或多个植物细胞融合为一个细胞,从而产生新的植物体。
植物细胞融合在植物育种和基因工程研究中具有重要的应用价值。
本文将介绍几种常用的促进植物细胞融合的方法。
1. 电融合法电融合法是一种常用的促进植物细胞融合的方法。
该方法利用高压电脉冲破坏细胞膜,使细胞间质融合。
首先,将待融合的两个植物细胞放置在含有融合缓冲液的培养基中,然后将电极插入培养基中,施加高压电脉冲。
电脉冲的作用下,细胞膜发生孔洞,使细胞间质相互融合。
融合后的细胞可以通过培养和筛选得到植株。
2. 化学融合法化学融合法是另一种常用的促进植物细胞融合的方法。
该方法利用化学物质破坏细胞膜,使细胞间质融合。
常用的化学物质包括聚乙二醇(PEG)和多价阳离子。
首先,在含有融合缓冲液的培养基中,将待融合的两个植物细胞共同处理。
化学物质会破坏细胞膜,使细胞融合。
融合后的细胞可以通过培养和筛选得到植株。
3. 基因转化融合法基因转化融合法是一种利用基因工程技术促进植物细胞融合的方法。
该方法利用载体将外源基因导入植物细胞中,从而改变细胞的性状和功能。
首先,将待融合的两个植物细胞分别转化为含有不同标记基因的转基因细胞。
然后,将转基因细胞进行融合,通过筛选和培养得到融合后的细胞。
基因转化融合法可以用于改良植物的性状,并在基因工程研究中发挥重要作用。
4. 培养基条件优化培养基条件的优化对促进植物细胞融合也起到重要的作用。
合适的培养基成分、培养基pH值、温度和光照条件等都会影响细胞融合的效率和成功率。
例如,增加融合缓冲液的浓度可以提高电融合和化学融合的效果;调节培养基pH值可以改变细胞膜的稳定性;适宜的温度和光照条件可以促进细胞的生长和分裂。
因此,对培养基条件的优化可以提高植物细胞融合的成功率。
总结起来,电融合法、化学融合法、基因转化融合法和培养基条件优化是促进植物细胞融合的常用方法。
这些方法在植物育种和基因工程研究中具有广泛的应用前景。
《植物细胞融合实验》课件

目录
• 植物细胞融合实验概述 • 植物细胞融合实验材料与方法 • 植物细胞融合实验结果与分析 • 植物细胞融合实验结论与展望
01
植物细胞融合实验概胞融合是指将不同植物的 细胞通过物理或化学方法诱导融 合,形成一个具有双亲遗传特征 的融合细胞的过程。
02
植物细胞融合技术是植物生物技 术领域中的一项重要技术,为植 物遗传改良和育种提供了新的途 径。
植物细胞融合的实验目的
创造具有优良性状的转基因植物。 实现植物种质资源的保存和利用。
改良植物的抗逆性、抗病性和抗虫性等。 促进植物基因工程和细胞工程的发展。
植物细胞融合的应用前景
在农业上,植物细胞融合技术可以用于培育抗逆、抗病、 抗虫、优质、高产的转基因植物,提高农作物的产量和品 质,满足人类不断增长的食物需求。
的改良提供了有力支持。
实验结果表明,融合后的植物 细胞表现出更强的分裂和分化 能力,进而形成完整的融合植 株。
植物细胞融合技术在克服远缘 杂种不育、创造新种质资源方 面具有巨大潜力。
研究展望
01
深入研究融合细胞和融合植株的遗传、生理和生化特性,提高融合技 术的效率和成功率。
02
拓展植物细胞融合技术在农业、林业和其他领域的应用,为解决全球 资源短缺和环境问题提供更多解决方案。
培养基
用于培养融合后的细胞。
实验设备与试剂
显微镜
观察细胞融合过程。
离心机
分离和洗涤细胞。
恒温培养箱
培养融合后的细胞。
实验方法与步骤
准备实验材料
选择适当的植物细胞、酶和培养 基。
酶解处理
将植物细胞放入含有酶的溶液中 ,使其细胞壁分解。
植物原生质体培养及细胞融合过程

3. 获得细胞无性系和选育突变体的优良起始材料。
植物原生质体培养及细胞融合过程
第一节 原生质体的分离与纯化
一、原生质体的分离
(一)材料来源
植物的茎、叶、胚、子叶、下胚轴等器官组织 以及愈伤组织和悬浮培养细胞均可作为原生质体分离的材料。
果胶酶/纤维素酶 纯度高, 但浓度不来自太高; 木本植物加入半纤维素酶。
植物原生质体培养及细胞融合过程
◆渗透稳定剂
如果溶液中的渗透压和细胞内的渗透压不同,原生质体有可能涨破或收缩, 因此在酶液、洗液和培养液中渗透压 应大致和原生质体内的相同,或者比细胞内渗透压略大些。
较高水平的渗透剂可以阻止原生质体的破裂和出芽, 但同时也可能抑制原生质体的分裂。
①糖溶液系统
包括甘露醇、山梨醇、蔗糖和葡萄糖等,浓度约在0.40-0.80mol/L。 可促进分离的原生质体再生细胞壁并继续分裂;
②盐溶液系统
包括 KCl、MgSO4和 KH2PO4等。
此外,酶溶液里还可加入适量的葡聚糖硫酸钾,
提高原生质体的稳定性植物;原使生质R体培N养A及酶细胞不融合活过程化;并使离子稳定。
细胞壁的组成
纤维素 半纤维素 果胶质
25-50% 53%
5%
纤维素酶 半纤维素酶 果胶酶
少量蛋白质
植物原生质体培养及细胞融合过程
酶的种类及特点
◆ 纤维素酶
主要含有 纤维素酶C,作用于天然的和结晶的纤维素,具有分解天然纤维素的作用, 还含纤维素酶CX,作用于定形的纤维素,可分解短链纤维素, 另含有纤维素二糖酶、木聚糖酶、萄聚糖酶、果胶酶、脂肪酶、磷脂酶、 核酸酶、溶菌酶等,
细胞融合实验报告

姓名班级 13级生命基地班学号同组者:科目细胞生物学实验实验题目动物细胞融合【实验题目】动物细胞融合【实验目的】1.了解动物细胞融合的常用方法。
2.学习化学融合的基本操作过程。
3.观察动物细胞融合过程中细胞的行为与变化。
【实验材料与用品】1、材料鸡血红细胞2、试剂50%PEG、GKN溶液、Alsever’s细胞保存液、0.85%氯化钠溶液。
3、器材倒置显微镜、离心机、载玻片、盖玻片、离心管、废液缸、滴管等。
【实验原理】细胞融合是指在自发或者诱导条件下,两个或两个以上细胞合并为双核或者多核细胞的过程。
目前人们已经发现有很多方法可以诱导细胞融合,包括:病毒诱导融合、化学诱导融和和电激诱导融合。
1、病毒诱导融合仙台病毒、牛痘病毒、新城鸡瘟病毒和疱疹病毒等可以介导细胞的融时也可介导细胞与细胞的融合。
用紫外线灭活后,这些病毒即可诱导细胞发生融合。
2、化学诱导融合很多化学试剂能够诱导细胞融合,如聚乙二醇(PEG)、二甲基亚砜、山梨醇、甘油、溶血性卵磷脂、磷脂酰丝氨酸等。
这些物质能够改变细胞膜脂质分子的排列,在去除这些物质之后,细胞膜趋向于恢复原有的有序结构。
在恢复过程中想接触的细胞由于接口处脂质双分子层的相互亲和与表面张力,细胞膜融合,胞质流通,发生融合。
化学诱导方法,操作方便,诱导融合的概率比较高,效果稳定,适用于动、植物细胞,但对细胞具有一定的毒性。
PEG是广泛使用的化学融合剂。
3、电激诱导融合姓名班级 13级生命基地班学号同组者:科目细胞生物学实验实验题目动物细胞融合包括电诱导、激光诱导等。
其中,电诱导是先使细胞在电场中极化成为偶极子,沿电力线排布成串,再利用高强度、短时程的电脉冲击破细胞膜,细胞膜的脂质分子发生重排,由于表面张力的作用,两细胞发生融合。
电诱导方法具有融合过程易控制、融合概率高、无毒性、作用机制明确、可重复性高等优点。
【实验步骤】在本次实验中采用的是化学诱导融合的方法,利用PEG使鸡血红细胞发生融合。
植物细胞融合(实验)

A Alignment: Cells are brought into close contact by means of dielectrophor esis.
B Fusion pulse: A squarewave pulse of a mere 15 microseconds is applied in order to permeate the membrane. The membranes then fuse.
细胞在融合过程中发生的主要变化: 细胞在融合过程中发生的主要变化:
呈致密状态的体细胞在促融合剂的作用 下,细胞膜的性质发生变化。 首先出现 细胞膜的性质发生变化。 细胞凝集现象;然后部分凝集细胞之间的 细胞凝集现象; 膜发生粘连;继而融合形成多核细胞;在 膜发生粘连;继而融合形成多核细胞; 培养过程中多核细胞又进行核的融合而成 为单核的杂种细胞, 为单核的杂种细胞,而那些不能形成单核 的融合细胞在培养过程中逐渐死亡。 的融合细胞在培养过程中逐渐死亡。
(2)使用时再加入: 使用时再加入: 纤维素酶 R-10 果胶酶 R-10 0.8% 1%
因酶制剂经过高压灭菌处理后会失活, 因酶制剂经过高压灭菌处理后会失活, 故先将酶储液灭菌, 故先将酶储液灭菌,待用时再将酶制剂按 比例加入到第一步已灭菌的酶液内。 比例加入到第一步已灭菌的酶液内。
2)配制CaCl2.2H2O 0.16mol/L 配制CaCl (pH5.8-6.2 用于悬浮原生质体) pH5.8用于悬浮原生质体) 3)PEG液 3)PEG液: 30%( 30%(w/v) PEG(MW=6000) CaCl2.2H2O kH2PO4 山梨醇 调pH 5.8-6.2 5.80.01mol/L 0.00074mol/L 0.1 mol/L ;用时现配! 用时现配!
促进植物细胞融合的方法

促进植物细胞融合的方法一、前言植物细胞融合是一种常用的细胞学技术,可实现杂交育种、基因工程等多种应用场景。
本文探讨促进植物细胞融合的方法,包括化学方法、物理方法及生物学方法。
二、化学方法1.多元醇法在高浓度多元醇溶液中,细胞质膜变得柔软并易于打破,使得细胞融合更容易发生。
然而,过高的浓度可能会对细胞产生毒性,导致细胞死亡,因此需要进行适当的浓度筛选。
2.聚乙二醇法聚乙二醇(Polyethylene glycol, PEG)是一种化学物质,可用于细胞融合。
在低渗透压条件下,聚乙二醇可产生体积效应,使细胞膜变软,融合更加容易。
三、物理方法1.电融合法在电融合法中,两个细胞被置于两个电极之间,电流会导致细胞融合。
这种方法可以产生高效的融合,但需要特殊设备,且对细胞产生的影响尚未明确。
2.激光融合法激光融合法是一种新兴的物理融合方法,其原理是利用激光束在不接触的情况下将细胞融合。
虽然该技术还处于研究阶段,但它具有高效性和精细度高的优点。
四、生物学方法1.质体介导法质体介导法是一种常用的生物学细胞融合方法,其基本原理是将目的细胞和质粒DNA一起处理,使目的细胞摄取质粒DNA,进而实现融合。
2.基因枪法基因枪法利用高速气流将DNA微粒载入目标细胞中,瞬间突破细胞壁,实现基因的快速转移。
此方法用于转移外源DNA时,对于植物基因工程有着广泛的应用。
五、总结综上所述,植物细胞融合是一种高效的细胞学技术,在实现杂交育种和基因工程等方面具有广泛的应用前景。
化学法、物理法及生物学法均为常用的促进植物细胞融合的方法,可按照具体情况选择适当的方法进行实验。
通过不断探索,相信我们会发现更多促进植物细胞融合的新方法,为植物科研和生产带来更多的发展机会。
动物细胞融合和植物细胞融合的方法

动物细胞融合和植物细胞融合的方法
一、动物细胞融合
动物细胞融合通常是通过化学或物理方式实现,主要分类有以下几种:
1、用电解法融合动物细胞
用电解法融合动物细胞,主要是将动物细胞悬挂在滤箱中,当加入电解液(NaCl)时,引起电场的作用,动物细胞接触到电解液就会形成电解质梯度,细胞受这种电场的作用就会与彼此碰撞,然后细胞膜发生融合,从而实现细胞的融合。
2、通过热法融合动物细胞
热法融合是在低温环境下将动物细胞悬挂在滤箱中,当加入离子梯度溶液时,细胞就会被激活,并且向溶液中的高活性离子运动,当它们相撞时,细胞膜接触并发生融合,从而实现细胞的融合。
3、通过胞外表达技术融合动物细胞
胞外表达就是将具有融合功能的基因表达到宿主细胞中,从而实现细胞的融合。
这种方法的优点在于可以控制融合细胞的类型,融合的实验更加安全、快捷。
4、通过化学处理融合动物细胞
化学处理融合动物细胞,主要是将动物细胞暴露在一定的溶剂中,如有机溶剂,对其进行化学处理,从而实现细胞的融合。
二、植物细胞融合
植物细胞融合也可以分为化学和物理两种方式。
1、通过化学方法融合植物细胞
使用化学方法融合植物细胞,将植物细胞暴露在冷冻密度梯度离子溶液中,从而形成温和的离子梯度,使细胞的膜发生融合,从而实现植物细胞融合。
2、通过超声处理融合植物细胞
超声处理融合植物细胞,通过高频超声去激活细胞,将细胞悬挂在离子梯度溶液中,然后使用高频超声波来刺激细胞发生融合,从而实现植物细胞的融合。
植物细胞融合成功的标志

植物细胞融合成功的标志植物细胞融合成功的标志,这可是个有趣的话题哦!你知道吗,植物的世界里也有许多秘密,像一部神秘的小说,总有惊喜等着我们去发现。
想象一下,两个植物细胞就像两个小伙伴,可能在某个阳光明媚的下午,相遇了!他们互相看了看,可能心中一阵小激动,然后就开始“握手”融合了。
嘿,听上去是不是像是在讲一段友情故事?一旦细胞融合成功,首先映入眼帘的就是颜色的变化。
说真的,这可不是普通的变化哦!像是变魔术一样,一瞬间你就能看到它们变得鲜艳夺目。
你想,原本的单一颜色一下子变成了五颜六色,那种感觉就像是过年一样,喜庆得不得了。
再说了,这种颜色的变化不仅好看,更是植物健康的标志。
你知道的,颜色越鲜艳,细胞的活力越强,简直就像在说:“我在这里,充满能量!”细胞的形态也会发生大变化。
嘿,你想象一下,两种细胞结合后,它们的形态会像什么?就好比两个好朋友的结合,各自的特点融合在一起,诞生出一个全新的个体。
这个新个体就像是一种新的生物,充满了无限可能。
看看这些变化,简直让人感叹,生命的奥秘真是奇妙无比。
然后,我们不得不提的就是细胞分裂的能力。
融合成功后,新的细胞会开始像春天的花朵一样,迅速生长。
就像是孩子们在操场上追逐嬉戏,越长越大,越长越壮。
这样生长的速度,可不是开玩笑的,真的是快得让人眼花缭乱。
每当我看到植物快速生长的样子,心中总会涌起一种难以言表的欣喜,仿佛看到了生命的奇迹在眼前绽放。
植物细胞融合后,还会影响到它们的遗传特征。
嘿,这可真是科学的神奇之处!两种不同的遗传特征在这里结合,就像是两种美味的食材,碰撞出新的火花。
你可能会想,哎呀,这样的结合会不会让植物变得奇奇怪怪?其实不然!许多新品种的植物就是这样产生的,个个都散发着独特的魅力,让人忍不住想要亲近。
再说了,融合成功的细胞还会有更强的抗逆性,面对各种恶劣环境的挑战。
这就好比是在说:“来吧,恶劣的天气,我们不怕!”这份勇气让植物更加顽强,就像是那些勇敢的小战士,时刻准备迎接挑战。
植物细胞融合(实验)
Potato plants growing in a test tube
Phenotype of intraspecific diploids of S. tuberosum
US-W9310.3 Somatic hybrid US-W9545.99
在原生质体细胞膜与膜紧密接触的部 位,膜内蛋白质颗粒易位并凝聚。接着可 能是相邻的剥去蛋白质的细胞膜间的类脂 质与类脂质反应。继之,类脂质分子的扰 动和重排导致接触的细胞膜局部发生融合, 形成很小的细胞质桥,之后它逐渐扩大, 两个原生质体最终融合。
使用化学促融剂时,Ca2+是必需的。 关于Ca2+的作用机理,有的认为是Ca2+和 PO43-形成不溶于水的配合物,成为细胞间 的钙桥,由此引起融合。也有解释为Ca2+ 结合到带负电磷脂的电离基上,使磷脂分 子在膜上相互分离,由此引起融合。
Putative somatic hybrid plants
A fertile somatic hybrid
Phenotype of somatic hybrids clearly shows characteristics of both parents
S. brevidens somatic hybrid S. tuberosum
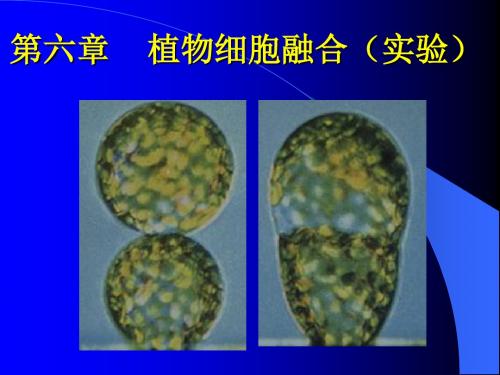
电融合法原生质体的融合结果
原生质体成串(40×)
原生质体融合(图1)
电融合法原生质体的融合结果
原生质体融合(图2) 原生质体融合(图3)
