硫酸亚铁铵制备实验条件探讨_王永明
硫酸亚铁铵的制备实验报告完整版

硫酸亚铁铵的制备实验报告完整版实验目的:1.掌握反应条件下硫酸铵和亚铁盐反应生成硫酸亚铁铵的方法。
2.了解硫酸亚铁铵的性质和用途。
实验原理:2NH4OH+FeSO4→(NH4)2SO4+Fe(OH)2↓Fe(OH)2+H2SO4→FeSO4+2H2O(NH4)2SO4+FeSO4→(NH4)2Fe(SO4)2↓实验仪器和试剂:仪器:烧杯、玻璃棒、试管、热水浴、磁力搅拌器。
试剂:浓硫酸、硫酸铵、亚铁盐。
实验步骤:1.取一只烧杯,称取适量的硫酸铵和亚铁盐,加入烧杯中。
硫酸铵和亚铁盐的摩尔比为2∶12.在烧杯中加入少量蒸馏水,以便将试剂全部溶解。
3.将烧杯放入热水浴中,用磁力搅拌器不断搅拌溶液,保持水温在60-70℃之间,加快反应速度。
4.溶液开始沉淀后,继续保持搅拌和加热条件,直至无明显沉淀生成。
5.关闭热水浴,取出烧杯,使溶液冷却至室温。
6.将溶液过滤,收集沉淀。
7.用蒸馏水洗涤沉淀几次,使产品纯净。
8.将沉淀置于通风处,使其完全干燥。
9.称取干燥的产物,记录质量。
实验数据和结果分析:根据反应方程式可知,1 mol硫酸铵和0.5 mol亚铁盐反应可以生成1 mol硫酸亚铁铵。
假设硫酸铵和亚铁盐的质量均为m,则可推算出硫酸亚铁铵的理论产量为2m。
实验条件下,取硫酸铵和亚铁盐的质量分别为1.5g和0.75g。
经过实验反应,获得硫酸亚铁铵的实际产量为1.9g。
计算得出:实验产率=实际产量/理论产量×100%=1.9g/(2×1.5g)×100%≈63.3%移液记录:记录表明,在实验过程中,实验者需要准确记录使用的试剂质量、反应温度、时间等重要参数,以便对实验结果进行分析和讨论。
实验安全注意事项:1.实验中使用浓硫酸等腐蚀性试剂时,需要佩戴防护眼镜和实验服,防止化学物质对人体造成伤害。
2.实验过程中,需要注意对实验仪器和玻璃器皿的正确使用和保养,以防发生意外破损。
3.实验过程中的火源需要远离实验区,以防发生火灾。
硫酸亚铁铵的制备实验报告

硫酸亚铁铵的制备实验报告
实验目的:硫酸亚铁铵是一种常用的分析试剂和有机合成试剂,在医药、化妆品和农业等领域中有广泛的应用。
本实验旨在通过反应原料的适当选择和实验条件的控制,制备出纯度较高的硫酸亚铁铵。
实验原理:
FeSO4+(NH4)2SO4+H2SO4→(NH4)2Fe(SO4)2·6H2O
实验步骤:
1.取一只干净的烧杯,称取适量的硫酸亚铁(FeSO4)固体,称量准确。
2.将称取的硫酸亚铁固体加入烧杯中,加入适量的硫酸铵
((NH4)2SO4)固体,控制比例。
3.在烧杯中缓慢加入浓硫酸(H2SO4),注意搅拌和温度控制。
4.继续搅拌直至反应完全进行,并出现混合物的特征颜色,此时停止搅拌。
5.将制备好的混合物过滤,收集溶液。
6.将溶液冷却至室温,结晶出硫酸亚铁铵。
7.用冷蒸馏水洗涤结晶物,以去除杂质。
8.用纸巾等吸去结晶物的水分,放置在通风处自然晾干。
实验结果:
经过制备得到的硫酸亚铁铵呈现出良好的结晶性质,结晶物质呈现出蓝绿色的颜色。
实验讨论:
1.实验中应严格控制反应物的比例和实验室条件,以提高硫酸亚铁铵的纯度。
2.实验过程中应注意搅拌均匀,避免结晶物表面的杂质。
3.结晶物的洗涤过程应尽量使用冷蒸馏水,以降低杂质的溶解度。
4.实验操作中应做好个人防护,避免与反应物接触眼睛或皮肤。
结论:
本实验成功制备出纯度较高的硫酸亚铁铵。
制备过程中需要严格控制反应物的比例和实验条件,以提高产品的纯度。
实验结果显示,通过适当的反应条件和操作技巧,可以获得良好的结晶性质和纯度较高的硫酸亚铁铵。
硫酸亚铁铵制备实验报告

硫酸亚铁铵制备实验报告实验报告:硫酸亚铁铵制备实验一、实验目的本实验旨在通过化合物之间的置换反应制备硫酸亚铁铵,并学习置换反应的原理和方法。
二、实验原理FeSO4+(NH4)2SO4→(NH4)2Fe(SO4)2三、实验步骤1.将10g的硫酸铵溶解在50mL的蒸馏水中,搅拌均匀,得到溶液A。
2.将10g的硫酸亚铁溶解在50mL的蒸馏水中,搅拌均匀,得到溶液B。
3.将溶液A缓慢倒入溶液B中,同时用玻璃杯棒搅拌,反应产物出现沉淀。
4.将反应产物过滤,将沉淀用蒸馏水洗涤,然后用滤纸吸干,得到硫酸亚铁铵。
四、实验结果和分析经过实验制备的硫酸亚铁铵为淡绿色晶体,它的外观和结晶形状与预期一致。
制备出的产品可以通过透明度、颜色和晶体形状等进行观察和判断。
五、实验注意事项1.实验中使用的器皿和玻璃杯棒需干净,以免杂质影响实验结果。
2.水的用量和加入速度应适当控制,过快或过多的加入可能影响化学反应。
3.在过滤过程中尽量避免产生空气冲击,以免溶液喷溅。
六、实验总结通过本实验,我深刻理解了置换反应的原理和方法,以及硫酸亚铁铵的制备过程。
在实验过程中,我注意到了实验操作的细节和注意事项,保证了实验的顺利进行。
实验结果与预期相符,我取得了满意的成果。
虽然本实验成功制备了硫酸亚铁铵,但是在未来的实验中,仍然可以进一步改进。
例如,在实验过程中可以控制反应的温度和时间,以获得更纯净的产物。
此外,还可以通过进一步的实验和测试,确定产物的物理和化学性质,深入了解硫酸亚铁铵的应用和特性。
总之,通过本实验的学习和实践,我对置换反应和化学实验操作有了更深入的了解,提高了实验技能和科学素养。
硫酸亚铁铵制备实验报告

实验报告高三 (5)班郭嘉麟【实验目的】制备 (NH 4)2SO4·FeSO4·6H 2O,了解复盐的特性。
【实验原理】 Fe + H 2SO4= FeSO4 + H 2↑FeSO4 +(NH 4)2+ 6H 2O= (NH 4)2 SO4Fe SO4· 6H 2O将制得的硫酸亚铁溶液与等物质的量的 (NH 4)2SO4在溶液中混合,经加热浓缩、冷却后得到溶解度较小的硫酸亚铁铵晶体。
【实验用品】 Fe 屑, 10 % Na2CO3溶液, 3 mol ·L-1H2SO4,(NH 4)2SO4,蒸馏水 ,无水乙醇 ,锥形瓶,玻璃棒,漏斗,烧杯,胶头滴管,酒精灯,石棉网,铁架台,蒸发皿,滤纸,量筒,托盘天平称取 Fe屑洁净 Fe,再次称量酸溶【实验流程图】成热过滤计算,称量加硫酸铵蒸发称量成品【实验步骤】实验步骤预期现象实验现象解释与结论1.称取 3gFe 屑,放于锥Fe 屑变洁净.形瓶内,加入15mL10% Na2CO3溶液,小火加热 10 分钟以除去 Fe 屑上的油污,用倾泻法倒掉碱液然后用自来水再用蒸馏水将铁屑洗涤干净,然后干燥,记录其质量 m1(Fe)2.往盛有 Fe 屑的锥形瓶中加入 15 mL,放在水浴上加热至不再有气泡放出,趁热过滤,用少量热水洗涤锥形瓶及漏斗上的残渣,吸干。
将溶液倒入蒸发皿中。
将留在锥形瓶内和滤纸上的残渣收集在一起用碎滤纸吸干后称重m2(Fe),由已作用的 Fe屑质量算出溶液中生成的FeSO4 的量Fe 屑量变少,溶液变为浅绿色, 加热过程时 ,有气泡放出 ,3. 根据溶液中FeSO4的量,接反应方程式计算并称取所需(NH 4)2SO4固体的量,倒入上面制得的 FeSO4溶液中。
水浴蒸发、浓缩至表面出现结晶薄膜为止。
放置冷却,得(NH4)2SO4·FeSO4·6H2O 晶体。
4.用无水乙醇冲洗晶体2到 3 次 ,以去除表面水份 , 用两块滤纸吸干无水乙醇 ,观察晶体的颜色和形状。
硫酸亚铁铵制备条件

硫酸亚铁铵制备条件《硫酸亚铁铵制备条件》我有个朋友叫小李,那家伙最近在实验室里忙得晕头转向。
有一天他跑过来跟我抱怨:“你知道吗?我制备硫酸亚铁铵都失败好几次了,这玩意儿的制备条件太刁钻了。
”就因为他这话,我对硫酸亚铁铵的制备条件做了些深入的研究。
首先呢,原料的选择是很关键的基础。
硫酸亚铁的来源就得好好斟酌。
一般可以用铁屑和稀硫酸反应来制取硫酸亚铁。
这其中铁屑要是不纯,带有很多杂质,那得到的硫酸亚铁肯定也不干净,最后制得的硫酸亚铁铵品质就大打折扣。
我就跟小李说:“你这铁屑可得把好关啊,像是从那种锈得乱七八糟,又沾着其他脏东西的铁上取下来的铁屑,那肯定不行。
”他挠挠头说:“好像还真有这么个问题呢。
”然后就是反应的温度和PH值的控制。
制备硫酸亚铁的时候,反应温度不能太高。
要是温度过高啊,一方面铁屑和稀硫酸反应可能会过于剧烈,不好控制;另一方面还可能导致生成的硫酸亚铁被氧化。
好比烧水,火太大水就扑腾扑腾地溢出来了。
对于PH值,一般要控制在反应体系略显酸性,这样才能保证铁屑持续反应,生成充足的硫酸亚铁。
有次我在旁边看小李做实验,就说:“你这PH值测一测啊,可别到碱性那边去了,不然铁屑还得跟碱反应,那你的硫酸亚铁就没影了。
”他赶忙去调整实验装置。
在制备硫酸亚铁铵的过程中,结晶这一步也是极为重要的。
结晶时的温度降低速度和搅拌方式对产品的质量和产量都有很大影响。
如果降温太快,晶体很小而且不均匀,杂质可能会裹在里面出不来;要是不搅拌,上下层溶液结晶情况就不一样,也容易出问题。
我给小李传授经验:“你这个结晶的锅啊,要慢慢降温,搅拌就像炒菜翻锅一样,要轻轻的但是又要均匀。
”他笑着说:“你这比喻还挺形象。
”对于制备硫酸亚铁铵,我的建议就是在开始实验前,要做好准备工作,把每个环节的理论知识都熟透于心。
多进行几次预试验,检验各制备条件是否能达到理想的效果。
还有啊,做实验时要专注,仔细观察周围环境因素是不是影响到实验。
千万不能像小李开始那样,手忙脚乱不注重细节。
制备硫酸亚铁铵的实验报告

制备硫酸亚铁铵的实验报告实验目的本实验旨在通过化学反应制备硫酸亚铁铵。
实验材料•硫酸亚铁•氨水•硫酸•蒸馏水•烧杯•搅拌棒•试管实验步骤1.将硫酸亚铁溶解:取适量硫酸亚铁,放入烧杯中。
由于硫酸亚铁易吸湿,因此应迅速称取并避免暴露于空气中。
2.加入蒸馏水:将适量的蒸馏水加入烧杯中,用搅拌棒充分搅拌溶解硫酸亚铁。
溶解过程中需注意安全,避免溅出溶液。
3.验证溶液是否溶解完全:观察溶液是否呈现完全透明的状态,如果有未溶解的颗粒物,则需要继续搅拌直至完全溶解。
4.加入氨水:将适量氨水滴加入溶液中,并同时用搅拌棒充分搅拌,直至溶液呈现淡绿色。
氨水的添加过程需要缓慢进行,以免反应过于剧烈。
5.验证溶液颜色:观察溶液颜色是否符合预期,确保反应进行正常。
6.加入硫酸:将适量的硫酸滴加入溶液中,并同时用搅拌棒充分搅拌。
加入硫酸的过程需要缓慢进行,以免反应过于剧烈。
7.验证溶液颜色和反应:观察溶液颜色是否发生变化,以及反应是否呈现活跃状态。
8.过滤沉淀:将反应后的溶液通过过滤纸过滤,以去除不溶性物质。
9.蒸发溶液:将过滤后的溶液倒入烧杯中,用火源加热蒸发,使溶液逐渐浓缩。
10.结晶:当溶液浓缩到一定程度时,会开始形成结晶。
此时可以停止加热,将烧杯放置在室温下,等待结晶的形成。
11.收集晶体:当结晶足够大且完全形成时,用过滤纸过滤晶体,并用蒸馏水洗涤晶体以去除杂质。
12.干燥晶体:将洗涤后的晶体放置在通风处,使其自然干燥。
13.称重并保存:将干燥后的晶体称重,并储存在干燥密封的容器中,以防止吸湿。
实验结果通过以上步骤进行实验后,我们成功制备出硫酸亚铁铵晶体。
根据实验条件的不同,晶体的形态和颜色可能有所差异。
实验完成后,我们可以通过测定晶体的质量来确定产量。
实验注意事项1.实验过程中需佩戴实验手套和护目镜,确保安全。
2.操作中应注意用量,避免浪费和反应过于剧烈。
3.搅拌过程中要轻柔,以免溅出溶液。
4.加热时要小心火源,避免烧伤。
实验硫酸亚铁铵的制备

实验 硫酸亚铁铵的制备———设计实验一、教学目的1.掌握实验有关原理及数据设计并制备复盐硫酸亚铁铵;2.进一步掌握水浴加热、溶解、过滤、蒸发、结晶等基本操作;3.了解检验产品中杂质含量的一种方法——目视比色法。
二、实验原理硫酸亚铁铵又称摩尔盐,是浅蓝绿色单斜晶体,它能溶于水,但难溶于乙醇。
在 空气中它不易被氧化,比硫酸亚铁稳定,所以在化学分析中可作为基准物质,用来直 接配制标准溶液或标定未知溶液浓度。
由硫酸铵、硫酸亚铁和硫酸亚铁铵在水中的溶解度数据(见课本 234 页)可知, 在一定温度范围内,硫酸亚铁铵的溶解度比组成它的每一组分的溶解度都小。
因此, 很容易从浓的硫酸亚铁和硫酸铵混合溶液中制得结晶状硫酸亚铁铵 FeSO4·(NH4)2SO4·6H2O。
在制备过程中,为了使 Fe 2+ 不被氧化和水解,溶液需保持 足够的酸度。
本实验是先将金属铁屑溶于稀硫酸制得硫酸亚铁溶液:Fe + H2SO4 === FeSO4 + H2↑然后加入等物质的量的硫酸铵制得混合溶液,加热浓缩,冷却室温,便析出硫酸亚铁 铵复盐。
FeSO4 + (NH4)2SO4 +6H2O === FeSO4·(NH4)2SO4·6H2O 目视比色法是确定杂质含量的一种常用方法,在确定杂质含量后便能定出产品的 级别。
将产品配成溶液,与各标准溶液进行比色,如果产品溶液的颜色比某一标准溶 液的颜色浅,就可确定杂质含量低于该标准溶液中的含量,即低于某一规定的限度, 所以这种方法又称这限量分析。
本实验仅做摩尔盐中Fe 3+ 的限量分析。
三、实验用品仪器:量筒、烧杯、蒸发皿、布氏漏斗、吸滤瓶、酒精灯、台秤、烘箱、水浴锅固体药品:铁屑、硫酸铵液体药品:稀硫酸(3mol/L)、Na2CO3(2mol/L)、HCl(2.0mol/L)、KSCN(1.0mol/L)材料:滤纸、pH试纸四、实验内容1.铁屑的净化称取4克铁屑放在250mL的烧杯中,加入2mol/L的Na2CO3 溶液15mL,加热约 10分钟后,用倾析法除去碱液,用水冲洗铁屑。
硫酸亚铁铵的制备的实验报告

硫酸亚铁铵的制备的实验报告一. 实验目的1.学会利用溶解度的差异制备硫酸亚铁铵。
2.从实验中掌握硫酸亚铁、硫酸亚铁铵复盐的性质3.掌握水浴、减压过滤等基本操作4.学习pH试纸、吸管、比色管的使用5.学习用目测比色法检验产品质量。
二. 原理铁屑溶于稀硫酸生成硫酸亚铁。
硫酸亚铁与硫酸铵作用生成溶解度较小的硫酸亚铁铵。
Fe + H2SO4 = FeSO4 + H2↑FeSO4 +(NH4)2SO4+6H2O = FeSO4(NH4)2SO4·6H2O由于复盐的溶解度比单盐要小,因此溶液经蒸发浓缩、冷却后,复盐在水溶液中首先结晶,形成(NH4)2FeSO4·6H2O晶体。
比色原理:Fe3+ + n SCN- = Fe(SCN)n(3-n) (红色) 用比色法可估计产品中所含杂质Fe3+的量。
Fe3+由于能与SCN-生成红色的物质[Fe(SCN)]2+,当红色较深时,表明产品中含Fe3+较多;当红色较浅时,表明产品中含Fe3+较少。
所以,只要将所制备的硫酸亚铁铵晶体与KSCN溶液在比色管中配制成待测溶液,将它所呈现的红色与含一定Fe3+量所配制成的标准Fe(SCN)]2+溶液的红色进行比较,根据红色深浅程度相仿情况,即可知待测溶液中杂质Fe3+的含量,从而可确定产品的等级。
三. 仪器及药品1.仪器:台称,布氏漏斗,抽滤瓶,比色管(25ml),水浴锅,蒸发皿,量筒(10、50ml),酒精灯。
2.药品:3mol·L-1H2SO4溶液,铁屑,(NH4)2SO4(固体),1mol·L-1Na2CO3溶液,0.1mol·L-1KSCN溶液,pH试纸。
四.物理常数表1几种物质的溶解度(g/100gH2O)0℃10℃20℃30℃40℃FeSO4·7H2O 28.8 40.0 48.0 60.0 73.3(NH4)2SO470.6 73 75.4 78.0 81 FeSO4·(NH4)2SO412.5 17.2 26.4 33 46 FeSO4·(NH4)2SO4·6H2O 17.2 31.0 36.47 45.0 —表2不同等级标准溶液Fe3+含量规格ⅠⅡⅢFe3+含量(mg) 0.050 0.10 0.20五. 实验步骤1.硫酸亚铁制备2. 硫酸亚铁铵的制备配(NH 4)2SO 4饱和溶液:(NH 4)2SO 4)的质量:0.005L*3.0 mol/L*132 g/mol = 1.98g , 量取水:75:100 = 1.98/x, x= 1.98*100÷75=2.64g (水) = 2.64mL 3. Fe 3+的限量分析不含氧水的准备 :在250mL 锥形瓶中加热150mL 纯水至沸,小火煮沸10~20分钟,冷却后备用。
硫酸亚铁铵的制备实验

硫酸亚铁铵的制备实验一、实验目的1.学习和掌握硫酸亚铁铵的制备原理和方法。
2.了解和掌握实验原理和实验操作技能。
3.培养实验操作能力和观察能力。
二、实验原理硫酸亚铁铵是一种有广泛应用价值的化合物,可用于净水、农药、催化剂等。
制备硫酸亚铁铵的实验原理是基于硫酸铁和硫酸铵在水溶液中的复分解反应,反应方程式如下:(NH4)2SO4 + FeSO4 + 2H2O = (NH4)2SO4•FeSO4•2H2O 实验过程中需要注意控制反应条件,如温度、浓度、pH值等,以保证实验结果的稳定性和可靠性。
三、实验步骤1.准备实验试剂和设备:硫酸铁溶液、硫酸铵溶液、氢氧化钠溶液、去离子水、离心管、滴管、电子天平等。
2.将离心管放置在电子天平上,称取一定量的硫酸铁溶液和硫酸铵溶液,分别加入离心管中。
3.用滴管缓慢地加入氢氧化钠溶液,同时用pH试纸监测溶液的pH值,使pH值保持在一定范围内。
4.将离心管放入离心机中,进行离心分离,分离出上层清液。
5.对分离出的清液进行蒸发浓缩,得到硫酸亚铁铵晶体。
6.对得到的晶体进行称量和计算,记录数据。
四、实验结果与分析1.实验结果:通过实验,我们成功地制备出了硫酸亚铁铵晶体,并对晶体进行了称量和计算。
具体数据如下:1.我们成功地制备出了硫酸亚铁铵晶体,并且质量较为稳定。
通过对实验数据的分析,我们可以得出以下结论:(1)本实验中,控制pH值是关键因素之一。
在加入氢氧化钠溶液时,需要缓慢加入并同时用pH试纸监测溶液的pH 值,以保证pH值在一定范围内。
通过控制pH值,我们可以有效地控制反应速度和生成物的质量。
(2)本实验中,蒸发浓缩是另一个关键步骤。
在蒸发浓缩过程中,需要控制温度和时间,以避免晶体分解或失去结晶水。
通过蒸发浓缩,我们可以得到干燥、纯净的硫酸亚铁铵晶体。
(3)本实验中,离心分离是必要的步骤之一。
通过离心分离,我们可以去除上层清液中的杂质,保证得到纯净的硫酸亚铁铵晶体。
(4)本实验中,我们对得到的硫酸亚铁铵晶体进行了称量和计算,验证了实验结果的可靠性。
硫酸亚铁铵的制备实验报告

硫酸亚铁铵的制备实验报告[实验目的]1 .了解复盐的一般特征和制备方法;2 .练习水浴加热、常压过滤与减压过滤、蒸发与结晶等基本操作;3 .学习用目测比色法检验产品质量。
[实验原理]Fe屑溶于稀H2SO4生成FeSO4:Fe + H2SO4 = FeSO4+ H2等物质的量的FeSO4与(NH4)2SO4作用,能生成溶解度较小的硫酸亚铁铵(NH4)2SO4〃FeSO4〃6H2O,商品名称为莫尔盐。
FeSO4+ (NH4)2SO4+6H2O = (NH4)2SO4〃FeSO4〃6H2O一般亚铁盐在空气中易被氧化,但形成复盐后就比较稳定,因此在定量分析中常用来配制亚铁离子的标准溶液。
和其它复盐一样,(NH4)2SO4〃 FeSO4〃6H2O在水中的溶解度比组成的每一种组分[FeSO4或(NH4)2SO4]的溶解度都要小。
[仪器与试剂]仪器:台秤,锥形瓶 (150mL) ,250mL烧杯,量筒 (10 、 50mL) ,磨口抽滤漏斗及配套锥瓶,漏斗架,蒸发皿,吸滤瓶,水浴锅( 可用大烧杯代替 ) ,比色管 (25mL),石棉网,比色架,电炉,调压器,玻璃杯,抽滤机。
试剂:纯铁粉,HCl(2mol〃L -1) , H 2SO 4(3mol〃L -1) , 0.0100mg〃mL-1 标准 Fe 3+溶液,KSCN(1mol〃L -1 ) , (NH 4 ) 2SO 4 (s) , Na,无水乙醇,pH 试纸,蒸馏水。
2 CO 3[实验步骤]1.硫酸亚铁的制备:往盛有 2.0g 洁净铁屑的小烧杯中加入 15mL 3mol〃L -1H 2 SO 4溶液,盖上表面皿,放在低温电炉加热 ( 在通风橱中进行 ) 。
在加热过程中应不时加入少量去离子水,以补充被蒸发的水分,保持原有体积,防止 FeSO 4结晶出来;使铁屑与稀硫酸反应至不再冒出气泡为止。
趁热用普通漏斗过滤,滤液承接于洁净的蒸发皿中。
将留在小烧杯中及滤纸上的残渣取出,用滤纸片吸干后称量。
硫酸亚铁铵的制备反应条件与绿色化研究

钟 国清 , 等: 硫 酸 亚 铁 铵 的制 备 反 应 条 件 与绿 色 化 研 究
中图分类号 : 0 6 — 3 文献标志码 : B 文 章编 号 : 1 0 0 2 — 4 9 5 6 ( 2 0 1 3 ) 0 5 — 0 0 1 4 — 0 3
P r o c e s s i n g c o n d i t i o n a n d g r e e n i n g i mp r o v e me n t O f e x p e r i me n t s f o r p r e p a r a t i o n o f a mmo iu n m f e r r o u s s u l f a t e
Vo 1 . 3 0 No . 5 Ma y .2 0 1 3
实 验 技 术 与 方 法
硫酸 亚铁 铵 的制 备反 应 条 件 与绿 色 化研 究
钟 国清 ,周 齐文。 ,夏 安
( 1 .西 南科 技 大 学 材料 科 学 与 工程 学 院 ,四 川 绵 阳 6 2 1 0 1 0 ;
收稿 日期 : 2 0 1 2 — 0 8 — 2 9
基 金项 目 : “ 化 学 综 合设 计 实验 ” 国家 精 品 课 程 项 目 ; 西 南 科 技 大 学 重 点
实 验 技 术 研 究项 目( No . 1 2 s y j s 一 2 4 ) 作者简介 : 钟 国清 ( 1 9 6 5 一) , 男, 四川 内江 , 学士 , 教授 , 主 要 从 事 基 础 化 学 教 学及 配 位 化 学 研究 工作 .
2 .西 南 石 油局 油 田 工程 服 务 公 司 ,四 川 绵 阳 6 2 1 0 0 0 )
硫酸亚铁铵的制备与组成分析实验报告样板(给学生).doc档

广州大学化学化工学院本科学生综合性、设计性实验报告实验课程普通化学实验D实验项目硫酸亚铁铵的制备及质量检验专业生物科学班级生科111班学号1114100058 姓名王衣指导教师贾玉江开课学期2011 至2012 学年一学期时间2011 年11 月13 日实验方案设计实验目标1.了解复盐的一般特性及硫酸亚铁铵的制备方法2.熟练掌握水浴加热,蒸发,结晶和减压过滤等基本操作。
3.掌握高锰酸钾滴定法测定铁的方法和巩固产品中Fe+的定量分析实验原理(NH4)2SO4·FeSO4·6H2O即莫尔盐,是一种透明、浅蓝绿色单斜晶体。
由于复盐在水中的溶解度比组成中的每一个组分的溶解度都要小,因此只需要将FeSO4与(NH4)2SO4的浓溶液混合,反应后,即得莫尔盐。
Fe + H2SO4 = FeSO4 + H2↑FeSO4 + (NH4)2SO4+ 6H2O = (NH4)2SO4·FeSO4·6H2O实验流程或实验装置图实验用品(包括:名称、规格、数量)仪器:台秤、锥形瓶、水浴锅、布氏漏斗、吸滤瓶试剂:(NH4)2SO4(s)、3 mol·L-1H2SO4、10%Na2CO3、95%乙醇、1.0 mol·L-1KCNS、2.0 mol·L-1HCl、0.01 mg·mL-1Fe3+标准溶液、铁屑或还原铁粉数据记录和处理(表格、计算公式等)参考文献普通化学实验(1)教师对实验方案设计的意见签名:日期:实验报告一.制备实验用品仪器:台秤、锥形瓶、水浴锅、布氏漏斗、吸滤瓶试剂:(NH4)2SO4(s)、3 mol·L-1H2SO4、10%Na2CO3、95%乙醇、1.0 mol·L-1KCNS、2.0 mol·L-1HCl、0.01 mg·mL-1Fe3+标准溶液、铁屑或还原铁粉制备原理(简述)(NH4)2SO4·FeSO4·6H2O即莫尔盐,是一种透明、浅蓝绿色单斜晶体。
硫酸亚铁铵的制备实验报告完整版

硫酸亚铁铵的制备实验报告完整版一、实验目的1、掌握硫酸亚铁铵的制备原理和方法。
2、练习无机制备中的基本操作,如称量、加热、溶解、过滤、蒸发、结晶等。
3、了解并掌握产品纯度的检验方法。
二、实验原理硫酸亚铁铵,俗称莫尔盐,化学式为(NH₄)₂Fe(SO₄)₂·6H₂O,是一种浅蓝绿色的复盐。
在空气中比硫酸亚铁更稳定,不易被氧化。
本实验首先用过量的铁屑与稀硫酸反应生成硫酸亚铁:Fe + H₂SO₄= FeSO₄+ H₂↑然后加入等物质的量的硫酸铵,经过蒸发浓缩、冷却结晶,即可得到硫酸亚铁铵晶体:FeSO₄+(NH₄)₂SO₄+ 6H₂O =(NH₄)₂Fe(SO₄)₂·6H₂O三、实验用品1、仪器电子天平、锥形瓶、玻璃棒、铁架台、酒精灯、石棉网、漏斗、滤纸、蒸发皿、表面皿、容量瓶、移液管。
2、药品铁屑、稀硫酸(3mol/L)、硫酸铵固体、无水乙醇、KSCN 溶液(01mol/L)。
四、实验步骤1、铁屑的净化用电子天平称取_____g 铁屑,放入锥形瓶中,加入_____mL 10%的Na₂CO₃溶液,加热煮沸约 5 分钟,以除去铁屑表面的油污。
用倾析法倒掉碱液,并用蒸馏水冲洗铁屑至中性。
2、硫酸亚铁的制备在锥形瓶中加入_____mL 3mol/L 的 H₂SO₄溶液,加热至不再有气泡产生,趁热过滤,将滤液转移至蒸发皿中。
3、硫酸亚铁铵的制备根据反应式计算所需硫酸铵的质量,称取硫酸铵固体,将其加入到上述硫酸亚铁溶液中,搅拌溶解。
用小火加热,蒸发浓缩至溶液表面出现晶膜,停止加热。
冷却至室温,析出浅绿色的硫酸亚铁铵晶体。
4、过滤与洗涤用减压过滤的方法将晶体与母液分离,并用少量无水乙醇洗涤晶体2 3 次,以除去晶体表面残留的水分和杂质。
5、干燥将晶体放在表面皿上,自然晾干,得到浅绿色的硫酸亚铁铵晶体。
6、产品纯度的检验称取_____g 制备的硫酸亚铁铵晶体,用蒸馏水溶解后,配制成_____mL 溶液。
大制备硫酸亚铁铵实验报告

大制备硫酸亚铁铵实验报告一、实验目的1、掌握硫酸亚铁铵的制备原理和方法。
2、熟练掌握水浴加热、过滤、蒸发、结晶等基本操作。
3、学习通过目视比色法检验产品中的杂质含量。
二、实验原理硫酸亚铁铵又称莫尔盐,化学式为\((NH_{4})_{2}Fe(SO_{4})_{2}·6H_{2}O\),浅绿色晶体,是一种复盐。
在空气中比一般亚铁盐稳定,不易被氧化。
本实验首先用过量的铁屑与稀硫酸反应生成硫酸亚铁溶液:\(Fe + H_{2}SO_{4} = FeSO_{4} +H_{2}↑\)然后加入等物质的量的硫酸铵固体,在一定温度下使其溶解,经过蒸发浓缩、冷却结晶、过滤等操作,得到硫酸亚铁铵晶体。
三、实验仪器与试剂1、仪器电子天平、水浴锅、抽滤装置(布氏漏斗、抽滤瓶、真空泵)、蒸发皿、玻璃棒、烧杯(多个)、量筒、表面皿。
2、试剂铁屑、\(3mol/L\)硫酸溶液、\((NH_{4})_{2}SO_{4}\)固体、无水乙醇、\(1mol/L KSCN\)溶液。
四、实验步骤1、铁屑的净化称取_____g 铁屑放入小烧杯中,加入_____mL \(1mol/L\)碳酸钠溶液,加热并搅拌几分钟,以除去铁屑表面的油污。
用倾析法倒掉碱液,并用蒸馏水冲洗铁屑至中性。
2、硫酸亚铁的制备在通风橱中,将洗净的铁屑放入_____mL 烧杯中,加入_____mL \(3mol/L\)硫酸溶液,盖上表面皿,放在水浴锅中加热(温度控制在_____℃左右),并不时搅拌。
反应至不再有气泡产生,趁热过滤,滤液转移至另一干净的烧杯中。
3、硫酸亚铁铵的制备根据反应式计算所需\((NH_{4})_{2}SO_{4}\)固体的质量,称取并将其加入到上述硫酸亚铁溶液中,搅拌使其溶解。
然后在水浴锅中加热至溶液表面出现晶膜,停止加热。
4、晶体的析出将溶液自然冷却至室温,再放入冰水浴中冷却,使硫酸亚铁铵晶体充分析出。
5、晶体的过滤与洗涤用布氏漏斗进行抽滤,并用少量无水乙醇洗涤晶体,以除去晶体表面附着的水分和杂质。
硫酸亚铁铵制备实验的思索

硫酸亚铁铵制备实验的思索硫酸亚铁铵制备实验的思索一、总体解释硫酸亚铁铵(Ammonium ferrous sulfate)作为一种重要的物质,经常在诸多实验中被用于各种用处。
硫酸亚铁铵在化工工业中的使用十分普及,用作漂白剂、防锈剂等,而在生物学实验领域,它可以用作增补铁的补充物,用以影响分枝杆菌的形态和生长。
因此,硫酸亚铁铵的制备实验室被广泛用于各种实验中。
二、实验的策划1. 化学材料的准备在硫酸亚铁铵的制备实验中,主要化学物质为硫酸亚铁、硫酸铵、水以及苯乙酸。
实验前,先称取用于本实验的每种物质,根据实验量比例精确分比称取各种成份,然后将各种材料放置于烧杯中。
2. 实验中的操作在实验中,要求静置温度为室温,通风情况良好。
烧杯中加有指定数量的每种成品物质,搅拌均匀后,调节加热电源的功率,将烧杯中的物质加热至其开始发生蒸发的温度,当被加热溶液减小至指定体积后,熄火冷却,用滤瓶过滤,即可得到湿淀积物,别置于干燥处,即可得到制备完成的硫酸亚铁铵。
3. 安全操作在这个实验中,必须遵守一定的安全操作规程,以防发生任何意外事件。
首先,实验室必须保持良好的通风情况,并禁止穿着过厚的衣服,以防被加热的物质烫伤身体。
其次,着陆后需要佩戴护目镜、橡胶手套和防静电服,确保个人安全。
最后,加热时可能还需要使用酸性抗碱液,即使操作技术贴切,仍要严格注意安全操作。
三、小结硫酸亚铁铵是一种广泛使用的物质,在化学实验中拥有重要的用途,其制备实验也属于化学实验中常见的实验之一。
实验前,必须准备好所需要的化学物质,并且精确测量其数量;实验中,要求实验室的通风良好,且操作室人员应该佩戴安全的防护装置;实验后,根据实验过程得出的结果,分析及总结本实验的成功程度,以及实验产生的收获。
总之,硫酸亚铁铵的制备实验的成功与否,直接关系着实验室人员的技术水平及安全注意事项的落实,因此,科学家们必须加大精神,做好每一次实验中的每一步,以得到成功。
硫酸亚铁铵的制备实验报告思考题

硫酸亚铁铵的制备实验报告思考题硫酸亚铁铵的制备实验报告思考题引言:硫酸亚铁铵是一种常见的无机化合物,广泛应用于农业、医药和化工等领域。
本篇文章将对硫酸亚铁铵的制备实验进行报告,并提出一些思考题,以便读者更好地理解实验原理和应用。
实验目的:本实验旨在通过反应制备硫酸亚铁铵,并了解其结构和性质。
实验原理:硫酸亚铁铵的化学式为FeSO4·(NH4)2SO4·6H2O,是一种含水晶体。
它可以由硫酸亚铁和硫酸铵在适当条件下反应得到。
实验步骤:1. 准备所需试剂:硫酸亚铁、硫酸铵、蒸馏水。
2. 将硫酸亚铁和硫酸铵按一定比例称取,放入两个不同的容器中。
3. 将硫酸亚铁溶液缓慢倒入硫酸铵溶液中,同时用玻璃棒搅拌。
4. 搅拌均匀后,将溶液过滤,得到固体沉淀。
5. 将固体沉淀用蒸馏水洗涤数次,以去除杂质。
6. 将洗涤后的固体沉淀放置在通风处晾干,得到硫酸亚铁铵。
实验结果:通过上述步骤,我们成功制备了硫酸亚铁铵。
它呈现出淡绿色的结晶体,具有一定的溶解度。
在常温下,硫酸亚铁铵可以稳定存在。
实验思考题:1. 为什么在制备硫酸亚铁铵的实验中使用了硫酸亚铁和硫酸铵?硫酸亚铁和硫酸铵是制备硫酸亚铁铵的两种重要原料。
硫酸亚铁提供了亚铁离子(Fe2+),而硫酸铵提供了铵离子(NH4+)。
这两种离子在反应中发生配位作用,形成硫酸亚铁铵的结构。
2. 为什么在制备硫酸亚铁铵的实验中需要搅拌溶液?搅拌溶液可以促进反应物的充分混合,提高反应速率。
此外,搅拌还可以均匀分布热量,防止溶液局部过热。
3. 为什么在制备硫酸亚铁铵的实验中需要过滤固体沉淀?固体沉淀中可能存在一些杂质,通过过滤可以将这些杂质分离出来,得到纯净的硫酸亚铁铵。
4. 为什么在制备硫酸亚铁铵的实验中需要洗涤固体沉淀?洗涤固体沉淀可以去除残留的杂质和未反应的物质,提高产物的纯度。
5. 为什么在制备硫酸亚铁铵的实验中需要将固体沉淀晾干?固体沉淀中可能含有一定的水分,晾干可以去除这些水分,得到干燥的硫酸亚铁铵。
硫酸亚铁铵制备实验条件探讨_王永明

Abstract: This paper introduced some exploratory research for the preparation of ferrous ammonium sulfate,the greenness of experimental process was realized by optimizing the experimental condition and use quantity of materia medica,this has very important meaning to economy material,lessen let of rubbish and protect entironment. Key words: ferrous ammonium sulfate; experimental improvement; green chemistry
[7] 李晓红,董金玲,卢培栋,等. FTIR-ATR 原位观测 Mg( NO3 ) 2 气溶胶的潮解和风化过程[J]. 中国科学 B 辑,2007,37 ( 3 ) : 295 -303 .
[8] 王陈琛,林珂,胡乃银,等. 利用超额拉曼光谱研究硝酸镁水溶 液中的离子对[J]. 物理化学学报,2012,28( 8) : 1823-1829.
3 结语
在以往的“激光拉曼光谱的检测”实验中,主要 涉及的是常规物质的定性检测,实验内容稍显单一, 学生在对拉曼光谱进行分析时,理解上也常出现误 区。本实验考虑了测定过程中激光强度、激光曝光 时间、激光聚焦好坏程度等诸多因素的影响,通过引 入水峰和无机盐拉曼峰的面积比( WSR) 概念,利用 非线性拟合,获得了 WSR 与溶液浓度之间的曲线方 程,实现了拉曼光谱对无机盐溶液浓度的定量分析。 该实验技术应用于本科实验教学能有助于构建多层 次拉曼光谱实验教学体系,满足不同层次学生的实 验教学需求,对拓展“现代仪器分析”课程的教学内 容也有积极意义。
硫酸亚铁铵制备实验的思索

硫酸亚铁铵制备实验的思索蒋林玲【摘要】Factors contributing to the low success rate and yield were analyzed. The yield and the purity of ammonium ferrous sulfate were increased by improved experimental device and conditions. The improved experiment for experimental teaching with normal experiment devices can improve product quality and enhance students’ interest in experiment. The result showed that the improved experiment on the one hand can reduce environmental pollution in the laboratory, and realize greening experimental teaching, and on the other hand, can greatly reduce the experimental reagent wastage, raise the quality and benefit of the talent training.%分析了高校硫酸亚铁铵制备实验成功率和产率不高的原因,并根据分析对实验装置进行合理化、绿色化改进。
结果表明,通过对实验条件的改进和探索,大大提高了实验成功率,改善了产品质量,增加了学生对制备实验的认识和兴趣。
改进后的实验一方面减少了废物排放,实现了制备实验的绿色化,对于保护环境具有非常重要的意义。
另一方面降低了实验消耗、节省实验经费,全面提高人才的培养质量和效益。
硫酸亚铁铵的制备实验学案
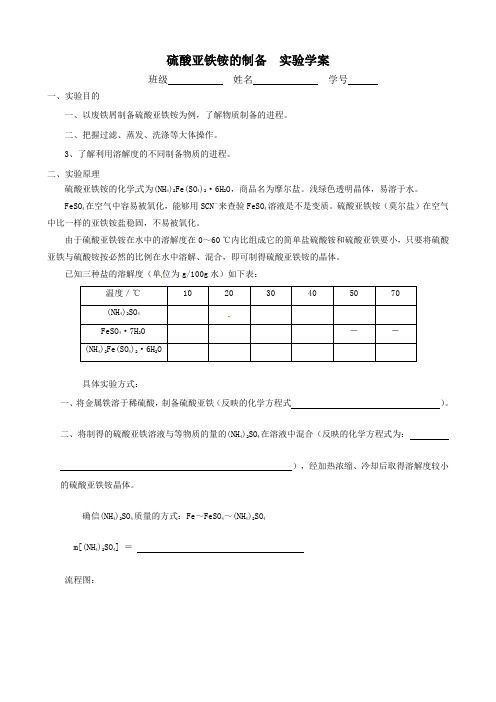
硫酸亚铁铵的制备实验学案班级姓名学号一、实验目的一、以废铁屑制备硫酸亚铁铵为例,了解物质制备的进程。
二、把握过滤、蒸发、洗涤等大体操作。
3、了解利用溶解度的不同制备物质的进程。
二、实验原理硫酸亚铁铵的化学式为(NH4)2Fe(SO4)2·6H2O,商品名为摩尔盐。
浅绿色透明晶体,易溶于水。
FeSO4在空气中容易被氧化,能够用SCN-来查验FeSO4溶液是不是变质。
硫酸亚铁铵(莫尔盐)在空气中比一样的亚铁铵盐稳固,不易被氧化。
由于硫酸亚铁铵在水中的溶解度在0~60 ℃内比组成它的简单盐硫酸铵和硫酸亚铁要小,只要将硫酸亚铁与硫酸铵按必然的比例在水中溶解、混合,即可制得硫酸亚铁铵的晶体。
已知三种盐的溶解度(单位为g/100g水)如下表:温度/℃102030405070(NH4)2SO4FeSO4·7H2O--(NH4)2Fe(SO4)2·6H2O具体实验方式:一、将金属铁溶于稀硫酸,制备硫酸亚铁(反映的化学方程式)。
二、将制得的硫酸亚铁溶液与等物质的量的(NH4)2SO4在溶液中混合(反映的化学方程式为:),经加热浓缩、冷却后取得溶解度较小的硫酸亚铁铵晶体。
确信(NH4)2SO4质量的方式:Fe~FeSO4~(NH4)2SO4m[(NH4)2SO4] =流程图:三、实验用品药品:10%Na2CO3溶液、Fe屑、3mol/L H2SO4、(NH4)2SO4、蒸馏水、无水乙醇仪器:锥形瓶、蒸发皿、酒精灯、玻璃棒、烧杯、铁架台、漏斗、托盘天平、量筒、滤纸四、实验步骤五、问题与讨论一、Fe屑的处置时利用Na2CO3溶液以除油污的缘故是,加热更有利于提高去污能力的缘故是。
二、硫酸亚铁溶液在空气中容易变质,在操作时应注意。
3、①将(NH4)2SO4与FeSO4混合后加热、浓缩,停止加热的机会是。
②加热、浓缩溶液时,不浓缩至干的理由是。
③实验时,使摩尔盐结晶能够采取的方式是。
(填序号)A.蒸发浓缩溶液、再自然冷却结晶 B.不蒸发溶液、直接自然冷却结晶C.加热、蒸发、浓缩至晶体完全析出④制得的晶体过滤后用无水乙醇洗涤而不用蒸馏水,依照是。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
[1] 胡晓红,周金 池. 拉曼光谱的应用及其进展[J]. 分 析 仪 器, 2011( 6) : 1-4.
[2] 韦娜,冯叙桥,张孝芳,等. 拉曼光谱及其检测时样品前处理的 研究进展[J]. 光谱学与光谱分析,2013,33( 3) : 694-698.
[3] 陈芳,陆维敏,胡恩萍. 拉曼光谱在企业产品质量监控过程中 的应用[J]. 实验技术与管理,2013,30( 5) : 22-25.
15
可知,对于 KNO3 溶液,式 1 中的 a 值为 97. 50,再代 入式 1 后,可 视 为 标 准 曲 线 方 程。学 生 只 要 测 定 KNO3 溶液的拉曼光谱,计算出 WSR 值,即可由标 准曲线推算出 KNO3 的浓度。
需要注意的是,上述方法仅限于对同种溶液的 不同浓度之间的定量分析,而不能推广到不同溶液 的浓度比较,因此,该方法具有一定的局限性。
[4] 王红球,张丽,王璐,等. 拉曼光谱在安检领域中的应用[J]. 光 散射学报. 2012,24( 4) : 367-370.
[5] 丛培盛,孙玉萍,王晓岗,等. 拉曼光谱鉴别宝石教学实验的开 发[J]. 实验技术与管理,2012,29( 8) : 137-139.
[6] 刘文涵,秦延平,滕渊洁,等. 激光拉曼光谱直接测定维生素 C 含量[J]. 徐州工程学院学报,2013,28( 1) : 24-29.
言,他们的实验基础较差、操作技能不够熟练,如果 教师未能对学生进行及时有效的指导,实验可能会 出现诸多问题[6-8],比如: 还原铁粉与稀硫酸反应本 应形成浅绿色溶液,却出现了黄色溶液或黑色块状 物质; 进行硫酸亚铁溶液热过滤时,可能会造成漏斗 颈堵塞; 硫酸亚铁与饱和硫酸铵混合时溶液变成了 黄色; 蒸发浓缩混合液时,晶膜不出现或形成了黄色 晶体; 产物产率太低,杂质含量过高; 实验过程中产 生大量有毒有害气体( 如 H2 S、PH3 ) ,等等。不可否 认,这些问题的出现与学生的实验能力有一定关系, 但也反映出教材中该实验过程的繁杂性,所以难以 取得理想的实验效果。
综上所述,半微型实验在减少实验经费、增强实 验安全性、培养学生实验能力和提高环境保护意识 等方面都是有益的。
2. 2 实验条件的改进
( 1) 实验材料的改进 实验中用废弃物铁丝为原料代替还原铁粉,最 好是直径大约为 0. 5 ~ 1mm 的铁丝,也可用细弹簧 弯曲状废铁。选用废弃铁丝为原料可以降低实验成 本,做到废物再利用,有利于培养学生的绿色化学理 念,同时由于铁丝的表面积大,不仅可以缩短反应时 间,还能够清楚地看到反应进行的程度,便于选择合 适的硫酸用量。
参考文献( References) :
[1] 陈虹锦. 实验化学( 上册) [M]. 北京: 科学出版社,2003: 225 - 228.
[2] 北京大学化学系普通化学教研室. 普通化学实验[M]. 北京: 北京大学出版社,1991: 147-150.
( 下转第 15 页)
肖寒霜,等: 拉曼光谱对无机盐溶液定量检测的探索
[7] 李晓红,董金玲,卢培栋,等. FTIR-ATR 原位观测 Mg( NO3 ) 2 气溶胶的潮解和风化过程[J]. 中国科学 B 辑,2007,37 ( 3 ) : 295 -303 .
[8] 王陈琛,林珂,胡乃银,等. 利用超额拉曼光谱研究硝酸镁水溶 液中的离子对[J]. 物理化学学报,2012,28( 8) : 1823-1829.
3 结语
在以往的“激光拉曼光谱的检测”实验中,主要 涉及的是常规物质的定性检测,实验内容稍显单一, 学生在对拉曼光谱进行分析时,理解上也常出现误 区。本实验考虑了测定过程中激光强度、激光曝光 时间、激光聚焦好坏程度等诸多因素的影响,通过引 入水峰和无机盐拉曼峰的面积比( WSR) 概念,利用 非线性拟合,获得了 WSR 与溶液浓度之间的曲线方 程,实现了拉曼光谱对无机盐溶液浓度的定量分析。 该实验技术应用于本科实验教学能有助于构建多层 次拉曼光谱实验教学体系,满足不同层次学生的实 验教学需求,对拓展“现代仪器分析”课程的教学内 容也有积极意义。
( 2) 药品相对使用量的改进 在制备硫酸亚铁溶液的过程中,理论上无论是 铁过量还是硫酸过量都有利于硫酸亚铁的生 成[1 0],但是实验过程中只能控制一种反应物过量, 如果控制反应过程中酸过量,我们会发现 Fe2+ 离子 易被空气中的氧气氧化成 Fe3+ 离子,从而影响产品 硫酸亚铁铵的质量; 如果控制铁过量,我们发现过量 的铁不仅能够很好地防止 Fe2+ 离子氧化,而且剩余 铁丝便于称量,从而可以准确计算所需硫酸铵的质 量,最终获得纯度较高的产品硫酸亚铁铵。 ( 3) 反应温度的选择 反应过程中若使用酒精灯加热,受热不均会使 局部温度过高,反应不易控制而使实验失败,水浴加 热受热均匀而且能够很好地控制反应温度,因而效 果更佳。表 1 为不同温度下铁与稀硫酸的反应时 间,由表 1 可知: 反应一段时间后,反应中铁粉的余 量都不足 0. 1g,但反应中随着温度的升高,反应时 间逐渐缩短。我们知道,温度过高,会促使 Fe2+ 离子 氧化为 Fe3+ 离子,影响产品的纯度,所以反应温度应 控制在 60 ~ 70℃ ,这样可获得较纯的硫酸亚铁。
1 硫酸亚铁铵制备实验的不足
硫酸亚铁铵制备实验原理为: Fe + H2 SO4( 稀) = FeSO4 + H2 ↑,然后利用复盐硫酸亚铁铵的溶解 度比硫酸亚铁和硫酸铵的溶解度都小的性质,将等 摩尔硫酸亚铁和硫酸铵在水溶液中混合,生成溶解 度较小 的 复 盐 硫 酸 亚 铁 铵,FeSO4 + ( NH4 ) 2 SO4 + 6H2 O = ( NH4 ) 2 SO4 ·FeSO4 ·6H2 O。实验不仅涉 及称量、水浴加热、蒸发、浓缩、结晶、干燥、倾析、常 压过滤、减 压 过 滤 等 化 学 基 本 操 作,还 涉 及 去 除 杂 质、制备复盐、防止副反应发生和绿色化学教育等化 学基本原理。学生如果能够掌握好实验的各个环 节,就会取得较好的实验效果,然而对于部分学生而
3 结语
以废铁丝为原料制备硫酸亚铁铵,采用半微型
化制备仪,控制反应过程铁丝过量,酸度 pH 在 1 ~ 2 之间,采用反应温度 60 ~ 70 ℃ ,可得纯度高达 95% 以上、产率 65 % 以上的硫酸亚铁铵。
半微型实验即能达到教学要求,又可以激发学 生的实验兴趣。通过对该实验过程的优化,不仅提 高了产品的产量和纯度,而且还实现了实验过程的 绿色化,这对于培养学生的绿色化学理念,提高学生 的实验 操 作 技 能 和 自 主 创 新 意 识 具 有 非 常 重 要 的意义。
2 硫酸亚铁铵制备实验的改进
2. 1 硫酸亚铁铵制备实验的半微型化
与常规实验相比,半微型实验药品用量大大减 少[9],实验只需废铁丝 0. 5g,3mol·L-1 H2 SO4 溶液 4mL,硫酸铵固体 1. 1g,仅为常规实验用量的 20% 左右。半微型实验不仅节约经费开支,又缩短了实 验时间,既实现了废物的再利用,又能培养学生节俭 的品格。实验中产品质量检验采用的是产物中 Fe3+
[9] 郭鑫,陈斯华,商志军,等. 共聚焦拉曼光谱研究过饱和硝酸铵 液滴中 NH4 + ,NO3 - 和 H2 O 之间的相互作用[J]. 物理化学学 报,2012,28( 4) : 766-772.
[10] 滕达,郑磊,祝传刚. 海水阴离子溶液中水的激光拉曼光谱特 性研究[J]. 激光杂志,2010,31( 4) : 21-23.
表 1 铁与稀硫酸在不同温度下的反应情况
( 4) 酸碱度的选择 硫酸亚铁为强酸弱碱盐,在中性或弱酸性环境 下易发生水解,同时 Fe2+ 也容易被空气中的氧气氧 化为 Fe3+ 离子。若铁与硫酸反应后,溶液接近中性 ( pH 接近于 6) ,硫酸亚铁就会被溶解在水中的氧气 氧化( 实验中的蒸馏水要加热后使用) ,并发生水解 生成 碱 式 硫 酸 盐 或 氢 氧 化 铁 沉 淀: 4FeSO4 + O2 + 4H2 O = 2[Fe ( OH) 2]2 SO4 +2H2 O,因此反应结束后 应控制酸度 pH 在 1 ~ 2 之间,这样可抑制硫酸亚铁 水解,同时也能防止 Fe2+ 离子氧化成 Fe3+ 离子。制 得的硫酸亚铁与饱和硫酸铵溶液混合时,也需要控 制酸度在 1 ~ 2 之间,若酸度不够可用稀硫酸调节。
Discussion of the experimental condition for the preparation of ferrous ammonium sulfate
WANG Yong-ming
( Department of Basic Course,Armed Police Academy,Langfang 065000,China)
ISSN1672 -4305 CN12-1352 / N
实验室科学 LABORATORY SCIENCE
第 17 卷 第 3 期 2014 年 6 月 Vol. 17 No. 3 Jun. 2014
硫酸亚铁铵制备实验条件探讨
王永明
( 武警学院 基础部,河北 廊坊 065000)
摘 要: 对硫酸亚铁铵制备实验进行了改进,通过药品用量和实验条件的优化,实现了制备 过程的绿色化,这对于节约原料,减少废物排放,保护环境具有非常重要的意义。 关键词: 硫酸亚铁铵; 实验改进; 绿色化学 中图分类号: O614. 81 文献标识码: A doi: 10. 3969 / j. issn. 1672-4305. 2014. 03. 004
硫酸亚铁铵是一种复盐,俗称摩尔盐,浅绿色单 斜晶体,常以水合物 FeSO4 ·( NH4 ) 2 SO4 ·6H2 O 形 式存在,在空气中比一般亚铁盐稳定,不易被氧化, 溶于水校无机化学实验教材中,多数都有硫酸亚铁铵 的制备实验[1-5],作 者 在 教 学 中 发 现 该 实 验 过 程 存 在不足之处,为此,作者对药品用量和实验条件进行 了优化,实现了制备过程的绿色化。
