配合物与沉淀溶解平衡
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
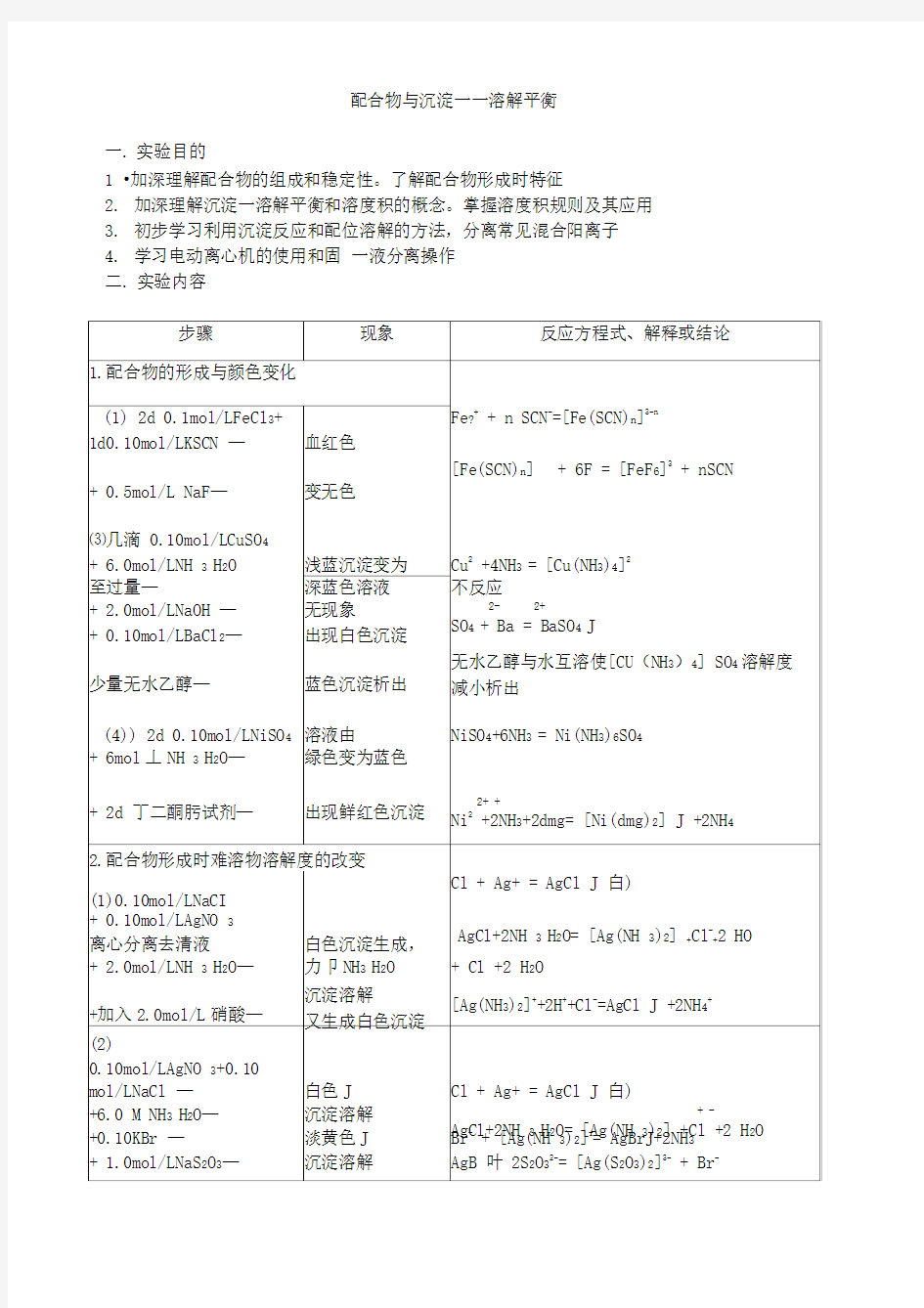
配合物与沉淀一一溶解平衡
一. 实验目的
1 •加深理解配合物的组成和稳定性。了解配合物形成时特征
2.加深理解沉淀一溶解平衡和溶度积的概念。掌握溶度积规则及其应用
3.初步学习利用沉淀反应和配位溶解的方法,分离常见混合阳离子
4.学习电动离心机的使用和固一液分离操作
二. 实验内容
9.沉淀法分离混合离子 分离 Ag +,Fe 3+,AI 3+离子
+
3+
3+
Ag +Fe +AI 2.0moI/L HCI
v
Fe(0H)3j AI(OH)4
(红棕色)
8.沉淀的溶解
(1)
0.5ml .10mol/LMgCI 2+
数滴2.0moI/LNH 3 H 2O 产生白色沉淀 +几滴2.0moI/LHCI — 沉淀溶解 +几滴1.0moI/LNH 4CI
沉淀溶解
Mg 2++2NH 3 H 2O — Mg(OH)2 抄2NH 4+
Mg(OH)2+2H — Mg 2
+2H 2O Mg(OH)2+2NH 4+—Mg 2++2NH 3. H 2O T
AgCI J
Fe 3++AI 3+
Ag + + Cl - — AgCI J
Fe 3+ + 3OH -— Fe(OH)3 J Al 3 +4OH — AI(OH)4
