化工原理下册课件第二章 吸收第6次课解吸及其他条件下的吸收
化工原理吸收教学课件PPT

5.1.1 化工生产中的传质过程
一、均相物系的分离
均相混合物的分离,首先要设法制造另外一个相,
使得物质从一个相转移到另外一相。
根据不同组分
某种过程
均相物系
两相物系
在各相中物性 的差异,使某
组分从一相向
实现均相物系的分离
另一相转移: 相际传质过程
相际传质过程
均相物系分离
相际传质过程的推动力:浓度差
5
分离
均 相 混 合 物 非 均 相 混 合 物
动量传递 三传 热量传递
质量传递
-----在浓度差、温度差、压 力差等推动力作用下,物质从 一处向另一处的转移过程。包 括相内传质和相际传质两类。
利用某种性质差异
方法 加 加入 入能 另量 外一种分 物离 质剂 作为 加场,如浓度场、电 温场 度、磁场
4
13
5.1.7 吸收操作的分类
按被吸收 组分数目
单组分吸收
多组分吸收√ 气体混合物 液体
气体 吸收
按吸收有无 化学反应
按溶质组 成的高低
按吸收的 温度变化
物理吸收
化学吸收√
低浓度吸收
高浓度吸收√
等温吸收
非等温吸√收
溶质A S
惰性组分B 吸收剂
相界面
本章只讨论单组分、低浓度、等温、物理吸收过程 的有关原理和计算。
ExA p*A
y*Ap*A/ pxAE/ p
p*A ExA
∴
mE p
y*A mxA
26
在低浓度气体吸收计算中,通常采用基准不变
的比摩尔分数Y( 或 X)表示组成。
由yA*mxA
得
YA* 1YA*
mX*A 1 X*A
化工原理吸收

Yi* mXi
由气相组成求液相组成:
x
* i
pi E
ci* Hpi
x
* i
yi m
X
* i
Yi m
亨利定律适用条件:理想溶液或稀溶液(一般<5%), 总压< 101.33MPa。
17
例2-1: 含有30%(体积)CO2的某种混合气与水接触,系统 温度为30℃,总压为101.33kPa,试求液相中CO2的平衡浓度 为若干kmol/m3. 解:pi=pyi=101.33 ×0.3=30.4kPa<101.33kPa, 故亨利定律适用
截面2处放一层膜,只允许A通过,
不允许B通过。
此时仍存在分子扩散,仍有JA=-JB 但此时还存在总体流动,即两种分子并
溶解度一般以单位质量或体积液体中所含溶质的质量来表示。
10
气体在液体中的溶解度
溶解度曲线:在一定温度、压力下,平衡时溶质在气相和液 相中的浓度的关系曲线。溶解度曲线由实验得来。
用水作吸收剂时,称 NH3 为易溶气体,SO2为中等溶解气体, 溶解度更小的O2则为难溶气体。 从溶解度曲线可知: 对同一溶质,其溶解度随温度的升高而减少; ➢加压和降温有利于吸收过程; ➢升温和减压则有利于脱吸过程。
溶解热:气体溶解于液体时所释放的热量。化学吸收时,还 会有反应热。
非等温吸收:体系温度发生明显变化的吸收过程。 等温吸收:体系温度变化不显著的吸收过程。
7
吸收操作的用途
(1) 制取产品
用吸收剂吸收气体中某些组分而获得产品。如硫酸吸收 SO3 制 浓 硫 酸 , 水 吸 收 甲 醛 制 福 尔 马 林 液 , 氨 水 吸 收 CO2制碳酸氢氨等。 (2) 分离混合气体
《化工原理》课件—02吸收

12
3.溶解度的影响因素
❖ 溶质的性质:不同的气体在溶剂中的溶解度不同 易溶气体,难溶气体
❖ 分压对溶解度的影响:当Pe增加,x 增加。(T 一定) ❖ 总压对溶解度的影响:在溶质组份分压不变时,若P
变化不大,不影响溶解度。即总压不影响pe、x之间 的关系 ❖ 温度对溶解度的影响: T增加,x下降,(Pe一定)
2020/12/11
7
选择合适的溶剂。吸收剂的性能是吸收操作良
好与否的关键,选择时要从以下几方面来考虑:
1.对被吸收的组分要有较大的溶解度,且有较好的选择性。 2.要有较低的蒸气压,以减少吸收过程中溶剂的挥发损失。 3.要有较好的化学稳定性,以免使用过程中变质。 4.腐蚀性要小,以减小设备费用和维修费。 5.粘度要低,以利于传质及输送;比热要小,使再生时的耗热 量较小;不易燃,以利于安全生产。 6.吸收后的溶剂应易于再生。
29
第二节 吸收速率
两个基本问题:一是过程的极限,取决于吸收的相平衡关系;
另一是过程的速率。
气液传质过程: 三个基本步骤
①溶质由气相主体
相界面,(相内传质)Байду номын сангаас
②溶质组分在界面上发生溶解进入液相。 (相际传质)
③由界面 液体主体传递。(相内传质)
溶解过程易进行的,其阻力很小。通常认为界面上气液两 相的溶质浓度满足平衡关系。
18
4. 各亨利系数的影响因素
➢ 亨利系数E=f(物系,T)
温度T ,E ; 总压P对E影响很小
理想溶液: E=p0(饱和蒸汽压)
易溶气体E<难溶气体E
➢ 溶解度系数H =f(物系,T)
总压P对H影响很小;温度T ,H
易溶气体H>难溶气体H
化工原理 PPT 第2章 吸收

m
202 .6 p
从气相分析 y*=mx=23.94×0.01=0.24<y=0.3 故SO2必然从气相转移到液相,进行吸收过程。 y 0.3 x* 0.0125 m 23.94 以液相摩尔分数表示的吸收推动力为: ∆x=x*-x=0.0125-0.01=0.0025 以气相摩尔分数表示的吸收推动力为: ∆y= y - y*=0.3-0.24=0.06
1.判断传质进行的方向
①气、液相组成(yi,xi)在平衡线上方(P点): 相对于液相组成xi 而言, 气相浓度为过饱和 ( yi yi* ),溶质 A 由气 相向液相转移。 相对于气相组成yi 而言, 液 相 浓 度 欠 饱 和 ( xi xi* ),故液相有吸 收溶质 A 的能力。
y yi
V,yi2 L,xi2
yi 2,min y mxi 2
* i2
2)逆流吸收,塔高无限,
xi1,min
y i1 x m
* i1
V,yi1
L,xi1
31
【例】
在总压101.3kPa,温度30℃的条件下, SO2摩尔分率为0.3的混合气体与SO2摩尔分 率为0.01的水溶液相接触,试问: (1) 从液相分析SO2的传质方向; (2) 从气相分析,其它条件不变,温度降到 0℃时SO2的传质方向; (3) 其它条件不变,从气相分析,总压提高 到202.6kPa时SO2的传质方向,并计算以 液相摩尔分率差及气相摩尔率差表示的传 质推动力。
7
4.吸收分类 1)物理吸收和化学吸收 物理吸收:吸收过程溶质与溶剂之间不发生显著 的化学反应,可以当作是气体单纯地 溶解于液相的物理过程。如用水吸收 二氧化碳、用水吸收乙醇或丙醇蒸汽、 用洗油吸收芳烃等。 化学吸收:溶质与溶剂发生显著的化学反应。如 用氢氧化钠或碳酸钠溶液吸收二氧化 碳、用稀硫酸吸收氨等过程。化学反 应能大大提高单位体积液体所能吸收 的气体量并加快吸收速率。但溶液解 吸再生较难。
化工原理下ppt第2章 吸收

2.1 气体吸收的相平衡关系 2.2 传质机理与吸收速率 2.3 吸收塔的计算 2.4 吸收系数
2.5 脱吸及其他条件下的吸收
1
1. 吸收的原理
分离物系 气体混合物
尾气 B(含微量A)
吸收剂 S
形成两相体系的方法
引入一液相(吸收剂) 传质原理 各组分在吸收剂中溶 解度不同。 A:溶质(吸收物质) B:惰性组分(载体)
p*
NH3 10℃
0
x
14
2.亨利定律的表达式
1) p - x关系
p Exi
式中:E——亨利系数,k pa。 E的讨论: 表示气体溶解能力的常数; 溶解度,亨利系数↓;
i
E随温度变化而变化, T↓,E↓;
E的来源:实验测定或从手册中查得。
15
2.亨利定律的表达式
2) p - c关系
45
2. 一组分通过另一停滞组份的扩散
Dp NA RTz pA1 pA2 pB2 pB1 ln pB 2 pB1
NA p pA2 Dp p ln B2 A1 RTz pB1 pB2 pB1
令
pBm
pB2 pB1 pB2 ln pB1
Nm N
2
42
1
JA
N NcA/c NcB/c JB 1 2 NB
NA
N NA N B NB 0 N NA
对组分A
cA NA J A N c
cA dcA NA (1 ) J A D c dz
Dc dcA NA c c A dz
在气相扩散
pA cA RT
液相主体
溶解
化工原理下册课件第二篇 章 吸收第6次课解吸及其他条件下的吸收

---------------------------------------------------------------最新资料推荐------------------------------------------------------1 / 10化工原理下册课件第二篇 章 吸收第6次课解吸及其他条件下的吸收2. 6 解 吸 2. 6 解 吸 一、概述 1 、作用: ① ① 吸收剂的再生,以便循环使用; ② 回收溶质,得到分离后气体。
2 、解吸常用的方法:压力低,温度高,有利于脱吸 加热溶液(加热解吸) ,增大溶液中溶质的 平衡分压 用水蒸汽(气提) ,加热、降低气相中溶质的 分压 ;适用于溶质为不凝性气体,或溶质冷凝液不溶于水 通惰性气体(惰性气体气提) ,降低操作压力,主要用于吸收剂的再生,不能直接得到纯净的溶质组分。
Y=mX B A X 1 X 2 Y 2 * Y 2 Y 1 1、 、 物料衡算:-=-=二 、解吸塔的计算 解吸过程的操作线总是在平衡线的下方, 解吸过程的推动力是吸收的相反值。
2 、操作线方程:3 、最小气液比:4 、填料层高度的求法:Z=H OG N OG =H OL N OL ((1 )对数平均推动力法((2 )吸收因数法:-=AY YY YAANOL *1 1*2 1) 1 ( ln11-=2.7 强化吸收过程的途径从从可以看出,影响吸收的主要因素: K Y 、吸收推动力和相接触面积。
吸收过程的主要阻力集中在滞流膜上。
要提高吸收总系数, 必须设法降低气膜和液膜的厚度。
通过加大流体的流动速度,增加流体的湍动程度,则可减小滞流膜层的厚度。
一、提高吸收总系数K Y ( 或K G ) 或K X ( 或K L ) 三、增大单位吸收传质面积面积主要由设备来决定,对于填料塔,应该注意:填料的选型,应尽量选比表面积大的填料。
增大气液分散度,液体喷淋均匀,填料充分润湿,保证上升气泡和液层充分接触,达到传质目的。
化工原理第六章吸收

吸收
§1 §2 §3 §4 §5
气体吸收的相平衡关系 传质机理与吸收速率 吸收塔的计算 吸收系数 脱吸及其他条件下的吸收
概述
1、定义 吸收:利用混合气体各组分在液体中溶解度 差异,使某些易溶组分进入液相形成 溶液,不溶或难溶组分仍留在气相, 实现混合气体分离。 解吸:也称为脱吸,与吸收相反的过程,即 溶质从液利。
2.1.2 亨利定律
体系:单组分、低浓、恒温、物理吸收。 总压P<5×105Pa,一定温度下溶质在液相中 的溶解度(平衡)与其在气相中的分压成正比。
亨利系数(E): (单位与分压单位一致) ① 理想溶液:P不高,T恒定,亨利定律 与拉乌尔定律一致,即:E=p0
② 非理想溶液: E≠p0,但在一定浓度范 围内(低浓),E=const. E=f(T)。
混合气中某些组分在气液相界面溶解、在气相和液
相内由浓度差推动的传质过程。
分离
气相 1.定义:
液相
气相 NH3 + 空气 水 NH3
2.依据:溶解度不同
吸 收
NH3: 气相
液相
٭吸收质(溶质):A ٭惰性组分(载体):B
٭吸收剂:S ٭吸收液:S+A
٭尾气:B+(A)
2、吸收分离操作的目的与任务 制取液体产品:如盐酸、硝酸,碳化氨水吸收CO2 制碳酸氢氨等。 分离混合气体吸收获得某些组分:如用液态烃吸收 裂解气中的乙烯、丙烯等。 气体净化除去混合气体中杂质:如合成氨原料气脱 CO2等; 尾气处理和废气净化:脱SO2、NOx等 分离基础:各组分溶解度的差异
例2: 已知20℃时,1atm下氨在水中的溶 解度数据(p85)。绘制p*~x及Y*~X曲 线,计算E、m,并指出服从亨利定律的范围。
天津大学版 化工原理 第六章 脱吸及其它条件下吸收 ppt 课件

同理: dG Ld ( x ) L dx
1 x
而
1 x dG N AdA K y ( y y )a dz K x ( x x )a dz
L dx K x ( x x )a dz 1 x x1 Ldx z x 2 K x a ( 1 x )( x x )
2、吸收过程是非等温的,沿塔高有温度分布;
3、膜传质系数将与浓度、流动状况、温度有关,不再是常数;
填料塔微元段内吸收的溶质量:
dG d ( V y ) d ( L x ) V V 1- y L L 1- x
y dy dy dG Vd ( )V V 2 1 y 1 y (1 y )
(2)最小气液比和载气流量的确定 当吸收液与载气在解吸塔中 V, Y L, X 逆流接触如图所示时,吸收 液流量,吸收液进出口组成 V, Y 及载气进塔组成通常由工艺 m' n' 规定,所要计算的是载气流 L, X 量V及填料层高度。 采用处理吸收操作线类似的 V, Y L, X 方法,可得到解吸操作线方 图 5-22 逆流解吸塔示意图 程
(二)变温平衡曲线的确定 如图,塔内各截面处的组成xi各对应 一条等温平衡线。 作法: 1、确定xi与ti 的对应关系,这样可在指定 的xi下,算出ti ; 2、 取一系列xi值,得 到相应ti值;3、在x-y座标上做出一系列ti 下的等温平衡曲线;4、xi与ti线的交点纵坐 标即为 5、 连接所有交点得到的曲线即 为该过程的变温平衡曲线。
4、化学吸收时:溶质从 气相主体到气液相界面 的传质机理和传质系数 并未受影响,与物理吸 收相同;液相中反应对 传质的影响可分为以下 两个方面。 (1)反应使液相主体中A组分浓度大为降低,从而 使传质推动力增大,在多数工业化学吸收中趋于 零;
化工原理下册课件 解吸
理论级数计算
x1 x2e 1 NT ln 1 A A ln(1 / A) x2 x2 e
学 习 指 导
本章重点掌握的内容
气体在液体中的溶解度 亨利定律 吸收速率方程式 膜吸收速率方程式 气膜控制与液膜控制 总吸收速率方程式
学 习 指 导
低组成气体吸收的计算 物料衡算与操作线方程 吸收剂用量的确定 填料层高度的计算 吸收系数的准数关联式中常用的准数 解吸的原理与方法
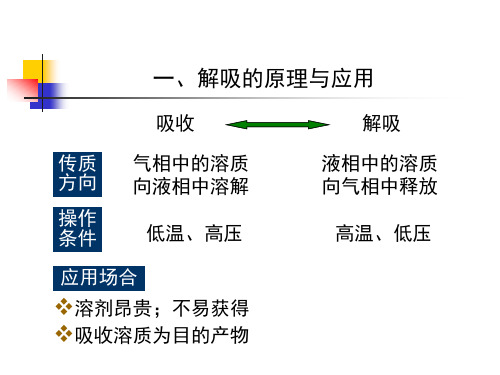
一、解吸的原理与应用
吸收 传质 方向 操作 条件 应用场合 气相中的溶质 向液相中溶解 低温、高压 解吸 液相中的溶质 向气相中释放 高温、低压
溶剂昂贵;不易获得 吸收溶质为目的产物
二、化工中常用的解吸方法
气提解吸
解吸 方法
加入气提气,降低溶质的分压。 减压解吸 √ 吸收在加压下进行,通过减压进行解吸。 加热解吸 对吸收液加热,通过升温进行解吸。 加热-减压联合解吸 √ 加热-减压联合进行,提高解吸程度。
或
L y ( x x2 ) y 2 G
气提解吸操作线方程
直线的斜率 L / G
操作线方 程为直线 直线通过点
T (x1,y1)
B (x2,y2)
三、气提解吸的计算
2.最小气液比和载气流量的计算
在气提解吸的计算中,通常吸收液的量是已
知的,而载气的用量需通过工艺计算来确定。在 液量一定的情况下,确定载气的用量也即确定气 液比 G / L 。 气液比 G/L 的确定方法是,先求出气提解吸 过程的最小气液比(G / L)min,然后再根据工程 经验,确定适宜(操作)气液比。
L ( ) max G L ( ) G
y1e
y1 y1 y2
T*
《化工原理吸收》课件

本课件将全面介绍吸收过程的基本原理、吸收器的类型和吸收的应用,以及 如何进行建模和计算。
吸收的定义和目的
1 定义
2 目的
吸收是一种分离技术,通过将一种气体或 蒸汽置于另一种稀释剂或溶液中,从而将 其中溶解的组分分离出来。
吸收的主要目的是去除气体和蒸汽中的污 染物质和有害化学物质,以及对溶液中有 用组分进行富集。
展望
未来的吸收技术仍将面临许多新挑战,如高质 量、低能耗、低成本、多功能、可重复利用、 小型化、智能化等方面的需求。
吸收过程的应用
烟气处理
吸收技术可应用于较小的氮氧 化物、二氧化硫和氯化氢排放 源的处理。
成分分离
可用于将有机物和无机物中有 用成分进行分离,一些医药工 业中可用于制备纯药物。
能源行业
使用吸收技术深度处理二氧化 碳,达到减排工作的目标。
吸收的基本原理
气液平衡
根据热力学原理,气体向易溶于液体的物质分子扩散,溶质向气态分子扩散。
吸收建模和计算
塔设计参数
如污染物浓度、填料形状、液气流速、进出口口径等参数,关键点是设计吸收塔的高度和塔 板数目。
质量传递系数的估算
可采用拟合法、直接平衡法、平衡理论法等方法进行计算。
吸收过程的模拟和优化
涉及塔内相和质量传递过程的动态及静态模拟、计算等方面。
吸收的应用和工程实例
吸收应用 烟气处理
质量传递
气体成分从气相Байду номын сангаас液相传递的速率与气液相的传质速率有关。
相互作用
液相吸收剂对气相中各组分有特定的物理和化学作用。
吸收器的类型
1
塔式吸收器
顶部进料,下部排出产物的装置,连续自动运行。
化工原理--吸收(课件版)

二、摩尔比
1.定义:
X
x 1
x
液相中溶质的摩尔数 液相中溶剂的摩尔数
Y
y 1
y
气相中溶质的摩尔数 气相中惰性气体的摩尔
数
2.摩尔比表示的亨利定律
由
X x 1 x
,
得
x X
,
1 X
Y y 1 y
y Y 1Y
代入 y* mx 得 Y * m X
1Y * 1 X
所以 mX (1 Y*) Y * (1 X )
所以
cA
f (T ,
p
A
)
或
p
A
f (T , cA )
溶解度曲线:表示该函数的曲线。(图2-2、图23、图2-4)
• 溶解度特性: T↑,cA↓
•
p
A
↑,cA↑
• 所以: 低温高压有利吸收
•
高温低压有利解(脱)吸
2-1-2 亨利定律
一、亨利定律:在一定的温度和压力(不太高)下, 稀溶液中溶质在气相中的平衡分压与其在液相 中的溶解度成正比,即:
二、分类 • 物理吸收,H2O吸收CO2 • 化学吸收,NaOH溶液吸收CO2
• 单组分吸收,H2O吸收乙醇 • 多组分吸收,液态烃吸收气态烃
• 等温吸收,H2O吸收丙酮 • 非等温吸收,H2O吸收SO3
• 低浓度吸收,氨水吸收SO2 • 高浓度吸收,H2O吸收NH3
三、用途 (1)回收混合气体中的有用物质,用硫酸吸收焦炉
代入
p
A
Ex
得
pA
L
EcAM S cA(MS
M A)
又
pA
cA H
得
1
EM S
化工原理下册 第二章吸收

0
20
40
60 80 pNH3/kPa
100
120
20
100
120
在相同条件下,NH3 在水中的溶解度较 SO2 大得多。 用水作吸收剂时,称 NH3 为易溶气体,SO2为中等溶解气体,溶解度更 小的气体则为难溶气体(如O2 在 30℃ 和溶质的分压为 40kPa 的条件下, 1kg 水中溶解的质量仅为 0.014g)。
溶解度曲线:
P*—x关系曲线:
直接反映了相平衡的本质,用于思考与分析问题 y—x关系曲线: 可方便地与物料衡算式等其它关系式一起对整个吸收过程进行数学描述
(一)平衡分压与溶解度的关系
氨在水中的溶解度 随氨分压的增大而
增大,随温度的降
低而增大。
结论:温度一定时,
溶质在溶剂中的溶 解度只取决于溶质 在气相中的分压。
度应迅速下降,平衡分压应迅速上升。这样,被吸收的气体容
易解吸,溶剂再生方便。
④溶剂的蒸汽压要低,不易挥发。一方面是为了减少溶剂在吸收 和再生过程的损失,另一方面也是避免在气体中引入新的杂质。 ⑤溶剂应有较好的化学稳定性,以免使用过程中发生变质。 ⑥溶剂应有较低的粘度,不易产生泡沫,以实现吸收塔内良好的 气液接触和塔顶的气液分离。 ⑦溶剂应尽可能满足价廉、易得、无毒、不易燃烧等经济和安 全条件。
单 组 分 吸 收 吸收 多 组 分 吸 收
3、按吸收过程有无温度变化分类: 吸 收
等温吸收 非 等 温 吸 收
4、按溶质组成高低分类: 低 组 成 吸 收 (0.1) 吸收
高 组 成 吸 收
低组成单组分等 温物理吸收过程
六、溶剂选择
吸收操作的成功与否在很大程度上决定于溶剂的性质,选择 吸收剂时一般应考虑以下几点: ①溶剂应对被分离组分(溶质)有较大的溶解度。处理一定 量混合气体所需溶剂量减少,气体中溶质的极限残余浓度亦可 降低。 ②溶剂对混合气体中其他组分的溶解度要小,即应具备较高 的选择性。若溶剂的选择性不高,将同时吸收混合物中的其他 组分,只能实现组分间某种程度的增浓而不能实现较为完全的 分离。 ③溶质在溶剂中的溶解度应对温度的变化比较敏感,即不仅在 低温下溶解度要大,平衡分压要小,而且随着温度升高,溶解
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
L y 2 x1 V
Z
y y2 V 1 K ya y m
K ya KGa P
y1 , y 2 , m , , V , y 2
(3)求 Z(吸收因数法)
V Z K ya
1 m V y1 y 2 ln 1 m V L x1 x 2 1 L
从液相推动力(c* -c)来分析:
增大吸收质在液相中的浓度c*,减小溶剂中吸收质的 浓度c,则有利于c或X的增大。 选择较大的溶解性吸收剂可提高c*,降低c,有利于c 或X的增大。
三、增大单位吸收传质面积 面积主要由设备来决定,对于填料塔,应该注意:
填料的选型,应尽量选比表面积大的填料。
流体的流动速度,增加流体的湍动程度,则可减小
滞流膜层的厚度。
对于易溶气体,KG约等于kG ,是气膜控制过程; 关键是
降低气膜层的厚度。增加气体总压,增加气流速度, 增大气相的湍动程度,则膜分系数增大,KY=P· kG 。 但是,气流速度应根据设备大小来考虑,不能超过液流 速度。
对于难溶气体,KL约等于kL ,是液膜控制过程: 关键是
Y=mX
3、最小气液比:
Y2*’
Y 2’ Y 1’ A
X1’ X2’
X 2 '-X V = * ' Y2 'Y1 L' min
' 1
ห้องสมุดไป่ตู้
B
4、填料层高度的求法: Z=HOG×NOG=HOL×NOL
(1)对数平均推动力法 Y=Y *-Y ,X X X *
(2)吸收因数法:
1 Y1 Y2* N OL= ln (1 A) A * 1 -A Y1 Y1
2.7 强化吸收过程的途径
从G=NA· Ω=KYY·Ω可以看出,影响吸收的主要因素:
KY、吸收推动力Y和相接触面积Ω 。
一、提高吸收总系数KY(或KG)或KX(或KL) 吸收过程的主要阻力集中在滞流膜上。要提高吸收 总系数,必须设法降低气膜和液膜的厚度。通过加大
2. 6 解 吸
一、概述
2. 6 解 吸
② 回收溶质,得到分离后气体。
1、作用: ①吸收剂的再生,以便循环使用; 2、解吸常用的方法:
压力低,温度高,有利于脱吸
• 加热溶液(加热解吸),增大溶液中溶质的平衡分压 • 用水蒸汽(气提),加热、降低气相中溶质的分压; 适用于溶质为不凝性气体,或溶质冷凝液不溶于水 • 通惰性气体(惰性气体气提),降低操作压力,主要
mV L
按前述计算结果代入即可。
(1)
y2 1 y1 1 0.950.05 0.0025 10005.78 3.17 c s m m HP M s HP 18101.3 L y y2 y1 y2 0.05 0.0025 1.5 1 1 . 5 1 . 5 4.517 * y 0 . 05 V x1 x2 1 0 m 3.17 V 1 0.05 0.0025 0.0105 x1 y1 y2 L 4.517
降低液膜厚度。提高吸收剂的流速,增大液相的湍流 程度,使液膜分系数增大,KX约等于c· kL 。
溶解度适中的气体,其吸收速度由两个膜控制,同时 增大气相和液相流速,增大两相的湍动程度,从而减
小两膜的厚度。
二、增大吸收推动力Y或X
从气相推动力(p – p* )来分析: 增大吸收质的分压p,减小吸收质平衡分压p* , 有利于 p或Y 增大。 选择较大的溶解性吸收剂,操作温度较低,可以降低 p* ;增大气体总压可以提高分压p 。
K y a K G aP 1.1kmol m 2 h 1 at m1 93m 2 m 3 1at m 102.3kmol m 3 h 1
* y1 y1 y1 y1 m x1 0.05 3.17 0.0105 0.0167 * y2 y2 y2 y2 0.0025
径0.8m,填料单位有效传质面积a=93m2· m-3,吸 收系数KG=1.1kmol· m-2· h-1· atm-1。取吸收剂用量 为最小用量的1.5倍。该塔在30℃和101.3kPa压力 下操作,在操作条件下的平衡关系为p*=5.78c kPa,
试求:(已知吸收为逆流吸收过程。)
(1)出塔溶液浓度x1; (2)用平均推动力法求填料层高度Z; (3)用吸收因数法求Z。
y y2 L 1 V x1 x 2
y1 y 2 或 y 2 1 y1 y1 y1 y 2 L L 1.5 1 .5 V y1 / m x 2 V min
y1
x1
m
s E P Ms H P
解题过程是由已知到未知。即求出 m (2)求 Z(平均推动力法)
增大气液分散度,液体喷淋均匀,填料充分润湿, 保证上升气泡和液层充分接触,达到传质目的。 采用湍流塔,促使气液充分湍动,两相接触面不 断更新,扩大了接触面积。
【例2-4】在填料塔中用清水吸收氨与空气的混合气 中的氨。混合气流量为1500标m3· h-1,氨所占体
积分率为5%,要求氨的回收率达95%。已知塔内
首先列出已知条件,并用公式符号和标准单位表达出来。
此题中: x 2 0 , y1 0.05 , V 1500 22.4 67 kmol h 1
思路就是由所求目标推至已知条件。 (1)求 x1
y2
x2 L
0.95 , a 93m 2 m -3 , H 1 / 5.78 m kN kmol 1 V
用于吸收剂的再生,不能直接得到纯净的溶质组分。
二 、解吸塔的计算
解吸过程的操作线总是在平衡线的下方,
解吸过程的推动力是吸收的相反值。 1、物料衡算:
V ' (Y Y ) L' ( X X )
' 2 ' 1 ' 2 ' 1
' V' X '-X 1 = 2、操作线方程: L' Y 'Y1'
