EDTA滴定法操作流程
稀土母液浓度edta滴定法试验步骤

稀土母液浓度edta滴定法试验步骤操作步骤
(1)试样的制备
①一般样品不需预处理。
如样品中存在大量微小颗粒物,需在采样后尽快经0.45 μm孔径滤膜过滤。
样品经过滤,可能有少量钙和镁被滤除。
②试样中钙和镁总量超出3.6 mmol/L时,应稀释至低于此浓度,记录稀释因子F。
③如试样经过酸化保存,可用计算量的氢氧化钠溶液中和。
计算结果时,应把样品或试样由于加酸或碱的稀释考虑在内。
(2)测定
①用移液管吸取50.0 ml试样于250 ml锥形瓶中,加4 ml缓冲溶液和3滴铬黑T指示剂溶液或约50~100 mg指示剂干粉,此时溶液应呈紫红或紫色,其pH值应为10.0 ±0.1。
②为防止产生沉淀,应立即在不断振摇下,自滴定管加入EDTA二钠溶液,开始滴定时速度宜稍快,接近终点时应稍慢,并充分振摇,最好每滴间隔2~3s,溶液的颜色由紫红或紫色逐渐转变蓝色,在最后一点紫的色调消失,刚出现天蓝色时即为终点,整个滴定过程应在5 min内完成。
③在临滴定前加入250 mg氰化钠或数毫升三乙醇胺掩蔽。
氰化物使锌、铜、钴的干扰减至最小。
加氰化物前必须保证溶液呈碱性。
④试样如含正磷酸盐和碳酸盐,在滴定的pH条件下,可能使钙生
成沉淀,一些有机物可能干扰测定。
如上述干扰未能消除,或存在铝、钡、铅、锰等离子干扰时,需改用火焰原子吸收法或等离子发射光谱法测定。
钙离子的测定——EDTA滴定法

钙离子的测定——EDTA 滴定法本方法适用于循环冷却水和天然水中钙离子的测定。
1.0 原理钙黄绿素能与水中钙离子生成莹光黄绿色络合物,在PH >12时,用EDTA 标准溶液滴定钙,当接近终点时,EDTA 夺取与指示剂结合的钙,溶液莹光黄绿色消失,呈混合指示剂的红色,即为终点。
2.0 试剂2.1 1+1盐酸溶液2.2 20%氢氧化钾溶液。
2.3 钙黄绿素酚酞混合指示剂称取钙黄绿素酚酞置于研钵中,再加入20g 氯化钾,研细混匀,贮于广口瓶中。
2.4 LEDTA 标准溶液3.0 仪器3.1 滴定管:25mL3.2 移液管:5mL4.0 分析步骤吸取经中速滤纸干过滤的水样50mL ,移入250mL 锥形瓶中,加1+1盐酸3滴,混匀,加热煮沸半分钟,冷却至50℃以下加5mL20%氢氧化钾溶液,再加约80mg 钙黄绿素酚酞混合指示剂,用LEDTA 标准溶液滴定至莹光黄绿色消失,出现红色即为终点。
5.0 分析结果的计算水样中钙离子含量X (毫克/升,以CaCO3计),按下式计算:X=WV M V 10008.100⨯⨯⨯式中: V ——滴定时EDTA 标准溶液消耗体积,毫升;M ——EDTA 标准溶液浓度,摩尔/升;Vw ——水样体积,毫升;——碳酸钙摩尔质量,克/摩尔。
6.0 注释6.1 若测定时有轻度返色,可滴至不返色为止。
6.2 若返色严重可用慢速滤纸对水样进行“干过滤”。
6.3 也可采用钙指示剂或紫脲酸铵作指示剂。
7.0 允许差水中钙离子含量在500mg/L (以CaCO3计)时,平行测定两结果差不大于2mg/L 。
8.0 结果表示取平行测定两结果算术平均值,作为水样的钙离子含量。
EDTA滴定法测定硫酸根

EDTA 滴定法测定硫酸根实验操作说明EDTA滴定法测定硫酸根1.主要仪器和试剂瓷蒸发皿,带刻度的250mL;锥形瓶25mL;酸式滴定管;刚果红试剂或广泛P H 试纸;马弗炉;盐酸:(1+49);EDTA标准溶液(约0.01mol/L):称取3.72g二胺四乙酸二钠溶于水中,移入1000mL容量瓶中,加蒸馏水稀释到标线。
锌标准溶液标定:精确称取0.6538g纯锌,溶于(1+1)盐酸中(6mL),待其全部溶解后移入1000mL容量瓶中,用水稀释至刻度,即为0.1 OOmol/L锌标准溶液。
吸取此溶液25.00mL置于锥形瓶中,加入75mL水及10mL氨一氯化铵缓冲液,3滴5%铬黑T指示剂,摇匀后,用EDTA标准溶液滴至溶液由紫红色变为蓝色为终点。
记录用量,用下式计算其浓度:C =C,V,/V.(1)式中:Cl--- EDTA标准溶液浓度(mol/L);Vl---消耗EDTA标准溶液体积(mL);c2---锌标准溶液浓度(mol/L);V2---锌标准溶液体积(mL)。
氨---氯化铵缓冲溶液:称取20g氯化铵,溶于500mL水中,加l00mL浓氨水,用水稀释至l000rnL,得pH=l0的缓冲溶液。
5%铬黑T指示剂:称取0.5g铬黑T,溶于lOOmL水中,储存于棕色瓶中,紧塞备用。
钡、镁混合液:称取3.05g氯化钡(BaC1,-2H,O)和2.5g氯化镁(MgC1,·6H,O)溶于100mL水中,移入1000mL容量瓶中,用水稀释至刻度,此溶液浓度(Mg2 + +Ba2+ )= 0.025mol /L。
(1+1)盐酸:优级纯,其他试剂为分析纯,实验用水为去离子水。
2、实验方法(1)称取草酸样品1 0g(精确到0.0002g)于已干燥的蒸发皿中,在马弗炉200℃灼烧约2h至草酸全部挥发,加入少许水,转移至250mL锥形瓶中,加水至50mL,滴加(1+1)盐酸,使刚果红试纸由红变蓝色(或调节pH到4左右),加热煮沸l一2min,以除去二氧化碳。
EDTA测定各种金属离子的方法 汇总

EDTA是目前最常用的测定各类金属离子的络合滴定剂,大部分金属离子可以直接滴定其含量,少部分由于动力学原因需要借助返滴定或置换滴定测定。
下面我们将对于实验室常见的15种金属离子的EDTA滴定法进行整理。
金属离子如未特殊说明,默认配制成酸性的0.02 mol·L-1的标准溶液,每组测定取25.00 mL。
准确加入意味着需要准确知道溶液的浓度和体积。
1. 镁、钙稀释溶液体积至100 mL,加入10 mL氨性缓冲溶液(6.75 g氯化铵、57 mL氨水定容至100 mL),加入铬黑T(钙镁均可)或钙指示剂(仅限钙),滴定至终点溶液颜色由紫红色变为天蓝色。
注意事项:镁存在下测定钙时,用氢氧化钠调节pH使镁沉淀,此时应增加溶液体积,减少氢氧化镁沉淀对钙指示剂的吸附。
2. 铝(返滴定或置换滴定)稀释溶液体积至100 mL,准确加入过量EDTA标准溶液,再加入15 mL醋酸缓冲溶液(60 g醋酸钠、2 mL冰乙酸定容至100 mL),加热煮沸3 min,加入PAN指示剂,用Cu2+标准溶液滴定至终点溶液颜色变为紫红色。
加入1~2 g氟化钠后煮沸,再用Cu2+标准溶液滴定至终点溶液颜色变为紫红色。
注意事项:通常采用第二步置换滴定测得的结果。
3. 锰(II)稀释溶液体积至100 mL,用氨水(1+1)调节pH到10,再加入25 mL 氨性缓冲溶液(6.75 g氯化铵、57 mL氨水定容至100 mL),加入K-B混合指示剂,滴定至终点溶液颜色由紫红色变为纯蓝色。
注意事项:高价锰可用盐酸羟胺还原后测定。
4. 铁(III)用盐酸(1+1)调节pH到2,水浴加热至60℃,加入Ssal指示剂,滴定至终点溶液颜色由紫红色变为无色或淡黄色。
注意事项:二价铁可用过氧化氢氧化至三价后测定。
pH需在1.3 ~ 2之间,太低络合不定量,太高铁离子水解沉淀。
5. 钴(II)(返滴定)准确加入过量EDTA标准溶液,再加入10 mL醋酸缓冲溶液(20 g醋酸钠、2.6 mL冰乙酸定容至100 mL),稀释溶液体积至100 mL,加入PAN 或二甲酚橙,用Cu2+标准溶液或Zn2+标准溶液滴定至终点溶液颜色变为紫红色。
EDTA滴定法操作步骤及检测方法

EDTA滴定法操作步骤及检测方法一、目的和使用范围本试验方法使用于在工地快速测定水泥石灰稳定土中的水泥和石灰的剂量,并可用以检查拌和的均匀性。
二、仪器设备1、滴定管(酸式)50ml,一支。
2、滴定台,一个。
3、滴定管夹,一个。
4、大肚移液管:10ml,10支。
5、锥形瓶:200ml,20个。
6、烧杯:2000ml(或1000ml),1只;300ml,10只。
7、容量瓶:1000ml,1个。
8、玻璃棒。
9、量筒:100ml和5ml各一个;50ml2个。
10、搪瓷杯:容量大于1200ml,10只。
11、棕色广口瓶:60ml,1只(装钙红)12、托盘天平:60ml,1只13、秒表1只14、表面皿直径9㎝,10个。
15、研体:直径12—13cm。
16、土样筛:筛孔2.0mm或2.5mm,一个.17、洗耳球:(1两或2两)1个。
18、精密试纸:PH12—14。
19、聚乙烯桶20L,1个(装蒸馏水);10L,2个(装氯化铵及EDTA二钠标准液);5L,1个(装氢氧化钠)。
20、毛刷、去污粉、吸水管、塑料勺、特种铅笔、厘米纸。
21、洗瓶(塑料)500ml,1只。
三、试剂1、0.1mol/m3乙二胺四乙酸二钠(简称EDTA二钠)标准液:准确称取EDTA二钠(分析纯)37.226g,用微热的无二氧化碳蒸馏水溶解,待全部溶解并冷至室温后,定容至1000ml。
2、10%氯化铵溶液:将500克氯化铵(分析纯或化学纯)放在10L的聚乙烯桶内,加蒸馏水4500Ml,充分振荡,使氯化铵完全溶解。
也可以分批在1000ml的烧杯内配制,然后放入塑料桶内摇匀。
3、1.8%氢氧化钠(内含三乙醇胺)溶液:用100克架盘天平称18克氢氧化钠,放入洁净干燥的1000mL烧杯中,加1000mL蒸馏水使其全部溶解,待溶液冷至室温后,加入2mL三乙醇胺(分析纯),搅拌均匀后储于塑料桶中。
4、钙红指示剂:将0.2克钙试剂羟酸钠与20克预先在105℃烘箱中烘1h的硫酸钾混合。
EDTA标准溶液配制、标定(方便操作版)

EDTA标准滴定溶液标定及水硬度测定一、目的要求1.了解EDTA标准溶液标定的原理。
2.掌握配制和标定EDTAB标准溶液的方法。
二.仪器1.1 50mL 滴定管一支1.2 50mL 移液管一支1.3 250mL 容量瓶一只1.4 250mL 锥形瓶三只1.5 25mL 量筒一只1.6 50mL 烧杯一只1.7 10cm 表面皿一块三、原理乙二胺四乙酸二钠盐(习惯上称EDTA)是一种有机络合剂,能与大多数金属离子形成稳定的1∶1螯合物,常用作配位滴定的标准溶液。
EDTA在水中的溶解度为120g/L,可以配成浓度为0.3mol/L以下的溶液。
EDTA 标准溶液一般不用直接法配制,而是先配制成大致浓度的溶液,然后标定。
用于标定EDTA标准溶液的基准试剂较多,例如Zn、ZnO、CaCO3、Bi、Cu、MgSO4·7H2O、Ni、Pb等。
用氧化锌作基准物质标定EDTA溶液浓度时,以铬黑T作指示剂,用pH=10的氨缓冲溶液控制滴定时的酸度,滴定到溶液由紫色转变为纯蓝色,即为终点。
四、试剂1. 称取3.7g乙二胺四乙酸二钠盐(Na2H2Y·2H2O,相对分子量372.2)加热溶解后稀释至1升,储于聚乙烯塑料瓶中。
2.氨水-氯化铵缓冲液(pH=10):称取5.4g氯化铵,加适量水溶解后,加入35mL 氨水,再加水稀释至100mL。
3.铬黑T指示剂:称取0.1g铬黑T,加入10g氯化钠,研磨混合。
4.40%氨水溶液:量取40mL氨水,加水稀释至100mL。
5.氧化锌(基准试剂)。
6.盐酸五、步骤1. 0.01mol ·L -1EDTA 溶液的配制称取乙二胺四乙酸二钠盐(Na 2H 2Y ·2H 2O )4g ,加入1000mL 水,加热使之溶解,冷却后摇匀,如混浊应过滤后使用。
置于玻璃瓶中,避免与橡皮塞、橡皮管接触。
贴上标签。
2. 锌标准溶液的配制准确称取约0.16g 于800℃灼烧至恒量的基准ZnO ,置于小烧杯中,加入0.4mL 盐酸,溶解后移入200mL 容量瓶,加水稀释至刻度,混匀。
EDTA滴定的原理与操作

EDTA滴定的原理与操作1.简述EDTA滴定的原理与操作。
2.如何配置EDTA溶液?3.如何用EDTA滴定法测定水的硬度?镁的检测可以用EDTA滴定法分析。
由于镁比铝轻,因此可以作为合金在航空、航天上使用。
另外利用镁易于氧化的性质,可用于制造许多纯金属的还原剂。
也可用于闪光灯、吸气器等。
测定水的总硬度就是测定水中钙、镁离子的总含量,可用EDTA配位滴定法测定:滴定前:M + EBT M-EBT(红色)主反应:M + Y MY终点时:M-EBT + Y MY + EBT(红色) (蓝色)滴定至溶液由红色变为蓝色时,即为终点。
滴定时,Fe3+、Al3+等干扰离子可用三乙醇胺予以掩蔽;Cu2+、Pb2+、Zn2+等重属离子,可用KCN、Na2S或巯基乙酸予以掩蔽。
水的硬度有多种表示方法,本实验要求以每升水中所含Ca2+、Mg2+总量(折算成CaO的质量)表示,单位mg·L-1。
器材和药品1.器材天平(0.1g、0.1mg),容量瓶(100mL),移液管(20mL),酸式滴定管(50mL),锥形瓶(250mL)等。
2.药品HC1(1∶1),乙二胺四乙酸二钠(Na2H2Y·2H2O,A.R.),碱式碳酸镁[Mg(OH)2·4MgCO3·6H2O,基准试剂],NH3-NH4Cl缓冲溶液(pH=10.0),三乙醇胺(1∶1),铬黑T指示剂(0.2%氨性乙醇溶液)等。
实验方法一、Mg2+标准溶液的配制(约0.02mol·L-1)准确称取碱式碳酸镁基准试剂0.2~0.25g,置于100mL烧杯中,用少量水润湿,盖上表面皿,慢慢滴加1∶1 HC1使其溶解(约需3~4mL)。
加少量水将它稀释,定量地转移至100mL容量瓶中,用水稀释至刻度,摇匀。
其浓度计算:二、EDTA标准溶液的配制与标定1.EDTA标准溶液的配制(约0.02mol·L-1)称取2.0g乙二胺四乙酸二钠(Na2H2Y·2H2O)溶于250mL蒸馏水中,转入聚乙烯塑料瓶中保存。
(完整版)EDTA测定各种金属离子的方法汇总

EDTA是目前最常用的测定各类金属离子的络合滴定剂,大部分金属离子可以直接滴定其含量,少部分由于动力学原因需要借助返滴定或置换滴定测定。
下面我们将对于实验室常见的15种金属离子的EDTA滴定法进行整理。
金属离子如未特殊说明,默认配制成酸性的0.02 mol·L-1的标准溶液,每组测定取25.00 mL。
准确加入意味着需要准确知道溶液的浓度和体积。
1.镁、钙稀释溶液体积至100 mL,加入10 mL氨性缓冲溶液(6.75 g氯化铵、57 mL氨水定容至100 mL),加入铬黑T(钙镁均可)或钙指示剂(仅限钙),滴定至终点溶液颜色由紫红色变为天蓝色。
注意事项:镁存在下测定钙时,用氢氧化钠调节pH使镁沉淀,此时应增加溶液体积,减少氢氧化镁沉淀对钙指示剂的吸附。
2.铝(返滴定或置换滴定)稀释溶液体积至100 mL,准确加入过量EDTA标准溶液,再加入15 mL醋酸缓冲溶液(60 g醋酸钠、2 mL冰乙酸定容至100 mL),加热煮沸3 min,加入PAN指示剂,用Cu2+标准溶液滴定至终点溶液颜色变为紫红色。
加入1~2 g氟化钠后煮沸,再用Cu2+标准溶液滴定至终点溶液颜色变为紫红色。
注意事项:通常采用第二步置换滴定测得的结果。
3.锰(II)稀释溶液体积至100 mL,用氨水(1+1)调节pH到10,再加入25 mL氨性缓冲溶液(6.75 g氯化铵、57 mL氨水定容至100 mL),加入K-B混合指示剂,滴定至终点溶液颜色由紫红色变为纯蓝色。
注意事项:高价锰可用盐酸羟胺还原后测定。
4.铁(III)用盐酸(1+1)调节pH到2,水浴加热至60℃,加入Ssal指示剂,滴定至终点溶液颜色由紫红色变为无色或淡黄色。
注意事项:二价铁可用过氧化氢氧化至三价后测定。
pH需在1.3 ~ 2之间,太低络合不定量,太高铁离子水解沉淀。
5.钴(II)(返滴定)准确加入过量EDTA标准溶液,再加入10 mL醋酸缓冲溶液(20 g醋酸钠、2.6 mL冰乙酸定容至100 mL),稀释溶液体积至100 mL,加入PAN或二甲酚橙,用Cu2+标准溶液或Zn2+标准溶液滴定至终点溶液颜色变为紫红色。
氧化钙的测定—EDTA滴定法

称取约0.5g 试样(m ),精确至0.0001g ,置于铂坩埚中,将盖斜置于坩埚上,在950℃~1000℃下灼烧5分钟,取出坩埚冷却。
用玻璃棒仔细压碎块状物,加入(0.30±0.01)g 已磨细的无水碳酸钠,仔细混匀。
再将坩埚置于950℃~1000℃下灼烧10分钟,取出坩埚冷却。
将烧结块移入瓷蒸发皿中,加入少量水润湿,用平头玻璃棒压碎块状物,盖上表面皿,从皿口慢慢加入5ml 盐酸及2~3滴硝酸,待反应停止后取下表面皿,用平头玻璃棒压碎块状物使其分解完全,用热盐酸(1+1)清洗坩埚数次,洗液合并于蒸发皿中。
将蒸发皿置于蒸汽水浴上,皿上放一玻璃三角架,再盖上表面皿。
蒸发至糊状后,加入约1g 氯化铵,充分搅匀,在蒸汽水浴上蒸发至干后继续蒸发10分钟~15分钟。
蒸发期间用平头玻璃棒仔细搅拌并压碎大颗粒。
取下蒸发皿,加入10ml ~20ml 热盐酸(3+97),搅拌使可溶性盐类溶解。
用中速定量滤纸过滤,用胶头擦棒擦洗玻璃棒及蒸发皿,用热盐酸(3+97)洗涤沉淀3~4次,然后用热水充分洗涤沉淀,直至检验无氯离子为止。
滤液及洗液收集于250ml 容量瓶中。
将沉淀连同滤纸一并移入铂坩埚中,将盖斜置于坩埚上,在电炉上干燥,灰化完全后,放入950℃~1000℃的高温炉内灼烧60分钟,取出坩埚置于干燥器中,冷却至室温,称量。
反复灼烧,直至恒重。
向坩埚中慢慢加入数滴水润湿沉淀,加入3滴硫酸(1+4)和10ml 氢氟酸,放入通风橱内电热板上缓慢加热,蒸发至干,升高温度继续加热至三氧化硫白烟完全驱尽。
将坩埚放入950℃~1000℃的高温炉内灼烧30分钟,取出坩埚置于干燥器中,冷却至室温,称量。
反复灼烧,直至恒量。
向上述经过氢氟酸处理后得到的残渣中加入0.5g 焦硫酸钾,在喷灯上熔融,熔块用热水和数滴盐酸(1+1)溶解,溶液合并入按3.1分离二氧化硅后得到的滤液和洗液中。
用水稀释至标线,摇匀,记为溶液A 。
从溶液A 中吸取25.00ml 溶液放入300ml 烧杯中,加水稀释至约为200ml 。
EDTA滴定法操作步骤及检测方法(精)

EDTA滴定法操作步骤及检测方法一、目的和使用范围本试验方法使用于在工地快速测定水泥石灰稳定土中的水泥和石灰的剂量,并可用以检查拌和的均匀性。
二、仪器设备1、滴定管(酸式)50ml,一支。
2、滴定台,一个。
3、滴定管夹,一个。
4、大肚移液管:10ml,10支。
5、锥形瓶:200ml,20个。
6、烧杯:2000ml(或1000ml),1只;300ml,10只。
7、容量瓶:1000ml,1个。
8、玻璃棒。
9、量筒:100ml和5ml各一个;50ml2个。
10、搪瓷杯:容量大于1200ml,10只。
11、棕色广口瓶:60ml,1只(装钙红)12、托盘天平:60ml,1只13、秒表1只14、表面皿直径9㎝,10个。
15、研体:直径12—13cm。
16、土样筛:筛孔2.0mm或2.5mm,一个.17、洗耳球:(1两或2两)1个。
18、精密试纸:PH12—14。
19、聚乙烯桶20L,1个(装蒸馏水);10L,2个(装氯化铵及EDTA二钠标准液);5L,1个(装氢氧化钠)。
20、毛刷、去污粉、吸水管、塑料勺、特种铅笔、厘米纸。
21、洗瓶(塑料)500ml,1只。
三、试剂1、0.1mol/m3乙二胺四乙酸二钠(简称EDTA二钠)标准液:准确称取EDTA二钠(分析纯)37.226g,用微热的无二氧化碳蒸馏水溶解,待全部溶解并冷至室温后,定容至1000ml。
2、10%氯化铵溶液:将500克氯化铵(分析纯或化学纯)放在10L的聚乙烯桶内,加蒸馏水4500Ml,充分振荡,使氯化铵完全溶解。
也可以分批在1000ml的烧杯内配制,然后放入塑料桶内摇匀。
3、1.8%氢氧化钠(内含三乙醇胺)溶液:用100克架盘天平称18克氢氧化钠,放入洁净干燥的1000mL烧杯中,加1000mL蒸馏水使其全部溶解,待溶液冷至室温后,加入2mL三乙醇胺(分析纯),搅拌均匀后储于塑料桶中。
4、钙红指示剂:将0.2克钙试剂羟酸钠与20克预先在105℃烘箱中烘1h的硫酸钾混合。
(完整版)EDTA滴定法

——EDTA滴定法本方法适用于循环冷却水和天然水中总硬度的测定。
1.原理在pH=10时,乙二胺四乙酸二钠(简称EDTA)和水中的钙镁离子生成稳定络合物,指示剂铬黑T也能与钙镁离子生成葡萄酒红色络合物,其稳定性不如EDTA与钙镁离子所生成的络合物,当用EDTA滴定接近终点时,EDTA自铬黑T的葡萄酒红色络合物夺取钙镁离子而使铬黑T指示剂游离,溶液由酒红色变为兰色,即为终点。
其反应如下:Mg2++Hlnd2- Mglnd-+H+Mglnd-+H2Y2- MgY2-+H++Hlnd2-Ca2++Hlnd2- Calnd-+H+Calnd-+H2Y2- CaY2-+H++Hlnd2-式中Hlnd2-——铬黑T指示剂(蓝色);Mglnd-——镁与铬黑T的络合物(酒红色);H2Y2-——乙二胺四乙酸离子(无色)。
2.试剂2.1 6mol/L盐酸溶液。
2.2 10%氨水:量取440mL氨水,稀释至1000mL。
2.3 1+1三乙醇胺溶液2.4 铬黑T指示剂称取0.5g铬黑T和4.5g盐酸羟胺,溶于100mL95%乙醇中,储于棕色瓶中。
2.5 pH=10氨-氯化铵缓冲溶液。
称取54g氯化铵,溶于200mL水中,加350mL氨水,用水稀释1000mL。
2.6 0.01mol/L EDTA标准溶液。
2.6.1 配制称取乙二胺四乙酸二钠(C10H14O8N2Na2•2H2O)3.72g溶于1000mL水中,摇匀。
2.6.2 标定称取0.2g于800℃灼烧至恒重的基准氧化锌(称重至0.0002g)。
用少许水湿润,加2mL 6mol/L盐酸溶液至样品溶解,移入250mL容量瓶中,稀释至刻度。
吸取此溶液20mL,移入250mL锥形瓶中,加30mL水,用10%氨水中和至pH7~8(稍有氨味),加5mL氨一氯化铵缓冲溶液,加2~4滴铬黑T指示剂,用EDTA 溶液滴定至溶液由酒红色变为天蓝色。
同时做空白试验。
2.6.3 计算EDTA标准溶液摩尔浓度M(摩尔/升),按下式计算:式中:G——氧化锌的重量,克;V1—— EDTA溶液的用量,毫升;V 0 ——空白试验EDTA溶液用量,毫升;81.39——氧化锌摩尔质量,克/摩尔。
EDTA滴定法测定钴的操作规程

EDTA滴定法测定钴
1. 试剂
六次甲基四胺
盐酸(1+1)
氨水(1+1)
对硝基酚指示液(1g/L) :
称取0.10g 对硝基酚, 溶于100m l 乙醇中。
二甲酚橙指示剂(0.5% )
孔雀石绿溶液(2g/L) :
称取0.20g 孔雀石绿, 溶于水, 稀释至100m l。
乙二胺四乙酸二钠(EDTA)标准溶液(0.05mol/L) :
称取37.2gEDTA二钠,定容于2000ml容量瓶中,摇匀。
2. 测定
移取0.5ml钴溶液于250ml锥形瓶加入约50ml水再加入2滴对硝基酚指示剂,用氨水(1+1) 调至溶液刚好变成黄绿色,再加入盐酸(1+1)至黄绿色刚好消失并过量4滴,加六次甲基四胺一勺,于电炉上加热至近沸。
取下加3滴孔雀石绿溶液,加二甲酚橙4滴,趁热用EDTA标准溶液滴定至溶液变为亮绿色即为终点。
3.计算公式
C(mg/L)=
5.0
93 . 58
05
.0⨯
⨯
EDTA
V。
EDTA滴定法测水泥剂量计算

EDTA滴定法测水泥剂量计算EDTA(乙二胺四乙酸)滴定法是一种常用于测定水泥中含有的金属离子浓度的方法。
在测定过程中,EDTA与金属离子形成稳定的络合物,通过滴定剂的加入和指示剂的变色反应来确定金属离子的浓度。
本文将详细介绍EDTA滴定法测水泥剂量的计算方法。
首先,选择悬浮液和适量的水泥样品进行试验。
通常情况下,将水泥样品与硝酸一起煮沸,用硝酸进行消解和稀释,然后用去离子水稀释至一定体积,制备成测定所需的水泥悬浮液。
接下来,准备EDTA的滴定剂。
将适量的EDTA溶解在含有柠檬酸和氯化铵的溶液中,并用去离子水稀释至一定体积。
然后,准备指示剂。
常用的指示剂是Eriochrome Black T(EBT),它与金属离子形成稳定的红色络合物。
将EBT溶解在溶液中,并用去离子水稀释至一定浓度。
在进行滴定之前,先测定指示剂的滴定容量。
将适量的EBT溶液与硫酸进行反应,然后用去离子水稀释至一定体积。
将该溶液滴加到试管中,再加入几滴EDTA,观察溶液的颜色变化。
当溶液由红色变为蓝色时,说明EBT已经溶解。
根据溶液的颜色变化,可以计算出EBT的滴定容量。
开始滴定之前,将适量的水泥悬浮液取出一定体积,用去离子水稀释至一定体积,通常为200mL。
然后,加入适量的盐酸和柠檬酸,以分解水泥样品中的金属离子。
将一定量的滴定剂(通常为10-30mL)滴入水泥悬浮液中,轻轻摇匀,并等待指示剂的颜色变化。
当溶液的颜色由蓝色变为红色时,表示金属离子与EDTA形成络合物的终点已经达到。
记录滴定剂的滴定体积。
根据EDTA的摩尔浓度、滴定剂的滴定体积和水泥样品的体积,可以计算出水泥样品中金属离子的浓度。
计算公式如下:[C]=(V/V0)*M其中,[C]表示金属离子的浓度,V表示滴定剂的滴定体积,V0表示滴定剂的摩尔浓度,M表示水泥样品的体积。
根据实验所得的数据,可以计算水泥样品中金属离子的浓度。
此外,还可以通过反推,确定所用水泥样品中金属离子的含量。
硫酸根的测定——EDTA滴定法

硫酸根的测定——EDTA滴定法本方法适用于循环冷却水和天然水中硫酸根离子的测定,水样中硫酸根含量大于200mg/L时,可进行适当稀释。
1.0 原理水样中加入氯化钡,与硫酸根生成硫酸钡沉淀。
过量的钡离子在氯化镁存在下,以铬黑T为指示剂,用EDTA滴定。
2.0 试剂2.1 1+1盐酸溶液。
2.2 0.5%铬黑T乙醇溶液(同总硬度的测定)2.3 氨-氯化铵缓冲溶液(PH=10.3)2.4 0.0125mol/L氯化钡溶液称取3.054g氯化钡(BaCl2·2H2O)溶于100mL水中,移入1000mL溶量瓶中,稀释至刻度。
2.5 0.01mol/L氯化镁溶液的配制称取2.1g氯化镁(MgCl2·6H2O)溶于少量水中,移入1000mL容量瓶中,稀释至刻度。
2.6 0.01mol/LEDTA标准溶液3.0 仪器3.1 滴定管:酸式25mL。
3.2 电炉。
4.0 分析步骤4.1 水样的测定吸取经中速滤纸干过滤的水样50mL于250mL锥形瓶中,加入三滴1+1盐酸,在电炉上加热微煮半分钟,再加入10mL0.0125mol/L氯化钡溶液,微沸半分钟,再加入10mL0.0125mol/L氯化钡溶液,微沸10分钟,冷却10分钟后,加入5mL0.01mol/L氯化镁溶液,10mL氨-氯化铵缓冲液,6-10滴铬黑T指示剂,用0.01mol/LEDTA标准溶液滴定,溶液从酒红色至纯蓝色为终点。
4.2 水中硬度的测定吸取经中速滤纸干过滤后水样50mL,加10mL氨-氯化铵缓冲溶液,6~10滴铬黑T指示剂,用0.01mol/LEDTA标准溶液滴定至纯蓝色。
4.3 氯化钡、氯化镁消耗EDTA标准溶液的体积。
准确吸取10mL 0.0125mol/L 氯化钡溶液,5mL0.01mol/L氯化镁溶液于250mL锥形瓶中,加水50mL,再加入10mL氨-氯化铵缓冲溶液及6-10滴铬黑T指示剂,用0.01mol/LEDTA标准溶液滴至纯蓝色。
EDTA滴定法测定 2

EDTA滴定法测定铅方法基于使铅生成硫酸铅沉淀于其它元素分离,然后将硫酸铅转化成为醋酸铅,在PH5.5-6的醋酸—醋酸钠缓冲溶液中,以二甲酚橙为指示剂,用EDTA 标准溶液滴定。
试剂配制醋酸—醋酸钠缓冲溶液:取200g结晶乙酸钠,用水溶解后,加入10ml冰乙酸,用水稀释到1000ml。
EDTA标准溶液:称取EDTA3.35g于250ml烧杯中,加水150ml,加热溶液,冷却后移入1000容量瓶中,用水稀释至刻度。
此次溶液的浓度约为0.009mol/L。
铅标准溶液:称取2.0000g金属铅(99.99%)于400ml烧杯中,加入硝酸(1+1)20ml,加热溶解,冷却后移入1000ml容量瓶中,以水稀释到刻度,摇匀。
此溶液为2mg/ml铅。
标定:吸取铅标准溶液20ml于250ml烧杯中,加甲基橙指示剂一滴,用氨水(1+1)中和使溶液由橙红色到刚好显黄色,加入缓冲溶液25ml,加水50ml,加二甲酚橙指示剂一滴,用EDTA标准溶液滴定至溶液由酒红色到亮黄色即为终点。
同时做空白试验。
计算:mF =V-V0F EDTA标准溶液对铅的滴定度,mg/mlm 吸取铅标准溶液中铅的质量,mg;V 滴定消耗EDTA标准溶液的体积。
ml;V0空白试验消耗EDTA标准溶液的体积,ml ;分析步骤称取试样0.2~0.5g于250ml烧杯中,加氟化钠0.5g(试样含硅量低时可以不加)加盐酸12~15ml;于低温加热溶解,当蒸发至约5ml左右时加硝酸7~10ml,继续加热数分钟,稍冷,加入0.3~0.5氯酸钾(试样中不含碳时可不加)加热使有机物完全氧化,加30ml硫酸(1+1),蒸发至冒三氧化硫浓烟保持5min,取下冷去。
以水冲洗杯壁,加水50ml,加10%酒石酸溶液10ml(试样中不含锑铋时可不加)加热煮沸数分钟使可溶性硫酸盐溶解,取下流水冷却静止40~60min(或在室温静止三小时),在带有滤纸的浆或脱脂棉的漏斗上过滤,用2%的硫酸溶液冲洗烧杯及其沉淀无Fe+3反应(用10%硫氰酸铵检查),用水洗烧杯和沉淀2—3次或用乙醇(1+4)洗1—2次,将沉淀和滤纸一同移入原烧杯中,加水25ml,加醋酸—醋酸钠缓冲溶液25ml,加热煮沸3—5min,取下冷却,加入2ml200g/LKF 溶液,加二甲酚橙指示剂(5g/L)2滴,用EDTA标准溶液滴定,溶液由酒红色到亮黄色即为终点。
EDTA溶液石灰滴定法
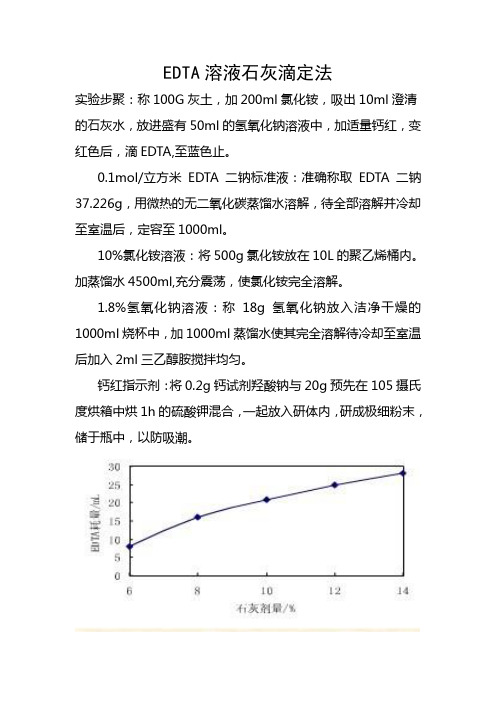
EDTA溶液石灰滴定法
实验步聚:称100G灰土,加200ml氯化铵,吸出10ml澄清的石灰水,放进盛有50ml的氢氧化钠溶液中,加适量钙红,变红色后,滴EDTA,至蓝色止。
0.1mol/立方米EDTA二钠标准液:准确称取EDTA二钠37.226g,用微热的无二氧化碳蒸馏水溶解,待全部溶解并冷却至室温后,定容至1000ml。
10%氯化铵溶液:将500g氯化铵放在10L的聚乙烯桶内。
加蒸馏水4500ml,充分震荡,使氯化铵完全溶解。
1.8%氢氧化钠溶液:称18g氢氧化钠放入洁净干燥的1000ml 烧杯中,加1000ml蒸馏水使其完全溶解待冷却至室温后加入2ml 三乙醇胺搅拌均匀。
钙红指示剂:将0.2g钙试剂羟酸钠与20g预先在105摄氏度烘箱中烘1h的硫酸钾混合,一起放入研体内,研成极细粉末,储于瓶中,以防吸潮。
EDTA清洗液浓度分析方法(滴定法)

EDTA残留浓度的测定——MgCl2滴定法测定范围:2-200mg/L1、原理在pH=10时,乙二胺四乙酸二钠(简称EDTA)和水中的钙镁离子生成稳定络合物,过量EDTA自铬黑T的葡萄酒红色络合物夺取钙镁离子而使铬黑T指示剂游离,溶液为明蓝色,通过滴加MgCl2标准溶液,使指示剂铬黑T也能与游离钙镁离子生成葡萄酒红色络合物,当用MgCl2标准溶液滴定接近终点时,溶液由明蓝色变为酒红色,即为终点。
其反应式如下:Mg2+ + Hlnd2- → Mglnd-+H+Mglnd- + H2Y2- → MgY2- + H+ + Hlnd2-Ca2+ + Hlnd2- → Calnd- + H+Calnd- + H2Y2 → CaY2- + H+ + Hlnd2-式中Hlnd2-——铬黑T指示剂(蓝色);Mglnd-——镁与铬黑T的络合物(酒红色);H2Y2-——乙二胺四乙酸离子(无色)。
2、试剂2.1 10%氨水:量取440mL氨水,稀释至1000mL。
2.2 1+1 三乙醇胺溶液。
2.3 铬黑T指示剂称取0.5铬黑T和4.5g盐酸羟胺,溶于100mL95%乙醇中,储于棕色瓶中。
2.4 pH=10氨—氯化铵缓冲溶液。
称取54g氯化铵,溶于200mL水中,加350mL氨水,用水稀释1000mL。
2.5 0.01mol/LMgCl2标准溶液。
2.5.1 配制称取四水合氯化镁(MgCl2·4H2O)1.67g溶于1000mL水中,摇匀。
23、仪器3.1 滴定管:50mL 酸式。
3.2 移液管;5mL 。
4、分析步骤吸取水样50mL ,移入250mL 锥形瓶中,加入5mL 氨—氯化铵缓冲溶液,2—4滴铬黑T 指示剂,用0.01mol/L MgCl 2标准溶液滴定至溶液由明蓝色变为酒红色即为终点。
5、分析结果的计算水样中EDTA 含量X (毫摩尔/升),按下式计算:X= ×1000式中:V ——滴定时MgCl 2标准溶液消耗体积,毫升;M ——MgCl 2标准溶液浓度,摩尔/升;Vw ——水样体积,毫升;6、注释6.1 若水样中有铁、铝干扰测定时,加1+1三乙醇胺1~3mL 加以掩蔽。
EDTA滴定法试验步骤

E D T A滴定法试验步骤
一、氢氧化钠试剂配制:
1、称氢氧化钠18g倒入3000mL量杯中;
2、蒸馏水1000mL倒入3000mL量杯中;
3、三乙醇胺4mL到入3000ml量杯中;
将1、2、3向搅拌溶化后,倒入5L塑料桶内备用。
二、氯化铵试剂配制:
1、氯化铵500g(一整瓶)倒入3000mL量杯中;
2、蒸馏水4500mL分两次倒入3000mL量杯中;
将1、2向搅拌溶化,倒入5L塑料桶内备用。
三、酸二钠试剂配制:
1、酸二钠倒入3000mL量杯中,加温水搅拌溶化,等晾凉后倒入容量瓶,药品不变,水控制在容量瓶刻度线处。
四、钙红指示剂配制:
将钙试剂羧酸钠与20g硫酸钾混合。
一起放入研钵中,研成极细粉末,储于棕色广口瓶中,以防吸潮。
五、试验步骤:
1、取工地拌和好的灰土,称300g倒入陶瓷杯,加氯化铵水600mL,顺时针搅拌3—4分钟,搅拌好后沉淀10分钟。
2、配制好的氢氧化钠试剂50mL倒入250mL烧杯中(同时进行两个试样);抽取10mL灰土沉淀水,倒入已有氢氧化钠试剂的烧杯中,再加少量的钙红指示剂摇匀。
(溶液呈玫瑰红色)
3、将配制好的酸二钠试剂倒入滴定管内50mL。
4、然后用EDTA二钠标准溶液滴定,边滴定边摇匀,并仔细观察溶液的颜色;在溶液颜色变为紫色时,放慢滴定速度,并摇匀;直到纯蓝色为终点,记录滴定管中EDTA二钠标准溶液体积,所消耗的即为EDTA二钠标准溶液的消耗量。
5、对其他几个盛样器中的试样,用同样的方法进行试验,并记录各自的EDTA 二钠标准溶液的消耗量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
E D T A滴定法操作流程 This model paper was revised by the Standardization Office on December 10, 2020
E D T A滴定法操作流程
1、适用范围
本方法适用于工地快速测定水泥和石灰稳定材料中水泥和石灰的剂量,并可用于检查现场拌合和摊铺的均匀性
本办法适用于再水泥终凝之前的水泥含量测定,现场土样的石灰剂量应在路拌后尽快测试,否则,需要用相应龄期的EDTA二钠标准溶液消耗量的标准曲线确定
2、仪器设备
滴定管、滴定台、滴定管夹、大肚移液管、锥形瓶、烧杯、容量瓶、搪瓷杯、、不锈钢棒(或粗玻璃棒)、量筒、棕色广口瓶、电子天平、秒表、表面皿、研钵、聚乙烯桶、毛刷、去污粉、吸水管、塑料勺、特种铅笔、厘米纸、洗瓶
3、试剂
0.1mol/m3EDTA二钠标准溶液:准确称取EDTA二钠(分析纯)37.23g,用40-50度的无二氧化碳蒸馏水溶解,待全部溶解并冷却至室温后,定容至1000ml
10%氯化钠溶液:将500g氯化钠(分析纯)放在10L的聚乙烯桶内,加蒸馏水4500ml,充分振荡,使氯化钠完全溶解
1.8%氢氧化钠(内含三乙醇胺)溶液:用电子天平称18g氢氧化钠(分析纯),放入洁净干燥的
1000ml烧杯中,加1000ml蒸馏水使其全部溶解,待溶液冷却至室温后,加入2ml三乙醇胺(分析纯),搅拌均匀后储于塑料桶中
钙红指示剂:将0.2g钙试剂羧酸钠与20g预先在105度烘箱中烘干1h的硫酸钾混合,一起放入研钵中,研成极细粉末,储于棕色广口瓶中,以防吸潮
4、试验步骤
取一个盛有试样的盛样器,在盛样器内加入两倍试样质量(湿料质量)体积的10%氯化钠溶液,料为300g,则搅拌3min(每分钟搅拌110-120次);料为1000g,则搅拌5min;放置沉淀10min,然后将上部清液转移至300ml烧杯中,搅匀,加盖表面皿待测
用移液管吸取上层(液面上1-2cm)悬浮液10ml放入200ml的三角瓶内,用量管量取1.8%氢氧化钠溶液50ml倒入三角瓶中,此时溶液PH值为12.5-13.0(可用PH12-14精密试纸检验),然后加入钙红指示剂(质量约为0.2g),摇匀,溶液呈玫瑰红色,记录滴定管中EDTA二钠标准溶液的体积V1,然后用EDTA二钠标准溶液滴定,边滴定边摇匀,并仔细观察溶液的颜色,在溶液颜色变为紫色时,放慢滴
定速度,并摇匀,直到纯蓝色为终点,记录滴定管中EDTA二钠标准溶液体积V2(以ml计),计算V1-V2,即为EDTA二钠标准溶液的消耗量
利用所绘制的标准曲线,根据EDTA二钠标准溶液消耗量,确定混合料中的水泥或石灰剂量
5、结果整理
本实验应进行二次平行测定,取算术平均值,精确至0.1g,允许重复性误差不得大于均值的5%,否则,重新进行试验
6、记录和报告
试验过程中应作好记录,并根据记录做出试验报告,报告应包括试验数量、结果平均值、标注差、偏差系数等。
