药物合成反应习题 第一章 卤化反应概要
药物合成反应习题集.doc

《药物合成技术》习题集适用于制药技术类专业第一章概论123.4.5.酸能够67235如何?二、完成下列反应三、为下列反应选择合适的试剂和条件,并说明原因。
四、分析讨论1.试预测下列各烯烃溴化(Br2/CCl4)的活性顺序。
2.在乙胺嘧啶中间体对氯氯苄的制备中,有如下两条路线,各有何特点?试讨论其优缺点。
3.以下是三种制备溴乙烷的方法,其中哪种适合工业生产,哪种适合实验室制备?4.在氯霉素生产过程中,对-硝基-α-溴代苯乙酮的制备时,(1)反应有无催化剂?若有,属于哪种催化剂?(2)将对硝基苯乙酮与溶于氯苯中,加热至24-25℃,滴加少量溴,当有HBr生成并使反应液变色则可继续加溴,否则需升温至50℃直至反应开始方可继续滴加溴,为什么?(3)反应毕开大真空排净溴化氢,反应过程中溴化氢也不断移走,是不是移得越净越有利于反应?为什么?(4)生产过程中,影响因素有哪些?1234561.以甲苯、环氧乙烷、二乙胺为主要原料,选择适当的试剂和条件合成局麻药盐酸普鲁卡因。
2.以乙苯为主要原料,选择适当的试剂和条件合成氯霉素中间体对硝基-α-胺基苯乙酮盐酸盐。
3.以对硝基甲苯、乙酰胺基丙二酸二乙酯、环氧乙烷为主要原料选择适当的试剂和条件合成抗肿瘤药消卡芥。
六、设计下列化合物的最佳合成路线(要求用简单、易得的起始原料)第四章酰化技术(Acylation Reaction)一、回答下列问题1.何为酰化反应?常用的酰化剂有哪些?它们的酰化能力、应用范围以及在使用上有何异同?2.羧酸和醇的酯化反应有何特点?加速反应和提高收率都有哪些方法?总结酯化反应的其他方法,并用实例加以说明。
3.羧酸法酯化反应常用的催化剂有哪些?各有何特点?为什么叔醇和酚不宜用羧酸作酰化剂?要酰化酚类应用哪些方法?4.何为活性酯、活性酸酐?它们的结构各有什么特点?在O 、N 、C 的酰化中有哪些应用? 5.胺类化合物的酰化活性一般有什么规律?6.在Friedel-Crafts 酰化反应中,酰化剂的结构、被酰化物的结构、催化剂、溶剂这些因素对CH 2CH 2Ph 2C OHCOOEtN HOCH3CH 3Br?NHCOCH 3O OOPy OCH 3H 3COCOCl3CH 3NH 2CH 3ClCH 2COCl三、给下列反应选择合适的条件 NH2COOHNHCOCOOHHOHOHOEtOHCOOEtHOHO HO四、讨论H 2O23.在利尿药氯噻酮的中间体对氯苯甲酰苯甲酸的制备中,为什么1mol 的邻苯二甲酸酐要用2.4mol 的AlCl 3为催化剂?若付—克酰化反应中用酰氯为酰化剂,催化剂AlCl 3的用量如何?反应结束后,产物如何从反应液中分离?4.氯霉素生产中,对硝基―α―乙酰氨基苯乙酮制备时, (1)何为酰化剂?(2)除加酰化剂外,还加哪种试剂?加料顺序如何?为什么? (3)此反应的主要副反应有哪些?生产上是如何避免的? (4)检测弱点的方法是什么?此方法的基本原理是什么?(5)生产过程影响该反应的因素有哪些?生产中应如何控制反应条件?5.结合头孢拉定的生产过程,说明混合酸酐不制备方法、特点及应用中的注意事项。
药物合成反应 卤化反应

X
OH C C X
O O CR C C X
C C
+ X2
C
C
O R C O
RO
OR C C X
一方面:
在非极性非质子性溶剂中进行(CS2、CF4) 增加卤化物,提高二卤代物比例。
H3C H AcOH/ Cl2 H C 3 LiCl H Cl C Cl C H C2H5 Cl OAc C H C2H5
C
H
C
C2H5
+
H3C H
C
相反:
利用一些方法可以制备β -卤代醇或衍生物
CH3CH CH2
I2 / KIO3 H2SO4 / H2O
H H3C C CH2I OH
+
H H3C C I
CH2OH
92%
I2 / CH3CO3H / CH3CO2H Et2O
8%
H H3C C CH2I OCOCH3
80%
C C X2 +H2O C C + HX X2=Cl2, Br2
OH X
E. 加硼烷 ( 硼氢化-卤解 )
第一节 不饱和烃的卤加成反应
一、不饱和烃加卤素
X2
一、不饱和烃加卤素
1. X2对烯烃的加成
C C
C X
C X
活性:F> CI> Br> I CH2=CH2 + Br2 → BrCH2CH2Br
2、N-卤代酰胺为卤化剂 ① 较常用的卤化剂
N-卤代乙酰胺
O H3C C NH Br :NBA
O H3C C NH Cl :NCA
N-溴代琥珀酰亚胺
O N Br O
O N Cl O
:NBS
药物合成习题答案
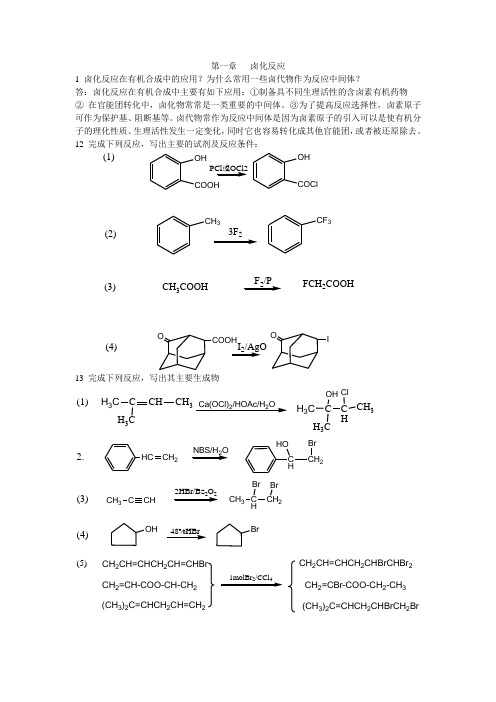
13完成下列反应,写出其主要生成物
第二章烃化反应
一√烃化剂的种类有哪些?进行甲基化和乙基化反应时,应选用那些烃化剂?引入较大烃基时选用那些烃化剂为好?
答:烃化剂种类主要有:卤代烷类;硫酸酯、磺酸酯类;醇、醚类;烯烃类;环氧烷类;重氮甲烷;甲基化和乙基化时选用的烃化剂为:卤代烃RX(R为甲基或乙基,);硫酸二甲酯或硫酸二乙酯,重氮甲烷。引入较大的烃基时选用芳基磺酸酯。
答:KmnO4的氧化能力在酸性条件下最强;中性和碱性条件下氧化能力相当且相对较弱,两者只是使用场合有些不同。KmnO4主要用于烯键的断裂氧化、将醇氧化成醛或酮和将醛氧化成酸。
16完成下列反应(12345)
(1)
(2)
(3)
(4)
(5)
重排反应
完成下列反应,并注明反应名称
1
2
3
4
5
6
3在Backmann重排中常用的催化剂有那几种?
用LiAlH4反应结束后可加入乙醇、无水乙醚或10%氯化胺水溶液以分解未反应的LiAlH4和还原物;NaBH4反应结束后可加稀酸分解还原物并使剩余的NaBH4生成硼酸,便于分离。
七、√完成下列反应
九、√完成下列反应
第三章酰化反应
2.常见的酰化剂有哪些?他们的酰化能力、应用范围、以及使用条件上有何异同点?
答:常见的酰化剂有:羧酸、羧酸酯、酸酐、酰氯、酰胺等。
羧酸的酰化能力较弱,可用于C-酰化、N-酰化和O-酰化,一般需设法活化羧酸以增强羰基的亲电能力。
羧酸酯的酰化能力比羧酸弱,可用于N-酰化和O-酰化反应,一般应在高温下进行反应,且以质子酸、Lewis酸或醇钠进行催化。
相转移催化氢化:指在相转移催化剂的作用下所进行的催化氢化反应。相转移催化剂是指在非均匀相反应中,它能使水相中的反应物转入有机相,从而改变了离子的溶剂化程度,增大离子反应活性,加快反应速率,简化处理手续的一种有机试剂。
药物合成反应习题集

《药物合成技术》习题集适用于制药技术类专业第一章概论一、本课程的学习内容和任务是什么?学好本课程对从事药物及其中间体合成工作有何意义?二、药物合成反应有哪些特点?应如何学习和掌握?三、什么是化学、区域选择性?举例说明。
四、什么是导向基?具体包括哪些类型?举例说明。
五、药物合成反应有哪些分类方法?所用试剂有哪些分类方法?举例说明。
六、查资料写一篇500 字左右的短文,报道药物合成领域的新技术及发展动态?第二章卤化技术( Halogenation Reaction)一、简答下列问题1.何为卤化反应?按反应类型分类,卤化反应可分为哪几种?并举例说明。
2.在药物合成中,为什么常用卤化物作为药物合成的中间体?3. 在较高温度或自由基引发剂存在下,于非极性溶剂中,臼2和NBS都可用于烯丙位和苄位的溴取代,试比较它们各自的优缺点。
4. 比较X2、HX 、HOX 对双键离子型加成的机理、产物有何异同,为什么?5. 解释卤化氢与烯烃加成反应中,产生马氏规则的原因(用反应机理)什么Lewis 酸能够催化该反应?6•解释溴化氢与烯烃加成反应中,产生过氧化效应的原因?卤化剂(HX 、SOCI 2、PC 3、PCb )各有何特点, 它们的使用范围如何?、完成下列反应AcOK A Me 2CO三、为下列反应选择合适的试剂和条件,并说明原因。
1.(CH 3)2C=CHCH 3» (CH 3)2C = CHCH 2Br2.CH 3—CH 二CH —COOH* CH 3—CH 二 CH —COCl3. HOCH 2(CH 2)4CH 2OHI CH 2(CH 2)4CH 2l7.在羟基卤置换反应中, 1.叫CH 3”C —CHCH 3Ca(OCI )2/AcOH/H 2OPBr sCH 36.CH 2CHCOBrI Br5- CH3 — CH=CH —CO 2CH 3• BrCH 2—CH 二 CH —CO 2CH 3”CH 2CH 2OH6-O :CH 2CH 2OH” CH 3CH(CH 2)8COOHI Br » BrCH 2(CH 2)9COOHC 2H 5O10. CHsQH^CH —C —CH 3C 2H 5 O 1 CH 3(CH 2)5CH —C —CH 2BrC 2H 5O• CH 3(CH 2)5CH —C —OHCH 3(CH 2)4CH 2CI(构型保持)7. OCH 3OCH 3CH 3CH 2—C(COOC 2H 5)INHCOCH 3 -NO 2CH 2BrCH 2 — N(CH 2CH 2OH )2CH 2—C(COOC 2H 5)CH 2—C(COOC 2H 5)1NHCOCH 3 ----------- *12 NHCOCH 3T NO2NO 2CH 2—N (CH 2CH 2CI )2 CH 2—C (COOC 2H 5)NHCOCH 3NO 2(抗肿瘤药消卡芥)11. CH 3(CH 2)4CH 2OHCH 3(CH2)4CH 2CI (构型反转)CH 2CH 2Cl O : XCH 2CH 2Cl8.CH 2二CH(CH 2)8COOH4.CH 2CH 2CO 2HCH 3—CH 3CH 2OH4.在氯霉素生产过程中,对-硝基-a 溴代苯乙酮的制备时,(1) 反应有无催化剂?若有,属于哪种催化剂?(2) 将对硝基苯乙酮与溶于氯苯中,加热至24-25C ,滴加少量溴,当有HBr 生成并使反应液变色则可继续加溴,否则需升温至50C 直至反应开始方可12.四、分析讨论1 •试预测下列各烯烃溴化(BMCCh )的活性顺序。
2023年药物合成考试题及答案

第一章卤化反应试题一.填空题。
(每空2分共20分)1.Cl和2Br与烯烃加成属于(亲电)(亲电or亲核)加成反应,其过2渡态也许有两种形式:①( 桥型卤正离子 )②(开放式碳正离子)2.在醇旳氯置换反应中,活性较大旳叔醇,苄醇可直接用(浓HCl )或( HCl )气体。
而伯醇常用(LUCas)进行氯置换反应。
3.双键上有苯基取代时,同向加成产物(增多){增多,减少,不变},烯烃与卤素反应以(对向加成)机理为主。
4在卤化氢对烯烃旳加成反应中,HI、HBr、HCl活性次序为(HI>HBr>HCl )烯烃RCH=CH2、CH2=CH2、CH2=CHCl旳活性次序为( RCH=CH2>CH2=CH2>CH2=CHCl )5写出此反应旳反应条件-----------------( NBS/CCl hv,4h)Ph3CCH2CH CH2Ph3CCH CHCH2Br5 二.选择题。
(10分)1.下列反应对旳旳是(B)A.C CH CBr C CH3Br2+= B.C.(CH3)3HCH2CHCl(CH3)3C CHCH3ClD.Ph3C CH CH22CCl4/r,t.48h3CHCBrCH2Br2.下列哪些反应属于SN1亲核取代历程(A)A .(CH 3)2CHBr +H 2O(CH 3)2CHOH +HBrB .CH 2I +CH 2CNNaCN+NaIC. NH 3+CH 3CH 2ICH 3CH 3NH 4+ID. CH 3CH(OH)CHCICH 3+CH 3C H OC H CH 3CH 3ONa3.下列说法对旳旳是(A ) A 、次卤酸新鲜制备后立虽然用.B 、次卤酸酯作为卤化剂和双键反应, 在醇中生成卤醇, 在水溶液中生成卤醚.C 、次卤酸(酯)为卤化剂旳反应符合反马氏规则, 卤素加在双键取代基较多旳一端;D 、最常用旳次卤酸酯: 次氯酸叔丁酯 (CH3)3COCl 是具有刺激性旳浅黄色固体.4.下列方程式书写不对旳旳是(D )A.RCOOH RCOCl + H 3PO 3PCl 3B.RCOOH RCOCl + SO 2 + HCl SOCl 2C.N HCOOHN HCOOC 2H 5C 2H 5OH, H 2SO 4D.5、N-溴代乙酰胺旳简称是(C )A 、NSB B 、NBAC 、NBSD 、NCSBrNO 2BrHNO 3 / H 2SO 4BrBr三.补充下列反应方程式(40分)1OEtO t -BuOCl / EtOH-55~0℃OEtOCl OEt .2.CH 3(CH 2)2CH 2CH=CHCH 3NBS / (PhCO)2O 24CH 3(CH 2)2CHCH=CHCH 3Br3.CH 2=CHCH 2C CHBr 2BrCH 2CHBrCH 2C CH4.R -CH=CH -CH 2-CH -OHOX 2OO RX5.PhCCCH 3Br/Li/Br AOAC/25oCCCPhBrBrCH 36.PhCHCH 2PhH C OHCH 2BrNBS/H 2O 25o C,35min7.COClClOHCClCl 28.COOAgNO 2BrO 2NBr 2/CCl 4加热3h9.10.O HB rO HO HBrBr1molBr /CS t-BWNH2-70c四.简答题(20分)1.试从反应机理出发解释酮羰基旳α-卤代在酸催化下一般只能进行一卤代,而在碱催化时则直接得到α-多卤代产物。
药物合成反应习题 第一章 卤化反应

(1).药物合成反应的分类
③按官能团的演变规律分类 : 根据引入的 原子或基团的不同分为: 卤化、 烃化、 酰化、 缩合、 氧化、 还原、 重排等反应类型。
(2)反应试剂的分类
(1)亲电试剂
具有较高的活性能从作用 物得到电子而形成共价键的试剂 。 有三 类:①正离子如C+、Cl+、Br+、I+、NO2+ 等;②可接收孤对电子的分子如Lewis酸; ③羰基碳原子等。
四、药物合成反应课程的学习方 法
1 掌握重要药物合成反应、反应的影响因素, 如作用物和试剂活性,主要反应条件,反应 的选择性等及其药物合成的应用,并了解其 反应机理。
NO2
H2/Pd-BaSO4
喹啉-硫/二甲苯
NO2
ClOC
CHO
四、药物合成反应课程的学习方法
2 掌握重要人名反应在药物合成中的应用。 Delepine反应
2、卤素对炔加成 得反式二卤烯烃
Br Br2 ph C C-CH3 LiBr Cl2 ph Br ph C Cl I C H C I C CH3 CH 2OH Cl C C-CH3
C
C-CH2OH
I2
二、不饱和酸卤内酯反应
I O I2/KI/NaHCO3 O
CH2 COOH
H C C Ph Br2 第二步 O
卤素原子(X)的反应称卤 化反应。 用途: 作为特定活性化合物; 作官能团转化的中间体; 卤原子作为保护剂、阻断剂;
H3C
SO2NHCONH(CH2)3CH3
甲苯磺丁脲 t1/2 5.7hr
Cl
SO2NHCONH(CH2)2CH3
氯苯磺丙脲 t1/2 33hr
O HN O N H F
药物合成反应习题集

《药物合成技术》习题集适用于制药技术类专业第一章 概论一、本课程的学习内容和任务是什么?学好本课程对从事药物及其中间体合成工作有何意义?二、药物合成反应有哪些特点?应如何学习和掌握? 三、什么是化学、区域选择性?举例说明。
四、什么是导向基?具体包括哪些类型?举例说明。
五、药物合成反应有哪些分类方法?所用试剂有哪些分类方法?举例说明。
六、查资料写一篇500字左右的短文,报道药物合成领域的新技术及发展动态?第二章 卤化技术(Halogenation Reaction )一、简答下列问题1.何为卤化反应?按反应类型分类,卤化反应可分为哪几种?并举例说明。
2.在药物合成中,为什么常用卤化物作为药物合成的中间体?3.在较高温度或自由基引发剂存在下,于非极性溶剂中,Br 2和NBS 都可用于烯丙位和苄位的溴取代,试比较它们各自的优缺点。
4.比较X 2、HX 、HOX 对双键离子型加成的机理、产物有何异同,为什么?5.解释卤化氢与烯烃加成反应中,产生马氏规则的原因(用反应机理)。
为什么Lewis 酸能够催化该反应?6.解释溴化氢与烯烃加成反应中,产生过氧化效应的原因?7.在羟基卤置换反应中,卤化剂(HX 、SOCl 2、PCl 3、PCl 5)各有何特点,它们的使用范围如何?二、完成下列反应C CH 3CH 3CHCH 3Ca(OCl)2/AcOH/H 2O1.Ph 2CHCH 2CH 2OH32.CH 3SO 2ClCl /AIBN3.OH4CH 3CH 35.2OC O CH 3OHI 2/CaOTHF/MeOHAcOK Me 2CO?6.三、为下列反应选择合适的试剂和条件,并说明原因。
(CH 3)2CCHCH 3CHCH 2Br(CH 3)2C1.CH 3CH CH COOHCH 3CH CH COCl 2.HOCH 2(CH 2)4CH 2OH(CH 2)4CH 2I CH 2I 3.CH 3OCH 2CH 2CO 2HCH 2CHCOBrCH 3O 4.CH 3CH CH CO 2CH 3CH 2CH CH CO 2CH 3Br 5.OCH 2CH 2OH CH 2CH 2OHO2CH 2CH 2CH 2ClCl 6.CH 2OHOCH 3CH2ClOCH 37.8.BrCH 2(CH 2)9COOH CH 3CH(CH 2)8COOHBrCH 2CH(CH 2)8COOHCH 3NO 2CH 2C(COOC 2H 5)3CH 2BrNO 2CH 2C(COOC 2H 5)39.CH 22CH 2N(CH 2CH 2OH)2C(COOC 2H 5)3(抗肿瘤药消卡芥)CH 2NO 2CH 2N(CH 2CH 2Cl)2CHCOOH 2CH 2NO 2CH 2N(CH 2CH 2Cl)2C(COOC 2H 5)NHCOCH 310.CH 3(CH 2)5OCH 3C 2H 5CH 3(CH 2)5OCH 2BrC 2H 5CH 3(CH 2)5OOHC 2H 5CH 3(CH 2)4CH 2OHCH 3(CH 2)4CH 2Cl CH 3(CH 2)4CH 2Cl (构型反转)(构型保持)11.OC 2H 5OC 2H 5Br12.四、分析讨论1.试预测下列各烯烃溴化(Br 2/CCl 4)的活性顺序。
药物合成考试题及答案

第一章卤化反应试题一.填空题。
(每空2分共20分)1.2Cl和2Br与烯烃加成属于(亲电)(亲电or亲核)加成反应,其过渡态可能有两种形式:①( 桥型卤正离子 )②(开放式碳正离子)2.在醇的氯置换反应中,活性较大的叔醇,苄醇可直接用(浓HCl )或( HCl )气体。
而伯醇常用(LUCas)进行氯置换反应。
3.双键上有苯基取代时,同向加成产物(增多){增多,减少,不变},烯烃与卤素反应以(对向加成)机理为主。
4在卤化氢对烯烃的加成反应中,HI、HBr、HCl活性顺序为(HI>HBr>HCl )烯烃RCH=CH2、CH2=CH2、CH2=CHCl的活性顺序为( RCH=CH2>CH2=CH2>CH2=CHCl )5写出此反应的反应条件-----------------( NBS/CCl hv,4h )Ph3CCH2CH CH2Ph3CCH CHCH2Br5 二.选择题。
(10分)1.下列反应正确的是(B)A.B.C.(CH3)3HCH2CHCl(CH3)3C CHCH3ClD.Ph3C CH CH22CCl4/r,t.48h3CHCBrCH2Br2.下列哪些反应属于SN1亲核取代历程(A)A.(CH3)2CHBr+H2O(CH3)2CHOH+HBrB.CH2I+CH2CNNaCN+NaIC. NH3+CH3CH2I CH3CH3NH4+ID. CH3CH(OH)CHCICH3+CH3CHOCHCH3CH3ONa3.下列说法正确的是(A)A、次卤酸新鲜制备后立即使用.B、次卤酸酯作为卤化剂和双键反应, 在醇中生成卤醇, 在水溶液中生成卤醚.C、次卤酸(酯)为卤化剂的反应符合反马氏规则, 卤素加在双键取代基较多的一端;D、最常用的次卤酸酯: 次氯酸叔丁酯 (CH3)3COCl是具有刺激性的浅黄色固体.4.下列方程式书写不正确的是(D)D.5、N-溴代乙酰胺的简称是(C)Br NO2BrHNO3 / H2SO4BrBrA、NSBB、NBAC、NBSD、NCS 三.补充下列反应方程式(40分)1O EtO t-BuOCl / EtOH-55~0℃OEtOClOEt.2.CH3(CH2)2CH2CH=CHCH3NBS / (PhCO)2O24CH3(CH2)2CHCH=CHCH3Br3.4.5.6.7.8.9.10.四.简答题(20分)1.试从反应机理出发解释酮羰基的α-卤代在酸催化下一般只能进行一卤代,而在碱催化时则直接得到α-多卤代产物。
药物合成反应(第三版_闻韧)第一章卤化反应

Organic Reactions for Drug Synthesis
例1.
C6H5 H
CC
H
COOC2H5
Br2 / CCl4
Br
C6H5
C
H C
H Br COOC2H5
C6H5 H CC
H Br COOC2H5
1. 卤素与烯烃的亲电加成反应
(1)反应历程: 第一步:卤正离子向π 键进攻,形成三员环卤正离子 或开放式碳正离子的过渡态。
R1 R3
R2
R4
δ +δ XX
Organic Reactions for Drug Synthesis
R1 R3 CC
R2 X R4
(1)
R1 R3
CC
R2
X R4
(2)
第二步:
反应类型
亲电加成 亲电取代 亲核取代 自由基反应
Organic Reactions for Drug Synthesis
常用的卤化剂 卤素(X2):Cl2、Br2
次卤酸(HOX):HOCl、HOBr
N-卤代酰胺:
如 N-溴(氯)代乙酰胺( NBA,NCA) N-溴(氯)代丁二酰亚胺(NBS,NCS)
Ph H CC
H CH3
NBS / DMSO / H2O
OH
Ph
H
CC
H
Br CH3
NBS / 干燥的DMSO
O H
Ph C C Br CH3
Organic Reactions for Drug Synthesis
五、卤化氢与烯烃的加成
药物合成习题及答案1(20201229183516)

药物合成习题及答案1第一章卤化反应习题参考答案一、简述题1 .如何解释以下反应结果:CH3X=HX=OCH3(88%)(63%)(12%)(37%)CH322(55%~56%)(28%~29%)参考答案:(1)苯环对位的甲氧基取代基具有供电子效应,可通过共轭效应使苄位碳正离子稳定,所以促使以开放式碳正离子历程进行反应的比例增加。
(2)卤素氯与溴相比较难极化,不易形成桥型卤正离子,所以对位加成比例减少。
2 .制备氟代芳烃除了经典的Schiemann 反应外,还有哪些方法?分析其各自的特点或适用性。
参考答案:Schiemann 反应是经芳烃重氮盐的氟代来实现芳环上引入氟,其他用于芳环氟化的方法还有:(1)在低温下,用经惰性气体稀释的氟素进行直接氟化,或用酰基次氟酸酐(CH3COOF作为酰化剂,经芳环上的亲电取代反应获得氟代芳烃。
(2)XeF2或XeF4为氟化剂氟化芳也都可得氟代芳烃——一般属于自由基反应。
(3)另外,对于邻、对位有强吸电子基团的卤代芳环,可采用芳环上卤置换(亲核取代反应)进行氟代——Fenkelstein 卤素交换反应。
3 •在卤化物的卤素交换反应中,BBr3可以将氯代烷转化成溴代烷;BiBr3可以将碘代烷转化为溴代烷,并能保留原有构型(经历一个四面体过程)。
使比较这两种试剂的异同之处。
RI + BiBr3 参考答案:前者(BBr3)反应时先将卤代烃转化为碳正离子,然后进行卤素加成;而后者经历一个四面体过程,产物保留了原有的构型4 .与醇的直接卤取代相比,醇羟基通过磺酸酯化再卤取代有什么好处?参考答案:由于磺酰氯及其酯的活性较大,磺酰化和卤置换反应均在较温和的条件下进行,常比卤素交换更有效(收率更高),另外,还可以避免醇羟基直接卤置换反应中可能产生的副反应(如碳正离子重排等)。
5 •为什么说“烯醇硅烷醚卩-碳原子的亲核性比相应的烯醇酯为强,故其卤化反应常常比烯1醇酯容易”(见教材p26)?参考答案:因为烯醇式的卤化是亲电性的,比较烯醇硅烷醚结构中的硅氧键极性情况与烯醇酯结构中的碳氧键极性。
药物合成反应(08级)(卤化)

CH3 CH2 CH2 CH2Br (亲核置换)
三、卤化反应的应用
1、制备具有不同生理活性的含卤素药物。
2、在官能团转换中,卤化物常常是重要的中间体。
3、为提高反应的选择性,卤原子可作为保护基、
阻断基等。
第一节 卤化反应机理
一、电子反应机理(P1-3)
1、亲电反应
(1)亲电加成 ① 桥型卤正离子或离子对的过渡态形式 ② 三分子协同亲电加成 (2)亲电取代
CH3(CH2)4 CH
CH2
NBA/HF/Et 2O
CH3(CH2)4 CHCH2Br F
四、卤化氢对不饱和烃的加成反应 1、卤化氢对烯烃的加成反应 (1)反应通式 生成卤素取代的饱和烃。反应时可采用卤化氢 气体或其饱和有机溶剂,或用浓的卤化氢水溶液, 或用无机碘化物/磷酸等方法。
H C R2 C X R4
(3)卤化试剂(P16)
常用卤化剂为卤素、 N-卤代酰胺(NBS和
NCS)、次卤酸酯等,其中N-卤代酰胺最好,
无芳核取代和羰基α位取代(亲电取代)等副反
应,特别适用于苄位和烯丙位的卤取代。 (4)溶剂(P16) 常用惰性溶剂,如CCl4、CHCl3、苯等。 (5)作用物结构(P13-15)
主要取决于中间体自由基的稳定性。
① 芳烃的卤取代反应
② 羰基α位的卤取代反应
③ 炔烃的卤取代反应
2、亲核反应:亲核取代
二、自由基反应机理(P3-4)
1、自由基加成
2、自由基取代
第二节 不饱和烃的卤加成反应
一、不饱和烃和卤素的加成反应 1、卤素对烯烃的加成反应
(1)反应通式
生成邻二卤化物。其中,氯化和溴化最常用,
氟化和碘化的应用受到限制(P5)。
药物合成反应习题
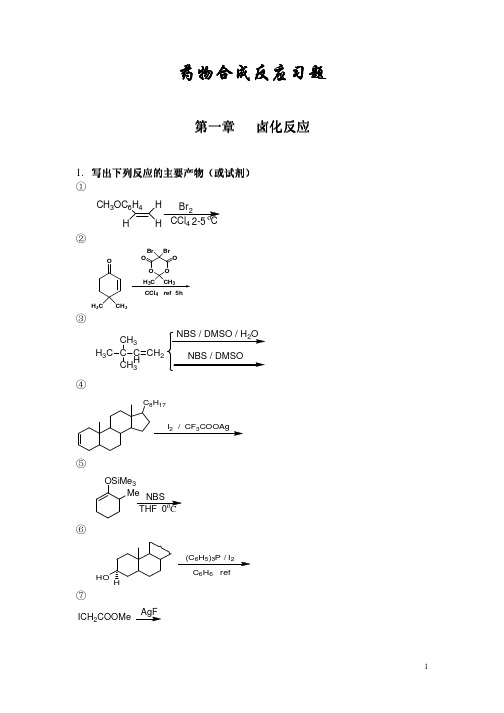
40-50°C
④
H3C H C2H5 H Cl2, CH3COOH
2
3.
①
写出下列反应的主要试剂及条件 写出下列反应的主要试剂及条件
C(CH2OH) 4
C(CH2Br)4
②
HOOC(CH2)4COOH ClCO(CH2)4COCl
③
PhCH 2COCH3 PhCHCH 2OCH 3 Cl
④
O COOH O I
药物合成反应习题
第一章 卤化反应
1. 写出下列反应的主要产物( 写出下列反应的主要产物(或试剂) 或试剂) ①
CH3OC6H4 H H Br 2 ο H CCl4 2-5 C
Br O O O H3C O CH3 Br O
②
CCl4 ref 5h H3C CH3
③
CH3 H3C C C CH2 H CH3 NBS / DMSO / H2O NBS / DMSO
氧化反应
①
②
CH3 COOH
③
CH3 CH3COCl AlCl3 CH3 CH3
R MnO2 CHCl 3 ,25°C HO OH
CH3 COOH
④
⑤
OAc KMnO 4/ KIO4 / H2O BaOH / K2CO3 / 35°C O
⑥
CH3 NO2 OCH3 CrO2Cl2 CS2 25° C
⑦
HO CH2OH (C5H5N)2CrO3 CH2Cl 2 25° C
13
⑧
0.5 M SeO 2 C2H5OH, ref.
⑨
HO OH DMSO-DCC H3PO4 RT H3CO
⑩
CH3 C O CH3 C O O
药物合成考试题及答案

第一章卤化反应试题一.填空题。
(每空2分共20分)1.Cl和2Br与烯烃加成属于(亲电)(亲电or亲核)加成反应,其过2渡态可能有两种形式:①( 桥型卤正离子 )②(开放式碳正离子)2.在醇的氯置换反应中,活性较大的叔醇,苄醇可直接用(浓HCl )或( HCl )气体。
而伯醇常用(LUCas)进行氯置换反应。
3.双键上有苯基取代时,同向加成产物(增多){增多,减少,不变},烯烃与卤素反应以(对向加成)机理为主。
4在卤化氢对烯烃的加成反应中,HI、HBr、HCl活性顺序为(HI>HBr>HCl )烯烃RCH=CH2、CH2=CH2、CH2=CHCl的活性顺序为( RCH=CH2>CH2=CH2>CH2=CHCl )5写出此反应的反应条件-----------------( NBS/CCl hv,4h)Ph3CCH2CH CH2Ph3CCH CHCH2Br5 二.选择题。
(10分)1.下列反应正确的是(B)A.C CH CBr C CH3Br2+= B.C.(CH3)3HCH2CHCl(CH3)3C CHCH3ClD.Ph3C CH CH22CCl/r,t.48h3CHCBrCH2Br2.下列哪些反应属于SN1亲核取代历程(A)A.(CH3)2CHBr+H2O(CH3)2CHOH+HBrB .CH 2I +CH 2CNNaCN+NaIC. NH 3+CH 3CH 2ICH 3CH 3NH 4+ID. CH 3CH(OH)CHCICH 3+CH 3C H OC H CH 3CH 3ONa3.下列说法正确的是(A ) A 、次卤酸新鲜制备后立即使用.B 、次卤酸酯作为卤化剂和双键反应, 在醇中生成卤醇, 在水溶液中生成卤醚.C 、次卤酸(酯)为卤化剂的反应符合反马氏规则, 卤素加在双键取代基较多的一端;D 、最常用的次卤酸酯: 次氯酸叔丁酯 (CH3)3COCl 是具有刺激性的浅黄色固体.4.下列方程式书写不正确的是(D )A.RCOOH RCOCl + H 3PO 3PCl 3B.RCOOH RCOCl + SO 2 + HCl SOCl 2C.N HCOOHN HCOOC 2H 5C 2H 5OH, H 2SO 4D.5、N-溴代乙酰胺的简称是(C )A 、NSB B 、NBAC 、NBSD 、NCS三.补充下列反应方程式(40分)1BrNO 2BrHNO 3 / H 2SO 4BrBrOEtO t -BuOCl / EtOH-55~0℃OEtOCl OEt .2.CH 3(CH 2)2CH 2CH=CHCH 3NBS / (PhCO)2O 24CH 3(CH 2)2CHCH=CHCH 3Br3.CH 2=CHCH 2C CHBr 2BrCH 2CHBrCH 2C CH4.R -CH=CH -CH 2-CH -OHOX 2OO RX5.PhCCCH 3CCPhBrBrCH 36.PhCHCH 2PhH C OHCH 2BrNBS/H 2O 25o C,35min7.COClClOHCClCl 28.COOAgNO 2BrO 2NBr 2/CCl 4加热3h9.10.O HB rO HO HBrBr1molBr /CS t-BWNH2-70c四.简答题(20分)1.试从反应机理出发解释酮羰基的α-卤代在酸催化下一般只能进行一卤代,而在碱催化时则直接得到α-多卤代产物。
药物合成反应第一章卤化反应[1]
![药物合成反应第一章卤化反应[1]](https://img.taocdn.com/s3/m/540f83c8844769eae109eda4.png)
• N-溴(氯)代乙酰胺
•
N-溴(氯)代丁二酰亚胺
药物合成反应第一章卤化反应[1]
•4. 定位:遵循马氏规则
药物合成反应第一章卤化反应[1]
•(β- 溴醇)
•(α-溴酮) •注:一个从烯烃制备α-溴酮的很好方法!
药物合成反应第一章卤化反应[1]
•例:
药物合成反应第一章卤化反应[1]
•五、卤化氢与烯烃的加成
药物合成反应第一章卤化反应[1]
பைடு நூலகம் 四、N-卤代酰胺与烯烃的加成
1. 是制备β -卤醇的又一重要方法。
2.
反应历程与次卤酸(酯)与烯烃的亲电加成类似。
3. 2. 特点:
4. 卤正离子由质子化的N-卤代酰胺提供,
5.
— OH等负离子来自反应溶剂(H2O、ROH、DMSO、
DMF)。
6. 3. 四种常用的N-卤代酰胺:
•推电子基:
•如 HO—
• RO—
• CH3CONH— • C6H5— • R—
•吸电子基:
•如 —NO2 • —CN • —COOH • —COOR • —SO3H • —X
药物合成反应第一章卤化反应[1]
•b. 卤素活泼性 • Cl正离子的亲电性比Br正离子强,所以,氯与烯烃 的加成反应的速度比溴快,但选择性比溴差。
•2. 溴化氢对烯烃的自由基加成历程
•反应的定位:反马氏规则 • 碳自由基的稳定性顺序:叔R3C· > 仲R2HC· > 伯RH2C· • 碳自由基可与苯环、烯键、烃基发生共轭或超共轭效应 •而得到稳定,故溴倾向于加在含氢较多的烯烃碳原子上。
药物合成反应第一章卤化反应[1]
•注:只有溴化氢才能和烯烃发生自由基型亲 电加成反应!
药物合成考试题及答案

药物合成考试题及答案 TTA standardization office【TTA 5AB- TTAK 08- TTA 2C】第一章卤化反应试题一.填空题。
(每空2分共20分)1.Cl和2Br与烯烃加成属于(亲电)(亲电or亲核)加成反应,其2过渡态可能有两种形式:①( 桥型卤正离子 )②(开放式碳正离子)2.在醇的氯置换反应中,活性较大的叔醇,苄醇可直接用(浓HCl )或( HCl )气体。
而伯醇常用(LUCas)进行氯置换反应。
3.双键上有苯基取代时,同向加成产物(增多){增多,减少,不变},烯烃与卤素反应以(对向加成)机理为主。
4在卤化氢对烯烃的加成反应中,HI、HBr、HCl活性顺序为(HI>HBr>HCl )烯烃RCH=CH2、CH2=CH2、CH2=CHCl的活性顺序为( RCH=CH2>CH2=CH2>CH2=CHCl )5写出此反应的反应条件-----------------( NBS/CCl hv,4h )Ph3CCH2CH CH2Ph3CCH CHCH2Br5 二.选择题。
(10分)1.下列反应正确的是(B)A.C CH CBr CBr CH3Br2+= B.C.(CH3)3HCH2CHCl(CH3)3C CHCH3ClD.Ph3C CH CH22CCl4/r,t.48h3CHC CH2Br2.下列哪些反应属于SN1亲核取代历程(A)A.(CH3)2CHBr+H2O(CH3)2CHOH+HBrB .CH 2I +CH 2CNNaCN+NaIC. NH 3+CH 3CH 2ICH 3CH 3NH 4+ID. CH 3CH(OH)CHCICH 3+CH 3C H OC H CH 3CH 3ONa3.下列说法正确的是(A ) A 、次卤酸新鲜制备后立即使用.B 、次卤酸酯作为卤化剂和双键反应, 在醇中生成卤醇, 在水溶液中生成卤醚.C 、次卤酸(酯)为卤化剂的反应符合反马氏规则, 卤素加在双键取代基较多的一端;D 、最常用的次卤酸酯: 次氯酸叔丁酯 (CH3)3COCl 是具有刺激性的浅黄色固体.4.下列方程式书写不正确的是(D )A.RCOOH RCOCl + H 3PO 3PCl 3B.RCOOH RCOCl + SO 2 + HCl SOCl 2C.N HCOOHN HCOOC 2H 5C 2H 5OH, H 2SO 4D.5、N-溴代乙酰胺的简称是(C ) A 、NSB B 、NBA C 、NBS D 、NCS三.补充下列反应方程式(40分)1BrNO 2BrHNO 3 / H 2SO 4BrBrOEtO t -BuOCl / EtOHOEtOCl OEt .2.CH 3(CH 2)2CH 2CH=CHCH 3NBS / (PhCO)2O 24CH 3(CH 2)2CHCH=CHCH 3Br3.CH 2=CHCH 2C CHBr 2BrCH 2CHBrCH 2C CH4.R -CH=CH -CH 2-CH -OHOX 2OO RX5.PhCCCH 3CCPhBrBrCH 36.PhCH CH2PhHCOHCH2BrNBS/H2O25o C,35min7.COClClOHCClCl28.COOAg NO2Br O2N Br2/CCl4加热3h9.10.O HB rO HO HBrBr1molBr /CS t-BWNH2-70c四.简答题(20分)1.试从反应机理出发解释酮羰基的α-卤代在酸催化下一般只能进行一卤代,而在碱催化时则直接得到α-多卤代产物。
药物合成习题答案
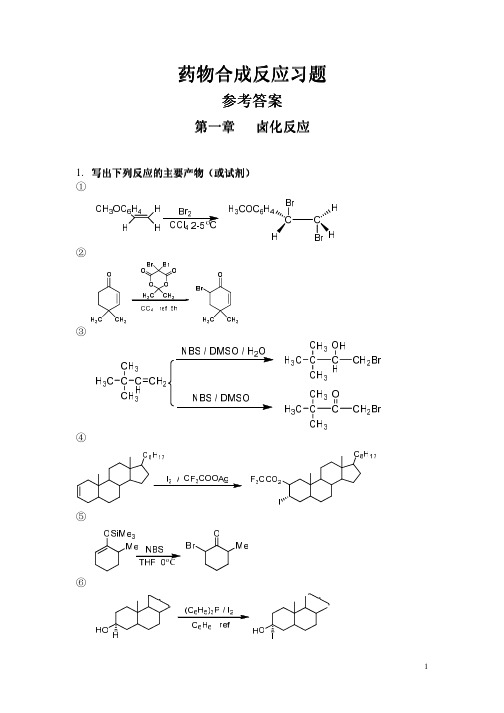
C2H5ONa
(COOC2H5)2CH(CH2)6CH(COOC2H5)2 Na, NH3 PhCH3 (CH2)2 HO O O (CH2)2
C2H5OOC(CH2)8COOC2H5
O
O
②试由
O
OCH3 合成
。
OH 0.25 NaBH4 OCH3 H2O H+ OCH3
OH H+ O O
H COOEt CH2CH 2COOH
HO
2.完成下列合成过程 (1)
O CHO CN PCC NaOAc O O O NaOH H3O O O COOH OH
O
(2)
CH3 O CH2OH + CH3 CHO O OC2H5 O O CH3 Claisen
Cope O
CH3 CHO
H2, Pd-C O
CHO CH3
(3)
C2H5 CH3 OCH3 OCH3 C2H5 O CO2CH3 + H3CO2C CH3 CH3 Claisen Rearrangement OH 2,4-O2NC6H5OH Tol C2H5 CH3 CO2CH3 O
药物合成反应习题
参考答案
第一章 卤化反应
1. 写出下列反应的主要产物( 写出下列反应的主要产物(或试剂) 或试剂) ①
②
③
④
⑤
⑥
1
⑦
⑧
⑨
⑩
2.写出下列反应的可能产物
①
②
2
③
④
3.
①
写出下列反应的主要试剂及条件
②
③ቤተ መጻሕፍቲ ባይዱ
④
第二章 1.
① 完成下列反应
烃化反应
药物合成反应 第一章 卤化反应

对于环烯、桥卤正离子在位阻小的一面形成:
Me Br
OH H Br
甾体化合物
Me
Br
OH
H Br
84-85%
④有重排产物生成,生成更稳定的C 离子 +
Br2 Ph3CCHCH2 CCl4
Ph3CCH CH2Br+Ph2C C CH2BrBrPh70%23%
δ+ δ δ+ δ Ph3CCH CH2+Br Br
N B S /D M S O
O
r.t
(90%)
O g lu A c 4
OAc Br
O
O
O g lu A c 4
四、卤化氢对不饱和烃的加成反应
• 1. 卤化氢对烯烃的加成 • (1)反应通式
• 通卤化氢气体或其饱和有机溶剂,若困难 ,可加Lewis Acid或密封管加热。
• (2)反应机理 • ①离子对过渡态 • ②三分子协同 • ③自由基加成
• (3)影响因素 • 同离子效应,可减少副反应
• (4)应用特点
• 应用烯烃直接制备二卤代烯,困难。炔烃 的卤加成,方便。
二、不饱和羧酸的卤内酯化反应
• (1)反应通式
(2)反应机理
I2 /K I/N a H C O 3 C H2C O 2H H2O /r.t.4h
O
C
H2C
O
I HH
** O O
目录
第一章 第二章 第三章 第四章 第五章 第六章 第七章
卤化反应 烃化反应 酰化反应 缩合反应 重排反应 氧化反应 还原反应
第一章 卤化反应
有机化合物分子中引入碳—卤键 的反应。包括: 亲电加成、亲电取 代、亲核取代及自由基反应(从 机理上考虑)
药物合成反应(第三版)

O CH3 Br2 O
酸碱催化的定位问题
Br CH3
O CH3 SO2Cl2
O Cl CH3
Br2/NaOH
(CH3)3CCOCH3
(CH3)3CCOCBr3
(CH3)3CCOOH
HCBr3
71%-74%
O H3C C CH2CH3
Br2
O H3C C CHCH3 Br
第三节 羰基化合物的卤代反应
R1 R3 R1 OH R3 R4 R1 OH R3
C
R2
C
R4
C
R2 Cl--OH Br--OH
R
C
X R2
C
CX R4X-OH来自HClO实例HBrO
R
R OH Cl
HOCl
+
Cl
OH
Ar-CH CH2
HClO水 中
收率较低 OH -
C OCl
(有 机 溶 剂 中 )
AcOH
Ar-CH-CH2 70%
三、不饱和烃和次卤酸(酯),N-卤代酰胺的反应
NBS
英文名称:N-Bromosuccinimide 别名:N-溴代琥珀酰亚胺。 结构式: NCS NBA NCA
HO Br
NBA/dioxane H2O/HClO4
Br
O
O
O
P h -C H = C H 2
NBA
DMSO
P h -C H - C H 2 OH Br
第一节 不饱和烃的卤加成反应
• 加卤素
C C X2 C X C X
概述
X2=Cl2, Br2
• 加卤化氢
C C HX C H C X HX=HCl, HBr, HI
(完整word版)药物合成反应习题
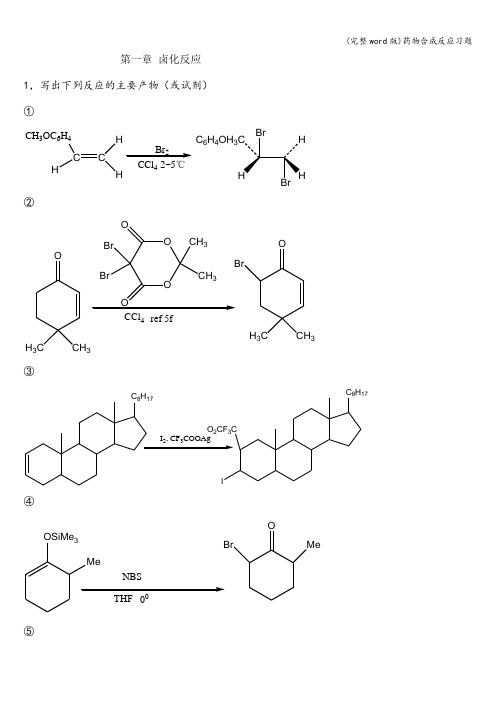
第一章 卤化反应1,写出下列反应的主要产物(或试剂) ①CH 3OC 6H 4C HCHH Br 2CCl 42~5℃C 6H 4OH 3②OH 3CCH 3OOCH 33Br BrOOCCl 4ref 5fOH 3CCH 3Br③④OMe⑤HOHHI 6532C6H6 ref⑥OO ⑦ICH2COOMe AgFFCH2COOMe⑧COCH3⑨BHI 23CH 3OHCH 3CH 2CHICH 32,写出下列反应可能产物①(CH 3)3CCH 2OH3)2CCHCH 3+(CH 3)2CHCH 3CH 3+(CH 3)3CCH2Br②CH 3CC3CH 3NBS,(C 6H5CO)2O 2CCl 4refHCBrH 2CCCOOCH 3CH 3HCH 3CC3CH 2Br H③CH 3CCH 2CH 2CH 3O23240~45℃CH 3COCH 2 CH 2CH 3CH 2COCH 2CH 2CH 3BrBr④C HCC 2H 5CCH 3CCH 3Cl 2,CH 3COOH 25℃Cl C 2H 5CCH 3COCOCH 3C 2H 5CCH 3CCl OCOCH 3C 2H 5++3,写出下列反应的主要试剂及条件①C(CH 2OH)PBr 3/170~180℃C(CH 2Br)4②HOOC(CH 2)4COOHSOCl 2/RefClCO(CH 2)4COCl③PhCH2COCH3SOCl2/Refor,Cl/加热PhCHCOCH3Cl④O COOH Oor I2/LTA/CCl4/refHgO/I2/加热or AgNO3I2加热第二章烃化反应4,完成下列反应①COOCH3OH OH3COOCH3OCH3OH②OHOCH3OHMe2SO4K2CO3OCH3OCH3OH③H3C H2COCH2CH3OH,H2SO43ONaH3CH2COCH3CH2OH3CH2COHCH2OH④(H2C)5CNHO Me SO(H2C)5CNCH3O⑤NO2ClO2N2NO2NHPhO2N ⑥HOHH3CC6H4SO2OH3642(EtO2C)2HCHCH2(COOC2H5)2C2H5ONaC2H5OH⑦NHNHCH2⑧OH3C2,完成下列反应过程①OCC O CH(COOC2H5)2OCCOC(COOC2H5)2NaC2H5ONa25ClCH2COOC2H5 150~160℃OCCON C(COOC2H5)2CH2COOC2H52CH3COOH H2N CHCOOHCH2COOH②CHO+CH3NH2H2/Raney-NiCH2NHCH3O CH2NCH3CH2CH2OH③C6H5CH2NH2(C2H5O)2PHOC6H5CH2NHP(OC2H5)2O250%NaOH (n-C4Hg)4NHSO4C6H5CH2NP(OC2H5)2OCH2CH CH2C6H5CH2NHClCH2CH CH2④OCH 3(H 3C)3C266NCH 3(H 3C)3CN CH 3(H 3C)3CMgBrCH 3OCH 3(H 3C)3CCH 2C=CH 2CH 3第三章 酰化反应①H 3COOCH 3OCH 3+CH 3COClAlCl 3H 3COOCH 3OCH 3C CH 3O②C C CH 2OHO 2NHOHNHCOCHCl 2H+CH 3(CH 2)16COClN/C 6H 6C C CH 2OOC(CH 2)16CH 3O 2NHOHNHCOCHCl 2H③ClCH2CONHS CCOOHNOCH3+H2NNSNNCH3 OH2C SNNSNNNNCH3 OH2C SClCH2CONHS C NOCH3OC④CH3CH3(CH2)5COCl AlCl3ClCH2CH2ClCH3CH3O⑤OCH3 H3COH3CO H3CO2①DMF/POCl3②2OCH3H3COH3COH3COCHO⑥+C6H5NCH3H OPOCl3CHO⑦CH 3COCH 2COOC 2H 5+HOH 3CCOCH 2COO2,完成下列合成路线 ①OH24或25OC 2H 5DMF POCl 3OC 2H 5CHOCl 2OC 2H 5COClH 2NSONHCH 3CH 3COONa2H 5②以苯和丁二酸为起始原料合成四氢萘+OOOAlCl CH 2CH 2COOHOHClCH 2CH 2CHOOHHF CH 32OZn Hg HCl第四章 缩合①COCH 3+HCHO +CH 3NHCOCH 2CH 2NCH 3COCH 2CH 2NCH 3CH 3NHCOCH 2CH 2N(CH 3)2COCH 3+HCHO +HN(CH 3)2②Ph 3PHCHCH 3+3+HCH 3H③CH 3CH 2CH 2COCH 3+CH 3COOC 2H 5碱CH 3CH 2CH 2COCH 2COCH 3④CHO H+BrCH 2COOC 2H ①Zn+C H ②H 2O(C 2H 5)2O CCHCOOC 2H 52,完成下列反应式 ①OCH 3+O 2NCHO OH 2H 3COHCNO 2②O O 2Ph3P CHCH3H3CHC CHCH3③O+CH2O(过量Ca(OH)2H2OOHOH2CHOH2CCH2OHCH2OH④C6H52H5CH2CO)2O,C3H7COOK②NaOH C H CCOOHC2H5⑤O23CH3ONaOCOOCH32OH OCOOH CHO⑥(EtO)2C=O+C6H5CH2CN C2H5ONaC6H5HC COOC2H5 CN⑦(C6H5)3P CH2CH=CH2Cl2NH3C6H6回流(C6H5)3P CHCH=CH2 OCH2CH2CHOH3C6625%OCH2CH2CH=CHCH=CH2H3C⑧CH3CO2CH3O +BrCH2CO2CH3ZnC6H6 (C2H5)2O32H2OCH3CO2CH3CHCOOCH33,完成下列合成反应①从甲苯→CCOOEtC2H5CH3Br2/hv CH2BrNaCNCH2CNCN2H5CHCOOEtC2H5Br CCOOEtCOOEtC2H5加热CH ②CH3 CH3H2CCH3HCCH3CHOCH3 CH3H2CCH3HCCH3CHO33CCHOCH3Pd-CH2 125℃4,填写下列各部产物①α甲基丙醛A(C5H10O2H3OB(C6H12O4)+H2OC(C6H10O3)2222DH3O+AH3C C CHOCH2OHCH3BH3C C CHCH2OHCH3CNCH3C C CHH2CCH3OOOHDH3C CHCCH2OHCH3HN CH2CH2COOCH2PhOHO9H17NO5)+PhCH2OHH3C CHCCH2OHCH3HN CH2CH2COOHOHOE②32CH2COCH3③第五章氧化反应1,完成下列反应式①CH3NO2CrO3/Ac2OH2SO4CHONO2②CH3NO CrO/H O高温高压COOH③CH3CH33CH3CH3COCH32NaOH②H+CH3CH3COOH④⑤⑥CH3OCH3NO2CH3OCH3NO2 CrO ClCS2 25℃⑦HO CH2OH(C5H5N)2 CrO322HO CHO ⑧2C2H5OHOH⑨H33⑩⑾COOOHClH3CH3CHHHOH(C2H5)2O 25℃⑿HCOCH3HOCOCH3C6H5COOOHCHCl32,试以化学表示实现下列变化的各步反应①CHO2525CONH2C2H5①SOCl2②3RCO H CONH2C2H5O②HO(CH2)6CH3H3C SO2ClH3C SO2O(CH2)6CH3DMSOOHC(CH2)5CH3③OHPb(OAc)4CHOCHO 稀NaOH CHO④OH①KOH-t ②HCl,加热OBu-t第六章还原反应1,完成下列反应①CH30.25MNaBH4CH3CH=CHCH2OH②NO2NH NH H OPd-C/C2H2OHNH2③O44or M PVOH④O COC(CH2)3OCH3OCH3Br⑤262BHH2O2 NaOHCH3HHOH⑥H3COOClPb-BaSO4 H2Q-S H3COOH CH3CH3⑦2PHCH2CH=CH2+Pd/C2PHCH2CH2CH3+⑧O⑨OOPh2AcOH,HClO 4HOCH 2CH 2OCH 2CH 2Ph⑩H 322,改错①COOEtHOOCC 2H 6COOEtHOH 2CLAHCH 2OHHOH 2C②CH 3COCOOEtZn-Hg HClCH 3CHOHCOOEt③CH 3OCH 3H 3C HH 3CCH 3LAHCH 3H CH 3H 3C H H 3CCH 3HO3,完成下列合成题1,试由环己醇、氯乙酸、乙醇合成H 2C(H 2C)7CH 2C=OOH2)6ClClCH 2COOH CH 2(COOC 2H 5)22CH 2(COOC 2H 5)2+Cl(CH 2)6ClC 2H 5ONa(C 2H 5OOC)2CH(CH 2)6CH(COOC 2H 5)2①②H 2O NaOH EtOH H +C 2H 5OOC(CH 2)8COOC 2H 5Na C 6H 4(CH 3)2refH 2C (H 2C)7CHOHC=O H 2C (H 2C)7CH 2C=O Zn/HCl HOAc2,试由OOCH 3合成OOOCH 30.25MNaBH 4OHO+O3,试由COOEtHHCH 2CH 2COOHCOOEtHHCH 2CH 2COOHC H OHHCH 2CH 2COONaHCH 2OH+第七章 重排反应1,完成下列反应式 ①OHOH②CONH 2OH H H HO OH H OH HCH 2OH2CONH 2OH HH HO OH H OH HCH 2OH③N C 2H5CH 2C 6H 4OCH 3CH 3C 6H 5Li Et 2ONCH 3C 2H 5CH 2C 6H 9PH 2CO +NC 2H 5CH 2C 6H 5OCH 3PCH 3④N -Cl⑤N CH3CH2N(CH3)3NaNH2/NH3NCH3CH2N(CH3)2⑥CH3OHOH CH3H+2COCH3CH3⑦OCH3CONH2OCH3OCH3NH2OCH3⑧NCEtOOCHNHCEtOOC 180℃⑨OH 3OCH3⑩HO CH2NH2CH3NaNO/H+OH3C⑾HO33142~147℃8 days CH2COOEt⑿CHMe 2Me 2HOCO 2MeMe①HCl-HOAc-Ac 2O ②H 3O CHMe 2CO 2MeMeNH 2二,完成下列合成过程 ①OCHO2KCNOH COCOCOCOOHNO②OCHO+OC 2H 5CH 3OO加热OOHOCHOOOHCOCH 3CHO③H2CCH3EtOCH3+H3COOCCH2OHCH32,4-O2NC6H5OH/Tol100℃ 8hrOCOOCH3HCH3Etclaisen重排COOCH3EtOCH33OHH2CCH3OCH33EtOEtEtCOOCH3CH3claisen重排COOCH3EtOEt CH3NaBH4CH3OHCOOCH3Et Et CH3。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(1).药物合成反应的分类
③按官能团的演变规律分类 : 根据引入的 原子或基团的不同分为: 卤化、 烃化、 酰化、 缩合、 氧化、 还原、 重排等反应类型。
(2)反应试剂的分类
(1)亲电试剂
具有较高的活性能从作用 物得到电子而形成共价键的试剂 。 有三 类:①正离子如C+、Cl+、Br+、I+、NO2+ 等;②可接收孤对电子的分子如Lewis酸; ③羰基碳原子等。
பைடு நூலகம்
讨论与练习
1.学好本课程对从事药物及其中间体合 成工作有何意义? 2.药物合成反应有哪些特点?应如何学 习和掌握? 3.什么是导向基?具体包括哪些类型? 举例说明。 4.查阅报道药物合成领域的新技术及发 展动态资料?
第一章 卤化反应
Halogenation Reaction
定义:有机化合物分子中引入
药物合成反应 Organic Reaction for Drug Synthesis
• 《药物合成反应》是药学专业、制药工 程专业的专业基础必修课.
绪论
一、药物合成课程的目的 二、药物合成的发展趋势与新技术 三、药物合成反应课程教授内容 四、药物合成反应课程的学习方法 五、药物合成反应授课的要求和安排
NH2
NH2
Br2/H2O
Br
Br
1. NaNO2/HCl, 0~5 2. H3PO4
Br
Br
Br
Br
(2)钝化导向基
• 与活化导向基相反,钝化导向基起钝化官能 团的作用,使反应停留在某一阶段。
NH2
(CH3CO)2O
NHCOCH3
Br2
NHCOCH3
H2O
NH2
Br
Br
(3)阻断基
• 阻断基的引入使反应物分子中某一活性部位被 封闭,让分子中其他活性低的部位发生反应并 顺利引入所需的基团,等目的达到后再除去阻 断基。
卤素原子(X)的反应称卤 化反应。 用途: 作为特定活性化合物; 作官能团转化的中间体; 卤原子作为保护剂、阻断剂;
OH
C
(CH2)4COOC2H5
NaBH4/EtOH
OH (2)
r.t. CHO
(2)区域选择性
定义:是指试剂对底物分子中两种不同位 的进攻,从而生成不同产物的情况。
(3)立体选择性
立体选择性是指在给定的条件下,产物 为唯一的立体异构体或某种占优势的立 体异构体为主。
Me
Me
Br2
HO
Br Br
NH2
(CH3CO)2O
NHCOCH3
98% H2SO4
NHCOCH3
HNO3/H2SO4
NHCOCH3 NO2
NH2 NO2
H2O/H
SO3H
SO3H
(4)保护基
• 在多官能团化合物的合成中,为了保护某些 官能团而引入的基团叫保护基 。 • 保护基是药物合成过程中应用最为广泛的导 向基。
3.药物合成反应的分类与试剂的分类
N N N N + RX N N N N RX
环六亚甲基四胺(乌洛托品)
四、药物合成反应课程的学习方法
3. 了解一些新试剂,新反应的特点、应用 范围,并与类似反应进行比较. 4.课后要做练习; 5.重视《药物合成实验》提高自己的动手 能力。
五.药物合成反应授课的要求和安排
• 课堂讲授为主、自学为辅。课堂上的重 点突出,讲解主要内容及难点,因课时 有限,有部分内容要求同学自学。 • 课前要预习.
三、药物合成反应课程教授内容和特点
第一章 卤化反应、 第二章 烃化反应、 第三章 酰化反应、 第四章 缩合反应、 第五章 重排反应、 第六章 氧化反应 第七章 还原反应 第八章 药物合成设计原理。
(一)各单元反应的特点
1.具有较高的选择性 2.导向基(定位基)的应用广泛 3.所用原料、试剂种类多
1.具有较高的选择性
• (1)化学选择性 • (2)区域选择性 • (3)立体选择性
(1)化学选择性
• 定义:是一种区别基团的反应选择性,指反 应试剂对不同官能团或处于不同化学环境的 相同官能团的选择性反应。
O ClCH2CH2 (1)
OH
CrO3/Py/CH2Cl2
LiAlH4/Et2O
OH ClCH2CH2CH(CH2)4CH2OH OH ClCH2CH2CH(CH2)4COOC2H5
四、药物合成反应课程的学习方 法
1 掌握重要药物合成反应、反应的影响因素, 如作用物和试剂活性,主要反应条件,反应 的选择性等及其药物合成的应用,并了解其 反应机理。
NO2
H2/Pd-BaSO4
喹啉 -硫 /二甲苯
NO2
ClOC
CHO
四、药物合成反应课程的学习方法
2 掌握重要人名反应在药物合成中的应用。 Delepine反应
(1).药物合成反应的分类 (2).反应试剂的分类
(1).药物合成反应的分类
①按新键的形成分类 分为:
碳 —碳键形成; 碳—卤键形成; 碳—氮键形成; 碳—杂键形成等反应类型。
(1).药物合成反应的分类
②按反应机理分类分为: • 亲电取代、 • 亲电加成、 • 亲核取代、 • 亲核加成、 • 自由基等反应类型。
(2)反应试剂的分类
亲核试剂 在反应过程中,提供电子与作 用物形成共价键的试剂。有三类: • ①负离子如Cl—,OH—,RO—,NH2—等; • ②具有孤对电子的分子如H2O, ROH, RNH2等; • ③具有π 电子的烯键、芳烃等
(2)反应试剂的分类
• 自由基试剂 由共价键均裂所产生的带有 独电子的中性基团
Me
HO Cl2 HO
Cl
Cl
2.导向基(定位基)的广泛应用
(1)活化导向基 (2)钝化导向基 (3)阻断基 (4)保护基
(1)活化导向基
• 导向基的引入使分子的某一部位变得比其他 部位更容易发生反应,即此时导向基所起的 作用是活化和定位导向双重作用。
NO2
H2SO4 / HNO2 55 Fe/HCl
一、药物合成反应课程的目的
• 使学生在学习有关基础课程后能系统地 掌握药物制备中重要的有机合成反应和 合成设计原理,培养学生在实际药物合 成工作中设计、分析问题和解决问题的 能力。
二、药物合成的发展趋势与新技术
• 1.药物合成实现绿色化生产。 • 2.微生物转化应用于药物合成,许多难以 用化学方法实现的反应得以顺利进行。 • 3.半合成药物技术得到广泛的应用。 • 4.利用不对称合成、区域控制和立体选择 性控制等技术制备手性药物。 • 5.药物合成技术与生物技术相结合实现仿 生合成。
