(优选)药物合成反应第五章习题药物合成反应习题第五章重排反应
药物合成反应 第五章 重排反应

• (2) the R1 group has to be able to stabilize carbanions, so it is often an electronwithdrawing group;
反应机理
O R-C-R'
+
H+
OH
OH R-C-R'
+
-H
+
OH R-C-R' O-OCR" O
R-C-R'
O R"COO-HR R' C O NhomakorabeaO
H O
R´重排 O-O键断裂 -H+
O R-C-OR'
O
C R"
-R´´COO- ,
R3C- > R2CH- ,
>
CH 2
>
>RCH2- > CH3-
3. 从杂原子到碳原子的重排
Examples
Arndt-Eistert synthesis • 1. 反应通式
• 2. 反应机理
• 3. 应用特点 • 羧酸同系化C+1
第三节 碳原子到杂原子重排
一、Beckmann重排
OH
• 1. 反应通式
H+ O R´-C-NHR
R' C=N R
酮肟在酸性催化剂的作用下重排成酰胺 的反应称为贝克曼重排。
(5)拜耳-魏立格氧化重排
O RCR' + CH3COOOH
药物合成反应_第五章_重排反应

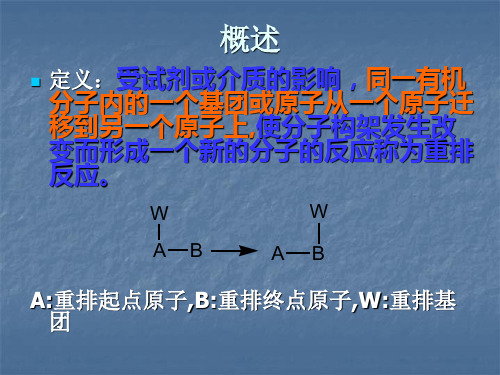
重 排
1
(CH3)3C-CH2OH
③烯烃+氢离子
-H2O H+
(CH3)3C-CH2
Wagner-Meerwein
(CH3)3C-CH=CH 2 +
Ag
(CH3)3C-CH-CH3
OCH3
H3C
Cl
④重氮盐放氮 H3C C CH2Cl (CH3)3 C-CH 3NH2 CH 3
重排的顺序:
∨
∨
CH3 CH3
CH2 CH2
莰烯
CH2
TsOH C6H6 H3C
CH3
CH3
CH3
CH2
CH3
CH3
反应机理:
重 排
1
Pinacol
邻二醇类化合物在酸催化下,失去一分子水重排生成醛或酮的反应,称为Pinacol重排。
反应机理:
R1
R2 R3 H C C R4 OHOH
R1
R2 R3 R3 1,2-迁移 C C R4 R1 C C R4 - H OH OHR2
O O OR Br Br Br Br O O O OR
重 排
4
Wolff/Arndt-Eistert
α-重氮酮在银、银盐或铜存在条件下,或用光照射或热分解都消除氮分子而重排为烯酮,
生成的烯酮进一步与羟基或胺类化合物作用得到酯类、酰胺或羧酸的反应称为Wolff重排。
反应机理:
R' C C N N O R
Ph CH3 Ph
Ph CH3 Ph C C CH3
Ac2O/ZnCl2
CH3 C O C Ph
CH3 Ph C O C Ph CH3
C
C
CH3
药物合成反应习题答案

药物合成反应习题答案药物合成反应习题答案药物合成反应是药物化学中的重要内容,通过合成反应可以获得特定结构的化合物,从而用于研发新药。
在药物合成反应的学习过程中,习题是不可或缺的一部分,通过解答习题可以加深对药物合成反应的理解和应用。
下面将给出一些药物合成反应习题的答案,帮助读者更好地掌握这一知识点。
1. 请给出以下反应的产物:(a) CH3CH2CH2MgBr + H2O(b) CH3CH2CH2COOH + SOCl2(c) C6H5CH2OH + H2SO4(a) CH3CH2CH2MgBr + H2O答案:CH3CH2CH2OH + Mg(OH)Br(b) CH3CH2CH2COOH + SOCl2答案:CH3CH2CH2COCl + SO2 + HCl(c) C6H5CH2OH + H2SO4答案:C6H5CH2OSO2OH + H2O2. 请给出以下反应的产物和反应类型:(a) CH3CH2CH2Br + NH3(b) CH3COOH + CH3OH(c) CH3CH2CH2OH + PCl5(a) CH3CH2CH2Br + NH3答案:CH3CH2CH2NH2 + HBr反应类型:亲核取代反应(b) CH3COOH + CH3OH答案:CH3COOCH3 + H2O反应类型:酯化反应(c) CH3CH2CH2OH + PCl5答案:CH3CH2CH2Cl + POCl3 + HCl反应类型:亲电取代反应3. 请给出以下反应的产物和反应机理:(a) CH3CH2CH2OH + H2SO4(b) CH3CH2CH2COOH + NaOH(c) CH3CH2CH2Br + Mg(a) CH3CH2CH2OH + H2SO4答案:CH3CH2CH2OSO2OH + H2O反应机理:在酸性条件下,H2SO4负责质子化,使得CH3CH2CH2OH中的羟基离子化,生成CH3CH2CH2O+,然后与H2SO4中的SO42-发生亲核取代反应。
药物合成考试题及答案

第一章卤化反应试题一.填空题。
(每空2分共20分)1.2Cl和2Br与烯烃加成属于(亲电)(亲电or亲核)加成反应,其过渡态可能有两种形式:①( 桥型卤正离子 )②(开放式碳正离子)2.在醇的氯置换反应中,活性较大的叔醇,苄醇可直接用(浓HCl )或( HCl )气体。
而伯醇常用(LUCas)进行氯置换反应。
3.双键上有苯基取代时,同向加成产物(增多){增多,减少,不变},烯烃与卤素反应以(对向加成)机理为主。
4在卤化氢对烯烃的加成反应中,HI、HBr、HCl活性顺序为(HI>HBr>HCl )烯烃RCH=CH2、CH2=CH2、CH2=CHCl的活性顺序为( RCH=CH2>CH2=CH2>CH2=CHCl )5写出此反应的反应条件-----------------( NBS/CCl hv,4h)Ph3CCH2CH CH2Ph3CCH CHCH2Br5 二.选择题。
(10分)1.下列反应正确的是(B)A. B.C.(CH3)3HCH2CHCl(CH3)3C CHCH3ClD.Ph3C CH CH22CCl4/r,t.48h3CHCBrCH2Br2.下列哪些反应属于SN1亲核取代历程(A)A.(CH3)2CHBr+H2O(CH3)2CHOH+HBrB.CH2I+CH2CNNaCN+NaIC. NH3+CH3CH2I CH3CH3NH4+ID. CH3CH(OH)CHCICH3+CH3CHOCHCH3CH3ONa3.下列说法正确的是(A)A、次卤酸新鲜制备后立即使用.B、次卤酸酯作为卤化剂和双键反应, 在醇中生成卤醇, 在水溶液中生成卤醚.C、次卤酸(酯)为卤化剂的反应符合反马氏规则, 卤素加在双键取代基较多的一端;D、最常用的次卤酸酯: 次氯酸叔丁酯(CH3)3COCl是具有刺激性的浅黄色固体.4.下列方程式书写不正确的是(D)A.RCOOH RCOCl + H3PO3PCl3B.RCOOH RCOCl + SO2 + HClSOCl2C.D.5、N-溴代乙酰胺的简称是(C)A、NSBB、NBAC、NBSD、NCS 三.补充下列反应方程式(40分)1O EtO t-BuOCl / EtOH-55~0℃OEtOClOEt.2.CH3(CH2)2CH2CH=CHCH3NBS / (PhCO)2O24CH3(CH2)2CHCH=CHCH3Br3.4.5.6.7.8.9.10. NHCOOHNHCOOC2H5C2H5OH, H2SO4Br NO2BrHNO3 / H2SO4BrBrC.H2CH2COCH3四.简答题(20分)1.试从反应机理出发解释酮羰基的α-卤代在酸催化下一般只能进行一卤代,而在碱催化时则直接得到α-多卤代产物。
药物合成反应习题集.

《药物合成技术》习题集适用于制药技术类专业第一章 概论一、本课程的学习内容和任务是什么?学好本课程对从事药物及其中间体合成工作有何意义?二、药物合成反应有哪些特点?应如何学习和掌握? 三、什么是化学、区域选择性?举例说明。
四、什么是导向基?具体包括哪些类型?举例说明。
五、药物合成反应有哪些分类方法?所用试剂有哪些分类方法?举例说明。
六、查资料写一篇500字左右的短文,报道药物合成领域的新技术及发展动态?第二章 卤化技术(Halogenation Reaction )一、简答下列问题1.何为卤化反应?按反应类型分类,卤化反应可分为哪几种?并举例说明。
2.在药物合成中,为什么常用卤化物作为药物合成的中间体?3.在较高温度或自由基引发剂存在下,于非极性溶剂中,B r 2和NBS 都可用于烯丙位和苄位的溴取代,试比较它们各自的优缺点。
4.比较X 2、HX 、HOX 对双键离子型加成的机理、产物有何异同,为什么?5.解释卤化氢与烯烃加成反应中,产生马氏规则的原因(用反应机理)。
为什么Lewis 酸能够催化该反应?6.解释溴化氢与烯烃加成反应中,产生过氧化效应的原因?7.在羟基卤置换反应中,卤化剂(HX 、SOCl 2、PCl 3、PCl 5)各有何特点,它们的使用范围如何?二、完成下列反应C CH 3CH 3CHCH 3Ca(OCl)2/AcOH/H 2O1.Ph 2CHCH 2CH 2OH32.CH 3SO 2ClCl /AIBN3.OH4CH 3CH 35.2OC O CH 3OHI 2/CaOAcOK Me 2CO?6.三、为下列反应选择合适的试剂和条件,并说明原因。
(CH 3)2C CHCH 3CHCH 2Br(CH 3)2C 1.CH 3CH CH COOHCH 3CH CH COCl 2.HOCH 2(CH 2)4CH 2OH(CH 2)4CH 2I CH 2I 3.CH 3OCH 2CH 2CO 2HCH 2CHCOBrBrCH 3O 4.CH 3CH CH CO 2CH 3CH 2CH CH CO 2CH 3Br 5.O2CH 2OH CH 2CH 2OHOCH 2CH 2CH 2CH 2ClCl 6.CH 2OH3CH2Cl37.8.BrCH 2(CH 2)9COOH CH 3CH(CH 2)8COOHBrCH 2CH(CH 2)8COOHCH 32CH 2C(COOC 2H 5)NHCOCH 3CH 2Br2CH 2C(COOC 2H 5)39.CH 2NO 2CH 2N(CH 2CH 2OH)2C(COOC 2H 5)3(抗肿瘤药消卡芥)CH 2NO 2CH 2N(CH 2CH 2Cl)2CHCOOH 2CH 2NO 2CH 2N(CH 2CH 2Cl)2C(COOC 2H 5)310.CH 3(CH 2)5OCH 3C 2H 5CH 3(CH 2)5OCH 2BrC 2H 5CH3(CH 2)5OOHC 2H 5CH 3(CH 2)4CH 2OHCH 3(CH 2)4CH 2Cl CH 3(CH 2)4CH 2Cl (构型反转)(构型保持)11.OC 2H 5OC 2H 5Br12.四、分析讨论1.试预测下列各烯烃溴化(Br 2/CCl 4)的活性顺序。
药物合成反应第五章 重排反应

重排反应中键的裂解和形成方式: 异裂(离子型) 均裂(游离基型) 环状过渡态(σ键迁移型)
离子型重排反应: 1.阴离子型重排(亲核重排)
C— A— Y Z -Y C— A Z C— A — Z
2.阳离子型重排(亲电重排)
X— B— C Y -Y X— B— C B— C X
3.游离基型重排反应: 重排反应中间体呈游离基状态
O
O COEt
*
5 0%
COEt
+ *
5 0%
*
O Ar X R
M eO Ar M eO H
OR X
-X
-
OAr R
O M eO Ar R
-
R Ar C O 2M e
M eO H
R Ar C O 2M e
• 碳负离子缺少共振稳定时 • 卤代酮羰基无可烯醇化的氢时 • 二卤代酮时
五 、Wolff(沃尔夫)重排 和Arndt-Eistert (阿恩特-埃斯特尔特)
例:
C 2H 5 C C 2H 5 Br CONH2 N a O Br H 2O
C 2H 5 C 2H 5 C O
(3)构型保持
Ph H2 H * C O N H B r 2 /N a O H C C 2 CH3 Ph H2 H * C C NH2 CH3
(4)当酰胺分子的适当位置有羟基、氨基存在时, 可以分子内成环。
HO HNO2
CH2 O
O HBr Cl C Ph C H Ph
A g N O 2 /E tO H Cl
O C
H C
Ph Ph
HO
Ph SPh
O Ph
HO O
CH3 Ph
Ph
O CH3
药物合成反应

四.缩合反应定义:两个及两个以上有机化合物通过反应形成一个新的较大分子或同一分子内部发生分子内的反应形成新分子的反应称为缩合反应。
Aldol:定义:在稀酸或稀碱催化下(通常为稀碱),一分子醛(或酮)的 氢原子加到另一分子醛(或酮)的羰基氧原子上,其余部分加到羰基碳上,生成 -羟基醛(或酮),这个增长碳链的反应称为α-羟烷基化反应。
但该类化合物不稳定,易消除脱水生成α,β-不饱和醛酮,又称Aldol缩合反应。
Aldol特点:酮:活性小于醛,反应速度慢。
1. 对称酮产物较单纯。
2. 不对称酮的自身缩合,在碱性或酸性催化下,反应都发生在取代较少的羰基碳原子上。
羟醛缩合催化剂碱:弱碱(如Na3PO4、NaOAc、Na2CO3、K2CO3、NaHCO3),强碱(如NaOH、KOH、NaOEt、NaH、NaNH2)酸:盐酸、硫酸、对甲苯磺酸、三氟化硼以及阳离子交换树脂等Cannizzaro反应(歧化反应)定义:凡α位碳原子上无活泼氢的醛类和浓NaOH或KOH水或醇溶液作用时,不发生醇醛缩合或树脂化作用而起歧化反应生成与醛相当的酸(成盐)及醇的混合物。
此反应的特征是醛自身同时发生氧化及还原作用,一分子被氧化成酸的盐,另一分子被还原成醇。
甲醛的羟甲基化反应和交叉Cannizzaro反应能同时发生,是制备多羟基化合物的有效方法。
定向醇醛(酮)缩合方法:A.烯醇盐法:醛或酮与具位阻的碱如LDA(二异丙胺锂)作用,形成烯醇盐再与另一分子醛或酮作用,B.烯醇硅醚法:醛、酮转变成烯醇硅醚,在TiCl4催化下与另一分子醛、酮分子作用。
C. 醛、酮与胺形成亚胺,与LDA形成亚胺锂盐,再与另一分子醛、酮作用。
Diels-Alder反应含有一个活泼的双键或叁键的烯或炔类和二烯或多烯共轭体系发生1,4-加成,形成六员环状化合物的反应称为Diels-Alder反应。
该反应易进行且反应速度快,应用范围广,是合成环状化合物的一个非常重要的方法。
药物合成考试题及答案

第一章卤化反应试题一.填空题。
(每空2分共20分)1.2Cl和2Br与烯烃加成属于(亲电)(亲电or亲核)加成反应,其过渡态可能有两种形式:①( 桥型卤正离子 )②(开放式碳正离子)2.在醇的氯置换反应中,活性较大的叔醇,苄醇可直接用(浓HCl )或( HCl )气体。
而伯醇常用(LUCas)进行氯置换反应。
3.双键上有苯基取代时,同向加成产物(增多){增多,减少,不变},烯烃与卤素反应以(对向加成)机理为主。
4在卤化氢对烯烃的加成反应中,HI、HBr、HCl活性顺序为(HI>HBr>HCl )烯烃RCH=CH2、CH2=CH2、CH2=CHCl的活性顺序为( RCH=CH2>CH2=CH2>CH2=CHCl )5写出此反应的反应条件-----------------( NBS/CCl hv,4h )Ph3CCH2CH CH2Ph3CCH CHCH2Br5 二.选择题。
(10分)1.下列反应正确的是(B)A.B.C.(CH3)3HCH2CHCl(CH3)3C CHCH3ClD.Ph3C CH CH22CCl4/r,t.48h3CHCBrCH2Br2.下列哪些反应属于SN1亲核取代历程(A)A.(CH3)2CHBr+H2O(CH3)2CHOH+HBrB.CH2I+CH2CNNaCN+NaIC. NH3+CH3CH2I CH3CH3NH4+ID. CH3CH(OH)CHCICH3+CH3CHOCHCH3CH3ONa3.下列说法正确的是(A)A、次卤酸新鲜制备后立即使用.B、次卤酸酯作为卤化剂和双键反应, 在醇中生成卤醇, 在水溶液中生成卤醚.C、次卤酸(酯)为卤化剂的反应符合反马氏规则, 卤素加在双键取代基较多的一端;D、最常用的次卤酸酯: 次氯酸叔丁酯 (CH3)3COCl是具有刺激性的浅黄色固体.4.下列方程式书写不正确的是(D)D.5、N-溴代乙酰胺的简称是(C)Br NO2BrHNO3 / H2SO4BrBrA、NSBB、NBAC、NBSD、NCS 三.补充下列反应方程式(40分)1O EtO t-BuOCl / EtOH-55~0℃OEtOClOEt.2.CH3(CH2)2CH2CH=CHCH3NBS / (PhCO)2O24CH3(CH2)2CHCH=CHCH3Br3.4.5.6.7.8.9.10.四.简答题(20分)1.试从反应机理出发解释酮羰基的α-卤代在酸催化下一般只能进行一卤代,而在碱催化时则直接得到α-多卤代产物。
第五章-重排反应

二、 Pinacol重排
(邻二醇或邻二官能团合成醛酮的方法)
药 学 院 药 物 合 成 反 应
定义:在酸催化下,邻二叔醇失去一分子水, 重排成醛或酮的反应称Pinacol重排。
R1发生1,2-迁移
1
2
1
2
邻二醇
羰基类化合物
13
二、 Pinacol重排
反应机理:
(☆☆☆☆☆)
邻二醇
不对称的质子化酮
RCONH2 + NaOBr R N C O H2O RNH2
机理:
R C NH2 O OH Br2 R C NHBr O R N C O
R C N Br O
• 供电性R速度快于 吸电性R • 重排后R保留原来 手性
40
H2O/OH
RNH2 + CO3
2
36
15
二、 Pinacol重排 2、影响因素
i. 碳正离子稳定性的影响
ii. 立体化学因素的影响
iii.迁移基团迁移能力的影响
iv.反应条件的影响
16
i. 碳正离子稳定性的影响
关键:不对称连二醇类化合物重排的方向决定于羟基失去后,所 生成碳正离子的稳定性,通常与基团迁移能力的大小无关 。
不对称的邻二醇
OH COOH O
29
4)Favorski 卤化酮重排 法沃尔斯基重排
(☆☆☆)
定义: -卤代酮在亲核碱(NaOH, RONa等)条件下,发生重排,α-基团迁移到 卤素位置,得到羧酸盐、酯或酰胺的反应称为Favorski卤化酮重排反应。
R EtONa/EtOH O C X C CH3 NaOH R R C COOEt α-卤代酮的反应 COOH
药物合成考试题及答案

第一章卤化反应试题一.填空题。
(每空2分共20分)1.Cl和2Br与烯烃加成属于(亲电)(亲电or亲核)加成反应,其过2渡态可能有两种形式:①( 桥型卤正离子 )②(开放式碳正离子)2.在醇的氯置换反应中,活性较大的叔醇,苄醇可直接用(浓HCl )或( HCl )气体。
而伯醇常用(LUCas)进行氯置换反应。
3.双键上有苯基取代时,同向加成产物(增多){增多,减少,不变},烯烃与卤素反应以(对向加成)机理为主。
4在卤化氢对烯烃的加成反应中,HI、HBr、HCl活性顺序为(HI>HBr>HCl )烯烃RCH=CH2、CH2=CH2、CH2=CHCl的活性顺序为( RCH=CH2>CH2=CH2>CH2=CHCl )5写出此反应的反应条件-----------------( NBS/CCl hv,4h)Ph3CCH2CH CH2Ph3CCH CHCH2Br5 二.选择题。
(10分)1.下列反应正确的是(B)A.C CH CBr C CH3Br2+= B.C.(CH3)3HCH2CHCl(CH3)3C CHCH3ClD.Ph3C CH CH22CCl/r,t.48h3CHCBrCH2Br2.下列哪些反应属于SN1亲核取代历程(A)A.(CH3)2CHBr+H2O(CH3)2CHOH+HBrB .CH 2I +CH 2CNNaCN+NaIC. NH 3+CH 3CH 2ICH 3CH 3NH 4+ID. CH 3CH(OH)CHCICH 3+CH 3C H OC H CH 3CH 3ONa3.下列说法正确的是(A ) A 、次卤酸新鲜制备后立即使用.B 、次卤酸酯作为卤化剂和双键反应, 在醇中生成卤醇, 在水溶液中生成卤醚.C 、次卤酸(酯)为卤化剂的反应符合反马氏规则, 卤素加在双键取代基较多的一端;D 、最常用的次卤酸酯: 次氯酸叔丁酯 (CH3)3COCl 是具有刺激性的浅黄色固体.4.下列方程式书写不正确的是(D )A.RCOOH RCOCl + H 3PO 3PCl 3B.RCOOH RCOCl + SO 2 + HCl SOCl 2C.N HCOOHN HCOOC 2H 5C 2H 5OH, H 2SO 4D.5、N-溴代乙酰胺的简称是(C )A 、NSB B 、NBAC 、NBSD 、NCS三.补充下列反应方程式(40分)1BrNO 2BrHNO 3 / H 2SO 4BrBrOEtO t -BuOCl / EtOH-55~0℃OEtOCl OEt .2.CH 3(CH 2)2CH 2CH=CHCH 3NBS / (PhCO)2O 24CH 3(CH 2)2CHCH=CHCH 3Br3.CH 2=CHCH 2C CHBr 2BrCH 2CHBrCH 2C CH4.R -CH=CH -CH 2-CH -OHOX 2OO RX5.PhCCCH 3CCPhBrBrCH 36.PhCHCH 2PhH C OHCH 2BrNBS/H 2O 25o C,35min7.COClClOHCClCl 28.COOAgNO 2BrO 2NBr 2/CCl 4加热3h9.10.O HB rO HO HBrBr1molBr /CS t-BWNH2-70c四.简答题(20分)1.试从反应机理出发解释酮羰基的α-卤代在酸催化下一般只能进行一卤代,而在碱催化时则直接得到α-多卤代产物。
药物合成重排反应
RR H+
RCCR
R R C CR
OH OH
OR
机理:
RR R C C R H+
OH OH
RR R C CR
OH
R R C CR
OH R
H+
R
-H+
R
R CCR
R CCR
OH R
OR
第一节 从碳原子到碳原子的重排
▲二 频纳醇重排(Pinacol)
Pinacol重排-----碳正离子1,2-迁移的立体化学
迁移基团 相同位相,同面迁移保留构型为主
终点碳原子 ①迁移基团在离去基团离子之前发生迁移构型反转
②迁移基团与离去基团邻位交叉,且碳正离子寿命很 短构型保留。
1 四取代乙二醇:
第一节 从碳原子到碳原子的重排
▲二 频纳醇重排(Pinacol)
NHTs
NHTs
NHTs
OH H
异冰片
-H
CH2
莰烯 CH2
反应实例:
第一节 从碳原子到碳原子的重排
▲一、 Wangner-Meerwein重排
Ph
CH3 OTs C CH CH3
PhH
CH3 *
H3C C C* Ph CH3 CH3
CH3 Ph C C*H CH2
H
CH3
Ph C C* CH3 CH3 CH3 +
R2
R1 R4 C C R5
H+(-H2O)
R3 OH
R1 R4 R2 C C R5
R3
重排
药物合成反应复习题

第一章卤化反应1 卤化反应在有机合成中的应用?为什么常用一些卤代物作为反应中间体?2 归纳下常用的氯化剂、溴化剂都有哪些?它们的主要理化性质及应用范围?3 根据反应历程的不同,讨论一下卤化反应的类型、机理及对反应的影响。
(1)卤素对双键的离子型加成(2)芳香环上的取代(3)方向化合物侧链上的取代(4)卤化氢对醇羟基的置换(5)NBS 的取代反应4 比较X2、HX 、HOX 对双键的离子型加成反应的机理又何异同点。
怎样判断加成方向5 在-OH 得置换反应中各种卤化剂各有何特点?他们的应用范围如何?6 预测Br2/CCl4 于下列各种烯烃进行溴化反应的相对速度的次序。
CH2=CH2 (CH3)2C=CH2 HOOC-CH=CH-COOH (CH3)2C=C(CH3)2 CH3CH2=CH2 CH2=CH-CN7 对比下列反应的条件有何不同?结合反应机理加以说明:H3C CH2 CH 2Br(1)H3C CH CH 2H3C CHBr CH 3CH 3Cl CH 3(2)CH 2ClRH 2C CH CH 2(3) R H 2C CH CH 2BrRH 2C C CH 2OH8 下列反应选用何种氯化剂为好?说明原因。
(1) H3C C CH CH3 H3CC CH CH 2BrCH 3 CH 3(2)H3 C HC CH COOH H3C HC CH COCl(3) HO (CH 2 )6 OH IH2C(CH 2)4 CH 2 OH(4) H3CCO C H 2CH 2 COOH H3 CCO CH2CHCOBrBr(5) H3 CO CH2 OHH3CO CH 2 ClH2C C (CH 2 )6 COOHCl(6)H2 C HC (CH 2)6 COOHBr H2C (CH 2)6 COOHCOOHCOOHCOCl(7)Cl Cl HO OHNCl Cl NNCOClHO OHN9 完成下列反应,写出主要的试剂及反应条件:OHOH(1)COOH COClCH 3 CF3(2)(3) CH3COOHFXH2COOH(4) O COOH O I10 完成下列反应,写出其主要生成物(1) H3C C CHCH3Ca(OCl) 2/HOAc/H 2OH3C(2)HC CH2NBS/H 2O(3) CH3 C CH 2HBr/Bz2O2(4) OH 48%HBr(5) C H 2CH=CHCH2CH=CHBrCH 2=CH-COO-CH-CH 2 1molBr2/CCl4(CH 3)2C=CHCH 2CH=CH 2第二章烃化反应一烃化剂的种类有哪些?进行甲基化和乙基化反应时,应选用那些烃化剂?引入较大烃基时选用那些烃化剂为好?二用卤代烃对氨基和羟基的烃化反应各有何特点?烃化剂及被烃化物的结构对反应有何影响?三用于制备较纯的伯胺的方法有那几种?四举例说明“还原烃化”、“羟乙基化”的机理、特点及反应中的注意事项。
(优选)药物合成反应第五章习题药物合成反应习题第五章重排反应

Wolff重排
Arndt-Eistert合成
2. 反应机理
3. 影响因素
4. 应用特点
(1) 由羧酸制备多一个碳原子的酸或其衍生物
(2) 由α-重氮酮制备缩环产物
第三节 从碳原子到杂原子的重排
一、Beckmann重排
肟类化合物在酸性催化剂作用下,烃基向氮 原子迁移,生成取代酰胺的反应,称为 Beckmann重排
(1) 卤代烃Wagner-Meerwein重排
(2) 醇类化合物Wagner-Meerwein重排
(3) 烯烃化合物Wagner-Meerwein重排
(4) 胺化合物Wagner-Meerwein重排
二、Pinacol重排
连二醇类化合物用酸处理时重排生成醛或 酮的反应,称为Pinacol重排反应。 1. 反应通式
(2) 溶剂的影响 (3) 酮肟结构的影响
4. 应用特点
(1) 脂环酮肟生成扩环内酰胺
(2) 立体专一性
Beckmann重排中,与离去羟基处于反位的基 团发生迁移,具立体专一性
(3) 制备苯并噁唑或苯并咪唑衍生物
二、Hofmann重排
未取代的酰胺与次溴酸钠(或溴与氢氧化钠) 作用,得到少一个碳原子的伯胺的反应称 为Hofmann重排
三、二苯基乙二酮 ——二苯乙醇酸型重排
二苯基乙二酮(苯偶酰)类化合物用碱处理,生 成二苯基-羟基酸(二苯乙醇酸)的反应称为苯偶 酰-二苯乙醇酸型重排反应。
1. 反应通式
2. 反应机理
4. 应用特点
(1) 制备二芳基乙醇酸
(2) 制备环状酮
缩小一个碳
四、Favorskii重排
-卤代酮在亲核碱(NaOH,RONa等)存在的条 件下,发生重排得到羧酸盐、酯或酰胺的反 应称为Favorski重排
药物合成方程式+名词解释+反应机理 石皮 石...
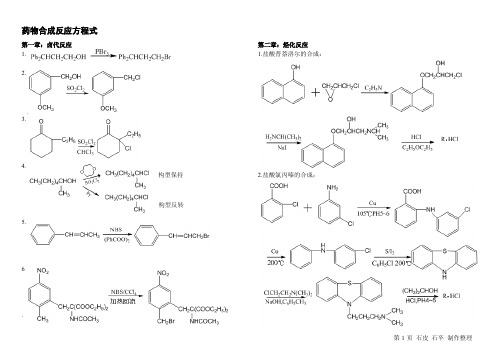
药物合成反应方程式第一章:卤代反应1.2.3.4.5.6.第二章:烃化反应1.盐酸普萘洛尔的合成:2.盐酸氯丙嗪的合成:构型保持构型反转4.第三章:酰化反应 1. 2. 3. 4第四章:缩合反应 1. 2. 3 4.6.7.8.9.10.11. 13.第五章:重排反应1.2.3.4.5.7.8.9. 11.12.13.14.15.17.第六章:氧化反应 一、完成下列反应: 1. 2. 3. 4. 5. 6. 7. 8. 9. 10.℃℃11.12.13.14.二、写出下列反应的主要试剂和反应条件:1.2. 3.4.5.6.7.8.9.第七章:还原反应 一、完成下列反应: 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11.二、写出下列反应的化学试剂和反应条件: 1.2.3.4.5. 其他:1.在利尿药氯噻酮的中间体对氯苯甲酸的制备中,为什么1mol的邻苯二甲酸酐要用2.4mol的AlCl3为催化剂?若傅克酰化反应中用酰氯为酰化剂,催化剂AlCl3的用量如何?反应结束后,产物如何从反应中分离?2.下列两种甾醇以鉻酸氧化时,哪一种速度快,为什么?药物合成名词解释1.Adams’ catalyst (Adams催化剂):将氯铂酸铵与硝酸钠混合均匀后灼热熔融,氧化过程中有大量二氧化氮放出,经洗涤等处理后即得二氧化铂催化剂。
2.Arndt-E istert reaction (Arndt-E istert重排):Arndt-Eistert等用酰氯与重氮甲烷反应得α-重氮酮,再经Wollf重排,生成比原酰氯多一个碳的羧酸,该反应环称Arndt-Eistert反应。
3.Baeyer-Villiger oxidation (Baeyer-Villiger氧化反应):在酸催化下,醛或酮与过氧酸作用,在烃基与羰基之间插入氧生成酯的反应称为Baeyer-V illiger氧化重排。
4.Beckmann rearrangement (Beckmann重排):醛肟或酮肟在酸性催化剂作用下重排成取代酰胺的反应称Beckmann重排。
药物合成反应知识复习资料收集

药物合成反应知识点复习题资料第一章绪论1、药物合成反应主要研究对象:化学合成药物2、药物合成反应中反应类型有哪几种?①按有机分子的结构变换方式分:新基团的导入反应;取代基的转化反应;有机分子的骨架。
②按反应机制分:极性反应(a.亲核试剂、b.亲电试剂);自由基反应;协同反应3、化学品的安全使用说明书——MSDS4、原子经济性反应:“原子经济性”是指在化学品合成过程中,合成方法和工艺被设计成能把反应过程中使用的所有原料尽可能多的转化到最终产物中。
5、三废:废气、废水、废渣第二章硝化反应定理1、混酸硝化试剂的特点有哪些?①硝化能力强;②氧化性较纯硝酸小;③对设备的腐蚀性小○+2、硝化试剂的活泼中间离子为:硝酰正离子NO23、桑德迈尔反应定义及应用定义:在氯化亚铜或溴化铜的存在下,重氮基被氮或溴置换的反应;重氮基被氰基置换:将重氮盐与氰化亚铜的配合物在水介质中作用,可以使重氮基被氰基置换,该反应也称Sandmeyer反应。
应用:CuX+Ar-N2X Ar-X+N2 (X:Cl,Br,-CN)4、常用的重氮化试剂一般是由盐酸、硫酸、过氯酸和氟硼酸等无机酸与亚硝酸钠作用产生。
5、硝化反应定义:指向有机分子结构中引入硝基(—NO2)的反应过程,广义的硝化反应包括生产(C—NO2、N—NO2和O—NO2)反应。
6、重氮化反应定义:含有伯氨基的有机化合物在无机酸的存在下与亚硝酸钠作用生成重氮盐的反应。
7、硝化剂:单一硝酸、硝酸和各种质子酸、有机酸、酸酐及各种Lewis酸的混合物。
8、生成硝基烷烃的难易顺序:卤代烃中卤素被取代的顺序:9、DMF:DMSO:10、常用的重氮化试剂有哪些?NaNO2+HCl/H2SO4第三章卤化反应原理1、Ph上取代基对卤化反应的影响①催化剂的影响;②芳环结构的影响;③反应温度的影响; ④卤化剂的影响; ⑤反应溶剂影响2、醇与HCl 发生卤置换反应活性顺序醇羟基的活性顺序:叔(苄基、烯丙基)醇>仲醇>伯醇 氢卤酸的活性顺序:HI >HBr >HCL 3、NBS 的应用(N —溴代丁二酸亚胺)①N —卤代酰胺与不饱和烃的卤取代反应机制:RCH 2CH=CH 2+NBS RCHBrCH=CH 2本反应属自由基型反应,可在光照下引发自由基②N —卤代酰胺与不饱和烃的加成反应:在质子酸(醋酸、溴氢酸、高氯酸)的 催化下,N —卤代酰胺与烯烃加成易制备错误!未找到引用源。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(2) 醇类化合物Wagner-Meerwein重排
(3) 烯烃化合物Wagner-Meerwein重排
(4) 胺化合物Wagner-Meerwein重排
二、Pinacol重排
连二醇类化合物用酸处理时重排生成醛或 酮的反应,称为Pinacol重排反应。 1. 反应通式
三、二苯基乙二酮 ——二苯乙醇酸型重排
二苯基乙二酮(苯偶酰)类化合物用碱处理,生 成二苯基-羟基酸(二苯乙醇酸)的反应称为苯偶 酰-二苯乙醇酸型重排反应。
1. 反应通式
2. 反应机理
4. 应用特点
(1) 制备二芳基乙醇酸
(2) 制备环状酮
缩小一个碳
四、Favorskii重排
-卤代酮在亲核碱(NaOH,RONa等)存在的条 件下,发生重排得到羧酸盐、酯或酰胺的反 应称为Favorski重排
芳基 ≈ 氢 ≈ 乙烯基 > 叔丁基 >> 环丙基 > 仲烷基 > 伯烷基
(94%) (6%)
4. 应用特点
(1) Pinacol重排制备Pinacolone
(2) Semipinacol重排制备酮类化合物 X = Cl、Br、I、SR、OTs、OMs
①β-氨基醇类
②β-卤代醇类
③制备环状酮
R = 烷基、芳基或氢
2. 反应机理
3. 影响因素
(1) 碳正离子的稳定性
重排的方向
哪个碳上的羟基更容易 离去成为正碳离子?
羟基离去后形成的碳正离子越稳 定越有利于重排
(2) 立体化学因素的影响
迁移基与 离去基互 成反应式 才能迁移
(3) 反应条件的影响
(4)迁移基团的迁移能力
使正电荷稳定(好的供电性) 的取代基迁移倾向大
第二节 从碳原子到碳原子的重排
一、Wagner-Meerwein重排
1. 反应通式
R =烷基、 芳基或氢
(如果R4 = H)
(如果R2 含一个α-氢)
2、反应机理
3. 影响因素
(1) 碳正离子的稳定性
正常反应的中 间体碳正离子 已是最稳定了, 不重排
由仲碳正离子重排成叔碳正离子,更稳定 由仲碳正离子重排成苄位碳正离子,更稳定
1. 反应通式
2. 反应机理
3. 影响因素
(1) 反应条件的影响
如果R为脂肪取代基,碳原子数小于8
所用的碱用醇钠代替氢氧化钠,重排后的 异氰酸酯与醇作用得到氨基甲酸酯
Pb(OAc)4 (LTA),高价碘试剂(苯基二乙 酰基碘)等也可促使Hofmann重排的发生。
(2) 反应物酰胺结构的影响
1. 反应通式
Wolff重排
Arndt-Eistert合成
2. 反应机理
3. 影响因素
4. 应用特点
(1) 由羧酸制备多一个碳原子的酸或其衍生物
(2) 由α-重氮酮制备缩环产物
第三节 从碳原子到杂原子的重排
一、Beckmann重排
肟类化合物在酸性催化剂作用下,烃基向氮 原子迁移,生成取代酰胺的反应,称为 Beckmann重排
NaNH2, KNH2 HNR2
4. 应用特点
(1) 由α-卤代酮制备羧酸衍生物
(2) 由α, α’-二卤代酮制备α, β-不 饱和羧酸衍生物
(3) 由α-卤代环酮制备少一个碳原子 的环状羧酸衍生物
五、Wolff重排和Arndt-Eistert合成
在光、热或金属化合物催化下,α-重氮酮 重排生成烯酮的反应称为Wolff重排。
1. 反应通式
2. 反应机理
3. 影响因素
(1) 反应物α-卤代酮的影响 重排产物的羧羰基保留在哪个α碳上?
PK稳定性
中间体环丙酮开环后形成的负碳离 子稳定性较高的,导向重排产物
共轭结构有利于碳负离子的稳定
取代基少的碳负离子较稳定
(2) 催化剂的影响
碱Байду номын сангаас
重排产物
NaOH, KOH
NaOR, KOR
(3) 酰基肼与亚硝酸反应 (4) 羧酸与二苯基磷酰叠氮(DPPA)反应
4. 应用特点
(1) 制备伯胺
(2) 制备氨基甲酸酯
四、Schmidt反应
(1) 反应通式
2. 反应机理 (1) 羧酸与叠氮酸的反应机理
4. 应用特点
(1) 由羧酸制备伯胺
(2) 由酮制备酰胺
Hofmann降解
1. 反应通式
2. 反应机理
3. 影响因素 (1)催化剂的影响 质子酸(H+),使肟生成羊离子(羊盐), 以促进羟基消除
常用的质子酸:H2SO4 , HCl, H3PO4,多聚磷酸
非质子酸,将肟羟基转化为易于脱离的基 团(离去性强的基团)
常用非质子酸:POCl3, PCl5, SOCl2, MeSO2Cl, PhSO2Cl
4. 应用特点
(1) 由酰胺制备少一个碳原子的伯胺
(2) 由酰胺制备少一个碳原子的氨基甲酸酯
三、Curtius重排
酰基叠氮化合物加热分解为异氰酸酯的反 应称为Curtius重排
1. 反应通式
2. 反应机理
3.影响因素:反应物酰基叠氮化合物的制备
(1) 酰卤与叠氮化钠反应
(2) 混合酸酐与叠氮化钠反应
(优选)药物合成反应第五章 习题药物合成反应习题第五章
重排反应
按反应历程分类
➢离子型机理
亲核重排 亲电重排
➢自由基重排 ➢σ-键迁移重排
周环机理重排
根据起点原子与终点原子的相对位置分类
➢1, 2-迁移 ➢1, 3-迁移 ➢1, 4-迁移 ➢1, 5-迁移 ➢3, 3-迁移
σ-迁移,实例少
按起点原子和终点原子的种类分类 ➢从碳原子到碳原子的重排 ➢从碳原子到杂原子的重排 ➢从杂原子到碳原子的重排 ➢-键迁移重排
(2) 溶剂的影响 (3) 酮肟结构的影响
4. 应用特点
(1) 脂环酮肟生成扩环内酰胺
(2) 立体专一性
Beckmann重排中,与离去羟基处于反位的基 团发生迁移,具立体专一性
(3) 制备苯并噁唑或苯并咪唑衍生物
二、Hofmann重排
未取代的酰胺与次溴酸钠(或溴与氢氧化钠) 作用,得到少一个碳原子的伯胺的反应称 为Hofmann重排
重排生成更稳定的碳正 离子是Wagner-
Meerwein重排的驱动力
(2) 碳正离子的形成
①由卤代烃获取碳正离子
卤代烃溶于强的极性溶剂,或加入Lewis 酸,如银离子夺取卤素,形成碳正离子
② 醇与酸作用形成碳正离子
③烯烃经质子加成后形成碳正离子 ④胺与亚硝酸作用形成碳正离子
4. 应用特点
