实验09 委托与事件
GLP及其实践

WHO GLP Taining Course Copyright of Next Century 2002
17
2. SOP的格式和内容
-每一种标准操作程序都必须有各自的编号(码), 并且署明部门、版本和副本数目; -标准操作程序的名称(题目)和生效日期; -审批者和共(会)签者包括质量保证部门负责人的 签字及签署 日期; -该标准操作程序的目的,涵盖范围,以及文中所用术 语的定义; -材料,操作程序和过程; -转换和计算方法; -报告要求,并将文中“材料”部分和报告的格式 (常用表格式)作为标准操作程序之附件; -分发和保存的规定与要求;
WHO GLP Taining Course Copyright of Next Century 2002
16
1 。 种类和制定过程(continue)
6. 垂(频)死中死亡试验系统/动物处理; 7. 试验系统的尸检或者尸解; 8. 标本的收集采取与标记; 9. 组织病理学检查; 10. 文件资料的处理、存放和检索; 11. 仪器设备的校正(准)和保养; 12. 试验系统的转移(运)、取(替)代和鉴 别方法。 (Samples of Table of Contents)
WHO GLP Taining Course Copyright of Next Century 2002 14
2. 仪器设备:
关键仪器设备 (critical equipment) 常规仪器设备 安全设施与设备
仪器设备的认证。计量审计及日常 维修保养
WHO GLP Taining Course Copyright of Next Century 2002
WHO GLP Taining Course Copyright of Next Century 2002
实验室评审不符合项实例

4.5缺少省计量院资质证明及评价计录4.9 记录表无受控编号5.1.3 无培训计划5.1.5安程程档案内容不全5.2.2 检测车间无温湿度计5.3.1缺少路试制动仪指导书5.4.4路试制动仪无人员授权5.4.5路试制动仪档案内容不全5.5.3(1)无检定计划5.5.3(2)声级计未标定4.1.102009年度质量监督记录未体现监督对象4.3JTG E60-2008标准没有受控标识4.5未提供满城县计量所资质材料4.62009-1026-001号委托单缺少检验依据信息4.9(6)2009-0521-001原始记录无加荷速度、样品状态描述无养生条件信息5.2.3(1)化学危险品存放未做到双锁双控5.3.2(2)未见JTG E60-2008标准的确认记录5.4.4万能试验机授权书无授权人签字、无授权日期等信息5.4.6三米直尺无状态标识5.4.8未见2009-2010年度期间核查计划5.6.7水泥样品直接贮存在铁皮罐中,不满足要求5.7.2(1)2009年10月沥青三大指标比对试验结果未进行分析5.8.2(c)2009-0518-001报告无页码标识5.8.2 (e)2009-0607-001沥青三大指标无具体检测方法4.3技术记录表格无受控标识4.5无2010年合格服务方、供应商评价4.6 编号KY-HT-0901合同无评审记录4.9(4)090836记录中无细度试验过程记录4.9(6)编号091350记录无养护条件样品状态描述等信息。
4.11 无2010年管理评审计划5.1.5 魏克家档案中无身份证、内审员证04年以前的工作经历07年以后的培训记录5.2.3 无急救箱等安全处理措施5.2.5 水泥室中的跳桌安装位置对其它试验有影响5.3.1 编号091350记录中使用JGJ/T27-2009不正确5.3.2 无新项目GB18242-2008的新工作开展记录5.4.1 无细度试验用分度值0.01克天平5.4.4 无设备操作人员授权书5.4.6 砂、石试验筛无状态状态标识5.4.8 无砼标养室的期间核查计划及记录5.6.6 编号091678试验样品标识不惟一5.6.7(1)无水泥存样区5.6.7(2)无样品流转记录4.1.10 监督计划没有具体办法4.3仪器设备使用履历表”缺少文件编号4.9编号为20090403-02的原始记录中有涂改现象4.10在2009年4月进行的内审工作中,缺少对管理层的内审记录4.11在2008年12月进行的管理评审的输入中缺少管理人员和监督人员的报告。
WHO_TRS_996_annex09翻译

Annex9组织机构进行体内生物等效性研究指南背景2014年的一场非正式讨论会上,在世界卫生组织(WHO)药学准备工作规范专家委员会的第49次会议,讨论产生关于可能修正组织机构进行体内生物等效性研究指南(WHO技术报告系列,No. 937, Annex9, 2006)。
WHO药学准备工作规范专家委员会同意,鉴于新的事态发展,将会准备一条修正法案。
新的指南不仅考虑多来源指南的修订,并会考虑创造良好数据管理下的新的指南。
法案也会考虑自从2006年评价和稽查BE试验领域的经验。
在稽查者们重复发现相同问题的领域,新的指南将会提供阐述,增补的细节也已加入生物分析。
指南也会更加注重项目安全性和数据完整性。
在第一版工作文件的基础上,第二版结合了很多的意见和反馈,有来自于公众、WHO资格预审团队(PQT)的意见,也有来自于2015年举行的关于数据管理、生物等效性、GMP、药品稽查的讨论会。
WHO/PQT建立于2001年,是为了保障采购的药用产品满足WHO关于质量、安全性、有效性的规范和标准(http://www.who.int/prequal/)。
特别的是,要求报送的产品档案所有必要的内容经评估都是可接受的,成品药(FPP)以及API的生产地点满足WHO的GMP要求。
由于报送WHO/PQT的产品通常是多来源的(仿制的),一般通过在比如合同研究组织CRO(也叫做临床研究机构)进行的BE试验来证明治疗等价性。
对于资格预审的产品至关重要的是,除了上述的要求,申办方BE试验使用的CRO公司要满足WHO的药物临床试验质量管理规范GCP,考虑优良实验室规范GLP和质量控制(QC)305实验室管理规范来保证数据的完整性和可追溯性。
除此之外,如果存在当地的法律法规,CRO应该得到各自国家药品局的认可。
如果国家规定需要,BE试验应该获得国家监督管理局的授权。
因此报送资格预审的产品涉及到BE试验中执行和分析的,需要保证满足WHO相关的规范和标准,以便为WHO的稽查做准备。
国际结算实验-托收实验参考答案

实验3.托收结算业务3.2 实验项目3.2.1实验目标1、托收委托书填写完整、准确性的审核。
2、根据托收委托书和条件正确缮制托收指示。
3、托收指示完整、准确性的审核。
4、掌握拒付中退票通知书、拒付电文的发送、审核和处理。
5、跟单托收处理流程。
6、付款交单、承兑交单处理流程。
7、掌握URC522对托收业务处理中的规定。
3.2.2实验要求1、托收行审核光票托收委托书。
2、托收行根据所给光票托收委托书缮制光票托收指示。
3、托收行审核跟单托收委托书。
4、托收行根据所给跟单托收委托书缮制跟单托收指示。
5、代收行审核跟单托收指示。
6、代收行缮制和发送退票通知、拒付电文。
7、托收行对收到的退票通知和拒付电文进行审核和处理。
3.2.3实验素材一、光票托收(一)2003年5月22日中国进出口公司广州分公司向中国银行广州分行提交下面这张光票托收委托书,托收行按所给问题审核光票托收委托书。
(二)中国银行广州分行根据中国进出口公司广州分公司提交的光票托收委托书,于2003年5月23日缮制并向代收行Bank of America N.T.& S.A.邮寄光票托收指示,并选择第二、第三、第五、第六项托收指示条款。
二、跟单托收(一)2003年5月18日Guangdong Arts & Craft Imp. & Exp. Company向中国银行广州分行提交下面这张跟单托收委托书,托收行按所给问题审核跟单托收委托书。
(二)中国银行广州分行根据Guangdong Arts & Craft Imp.& Exp. Company提交的跟单托收委托书,于2003年5月20日缮制并向代收行Standard Chartered Bank Ltd., Hong Kong邮寄跟单托收指示,其中:①Ten boxes oflamps from Guangzhou to Hong Kong by par of Tianyu vessel on May 12, 2003;②款项划至中国银行香港分行贷记托收行账户;③两次寄单。
土木工程结构试验方案

土木工程结构试验方案一、背景土木工程结构试验是对建筑物和其他工程结构在静态或动态载荷下进行实验性能测试的一种方法,通过试验得到结构在不同条件下的力学性能参数,以评估结构的安全性能和耐久性,为设计和施工提供可靠的依据。
本试验方案旨在针对某一具体建筑结构进行试验,对其静态和动态性能进行全面的评测。
二、试验对象本试验对象为一栋四层钢筋混凝土建筑的主体结构,包括梁、柱和板等各个组成部分。
建筑结构已经完成施工并通过验收,但为了进一步评估其安全性能和耐久性,需要进行全面的力学性能试验。
三、试验目的1. 评估结构的受力性能,包括承载能力、变形性能和破坏模式;2. 测定结构的振动性能,包括自由振动频率和振动模态;3. 确定结构在特定荷载条件下的破坏载荷,以验证设计的合理性;4. 分析结构在地震等动力荷载下的响应情况,为结构抗震设计提供依据。
四、试验内容1. 静态试验1.1 施加逐渐增大的集中荷载,测定结构的承载力;1.2 施加逐渐增大的均布荷载,测定结构的变形情况;1.3 施加逐渐增大的侧向荷载,测定结构的位移和倾斜情况。
2. 动态试验2.1 振动台试验:利用振动台对结构进行自由振动实验,测定结构的固有频率和振型;2.2 冲击试验:利用冲击负荷,模拟结构在地震等动力荷载下的响应情况。
3. 破坏试验3.1 施加集中荷载,直至结构发生破坏,测定破坏载荷和破坏模式;3.2 分析破坏之前结构的受力性能,验证试验结果与设计参数的符合度。
1. 静态试验1.1 采用静态加载试验机,施加逐渐增大的集中荷载,测定结构的承载力,并记录荷载-位移曲线和荷载-应变曲线;1.2 采用测量仪器,测量结构在均布荷载作用下的变形情况,记录荷载-变形曲线;1.3 利用测量仪器和位移传感器,测定结构在侧向荷载作用下的变形、倾斜和位移情况。
2. 动态试验2.1 利用振动台设备,施加不同频率和幅值的激励,测定结构的自由振动频率和振型;2.2 利用冲击试验装置,对结构进行冲击试验,测定结构在地震等动力荷载下的响应情况。
程序09委托储存医疗器械退货操作程序

****医药连锁有限公司医疗器械三方物流文件委托储存医疗器械退货操作程序1.目的:建立退货医疗器械控制程序,规范退货医疗器械管理工作,确保药品质量。
2.依据与适用范围:依据《医疗器械监督管理办法》《医疗器械经营质量管理规范》及其附录、《医疗器械经营质量管理规范现场检查指导原则》》修订本规程。
适用于委托储存退货医疗器械的控制过程。
3.职责:采购部、质量管理部、销售部、物流部对本程序的实施负责。
4 内容:4.1 销售退回4.1.1 委托方销售退回的医疗器械,由受托方收货员根据委托方的经审批通过的退货申请单收货并核验退货单与实物,将医疗器械存放于符合储存条件退货验收区。
没退货申请单的,不办理退货。
4.1.2 对销后退回医疗器械,在收货时应当调出原对应的销售、出库复核记录进行核实,比对一致后方可收货验收,验收员按《委托储存医疗器械验收操作规程》进行退货验收,验收完成系统自动生成销后退回验收记录。
4.1.3 验收发现信息不一致的通知委托方处理,货品暂存于退货验收区。
4.1.4 销后退回医疗器械经验收认为质量可疑的要经委托方质管部经理确认,确认为质量合格的,重新办理入库;确认为不合格的,按《委托储存不合格医疗器械控制操作规程》的要求进行有效的控制。
4.2.采购退出4.2.1 保管员根据委托方的采购退出申请单生成的WMS下架任务进行备货,复核完毕后暂存于退货区。
4.2.2 提货人员凭提货授权委托书到公司提货,提货人员需与委托方提供人员信息一致。
人员不一致的,不予提货,并通知委托方处理。
4.2.3 退货时,库管员应核对退货品种、数量是否与退货票据一致。
4.2.4 退货完毕,按照相应单据内容生成购进退出记录。
4.3 认真、及时、规范地做好退货医疗器械的各种记录,记录妥善保存五年。
1/ 1。
09 案例+分析9:物业闯入私人住宅强行整改住房

案例9:物业闯入私人住宅强行整改住房案例介绍:2005 年,某小区业主来访反映,小区管理部在未经业主同意的前提下,派员进入其尚在装修的房屋内,将业主自行安装的窗框拆除并拿走,安装部位的外墙在拆除的同时也遭到破坏。
业主认为:小区管理部虽出具了书面整改通知书,但无权擅自闯入私人住宅强行拆除,这种行为严重侵害了业主的利益,管理部人员缺乏最基本的法律常识,同时要求小区管理部对在该事件中给业主造成的损失进行赔偿。
注:1、经有关部门认定,业主安装的窗为违章搭建的构筑物;2、小区物业管理部之前已向业主发出《违约行为整改通知书》,但业主表示拒不整改。
案例分析:1.小区管理部有没有对业主在装修过程中的行为进行必要限制的责任? 作为《物业管理服务合同》内约定的一项义务,物业管理公司有责任对业主在装修过程中的行为进行监管和必要的限制。
首先,小区管理部应当审查业主的装修方案,将住宅装修工程的禁止行为和注意事项通过《住宅装修须知》的形式告知业主和业主委托的装修公司,并与业主签订《住宅装修管理服务协议》。
值得注意的是:在签订协议时,小区管理部应当告知业主在装修时的禁止行为。
例如:不得损坏房屋承重结构和破坏房屋外貌,改变房屋外部颜色;应考虑楼层楼板承载力;不影响毗邻房屋的安全使用;不影响其他业主的正常使用等等。
其次,小区管理部应当按照协议,加强对日常装修现场的巡视和检查,监督业主或装修公司履行装修协议条款内容。
如果发现业主或者装修公司有违反协议的行为,小区管理部应当及时制止,已造成事实后果或者拒不改正的,应当及时报告有关部门依法处理。
最后,装修完毕,小区管理部应当进行现场验收,凡有违反装修协议的行为,应要求业主或装修公司恢复或赔偿。
2.小区管理部是否应对业主的违约(违章)行为承担管理不善的责任?物业管理公司作为受托实施管理的公司,应当按照《物业管理服务合同》约定,履行相应的管理义务。
但是,物业管理公司是一个民事主体而非行政管理机关,因此,物业管理公司是不能采取强制措施的,它所能做的仅仅是在发现问题时向业主及使用人提出改进意见,而不能直接采取行政制裁手段。
资料09 确证化学结构或者组 份的试验资料及文献资料

注册分类:化学药品6类资料项目编号:9申请生产研究资料甘露醇确证化学结构或者组份的试验资料及文献资料研究机构(盖章):兵器工业非金属材料理化检测中心研究机构地址:济南市天桥区田家庄东路3号研究机构联系电话:研究负责人(签字):试验者姓名:尤瑜升、华兰、冀克俭、吴立军、邓卫华等试验时间:2005年02月1日-2005年03月31日原始资料保存地点:山东***药业有限公司品质管理部联系人:栾少华联系电话:山东***药业有限公司资料9、确证化学结构或者组份的试验资料及文献资料一、 甘露醇的化学结构式、分子式、分子量化学结构式:分子式:C 6H 14O 6 分子量:182.17二、甘露醇和对照品的来源、批号供试品: 山东***药业有限公司 批号:200502001 被仿品:河北华旭药业有限责任公司 批号:0501023三、 样品的精制方法将甘露醇粗品溶解后加入结晶机中,降温至16-18℃,经过离心分离后,将甘露醇一级精制品再次溶解后,转移到三口烧瓶中,加入活性炭,脱色30-40分钟,脱色后的料液转移到结晶机中,降温至16-18℃,经过离心分离后,微波干燥得甘露醇。
四、 样品的含量按照《中国药典》2005年版 二部第72页中方法,滴定含量法测定样品的含量。
取本品约0.2g ,精密称定,置250ml 量瓶中, 加水使溶解并稀释至刻度, 摇匀;精密量取 10ml ,置碘量瓶中,精密加入高碘酸钠溶液50ml ,置水浴上加热15分钟,放冷,加碘化钾试液10ml ,密塞,放置5分钟,用硫代硫HO酸钠滴定液滴定,至近终点时,加淀粉指示液1ml,继续滴定至蓝色消失,并将滴定的结果用空白试验校正。
每1ml硫代硫酸钠滴定液相当于0.9109mg的C6H14O6。
含C6H14O66 :供试品100.02%;被仿品99.87%。
五、样品的旋光度称取硼砂6.4g于50ml容量瓶中,准确加入相当于干物质5g的试液,振摇,在50~60℃的水浴中温热至硼砂完全溶解,冷却至室温后,用水稀释至刻度,摇匀,放置2h,过滤。
土工试验报告表格

土工试验报告表格土工试验报告表格土工试验报告表格( 铁建建 09 版) 土工试验报告(三)报告编号委托编号表号:铁建试报 60 批准文号:铁建设函【2009 】27 号工程名称委托单位勘探点编号取样地点报告日期试验单位批准试验复核土工试验报告(二)表号:铁建试报 59 批准文号:铁建设函【2009 】27 号委托单位报告编号工程名称委托编号工程名称委托编号取样地点样品编号取样深度报告日期取样深度报告日期试验复核批准单位(章)土工试验报告(一)表号:铁建试报 58 批准文号:铁建设函【2009 】27 号委托单位报告编号工程名称委托编号取样地点样品编号复核批准单位(章)试验篇二:铁路工程试验报告表格(09版)( 土工) 工程名称委托单位勘探点编号取样地点土工试验报告(三)报告编号委托编号表号:铁建试报 60 批准文号:铁建设函【2009 】27 号报告日期试验单位批准试验复核土工试验报告(二)表号:铁建试报 59 批准文号:铁建设函【2009 】27 号委托单位报告编号工程名称委托编号1/ 8工程名称委托编号取样地点样品编号取样深度报告日期取样深度报告日期试验复核批准单位(章)土工试验报告(一)表号:铁建试报 58 批准文号:铁建设函【2009 】27 号委托单位报告编号工程名称委托编号取样地点委托编号取样地点样品编号试验复核批准单位(章)篇三:土工实验报告二密度试验 2.1 基本原理:土( 体)的密度是指土的单位体积的质量,单位是的密度是指土的单位体积的质量,单位是 g/cm3 或或 kg/m3,土的密度可分为天然密度(湿密度)和干密度两种。
,土的密度可分为天然密度(湿密度)和干密度两种。
2.2 试验方法及适用范围 ?环刀法:一般适用于原状样中的细粒土,未受扰动的砂土,以环刀法:一般适用于原状样中的细粒土,未受扰动的砂土,以及形状规则的土体。
蜡封法:适用于具有不规则形状的易碎裂的难以切割的土体。
科学管理理论的评述及现实意义

202X
科学管理理论的评述及现实意义
目录
CONTENTS
科学管理理论的含义
01
科学管理理论的内容
02
科学管理理论的代表人物和指导思想
03
对科学管理理论的评价
04
科学管理理论的现实意义
05
科学管理理论的产生背景
19世纪末期,由于生产技术日益复杂,生产规模发展和资本的日益扩大,企业的管理职能便逐渐与资本所有权相分离,管理职能则由资本家委托给以经理为首的由各方面管理人员所组成的专门管理机构承担。从此,出现了专门的管理阶层。同时,管理工作也成了有人专门研究的一门学问,并产生了称为“科学管理”的理论。
劳资矛盾的存在 经济人假设 单个人是可以取得最大效率的,但集体的行为反而导致效率下降
科学管理理论的基本假设
效率至上。 管理的中心问题是提高劳动生产率。 为了谋求最高的工作效率,可以采取任何必要的方法。 劳资双方应该共同协作。
科学管理理论的出发点
其他人的贡献
甘特 (1861-1919)
吉尔布雷斯(夫妇) (1868-1924)
科学管理想打而言是重视物,不是重视人。
科学管理趋向的观点是企业越大越好,产品越多越好。
局限性
THANKS FOR WATCHING
现实意义
三、经验对于管理虽然是重要 的基础性的,但却远非决定性 的和唯一性的,任何工作和业 务流程,通过科学的探讨,更 能够接近并在一定程度上达到 完美。让人们认识到在管理上 引进科学研究方法的重要性和 必要性
科学管理的目的 科学管理的原则 作业标准原理 职能分工原理 信任与合作原理
科学管理理论的内容
202X
event study 笔记

event study 笔记事件研究(Event Study)是一种用于研究某一特定事件对股票价格或收益率的影响的方法。
以下是关于事件研究的一些笔记:事件定义:事件研究中的事件通常是指一个特定的事件或信息披露,例如公司并购、股票分拆、重大资产重组等。
这些事件可能会对公司的价值和未来收益产生影响,因此研究这些事件的影响是很有意义的。
研究方法:事件研究通常采用比较分析法,即将事件发生前后的股票价格或收益率与市场整体或其他相似公司的数据进行比较,以评估事件对股票价格或收益率的影响。
样本选择:在事件研究中,需要选择合适的样本进行比较分析。
样本应该包括事件发生前后一定时间内的股票价格或收益率数据。
同时,还需要选择与事件相关的其他公司作为比较对象,以便更准确地评估事件的影响。
数据处理:在事件研究中,需要对数据进行处理和清洗,以确保数据的准确性和有效性。
这包括去除异常值、处理缺失值、标准化数据等。
模型选择:在事件研究中,需要选择合适的模型来评估事件的影响。
常用的模型包括市场模型、三因子模型、四因子模型等。
这些模型可以帮助更准确地评估事件对股票价格或收益率的影响。
结果解释:在事件研究中,需要对结果进行解释和讨论。
这包括评估事件对股票价格或收益率的影响程度、分析影响的原因、讨论结果的稳健性等。
总之,事件研究是一种用于研究特定事件对股票价格或收益率的影响的方法。
在研究中,需要选择合适的样本、处理数据、选择合适的模型并对结果进行解释和讨论。
以下是一个使用事件研究的例子:假设一家公司发布了重大资产重组的公告,该事件可能会对公司的股票价格产生影响。
为了研究该事件的影响,可以采用事件研究的方法。
首先,需要选择合适的样本。
在这个例子中,可以选择该公司的股票价格数据作为样本。
同时,还需要选择与该事件相关的其他公司作为比较对象,以便更准确地评估该事件的影响。
其次,需要确定事件的时间窗口。
在这个例子中,可以将事件发生前后的时间段作为时间窗口。
205宿舍 康泰克ppa事件

• 社会文化环境:消费者的消费观、认知水平是影响消费者 消费的最重要因素。改革开放以来,教育水平不断提高, 经济状况不断改善,科技水平不断进步。人们对就医的概 念不单单再是喝中药、针灸、拔罐等传统的中医疗法,而 且传统中医疗法也不能满足日益增长的消费需求。打针, 吃药片、胶囊已成为主流。而康泰克中含有对身体有副作 用的ppa,给消费者的消费心理上蒙上了一成阴影。 • 科技环境:科学的进步推动了医学的进步,科技是第一生 产力在这同样是真理,中药见效缓慢这个中国传统医疗弊 端通过科技得以解决。通过提存或人工合成药物成分,药 品可以批量生产。普通的小感冒通过吃一粒胶囊或者一粒 药片时间不长就可以治愈
2.swot分析 2.swot分析
A:机会与威胁(外部环境分析) A:机会与威胁(外部环境分析) 机会:在危机出现之前的11年间,康泰克的销售量达到51亿 机会:在危机出现之前的11年间,康泰克的销售量达到51亿 粒,占据 OTC市场份额的40%。由此可见,中美史克已经 OTC市场份额的40%。由此可见,中美史克已经 建立了较为完善的市场机制,拥有广大的消费者和潜在消费 者。危机出现后,对于规模如此大的企业无疑是一出生那个 灭顶之灾。营销环境是机会和威胁并存的。如果中美史克公 司能迅速做出反应,采取积极措施,维护康泰克良好的声誉, 通过生产不含ppa的新型感冒药,做到为消费者考虑,抓住 通过生产不含ppa的新型感冒药,做到为消费者考虑,抓住 康泰克的消费者。必定能在感冒药市场脱颖而出,继续保持 其在市场中的地位,甚至还能得到发展 威胁:1996年11月16日中国政府发布了发布了《 威胁:1996年11月16日中国政府发布了发布了《关于暂停使 用和销售含苯丙醇胺的药品制剂的通知》 用和销售含苯丙醇胺的药品制剂的通知》,宣布暂停销售含 有PPA(苯丙醇胺)的15种药品,而中美史克的两个主打产 PPA(苯丙醇胺)的15种药品,而中美史克的两个主打产 品康泰克(复方盐酸苯丙醇胺缓释胶囊)和康得(复方氨酚 美沙芬片)正含有这种成分。中美史克公司经过商议,严格 遵守国家规定,决议暂停康泰克的生产和销售
国贸实务实验报告

国贸实务实验报告国贸实务实验报告《出口策划方案》实验报告姓名:____________________________学号:_____________________________班次:经济与管理学院_________级___(专业)___(班)实验时间:实验地点:实验内容:出口模拟交易实验目的:了解并掌握出口外贸交易流程基本要求:(实验的基本要求)1.遵守相关法律法规,不得在网上发表违法言论。
2.按实习内容,认真进行准备,积极展开调查活动,刻苦学习,并做好实习日记。
3.在实习期间应尽可能的多做业务,熟练掌握进出口业务相关环节的主要业务及操作技巧。
4.每个角色必须完成以下任务:(1)出口商:完成1笔出口业务(2)进口商:完成1笔进口业务(3)工厂:完成1笔业务(4)进口地银行:完成对信用证申请的审核及开证、审单。
(5)出口地银行:完成审证、审单。
5.就具体业务操作的过程,完成实习报告。
实验步骤及结果:(写出主要实验步骤及最终实验结果)一、交易准备阶段1以出口商角色登录,输入用户名,在"选择用户类型"下拉框中选择"出口商",点"登录系统",进入出口商业务主页面;2创建公司。
点"资料",可查看公司注册资金、帐号、单位代码、邮件地址等资料。
33发布公司广告。
点"业务中心",再点标志为"广告公司"的建筑物,在弹出页面中点"发布广告"4寻找商机。
点"淘金网",进入查询页面,在首页上查看通知以及各类市场信息与供求信息,其中在进口商发布信息中可找到CartersTradingCompany,LLC发布的求购甜玉米罐头的信息;5查看交易对手。
点"公司库",可看到所有公司,输入关键词"Carters",选择类别为"进口商",点"搜索",找到对应的公司,再点"详细情况",查看公司具体资料;6查看交易商品。
质量记录单
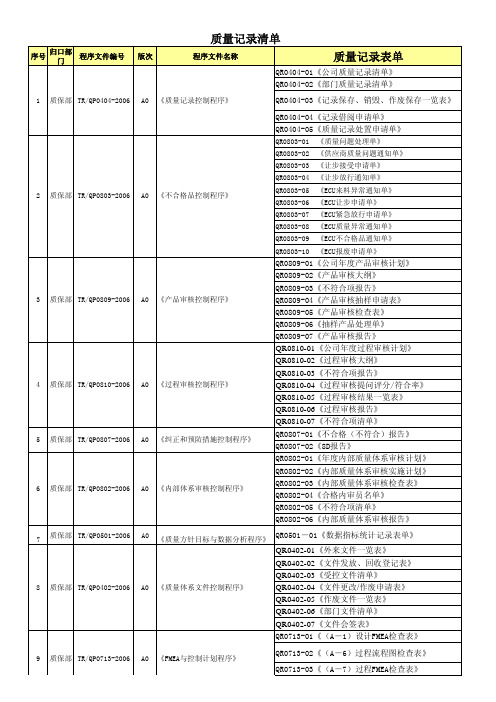
质量记录清单序号归口部门程序文件编号 版次程序文件名称质量记录表单1质保部TR/QP0404-2006A0《质量记录控制程序》QR0404-01《公司质量记录清单》QR0404-02《部门质量记录清单》QR0404-03《记录保存、销毁、作废保存一览表》QR0404-04《记录借阅申请单》QR0404-05《质量记录处置申请单》2质保部TR/QP0803-2006A0《不合格品控制程序》QR0803-01 《质量问题处理单》QR0803-02 《供应商质量问题通知单》QR0803-03 《让步接受申请单》QR0803-04 《让步放行通知单》QR0803-05 《ECU来料异常通知单》QR0803-06 《ECU让步申请单》QR0803-07 《ECU紧急放行申请单》QR0803-08 《ECU质量异常通知单》QR0803-09 《ECU不合格品通知单》QR0803-10 《ECU报废申请单》3质保部TR/QP0809-2006A0《产品审核控制程序》QR0809-01《公司年度产品审核计划》QR0809-02《产品审核大纲》QR0809-03《不符合项报告》QR0809-04《产品审核抽样申请表》QR0809-05《产品审核检查表》QR0809-06《抽样产品处理单》QR0809-07《产品审核报告》4质保部TR/QP0810-2006A0《过程审核控制程序》QR0810-01《公司年度过程审核计划》QR0810-02《过程审核大纲》QR0810-03《不符合项报告》QR0810-04《过程审核提问评分/符合率》QR0810-05《过程审核结果一览表》QR0810-06《过程审核报告》QR0810-07《不符合项清单》5质保部TR/QP0807-2006A0《纠正和预防措施控制程序》QR0807-01《不合格(不符合)报告》QR0807-02《8D报告》6质保部TR/QP0802-2006A0《内部体系审核控制程序》QR0802-01《年度内部质量体系审核计划》QR0802-02《内部质量体系审核实施计划》QR0802-03《内部质量体系审核检查表》QR0802-04《合格内审员名单》QR0802-05《不符合项清单》QR0802-06《内部质量体系审核报告》7质保部TR/QP0501-2006A0《质量方针目标与数据分析程序》QR0501-01《数据指标统计记录表单》8质保部TR/QP0402-2006A0《质量体系文件控制程序》QR0402-01《外来文件一览表》QR0402-02《文件发放、回收登记表》QR0402-03《受控文件清单》QR0402-04《文件更改/作废申请表》QR0402-05《作废文件一览表》QR0402-06《部门文件清单》QR0402-07《文件会签表》9质保部TR/QP0713-2006A0《FMEA与控制计划程序》QR0713-01《(A-1)设计FMEA检查表》QR0713-02《(A-6)过程流程图检查表》QR0713-03《(A-7)过程FMEA检查表》QR0713-04《(A-8)控制计划检查表》10质保部TR/QP0811-2006A0《统计技术应用程序》QR0811-01《过程能力研究》QR0811-02《P控制图》11质保部TR/QP0714-2006A0《生产件批准程序》QR0714-01 《产品样件认可报告》QR0714-02《PPAP检查表》12质保部TR/QP0707-2006A0《供应商选择与评价程序》QR0707-01《供应商基本情况调查表》QR0707-02《供应商报价单》QR0707-03《可行性供应商清单》QR0707-04《供应商审核计划》QR0707-05《供应商审核清单》QR0707-06《供应商审核结果报告》QR0707-07《不符合项报告》QR0707-08《合格供应商名录》QR0707-09《供应商绩效考核结果单》13实验部TR/QP0808-2006A0《台架试验控制程序》QR0808-01《台架试验委托单》QR0808-02《设备运行监控及校准记录表》QR0808-03《台架器件交接记录表》QR0808-04《台架工作日志》QR0808-05《台架试验数据记录表》QR0808-06《电控系统失效信息反馈表》QR0808-07《台架试验报告》QR0808-08《实验室每日安全检查表》QR0808-09《台架试验项目运行监控记录表》QR0808-10《台架器件状态确认清单》14采购部TR/QP0704-2006A0《采购控制程序》QR0704-01《采购订单》QP0704-02《物资采购申请表》15产品部TR/QP0403-2006A0《技术文件控制程序》QR0403-01《技术文件一览表》QR0403-02《外来技术文件一览表》QR0403-03《作废技术文件一览表》QR0403-04《技术文件分发、回收记录》QR0403-05《技术文件补发申请表》QR0403-06《技术更改通知单》QR0403-07《文件借阅申请单》QR0403-08《技术文件定期审核记录表》QR0403-09《技术文件需求单》16销售部TR/QP0604-2006A0《应急计划控制程序》QR0604-01《突发事件可能性分析表》QR0604-02《突发事件处理表》QR0604-03《应急计划实施表》17销售部TR/QP0702-2006A0《合同/订单管理程序》QR0702-01《销售计划》QR0702-02《新品可行性分析报告》QR0702-03《年度订货合同》QR0702-04《交付合同/订单》QR0702-05《合同会签单》QR0702-06《合同/订单评审表》18质保部TR/QP0706-2006A0《监视和测量装置控制程序》QR0706-01《监视和测量装置台帐》QR0706-02《设备校准通知单》QR0706-03《监视和测量装置封存、报废申报表》QR0706-04《监视和测量装置周期校准表》QR0706-05《交付使用单》QR0504-01质量损失统计表(一)QR0504-02质量损失统计表(二)QR0504-03质量损失统计表(三)19财务部TR/QP0504-2006AO《质量成本控制程序》QR0504-04质量损失统计表(四)QR0504-05质量损失统计表(五)QR0504-06质量损失统计表(六)QR0504-07质量损失统计表(七)QR0504-08质量损失统计表(八)QR0504-09质量损失汇总表QR0504-10质量成本报告20质保部TR/QP0801-2006A0《产品检验控制程序》QR0801-01《检验领料单》QR0801-02《检验记录表》QR0801-03《缺陷标识卡》QR0801-04《出厂终检报告》QR0801-05《一次交验合格率报表》QR0801-06《合格证》21市场部TR/QP0719-2006A0《顾客财产控制程序》QR0719-01《顾客财产登记表》QR0719-02《顾客财产接收单》QR0719-03《顾客财产反馈表》QR0719-04《顾客财产归还单》QR0719-05《样品、样品图验证/测绘报告》22综合管理部TR/QP0601-2006A0《人力资源管理程序》QR0601-01 《岗位说明书》QR0601-02 《年度人力资源计划表》QR0601-03 《人员需求增补申请表》QR0601-04 《人员应聘登记表》QR0601-05 《人员面试考评表》QR0601-06 《员工转正申请表》QR0601-07 《员工岗位变动表》QR0601-08 《员工月度绩效管理卡》QR0601-09 《培训记录表》QR0601-10 《年度培训需求计划表》QR0601-11 《月度培训计划表》QR0601-12 《委外培训申请表》QRO601-13 《培训计划变更申请表》QRO601-14 《员工满意度调查表》QRO601-15 《员工转正考核表》QRO601-16 《培训申请表》23综合管理部TR/QP0602-2006A0《基础设施管理程序》QR0602-01《基础设施更新计划表》QR0602-02《基础设施维修计划表》QR0602-03《基础设施日常保养项目表》QR0602-04《月基础设施月度检查表》QR0602-05《基础设施报废申请表》QR0602-06《基础设施维修申请表》QR0602-07《日常维修保养记录》QR0602-08《物资采购申请》QR0602-09《基础设施管理台帐》24生产部TR/QP0705-2006A0《生产过程控制程序》QR0705-01《生产工作进度跟踪表》QR0705-02《西红门ECU生产原材料统计表》QR0705-03《生产起始点检表》QR0705-04《岗位点检卡》QR0705-05《上料确认表》QR0705-06《生产记录》QR0705-07《返工/返修记录表》QR0705-08《ECU生产不合格品质量问题统计表》QR0705-09《P控制图》25综合管理部TR/QP0505-2006A0《计划任务管理程序》QR0508-01《年度采购计划任务单》QR0508-02《月度采购计划任务单》QR0508-03《采购计划任务反馈单》QR0508-04《采购计划统计分析月报表》QR0508-05《计划任务公示表》QR0508-06《零部件报检单》QR0508-07《计划任务单》QR0508-08《生产计划任务反馈单》QR0508-09《生产计划统计分析月报表》26芜湖TR/QP0717-2006A0《售后及顾客反馈程序》QR0717-01 《客户回访记录表》QR0717-02 《顾客满意度调查表》QR0717-03 《顾客满意度调查报告》27质保部TR/QP0804-2006A0《失效反馈控制程序》QR0804-01《失效信息反馈表-行车》QR0804-02《失效信息反馈表-台架》QR0804-03《失效信息反馈表-售服》QR0804-04《失效信息反馈表-其它失效》QR0804-05《失效处理备案表》QR0804-06《失效信息月报》QR0804-07《失效分析处理报告》QR0804-08《ECU失效分析处理报告》28综合管理部TR/QP0502-2006A0《业务计划控制程序》QR0502-01《业务计划变更记录表》QR0502-02《质量方针目标与业务计划实施情况一览表》QR0502-03《业务计划实施分析报告》29产品工程中心TR/QP0703-2006A0《EMS策划与开发程序》APQP文件包30产品部TR/QP0708-2006A0《产品设计变更控制程序》QR0708-01《产品设计变更申请表》QR0708-02《产品设计变更检查表》QR0708-03《产品设计变更可行性报告》QR0708-04《技术更改通知单》31生产部TR/QP0715-2006A0《设备管理程序》QR0715-01《设备引进计划》QR0715-02《设备交付验收单》QR0715-03《设备登记表》QR0715-04《设备易损件清单》QR0715-05《年度设备维修保养计划》QR0715-06《设备维修保养记录》QR0715-07《设备故障检修登记表》QR0715-08《设备日点检表》QR0715-09《设备报修单》QR0715-10《设备报废申请单》32产品部TR/QP0718-2006A0《产品标识及可追溯性管理程序》QR0718-01《产品状态标识卡》QR0718-02《产品信息追踪单》QR0718-03《产品缺陷标识卡》QR0718-04《返工返修标识卡》QR0718-05《标识抽查记录表》QR0721-01《产成品及原料库存表》33销售部TR/QP0721-2006A0《产品交付控制程序》QR0721-02《出库单》QR0721-03《发货清单》QR0721-04《客户回执单》QR0721-05《成品发货检验报告》QR0721-06《货运单》34产品部TR/QP0720-2006A0《产品防护控制程序》35市场部TR/QP0701-2006A0《市场分析与产品营销控制程序》QR0701-01《竞争对手信息表》QR0701-02《市场调研报告》QR0701-03《销售计划通知单》QR0701-04《项目市场信息表》36质保部TR/QP0503-2006A0《管理评审控制程序》QR0503-01《管理评审计划》QR0503-02《管理评审会议记录》QR0503-03《管理评审报告》QR0503-04《管理评审纠正、预防和改进跟踪审核记录表》37质保部TR/QP0722-2006A0《测量系统分析程序》QR0722-01《重复性和再现性分析报告》QR0722-02《MSA分析原始数据记录》QR0722-03《稳定性分析报告》QR0722-04《线性分析报告》QR0722-05《偏倚分析报告》38综合管理部TR/QP0805-2006A0《持续改进控制程序》QR0805-01《持续改进需求调查表》QR0805-01《持续改进计划表》39产品工程中心TR/QP0723-2006A0《实验室管理程序》QR0723-01《年度实验计划》QR0723-02《实验室业务范围一览表》QR0723-03《实验委托单》QR0723-04《实验数据记录表》QR0723-05《实验报告》QR0723-06《实验准备工作检查表》。
2021年第三方物流实验报告

第三方物流实验报告《第三方物流TPL模拟操作实验》实验报告(小组总结报告)201*-201*学年第1学期专业班级09物流管理公司名称致远物流公司小组成员吴夫骏0913115024陶强0913115036黄泽文0913115027实验成绩于安俊09131150一、实验操作流程和运作思路(包括各角色功能及运作情况)第一步注册小组的物流公司,公司名称为致远物流公司,小组成员角色分配如下,吴夫骏担任总经理,陶强运输中心职责,黄泽文负责调度中心,于安俊负责仓库中心。
第二步完成公司注册和角色分配后,总经理开始进行操作开始公司的日常运营,首先进行的是购买和租赁仓库。
第三步系统发布订单,总经理根据公司根据实际情况对合适的运输订单进行报价。
第四步此时系统中多家物流公司开始在报价竞争订单,系统将择优把订单分配给物流公司,为保证本公司的正常运营而选择多个订单进行报价,以获得最多和最优的订单。
第五步收到订单签订运输合同。
第六步按订单要求开通线路,第一期购买适当数量的车辆,雇佣驾驶员完成订单运输。
(一)、调度中心角色运作思路合理安排公司所获得的各项运输任务,通过制作运输计划,和对运输计划进行联运运输来达到运输效果最优,使得公司能够以最少人力、物力、资金投入来处理最多的定单任务。
第一步接受总经理的托运单第二步生成计划运输单第三步选择优化配送方案,并生成运输单。
第四步确认出入库通知并提交给仓储部门和运输部门(二)、仓库中心角色第一步对公司所购买的仓库进行库位分配第二步入库通知单确认(三)、运输中心角色运输中心的工作主要是承接调度中心和仓库中心之间,对调度中心发来的运输单据进行审核,并安排车辆和驾驶员进行运输工作。
同时妥善处理公司所属运输设施和资源,最大程度的发挥资源的作用,为公司带来收益。
二、实验成果与总结(一)实验成果1、认识了物流公司的基本流程,为以后进入物流工作岗位奠定了理论基础。
2、了解了物流运营过程中的各项职能和环节,职能分配等。
实验室常用记录表格

文件编号:GXZC-4000-00 记录表格编写:审核:批准:版本:受控状态:发放编号:发布日期:年月日实施日期:年月日1、文件和资料发放、回收记录表GXZC-4201-012、文件修改记录GXZC-4201-023、文件修改申请表GXZC-4201-034、文件修改通知单GXZC-4201-045、文件破损与丢失补发登记表GXZC-4201-056、文件和资料销毁登记表GXZC-4201-067、文件和资料借阅登记表GXZC-4201-078、备份文件记录GXZC-4201-089、文件和资料留用申请单GXZC-4201-0910、公正性声明措施执行情况检查表GXZC-4202-0111、外来人员参观审批表GXZC-4202-0212、查阅保密资料申请单GXZC-4202-0313、仪器设备(标准物质)申购单GXZC-4203-0114、仪器设备(标准物质)验收单GXZC-4203-0215、供应商评价表GXZC-4203-0316、合格供应商登记表GXZC-4203-0417、___年度服务和供应品采购计划GXZC-4203-0518、检测委托单GXZC-4204-0119、合同评审单GXZC-4204-0220、分包申请表GXZC-4205-0121、分包方能力调查表GXZC-4205-0222、合格分包方名单GXZC-4205-0323、申诉和投诉处理记录表GXZC-4206-0124、客户意见征求表GXZC-4206-0225、不符合工作控制处理表GXZC-4207-0126、内部管理体系审核检查表GXZC-4210-0127、不符合项报告GXZC-4210-0228、会议纪要GXZC-4211-0129、整改措施报告GXZC-4211-0230、会议签到表GXZC-4211-0331、检测人员上岗报批表GXZC-4212-0132、人员学习记录表GXZC-4212-0233、培训申请表GXZC-4212-0334、年度培训计划GXZC-4212-0435、个人技术档案表GXZC-4212-0536、年度人员培训记录表GXZC-4212-0637、公司办公及试验环境卫生情况检查表GXZC-4215-0138、仪器设备检定/校准报告GXZC-4217-0139、检测方法确认表GXZC-4218-0140、仪器设备(标准物质)期间核查记录表GXZC-4219-0141、更新标准实施审批表GXZC-4220-0142、新开展检测项目审批表GXZC-4220-0243、新开展检测项目验收表GXZC-4220-0344、仪器设备维修记录GXZC-4221-0145、计算机/自动化检测设备校核记录GXZC-4221-0246、计算机软件申购单GXZC-4221-0347、计算机软件验收单GXZC-4221-0448、仪器设备降级、停用、报废申请表GXZC-4222-0149、年度仪器设备周期检定/校准计划、实施记录表GXZC-4222-0250、仪器设备一览表GXZC-4222-0351、仪器设备周期检定/校准一览表GXZC-4222-0452、仪器设备档案资料借阅登记表GXZC-4222-0553、仪器设备租用/借出审批表GXZC-4222-0654、仪器设备租用/借出登记表GXZC-4222-0755、仪器设备(标准物质)送检通知书GXZC-4222-0856、年度仪器设备维护保养计划和实施记录GXZC-4222-0957、仪器设备(标准物质)使用记录GXZC-4222-1058、停用仪器设备启用申请单GXZC-4222-1159、检定/校准证书和测试报告确认表GXZC-4223-0160、允许偏离申请表GXZC-4224-0161、样品出入库登记表GXZC-4225-0162、日常质量监督抽查记录GXZC-4226-0163、检测报告更改申请表GXZC-4228-01文件和资料发放、回收记录表序号:编号:GXZC-4201-01文件修改记录序号:编号:GXZC-4201--02文件修改申请表序号:编号:GXZC-4201-03年月日文件修改通知单序号:编号:GXZC-4201-04文件破损与丢失补发登记表序号:编号:GXZC-4201-05文件和资料销毁登记表序号:编号:GXZC-4201-06文件和资料借阅登记表序号:备份文件记录序号:编号:GXZC-4201-08文件和资料留用申请单序号:编号:GXZC-4201-09公正性和行为准则执行情况审查表序号:外来人员参观审批表序号:编号:GXZC-4202-02查阅保密资料申请单序号:编号:GXZC-4202-03年月日仪器设备(标准物质)申购单序号:编号:GXZC-4203-01日期:年月日仪器设备(标准物质)验收单序号:编号:GXZC-4203-02日期:年月供应商评价表序号:编号:GXZC-4203-04合格供应商登记表序号:编号:GXZC-4203-05批准人: 编制人: 日期:______年度服务和供应品采购计划序号:编号:GXZC-4203-06批准: 审核: 编制:日期: 年月日检测委托单序号:合同评审单序号:编号:GXZC-4204-02分包申请表序号:编号:GXZC-4205-01分包方能力调查表序号;编号;GXZC-4205-02合格分包方名单序号:编号:GXZC-4205-03申诉和投诉处理记录表序号:编号:GXZC-4206-01客户意见征求表序号:编号:GXZC-4206-02不符合工作控制处理表序号:编号:GXZC-4207-01内部管理体系审核检查表序号:不符合项报告序号:会议纪要序号:整改措施报告序号:XZC-4211-02会议签到表序号:检测人员上岗报批表序号:人员学习记录表序号:序号:序号:制表:审核:批准:个人技术档案表序号:年度人员培训记录表序号:公司办公及试验环境卫生情况检查表序号:仪器设备检定/校准报告序号:编号:GXZC-4217-01检定单位:(章)检定员:审核:检测方法确认表序号:仪器设备(标准物质)期间核查记录表序号:编号:GXZC-4219-01负责人:设备管理员:更新标准实施审批表序号:编号:GXZC-4220-01。
实验室管理相关标准汇编

实验室管理相关标准汇编法规法规名称⽂号实施⽇期国家认可机构监督管理办法??国家认监委国认可(2002)20号2002-05-01国家认证认可监督管理委员会实施认证认可⾏政处罚若⼲规定国家认监委(2003)17号公告2003-12-09认证机构、检查机构、实验室取得境外认可机构认可备案管理办法国家认监委(2004)4号公告2004-02-20认证证书和认证标志管理办法质检总局令(2004)63号2004-08-01认证培训机构管理办法质检总局令(2005)81号2005-11-01认证咨询机构管理办法质检总局令(2005)82号2005-11-01认证技术规范管理办法国家认监委(2006)3号公告2006-03-01实验室能⼒验证实施办法国家认监委(2006)9号公告2006-05-01农药良好实验室考核管理办法农业部(2006)739号2006-12-01实验室资质认定评审员管理办法国家认监委(2007)24号公告2007-12-01⾷品检验机构资质认定管理办法(修订)质检总局令(2015)165号2015-06-19认证认可申述投诉处理⽅法国家认监委(2011)1号公告2011-01-11认证机构管理办法质检总局令(2011)141号2011-09-01检验检测机构资质认定管理办法质检总局令(2015)163号2015-08-01认证机构管理办法(修订)质检总局令(2015)164号2015-08-01 GB标准名称实施⽇期GBT 27025-2008 检测和校准实验室能⼒的通⽤要求2008-08-01GBT 20001.4-2015 标准编写规则第4部分:试验⽅法标准2016-01-01GBT 21785-2008 实验室玻璃器⽫密度计2008-09-01GBT 21785-2008 实验室玻璃器⽫密度计2008-09-01 GBT 22272-2008 良好实验室规范建议性⽂件建⽴和管理符合良好实验室规范原则的档案.2009-04-01 GBT 22273-2008 良好实验室规范建议性⽂件良好实验室规范原则在体外研究中的应⽤2009-04-01 GBT 22274.1-2008 良好实验室规范监督部门指南第1部分:良好实验室规范符合性监督程序指南2009-04-01 GBT 22274.2-2008 良好实验室规范监督部门指南第2部分:执⾏实验室检查和研究审核的指南2009-04-01 GBT 22274.3-2008 良好实验室规范监督部门指南第3部分:良好实验室规范检查报告的编制指南2009-04-01 GBT 22275.1-2008 良好实验室规范实施要求第1部分质量保证与良好实验室规范2009-04-01GBT 22275.2-2008 良好实验室规范实施要求第2部分:良好实验室规范研究中项⽬负责⼈的任务和2009-04-01职责GBT 22275.3-2008 良好实验室规范实施要求第3部分:实验室供应商对良好实验室规范原则的符合2009-04-01情况GBT 22275.4-2008 良好实验室规范实施要求第4部分:良好实验室规范原则在现场研究中的应⽤2009-04-01 GBT 22275.5-2008 良好实验室规范实施要求第5部分:良好实验室规范原则在短期研究中的应⽤2009-04-01GBT 22275.6-2008 良好实验室规范实施要求第6部分:良好实验室规范原则在计算机化的系统中的2009-04-01应⽤GBT 22275.7-2008 良好实验室规范实施要求第7部分:良好实验室规范原则在多场所研究的组织和2009-04-01管理中的应⽤GBT 22276-2008 良好实验室规范建议性⽂件在另⼀国家中要求和执⾏检查与研究审核2009-04-01 GBT 22277-2008 良好实验室规范建议性⽂件在良好实验室规范原则的应⽤中委托⽅的任务和职责2009-04-01 GBT 22278-2008 良好实验室规范原则2009-04-01GBT 25915.2-2010 洁净室及相关受控环境第2部分:证明持续符合GBT 25915.1的检测与监测技术2011-06-01条件GBT 25915.6-2010 洁净室及相关受控环境第6部分:词汇2011-05-01 GBT 25915.8-2010 洁净室及相关受控环境第8部分:空⽓分⼦污染分级2011-06-01 GBT 27401-2008 实验室质量控制规范动物检疫2008-10-01 GBT 27402-2008 实验室质量控制规范植物检疫2008-10-01 GBT 27403-2008 实验室质量控制规范⾷品分⼦⽣物学检测2008-10-01 GBT 27404-2008 实验室质量控制规范⾷品理化检测2008-10-01 GBT 27405-2008 实验室质量控制规范⾷品微⽣物检测2008-10-01 GBT 27406-2008 实验室质量控制规范⾷品毒理学检测2008-10-01 GBT 27410-2010 消费类产品中有毒有害物质检测实验室技术规范2011-07-01 GBT 29471-2012 ⾷品安全检测移动实验室通⽤技术规范2013-07-31 GBT 32146.1-2015 检验检测实验室设计与建设技术要求第1部分:通⽤要求2016-07-01 GBT 32146.3-2015 检验检测实验室设计与建设技术要求第3部分:⾷品实验室2016-07-01 NY、SC、SN标准名称实施⽇期NYT 1493-2007 农药残留试验良好试验室规范2008-03-01 NYT 718-2003 农药毒理学安全性评价良好实验室规范2004-03-01 SCT 7019-2015 ⽔⽣动物病原微⽣物实验室保存规范2015-05-01 SNT 1482-2004 实验室内部质量控制⽅法 MR统计合并动态跟踪监控技术2005-04-01 SNT 2294.1-2009 检验检疫实验室管理第1部分总则2009-09-01 SNT 2294.2-2009 检验检疫实验室管理第2部分信息系统2009-09-01 SNT 2294.3-2009 检验检疫实验室管理第3部分分类2010-03-16 SNT 2294.4-2011 检验检疫实验室管理第4部分事故处理规程2012-04-01 SNT 2294.5-2011 检验检疫实验室管理第5部分危险化学品安全管理指南2012-04-01 SNT 2294.6-2011 检验检疫实验室管理第6部分放射源安全管理指南2012-04-01 SNT 2723.1-2010 实验室能⼒验证第1部分总则2011-05-01 SNT 2723.2-2010 实验室能⼒验证第2部分名词和术语2011-05-01 SNT 2723.3-2010 实验室能⼒验证第3部分能⼒验证报告的格式和内容2011-05-01 SNT 2984-2011 检验检疫动物病原微⽣物实验活动⽣物安全要求细则2012-04-01 SNT 2989-2011 出⼊境动物检疫实验室能⼒验证技术规范2012-04-01 SNT 2990-2011 质量控制与质量评价实验室过程与测试能⼒指数评定⽅法2012-04-01 SNT 3092-2012 实验室应对公共安全事件能⼒规范2012-11-16 SNT 3509-2013 实验室样品管理指南2013-09-16 SNT 3590-2013 化学分析实验室中的职责和质量控制指南2014-03-01 SNT 3591-2013 实验室标准物质管理指南2014-03-01 CNAS标准名称实施⽇期CNAS-CC01:2011 管理体系认证机构要求2011-07-01 CNAS-CC03:2014 ⼈员认证机构通⽤要求2014-10-01 CNAS-CC11:2010 基于抽样的多场所认证2010-09-01 CNAS-CC12:2008 已认可的管理体系认证的转换2008-12-14 CNAS-CC13:2008 ⾼级监督和再认证程序2008-09-15 CNAS-CC131:2014 质量管理体系审核及认证的能⼒要求2014-05-01 CNAS-CC14:2008 计算机辅助审核技术在获得认可的管理体系认证中的使⽤2008-09-15 CNAS-CC15:2013 管理体系审核时间(QMS、EMS、OHSMS)2014-01-01 CNAS-CC18:2014 ⾷品安全管理体系认证机构要求2015-01-01 CNAS-CC21:2006 产品认证机构通⽤要求2006-07-01 CNAS-CC22:2007《产品认证机构通⽤要求》应⽤指南(IAF GD5:2006)2007-12-08 CNAS-CC31:2010《⼈员认证机构通⽤要求》应⽤指南2010-04-01 CNAS-CC41:2006 职业健康安全管理体系认证机构通⽤要求2006-07-01 CNAS-CC42:2006 《职业健康安全管理体系认证机构通⽤要求》应⽤指南2006-07-01 CNAS-R01 认可标识和认可状态声明管理规则2007-04-15 CNAS-R01:2010 认可标识和认可状态声明管理规则2011-01-01 CNAS-R02:2011 公正性和保密规则2011-04-01 CNAS-R03:2010 申诉、投诉和争议处理规则2010-11-08 CNAS-RC01:2013 认证机构认可规则2013-10-30 CNAS-RC02:2013 认证机构认可资格处理规则2013-10-30 CNAS-RC03:2013 认证机构信息通报规则2013-07-01 CNAS-RC04:2013 认证机构认可收费管理规则2013-10-30 CNAS-RC05:2014 多场所认证机构认可规则2014-09-04 CNAS-RC07:2011 具有境外关键场所的认证机构认可规则2011-04-28 CNAS-RI01:2007 检查机构认可规则2008-01-01 CNAS-Rl05:2008 实验室⽣物安全认可规则2008-08-01 CNAS-RL01:2011 实验室认可规则(2013修订版)2013-09-01 CNAS-RL02:2010 能⼒验证规则2011-02-01 CNAS-RL03:2013 实验室和检查机构认可收费管理规则2013-03-01 CNAS-RL04:2009 境外实验室和检查机构受理规则2009-03-01 CNAS-RL06:2014 能⼒验证提供者认可规则2014-05-01 CNAS-RL07:2014 标准物质标准样品⽣产者认可规则2014-06-01CNAS-AL07:2011 CNAS能⼒验证领域和频次2011-02-12表CNAS-AL08:2011 能⼒验证机构备案要求及2011-02-12项⽬确认需提交资料清单CNAS-CI01:2012 检查机构能⼒认可准则2013-06-01CNAS-CI02:2006 检查机构认可准则应⽤说明2006-07-01CNAS-CL01:2006 检测和校准实验室能⼒认2006-07-01可准则CNAS-CL02:2012 医学实验室质量和能⼒认2014-11-01可准则CNAS-CL03:2010 能⼒验证提供者认可准则2011-01-01CNAS-CL04:2010 标准物质标准样品⽣产者2011-01-01能⼒认可准则CNAS-CL05:2009 实验室⽣物安全认可准则2009-07-01 CNAS-CL07:2011 测量不确定度的要求2011-05-01CNAS-CL09:2013 检测和校准实验室能⼒认2015-06-01可准则在微⽣物检测领域的应⽤说明CNAS-CL10-2012 检测和校准实验室能⼒认可2013-01-01准则在化学检测领域的应⽤说明CNAS-CL21:2015 检测和校准实验室能⼒认2016-10-01可准则在卫⽣检疫领域的应⽤说明(2016-10-1实施)CNAS-CL22:2015 检测和校准实验室能⼒认2016-10-01可准则在动物检疫领域的应⽤说明(2016-10-1实施)CNAS-CL23:2015 检测和校准实验室能⼒认2016-10-01可准则在植物检疫领域的应⽤说明(2016-10-1实施)CNAS-CL26:2014 检测和校准实验室能⼒认可2015-01-01准则在感官检测领域的应⽤说明CNAS-CL30:2010 标准物质标准样品证书和2011-01-01标签的内容CNAS-CL31:2011 内部校准要求2011-07-01 CNAS-EC-016:2009 不予受理认证机构认可2009-08-12申请和暂停、撤销认证机构认可资格有关规定的说明CNAS-EC-017:2009 认证机构认可风险分级2009-04-22管理办法CNAS-EC-021:2007 GB/T 19001-2000/ISO2007-07-25 9001:2000应⽤说明CNAS-EC-028:2009 认证机构实施依据2009-03-01 GB/T19001-2008的质量管理体系认证的认可转换说明CNAS-EC-031:2011 CNAS-CC01:2011-02-15 2011《管理体系认证机构要求》过渡转换安排的说明》CNAS-EC-033:2011 ⾷品安全管理体系认证2012-01-01机构认可说明CNAS-EC-035:2013 基于PAC-TECH-003 对2013-06-01⾷品安全管理体系认证机构的认可说明CNAS-EC-035:2014 ⾷品安全管理体系认证2015-01-01机构认可说明CNAS-EC-041:2014 ⾷品安全管理体系认证2014-07-15机构依据新版专项技术规范实施认证的认可转换说明CNAS-GC02:2014 管理体系认证结合审核的2014-10-27应⽤指南CNAS-GC11:2011 质量管理体系认证机构认2015-12-16证业务范围能⼒管理实施指南(2015年第⼆次修订)CNAS-GC12:2013 环境管理体系认证机构认2013-07-01证业务范围能⼒管理实施指南CNAS-GC13:2011 职业健康安全管理体系认2011-07-01证机构认证业务范围能⼒管理实施指南CNAS-GC18:2013 ⾷品安全管理体系认证机2013-06-01构认证业务范围管理实施指南CNAS-GC21:2013 ⼀般⼯业产品认证业务范2013/10-30围管理实施指南CNAS-GC31:2006 环境管理体系认证机构认2006-07-01证业务范围管理实施指南CNAS-GC41:2006 职业健康安全管理体系认2006-07-01证机构认证业务范围管理实施指南CNAS-GI01:2006 检查机构认可指南2007-04-30CNAS-GL02:2014 能⼒验证结果的统计处理2014-09-15和能⼒评价指南CNAS-GL03:2006 能⼒验证样品均匀性和稳CNAS-GL03:2006 能⼒验证样品均匀性和稳2006-07-01定性评价指南CNAS-GL04:2011 量值溯源要求的实施指南2011-03-15CNAS-GL05:2011 测量不确定度要求的实施2011-05-01指南CNAS-GL06:2006 化学分析中不确定度的评2006-07-01估指南CNAS-GL09:2014 实验室认可评审不符合项2014-05-20分级指南CNAS-GL12-2007 实验室和检查机构内部审核2007-04-30指南CNAS-GL13-2007 实验室和检查机构管理评审2007-04-30指南CNAS-GL-26:2014 感官检验领域实验室认可2014-07-01技术指南CNAS-GL29:2010 标准物质标准样品定值的2011-01-01⼀般原则和统计⽅法CNAS-SC16:2014 良好⽣产规范(GMP)认2015-12-16证机构认可⽅案(2015年第⼆次修订)CNAS-SC21:2014 良好农业规范(GAP)认2014-05-01证机构认可⽅案CNAS-SC22:2014 实施有机产品认证的认证2014-05-01机构认可⽅案。
